
专题五铁及其化合物
1、铁元素的存在形态:
游离态:陨铁
化合态:铁元素主要以+2价和+3价的化合态存在。在地壳中的质量分数为4.65%,处于第四位,仅次于氧、硅和铝。
2、按不同标准给铁及其化合物分类
(1)按单质、氧化物、酸、碱、盐给上述物质分类。
单质:铁;氧化物:FeO、Fe2O3、Fe3O4;碱:Fe(OH)2、Fe(OH)3;盐:FeCl2、FeCl3、FeSO4、Fe2(SO4)3(2)按铁元素的化合价给上述物质分类。
0价:Fe;+2价:FeO、FeCl2、FeSO4、Fe(OH)2;+3价:Fe2O3、FeCl3、Fe2(SO4)3、Fe(OH)3
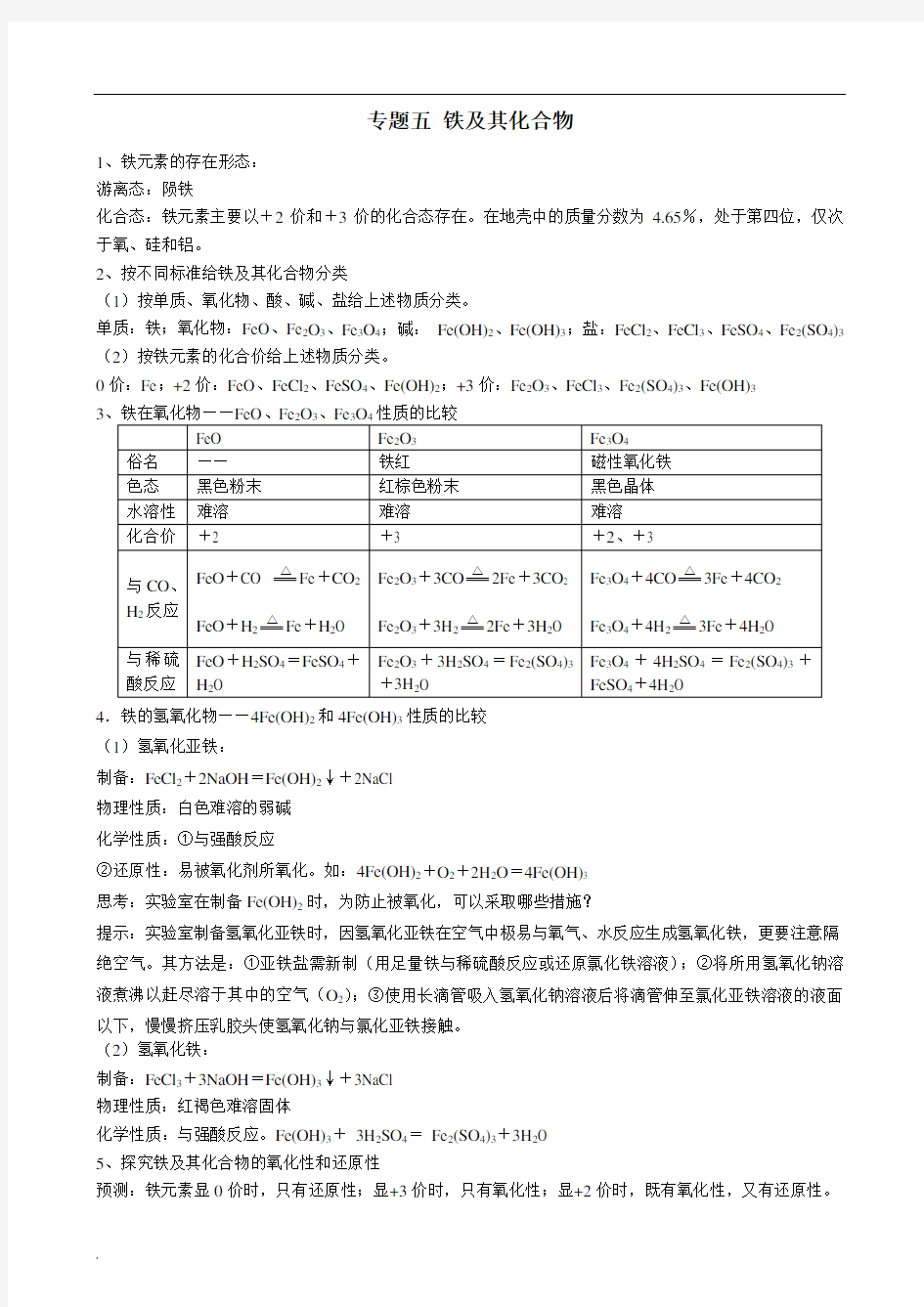
3
4.铁的氢氧化物——4Fe(OH)2和4Fe(OH)3性质的比较
(1)氢氧化亚铁:
制备:FeCl2+2NaOH=Fe(OH)2↓+2NaCl
物理性质:白色难溶的弱碱
化学性质:①与强酸反应
②还原性:易被氧化剂所氧化。如:4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考:实验室在制备Fe(OH)2时,为防止被氧化,可以采取哪些措施?
提示:实验室制备氢氧化亚铁时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,更要注意隔绝空气。其方法是:①亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);②将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);③使用长滴管吸入氢氧化钠溶液后将滴管伸至氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠与氯化亚铁接触。
(2)氢氧化铁:
制备:FeCl3+3NaOH=Fe(OH)3↓+3NaCl
物理性质:红褐色难溶固体
化学性质:与强酸反应。Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
5、探究铁及其化合物的氧化性和还原性
预测:铁元素显0价时,只有还原性;显+3价时,只有氧化性;显+2价时,既有氧化性,又有还原性。
(1)Fe 的还原性:与H +、Cu 2+、Fe 3+、Cl 2等反应
Fe +2H + = Fe 2++H 2↑、Fe +Cu 2+ = Fe 2++Cu 、2Fe 3++ Fe =3Fe 2+、2Fe +3Cl 2 加热
2FeCl 3
(2)Fe 3+的氧化性:与Fe 、Cu 、Zn 反应
2Fe 3++ Fe =3Fe 2+、2Fe 3++Cu = 2Fe 2++Cu 2+、3Zn +2Fe 3+ = 3Zn 2++2Fe (3)Fe 2+的氧化性: 与锌反应 Zn +Fe 2+ = Zn 2++Fe
(4)Fe 2+的还原性:与氯水、硝酸等反应
2Fe 2++Cl 2 = 2Fe 3++2Cl -
(5)铁及其化合物的相互转化示意图
Fe FeCl 2(氧化性)
(氧化性)(还原性)
FeCl 3HNO 3、Cl 2Fe 、Cu
(还原性)
HCl FeCl 3
Cl 2
Zn
Zn
6.Fe 2+与Fe 3+的鉴别
(1)直接观察颜色:Fe 2+的溶液呈浅绿色,Fe 3+的溶液呈棕黄色。 (2)利用显色反应:
Fe 2+的溶液+KSCN 或NH 4SCN 溶液,溶液不呈红色;Fe 3+的溶液+KSCN 或NH 4SCN 溶液,溶液呈血红色。 有关离子方程式:Fe 3++SCN -
=[Fe(SCN)]2+ (3)利用铁化合物沉淀的颜色:
Fe 2+的溶液+NaOH 溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色;Fe 3+的溶液+NaOH 溶液,出现红褐色沉淀。
反应式:Fe 2++2OH -
=Fe(OH)2↓、4Fe(OH)2+2H 2O +O 2=4Fe(OH)3;Fe 3++3OH -
=Fe(OH)3↓ (4)利用Fe 3+的氧化性:
①Fe 2+的溶液+Cu 片,无明显现象;Fe 3+的溶液+Cu 片,铜被腐蚀,溶液变为蓝绿色。 有关离子方程式:2Fe 3++Cu =2Fe 2++Cu 2+
②Fe 2+的溶液+淀粉KI 试纸,试纸不变蓝;Fe 3+的溶液+淀粉KI 试纸,试纸变蓝。 有关离子方程式:2Fe 3++2I -
=2Fe 2++I 2
(5)利用Fe 2+的还原性:
①Fe 2+的溶液+酸性KMnO 4溶液,KMnO 4溶液紫色褪去;Fe 3+的溶液+酸性KMnO 4溶液,KMnO 4溶液紫色不褪。
②Fe 2+的溶液+氯水,溶液变为棕黄色;Fe 3+的溶液+氯水,无明显现象。 有关离子反应式:2Fe 2++Cl 2=2Fe 3++2Cl -
注意:以上方法以KSCN 溶液鉴别最常用。 7.其他重要反应
(1)铁与强氧化性酸浓硫酸、硝酸的反应
常温下钝化,所以可用铁罐储存运输浓硫酸和硝酸;
(2)铁与高温水蒸气反应 高温
Fe +2H 2O (g )= Fe 3O 4+H 2↑ (3)铝热反应-焊接铁轨 Fe 2O 3+2Al 2Fe + Al 2O 3
习题
1.能使铁溶解,但不能生成沉淀的溶液是( )
A .稀H 2SO 4
B .FeCl 3溶液
C .CuSO 4溶液
D .FeSO 4溶液 2.为了除去FeSO 4溶液中的Fe 2(SO 4)3和 CuSO 4杂质,可选用的试剂为( ) A .NaOH B .氯水 C .Cu D .Fe 3.下列操作中,溶液的颜色不发生变化的是 ( ) A .碳酸氢钠溶液中滴加稀盐酸 B .硫酸铁溶液中滴加硫氰化钾溶液 C .碘水中滴加淀粉碘化钾溶液
D .氯化铁溶液中加入铁粉
4.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( ) A .锌粉
B .镁粉
C .铁粉
D . 铝粉
5.将铁的某种化合物溶于盐酸,滴加KSCN 溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色.则此铁的化合物是( )
A .Fe 2O 3
B .FeCl 3
C .Fe 2(SO 4)3
D .FeO 6.下列离子在溶液中能大量共存的是( )
A .Fe NH SCN Cl 34++
--、、、
B .-
-++24
32SO NO H Ba 、、、 C .Fe Fe Na NO 233+++-、、、
D .Fe NH Cl OH 24++--、、、
7.证明某溶液只含有Fe 2+
而不含有Fe 3+
的实验方法是( ) A .先滴加氯水,再滴加KSCN 溶液后显红色
B .先滴加KSCN 溶液,不显红色,再滴加氯水后显红色
C .滴加NaOH 溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D .只需滴加KSCN 溶液
8.在含有1molFeSO 4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是( )
A .Fe
B .FeO
C .Fe(OH)3
D .Fe 2O 3
9.将Fe 、Cu 、Fe 2+
、Fe 3+
和Cu 2+
盛于同一容器中充分反应,如Fe 有剩余,则容器中只能有( )
A .Cu 、Fe 3+
B .Fe 2+、Fe 3+
C .Cu 、Cu 2+、Fe
D .Cu 、Fe 2+
、Fe △
化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是()A.烧杯中有铜无铁B.烧杯中有铁无铜
C.烧杯中铁、铜都有D.烧杯中铁、铜都无
11.下列物质中, 能使铁溶解, 又不析出固体和放出气体的是
A.稀硫酸B.浓硝酸C.硝酸银溶液D.硫酸铁溶液
12.下列物质的颜色叙述正确的是
A. Fe2O3—黑色
B. MgO—白色
C. FeCl3溶液—红褐色
D. Fe(OH)2—灰绿色
13.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
A.Cu2+B.Fe3+C.Fe2+D.H+
14.根据Fe+Cu2+=Fe2++Cu、2FeCl3+Cu=2FeCl2+CuCl2两个反应,判断Fe3+、Fe2
Cu2+的氧化性顺序为()
A.Cu2+>Fe2+>Fe3+B.Fe3+>Fe2+>Cu2+
C.Fe3+>Cu2+>Fe2+D.Fe2+>Fe3+>Cu2+
15.人体血红蛋白中含有Fe2+,如果误服亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()A.酸性B.碱性C.氧化性D.还原性
16.将适量铁粉放入FeCl3溶液完全反应后,溶液中的c(Fe3+)和c(Fe2+)相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为()
A.3:2 B.1:2 C.1:1 D.2:3
17.下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁易锈蚀②在人体的血红蛋白中含有铁元素
③铁位于周期表中的第四周期第ⅧB族④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧⑤铁与硝酸反应的产物仅是Fe(NO3)3⑥不能通过化合反应生成FeCl2和Fe(OH)3
A.①③B.②④C.②⑤D.④⑥
18.下列反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应②Fe与过量稀H2SO4反应后,再向其中加KNO3③Fe(NO3)2溶液中加少量盐酸④把Fe和Fe2O3的混合物溶于盐酸中
A.只有①B.只有①②C.只有①②③D.全部
19.某学生设计了如图的方法对X盐进行鉴定:由此分析,下列结论中正确的是
A.X中一定有Fe3+B.Z中一定有Fe3+C.Y为AgI沉淀D.X一定为FeBr2溶液
20.在下列所指的各溶液中,分别滴加NH4SCN溶液后,溶液不呈血红色的是
A.加入足量镁粉的Fe2(SO4)3溶液
B.加入过量铁粉的稀硝酸溶液
C.铁丝在足量的氯气中燃烧后,所得产物的溶液
D.长期暴露在空气中的绿矾溶液
21.将Na2O2投入FeCl2溶液中, 可观察到的现象是
A.生成白色沉淀B.生成红褐色沉淀C.有气泡产生D.无变化
22.下列离子方程式书写正确的是
A.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2==Fe3+ + Br2+ 4Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3?H2O == Fe(OH)3↓+3NH4+
C.硫化亚铁与盐酸反应S2-+2H+==H2S↑
D.过量铁粉与稀HNO3反应:Fe+4H++NO3-= Fe3++NO↑+2H2O
23.把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
A.反应后生成的盐只为Fe(NO3)3B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
24.将5.32 g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53 g KNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009 mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是
A.–3 B.+4 C.+3 D.+2
25. 下列反应,其产物的颜色按红色、淡黄色、蓝色顺序排列的是①金属钠在纯氧中燃烧;②FeCl3溶液滴入KSCN溶液;③无水硫酸铜放入医用酒精中。
A.②①③
B.③②①
C.③①②
D.①②③
26.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质A.锌粉 B.镁粉C.铁粉 D.铝粉
27.国际上推广使用中国铁锅,这是因为铁锅
A.是单质B.含碳,属混合物C.化学性质活泼D.易使食物中含人体所需的铁元素
28.将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A.KSCN B.BaCl2C.NaOH D.HCl
29.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D.只需滴加KSCN溶液
30.下图中所涉及的A、B、C、D、E和F等都是中学化学教材
进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能
溶于HCl。
⑴A的电子式
⑵写出反应①的化学方程式
⑶写出E与强碱液反应的离子方程式
⑷C、E的混合物在工业上用于钢轨焊接,写出反应③的化学方程式:
_________________________________________
31.已知有以下物质相互转换
试回答: (1)写出B的化学式D的化学式
(2)写出由E转变成F的化学方程式
(3) 向G溶液加入A的有关离子反应方程式
离子方程式
混合物成分提纯所用试剂
的化学式
(1)FeCl2中含少量FeCl3杂质
(2)FeCl3中含少量FeCl2杂质
(3)FeSO4中含少量CuSO4杂质
33.有一种工业废水, 已知其中含有大量硫酸亚铁, 少量Ag+和Na+。今设计一种既经济又合理的方法, 回收银和硫酸亚铁。设计方案如下图所示
(1)药品①是(2)沉淀是(3)药品②是
(4)母液中除Fe2+外还存在的阳离子:________
34.(13分)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质。
(1)请你设计一个检验硫酸亚铁是否变质的实验方案:
________________________________________________________________________
________________________________________________________________________。
(2)如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质?
________________________________________________________________________。
35.将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /LFeSO4溶液和5.2 g固体沉淀物。试计算:
(1)反应后生成铜的质量; (2)原Fe2(SO4)3溶液的物质的量浓度。
仰望天空时,什么都比你高,你会自卑;
俯视大地时,什么都比你低,你会自负;
只有放宽视野,把天空和大地尽收眼底,
才能在苍穹泛土之间找准你真正的位置。
无须自卑,不要自负,坚持自信。
用心工作,快乐生活!(工作好,才有好的生活!)
此文档可编辑,欢迎使用!
~~~专业文档,VIP专享。更多精彩文档,尽在Baidu文库~~~