
乙酰乙酸乙酯的合成
学院:化工与材料学院
班级:B1201
姓名:康丽霞
学号:1511120106
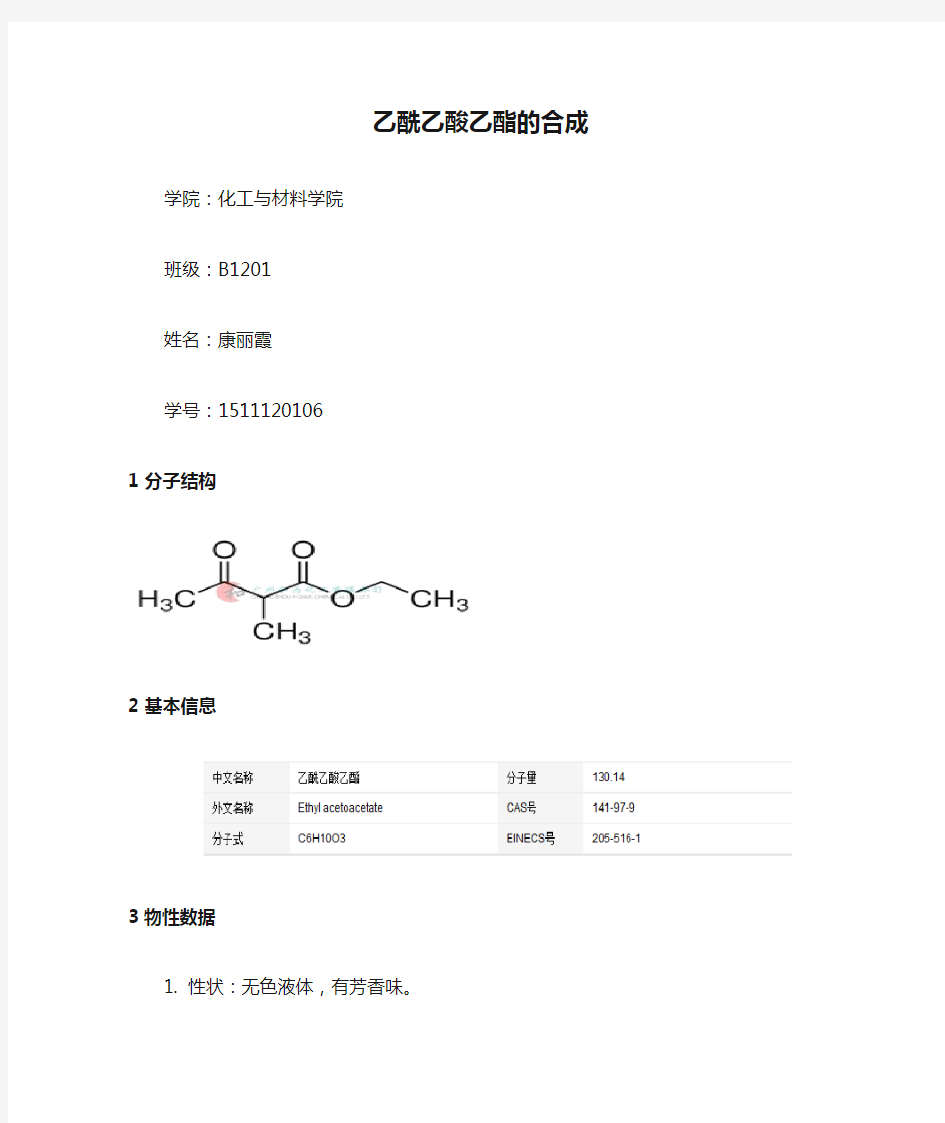
1 分子结构
2 基本信息
3物性数据
1. 性状:无色液体,有芳香味。
2. 沸点(oC,101.3kPa):181
3. 熔点(oC,酮式):-39
4. 熔点(oC,烯醇式):-44
5. 相对密度(g/mL,25/4oC):1.02126
6. 相对蒸汽密度(g/mL,空气=1):4.5
7. 折射率(20oC):1.4194
8. 黏度(mPa·s,25oC):1.5081
9. 闪点(oC,闭口):84.4
10. 燃点(oC):295
11. 燃烧热(KJ/mol,25oC):3162.7
12. 比热容(KJ/(kg·K),24.5oC,定压):1.92
13. 临界温度(oC):400
14. 电导率(S/m,25oC):1×10-7
15. 蒸气压(kPa,40~41oC):0.27
16. 热导率(W/(m·K),30oC):0.1558
17. 溶解性:微溶于水,溶于有机溶剂。25℃时在水中溶解12%;水在乙酰乙酸乙酯中溶解4.9%。
18. 相对密度(20℃,4℃):1.0282
19. 液相标准热熔(J·mol-1·K-1) :251.4
20. 气相标准燃烧热(焓)(kJ·mol-1):-3228.5
21. 气相标准声称热(焓)( kJ·mol-1) :-561.77
4 存储方法
1.应远离火源置阴凉通风处贮存。
2.本品用铝桶包装,桶盖密封性要好,贮于阴凉通风处,防火。按易燃有毒化学品规定贮运
5 合成方法
1. 双乙烯酮与乙醇酯化法双乙烯酮和无水乙醇在浓硫酸催化下进行酯化,得乙酰乙酸乙酯粗品。再经减压精馏得成品。
2.乙酸乙酯自缩合法由两分子乙酸乙酯在金属钠存在下自缩合而得。
2. 由乙酸乙酯在乙醇钠存在下缩合后蒸馏而得。
由双乙烯酮与无水乙醇在浓硫酸催化下酯化后减压蒸馏而得。
3. 工业上普遍采用的制备方法是双乙烯酮和无水乙醇在浓硫酸催化下进行酯化,得乙酰乙酸乙酯粗品,再经减压精馏得成品。
内按配比加入乙醇和硫酸,搅拌加热,当温度升至82℃时,开始滴加双乙烯酮,酯化温度不得超过130℃。继续回流到反应温度不再变化且酯化液无双乙烯酮时结束反应。将料液温度降至120℃以内,在控制回流比1∶1的条件下去除低沸物,当低沸物不再馏出时,提高真空度至86.6kPa,继续去除低沸物,当塔顶温度升至100℃以上时,再提高真空度至97.3 kPa,蒸馏出成品,含量大于97%。
也可用乙酸乙酯自缩合反应。
将250g金属钠加入4240mL乙酸乙酯中,开始反应很慢,需在水浴上温热,一旦反应开始就十分猛烈,需进行冷却。回流反应后蒸馏回收乙酸乙酯。加入
1375mL 56%的乙酸溶液搅拌回流,加入250g食盐,分出油状物,用乙醚提取,从提取液回收乙醚,用10%碳酸氢钠溶液洗至无酸性。用氯化钙干燥后,减压蒸馏,收集76~78℃/2.4kPa馏分即为成品,收率接近30%。
精制方法:易含杂质有游离的酸、醇和丙酮。精制时用碳酸钾或无水硫酸钠干燥后减压蒸馏。
4.将3750ml乙醇及2500ml乙酸混合后,慢慢加入375ml浓硫酸,在水浴上加热回流4h,蒸馏,馏出物用10%碳酸钠溶液洗至无酸性,再加饱和的氯化钙除去过量的醇。
4240ml乙酸乙酯加250g的金属钠,水浴加热回流,反应完后,蒸馏回收乙酸乙酯,加入1375ml56%的乙酸溶液,搅拌回流,加250g食盐,分出油状物,用乙醚提取,抽取液回收乙醚,用10%碳酸氢钠溶液洗至无酸性,用氯化钙干燥,减压蒸馏,收集76~78℃馏出物。反应式为:
5.制法:
于干燥的装有搅拌器、回流冷凝器(装氯化钙干燥管)的反应瓶中,加入二甲苯50mL,金属钠5g,加热回流使金属钠熔融,剧烈搅拌,迅速冷却,生成钠砂。将二甲苯倾出,迅速加入乙酸乙酯(2)50g(55mL,0.57mol),重新安上回流冷凝器,反应立即开始,有氢气泡生成。若反应较慢可适当加热。待剧烈反应后,再慢慢加热保持微沸,直至金属钠反应完,约需1.5h,生成橘红色溶液。稍冷后搅拌下加入50%的乙酸溶液至弱酸性,固体物全部溶解。将反应物转入分液漏斗中,加入等体积的饱和氯化钠溶液,充分摇动后,分出有机层,无水硫酸钠干燥。过滤,先蒸出未反应的乙酸乙酯,再减压分馏,收集100℃/10.66kPa的馏分,得化合物(1)12~14g,收率42%~49%(以使用的金属钠计)。
6 主要用途
1.乙酰乙酸乙酯是一种重要的有机合成原料,在农药生产上用于合成有机磷杀虫剂蝇毒磷的中间体α-氯代乙酰乙酸乙酯、嘧啶氧磷的中间体2-甲氧基-4-甲基-6-羟基嘧啶、二嗪磷的中间体2-异丙基-4-甲基-6-羟基嘧啶以及氨基甲酸酯杀虫剂抗蚜威,杀菌剂恶霉灵,除草剂味唑乙烟酸,杀鼠剂杀鼠醚、杀鼠灵等,也是杀菌剂新品种嘧菌环胺(cyprodinil)、氟嘧菌胺(difulmetorim)、呋吡菌胺(furammetpyr)及植物生长调节剂杀雄啉(cintofen)的中间体,此外,乙酰乙酸乙酯用作漆用溶剂,分析用试剂,也广泛用于医药、塑料、染料、香料、清漆及添加剂等行业。
2.偶用于栀子等化妆品香精,可赋予的酒果香或飘逸非花香的头香。在盥用水或水剂类中可给乙醇以圆熟感。广泛用于食用香精,可用于许多果香或酒香,如苹果、杏子、桃子、樱桃、浆果及黄酒、白兰地、白酒、威士忌、朗姆等食用香精和酒用香精。GB 2760—96规定为允许使用的食用香料。广泛用于配制草莓、苹果、杏、樱桃、桃等水果型和酒型(朗姆、威士忌等)香精。
3.乙酰乙酸乙酯在有机合成中的应用极广。例如,可用于合成吡啶、吡咯、吡唑酮、嘧啶、嘌呤和环内酯等杂环化合物。还广泛用于药物合成,例如,乙酰乙酸乙酯与间苯二酚环合得到4-甲基-7-羟基香豆素,这是抗过敏药垢中间体。乙酰乙酸乙酯与氯苄缩合得到α-乙酰基苯丙酸乙酯,这是止咳药止咳酮的中间体。乙酰乙酸乙酯与苯甲酰氯缩合得到苯甲酰乙酸乙酯,这是中枢兴奋药山梗菜碱盐酸盐的中间体。乙酸乙酸乙酯与硫脲环合,即制得抗甲状腺药物甲硫氧嘧啶(是冠脉扩张剂潘生丁的中间体)。EAA结构的特殊性,决定了它既有酮的性质,又有烯醇的反应特征,化学性质非常活泼。它被广泛应用于医药、染料、农药等领域,也用于食品添加剂和香精香料中。我国EAA最大的用途是用来合成医药及其中间体,主要是合成γ-乙酰丁内酯(维生素B的重要中间体)、4-甲基-7-羟基香豆素(一种抗敏药的中间体)等;也被用来制备乙酰乙酰邻氯苯胺(合成1,3,5-吡唑酮及汉沙黄色淀的中间体)、乙酰基乙酰邻甲基苯胺(用来合成有机黄染料包装增效颜料黄)等染料的中间体;此外EAA还用来生产农药如甲基嘧啶磷,嘧啶磷等。在国外它在不饱和聚酯共促进剂以及合成香料如制备芳樟醇、紫罗兰酮和大环香料等方面也有应用。乙酰乙酸乙酯也用于合成4-羟基香豆素,
进而制造抗凝血药物新抗凝。乙酰乙酸乙酯与1,3-溴氯丙烷环合得到2-甲基-3-
乙氧羰基-5,6-二氢吡喃。这是血管扩张药已酮可可碱的中间体。乙酰乙酸乙酯
还用于合成双氯苯唑青霉素钠、羟氨苄青霉素、选择性冠脉扩张剂延通心和唑嘧
啶。乙酰乙酸乙酯与苯胺缩合得到4-羟基喹哪啶。用于消毒防腐药克菌定的生
产。乙酰乙酸乙酯与苯肼缩合形成的吡唑酮衍生物和染料的中间体。在农药、香
料、光化学品、聚合催化剂等方面也都有重要的应用。乙酰乙酸乙酯还用作食品
着香剂。乙酰乙酸乙酯也作为溶剂使用,还是检测铊、氧化钙、氢氧化钙和铜的
试剂。
4.用作分析试剂、溶剂。用于有机合成、染料、医药、塑料、油漆等
工业。
7 系统编号
CAS号:141-97-9
MDL号:MFCD00009199
EINECS号:205-516-1
RTECS号:AK5250000
BRN号:385838
8 毒理学数据
1、急性毒性:大鼠经口LD50:3980 mg/kg;小鼠经口LC50:5105 mg/kg
9 分子结构数据
1、摩尔折射率:31.65
2、摩尔体积(m3/mol):128.1
3、等张比容(90.2K):300.6
4、表面张力(dyne/cm):30.2
5、极化率(10-24cm3):12.54
10 计算化学数据
1、疏水参数计算参考值(Xlop)2
2. 沸点(oC,101.3kPa):181
3、氢键受体数量:3
4、可旋转化学键数量:4
5、拓扑分子极性表面积(TPSA):43.4
6、重原子数量:9
7、表面电荷:0
8、复杂度:118
9、同位素原子数量:0
10、确定原子立构中心数量:0
11、不确定原子立构中心数量:0
12、确定化学键立构中心数量:0
13、不确定化学键立构中心数量:0
14、共价键单元数量:1
11 生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
12 性质与稳定性
1.常温常压下稳定。禁配物:酸类、碱、还原剂、氧化剂。属低毒类。避免吸入蒸气和接触皮肤。
化学性质:遇三氯化铁呈紫色。用稀酸或稀碱水解时,生成丙酮、乙醇和二氧化碳。在强碱作用下,生成两分子乙酸和乙醇。催化还原时生成β-羟基丁酸。新蒸馏的乙酰乙酸乙酯中,烯醇式占7%,酮式占93%。将乙酰乙酸乙酯的乙醇溶液冷却到-78℃时,析出结晶状态的酮式化合物。若将乙酰乙酸乙酯的钠衍生物悬浮于二甲醚中,在-78℃时通入略少于中和量的干燥氯化氢气体,可得到油状的烯醇式化合物。
2.本品毒性较小,大鼠经口LD50
3.98g/kg。但具有中等程度的刺激性和麻醉性,生产装置设备应保证密闭,良好通风。操作人员配备防护装具。
乙酸乙酯的合成 一、 实验目的和要求 1、 通过乙酸乙酯的制备,加深对酯化反应的理解; 2、 了解提高可逆反应转化率的实验方法; 3、 熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。 二、 实验内容和原理 本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯: 243323252H SO CH COOH CH CH OH CH COOC H H O ++ 副反应: 24 32322322H SO CH CH OH CH CH OCH CH H O ???→+ 由于酯化反应为可逆反应,达到平衡时只有2/3的物料转变为酯。为了提高酯的产率,通常都让某 一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。因为乙醇便宜、易得,本实验中乙醇过量。但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。 由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。这些共沸物的沸点都很低,不超过72 ℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。 表一、乙酸乙酯共沸物的组成与沸点 三、 主要物料及产物的物理常数 表二、主要物料及产物的物理常数
四、主要仪器设备 仪器100mL三口烧瓶;滴液漏斗;蒸馏弯头;温度计;直形冷凝管;250mL分液漏斗;50mL锥形瓶3个;25mL梨形烧瓶;蒸馏头;阿贝(Abbe)折光仪;气相色谱仪。 试剂冰醋酸;无水乙醇;浓硫酸;Na2CO3饱和溶液;CaCl2饱和溶液;NaCl饱和溶液。 五、实验步骤及现象 表三、实验步骤及现象
乙酸乙酯的制备 一、 实验目的 1. 掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。 2. 掌握分馏的原理及分馏柱的作用。 3. 进一步练习并熟练掌握液体产品的纯化方法。 二、 实验原理 乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的0.3%即可。其反应为: CH 3COOH +CH 3CH 2OH CH 3COOCH 2CH 3H 2O +CH 3CH 22 3CH 2OCH 2CH 3H 2O +CH 3CH 2OH 24 H 2O +CH 2CH 2主反应:副反应: 酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过 程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长的分馏柱进行分馏。
四、 实验装置图 蒸馏装置 五、 实验流程图 4ml 乙醇5ml 浓硫酸2粒沸石 10ml 8ml 73-80 的馏分,℃ 六、 实验步骤 在100ml 三颈瓶中,加入4ml 乙醇,摇动下慢慢加入5ml 浓硫酸,使其混合均匀,并加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以下,中间口安一长的刺形分馏柱(整个装置如上图)。 仪器装好后,在滴液漏斗内加入10ml 乙醇和8ml 冰醋酸,混合均匀,先向瓶内滴入约2ml 的混合液,然后,将三颈瓶在石棉网上小火加热到110-120℃左右,这时蒸馏管口应有液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维持反应温度在110-125℃之间,滴加完毕后,继续加热10分钟,直至温度升高到130℃不再有馏出液为止。 馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸等,在摇动下,慢慢向粗产品中加入饱和的碳酸钠溶液(约6ml )至无二氧化碳气体放出,酯层用PH 试纸检验呈中性。移入分液漏斗中,充分振摇(注意及时放气!)后静置,分去下层水相。酯层用10ml 饱和食盐
化学与环境学院 有机化学实验报告实验名称乙酰乙酸乙酯的制备(一) 【实验目的】 1、了解乙酰乙酸乙酯的制备原理和方法,加深对Claisen酯缩合反应原理的理解和认识; 2、熟悉在酯缩合反应中金属钠的应用和操作
3、掌握无水操作、萃取等操作。 【实验原理】(包括反应机理) 1、含有α-H的酯在碱性催化剂存在下,能和另一分子酯发生缩合反应生成β-酮酸酯,这类反应称为Claisen酯缩合反应。乙酰乙酸乙酯就是通过这个反应制备的。 反应式: Na+[CH3COCH2 CO2C2H5] - CH3COCH2 CO2C2H5 + NaOAc 2CH3CO2C2H5 反应机理: CH3COC2H5 O +OC2 H5CH22H5 O +C2H5OH 3 O CH22H5 O CH 3C 2 H5 CH22H5 O CH3COCHCOOC2H5 Na 3CH 3COCH2COOC2H5 + CH3COONa 2、通常以酯及金属钠为原料,并以过量的酯为溶剂,利用酯中含有的微量醇与金属钠反应来生成醇钠,随着反应的进行,由于醇的不断地进行下去,直至金属钠消耗完毕。 但作为原料的酯中含醇量过高又会影响到产品的得率,故一般要求酯中含醇量在3%以下。 【主要试剂及物理性质】
【仪器装置】 1、主要仪器:回流冷凝管,圆底烧瓶 2、实验装置: 回流装置 【实验步骤及现象】 实验步骤 实验现象 名称 分子量 熔点/℃ 沸点/℃ 外观 邻二甲苯 106.17 -25.18 144.4 无色透明液体 乙酸乙酯 88.12 -83.6 77.1 无色透明液体 金属钠 22.99 97.82 881.4 银白色有金属光泽固体 乙酰乙酸 乙酯 130.15 -45 180.4 无色或微黄色透明液体 醋酸 60.05 16.6 117.9 无色液体 苯 78.1 5.5 80.1 无色透明易挥发液体
\\乙酯的制备 一、 实验目的 1. 掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。 2. 掌握分馏的原理及分馏柱的作用。 3. 进一步练习并熟练掌握液体产品的纯化方法。 二、 实验原理 乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的0.3%即可。其反应为: CH 3COOH +CH 3CH 2OH CH 3COOCH 2CH 3H 2O +CH 3CH 223CH 2OCH 2CH 3H 2O +CH 3CH 2OH 24 H 2O +CH 2CH 2主反应:副反应: 酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过 程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长的分馏柱进行分馏。
四、 实验装置图 蒸馏装置 五、 实验流程图 4ml 乙醇5ml 浓硫酸2粒沸石 10ml 8ml 73-80 的馏分,℃ 六、 实验步骤 在100ml 三颈瓶中,加入4ml 乙醇,摇动下慢慢加入5ml 浓硫酸,使其混合均匀,并加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以下,中间口安一长的刺形分馏柱(整个装置如上图)。 仪器装好后,在滴液漏斗内加入10ml 乙醇和8ml 冰醋酸,混合均匀,先向瓶内滴入约2ml 的混合液,然后,将三颈瓶在石棉网上小火加热到110-120℃左右,这时蒸馏管口应有液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维持反应温度在110-125℃之间,滴加完毕后,继续加热10分钟,直至温度升高到130℃不再有馏出液为止。 馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸等,在摇动下,慢慢向粗产品中加
目录 一、设计任务 (2) 二、概述 (2) 1.乙酸乙酯性质及用途 (2) 2.乙酸乙酯发展状况 (3) 三. 乙酸乙酯的生产方案及流程 (4) 1、酯化法 (4) 2. 乙醇脱氢歧化法 (5) 3、乙醛缩合法 (6) 4、乙烯、乙酸直接加成法 (7) 5、确定工艺方案及流程 (8) 四.工艺计算 (8) 4.1. 物料衡算 (8) 4.2 初步物料衡算 (10) 五. 设备设计 (16) 5.1 精馏塔Ⅱ的设计 (16) 5.2最小回流比的估算 (18) 5.3 逐板计算 (20) 5.4 逐板计算的结果及讨论 (20) 六. 热量衡算 (21) 6.1 热力学数据收集 (21) 6.2 热量计算,水汽消耗,热交换面积 (23) 6.3 校正热量计算、水汽消耗、热交换面积(对塔Ⅱ) (26) 表10校正后的热量计算汇总表 (32)
乙酸乙酯车间工艺设计 一、设计任务 1.设计任务:乙酸乙酯车间 2.产品名称:乙酸乙酯 3.产品规格:纯度99% 4.年生产能力:折算为100%乙酸乙酯1880吨/年 5.产品用途:作为制造乙酰胺、乙酰乙酸酯、甲基庚烯酮、其他有机化合物、合成香料、合成药物等的原料;用于乙醇脱水、乙酸浓缩、萃取有机酸;作为溶剂广泛应用于各种工业中;食品工业中作为芳香剂等。 由于本设计为假定设计,因此有关设计任务书中的其他项目如:进行设计的依据、厂区或厂址、主要技术经济指标、原料的供应、技术规格以及燃料种类、水电汽的主要来源,与其他工业企业的关系、建厂期限、设计单位、设计进度及设计阶段的规定等均从略。 二、概述 1.乙酸乙酯性质及用途 乙酸乙酯又名乙酸乙酯,乙酸醚,英文名称Ethyl Acetate或 Acetic Ether Vinegar naphtha.乙酸乙酯是具有水果及果酒芳香的无色透明液体,其沸点为77℃,熔点为-83.6℃,密度为0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等有机溶剂。 乙酸乙酯的重要用途是工业溶剂,它是许多树脂的高效溶剂,广泛应用于油墨、人造革、胶粘剂的生产中,也是清漆的组份。它还用于乙基纤维素、人造革、油毡、着色纸、人造珍珠的粘合剂、医用药品、有机酸的提取剂以及菠萝、香蕉、草莓等水果香料和威士忌、奶油等香料。此外,还用于木材纸浆加工等产业部门。对于用很多天然有机物的加工,例如樟脑、
乙酰乙酸乙酯的制备 前言: 乙酰乙酸乙酯,无色至淡黄色的澄清液体。微溶于水,易溶于乙醚,乙醇。有刺激性和麻醉性。可燃,遇明火、高热或接触氧化剂有发生燃烧的危险。有醚样和苹果似的香气。广泛应用于食用香精中,主要用以调配苹果、杏、桃等食用香精。制药工业用于制造氨基比林、维生素B 等。染料工用作合成染料的原料和用于电影基片染色。涂料工业用于制造清。有机工业用作溶剂和合成有机化合物的原料。 减压蒸馏基本原理:某些沸点较高的有机化合物在未达到沸点时往往发生分解或氧化的现象,所以,不能用常压蒸馏。在较低压力下进行蒸馏的操作称为减压蒸馏。当蒸馏系统内的压力降低后,其沸点便降低,当压力降低到1.3~2.0 kPa (10~15 mmHg)时,许多有机化合物的沸点可以比其常压下的沸点降低80~100℃。因此,减压蒸馏对于分离提纯沸点较高或高温时不稳定的液态有机化合物具有特别重要的意义。 反应方程式: CH 3COOC 2H 5乙醇钠 CH 3COCH 2COOC 2H 5+C 2H 5OH 1、实验部分 1.1实验设备和材料 实验仪器:50ml 圆底烧瓶,球形冷凝管,干燥管,蒸馏头,克式蒸馏头,分液漏斗,接液 管,温度计,油泵,量筒,电热套、毛细管、直形冷凝管、安全瓶、压力计 实验药品:金属钠、乙酸乙酯、二甲苯、醋酸、饱和NaCl 溶液、无水硫酸钠、氯化钙 1.2实验装置 回流装置 减压蒸馏装置 1.3实验过程
(1)制钠珠:将 0.9g 金属钠和5mL 干燥二甲苯放入装有回流冷凝管的50ml原定烧瓶中。加热使钠熔融。拆去冷凝管,用磨口玻塞塞紧圆底烧瓶,趁热用力振摇(两下)得细粒状钠珠。 (2回流、酸化:稍经放置钠珠沉于瓶底,将二甲苯倒入指定回收瓶中。迅速向瓶中加入10mL 乙酸乙酯,装上冷凝管,并在其顶端装一氯化钙干燥管。反应开始有氢气泡逸出。如反应很慢时,可稍加温热。待激烈的反应过后,则小火加热,保持微沸状态,直至所有金属钠全部作用完为止。此时生成的乙酰乙酸乙酯钠盐为桔红色透明溶液。待反应物稍冷后,在摇荡下加入 50% 的醋酸溶液,直到反应液呈弱酸性(pH=5-6)为止。此时,所有的固体物质均已溶解。 (3)分液、干燥:将溶液转移到分液漏斗中,加入等体积的饱和氯化钠溶液,用力摇振片刻。静置后,乙酰乙酸乙酯分层析出。分出上层粗产物,用无水硫酸钠干燥后滤入蒸馏瓶,并用少量乙酸乙酯洗涤干燥剂,一并转入蒸馏瓶中。 (4)蒸馏和减压蒸馏:先水浴蒸去未作用的乙酸乙酯,然后将剩余液移入 50mL 圆底烧瓶中,用减压蒸馏装置进行减压蒸馏。减压蒸馏时须缓慢加热,待残留的低沸点物质蒸出后,再升高温度,收集乙酰乙酸乙酯。 2、结果与讨论 2.1实验现象 2.2 产率与产量 气压差:4.6kPa=34.51mmHg,温度:83℃, 该气压下蒸出乙酰乙酸乙酯的温度:85℃ 产量:产物为淡黄色透明液体1.4g 产率: 1.4 / 5.2=26.92% 2.3实验仪器需干燥的原因分析 ①金属钠易与水反应生成放出氢气及大量的热易导致燃烧和爆炸。②钠与水反应生成的NaOH的存在易使乙酸乙酯水解成乙酸钠,造成原料耗损。③水使金属钠消耗难以形成碳负离子中间体,导致实验失败。 2.4制备实验中,加入50%醋酸和饱和食盐水的原因分析 因为乙酰乙酸乙酯分子中亚甲基上的氢比乙醇的酸性强得多(pKa=10.654),反应后生成的乙酰乙酸乙酯的钠盐,必需用醋酸酸化才能使乙酰乙酸乙酯游离出来。用饱和食盐水洗涤的目
乙酸乙酯的合成实验报告 学号:1120132970 实验日期:2015年3月27日一、实验目的与要求 (1)练习巩固回流蒸馏基本操作; (2)掌握分液漏斗的使用; (3)了解液体的干燥方法; (4)复习巩固酯化反应的机理。 二、复习内容 (1)萃取和洗涤—分液漏斗的使用; (2)回流; (3)干燥和干燥剂; (4)常压蒸馏基本操作。 三、反应原理 (1)萃取和洗涤 萃取和洗涤是利用物质在不同溶剂中的溶解度不同来进行分离、提取或纯化的操作。 萃取和洗涤在原理上是一样的,只是目的不同。从混合物中抽取所需要的物质,叫萃取或提取;从混合物中除去不需要的杂质,叫洗涤。 萃取是利用物质在两种互不相溶的溶剂中溶解度或分配比的不 同来达到分离、提取或纯化目的的一种操作。根据分配定律,在一定
温度下,有机物在两种溶剂中的浓度之比为一常数。即:利用分配系数的定义式可计算每次萃取后,溶液中的溶质的剩余量。 设V为被萃取溶液的体积(mL),近似看作与溶剂A的体积相等(因溶质量不多,可忽略)。 Wo 为被萃取溶液中溶质的总质量(g ),S为萃取时所用溶剂B 的体积(mL),W1为第一次萃取后溶质在溶剂A中的剩余量(g ),(Wo -W1) 为第一次萃取后溶质在溶剂B中的含量(g )。 则: 设W2为第二次萃取后溶质在溶剂A中的剩余量(g ) 设Wn 为经过n次萃取后溶质在溶剂A中的剩余量(g ) ,则:因为上式中KV/ (KV+S) 一项恒小于1,所以n越大,Wn就越小,也就是说一定量的溶剂分成几份多次萃取,其效果比用全部量溶剂做一次萃取为好。萃取和洗涤在原理上是一样的,只是目的不同。从混合物中抽取所需要的物质,叫萃取或提取;从混合物中除去不需要的杂质,叫洗涤。 (2)干燥和干燥剂 干燥是用来除去固体、气体或液体中含有有少量水分和少量有机溶剂的方法。它是实验室中最常用的操作之一。此项操作较为简单,但其完成得好坏将直接影响到有机反应的本身以及纯化和分析产品 时的结果。因此,操作者必须严肃对待,严格操作。 干燥的方法,大致可分为两种:
乙酸乙酯 乙酸乙酯的分子式是C4H8O2,CAS号为141-78-6.是乙酸中的羟基被乙氧基取代而生成的化合物。 无色透明液体,有水果香,易挥发,对空气敏感,能吸水分,水分能使其缓慢分解而呈酸性反应。可用作纺织工业的清洗剂和天然香料的萃取剂,也是制药工业和有机合成的重要原料。 基本信息 乙酸乙酯 Aceticether 醋酸乙酯 CH3COOC2H5 相对分子质量 有机物-酯 不管制 密封阴凉干燥保存 展开 分子结构 基本信息 中文名称:乙酸乙酯 英文名称:Ethyl acetate 中文别名:醋酸乙酯;醋酸乙脂 英文别名:Acetic acid ethyl ester; ethyl acetate B&J brand 4 L; ETHYLACETATE ULTRA RESI-ANAL.; ETHYL ACETATE CAPILLARY GRADE; Ethyl Acetate Specially Purified - SPECIFIED; Acetic Ether; RFE; acetic ester CAS号:141-78-6 分子式:C4H8O2 分子量:
物性数据 1.性状:无色澄清液体,有芳香气味,易挥发。[1] 2.熔点(℃):[2] 3.沸点(℃):[3] 4.相对密度(水=1):(20℃)[4] 5.相对蒸气密度(空气=1):[5] 6.饱和蒸气压(kPa):(20℃)[6] 7.燃烧热(kJ/mol):-2072[7] 8.临界温度(℃):[8] 9.临界压力(MPa):[9] 10.辛醇/水分配系数:[10] 11.闪点(℃):-4(CC);(OC)[11] 12.引燃温度(℃):[12] 13.爆炸上限(%):[13] 14.爆炸下限(%):[14] 15.溶解性:微溶于水,溶于乙醇、丙酮、乙醚、氯仿、苯等多数有机溶剂。[15] 16.黏度(mPa·s,20oC): 17.闪点(oC,闭口):-3 18.闪点(oC,开口): 19.燃点(oC): 20.蒸发热(KJ/mol,.): 21.熔化热(KJ/mol): 22.生成热(KJ/mol): 23.(KJ/(kg·K),,定压): 24.电导率(S/m,25oC):×10-9 25.热导率(W/(m·K),20oC): 26.体膨胀系数(K-1,20oC): 27.临界密度(g·cm-3): 28.临界体积(cm3·mol-1):286 29.临界压缩因子: 30.偏心因子: 31.溶度参数(J·cm-3): der Waals面积(cm2·mol-1):×109 der Waals体积(cm3·mol-1): 34.气相标准燃烧热(焓)(kJ·mol-1):
乙酸乙酯的制备 摘要: 关键词:乙酸乙酯制备酯化 引言 [1]纯净的乙酸乙酯是无色透明有芳香气味的液体,微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。乙酸乙酯是一种用途广泛的精细化工产品,具有优异的溶解性、快干性,用途广泛,是一种非常重要的有机化工原料和极好的工业溶剂。它特有的溶解性和快干性使其被广泛应用于工业合成有机纤维、医疗制药业和食品食用香精加工业和化妆品香料制造业,更被作为低毒有机溶剂推广于化工生产的各个领域。 一、实验目的 (1)、熟悉和掌握酯化反应的基本原理和制备方法 (2)掌握回流、洗涤、蒸馏等基本操作 二、实验原理与用品 (1)原理 本实验乙酸乙酯采用乙酸和乙醇在少量浓硫酸催化下进行制备,反应式为 CH3COOH+CH3CH2OH CH3COOCH2+H2O 酯化反应是一个可逆反应,在反应中,酯的合成与酯的水解形成一个动态平衡,采用增加醇或酸的量,蒸出酯和水的方法,可以增加酯的产率。由于酯和水能形成二元共沸混合物,比乙醇和乙酸的沸点都低,因此乙酸乙酯很容易被蒸出。制得的粗产物需要进行纯化,进一步除去其中混有的乙醇和水。 (2)用品 实验仪器:圆底烧瓶蒸馏头球形冷凝管直形冷凝管锥形瓶量筒温度计分液漏斗烧杯折射仪电热套 实验试剂: 冰醋酸浓硫酸无水乙醇饱和碳酸钠溶液饱和食盐水饱和氯化钙溶液无水硫酸镁 三实验步骤 (1)制备 在50ml圆底烧瓶中加入19ml无水乙醇、12ml冰醋酸和2ml浓硫酸,加入几粒沸石,摇匀后,装上球形冷凝管,在电热套上小火加热,回流30min后停止加热。冷却后,取下球形冷凝管,装上蒸馏头,将仪器改装成普通蒸馏装置,加热蒸馏,至流出液体积约为反应物总体积的1/2为止。 (2)纯化 馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸。在摇动下,缓缓地加入饱和碳酸钠溶液约10ml,直至无二氧化碳气体逸出,然后移入分液漏斗中,充分振荡,静置后,分去下层水相,酯层用10ml饱和食盐水洗涤后,再分别用10ml饱和氯化钙溶液洗涤两次,弃去下层液,酯层自漏斗上口倒入干燥的50ml锥形瓶中,用无水硫酸钠干燥30min。 将干燥过的乙酸乙酯滤入干净的蒸馏瓶中,加入沸石后在电热套上进行蒸馏,收集73~78℃的馏分。 四、实验结果及讨论 (1)结果;本实验乙酸乙酯13ml,折射率为1.5159。
制备乙酸乙酯的工业方法研究 摘要:乙酸乙酯是一种重要的精细化学品应用比较广泛,世界需求量很大。其主要工业制备方法有乙酸酯化法、乙醛缩合法、乙醇脱氢法和乙烯加成法。本文介绍了四种制法的反应原理和工艺特点,结合当代社会精细化工产业的发展特点对这几种制法进行比较分析。 关键字:乙酸乙酯酯化反应反应机理乙醛缩合乙醇脱氢乙烯加成Abstract: Ethyl acetate is an important fine chemicals,it is used widely in the world and in great demand.The main industrial preparation of ethyl acetate are acid esterification,oxidation of acetaldehyde,ethanol dehydrogenation and ethylene-plus method.This article describes the principle of the reaction system of law and process characteristics.With contemporary society characterized by the development of fine chemical industry we compare these various methods . Keywords: ethyl acetate、esterification、reaction mechanis、aldehyde condensation Dehydrogenation of ethanol、Addition of ethylene 1.前言 精细化工产品(即精细化学品)是指那些具有特定的应用功能,技术密集,商品性强,产品附加值较高的化工产品。精细化工产品种类多、附加值高、用途广、产业关联度大,直接服务于国民经济的诸多行业和高新技术产业的各个领域。大力发展精细化工已成为我国调整化学工业结构、提升化学工业产业能级和扩大经济效益的战略重点[1]。 乙酸乙酯( EA),又名醋酸乙酯,作为一类重要的精细化学品应用较为广泛,具有良好的溶解性、快干性,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树酯、乙酸纤维树酯、合成橡胶等生产;也可用于生产复印机用液体硝基纤维墨水;在纺织工业中用作清洗剂;食品工业中用作特殊改性酒精的香味萃取剂;香料工业中是重要的香料添加剂,可作为调香剂的组分。此外,乙酸乙酯也可用作
班级:煤化111 姓名:郝海平 学号:10 乙酸乙酯的制备实验报告一.实验目的 1.掌握酯化反应原理以及由乙酸和乙醇制备乙酸乙酯的方法。 2.学会回流反应装置的搭制方法。 3.复习蒸馏、分液漏斗的使用、液体的洗涤与干燥等基本操作。 二.实验原理 本实验用冰醋酸和乙醇为原料,采用乙醇过量、利用浓硫酸的吸水作用使反 应顺利进行。除生成乙酸乙酯的主反应外,还有生成乙醚的副反应。 主反应: 浓H 2S O 4 CH 3COOH +CH 3CH 2OH CH 3COOCH 2CH 3H 2O + 副反应: CH 3CH 2OH H 2 O 浓H S O 170 o C C H 2C H 2+ H 2O (CH 3CH 2)2O 2(CH 3CH 2)2+浓H 2S O 4140 o C 三.仪器与试剂 仪器:100ml 、50ml 圆底烧瓶,冷凝管,温度计,分液漏斗,电热套,分馏柱, 接引管,铁架台,胶管 量筒等。 试剂:无水乙醇 冰醋酸 浓硫酸 碳酸钠 食盐水 氯化钙 硫酸镁 四.实验步骤 1.向烧瓶中加入19ml 无水乙醇和5ml 浓硫酸,向恒压漏斗中加入8ml 冰醋 酸。
2.开始加热,加热电压控制在70V----80V,并冰醋酸缓慢滴入烧瓶,微沸30----40min。 3.蒸馏温度控制在温度严格控制在73-----78℃直至反应结束。 五.产品精制 1.首先加入7ml碳酸钠饱和溶液,用分液漏斗分,目的是离除去冰醋酸。 2.再向分液漏斗上层液中加入7ml饱和食盐水,目的是防止乙酸乙酯水解。 3.加入7ml饱和氯化钙溶液,目的是出去无水乙醇。 4.加入2g MgSO4 固体,目的是除水。 六.数据处理 最后量取乙酸乙酯为。(冰醋酸相对分子质量相对 密度)(乙酸乙酯相对分子质量相对密度) 产率=()//60)X100%=57% 七.讨论 1.浓硫酸加入时会放热,应在摇动中缓慢加入。 2.加入饱和NaCO 3时,应在摇动后放气,以避免产生CO 2 而使分液漏斗内压力过 大。 3.若CO 32-洗涤不完全,加入CaCl 2 时会有CaCO 3 沉淀生成,应加入稀盐酸溶解。 4.干燥时应塞上瓶塞,并间歇振荡。 5.蒸馏时,所有仪器均需烘干。
化学与环境学院 有机化学实验报告 实验名称乙酰乙酸乙酯的制备(一) 【实验目的】 1、了解乙酰乙酸乙酯的制备原理和方法,加深对Claisen酯缩合反应原理的理解和认识; 2、熟悉在酯缩合反应中金属钠的应用和操作 3、掌握无水操作、萃取等操作。 【实验原理】(包括反应机理) 1、含有α-H的酯在碱性催化剂存在下,能和另一分子酯发生缩合反应生成β-酮酸酯,这类反应称为Claisen酯缩合反应。乙酰乙酸乙酯就是通过这个反应制备的。 反应式: 反应机理:
CH 3COC 2H 5O +OC 2 H 5 CH 2COC 2H 5O +C 2H 5OH CH 3COC 2H 5O CH 2COC 2H 5O +CH 3C O OC 2H 5 CH 2COC 2H 5 O CH 3COCHCOOC 2H 5 Na CH 3COOH CH 3COCH 2COOC 2H 5 + CH 3COONa 2、通常 以酯及金属钠为原料,并以过量的酯为溶剂,利用酯中含有的微量醇与金属钠反应来生成醇钠,随着反应的进行,由于醇的不断地进行下去,直至金属钠消耗完毕。 但作为原料的酯中含醇量过高又会影响到产品的得率,故一般要求酯中含醇量在3%以下。 【主要试剂及物理性质】 【仪器装置】 1、主要仪器:回 流冷凝管,圆底烧瓶 2、实验装置: 回流装置 名称 分子量 熔点/℃ 沸点/℃ 外观 邻二甲苯 106.17 -25.18 144.4 无色透明液体 乙酸乙酯 88.12 -83.6 77.1 无色透明液体 金属钠 22.99 97.82 881.4 银白色有金属光泽固体 乙酰乙酸 乙酯 130.15 -45 180.4 无色或微黄色透明液体 醋酸 60.05 16.6 117.9 无色液体 苯 78.1 5.5 80.1 无色透明易挥发液体
青岛大学实验报告 年月日姓名系年级组别同组者 科目有机化学题目乙酸乙酯的制备仪器编号 一.实验目的 1.掌握酯化反应原理以及由乙酸和乙醇制备乙酸乙酯的方法。 2.学会回流反应装置的搭制方法。 3.复习蒸馏、分液漏斗的使用、液体的洗涤与干燥等基本操作。 二.实验原理 本实验用冰醋酸和乙醇为原料,采用乙醇过量、利用浓硫酸的吸水作用使反应顺利进行。除生成乙酸乙酯的主反应外,还有生成乙醚的副反应。主反应: 副反应: 乙酸乙酯的立体结构 三.仪器与试剂 仪器:100ml、50ml圆底烧瓶,冷凝管,温度计,分液漏斗,电热套,维氏分馏柱,接引管,铁架台,胶管等。 试剂: 试剂名称用量规格试剂名称用量规格 冰醋酸20ml CP NaCl 4g CP 95%乙醇25ml CaCl 2 15g 98%浓硫酸10ml NaCO 3 10g 无水MgSO 4 5g 四.实验装置图 反应装置蒸馏装置 五.实验步骤流程图 浓H 2SO 4 蒸馏 饱和Na 2CO 3 洗涤 饱和NaCl洗涤 饱和CaCl 2洗涤 CH 3COOH+C 2 H 5 OH CH 3COOC 2 H 5 ,CH 3 COOH,C 2 H 5 OH,H 2 SO 4 ,H 2 O,(CH 3 CH 2 ) 2 O 馏出物CH 3COOC 2 H 5, C 2H 5 OH,H 2 O,(CH 3 CH 2 ) 2 O,CH 3 COO H 残馏液CH 3 COOH, H 2 SO 4, H 2 O,(CH 3 CH 2 ) 2 O 有机层(上层)CH 3COOC 2 H, C 2H 5 OH,(CH 3 CH 2 ) 2 O,Na 2 CO 3 水层(下层) CH3COONa,C 2 H 5 OH,H 2 O 有机层(上层)C 2 H 5 OH, CH 3 COOC 2 H 5 , (CH 3 CH 2 ) 2 O 水层(下层) C 2 H 5 OH,Na 2 CO 3, H 2 O,NaCl
几种工业乙酸乙酯制备方法的技术经济对比 李雄 (中国石化上海石油化工股份有限公司,200540) 乙酸乙酯是应用最广泛的脂肪酸酯之一,其制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。相对比,乙醛缩合法生产乙酸乙酯路线投资低、成本也较低,较适合乙醛富裕地区投资生产。 关键词:乙醛乙酸乙酯技经指标成本 1 用途及市场情况介绍 乙酸乙酯(EA),又名醋酸乙酯,是应用最广泛的脂肪酸酯之一,具有优良的溶解性能,是一种快干性的、极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树酯、乙酸纤维树酯、合成橡胶等生产;也可用于生产复印机用液体硝基纤维墨水;在纺织工业中用作清洗剂;食品工业中用作特殊改性酒精的香味萃取剂;香料工业中是最重要的香料添加剂,可作为调香剂的组分。以外,EA也可用作粘合剂的溶剂、油漆的稀释剂以及制造药物、染料的原料。 1.1 国际市场分析 乙酸乙酯由于其特殊的性能,在世界化工市场相当活跃。美国和日本是世界上最大的乙酸乙酯生产和消费国。全世界生产能力中美国占31.73%,日本占35.75%。美国的主要生产公司是Eastman公司、Hoechst Calanese及孟山都公司,总生产能力为127 kt/a。日本的主要生产公司是千叶乙酸乙酯、日本合成化学、德山石油化学及协和油化,总生产能力为193 kt/a。 在亚洲地区,乙酸乙酯的主要市场是日本、中国和东南亚。日本是该地区乙酸乙酯的净出口国,有近50%的生产能力在日本,该地区的生产缺口达70 kt/a,目前主要从美国和欧洲进口。近年来,日本的乙酸乙酯产量以每年10%的速率增长,增加量基本用于出口。 1.2 国内供需及预测 (1)生产能力 目前,我国乙酸乙酯的生产企业有30多家,年生产能力在万吨以上的仅有两家,其余均为千吨级生产装置,除上海石化采用乙醛法生产、山东临沭化肥厂是采用乙醇脱氢法生产外都是采用直接酯化法。 (2)产量和进口量
实验报告 课程名称合成化学实验名称乙酰乙酸乙酯的制备 二级学院化学化工学院专业化学姓名汪建红实验次数 2 实验日期: 3 月 18 日 验条件:室温℃ 相对湿度 % 大气压 mmHg 一、实验目的 1、学习乙酰乙酸乙酯制备的原理和方法; 2、掌握无水操作及减压蒸馏等操作。 二、实验原理 1、乙酰乙酸乙酯的结构 乙酰乙酸乙酯存在互变异构现象,是酮式和烯醇式混合物,室温下酮式(92%),烯醇式(8%) CH3C O CH2 C O OC2H5 CH3 C O H O C CH OC2H5 异构体表现出各自的性质,一定条件下可分离为纯物质,微量酸碱下呈迅速转化的平衡混合物,溶剂对平衡有明显影响。 2、乙酰乙酸乙酯的作用或者用途 其钠化物可与卤代烷发生亲核取代,生成一烷基或二烷基取代的乙酰乙酸乙酯, CH3COCH2CO2C2H5 NaOC H 25 Na [CH3COCHCO2C2H5] 3 COCHCO2C2H5 R NaOC H 25 R'X CH 3 COCCO2C2H5 R R' 取代的乙酰乙酸乙酯可发生酸式和酮式水解两种水解方式,用冷的稀碱处理,酸化后加热脱羧,即酮式水解,可用来生成酮:
CH 3COCHCO 2C 2H R CH 3COCHCO 2 R ① H O 3COCH 2R 如与浓碱在醇溶液中加热,则发生酸水解,生成取代乙酸 CH 3COCHCO 2C 2H 5 R ①KOH ,C H OH , RCH 2CO 2H + CH 3CO 2H 丙二酸酯可得到更高产率的取代乙酸,乙酰乙酸乙酯的酸水解在合成中已很少用 3、乙酰乙酸乙酯的合成方法 含α-活泼氢的酯,在碱性条件下能与另一分子酯发生Claisen 酯缩合,生成β-羰基酸酯,乙酰乙酸乙酯就是这样制备的,用金属钠作缩合试剂时,真正的催化剂是钠与乙酸乙酯中少量的乙醇生成的醇钠,一旦反应开始,乙醇可不断产生,反应继续,若无少量乙醇则不能缩合。 CH 3CO 2C 2H 5 + OC 2H 5 CH 2CO 2C 2H 5+HOC 2H 5 CH 32H 5 O CH 2 CO 2C 2H5CH 3C O OC 2H 5 CH 2CO 2C 2H 5 CH 32CO 2C 2H 5O + OC 2H 5 [ ]CH 3C CHCO 2C 2H O 3C CHCO 2C 2H 5 O 乙酰乙酸乙酯中亚甲基上的氢酸性比乙醇的强得多,最后一步实际上不可逆,生成的是乙酰乙酸乙酯的钠化合物。 反应式: CH 3CO 2C 2H 5 NaOC 2H 5 Na[CH 3COCHCO 2C 2H 5] HOAc CH 3COCHCO 2C 2H 5 + NaOAc 4、合成乙酰乙酸乙酯的主反应 Na + C 2H 5OH NaOC 2H 5 2CH 3CO 2C 2H 5 NaOC 2H 5 Na + CH 3COCHCO 2C 2H 5 [ ]_ HOAc CH 3COCH 2CO 2C 2H 5 + NaOAc
实验一 乙酸乙酯的制备 实验目的 1、熟悉和掌握酯化反应的基本原理和制备方法,掌握可逆反应提高产率的措施; 2、掌握液体有机化合物的精制方法(分馏)。 实验内容 一、实验原理 在少量酸(H 2SO 4或HCl )催化下,羧酸和醇反应生成酯,这个反应叫做酯化反应(Esterification)。该反应通过加成-消去过程。质子活化的羰基被亲核的醇进攻发生加成,在酸作用下脱水成酯。该反应为可逆反应,为了完成反应一般采用大量过量的反应试剂(根据反应物的价格,过量酸或过量醇)。有时可以加入与水恒沸的物质不断从反应体系中带出水移动平衡(即减小产物的浓度)。在实验室中也可以采用分水器来完成。 酯化反应的可能历程为: R C O OH R C OH OH H R'OH R C OH OH OR' H -H R C OH OH OR' R C OH OH OR' H R C OH OH 2 OR' -H 2O R C OH OR' H -R C O OR' 乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的3%即可。其反应为: CH 3COOH +CH 3CH 2OH H 2SO 4 CH 3COOCH 2CH 3H 2O +CH 3CH 2OH 2H 2SO 4 CH 3CH 2OCH 2CH 3H 2O +CH 3CH 2OH H 2SO 4 H 2O +CH 2CH 2主反应:副反应: 酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长的分馏柱进行分馏。 二、实验仪器及所需药品
乙酰乙酸乙酯的制备 【实验目的】 1.了解通过Claisen 缩合反应由乙酸乙酯制备“三乙”的基本原理和方法。 2.了解和掌握蒸馏装置的原理和作用。 【实验原理】 含α - 活泼氢的酯在碱性催化剂存在下,能与另一分子酯发生 Claisen 酯缩合反应,生成β - 羰基酸酯。 乙酰乙酸乙酯就是通过这一反应制备的。当用金属钠作缩合试剂时,真正的催化剂是钠与乙酸乙酯中残留的少量乙醇作用产生的乙醇钠。一旦反应开始,乙醇就可以不断生成并和金属钠继续作用产生乙醇钠。 反应式: 2CH 3CO 2C 2H 5 Na +[CH 3COCH 2 CO 2C 2H 5]-CH 3COCH 2 CO 2C 2H 5 + NaOAc CH 3COC 2H 5O +OC 2H 5 CH 22H 5O +C 2H 5OH 3 22H 5 O CH 3C OC 2H 5 CH 22H 5O CH 3COCHCOOC 2H 5 Na 3CH 3COCH 2COOC 2H 5 + CH 3COONa 由上述反应机理看出,反应要求: 1.仪器、药品均需干燥,严格无水。 2.第一步反应中C2H5O-的多少由钠决定,故整个反应以钠为基准。 3. 由于乙酰乙酸乙酯分子中亚甲基上的氢比乙醇的酸性强的多(p Ka =10.65),所以脱醇反应后生成的是乙酰乙酸乙酯的钠盐形式。最后必须用酸(如醋酸)酸化,才能使乙酰乙酸乙酯游离出来。 【实验装置图】
【实验的准备】 仪器:圆底烧瓶,冷凝管,干燥管,蒸馏头,分液漏斗,接液管,温度计,量筒,电热套等 药品:金属钠 0.5g(0.022mol)、乙酸乙酯5g (5.5mL, 0.057mol) 、二甲苯2.5mL、醋酸、饱和NaCl溶液、无水硫酸钠 【操作步骤】 1.安装回流反应装置 2.制钠珠在干燥的 25mL 圆底烧瓶中加入 0.5g 金属钠和 2.5mL 二甲苯,装上冷 凝管,加热使钠熔融。拆去冷凝管,用磨口玻塞塞紧圆底烧瓶,用力振摇得细粒状钠珠。 3.缩合和酸化稍经放置钠珠沉于瓶底,将二甲苯倒入指定回收瓶中。迅速向瓶中加 入 5.5mL 乙酸乙酯,装上冷凝管,并在其顶端装一氯化钙干燥管。反应开始有氢气泡逸出。如反应很慢时,可稍加温热。待激烈的反应过后,则小火加热,保持微沸状态,直至所有金属钠全部作用完为止。 此时生成的乙酰乙酸乙酯钠盐为桔红色透明溶液(有时析出黄白色沉淀)。待反应物稍冷后,在摇荡下加入 50% 的醋酸溶液,直到反应液呈弱酸性(约需3mL),此时,所有的固体物质均已溶解。
实验四 乙酸乙酯制备 一、实验目的: 1、 掌握用醇和羧酸制备酯的方法。 2、 练习分液漏斗的使用及蒸馏操作 二、试剂: 乙醇 、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3 g (用于干燥乙酸乙酯) 三、反应原理: 主反应 副反应 四、仪器与反应装置图: 仪器 三口圆底烧瓶、温度计、滴液漏斗、分液漏斗、锥形瓶、直形冷凝管、蒸馏头、接受弯头、加热系统。 装置图 2CH 3CH 2OH 140o C CH 3CH 2OCH 2CH 3+H 2O H 2SO 4CH 3CH 2OH 170o C +H 2O H 2SO 4 CH 2CH 2CH 3COOH +C 2H 5OH 浓H 2SO 4120℃ CH 3COOC 2H 5+H 2O
五、操作步骤: 1、粗乙酸乙酯的制备 ①在干燥的100 mL 三颈烧瓶中加入8 mL 95%的乙醇,在冷水冷却下,边摇边慢慢加入8 mL 浓硫酸,加入沸石;在滴液漏斗中加入8 mL 95%的乙醇和8 mL 乙酸,摇匀。按上述装置图组装仪器。滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5~1 cm 处。 ②加热,当温度计读数上升到110℃时,从滴液漏斗中滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),并维持反应温度在120℃左右。滴加完毕,继续加热数分钟,直到反应液温度升到130℃,不再有馏出液为止。 2、洗涤 ③向粗产物中慢慢加入饱和碳酸钠溶液,直到有机相的pH 值呈中性为止。分去水相,有机相用 7 mL 饱和食盐水洗涤后,再饱和氯化钙洗涤两次,每次7mL 。弃去水层,酯层用无水硫酸钠干燥。 ④将干燥后的乙酸乙酯滤入 25mL 蒸馏瓶中,蒸馏,收集 73-78 ℃馏分,称重,计算产率 。 纯粹乙酸乙酯的沸点为 77.06 ℃,具有果香味。 六、注意事项: 1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。 2、加热之前一定将反应混合物混合均匀,否则容易炭化。 3、分液漏斗的正确使用和维护。。 4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。 5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。 6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。 7、反应和蒸馏时不要忘记加沸石。 8、用CaCl 2溶液洗之前,一定要先用饱和NaCl 溶液洗,否则会产生沉淀,给分液带来困难。 七、思考题: 1 、酯化反应有什么特点,本实验如何创造条件使酯化反应尽量向生成物方向进行? 洗涤 饱和Na 2CO 3洗至PH 不显酸性(约10ml ) 饱和NaCl 洗(约7ml ) 饱和CaCl 2洗(约7ml )
工业乙酸乙酯的制备方法 目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。传统的乙酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要是乙醛缩合法和乙醇脱氢法,在乙醛原料较丰富的地区万吨级以上的乙醛缩合法装置得到了广泛的应用。乙醇脱氢法是近年开发的新工艺,在乙醇丰富且低成本的地区得到了推广。最新的乙酸乙酯生产方法是乙烯加成法,1998年在印度尼西亚迈拉库地区采用日本昭和电工专利技术建成了50 kt/a生产装置。 (1)乙酸酯化法 乙酸酯化法是传统的乙酸乙酯生产方法,在催化剂存在下,由乙酸和乙醇发生酯化反应而得。 CH3CH2OH+CH3COOH=CH3COOCH2CH3+H2O 乙醇乙酸乙酸乙酯水 反应除去生成水,可得到高收率。该法生产乙酸乙酯的主要缺点是成本高、设备腐蚀性强,在国际上是属于被淘汰的工艺路线。 (2)乙醛缩合法 在催化剂乙醇铝的存在下,两个分子的乙醛自动氧化和缩合,重排形成一分子的乙酸乙酯。 2CH3CHO→CH3COOCH2CH3 乙醛乙酸乙酯 该方法20世纪70年代在欧美、日本等地已形成了大规模的生产装置,在生产成本和环境保护等方面都有着明显的优势。 (3)乙醇脱氢法 采用铜基催化剂使乙醇脱氢生成粗乙酸乙酯,经高低压蒸馏除去共沸物,得到纯度为99.8%以上乙酸乙酯。 2C2H5OH→CH3COOCH2CH3+H2 乙醇乙酸乙酯氢 (4)乙烯加成法
在以附载在二氧化硅等载体上的杂多酸金属盐或杂多酸为催化剂的存在下,乙烯气相水合后与气化乙酸直接酯化生成乙酸乙酯。 CH2CH2+CH3COOH=CH3COOCH2CH3 乙烯乙酸乙酸乙酯 该反应乙酸的单程转化率为66%,以乙烯计乙酸乙酯的选择性为94%。Rhone-Poulenc 、昭和电工和BP等跨国公司都开发了该生产工艺。 由于上海石化股份有限公司具有丰富的乙烯、乙酸和乙醛,故本文对乙酸酯化法、乙醛缩合法和乙烯加成法生产乙酸乙酯的技术经济指标予以对比分析。 技术经济指标对比 对于同为80 kt/a级的工业乙酸乙酯生产装置,分析其各项经济技术指标,对比如表2。表2 乙酸乙酯各工艺路线技术经济指标对照 工艺路线 乙醛缩合法 乙烯加成法 酯化法 原料单耗 /t·t-1 乙烯 - 0.355 乙醛 1.02 乙酸 0.718 0.692 乙醇 - 0.533 其他 0.005 0.01 0.005