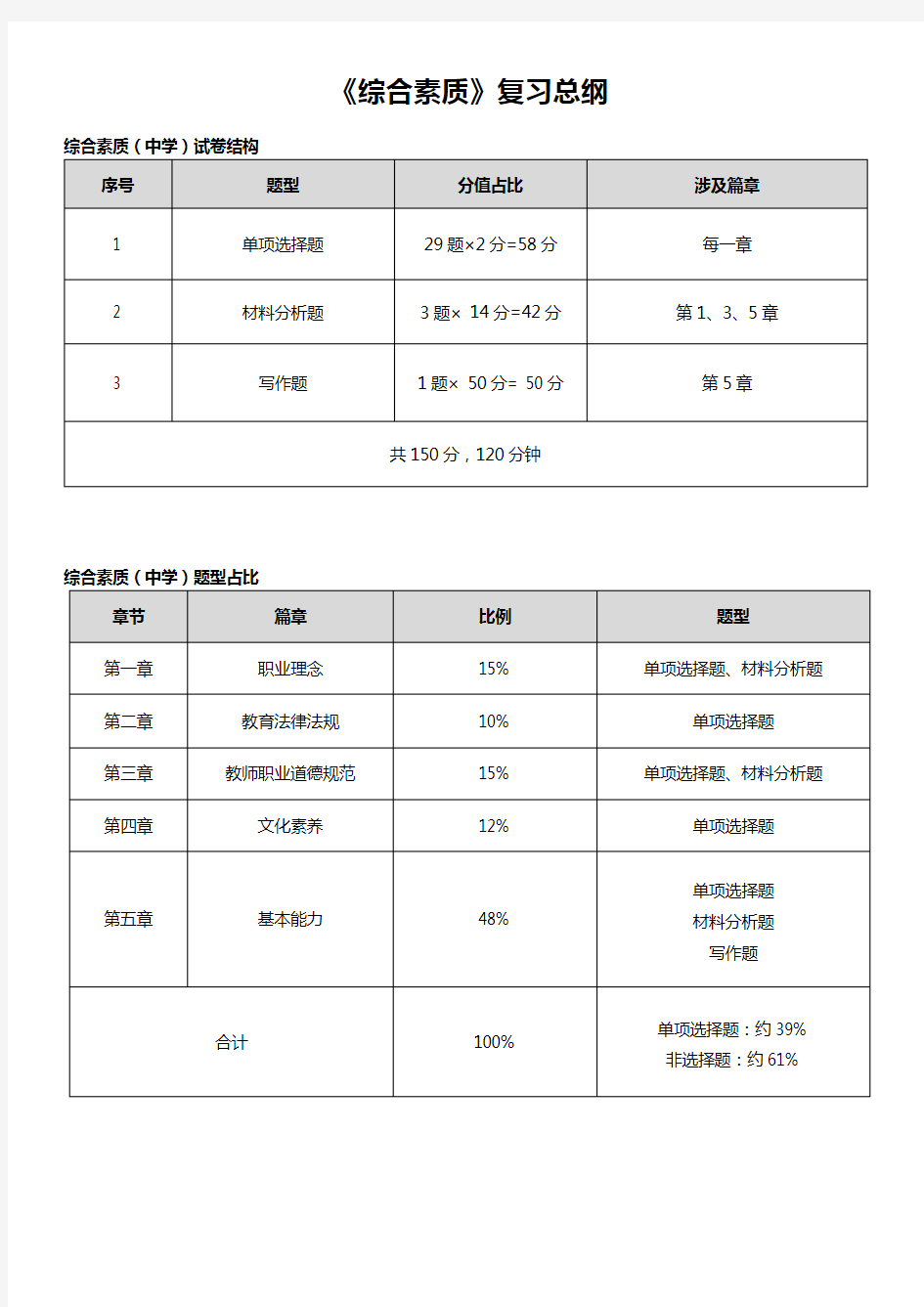

《综合素质》复习总纲
第一章 教师职业理念
第一节 教育观
教育观即教师的教育观念,是指教师在教育、教学实践中形成的,对相关教育现象,特别是对自己的教学能力和所教学生的主体性认识。 考纲解析
1.理解国家实施素质教育的基本要求。
2.掌握在学校教育中开展素质教育的途径和方法。
3.依据国家实施素质教育的基本要求,分析和评判教育现象。
? 素质教育的基本内涵
素质教育是以人的素质发展为核心的教育
《决定》指出:“实施素质教育,就是要全面贯彻党的教育指导方针,以提高国民的素质为根本宗旨,以培养学生的创新精神和时间能力为重点,造就‘有理想、有道德、有文化、有纪律’的、德智体美等全面发展的社会主义事业建设者和接班人。“
? 素质教育的基本内涵(要掌握,有可能出分析题)
1、 面向全体学生
依法保障义务教育阶段儿童和青少年学习发展的基本权利,改变仅以分数衡量学生的做法,有失教育公平。
2、 促进学生全面发展
要求学生德、智、体、美等各方面并重。 3、 重视学生创新精神和实践能力的培养
素质教育要以培养学生的创新精神和实践能力为重点。 教育与生产劳动相结合,是培养全面发展人才的重要途径。 4、 培养学生主动精神,注重学生个性发展
素质教育强调学生创新精神的培养,这是以学生注动精神和个性发展为基础的。
5、 着眼于学生的终身可持续发展
? 素质教育的实施
1、 转变课程功能 (改变课程过于注重知识传授的倾向,强调形成积极主动的学习态度)
2、 调整课程结构 (整体设置九年一贯课程门类和课时比例,并设置综合课程)
3、 密切课程内容与生活和时代的联系 (关注学生的学习兴趣和经验)
4、 改善学生的学习方式 (改变课程实施过于强调接受学习、死记硬背、机械训练的现状)
5、建立与素质教育理念相一致的评价与考试制度
6、实行三级课程管理制度(国家、地方、学校三级课程管理)
?学校教育中开展素质教育的主要途径和方法(要掌握)
1、把教学目标的的实现,落实到每一堂课,乃至教学的每一个环节(对课堂教学的基本要求)
2、构建生活、生产实际和社会发展紧密联系的学科内容体系(最为迫切、最为关键的一步)
3、全方位跳动学生的主动性和积极性,保证学生学习的有效性,提高学生学习的质量,促进学生学习的
良性循环。(课堂教学的首要任务和核心课题)
4、最大限度地发挥教师的作用
5、建立多层次、多样化的教学模式
?素质教育存在的问题
1、重智育,轻德育。
2、重文化知识传授,轻创新精神培养。
3、面向少数升学有望的学生而忽视了大多数学生的发展。
4、学生课业负担依然过重,影响了学生身心健康。
5、学生体质和健康状况不容乐观,部分指标有所下降。
?实施素质教育的对策探讨
1、转变教育观念
2、提高教师队伍素质
3、改革考试制度
第二节学生观
学生观即教师对学生的基本认识和根本态度,它直接影响教育活动的目的、方式和效果。在实施新课程中,学生是核心。
考纲解析
1.理解人的全面发展的思想。
2.理解“以人为本”的涵义,在教育教学活动中做到以学生的全面发展为本。
3.运用“以人为本”的学生观,在教学教学活动中公正地对待每一个学生,不因性别、民族、地域、经济状况、家庭背景和身心缺陷等歧视学生。
4.设计或选择丰富多样、适当的教学教学活动方式,因材施教,以促进学生的个性发展。
?全面发展教育的基本内涵
全面发展教育,对含有各方面素质培养功能的整体教育的一种概括,是对为使受教育者得到多方面发展而实施的培养多种素质的教育活动的总称,由多种相互联系而又各具特点的教育所组成。
?学生的本质特征
1、学生以系统学习间接经验为主
2、学生是具有主体性的人
3、学生具有明显的发展特征
(1)学生的身心发展具有规律性(2)每个学生都具有巨大的发展潜能
?以人为本的内涵(以理解为主)
1、从社会发展思想看,以人为本是科学发展观的核心
(1)以人为本是历史唯物主义的一项基本原则;
(2)以人为本是我们党的根本宗旨和执政理念的集中体现;
(3)以人为本全面回答了科学发展观的一系列基本问题。即为谁发展、靠谁发展、发展成果如何分配。
2、从教育思想看,以人为本就是在教育活动中以学生为本,以学生的全面发展为本,以全体学生的全面
发展为本。
(1)在教育活动中做到尊重学生主体地位,引导学生成长;
(2)在教育教学活动中,以促进学生全面发展为目标;
(3)坚持以人为本,必须面向全体学生。
?以人为本的学生观
“一切为了每一位学生的发展”是新课程的最高宗旨和核心理念。
1、学生是发展的人
2、学生是独特的人
3、学生是具有独立意义的人
?以人为本,公正对待每一个学生
教师应运用“以人为本”的学生观,在教育教学活动中公正地对待每一个学生,不因性别、民族、地域、经济状况、家庭背景和身心缺陷等歧视学生。
1.公正平等地对待每一位学生,尊重他们的人格和受教育的权利。
2.要公正合理地对学生进行教育。
3.要公正合理地对学生进行评价,努力创设一个民主、平等的班集体。
4.要公正合理地处理学生中的各类矛盾冲突。
5.要关注学生的情绪生活和情感体验。
?因材施教,促进学生个性发展的意义
1.适应素质教育的需要。
2.学生成长的最重要的内在要求。
3.有助于教师自我形象的重塑。
4.提升办学品位。
?在教育教学中,如何贯彻因材施教
1.教师要充分了解学生,以便从实际出发,有针对性地进行教学。
2.在教学中既要把主要精力放在面向全班集体教育上,又要善于兼顾个别学生,使每个学生都能得到相
应的发展。
3.针对学生的个性特点提出不同的要求。
第三节教师观
教师观即教师的教育观念,是教师对教师职业特点、责任、教师的角色以及科学履行职责所必须具备的基本素质等方面的认识。
考纲解析:
1.了解教师专业发展的要求。
2.具备终身学习的意识。
3.在教育教学过程中运用多种方式和手段促进自身专业发展。
4.理解教师职业的责任与价值,具有从事教育工作的热情与决心。
?教师劳动的特点
1.复杂性、创造性(教师劳动不是简单劳动,而是复杂的精神劳动。具有丰富而独特的创造性)
2.连续性、广延性(教师劳动时间上具有连续性,空间上具有广延性)
3.长期性、间接性(教师劳动对象是人。教师的劳动不仅周期长,而且见效慢。)
4.主体性、示范性(教师自身具备的素质影响学生。教学效果取决于教师的学识水平和教育能力等发挥。)
?教师角色的转变
1.从教师与学生的关系看,教师是学生学习的促进者
2.从教学与研究的关系看,教师是教育教学的研究者
3.从教学与课程的关系看,教师是课程的建设者和开发者
4.从学校与社区的关系来看,教师是社区型的开放教师
?教师行为的转变
5.在对待师生关系上,教师应尊重、赞赏学生
6.在对待教学关系上,教师应帮助、引导学生
7.在对待自我上,教师应注重反思
1.在对待与其他教育者的关系上,教师应加强合作
?教师专业发展的基本内涵
教师专业发展,教师在整个专业生涯中,依托专业组织、专门的培养制度和管理制度,通过持续的专业教育,习得教育教学专业技能,形成专业理想,专业道德和专业能力,从而实现专业自主的过程。
教师个体的专业发展包括
(1)专业理想的建立(2)专业知识的拓展(3)专业能力的发展(4)专业自我的形成
?教师专业发展的途径
1.职前教育
2.新教师的入职辅导
3.在职培训
4.教师专业发展学校
5.自我研修
6.同伴互动
7.家校合作
?教师促进自身专业发展的方法
1.教师必须学会学习,加强终身学习的意识和能力
2.培养和发展自己的反思能力,成为反思型教师
3.培养创新精神与强化创新能力
4.重视教师交往与合作能力的培养
5.教师要成为课程的开发者和教育教学的研究者
?终身学习
1965年,法国教育理论家保罗.朗格在联合国科教文组织巴黎召开的国际成人教育促进会议上,提出“终身教育”的概念。
?终身学习是教师职业的必然要求
1.终身学习是教师专业发展的必然要求。
2.终身学习是教师职业生涯周期特点的必然要求
3.终身学习是教师工作对象特点的必然要求
?教师终身学习的内涵
1.师德修养
2.教育科研能力的培养
3.反思能力的培养
4.现代教学手段的掌握
5.对学生和自身的研究
?教师终身学习的途径
1.在工作实践中贯彻落实终身学习
2.在反思中促进终身学习
第二章教育法律法规
第一节教师法律法规概述
?教育法的体系
教育法的六个层次:
1)宪法中的有关教育条款
2)教育基本法(《中华人民共和国教育法》)
3)教育单行法(《中华人民共和国义务教育法》、《中华人民共和国教师法》等)
4)教育行政法规(由国家最高行政机关(国务院)制定、发布)
5)地方性的教育法规(由省、自治区、直辖市的人民代表大会或其党委会等制定)
6)教育章程
?教育法的原则
1.坚持教育的社会主义方向,保证各级各类教育事业协调发展
2.坚持全面发展的教育基本方针,保障公民平等的受教育权。
3.确立不同主体的责任,维护教育的公共性原则。
?教育法的功能
1.规范功能
2.标准功能
3.预示功能
4.强制功能
?教育法律救济的措施(合法权益受到侵犯并造成损害时,获得恢复和补救的法律制度)
1.行政途径
2.司法途径
3.仲裁途径
4.调解途径
第二节有关教育法律法规解读
考纲解析
1.了解国家主要的教育法律法规,如《中华人民共和国教育法》、《中华人民共和国义务教育法》、《中华
人民共和国教师法》、《中华人民共和国未成年人保护法》、《中华人民共和国预防未成年人犯罪法》、《学生伤害事故处理办法》等。
2.了解《国家中长期教育改革和发展规划纲要(2010-2020)》的相关内容。
第二章第二节的复习内容,具体看课本
第三节教师的权利与义务
考纲解析
1.理解教师的权利和义务,熟悉国家有关教育法律法规所规范的教师教育行为,依法从教;
2.依据国家教育法律法规,分析、评价教师在教育教学实践中的实际问题。
?《宪法》赋予教师的基本权利
1.平等权
2.政治权利和自由
3.宗教信仰自由
4.人身自由
5.社会经济权利
6.文化教育权
7.监督权
?《教师法》赋予教师的职业权利(重要掌握,经常考的)
1.教育教学权
2.科学研究权
3.指导评价权
4.获得报酬待遇权
5.参与管理权
6.进修培训权
?《宪法》规定教师的基本义务
1.维护国家统一和民族团结
2.遵守宪法和法律的义务
3.维护祖国安全、荣誉和利益的义务
4.保卫祖国、抵抗侵略、依法服兵役和参加民兵组织的义务
5.其他方面的义务
?《教师法》规定教师的基本义务(重要掌握,第2、4、5点经常考)
1.遵守宪法、法律和职业道德,为人师表。
2.贯彻国家的教育方针,遵守规章制度,执行学校的教学计划,履行教师聘约,完成教育教学工作任务。
3.对学生进行宪法所确定的基本原则的教育和爱国主义,民族团结的教育。
4.关心、爱护全体学生,尊重学生人格,促进学生在品德、智力、体制等方面全面发展。
5.制止有害于学生的行为或者其他侵犯学生合法权益的行为,批评和地址有害于学生健康成长的现象。
6.不断提高思想政治觉悟和教育教学业务水平。
?规范教师教育行为,依法从教
1.故意不完成教育教学任务应承担的责任
2.教师体罚学生、侮辱学生人格应承担的责任
3.教师实施性犯罪应承担的责任
?教师在履行职责的过程中涉及的法律问题
1.侵犯教师的合法权益的行为及法律责任
1)侮辱、殴打教师
2)对教师进行打击报复
3)拖欠教师工资
2.教师的违法行为及其法律责任
1)教师的违法行为
2)执法机关及处理
3.教师在教学实践中容易发生的几种犯罪行为
?教师在教学实践中容易发生的几种犯罪行为
1.故意伤害罪
2.过失致人重伤罪
3.侮辱罪
4.强奸罪和奸淫幼女罪
5.教育设施重大安全事故罪
?具体教学实践中如何落实依法执教
1.遵守教师的职业道德,为人师表;
2.尊重和保护学生权利;
3.依照教学计划,完成教学任务;
4.保障安全健康的教学环境和教学设施
5.教育方式必须合理、合法
6.妥善处理教师与家长之间的关系
第四节学生权利的保护
考纲解析
1.了解有关学生权利保护的教育法规,保护学生的合法权利;
2.依据国家教育法律法规,分析、评价教育教学活动中学生权利保护等实际问题
?学生的权利(重要掌握)
1.人身权(生命健康权、人格尊严权、肖像权、荣誉权、隐私权、安全权)
2.财产权(财产所有权、继承权、受赠权以及知识产权中的财产权利等)
3.受教育权(受教育起点上的机会平等、受教育过程上的机会平等、受教育结果上的机会平等三个方面)
4.学生作为受教育者的权利
第三章教师职业道德规范
第一节教师职业道德
考纲解析
1.了解《中小学教师职业道德规范》(2008年修订),掌握过教师职业道德规范的主要内容,尊重法律及
社会接受的行业准则。
2.理解《中小学班主任工作规定》的文件精神。
3.分析评价教育教学实践中教师的道德规范问题。
?教师职业道德的含义
教师职业道德,简称师德,是教师在其职业生活中,调节和处理与他人、社会集体、工作关系所应遵守的基本行为规范或行为准则,以及在此基础上所表现出来的观念意识和行为品质。
?教师职业道德的本质
1.教师职业道德是教师从事的教育教学活动必须遵守的职业伦理
2.教师职业道德体现为特定的道德规范体系
3.教师职业道德是从教育活动的特殊利益关系中引申出来的
?教师职业道德的构成
1.教师职业理想
2.教师职业责任
3.教师职业态度
4.教师职业纪律
5.教师职业技能
6.教师职业良心
7.教师职业作风
8.教师职业荣誉
9.教师的教育人格
?教师职业道德的特点
1. 境界的高层次性
2. 意识的自觉性
3. 行为的典范性
4. 影响的深远性
? 教师职业道德社会作用
1. 对教师起调节作用
2. 对学生起榜样和带动作用
3. 对社会起影响和促进作用
? 教师职业道德的基本原则
4. 忠于教育事业的原则
5. 教育民主的原则
6. 教育人道主义的原则
? 《中小学教师职业道德规范》的内容(重中之重的重点)
1. 爱国守法。 热爱祖国,热爱人民,拥护中国共产党领导,拥护社会主义。
2. 爱岗敬业。 忠于人民教育事业,志存高远,勤恳敬业,甘为人梯,乐于奉献。
3. 关爱学生。 关心爱护全体学生,尊重学生人格,平等公正对待学生。
4. 教书育人。 遵循教育规律,实施素质教育。
5. 为人师表。 坚守高尚情操,知荣明耻,严于律己,以身作则。
6. 终身学习。 崇尚科学精神,树立终身学习理念,拓宽知识视野,更新知识结构。
? 《中小学班主任工作规定》的内容
《中小学班主任工作规定》共七章二十二条 1. 总则 2. 配备与选聘 3. 职责与任务 4. 待遇与权利
5. 培养与培训
6. 考核与奖惩
7. 附则
? 《中小学班主任工作规定》对班主任工作的要求
1
、坚持育人为本、德育为先的目标导向。 2、注重公平,面向每一位学生。 3、要关心学生的全面发展。 4、建立平等互信的师生关系。 5、遵循学生的年龄特点和身心发展规律。
6、建立完善班级管理制度。
7、积极进行班集体文化建设。
8、指导和组织学生积极参加社会实践活动。 9、充分发挥纽带作用。 10、大胆创新工作方式。
第二节 教师职业行为
考纲解析
1.了解教师职业行为规范的要求;
2.理解教师职业行为规范的主要内容,在教育活动运用行为规范恰当地处理与学生、学生家长、同事以及教
育管理者的关系;
3.在教育教学活动中,依据教师职业行为规范,爱国守法、爱岗敬业、关爱学生、教书育人、为人师表。 中小学教师行为规范的基本要求
(一)教师思想行为规范
1)热爱社会主义祖国,拥挤中国共产党的领导,认真学习和宣传马列主义、毛泽东思想,热爱教育事业。
2)执行教育方针,遵循教育规律,尽职尽责,教书育人。
3)正直诚实,作风正派,为人师表,遵纪守法。
4)树立正确的人生观和价值观,发扬无私奉献精神,不做有损国格、人格的事。
5)积极参加政治学习和宣传活动,做社会主义精神文明的建设者和传播者。
(二)教师教学行为规范
1)要有端正的教学态度,严肃认真地对待教学工作中的每一项内容;
2)钻研业务,熟悉教材,认真备课;
3)精心编排练习,认真批改作业,及时纠正错误;
4)按时上课下课,不迟到、不缺课、不拖堂;
5)上课语言文明、清晰流畅,表达准确简洁;板书整洁规范,内容简练精确;
6)既要严格要求学生,又要尊重学生,对待学生要一视同仁;
7)教学计划应符合教学进度的要求,不能随意删增内容、加堂或缺课。
(三)教师人际行为规范
1)教师与学生之间要做到:热爱学生,关心学生,尊重学生;严格要求,耐心教导,循循善诱,不偏不
袒;不以师生关系谋取私利;
2)教师之间要做到:互相尊重,切记嫉妒;相互学习,取长补乱短;平等相待,不卑不亢;乐于助人,
关心同事;
3)教师与领导之前要做到:尊重领导,服从安排;顾全大局,遵守纪律;互相理解,互相支持;秉公办
事,团结一致。
4)教师与家长之间要做到:尊重家长,理解家长;经常家访,互通情况;密切配合,教育学生。(四)教师的礼仪行为的基本要求
1)衣着整洁,朴实大方。服饰要符合职业特点,体现教师为人师表的好形象。
2)举止稳重大方、潇洒自然、彬彬有礼。切忌轻浮粗俗、拘谨呆板。
(五)教师语言行为规范的基本要求
1)科学规范,准确简明,富有示范性;
2)言行一致,表里如一,通俗诙谐,富有幽默感;
3)语言文明,礼貌待人,富有层次感;
4)准确生动,严谨纯洁,富有启发性和激励性;
5)声音洪亮清晰,抑扬顿挫,富有节奏感;
6)文雅流畅,讲究忒想,使用普通话,富有条理性。
教师行为规范主要内容的解读
(一)教师的思想行为
1)良好的思想政治素养2)热爱教育事业3)为人师表、遵纪守
(二)教师的教学行为
1)精心上好每一堂课
(1)上课前悉心准备;(2)课上尽心讲授;(3)课后倾心交流
2)构建合理的知识结构
(1)获取广博文化知识;(2)具有扎实专业知识;(3)掌握教育科技知识;(4)不断优化知识结构3)努力开展教育科学研究
(1)分析自我,了解学生;(2)加强学习,处处留意;(3)关注过程,时时反思
(三)教师的人际行为
1)教师与学生的关系2)教师与家长的关系3)教师与同事及领导的关系(四)教师的礼仪
1)个人礼仪2)学校礼仪3)公共礼仪
第四章文化素养
考纲解析
1.了解中外历史上的重大事件。
2.了解中外科技发展史上的代表人物及其主要成就。
3.了解一定的科学常识,熟悉常见的科普读物,具有一定的科学素养。
4.了解重要的中国传统文化知识。
5.了解中外文学史上重要的作家作品。、
6.了解一定的艺术鉴赏知识。
7.了解艺术鉴赏的一般规律,并能有效地运用于教育教学活动。
一、中国历史重大事件
一)古代(约170万年前-1840年)
1.约公元前2070年,禹建立了我国历史上第一个奴隶制国家——夏。
2.战国时期,七个实力最强的的诸侯国是齐、楚、燕、韩、赵、魏、秦,被称为“战国七雄”。
3.秦王嬴政灭六国,定都咸阳,秦灭六国的顺序为:韩、赵、魏、楚、燕、齐。
4.三省六部制,隋朝时正式建立,在唐朝得到进一步完善,六部包括吏部(吏政)、户部(财政)、礼
部(学政)、兵部(军政)、刑部(法律刑狱)、工部(营造工程)。
高中化学基础知识整理 Ⅰ、基本概念与基础理论: 一、阿伏加德罗定律 1.内容:在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。2.推论 (1)同温同压下,V1/V2=n1/n2 同温同压下,M1/M2=ρ1/ρ2 注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT有助于理解上述推论。 3、阿伏加德罗常这类题的解法: ①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。 ②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。 ③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。 二、离子共存 1.由于发生复分解反应,离子不能大量共存。 (1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。 (2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。 (3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、 CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。 (4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。 2.由于发生氧化还原反应,离子不能大量共存。 (1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。 (2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。 3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。 例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。 4.溶液中能发生络合反应的离子不能大量共存。
重点高中化学选修五知识点全汇总
————————————————————————————————作者:————————————————————————————————日期:
备战高中:梳理选修五知识点 结构相似,在分子组成上相差一个或若干个CH2原子团的物质物质。 同系物的判断要点: 1、通式相同,但通式相同不一定是同系物。 2、组成元素种类必须相同 3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。结构相似不一定完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链仍为同系物。 4、在分子组成上必须相差一个或几个CH2原子团,但通式相同组成上相差一个或几个CH2原子团不一定是同系物,如CH3CH2Br和 CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2原子团,但不是同系物。(马上点标题下蓝字"高中化学"关注可获取更多学习方法、干货!) 5、同分异构体之间不是同系物。 二、同分异构体 化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。具有同分异构现象的化合物互称同分异构体。 1、同分异构体的种类:
⑴碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。 ⑵位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。 ⑶异类异构:指官能团不同而造成的异构,也叫官能团异构。如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。 ⑷其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。 各类有机物异构体情况:
高中化学重要知识点详细总结一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体 Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体 铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2(OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象: 1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的; 2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红) 3、焰色反应:Na 黄色、K紫色(透过蓝色的钴玻璃)、Cu 绿色、Ca砖红、Na+(黄色)、K+(紫色)。 4、Cu丝在Cl2中燃烧产生棕色的烟; 5、H2在Cl2中燃烧是苍白色的火焰; 6、Na在Cl2中燃烧产生大量的白烟; 7、P在Cl2中燃烧产生大量的白色烟雾; 8、SO2通入品红溶液先褪色,加热后恢复原色; 9、NH3与HCl相遇产生大量的白烟;10、铝箔在氧气中激烈燃烧产生刺眼的白光; 11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧
高中生物知识点总结(史上最全) 重点知识汇总 高中生物学了三年,你知道高中生物哪些是重点吗?为了方便广大同学们学习生物以及更好的复习,高三网小编整理的史上最全的高中生物知识点总结,一起来看看!更多内容尽请关注高三网! 2017年高考生物核心知识点汇总高考生物最易错易混淆的考点汇总高考生物的高频考点有哪些?高中生物细胞的多样性和统一性知识点总结1高中生物知识点总结:必修一1、生命系统的结构层次依次为:细胞→组织→器官→系统→个体→种群→群落→生态系统细胞是生物体结构和功能的基本单位;地球上最基本的生命系统是细胞2、光学显微镜的操作步骤:对光→低倍物镜观察→移动视野中央(偏哪移哪) →高倍物镜观察:①只能调节细准焦螺旋;②调节大光圈、凹面镜3、原核细胞与真核细胞根本区别为:有无核膜为界限的细胞核①原核细胞:无核膜,无染色体,如大肠杆菌等细菌、蓝藻②真核细胞:有核膜,有染色体,如酵母菌,各种动物注:病毒无细胞结构,但有DNA或RNA 4、蓝藻是原核生物,自养生物5、真核细胞与原核细胞统一性体现在二者均有细胞膜和细胞质6、细胞学说建立者是施莱登和施旺,细胞学说建立揭示了细胞的统一性和生物体结构的
统一性。细胞学说建立过程,是一个在科学探究中开拓、继承、修正和发展的过程,充满耐人寻味的曲折7、组成细胞(生物界)和无机自然界的化学元素种类大体相同,含量不同8、组成细胞的元素①大量无素:C、H、O、N、P、S、K、Ca、Mg ②微量无素:Fe、Mn、B、Zn、Mo、Cu ③主要元素:C、H、O、N、P、S ④基本元素:C ⑤细胞干重中,含量最多元素为C,鲜重中含最最多元素为O 9、生物(如沙漠中仙人掌)鲜重中,含量最多化合物为水,干重中含量最多的化合物为蛋白质。10、(1)还原糖(葡萄糖、果糖、麦芽糖)可与斐林试剂反应生成砖红色沉淀;脂肪可苏丹III染成橘黄色(或被苏丹IV染成红色);淀粉(多糖)遇碘变蓝色;蛋白质与双缩脲试剂产生紫色反应。(2)还原糖鉴定材料不能选用甘蔗(3)斐林试剂必须现配现用(与双缩脲试剂不同,双缩脲试剂先加A液,再加B液) 11、蛋白质的基本组成单位是氨基酸,氨基酸结构通式为NH2—C—COOH,各种氨基酸的区别在于R基的不同。12、两个氨基酸脱水缩合形成二肽,连接两个氨基酸分子的化学键(—NH—CO—)叫肽键。13、脱水缩合中,脱去水分子数=形成的肽键数=氨基酸数—肽链条数14、蛋白质多样性原因:构成蛋白质的氨基酸种类、数目、排列顺序千变万化,多肽链盘曲折叠方式千差万别。15、每种氨基酸分子至少都含
最全高一化学知识点总结5篇 高一化学很多同学的噩梦,知识点众多而且杂,对于高一的新生们很不友好,建议同学们通过总结知识点的方法来学习化学,这样可以提高学习效率。 高一化学知识点总结1 1.原子定义 原子:化学变化中的最小微粒。 (1)原子也是构成物质的一种微粒。例如少数非金属单质(金刚石、石墨等);金属单质(如铁、汞等);稀有气体等。 (2)原子也不断地运动着;原子虽很小但也有一定质量。对于原子的认识远在公元前5世纪提出了有关原子的观念。但没有科学实验作依据,直到19世纪初,化学家道尔顿根据实验事实和严格的逻辑推导,在1803年提出了科学的原子论。 2.分子是保持物质化学性质的最小粒子。 (1)构成物质的每一个分子与该物质的化学性质是一致的,分子只能保持物质的化学性质,不保持物质的物理性质。因物质的物理性质,如颜色、状态等,都是宏观现象,是该物质的大量分子聚集后所表现的属性,并不是单个分子所能保持的。 (2)最小;不是绝对意义上的最小,而是;保持物质化学性质的最小;
3.分子的性质 (1)分子质量和体积都很小。 (2)分子总是在不断运动着的。温度升高,分子运动速度加快,如阳光下湿衣物干得快。 (3)分子之间有间隔。一般说来,气体的分子之间间隔距离较大,液体和固体的分子之间的距离较小。气体比液体和固体容易压缩,不同液体混合后的总体积小于二者的原体积之和,都说明分子之间有间隔。 (4)同种物质的分子性质相同,不同种物质的分子性质不同。我们都有这样的生活体验:若口渴了,可以喝水解渴,同时吃几块冰块也可以解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子构成的,同种物质的分子,性质是相同的。 4.原子的构成 质子:1个质子带1个单位正电荷原子核(+) 中子:不带电原子不带电 电子:1个电子带1个单位负电荷 5.原子与分子的异同 分子原子区别在化学反应中可再分,构成分子中的原子重新组合成新物质的分子在化学反应中不可再分,化学反应前后并没有变成其它原子相似点 (1)都是构成物质的基本粒子 (2)质量、体积都非常小,彼此间均有一定间隔,处于永恒的运
高二化学知识点归纳大全 相信大家在高一的时候已经选好文科和理科,而理科的化学是理科生最烦恼的。以下是我整理高二化学知识点归纳,希望可以帮助大家把知识点归纳好。 1、化学反应的反应热 (1)反应热的概念: 当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。用符号Q表示。 (2)反应热与吸热反应、放热反应的关系。 Q>0时,反应为吸热反应;Q<0时,反应为放热反应。 (3)反应热的测定 测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下: Q=-C(T2-T1)式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。实验室经常测定中和反应的反应热。 2、化学反应的焓变 (1)反应焓变 物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。 反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。 (2)反应焓变ΔH与反应热Q的关系。 对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热
能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。 (3)反应焓变与吸热反应,放热反应的关系: ΔH>0,反应吸收能量,为吸热反应。 ΔH<0,反应释放能量,为放热反应。 (4)反应焓变与热化学方程式: 把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+ O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1 书写热化学方程式应注意以下几点: ①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。 ②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或kJ·mol-1,且ΔH后注明反应温度。 ③热化学方程式中物质的系数加倍,ΔH的数值也相应加倍。 3、反应焓变的计算 (1)盖斯定律 对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律。 (2)利用盖斯定律进行反应焓变的计算。 常见题型是给出几个热化学方程式,合并出题目所求的热化学方程式,根据盖斯定律可知,该方程式的ΔH为上述各热化学方程式的ΔH的代数和。
高中生物知识点总结 1、生命系统的结构层次依次为:细胞→组织→器官→系统→个体→种群→群落→生态 系统 细胞是生物体结构和功能的基本单位;地球上最基本的生命系统是细胞 2、光学显微镜的操作步骤:对光→低倍物镜观察→移动视野中央(偏哪移哪) →高倍物镜观察:①只能调节细准焦螺旋;②调节大光圈、凹面镜 3、原核细胞与真核细胞根本区别为:有无核膜为界限的细胞核 ①原核细胞:无核膜,无染色体,如大肠杆菌等细菌、蓝藻 ②真核细胞:有核膜,有染色体,如酵母菌,各种动物 注:病毒无细胞结构,但有DNA或RNA 4、蓝藻是原核生物,自养生物 5、真核细胞与原核细胞统一性体现在二者均有细胞膜和细胞质 6、细胞学说建立者是施莱登和施旺,细胞学说建立揭示了细胞的统一性和生物体结构的统一性。细胞学说建立过程,是一个在科学探究中开拓、继承、修正和发展的过程,充满 耐人寻味的曲折 7、组成细胞(生物界)和无机自然界的化学元素种类大体相同,含量不同 8、组成细胞的元素 ①大量无素:C、H、O、N、P、S、K、Ca、Mg ②微量无素:Fe、Mn、B、Zn、Mo、Cu ③主要元素:C、H、O、N、P、S ④基本元素:C ⑤细胞干重中,含量最多元素为C,鲜重中含最最多元素为O 9、生物(如沙漠中仙人掌)鲜重中,含量最多化合物为水,干重中含量最多的 化合物为蛋白质。 10、(1)还原糖(葡萄糖、果糖、麦芽糖)可与斐林试剂反应生成砖红色沉淀;脂肪可苏丹III染成橘黄色(或被苏丹IV染成红色);淀粉(多糖)遇碘变蓝色;蛋白质与双 缩脲试剂产生紫色反应。 (2)还原糖鉴定材料不能选用甘蔗 (3)斐林试剂必须现配现用(与双缩脲试剂不同,双缩脲试剂先加A液,再加B液) 11、蛋白质的基本组成单位是氨基酸,氨基酸结构通式为NH2—C—COOH,各种氨基 酸的区别在于R基的不同。 12、两个氨基酸脱水缩合形成二肽,连接两个氨基酸分子的化学键(—NH—CO—)叫 肽键。 13、脱水缩合中,脱去水分子数=形成的肽键数=氨基酸数—肽链条数 14、蛋白质多样性原因:构成蛋白质的氨基酸种类、数目、排列顺序千变万化,多肽 链盘曲折叠方式千差万别。 15、每种氨基酸分子至少都含有一个氨基(—NH2)和一个羧基(—COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上,这个碳原子还连接一个氢原子和一个侧链基 因。 16、遗传信息的携带者是核酸,它在生物体的遗传变异和蛋白质合成中具有极其重要作用,核酸包括两大类:一类是脱氧核糖核酸,简称DNA;一类是核糖核酸,简称RNA,
全部高中生物知识点总结,高中生物基本知识总 结大全 全部高中生物知识点总结,高中生物基本知识总结大全下面是网分享的高中生物基本知识总结大全。 供大家参考高中生物基本知识总结大全1.诱变育种的意义提高变异的频率,创造人类需要的变异类型,从中选择、培育出优良的生物品种。 2.原核细胞与真核细胞相比最主要特点没有核膜包围的典型细胞核。 3.细胞分裂间期最主要变化DNA的复制和有关蛋白质的合成。 4.构成蛋白质的氨基酸的主要特点是a-氨基酸都至少含一个氨基和一个羧基,并且都有一氨基酸和一个羧基连在同一碳原子上。 5.核酸的主要功能一切生物的遗传物质,对生物的遗传性,变异性及蛋白质的生物合成有重要意义。 6.细胞膜的主要成分是蛋白质分子和磷脂分子。 7.选择透过性膜主要特点是水分子可自由通过,被选择吸收的小分子、离子可以通过,而其他小分子、离子、大分子却不能通过。
8.线粒体功能细胞进行有氧呼吸的主要场所。 9.叶绿体色素的功能吸收、传递和转化光能。 10.细胞核的主要功能遗传物质的储存和复制场所,是细胞遗传性和代谢活动的控制中心。 新陈代谢主要场所细胞质基质。 11.细胞有丝分裂的意义使亲代和子代保持遗传性状的稳定性。 12.ATP的功能生物体生命活动所需能量的直接来源。 13.与分泌蛋白形成有关的细胞器核糖体、内质网、高尔基体、线粒体。 14.能产生ATP的细胞器结构线粒体、叶绿体、细胞质基质结构能产生水的细胞器*结构线粒体、叶绿体、核糖体、细胞核结构能碱基互补配对的细胞器结构线粒体、叶绿体、核糖体、细胞核结构14.确切地说,光合作用产物是有机物一般是葡萄糖,也可以是氨基酸等物质和氧15.渗透作用必备的条件是一是半透膜;二是半透膜两侧要有浓度差。 16.矿质元素是指除C、H、O外,主要由根系从土壤中吸收的元素。 17.内环境稳态的生理意义机体进行正常生命活动的必要条件。 18.呼吸作用的意义是1提供生命活动所需能量;2为体内其他化合物的合成提供原料。
第一章从实验学化学-1- 化学实验基本方法 过滤一帖、二低、三靠分离固体和液体的混合体时,除去液体中不溶性固体。(漏斗、滤纸、玻璃棒、烧杯) 蒸发不断搅拌,有大量晶体时就应熄灯,余热蒸发至干,可防过热而迸溅把稀溶液浓缩或把含固态溶质的溶液干,在蒸发皿进行蒸发 蒸馏①液体体积②加热方式③温度计水银球位置④冷却的水流方向⑤防液体暴沸利用沸点不同除去液体混合物中难挥发或不挥发的杂质(蒸馏烧瓶、酒精灯、温度计、冷凝管、接液管、锥形瓶) 萃取萃取剂:原溶液中的溶剂互不相溶;②对溶质的溶解度要远大于原溶剂;③要易于挥发。利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,主要仪器:分液漏斗 分液下层的液体从下端放出,上层从上口倒出把互不相溶的两种液体分开的操作,与萃取配合使用的 过滤器上洗涤沉淀的操作向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次 配制一定物质的量浓度的溶液需用的仪器托盘天平(或量筒)、烧杯、玻璃棒、容量瓶、胶头滴管 主要步骤:⑴计算⑵称量(如是液体就用滴定管量取)⑶溶解(少量水,搅拌,注意冷却)⑷转液(容量瓶要先检漏,玻璃棒引流)⑸洗涤(洗涤液一并转移到容量瓶中)⑹振摇⑺定容⑻摇匀 容量瓶①容量瓶上注明温度和量程。②容量瓶上只有刻线而无刻度。①只能配制容量瓶中规定容积的溶液;②不能用容量瓶溶解、稀释或久贮溶液;③容量瓶不能加热,转入瓶中的溶液温度20℃左右 第一章从实验学化学-2- 化学计量在实验中的应用 1 物质的量物质的量实际上表示含有一定数目粒子的集体 2 摩尔物质的量的单位 3 标准状况 STP 0℃和1标准大气压下 4 阿伏加德罗常数NA 1mol任何物质含的微粒数目都是6.02×1023个 5 摩尔质量 M 1mol任何物质质量是在数值上相对质量相等 6 气体摩尔体积 Vm 1mol任何气体的标准状况下的体积都约为 7 阿伏加德罗定律(由PV=nRT推导出) 同温同压下同体积的任何气体有同分子数 n1 N1 V1 n2 N2 V2 8 物质的量浓度CB 1L溶液中所含溶质B的物质的量所表示的浓度 CB=nB/V nB=CB×V V=nB/CB 9 物质的质量m m=M×n n=m/M M=m/n 10 标准状况气体体积V V=n×Vm n=V/Vm Vm=V/n 11 物质的粒子数N N=NA×n n =N/NA NA=N/n 12 物质的量浓度CB与溶质的质量分数ω 1000×ρ×ω M 13 溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀) 以物质的量为中心
高三复习生物知识结构网络 第一单元生命的物质基础和结构基础 (细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1 1.2生物体中化学元素的组成特点
1.4细胞中的化合物一览表 1.5蛋白质的相关计算 设构成蛋白质的氨基酸个数m,构成蛋白质的肽链条数为n, 构成蛋白质的氨基酸的平均相对分子质量为a,蛋白质中的肽键个数为x, 蛋白质的相对分子质量为y,控制蛋白质的基因的最少碱基对数为r, 则肽键数=脱去的水分子数,为n m x- =……………………………………①蛋白质的相对分子质量x ma y18 - =…………………………………………② 或者x a r y18 3 - =…………………………………………③
1.8生物大分子的组成特点及多样性的原因 1.9生物组织中还原性糖、脂肪、蛋白质和DNA 的鉴定 1.10水 被选择的离子和小分子 其它离子、小分子和大分子
1.11细胞膜的物质交换功能 1.12线粒体和叶绿体共同点 1、具有双层膜结构 2、进行能量转换 3、含遗传物质——DNA 4、能独立地控制性状 5、决定细胞质遗传 6、内含核糖体 7、有相对独立的转录翻译系统 8、能自我分裂增殖 1.13真核生物细胞器的比较 1.14细胞有丝分裂中核内DNA 、染色体和染色单体变化规律 亲脂小分子 高浓度——→低浓度 不消耗细胞能量(A TP ) 离子、不亲脂小分子 低浓度——→高浓度 需载体蛋白运载 消耗细胞能量(ATP )
注:设间期染色体数目为2N 个,未复制时DNA 含量为2a 。 1.15理化因素对细胞周期的影响 注:+ 表示有影响 1.16细胞分裂异常(或特殊形式分裂)的类型及结果 1.17细胞分裂与分化的关系 1.18已分化细胞的特点 1.19分化后形成的不同种类细胞的特点 1.20分化与细胞全能性的关系 G 分化程度越低全能性越高,分化程度越高全能性越低 分化程度高,全能性也高 分化程度最低(尚未分化),全能性最高
化学必修1知识点 第一章从实验学化学一、常见物质的分离、提纯和鉴别 混合物的物理分离方法
i、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl和KNO3混合物。
ii、蒸馏蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体的分离,叫分馏。 操作时要注意: ①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。 ②温度计水银球的位置应与支管底口下缘位于同一水平线上。 ③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3。 ④冷凝管中冷却水从下口进,从上口出。 ⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。 常见物质除杂方法
①常见气体的检验
②几种重要阳离子的检验 (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。 (2)K+用焰色反应来检验时,它的火焰呈浅紫色(通过钴玻片)。 (3)Ba2+能使用稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。(4)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 (5)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2] (6)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。 (7)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,
目录 一、走近细胞 3 二、组成细胞的分子 4 三、协调配合——分泌蛋白合成与分泌 8 第一章遗传因子的发现 16 第二章基因和染色体的关系 18 第三章基因的本质 22 第四章基因的表达 26 第五章基因突变及其他变异 29 第6章从杂交育种到基因工程 34 第7章现代生物进化理论 35 第一部分稳态 38 第二部分神经系统的调节 40 第三部分植物激素调节 49 第四部分种群与群落 51 第五部分生态系统 53 第六部分环境问题 57
必修一 《分子与细胞》 (一)走近细胞 一、细胞的生命活动离不开细胞 1、无细胞结构的生物病毒的生命活动离不开细胞 生活方式:寄生在活细胞 病毒分类:DNA病毒、RNA病毒 遗传物质:或只是DNA,或只是RNA(一种病毒只含一种核酸) 2、单细胞生物依赖单个细胞完成各种生命活动。 3、多细胞生物依赖各种分化的细胞密切合作,完成复杂的生命活动。 二、生命系统的结构层次 细胞组织器官系统个体种群群落生态系统生物圈 (种群群落生态系统三者实例的判断,看以前练习) 除病毒以外,细胞是生物体结构和功能的基本单位,是地球上最基本的生命系统。 三、高倍显微镜的使用
1、重要结构 光学结构:镜头目镜——长,放大倍数小 物镜——长,放大倍数大 反光镜平面——调暗视野 凹面——调亮视野 机械结构:准焦螺旋——使镜筒上升或下降(有粗、细之分) 转换器——更换物镜 光圈——调节视野亮度(有大、小之分) 2、步骤:取镜安放对光放置装片使镜筒下 降使镜筒上升低倍镜下调清晰,并移动物像到视野中央转动转换器,换上高倍物镜缓缓调节细准焦螺旋,使物像清晰 注意事项: (1)调节粗准焦螺旋使镜筒下降时,侧面观察物镜与装片的距离; (2)首先用低倍镜观察,找到要放大观察的物像,将物像移到视野中央(粗准焦螺旋不动),然后换上高倍物镜; (3) 换上高倍物镜后,“不准动粗”。(4) 物像移动的方向与装片移动的方向相反。 3、高倍镜与低倍镜观察情况比较
高中生物知识点总结——97条 绪论 1.生物体具有共同的物质基础和结构基础。 2. 从结构上说,除病毒以外,生物体都是由细胞构成的。细胞是生物体的结构和功能的基本单位。 3.新陈代谢是活细胞中全部的序的化学变化总称,是生物体进行一切生命活动的基础。 4.生物体具应激性,因而能适应周围环境。 5.生物体都有生长、发育和生殖的现象。 6.生物遗传和变异的特征,使各物种既能基本上保持稳定,又能不断地进化。 7.生物体都能适应一定的环境,也能影响环境。 第一章生命的物质基础 8.组成生物体的化学元素,在无机自然界都可以找到,没有一种化学元素是生物界所特有的,这个事实说明生物界和非生物界具统一性。 9.组成生物体的化学元素,在生物体内和在无机自然界中的含量相差很大,这个事实说明生物界与非生物界还具有差异性。 10.各种生物体的一切生命活动,绝对不能离开水。 11.糖类是构成生物体的重要成分,是细胞的主要能源物质,是生物体进行生命活动的主要能源物质。 12.脂类包括脂肪、类脂和固醇等,这些物质普遍存在于生物体内。 13.蛋白质是细胞中重要的有机化合物,一切生命活动都离不开蛋白质。 14.核酸是一切生物的遗传物质,对于生物体的遗传变异和蛋白质的生物合成有极重要作用。 15.组成生物体的任何一种化合物都不能够单独地完成某一种生命活动,而只有按照一定的方式有机地组织起来,才能表现出细胞和生物体的生命现象。细胞就是这些物质最基本的结构形式。 第二章生命的基本单位——细胞 16.活细胞中的各种代谢活动,都与细胞膜的结构和功能有密切关系。细胞膜具一定的流动性这一结构特点,具选择透过性这一功能特性。 17.细胞壁对植物细胞有支持和保护作用。 18.细胞质基质是活细胞进行新陈代谢的主要场所,为新陈代谢的进行,提供所需要的物质和一定的环境条件。 19.线粒体是活细胞进行有氧呼吸的主要场所。 20.叶绿体是绿色植物叶肉细胞中进行光合作用的细胞器。 21.内质网与蛋白质、脂类和糖类的合成有关,也是蛋白质等的运输通道。 22.核糖体是细胞内合成为蛋白质的场所。 23.细胞中的高尔基体与细胞分泌物的形成有关,主要是对蛋白质进行加工和转运;植物细胞分裂时,高尔基体与细胞壁的形成有关。 24.染色质和染色体是细胞中同一种物质在不同时期的两种形态。
第一部分高中化学基本概念和基本理论一.物质的组成、性质和分类: (一)掌握基本概念 1.分子 分子是能独立存在并保持物质化学性质的一种微粒。 (1)分子同原子、离子一样是构成物质的基本微粒. (2)按组成分子的原子个数可分为: 单原子分子如:He、Ne、Ar、Kr… 双原子分子如:O2、H2、HCl、NO… 多原子分子如:H2O、P4、C6H12O6…2.原子 原子是化学变化中的最小微粒。确切地说,在化学反应中原子核不变,只有核外电子发生变化。 (1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等原子晶体)和分子的基本微粒。 (2)原子是由原子核(中子、质子)和核外电子构成的。 3.离子 离子是指带电荷的原子或原子团。 (1)离子可分为: 阳离子:Li+、Na+、H+、NH4+… 阴离子:Cl–、O2–、OH–、SO42–… (2)存在离子的物质: ①离子化合物中:NaCl、CaCl2、Na2SO4… ②电解质溶液中:盐酸、NaOH溶液… ③金属晶体中:钠、铁、钾、铜… 4.元素 元素是具有相同核电荷数(即质子数)的同—类原子的总称。 (1)元素与物质、分子、原子的区别与联系:物质是由元素组成的(宏观看);物质是由分子、原子或离子构成的(微观看)。 (2)某些元素可以形成不同的单质(性质、结构不同)—同素异形体。 (3)各种元素在地壳中的质量分数各不相同,占前五位的依次是:O、Si、Al、Fe、Ca。 5.同位素 是指同一元素不同核素之间互称同位素,即具有相同质子数,不同中子数的同一类原子互称同位素。如H有三种同位素:11H、21H、31H(氕、氘、氚)。 6.核素 核素是具有特定质量数、原子序数和核能态,而且其寿命足以被观察的一类原子。 (1)同种元素、可以有若干种不同的核素—同位素。 (2)同一种元素的各种核素尽管中子数不同,但它们的质子数和电子数相同。核外电子排布相同,因而它们的化学性质几乎是相同的。 7.原子团 原子团是指多个原子结合成的集体,在许多反应中,原子团作为一个集体参加反应。原子团有几下几种类型:根(如SO42-、OHˉ、CH3COOˉ
必修3 《稳态与环境》知识点 第一章:人体的内环境与稳态 1、体液:体内含有的大量以水为基础的物体。 细胞内液(2/3) 体液细胞外液(1/3):包括:等 2、体液之间关系: 血浆 细胞内液组织液淋巴 3、内环境:由构成的液体环境。 内环境作用:是细胞与外界环境进行物质交换的。 4、组织液、淋巴的成分和含量与血浆的相近,但又不完全相同,最主要的差别 在于,而组织液和淋巴中蛋白质含量较少 5、细胞外液的理化性质:渗透压、酸碱度、温度。 6、血浆中酸碱度:7.35---7.45 调节的试剂:缓冲溶液: NaHCO3/H2CO3 Na2HPO4/ NaH2PO4 7、人体细胞外液正常的渗透压:770kPa、正常的温度:37度 8、稳态:正常机体通过调节作用,使各个器官、系统协调活动、共同维持内 环境的相对稳定的状态。 内环境稳态指的是内环境的成分和理化性质都处于中 9、稳态的调节 : 共同调节 内环境稳态的意义:。 第二章;动物和人体生命活动的调节 1、神经调节的基本方式: 神经调节的结构基础: 反射弧:感受器→传入神经()→神经中枢→传出神经→效 应器(还包括) 神经纤维上双向传导静息时外正内负 静息电位→刺激→动作电位→电位差→局部电流 2、兴奋传导 神经元之间(突触传导)单向传导 突触小泡(递质)→突触前膜→突触间隙→突触后膜(有受体)→产生兴奋或抑制3、人体的神经中枢: 下丘脑: 脑干: 小脑:维持身体的作用 大脑:调节机体活动的中枢 脊髓:调节机体活动的低级中枢 4、大脑的高级功能:除了对外界的感知及控制机体的反射活动外, 还具有语言、学习、记忆、和思维等方面的高级功能。 语言中枢的位置和功能: 书写中枢(W区)→失写症(能听、说、读,不能写) 运动性语言中枢(S区)→运动性失语症(能听、读、写,不能说) 听性语言中枢(H区)→听觉性失语症(能说、写、读,不能听) 阅读中枢(V区)→失读症(能听、说、写,不能读) 5、激素调节:由内分泌器官(或细胞)分泌的化学物质进行调节 (1)激素调节是,体液调节还有 2的调节 6、人体正常血糖浓度;0.8—1.2g/L 低于0.8 g/L:低血糖症高于1.2 g/L;高血糖症、严重时出现糖尿病。 7、人体血糖的三个来源:食物、肝糖原的分解、非糖物质的转化 三个去处:氧化分解、合成肝糖原肌糖原、转化成脂肪蛋白质等
高考化学知识点总结大 全 内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
高中化学总复习
高考化学第一轮复习 实质:有电子转移(得失与偏移) 特征:反应前后元素的化合价有变化 还原性 化合价升高 弱氧 化性 ↑↑ 还原剂 氧化反应 氧化产物 氧化剂 还原反应 还原产物 ↓↓ 氧化性 化合价降低 弱还 原性 氧化还原反应:有元素化合价升降的化学反应是氧化还原反 应。 有电子转移(得失或偏移)的反应都是 氧化还原反应。 概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反 应中所含元素化合价降低物) 还原剂:反应中失去电子(或电子对偏离)的物质(反 应中所含元素化合价升高物) 氧化产物:还原剂被氧化所得生成物; 还原产物:氧化剂被还原所得生成物。 失电子,化合价升高,被氧化 变反应物 概念及转化 氧化→产物
双线桥: 氧化剂 + 还原剂 = 还原产物 + 氧化产物 得电子,化合价降低,被还原 电子转移表示方法 单线桥: 电子 还原剂 + 氧化剂 = 还原产物 + 氧化产物 二者的主 表示意义、箭号起止 要区别: 电子数目等 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数 找出价态变化,看两剂分子式,确定升降总数; 方法步骤:求最小公倍数,得出两剂系数,观察配平其它。 有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出 守恒关系式求解。 ①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周 期律) ②、由反应条件的难易比较; ③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物) ④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比 较。 元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。 配平 强弱比氧化剂、
必修2遗传与进化知识点汇编 第一章遗传因子的发现 第一节孟德尔豌豆杂交试验(一) 1.孟德尔之所以选取豌豆作为杂交试验的材料是由于: (1)豌豆是自花传粉植物,且是闭花授粉的植物; (2)豌豆花较大,易于人工操作; (3)豌豆具有易于区分的性状。 2.遗传学中常用概念及分析 (1)性状:生物所表现出来的形态特征和生理特性。 相对性状:一种生物同一种性状的不同表现类型。 区分:兔的长毛和短毛;人的卷发和直发等;兔的长毛和黄毛;牛的黄毛和羊的白 毛 性状分离:杂种后代中,同时出现显性性状和隐性性状的现象。如在DD×dd 杂交实验中,杂合F1 代自交后形成的F2 代同时出现显性性状(DD 及Dd)和隐性 性状(dd)的现象。 显性性状:在DD×dd 杂交试验中,F1 表现出来的性状;如教材中F1 代豌豆表现出 高茎,即高茎为显性。决定显性性状的为显性遗传因子(基因),用大写字 母表示。如高茎用 D 表示。 隐性性状:在DD×dd 杂交试验中,F1 未显现出来的性状;如教材中F1 代豌豆未表 现出矮茎,即矮茎为隐性。决定隐性性状的为隐性基因,用小写字母表示, 如矮茎用 d 表示。 (2)纯合子:遗传因子(基因)组成相同的个体。如DD 或dd。其特点纯合子是自交后代全为纯合子,无性状分离现象。 杂合子:遗传因子(基因)组成不同的个体。如Dd。其特点是杂合子自交后代出现性状分离现象。 (3)杂交:遗传因子组成不同的个体之间的相交方式如:DD×dd Dd×dd DD× Dd 等。 自交:遗传因子组成相同的个体之间的相交方式。如:DD×DD Dd×Dd 等 测交:F1(待测个体)与隐性纯合子杂交的方式。如:Dd×dd 正交和反交:二者 是相对而言的, 如甲(♀)×乙(♂)为正交,则甲(♂)×乙(♀)为反交; 如甲(♂)×乙(♀)为正交,则甲(♀)×乙(♂)为反交。 3.杂合子和纯合子的鉴别方法 若后代无性状分离,则待测个体为纯合子 测交法 若后代有性状分离,则待测个体为杂合子 若后代无性状分离,则待测个体为纯合子 自交法 若后代有性状分离,则待测个体为杂合子 4.常见问题解题方法 (1)如后代性状分离比为显:隐=3 :1,则双亲一定都是杂合子(Dd) 即Dd×Dd 3D_:1dd (2)若后代性状分离比为显:隐=1 :1,则双亲一定是测交类型。 即为Dd×dd 1Dd :1dd
高中化学全部知识点总结 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液 FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2 (OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象: