
标准热力学数据(298.15K)
https://www.doczj.com/doc/7213387748.html, 2005-6-7 20:58:37 来源:生命经纬
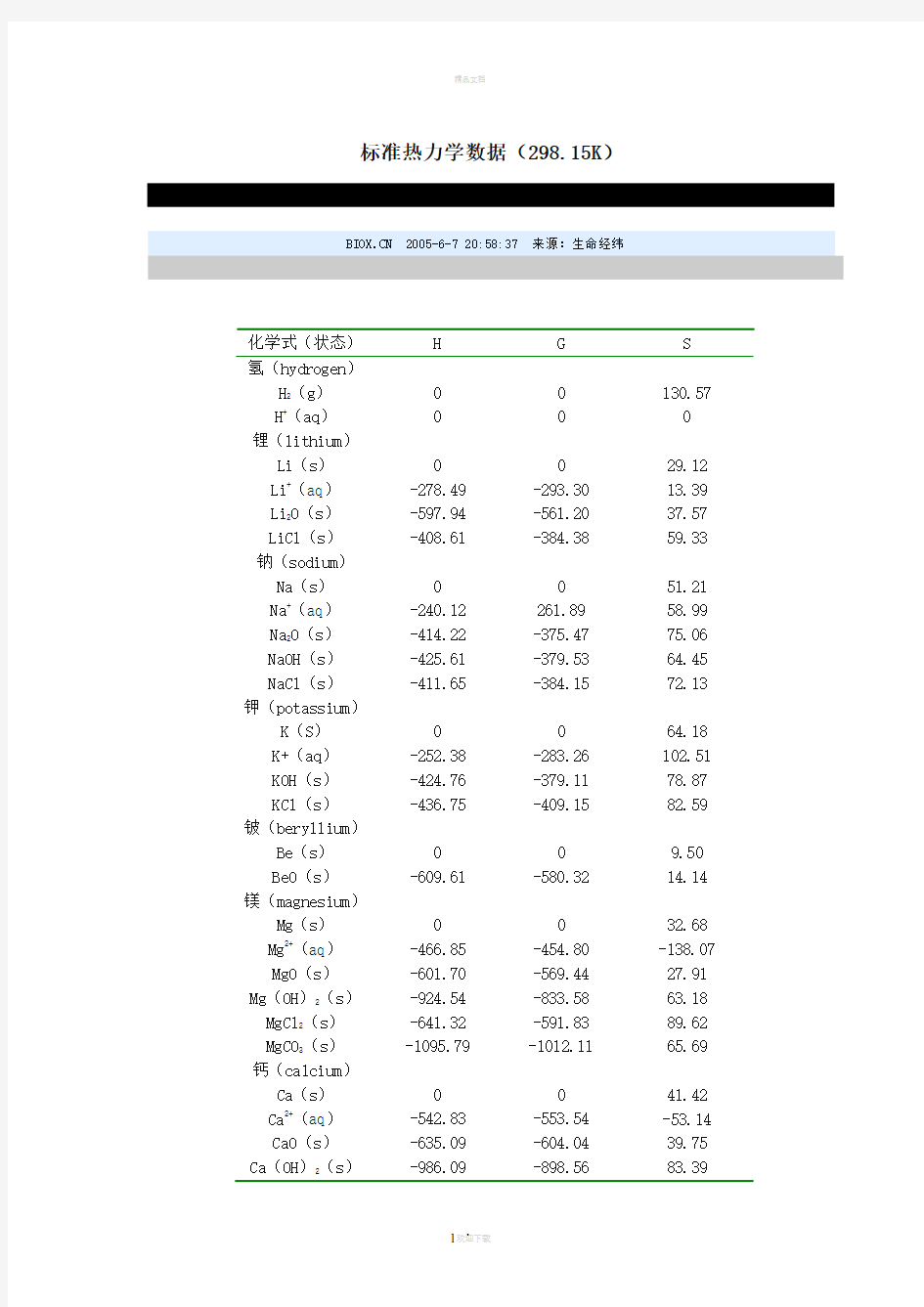
化学式(状态)H G S
氢(hydrogen)
H2(g)0 0 130.57 H+(aq)0 0 0
锂(lithium)
Li(s)0 0 29.12 Li+(aq)-278.49 -293.30 13.39 Li2O(s)-597.94 -561.20 37.57 LiCl(s)-408.61 -384.38 59.33 钠(sodium)
Na(s)0 0 51.21 Na+(aq)-240.12 261.89 58.99 Na2O(s)-414.22 -375.47 75.06 NaOH(s)-425.61 -379.53 64.45 NaCl(s)-411.65 -384.15 72.13 钾(potassium)
K(S)0 0 64.18 K+(aq)-252.38 -283.26 102.51 KOH(s)-424.76 -379.11 78.87 KCl(s)-436.75 -409.15 82.59 铍(beryllium)
Be(s)0 0 9.50 BeO(s)-609.61 -580.32 14.14 镁(magnesium)
Mg(s)0 0 32.68 Mg2+(aq)-466.85 -454.80 -138.07 MgO(s)-601.70 -569.44 27.91 Mg(OH)2(s)-924.54 -833.58 63.18 MgCl2(s)-641.32 -591.83 89.62 MgCO3(s)-1095.79 -1012.11 65.69 钙(calcium)
Ca(s)0 0 41.42 Ca2+(aq)-542.83 -553.54 -53.14 CaO(s)-635.09 -604.04 39.75 Ca(OH)2(s)-986.09 -898.56 83.39
续表
CaSO4(s)-1434.11 -1326.88 106.69
CaCO3(方解石,s)-1206.92 -1128.84 92.88
锶(strontium)
Sr(s)0 0 52.30
Sr2+(aq)-545.80 -599.44 -32.64
SrCO3(s)-1220.05 -1140.14 97.07
钡(barium)
Ba(s)0 0 62.76
Ba2+(aq)-537.64 -560.74 9.62
BaCl2(s)-858.56 -810.44 123.68
BaSO4(s)-1469.42 -1362.31 132.21
硼(boron)
B(s)0 0 5.86
H3BO3(s)-1094.33 -969.01 88.83
BF3(g)-1137.00 -1120.35 254.01
BN(s)-254.39 -228.45 14.81
铝(aluminum)
Al(s)0 0 28.33
Al(OH)3(无定形)-1276.12 - -
Al2O3(s,刚玉)-1675.69 -1582.39 50.92
碳(carbon)
C(石墨)0 0 5.74
C(金刚石) 1.897 2.900 2.377
CO(g)-110.525 -137.15 197.56
CO2(g)-393.51 -394.36 213.64
硅(silicon)
Si(s)0 0 18.83
SiO2(石英,s)-910.94 -856.67 41.84
SiCl4(g)-657.01 -617.01 330.62
SiC(s,β)-65.27 -62.76 16.61
Si3N4(s,α)-743.50 -642.66 101.25
锡(tin)
Sn(s,白)0 0 51.55
Sn(s,灰)-2.09 0.126 44.14
SnO2(s)-580.74 -519.65 52.3
铅(lead)
Pb(s)0 0 64.81
PbO(s,红)-218.99 -188.95 66.73
PbO(s,黄)-215.33 -187.90 68.70
PbS(s)-100.42 -98.74 91.21
续表
氮(nitrogen)
N2(g)0 0 191.50 NO(g)90.25 86.57 210.65 NO2(g)33.18 51.30 39.65 NO-3(aq)-207.36 -111.34 146.44 NH+4(aq)-132.51 -79.37 113.39 NH3(aq)-80.29 -26.57 111.29 NH3(g)-46.11 -16.48 192.34 磷(phosphorus)
P(s,白)0 0 41.09 P(s,红)-17.5 -12.13 22.80 P4O10(s)-2984.03 -2697.84 228.86 PH3(g) 5.44 13.39 210.12 PCl3(g)-287.02 -267.78 311.67 氧(oxygen)
O2(g)0 0 205.03 O3(g)142.67 163.18 238.82 H2O(l)-285.83 -237.18 69.91 H2O(g)-241.82 -228.59 188.72 OH-(aq)-229.99 -157.29 -10.75 H2O2(l)-187.78 -120.42 -
硫(sulfur)
S(s,斜方)0 0 31.80 S(s,单斜)0.33 - - SO2(g)-297.04 -300.19 248.11 SO3(g)-395.72 -371.08 256.65 H2S(g)-20.63 -33.56 205.69 氟(fluorine)
F2(g)0 0 202.67 HF(g)-271.12 -273.22 -173.67 F-(aq)-332.63 -278.82 -13.81 氯(chlorine)
Cl2(g)0 0 222.96 HCl(g)-92.31 -95.30 186.80 Cl-(aq)-167.16 -131.26 56.48 ClO-(aq)-107.11 -36.82 41.84 溴(bromine)
Br2(l)0 0 152.23 Br2(g)30.91 3.14 245.35 HBr(g)-36.40 -53.43 198.59 Br-(aq)-121.55 -103.97 82.42
续表
碘(iodine)
I2(s)0 0 116.14 I2(g)62.44 19.36 260.58 HI(g)26.48 1.72 206.48 I-(aq)-55.19 -51.59 111.29 钪(scandium)
Sc(s)0 0 34.64 钛(titanium)
Ti(s)0 0 30.54 TiO2(s,金红石)-939.73 -884.50 49.92 钒(vanadium)
V(s)0 0 28.91 V2O5(s)-1550.59 -1419.63 130.96 铬(chromium)
Cr(s)0 0 23.77 Cr2O3(s)-1139.72 -1058.13 81.17 CrO(aq)-881.19 -727.85 50.21 Cr2O(aq)-1490.34 -1301.22 261.92 锰(manganese)
Mn(s,α)0 0 32.01 Mn2+(aq)-220.75 -228.03 -73.64 MnO2(s)-520.03 -465.18 53.05 铁(iron)
Fe(s)0 0 27.28 Fe2+(aq)-89.12 -78.87 -137.65 Fe3+(aq)-48.53 -4.60 -315.89 Fe(OH)2(s)-569.02 -486.60 87.86 Fe(OH)3(s)-822.99 -696.64 -106.69 FeS(s,α)-95.06 -97.57 67.4 Fe2O3(s)-824.25 -742.24 87.40 Fe3O4(s)-1118.38 -1015.46 146.44 钴(cobalt)
Co(s,α)0 0 30.04 Co2+(aq)-58.16 -54.39 -112.97 镍(nickel)
Ni(s)0 0 29.87 Ni2+(aq)-53.97 -45.61 -128.87 铜(copper)
Cu(s)0 0 33.15 Cu2+(aq)64.77 65.52 -99.58 Cu(OH)2(s)-449.78 - -
续表
CuO(s)-157.32 -129.70 48.63
CuSO4(s)-771.36 -661.91 108.78 CuSO4·5H2O(s)-2279.65 -1880.06 300.41 银(silver)
Ag(s)0 0 42.55
Ag+(aq)105.58 77.12 72.68
Ag2O(s)-31.05 -11.21 121.34 Ag2S(s,α)-32.59 -40.67 144.01
AgCl(s)-127.07 -109.80 96.23
AgBr(s)100.37 -96.90 107.11
AgI(s)-61.84 -66.19 115.48 Ag(NH3)+2(aq)-111.89 -17.24 245.18 金(gold)
Au(s)0 0 47.40 [Au(CN)2]-(aq)242.25 285.77 171.54 [AuCl4]-(aq)-322.17 -235.22 266.94 锌(zinc)
Zn(s)0 0 41.63
Zn2+(aq)-153.89 -147.03 -112.13
ZnO(s)-348.28 -318.32 43.64 镉(cadmium)
Cd(s,γ)0 0 51.76
Cd2+(aq)-75.90 -77.58 -73.22
CdS(s)-161.92 -156.48 64.85 汞(mercury)
Hg(l)0 0 76.02
Hg(g)61.32 31.85 174.85 Hg2Cl2(s)-265.22 -210.78 192.46
CH4(g)-74.85 -50.6 186.27
C2H6(g)-83.68 -31.80 229.12
(l)48.99 124.35 173.26
C2H4(g)52.30 68.24 219.20
C2H2(g)226.73 209.20 200.83 CH3OH(l)-239.03 -166.82 127.24 C2H5OH(l)-277.98 -174.18 161.04 C6H5COOH(s)-385.05 -245.27 167.57 C12H22O11(s)-2225.5 -1544.6 360.2
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求
2 化学热力学基础 习题 1.已知:2Mg(s)+O 2(g )→MgO(s) ΔrHm =-1204kJ/mol 计算:(1)生成每克MgO 反应的ΔrH 。 (2)要释放1kJ 热量,必须燃烧多少克Mg ? 答案:(1)15.05kJ/g ;(2)0.04g 知识点: 难度: 提示: 题解: 2.已知: Cu 2O(s)+2 1O 2(g)→CuO(s) ΔrH m =-143.7kJ/mol CuO(s)+Cu(s)→Cu 2O(s)ΔrH m =-11.5kJ/mol 计算CuO(s)的标准摩尔生成焓。 答案:-155.2kJ/mol 知识点: 难度: 提示: 题解: 3.当2.50g 硝化甘油[C 3H 5(NO 3)3]分解生成N 2(g)、O 2(g)、CO(g)与H 2O(l)时,放出19.9kJ 的热量。 (1)写出该反应的化学方程式。 (2)计算1mol 硝化甘油分解的ΔrH 。 (3)在分解过程中生成每1mol O 2放出多少热量? 答案:(1)C 3H 5(NO 3)3→23N 2(g)+27O 2(g)+3CO(g)+2 5H 2O(l);(2)1806.9kJ/mol ;(3)516.3kJ 知识点: 难度: 提示: 题解: 4.由热力学数据表中查得下列数据: ΔfH m(NH 3,g)=-46.0kJ/mol ΔfH m(NO,g)=90.29kJ/mol ΔfH m(H 2O,g)=-241.8kJ/mol 计算氨的氧化反应:4NH3(g)+5O 2(g )4NO(g)+6H 2O(g)的热效应ΔrH m 。 答案:-905.64 kJ/mol 知识点: 难度: 提示: 题解: 5.在一敞口试管内加热氯酸钾晶体,发生下列反应:2KClO 3(s)2KCl(s)+3O 2(g)并放出89.5kJ 热量(298.15K )。
第一章 化学热力学基础 公式总结 1.体积功 We = -Pe △V 2.热力学第一定律的数学表达式 △U = Q + W 3.n mol 理想气体的定温膨胀过程 .定温可逆时: Wmax=-Wmin= 4.焓定义式 H = U + PV 在封闭体系中,W ′= 0,体系发生一定容过程 Qv = △U 在封闭体系中,W ′= 0,体系发生一定压过程 Qp = H2 – H1 = △H 5.摩尔热容 Cm ( J·K-1·mol-1 ): 定容热容 CV (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 定容过程 适用对象 : 任意的气体、液体、固体物质 ) 定压热容 Cp ?=?2 1 ,T T m p dT nC H (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 的定压过程 适用对象 : 任意的气体、液体、固体物质 ) 单原子理想气体: Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体: Cv,m = 2.5R , Cp,m = 3.5R 多原子理想气体: Cv,m = 3R , Cp,m = 4R 1 221ln ln P P nRT V V nRT =n C C m = ?=?2 1 ,T T m V dT nC U
Cp,m = Cv,m + R 6.理想气体热力学过程ΔU 、ΔH 、Q 、W 和ΔS 的总结 7.定义:△fHm θ(kJ·mol-1)-- 标准摩尔生成焓 △H —焓变; △rHm —反应的摩尔焓变 △rHm θ—298K 时反应的标准摩尔焓变; △fHm θ(B)—298K 时物质B 的标准摩尔生成焓; △cHm θ(B) —298K 时物质B 的标准摩尔燃烧焓。 8.热效应的计算 由物质的标准摩尔生成焓计算反应的标准摩尔焓变 △rH θm = ∑νB △fH θm ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变 △rH θm = -∑νB △cH θm ,B 9.Kirchhoff (基尔霍夫) 方程 △rHm (T2) = △rHm (T1) + 如果 ΔCp 为常数,则 △rHm (T2) = △rHm (T1) + △Cp ( T2 - T1) 10.热机的效率为 对于卡诺热机 12 11Q Q Q Q W R +=- =η dT C p T T ? ?2 1 1 2 1211Q Q Q Q Q Q W +=+=-=η121T T T -=
标准热力学数据(298.15K) https://www.doczj.com/doc/7213387748.html, 2005-6-7 20:58:37 来源:生命经纬 化学式(状态)H G S 氢(hydrogen) H2(g)0 0 130.57 H+(aq)0 0 0 锂(lithium) Li(s)0 0 29.12 Li+(aq)-278.49 -293.30 13.39 Li2O(s)-597.94 -561.20 37.57 LiCl(s)-408.61 -384.38 59.33 钠(sodium) Na(s)0 0 51.21 Na+(aq)-240.12 261.89 58.99 Na2O(s)-414.22 -375.47 75.06 NaOH(s)-425.61 -379.53 64.45 NaCl(s)-411.65 -384.15 72.13 钾(potassium) K(S)0 0 64.18 K+(aq)-252.38 -283.26 102.51 KOH(s)-424.76 -379.11 78.87 KCl(s)-436.75 -409.15 82.59 铍(beryllium) Be(s)0 0 9.50 BeO(s)-609.61 -580.32 14.14 镁(magnesium) Mg(s)0 0 32.68 Mg2+(aq)-466.85 -454.80 -138.07 MgO(s)-601.70 -569.44 27.91 Mg(OH)2(s)-924.54 -833.58 63.18 MgCl2(s)-641.32 -591.83 89.62 MgCO3(s)-1095.79 -1012.11 65.69 钙(calcium) Ca(s)0 0 41.42 Ca2+(aq)-542.83 -553.54 -53.14 CaO(s)-635.09 -604.04 39.75 Ca(OH)2(s)-986.09 -898.56 83.39
第四章均相敞开系统热力学及相平衡准则 1.均相混合物的热力学关系 2.偏摩尔性质 ①定义 1.已知溶液中各组分性质的数据可用表观摩尔性质表示:双元系的组分1的表观摩尔性质μ1= 定义为 式中x1是混合物的摩尔分数,M是摩尔性质,M2是纯组分2在溶液的T和P的摩尔性质。(1)试根据在T,P一定条件下,从作为x1函数的μ1导出确定摩尔性质和的方程式;(2)找出x1=0,x1=1的极限情况下的表达式。 ②的热力学关系式及计算 1. 在一定的T,P下,二元混合物的焓为。其中 ,单位均为J/mol,求(1)H1,H2;(2)。 2. 在一定的温度和常压下,二元溶液中的组分1的偏摩尔焓如服从,并已知纯组分的焓是H1,H2,求出和H表达式。 3.二元气体混合物的和,求。 4.已知苯(1)-环己烷(2)液体混合物在303K和101.3Kpa下摩尔体积是 ,试求此条件下的 (不对称归一化)。 5.解汽缸中置有1gmol理想气体,最初状态为5atm,50℃。求该气体的熵变,试假定不同途径计算之。 6.对于给定的T,p条件,假设二元系统的摩尔性质与组成的关系是
其中分别为两纯组分的摩尔性质,A是与组成无关的常数,求。 ③G-D方程(性质之间的依赖关系) 1.如果在T,P恒定时,某二元系统中组分1的偏摩尔自由焓符合,则组分2 应符合方程式,其中G1,G2是T,P下的纯组分摩尔自由焓;x1,x2是摩尔分数。 2.Kurihara等人测定了丙酮(1)-苯(2)体系在101.3kpa下的气液平衡数据如下: 丙酮和苯的饱和蒸气压可用Antoine方程来描述,已知Antoine方程常数为 试用Herrington法检验这套数据是否符合热力学一致性。 3.在定温定压下,一个简单的二元混合物中某一组分的偏摩尔焓可用下式表示
物理化学主要公式及使用条件 第一章 气体的 pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 pV (m/M )RT nRT 或 pV m p (V /n ) RT 式中p , V , T 及n 单位分别为Pa, m 3, K 及mol 。 V m V /n 称为气体的摩尔体 积,其单位为m 3?mol -1。R=8.314510 J mol -1 K 1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 ( 1) 组成 摩尔分数 式中 n A 为混合气体总的物质的 量。 V m ,A 表示在一定T , p 下纯气体A 的摩 A 尔体积。 y A V mA 为在一定T , p 下混合之前各纯组分体积的总和。 A ( 2) 摩尔质量 述各式适用于任意的气体混合物 (3) y B n B /n p B / p V B /V 式中P B 为气体B ,在混合的T , V 条件下,单独存在时所产生的压力,称为 B 的分压力。V B 为B 气体在混合气体的T , p 下,单独存在时所占的体积。 y B (或 x B ) = n B / n A A 体积分数 B y B V m,B / yAV m,A A y B M B m/n M B / n B B B B 式中 m m B 为混合气体的总质量, n B n B 为混合气体总的物质的量。上 M mix B
叮叮小文库3. 道尔顿定律 p B = y B p, p P B B 上式适用于任意气体。对于理想气体 P B n B RT/V 4. 阿马加分体积定律 V B ri B RT/V 此式只适用于理想气体。 第二章热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 U Q W 或dU 8Q SW 9Q P amb dV SW' 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中P amb为环境的压力,W为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 H U pV 3. 焓变 (1)H U (PV) 式中(pV)为pV乘积的增量,只有在恒压下(pV) P(V2v1)在数值上等于体积功。 2 (2)H 1n C p,m dT 此式适用于理想气体单纯pVT变化的一切过程,或真实气体的恒压变温过程,
第五章化学热力学基础 5-1从手册查出常用试剂浓盐酸﹑浓硫酸﹑浓硝酸﹑浓氨水的密度和质量分数,计算它们的(体积)物质的量浓度(c)和质量摩尔浓度(m)。 5-2从手册查出常温下的饱和水蒸气压,计算当相对湿度为40%时,水蒸气压多大。 5-3化学实验事中经常用蒸馏水冲洗已用自来水洗净的烧杯。设洗后烧杯内残留“水”为1ml,试计算,用30ml蒸馏水洗一次和洗两次,烧杯中残留的“自来水的浓度”分别多大? 5-4计算 15℃,97kPa下15g氯气的体积。 5-5 20 ℃,97kPa下0.842g 某气体的体积为0.400 L ,求该气体的摩尔质量。 5-6测得 2.96g 氯化汞在 407℃的 1L 容积的真空系统里完全蒸发达到的压力为60 kPa ,求氯化汞蒸汽的摩尔质量和化学式。 5-7 在1000℃和 97kPa 下测得硫蒸汽的密度为0.5977 g.L-1,求硫蒸气的摩尔质量和化学式。 5-8 在25℃时将相同压力的5.0 L 氮气和15 L 氧气压缩到一个10.0 L 的真空容器中,测得混合气体的总压为150 kPa ,(1)求两种气体的初始压力;(2)求混合气体中氮和氧的分压;(3)将温度上升到 210 ℃,容器的总压。 5-9在25 ℃, 1.47MPa 下把氨气通入容积为1.00 L 刚性壁容器中,在350℃下催化剂使部分氨分解为氮气和氢气,测得总压为 5MPa ,求氨的解离度和各组分的摩尔分数和分压。 5-10 某乙烯和足量的氢气的混合气体的总压为 6930Pa ,在铂催化剂催化下发生如下反应: C2H4(g) +H2(g) === C2H6(g) 反应结束时温度降至原温度后测得总压为4530Pa 。求原混合气体中乙烯的摩尔分数。 5-11以下哪些关系式是正确的( p、V、n 无下标时表示混合气体的总压、总体积和总的物质的量)?说明理由。 pV B = n B RT p B V = n B RT p B V B = nRT pV = nRT 5-12以下系统内各有几个相? (1)水溶性蛋白质的水溶液;(2)氢氧混合气体;(3)盐酸与铁块发生反应的系统 (4)超临界状态的水。 5-13 10g水在 373K 和100kPa 下汽化,所做的功多大?(设水蒸气为理想气体) 5-14反应CaC2(s) + 2H2O(l) ====Ca(OH)2(s) + C2H2(g)在 298K 下的标准摩尔热力学能变化量为-128 kJ.mol-1。求该反应的标准摩尔焓变。 5-15 人类登月使用的阿波罗火箭的第一级火箭使用了550 吨煤油在2.5min内与氧气发生燃烧产生巨大推力。以C12H26(l)为煤油的平均分子式的燃烧热为-7513 kJ.mol-1,试计算这个燃烧发应的功率。 5-16已知Al2O3(s) 和MnO2 的标准摩尔生成焓为-1676 kJ.mol-1和 -521 kJ.mol-1,计算1g铝与足量MnO2反应(铝热法)产生的热量。 5-17已知Cl-(aq)的标准摩尔生成焓为-167.5 kJ.mol-1,计算1 mol HCl(g) 溶于足量的水释放多少热?[注]计算得到的值为氯化氢的熔解热;HCl(g)的标准摩尔生成焓可从本书附表中查获。假设水量的多少与水合反应的程度无关(事实上是有关的,因此的数值通常设定为无限稀释。) 5-18用标准摩尔生成焓的数据计算SiF4(g) 与足量H2O(l) 反应生成 SiO2(s) 和HF(g) 的摩尔反应焓。 5-19利用本书附表与下列数据计算石灰岩[以 CaCO3 (方解石)计]被 CO2(g) 溶解发育成喀斯特地形的如下反应的标准摩尔生成焓:CaCO3(s) + CO2(g)+ H2O(l)===Ca2+ (aq) +2HCO3-(aq) △f H mθ/ kJ.mol-1: Ca2+ (aq) -543.0 HCO3-(aq) -691.1 5-20火柴头中的P4S3(s)的标准摩尔燃烧热为-3677 kJ.mol-1 [注:燃烧产物为 P4O10(s)和
5.梅耶公式: R c c v p =- R c c v p 0''ρ=- 0R MR Mc Mc v p ==- 6.比热比: v p v p v p Mc Mc c c c c ===''κ 1-= κκR c v 1 -=κnR c p 外储存能: 1. 宏观动能: 221mc E k = 2. 重力位能: mgz E p = 式中 g —重力加速度。 系统总储存能: 1.p k E E U E ++= 或mgz mc U E ++ =221 2.gz c u e ++=221 3.U E = 或u e =(没有宏观运动,并且高度为零) 热力学能变化: 1.dT c du v =,?=?2 1dT c u v 适用于理想气体一切过程或者实际气体定容过程 2.)(12T T c u v -=? 适用于理想气体一切过程或者实际气体定容过程(用定值比热计算) 3.102000121221t c t c dt c dt c dt c u t vm t vm t v t v t t v ?-?=-==???? 适用于理想气体一切过程或者实际气体定容过程(用平均比热计算)
4.把()T f c v =的经验公式代入?=?2 1dT c u v 积分。 适用于理想气体一切过程或者实际气体定容过程(用真实比热公式计算) 5.∑∑====+++=n i i i n i i n u m U U U U U 1121Λ 由理想气体组成的混合气体的热力学能等于各组成气体热力学能之和,各组成气体热力学能又可表示为单位质量热力学能与其质量的乘积。 6.?-=?21pdv q u 适用于任何工质,可逆过程。 7.q u =? 适用于任何工质,可逆定容过程 8.?=?21pdv u 适用于任何工质,可逆绝热过程。 9.0=?U 适用于闭口系统任何工质绝热、对外不作功的热力过程等热力学能或理想气体定温过程。 10.W Q U -=? 适用于mkg 质量工质,开口、闭口,任何工质,可逆、不可逆过程。 11.w q u -=? 适用于1kg 质量工质,开口、闭口,任何工质,可逆、不可逆过程 12.pdv q du -=δ 适用于微元,任何工质可逆过程 13.pv h u ?-?=? 热力学能的变化等于焓的变化与流动功的差值。 焓的变化: 1.pV U H += 适用于m 千克工质 2.pv u h += 适用于1千克工质 3.()T f RT u h =+= 适用于理想气体 4.dT c dh p =,dT c h p ?=?2 1 适用于理想气体的一切热力过程或者实际气体的定压过程
功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点
第五章 化学热力学基础 5-1从手册查出常用试剂浓盐酸﹑浓硫酸﹑浓硝酸﹑浓氨水的密度和质量分数,计算它们的(体积)物质的量浓度(c)和质量摩尔浓度(m)。 5-2从手册查出常温下的饱和水蒸气压,计算当相对湿度为40%时,水蒸气压多大。 5-3化学实验事中经常用蒸馏水冲洗已用自来水洗净的烧杯。设洗后烧杯内残留“水”为1ml,试计算,用30ml蒸馏水洗一次和洗两次,烧杯中残留的“自来水的浓度”分别多大? 5-4计算 15℃,97kPa下15g氯气的体积。 5-5 20 ℃,97kPa下0.842g 某气体的体积为0.400 L ,求该气体的摩尔质量。 5-6测得 2.96g 氯化汞在 407℃的 1L 容积的真空系统里完全蒸发达到的压力为60 kPa ,求氯化汞蒸汽的摩尔质量和化学式。 5-7 在1000℃和 97kPa 下测得硫蒸汽的密度为0.5977 g.L-1,求硫蒸气的摩尔质量和化学式。
5-8 在25℃时将相同压力的5.0 L 氮气和15 L 氧气压缩到一个10.0 L 的真空容器中,测得混合气体的总压为150 kPa ,(1)求两种气体的初始压力;(2)求混合气体中氮和氧的分压;(3)将温度上升到 210 ℃,容器的总压。 5-9在25 ℃, 1.47MPa 下把氨气通入容积为1.00 L 刚性壁容器中,在350℃下催化剂使部分氨分解为氮气和氢气,测得总压为 5MPa ,求氨的解离度和各组分的摩尔分数和分压。
5-10 某乙烯和足量的氢气的混合气体的总压为 6930Pa ,在铂催化剂催化下发生如下反应: C2H4(g) +H2(g) === C2H6(g) 反应结束时温度降至原温度后测得总压为4530Pa 。求原混合气体中乙烯的摩尔分数。
第一章气体的pVT关系 主要公式及使用条件 1. 理想气体状态方程式 pV =(m/M )RT =nRT 或pV m = p(V/n) = RT 式中p, V, T及n单位分别为Pa, m3, K及mol。V m =V /n称为气体的摩尔体 积,其单位为m3.mol-1。R=8.314510 J mol-1-K-1,称为摩尔气体常数。 此式适用丁理想气体,近似地适用丁低压的真实气体。 2. 气体混合物 (1)组成 摩尔分数y B (或X B) = n B/,n A A 体积分数 B = y B V m,B y A V "m,A 式中£ n A为混合气体总的物质的量。V*m,A表示在一定T, p下纯气体A的摩A 尔体积。z y A V%A为在一定T, p下混合之前各纯组分体积的总和。A (2)摩尔质量 M mix = Y B M B=m/n = L M B/' n B B B B 式中m=£m B为混合气体的总质量,n=£n B为混合气体总的物质的量。上述各式适用丁任意的气体混合物。 (3)y B =n B / n = P B / p = V;/V 式中p B为气体B,在混合的T, V条件下,单独存在时所产生的压力,称为 B 的分压力。V B*为B气体在混合气体的T, p下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p, p = % P B B 上式适用丁任意气体。对丁理想气体 P B =A B RT/V 4. 阿马加分体积定律 ..*
V B = n B RT / p 此式只适用丁理想气体。 第二章热力学第一定律 主要公式及使用条件 1.热力学第一定律的数学表示式 U =Q W 或 d U = a Q+a W =a Q-a 网V ' W 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中P amb为环境的压力,W'为非体积功。上式适用丁封闭体系的一切过程。 2.焰的定义式 H =U pV 3.焰变 (1) H = U (pV) 式中以P V)为P V乘积的增量,只有在包压下A(P V) = P。-V1)在数值上等丁体积功。 2 (2) H = 1 nC p,m dT 此式适用丁理想气体单纯pVT变化的一切过程,或真实气体的包压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4.热力学能(乂称内能)变 2 U = 1 nC v,m dT 此式适用丁理想气体单纯pVT变化的一切过程。 5.包容热和包压热 Qv = U ( dV = 0W =' 0 Q p = H (d p =0,W' =0) 6.热容的定义式 (1)定压热容和定容热容 C p = aQp/dT =(州 /钉)p C v =8Q V /dT =(印 /可)V (2) 摩尔定压热容和摩尔定容热容
5.梅耶公式: R c c v p =- R c c v p 0''ρ=- 0R MR Mc Mc v p ==- 6.比热比: v p v p v p Mc Mc c c c c = = = ''κ 1-= κκR c v 1 -=κnR c p 外储存能: 1. 宏观动能: 2 2 1mc E k = 2. 重力位能: mgz E p = 式中 g —重力加速度。 系统总储存能: 1.p k E E U E ++= 或mgz mc U E ++=2 21 2.gz c u e ++=22 1 3.U E = 或 u e =(没有宏观运动,并且高度为零) 热力学能变化: 1.dT c du v =,?=?2 1dT c u v 适用于理想气体一切过程或者实际气体定容过程 2.)(12T T c u v -=? 适用于理想气体一切过程或者实际气体定容过程(用定值比热计算) 3.10 20 121 2 2 1 t c t c dt c dt c dt c u t vm t vm t v t v t t v ?-?=-==???? 适用于理想气体一切过程或者实际气体定容过程(用平均比热计算)
4.把 ()T f c v =的经验公式代入?=?2 1 dT c u v 积分。 适用于理想气体一切过程或者实际气体定容过程(用真实比热公式计算) 5.∑∑====+++=n i i i n i i n u m U U U U U 1 1 21 由理想气体组成的混合气体的热力学能等于各组成气体热力学能之和,各组成气体热力学能又可表示为单位质量热力学能与其质量的乘积。 6.?-=?2 1pdv q u 适用于任何工质,可逆过程。 7.q u =? 适用于任何工质,可逆定容过程 8.?=?21 pdv u 适用于任何工质,可逆绝热过程。 9.0=?U 适用于闭口系统任何工质绝热、对外不作功的热力过程等热力学能或理想气体定温过程。 10.W Q U -=? 适用于mkg 质量工质,开口、闭口,任何工质,可逆、不可逆过程。 11.w q u -=? 适用于1kg 质量工质,开口、闭口,任何工质,可逆、不可逆过程 12.pdv q du -=δ 适用于微元,任何工质可逆过程 13.pv h u ?-?=? 热力学能的变化等于焓的变化与流动功的差值。 焓的变化: 1.pV U H += 适用于m 千克工质 2.pv u h += 适用于1千克工质 3.()T f RT u h =+= 适用于理想气体 4.dT c dh p =,dT c h p ?=?2 1 适用于理想气体的一切热力过程或者实际气体的定压过程
热力学基本状态参数 功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点 u状态参数仅决定于状态,即对应某确定的状态,就有一组状态参数。反之,一组确定的
第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相 对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统的某广延性参数值等于系统中各单元体该广延性参数值之和,如系统的容积、内能、焓、熵等。在热力过程中,广延性参数的变化起着类似力学中位移的作用,称为广义位移。 准静态过程:过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的 平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,整个过程可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。 可逆过程:当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态,这样的过程称为可逆过程。 膨胀功:由于系统容积发生变化(增大或缩小)而通过界面向外界传递的机械功称为膨胀功,也称容积功。 热量:通过热力系边界所传递的除功之外的能量。热力循环:工质从某一初态开始,经历一系列状态变化,最后又回复到初始状态的全部过程称为热力循环,简称循环。 2.常用公式 状态参数:1 2 1 2 x x dx- = ? ?=0 dx 状态参数是状态的函数,对应一定的状态,状态参数都有唯一确定的数值,工质在热力过程中发生状态变化时,由初状态经过不同路径,最后到达
热力学第二定律 一、 自发反应-不可逆性(自发反应乃是热力学的不可逆过程) 一个自发反应发生之后,不可能使系统和环境都恢复到原来的状态而不留下任何影响,也就是说自发反应是有方向性的,是不可逆的。 二、 热力学第二定律 1. 热力学的两种说法: Clausius:不可能把热从低温物体传到高温物体,而不引起其它变化 Kelvin :不可能从单一热源取出热使之完全变为功,而不发生其他的变化 2. 文字表述: 第二类永动机是不可能造成的(单一热源吸热,并将所吸收的热完全转化为功) 功 热 【功完全转化为热,热不完全转化为功】 (无条件,无痕迹,不引起环境的改变) 可逆性:系统和环境同时复原 3. 自发过程:(无需依靠消耗环境的作用就能自动进行的过程) 特征:(1)自发过程单方面趋于平衡;(2)均不可逆性;(3)对环境做功,可从自发过程获得可用功 三、 卡诺定理(在相同高温热源和低温热源之间工作的热机) ηη≤ηη (不可逆热机的效率小于可逆热机) 所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相同,且与工作物质无关 四、 熵的概念 1. 在卡诺循环中,得到热效应与温度的商值加和等于零:ηηηη+η ηηη=η 任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关 热温商具有状态函数的性质 :周而复始 数值还原 从物理学概念,对任意一个循环过程,若一个物理量的改变值的总和为0,则该物理量为状态函数 2. 热温商:热量与温度的商 3. 熵:热力学状态函数 熵的变化值可用可逆过程的热温商值来衡量 ηη :起始的商 ηη :终态的熵 ηη=(ηηη)η (数值上相等) 4. 熵的性质: (1)熵是状态函数,是体系自身的性质 是系统的状态函数,是容量性质 (2)熵是一个广度性质的函数,总的熵的变化量等于各部分熵的变化量之和 (3)只有可逆过程的热温商之和等于熵变 (4)可逆过程热温商不是熵,只是过程中熵函数变化值的度量 (5)可用克劳修斯不等式来判别过程的可逆性 (6)在绝热过程中,若过程是可逆的,则系统的熵不变 (7)在任何一个隔离系统中,若进行了不可逆过程,系统的熵就要增大,所以在隔离系统中,一切能自动进行的过程都引起熵的增大。若系统已处于平衡状态,则其中的任何过程一定是可逆的。 五、克劳修斯不等式与熵增加原理 不可逆过程中,熵的变化量大于热温商 ηηη→η?(∑ηηηηηηη)η>0 1. 某一过程发生后,体系的热温商小于过程的熵变,过程有可能进行不可逆过程 2. 某一过程发生后,热温商等于熵变,则该过程是可逆过程
《实用无机物热力学数据手册》 使用说明 1 关于化学反应吸热(或放热)量的计算 1.1计算公式 根据《手册》P.21式(70):
()()298G G G G G G T T 298T 298H H H -H H -H ?????=?+-????∑∑iiii生成物反物 nn (1.1) 式中: T G H ?——应理解为实际状态(101.325kPa ,T K )下的定压化学反应热P,T Q 。在反应前后温度T 相同时,(因压力均为101.325kPa )故也可理解为定压化学反应热效应。 化学反应热效应与反应热的区别仅仅在于:热效应是状态量(反应前后的温度、压力必须相同),而反应热是过程量(反应前后的温度、压力不一定相同)。 298 G H ?——为热化学标准状态(101.325kPa ,298K )下,生成物与反应物的标准生成焓298G H 之差。按下式计算: ()()298G G G 298298H H H ?????=-????∑∑iiii生成物反物 nn (1.2) ( )G G T 298H -H ????∑i i生成物 n——化学反应的每个生成物,从反应温度T K 降温到298K 的焓变(放热量)之和。 ( )G G T 298H -H ????∑i i反物 n——化学反应的每个反应物,从298K 升温到反应温度T K 的焓变(吸热量)之和。 ()G 298H ???? ∑i i 生成物 n——化学反应的每个生成物,从反应温度T K 降温到298K 的焓变 (放热量)之和。 ()G 298H ???? ∑i i 反物 n——化学反应的每个反应物,从298K 升温到反应温度T K 的焓变 (吸热量)之和。 ()G G T 298H -H i——单个生成物从反应温度T K 降温到298K 的焓变,或单个反应物从 298K 升温到反应温度T K 的焓变。 in——单个生成物(或单个反应物)的化学计量系数,即:化学反应方程式中,该物质的分子式前面的系数(也就是参与反应的该物质的摩尔数)。 1.2 吸热反应或放热反应的判定 根据式(1.1):当0G T H ?>时,表示系统能量增加,为吸热反应;当0G T H ?<时,表示系统能量减少,为放热反应。 1.3 对计算公式的分析 对于式(1.1):反应热G T H ?主要体现在298G H ?之中,即298G H ?为主要部分;而()()G G G G T 298T 298H -H H -H ????-????∑∑iiii生成物反物nn相当于是对298G H ?进行温度修正,为次要部分。
化学热力学基础习题 硫(一氧化碳,克)= 197.9焦耳摩尔-1克-1,硫(H2,克)= 130.6焦耳摩尔-1克-1 .(1)计算298K下反应的标准平衡常数k;(2)计算 标准配置中反应自发向右进行的最低温度。 15当298K已知时,反应为:C(石墨)+2S(对角线)→CS2(l),△fH(S,对角线)= 0kj mol,△fH(CS2,l) =-87.9kj mol-1,S(C,石墨)= 5.7j mol-1 k-1,S(S,对角线)= 31.9j mol-1 k-1,S(CS2,l) = 151.0j mol-1 k-1。尝试计算298K时△fG(CS2,l)和反应自发发生的最低温度。 16当298K已知时,反应为:(1)fe2o 3+3C→2Fe+3co 2(g)。 22 (2)Fe2O3(s)+3H 2(g)→2Fe(s)+3H2O(g),(Fe2O 3,s)=-824.2 kJ·mol-1,△fH (二氧化碳,克)=-393.5千焦摩尔-1,△千焦 (H2O, △fH G) =-241.8 kj mol-1,S(Fe2O3,s) = 87.4 j mol-1 k-1,S(C,石墨)= 5.7 j mol-1 k-1,S(Fe,s) = 27.3 j mol-1 k-1,S(CO2,g) = 213.7 j mol-1 k-1,S(H2,g) = 130.6 j mol-1 k-1,S(H2O,g) = 188.7 j mol-1 17当298K已知时,反应为:碳酸镁→氧化镁+二氧化碳(g),△ FH(碳酸镁,s)=-1110.0 kj·mol-1,△fHS (MgO,s)=-601.7kJ mol-1,△fH (CO2,g)=-393.5千焦摩尔-1,(氧化镁,s)= 26.9千焦摩尔-1千焦-1,
物理化学主要公式及使用条件 第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 /y B m,B B * =V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩 尔体积。∑*A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上 述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * ===
式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 W Q U +=? 或 'amb δδδd δdU Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ’为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 pV U H +=
Thermo-Calc 概述:(原产地:瑞典)热力学计算软件的开拓者,软件开发历史比较悠久,因此软件功能比较完善和强大,所涉及的领域比较广泛,包括冶金、金属合金、陶瓷、熔岩、硬质合金、粉末冶金、无几物等等,产品主要包括TCC、TCW、DICTRA、二次开发工具和数据库。 软件功能:1、热力学——相图、热力学性能、凝固模拟、液相面、热液作用、变质、岩石形成、沉淀、风化过程的演变、腐蚀、循环、重熔、烧结、煅烧、燃烧中的物质形成、CVD 图、薄膜的形成、CVM 计算,化学有序- 无序等等。2、动力学(DICTRA)——扩散模拟,如合金均匀化、渗碳、脱碳、渗氮、奥氏体/铁素体相变、珠光体长大、微观偏析、硬质合金的烧结等等。 数据库:TC的数据库比较多,甚至可以说杂来形容,呵呵,TC自己做的最好的数据库应该是Fe,当然现在也有像Ni等等的自己开发的数据库,但是大部分数据库都是利用第三方的,如有色金属(Al、Mg、Ti等)是英国ThermoTech的。当然TC的同盟战线非常广,所以相应可用的数据库也就非常多,包括众多无几物数据库、陶瓷数据库、硬质合金数据库、核材料数据库等等。 优势:软件功能强大、用户群较大方便交流、软件扩展性能好、灵活性强、适用范围广。 缺点:操作界面不是很友好,很难上手,动力学(扩散)数据目前不是很全,计算引擎技术滞后(主要表现在初始值方面)。 适用范围:适合于科学研究,尤其是理论研究,从行上来讲非常适合黑色金属行业,当然陶瓷、化工等行业也是首选(因为其他没有软件有这方面的数据库和功能)。 Pandat 概述:(原产地:美国,全是中国人开发,呵呵)热力学计算软件的后起者,或者说新秀吧,呵呵!主要是抓住竞争对手界面不友好和需要计算初值的弱点发展起来的,目前主要是在金属材料也就是合金行业中发展,产品包括Pandat、PanEngine和数据库。 软件功能:相图计算、热力学性能、凝固模拟、液相投影面、相图优化以及动力学二次开发(注意二次开发要在C++环境中进行)等。 数据库:Pandat的数据库主要的优势还在于有色金属方面,尤其是Mg和Al的数据应该是全球最优秀的,除此之外还有自己开发的Ti、Fe、Ni、Zr等,以及日本的Cu和Solder数据库。 优势:界面非常友好,容易上手不要很多的计算机知识,计算引擎先进(其实就是算法比较好),可二次开发。 缺点:功能不是很完善,适用面比较窄(暂时只能用于金属行业) 适用范围:适合于科学研究,工程应用,但目前只推荐用于金属行业。