实验七ds区金属(铜、银、锌、镉、汞)
一.
二. 目的要求
了解铜锌铬汞氧化物氢氧化物的酸碱性。
硫化物的溶解性
了解Cu(Ⅰ)Cu(Ⅱ)重要化合物的性质及相互转化条件。
试验并熟悉铜银锌铬汞的配位能力及Hg(Ⅰ)和Hg(Ⅱ)的转化
三.
四. 实验原理
五.
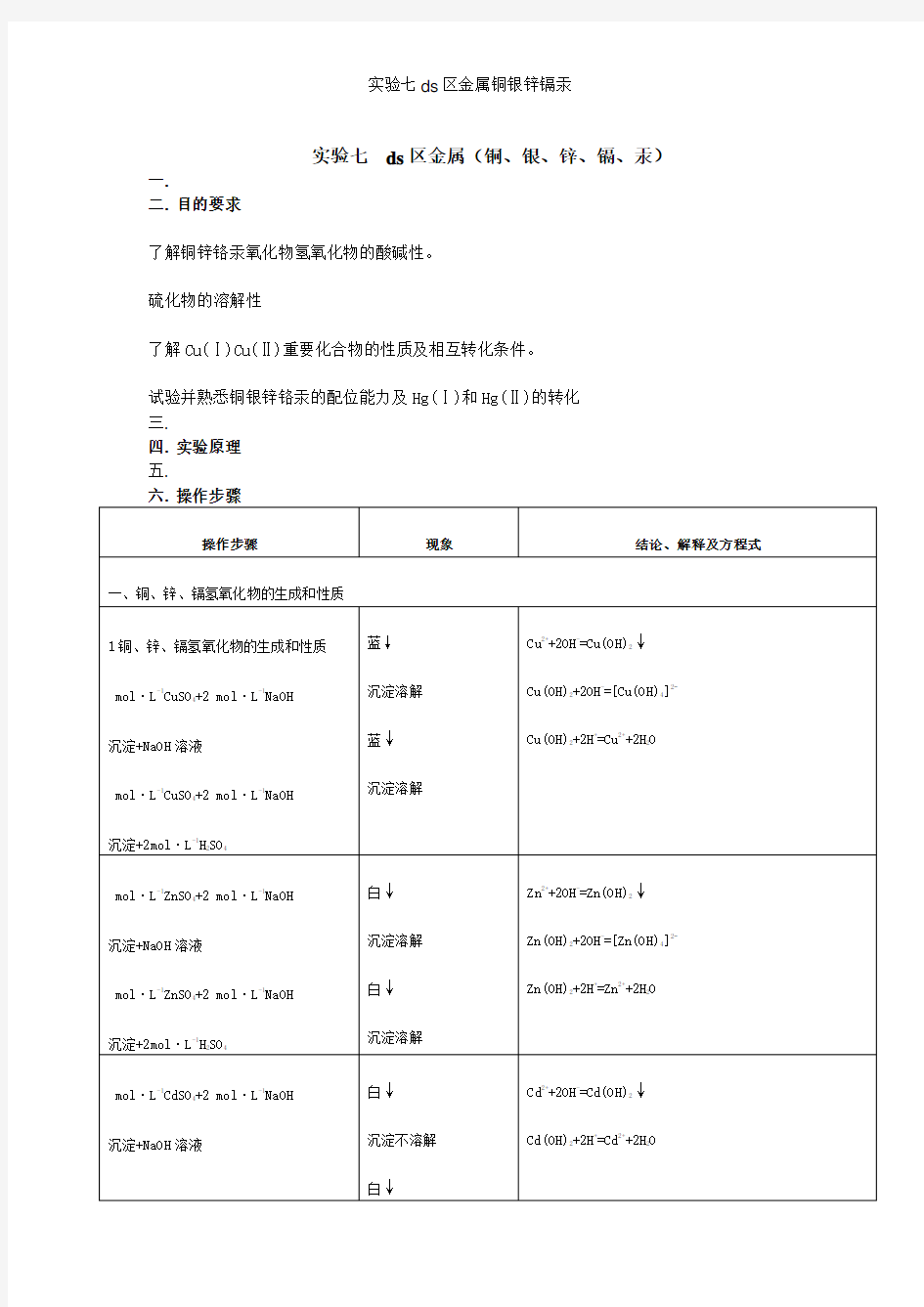
六. 操作步骤
七. 思考题
铜、银、锌、镉、汞 实验目的 1.试验并了解ds 区元素的氢氧化物(或氧化物)的酸碱性及对热稳定性 2.了解铜、银、锌、镉、汞的金属离子形成配合物的特征 3.了解Cu(Ⅱ)与Cu(Ⅰ),Hg(Ⅱ)与Hg(Ⅰ)的相互转化条件 4.了解铜、银、锌、镉、汞的离子鉴定 实验提要 ds区元素包括铜、银、锌、镉和汞。它们的价电子层结构分别为(n-1)d10ns1和(n-1)d10ns2。在化合物中常见的氧化值。铜为+2 和+1,银为+1,锌和镉为+2,汞为+2 和+1。这些元素的简单阳离子具有或接近18e的构型。在化合物中与某些阳离子有较强的相互极化作用,成键的共价成分较大。多数化合物较难溶于水,对热稳定性较差,易形成配位化合物,化合物常显不同的颜色。 例如,这些元素的氢氧化物均较难溶于水,且易脱水变成氧化物。银和汞的氢氧化物极不稳定。常温下即失水变成Ag2O(棕黑色)和HgO(黄色)。黄色HgO加热则生成桔红色HgO变体。 Cu(OH)2、Zn(OH)2和Cd(OH)2在常温下较稳定,但受热亦会失水成氧化物。浅蓝色Cu(OH)2在80℃失水成棕黑色CuO,白色Zn(OH)2在125℃开始失水成黄色(冷后为白色)的ZnO,白色Cd(OH)2在250℃变成棕红色的CdO。 Zn(OH)2呈典型的两性氢氧化物,Cu(OH)2呈较弱的两性(偏碱),Cd(OH) 2和Hg(OH)2(HgO)呈碱性,而AgOH为强碱性。Cu2+、Ag+、Zn2+、Cd2+、Hg2+与Na2S溶液反应都生成难溶的硫化物,即CuS(黑色),Ag2S(黑色),ZnS(白色),CdS (黄色)和HgS(黑色)。其中HgS可溶于过量的Na2S,与S2?生成无色的HgS22?配离子。若在此溶液中加入盐酸又生成黑色HgS沉淀。此反应可作为分离HgS的方法。根据ZnS、CdS、Ag2S、CuS和HgS溶度积大小,ZnS可溶于稀酸,CdS溶于6mol?L?1HCl 溶液,Ag S和2 CuS溶于氧化性的HNO3,而HgS溶于王水。 ds区元素阳离子都有较强的接受配体的能力,易与H2O、NH3、X?、CN?、SCN?和en等形成配离子。例如Cu(en)22+、Ag(SCN)2?、Zn(H2O)42+、Cd(NH3)42+和HgCl42?等。Hg2+与I?反应先生成桔红色HgI2沉淀,加入过量的I?则生成无色的HgI42?配离子,它和KOH的混合溶液称为奈斯勒试剂,该试剂能有效地检验铵盐的存在。Cu2+、Ag+、Zn2+、
实验11 ds区元素(铜、银、锌、镉、汞)的性质 一、实验目的 1、掌握铜、锌氢氧化物的酸碱性; 2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。 二、实验原理 IB IIB Cu Zn Cu(+2,+1)Zn(+2) Ag Cd Ag(+1)Cd(+2) Au Hg Au(+1,+3)Hg(+2,+1) 蓝色的Cu(OH) 2 呈现两性,在加热时易脱水而分解为黑色的CuO。AgOH在常温下极易脱水而转化为棕 色的Ag 2O。Zn(OH) 2 呈两性,Cd(OH) 2 显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色 的Hg 2 O(I)。 易形成配合物是这两副族的特性,Cu 2+ 、Ag + 、Zn 2+ 、Cd 2+ 与过量的氨水反应时分别生成[Cu(NH 3 ) 4 ] 2+ 、 [Ag(NH 3) 2 ] + 、[Zn(NH 3 ) 4 ] 2+ 、[Cd(NH 3 ) 4 ] 2+ 。但是Hg 2+ 和Hg 2 2+ 与过量氨水反应时,如果没有大量的NH 4 + 存在, 并不生成氨配离子。如: HgCl 2 +2NH 3 =Hg(NH 2 )Cl↓白+2 NH 4 Cl Hg 2Cl 2 +2NH 3 =Hg(NH 2 )Cl↓白+Hg↓黑+NH 4 Cl (观察为灰色) Cu 2+ 具有氧化性,与I-反应,产物不是CuI 2 ,而是白色的CuI:Cu 2+ +I- =2CuI↓白+I 2 将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2 ]-的溶液。将溶液稀释,得白色CuCl 沉淀: Cu +Cu 2+ +4Cl-=2[CuCl 2 ]- [CuCl 2 ]-←稀释→CuCl↓白+Cl- 卤化银难溶于水,但可利用形成配合物而使之溶解。例如: AgCl +2NH 3 =[Ag(NH 3 ) 2 ] + +Cl- 红色HgI 2 难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子: HgI 2 +2I- =[HgI 4 ] 2- 黄绿色Hg 2I 2 与过量KI反应时,发生歧化反应,生成[HgI 4 ] 2- 和Hg: Hg 2I 2 +2I- =[HgI 4 ] 2- +Hg↓黑 三、实验内容 1、氧化物的生成和性质
火焰原子吸收分光光度法测定环境水中的铜锌铅镉等有害元素 [摘要]本文采用火焰原子吸收分光光度法直接测定水样的铜、锌、铅、镉等有害元素的含量,其结果符合要求,易于操作,值得推广。 [关键字]原子吸收分光光度法铜锌铅镉水 0 前言 铜、锌、铅、镉等重金属元素会危害人体健康及生态环境。人的肌体如果受到有害金属的侵入就会让一些酶丧失活性而出现不同程度的中毒症状,不同的金属种类、浓度产生的毒性不一样。 铜是人体必须的微量元素,缺少铜元素就会发生贫血等情况,但过量掺入也会危害人体。铜对水生生物影响甚大,电镀、五金加工、工业废水等都是铜的主要污染源;适量的锌有益于人体,但影响鱼类及其他水生生物。另一方面,锌会抑制水的自净过程。冶金、颜料、工业废水是锌的主要污染来源;铅对人体及动物都是有毒的,其存在于人体有可能会使人出现贫血、神经机能失调等症状。蓄电池、五金、电镀工业废水等都是铅的主要污染源;镉的毒性也非常强,积累在人的肝肾里面会损害肾脏等内脏器官,引发骨质疏松。电镀、采矿、电池等是镉的主要污染源。 所以为了防止环境污染采取行之有效的分析方法检测铜、锌、铅、镉等重金属元素的含量具体特殊意义。 一般时候,江、河、水库及地下水仅含有非常少的铜、锌、铅、镉等金属元素,对于测定水样采用火焰原子吸收分光光度法进行检测很难检验出来,一般要采用富集的方法如用鳌合萃取或离子交换等方法才进行检测,但是这些方法比较复杂,容易受到干扰、测算量也比较大,测算效果达不到预期。将水样进行10倍的富集浓缩,采用火焰原子吸收分光光度法可以对测样里面的铜、铅、锌、镉等微量元素进行直接测定,这种方法容易操作、精密度及准确度也比较理想,环境监测实验室常常用这种方法监测江、河、水库及地下水的铜、锌、铅、镉等金属元素。 1 实验 1.1 关键仪器及试剂介绍 (1)采用GGX—600型的原子吸收仪,由北京科创海光光学仪器厂生产;(2)采用:北京瑞利普光电器件厂生产的铜、铅、锌、镉空心阴极灯;(3)准备浓度为每升1000毫克的铜、铅、锌、镉标准混合储备液。采用1000 mL容量瓶装入优级硝酸进行加热溶解光谱纯1.0000 g的铜、铅、锌、镉,均匀摇晃;(4)采用千分之二的的优级硝酸溶液稀释铜、铅、锌、镉标准混合储备液制成浓度为
1 适用范围 本标准规定了测定水中铜、锌、铅、镉得火焰原子吸收分光光度法。 本标准分为两部分。第一部分为直接法,适用于测定地下水、地面水与废水中得铜、锌、铅、镉;第二部分为螯合萃取法,适用于测定地下水与清洁地面水中低浓度得铜铅、镉。 2定义 2、1溶解得金属,未酸化得样品中能通过0、45um滤膜得金属成分。 2、2金属总量:未经过滤得样品经强烈消解后测得得金属浓度,或样品中溶解与悬浮得两部分金属浓度得总量。 3试剂与材料 除非另有说明,分析时均使用符合国家标准得分析纯试剂;实验用水,GB/T 6682,二级。 3、1硝酸:ρ(HNO3)=1、42 g/mL,优级纯。 3、3 硝酸:ρ(HNO3)=1、42 g/mL,分析纯。。 )=1、67 g/mL,优级纯。 3、3 高氯酸:ρ(HClO 4 3、4燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99、6%。 3、5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中得水、油与其她杂质。 3、6硝酸溶液:1+1。 用硝酸(3、2)配制。 3、7 硝酸溶液:1+499。 用硝酸(3、1)配制。 3、8 金属储备液:1、000g/L。 称取1、000g光谱纯金属,准确到0、001g,用硝酸(3、1)溶解,必要时加热,直至溶解完全,然后用水稀释定容至1000mL。 3、9中间标准溶液。 用硝酸溶液3、7稀释金属贮备液3、8配制,此溶液中铜、锌、铅、镉得浓度分别为50、00、10、00、100、00、10、00mg/L。
4 采样与样品 4、1用聚乙烯塑料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液3、6中浸泡,使用前用水冲洗干净。分析金属总量得样品,采集后立即加硝酸3、1酸化至PH=1~2,正常情况下,每1000mL样品加2ml硝酸3、1。 4、2试样得制备 分析溶解得金属时,样品采集后立即通过0、45um滤膜过滤,得到得滤液再按4、1中得要求酸化。 5适用范围 5、1测定浓度范围与仪器得特性有关。 5、2 地下水与地面水中得共存栗子与化合物在常见浓度下不干扰测定。但当钙得浓度高于1000 mg/L时,抑制镉得吸收,浓度为2000mg/L时,信号抑制达19%。铁得含量超过100mg/L时,抑制锌得吸收。当样品中含盐量很高,特征谱线波长又低于350nm时,可能出现非特征吸收。如高浓度得钙因产生背景吸收,使铅得测定结果偏高。 5原理 将样品或消解处理过得样品直接吸入火焰,在火焰中形成得原子对特征电磁辐射产生吸收,将测得得样品吸光度与标准溶液得吸光度进行比较,确定样品中被测元素得浓度。 6仪器 一般实验室仪器与:原子吸收分光光度计及相应得辅助设备,配有乙炔-空气燃烧器;光源选用空心阴极灯或无极放电灯。仪器操作参数可参照厂家得说明进行选择。 注:实验用得玻璃或塑料器皿用洗涤剂洗净后,在硝酸溶液3、6中浸泡,使用前用水冲洗干净。 7步骤 7、1 校准 7.1.1 参照下表1,在100mL容量瓶中,用硝酸溶液3、7稀释中间标准溶液3、9,配制至少4个工作标准溶液,其浓度范围应包括样品中被测元素得浓度。 表1
ds区元素(铜、银、锌、镉、汞) 一、实验目的与要求: 1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。 2. 掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。 3. 熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。 二、教学重点与难点: 了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性,熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化;掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件, 三、教学方法与手段:讲授法;演示法 四、教学课时: 4课时 五、课的类型:实验课 一、铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质 1、铜、锌、镉氧化物的生成和性质 向三支试管分别盛有0.5ml 0.2mol.L-1CuSO4、ZnSO4、CdSO4溶液的试管中滴加新配制的2mol.L-1NaOH溶液,观察溶液颜色及状态。将沉淀分成两份, 一份加硫酸另一份加NaOH溶液,观察现象。 Cu2++2OH-===Cu(OH)2↓ (蓝色沉淀) 蓝色沉淀,溶解于酸,微溶于过量的碱,得到深蓝色溶液[Cu(OH)4]2-。Cu(OH) 2两性偏碱,所以需强碱使之生成配离子。 Zn2++2OH-=== Zn(OH)2↓ (白色沉淀) 白色沉淀, 溶解于酸和过量的碱,典型的两性化物。 Cd 2++2OH-===Cd(OH)2↓白色沉淀,溶于酸, 不溶于碱。 碱性) Cd(OH)2 + NaOH (6M)= 不反应 (Cd(OH) 2 2. 银、汞氧化物的生成和性质 (1)、氧化银的生成和性质
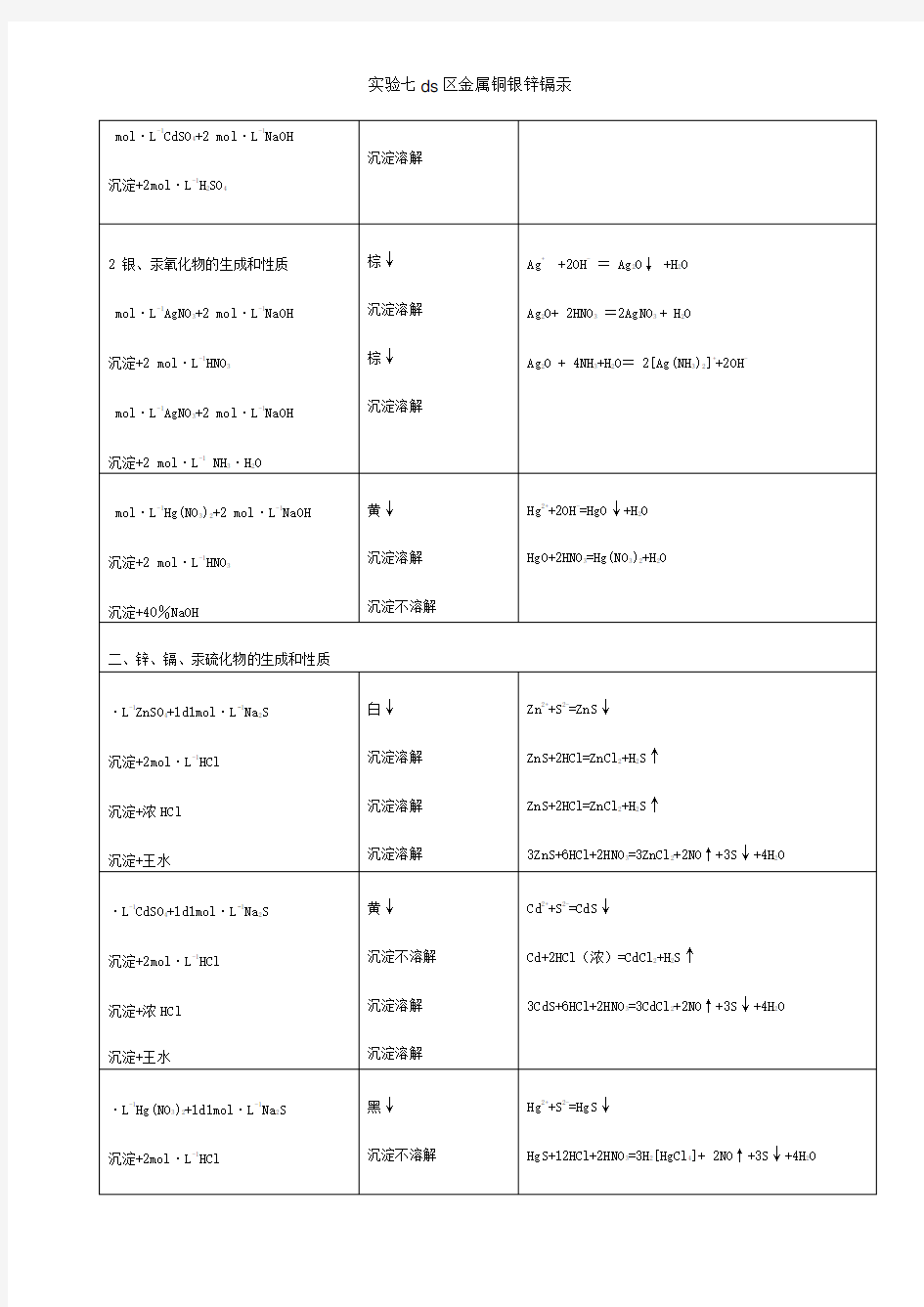
取0.5ml 0.1mol.L-1AgNO3溶液,滴加新配制的2mol.L-1的NaOH溶液,观察沉淀的颜色和状态。洗涤并离心,将沉淀分成两份,一份加入HNO3,另一份加入氨水,观察现象。 Ag++OH-===AgOH↓白色沉淀 2AgOH===Ag2O+H2O 黑色沉淀 Ag2O+2HNO3===2AgNO3+H2O Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O 氢氧化银不稳定,很容易被氧化成黑色的Ag2O,此黑色沉淀溶于硝酸得到银离 子,加入氨水得到银氨络合溶液。Ag2O微溶于水,溶液呈微碱性。它的△f H m很小, 不稳定,加热易分解,具有氧化性。 (2)、氧化汞的生成和性质 取0.5ml 0.2mol l-1的Hg(NO3)2溶液,滴加新配置的2mol.L-1的NaOH溶液,观察溶液颜色和状态。将沉淀分成两份一份2mol.L-1的HNO3,另一份加40%的NaOH溶液,观察现象。 Hg2++OH-===Hg(OH)2↓白色沉淀==HgO↓+H2O HgO+2HNO3==Hg(NO3)2+H2O HgO+NaOH(40℅)-----不溶解 补充:Hg22++2OH-=Hg↓+HgO↓+H2O (歧化反应) 沉淀不稳定,脱水得到HgO红色/黄色沉淀,沉淀溶于酸不溶于碱。HgO有黄色和红 色变体,结构相同,颜色差别因其颗粒大小不同所致, 黄色晶粒细小, 红色颗粒较大。 二、锌、镉、汞硫化物的生成和性质 向三支试管分别盛有0.5ml0.2mol.L-1CdSO4、ZnSO4、CdSO4溶液的离心试管中滴加新配制的1mol.L-1Na2S溶液,观察溶液颜色及状态。 Cd2++S2-===CdS 黄色沉淀 Zn2++S2-===ZnS 白色沉淀 Hg2++S2-===HgS 黑色沉淀 ZnS + 2HCl === ZnCl2 +H2S (ZnS能溶于 0.1mol/L的稀HCl) CdS + 2HCl === CdCl2 + H2S (CdS不溶于稀酸,但能溶于浓酸中) 3HgS + 12HCl + 2HNO3 === 3H2[HgCl4] + 3S↓+ 2NO↑+ 4 H2O 3HgS+12Cl-+2NO3-+8H+=3[HgCl4]2-+3S+2NO+4H2O HgS不溶于浓酸,在浓硝酸中也难溶,但它能溶于王水。所有的沉淀都能够溶 于王水中。这反映出三种沉淀的K sp存在差异。 将沉淀离心分离分成三份:一份加入 2 mol.L-1的盐酸,另一份加入浓盐酸,再一份加入王水。
铜、铅、锌、镉试题 (原子吸收分光光度法) 一、填空题 1.中华人民共和国国家标准GB7475-87规定测定水质Cu、Pb、Zn、Cd的方法是。答:原子吸收分光光度法。 2.原子吸收光度法测定水质Cu、Pb、Zn、Cd,可分为两部分,第一部分为法,适用于地下水和中的Cu、Pb、Zn、Cd测定。第二部分分为法,适用于测定地下水和清洁地面水中低浓度的Cu、Pb、Zn、Cd。 答:直接;地面水;废水;螯合萃取。 3.原子吸收法测定水质Cu、Pb、Zn、Cd分析时均使用符合国家标准或专业标准的试剂和水或等浓度的水(除另有说明外)。 答:分析纯;去离子。 4.原子吸收光度计光源使用灯或无极放电灯。 答:空心阴极。 5.原子吸收法测定某一元素时,所选择的火焰应使待测元素获得最大原子化效率即,测Ti、V等金属时因其金属氧化物离解能较高,宜选用富燃性火焰进行测量,而Cu、Pb、Zn、Cd的氧化物离解能较低测量时选用火焰即可。 答:测量灵敏度;贫燃性。 6.原子吸收分光光度计按其功能主要由四个基本部分组成:①;②; ③;④。 答:光源;原子化器;分光系统;检测放大和读出系统。 二、选择、判断题 1.原子吸收光度法测金属浓度时火焰用燃料气为。 A、甲烷气体; B、乙炔气体; C、丙烯气体; D、丙炔气体 答:B 2.用萃取火焰原子吸收分光光度法测定微量镉、铜、铅时,如样品中存在时可能破坏吡咯烷二硫代氨基甲酸铵,萃取前应去除。 A、强氧化剂; B、强还原剂; C、强酸; D、强碱 答:A 3.判断下列说法是否正确。
⑴铅、镉和锌在自然界中是以单一元素形态存在。() ⑵铜是动植所需的微量元素之一。() ⑶铅是一种蓄积性毒物,而镉是无毒的。() ⑷锌为人体必需元素,对酶的功能有很大作用。() 答:⑴×⑵√⑶×⑷√ 三、问答题 1.原子吸收法测定金属浓度时,若有化学干扰如消除? 答:①加释放剂②加保护剂③加助熔剂④改变火焰性质⑤预分离 2.简述原子吸收法的特点? 答:①灵敏度高②原子吸收谱线简单,选择性好,干扰少③操作简单、快速④测量精密度好⑤测定元素多(例举上述三个即可)。 3.原子吸收法测定水质Cu、Pb、Zn、Cd的原理是什么? 答:将样品或消解处理过的样品直接吸入火焰,在火焰中形成的原子对特征电磁辐射产生吸收,将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的浓度。4.用原子吸收法测定金属总量时水样应如何消解? 答:样品混匀后取100.0ml置于200ml烧杯中,加入5ml硝酸,在电热板上加热消解,确保样品不沸腾,蒸至10ml左右,加入5ml硝酸和2ml高氯酸,继续消解,蒸至1ml左右。如果消解不完全,再加入5ml硝酸和2ml高氯酸,再蒸至1ml左右。取下冷却,加水溶解残渣,通过中速滤纸(预先用酸洗)滤入100ml容量瓶中,用水稀释至标线。 5.螯合萃取法测量原理是什么? 答:吡咯烷二硫代氨基甲酸铵在pH3.0时与被测金属离子螯合后萃入甲基异丁基甲酮中然后吸入火焰进行原子吸收光谱测定。 三、计算题 1.已知原子吸收法测定水质总铜,直接测量法测定校准曲线为y=0.109x-5.17×10-4空白吸光值为0.004,某试样测量吸光度为0.096,求该水样中总铜的浓度。 答: x=(y+5.17×10-4)/0.109 =[(0.096-0.004)+5.17×10-4]/0.109 =0.849mg/L
1 适用范围 令狐采学 本标准规定了测定水中铜、锌、铅、镉的火焰原子吸收分光光度法。 本标准分为两部分。第一部分为直接法,适用于测定地下水、地面水和废水中的铜、锌、铅、镉;第二部分为螯合萃取法,适用于测定地下水和清洁地面水中低浓度的铜铅、镉。 2 定义 2.1溶解的金属,未酸化的样品中能通过0.45um滤膜的金属成分。 2.2金属总量:未经过滤的样品经强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金属浓度的总量。 3试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂;实验用水,GB/T 6682,二级。 3.1 硝酸:ρ(HNO3)=1.42 g/mL,优级纯。 3.3 硝酸:ρ(HNO3)=1.42 g/mL,分析纯。。 3.3高氯酸:ρ(HClO4)=1.67 g/mL,优级纯。 3.4 燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99.6%。 3.5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中的水、油和其他杂质。 3.6硝酸溶液:1+1。 用硝酸(3.2)配制。 3.7 硝酸溶液:1+499。 用硝酸(3.1)配制。 3.8金属储备液:1.000g/L。 称取1.000g光谱纯金属,准确到0.001g,用硝酸(3.1)溶解,必
要时加热,直至溶解完全,然后用水稀释定容至1000mL。 3.9 中间标准溶液。 用硝酸溶液3.7稀释金属贮备液3.8配制,此溶液中铜、锌、铅、镉的浓度分别为50.00、10.00、100.00、10.00mg/L。 4采样和样品 4.1用聚乙烯塑料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液3.6中浸泡,使用前用水冲洗干净。分析金属总量的样品,采集后立即加硝酸3.1酸化至PH=1~2,正常情况下,每1000mL 样品加2ml硝酸3.1。 4.2试样的制备 分析溶解的金属时,样品采集后立即通过0.45um滤膜过滤,得到的滤液再按4.1中的要求酸化。 5适用范围 5.1 测定浓度范围与仪器的特性有关。 5.2 地下水和地面水中的共存栗子和化合物在常见浓度下不干扰测定。但当钙的浓度高于1000mg/L时,抑制镉的吸收,浓度为2000mg/L时,信号抑制达19%。铁的含量超过100mg/L时,抑制锌的吸收。当样品中含盐量很高,特征谱线波长又低于350nm时,可能出现非特征吸收。如高浓度的钙因产生背景吸收,使铅的测定结果偏高。 5 原理 将样品或消解处理过的样品直接吸入火焰,在火焰中形成的原子对特征电磁辐射产生吸收,将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的浓度。 6仪器 一般实验室仪器和:原子吸收分光光度计及相应的辅助设备,配有乙炔-空气燃烧器;光源选用空心阴极灯或无极放电灯。仪器操作参数可参照厂家的说明进行选择。
实验 ds 区金属(铜、银、锌、镉、汞) 一、实验目的: 1、了解铜、银、锌、镉、汞的氧化物或氢氧化物的酸碱性、硫化物的溶解性。 2、掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。 3、试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg2 2+ 和Hg 2+ 的转化。 二、实验用品: 仪器:试管、烧杯、离心机、离心试管 固体药品:碘化钾、铜屑 液体药品: HCl(2mol/L、 浓)、 H2SO4(2mol/L)、 HNO3(2mol/L、 浓)、 NaOH(2mol/L、 6mol/L、 40%)、氨水(2mol/L、浓)、CuSO4(0.2mol/L)、ZnSO4(0.2mol/L)、CdSO4(0.2mol/L)、 CuCl2(0.5mol/L) 、 Hg(NO3)2(0.2mol/L) 、 SnCl2(0.2mol/L) 、 AgNO3(0.1mol/L) 、 Na2S(0.1mol/L)、KI(0.2mol/L)、KSCN(0.1mol/L)、Na2S2O3(0.5mol/L)、NaCl(0.2mol/L)、 金属汞、葡萄糖溶液(10%) 材料:pH试纸、玻璃棒 三、实验内容: (一)铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质 1、铜、锌、镉氢氧化物的生成和性质 在分别装有 0.5mL0.2mol/L CuSO4、ZnSO4、CdSO4 溶液的三支试管中滴加新配制 的2mol/L NaOH溶液,观察溶液颜色及状态。 将各沉淀分成两份:分别加入2mol/L H2SO4 和2mol/L NaOH,观察现象。 CuSO4 + 2NaOH === Cu(OH)2↓(兰)+ Na2SO4 ZnSO4 + 2NaOH === Zn(OH)2↓(白) + Na2SO4 CdSO4 + 2NaOH === Cd(OH)2↓(白)+ Na2SO4 Cu(OH)2 + H2SO4 === CuSO4 + 2H2O Cu(OH)2 + 2NaOH === Na2[Cu(OH)4] Zn(OH)2 + H2SO4 === ZnSO4 + 2H2O Zn(OH)2 + 2NaOH === Na2[Zn(OH)4] Cd(OH)2 + H2SO4 === CdSO4 + 2H2O Cd(OH)2 酸性特别弱,不易溶于强碱中,只缓慢溶于热、浓的强碱中。 2、银、汞氧化物的生成和性质 (1)氧化银的生成和性质 AgNO3(0.5mL0.1mol/L)→加入NaOH(2mol/L新配制)→观察沉淀的颜色和状态→离 心分离→沉淀分成两份→一份加氨水(2mol/L),另一份加HNO3(2mol/L)→观察现象 AgNO3 + NaOH === AgOH + NaNO3
实验三 ds 区金属(铜、银、锌、镉、汞) 实验目的 了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。掌握Cu(I)、Cu(Ⅱ) 重要化合物的性质及相互转化条件。试验并熟悉铜、银、锌、镉、汞的配位能力,以及+ 22 Hg 和Hg 2+的转化。 实验用品 仪器:试管(10 mL)、烧杯(250 mL)、离心机、离心试管 固体药品:碘化钾、铜屑 液体药品:HCl (2mol · L -1、浓)、H 2SO 4 (mol · L -1)、HNO 3 (2 mol · L -1、浓)、NaOH (2 mol · L -1、6 mol · L -1、40%)、氨水(2 mol · L -1、浓)、CuSO 4 (0.2 mol · L -1)、ZnSO 4 (0.2 mol · L -1)、CdSO 4 (0.2 mol · L -1)、CuCl 2 (0.5 mol · L -1)、Hg(NO 3)2 (0.2 mol · L -1)、SnCl 2 (0.2 mol · L -1)、AgNO 3 (0.1 mol · L -1)、Na 2S (0.1 mol · L -1)、KI (0.2 mol · L -1)、KSCN (0.1 mol · L -1)、Na 2S 2O 3 (0.5 mol · L -1)、NaCl (0.2 mol · L -1)、金属汞、葡萄糖溶液 (10%) 材料:pH 试纸、玻璃棒 实验内容 一 铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质 1.铜、锌、镉氢氧化物的生成和性质 向三支试管分别盛有0.5 mL0.2 mol · L -1CuSO 4、ZnSO 4、CdSO 4溶液的试管中滴加新配制的2 mol·L -1NaOH 溶液,观察溶液颜色及状态。 将各试管中沉淀分成两份:一份加2 mol · L -1 H 2SO 4,另一份继续滴加2 mol · L -1NaOH 溶液。观察现象,写出反应式。 2.银、汞氧化物的生成和性质 (1) 氧化银的生成和性质 取0.5 mL 0.1 mol · L -1 AgNO 3溶液,滴加新配制的 2 mol · L -1NaOH 溶液,观察Ag 2O (为什么不是AgOH) 的颜色和状态。洗涤并离心分离沉淀,将沉淀分成两份:一份加入2 mol · L -1HNO 3,另一份加入2 mol · L -1氨水。观察现象,写出反
水质 铜、锌、铅、镉分析检测实施细则 本标准规定了测定水中铜、锌、铅、镉的原子吸收光谱法。 本标准分为两部分。第一部分为直接法,适用于测定地下水、地面水和废水 中的铜、锌、铅、镉; 第二部分螯合萃取法,适用于测定地下水和清洁地面水中低浓度的铜、铅、镉。 原子吸收分光光度法 1定义 溶解的金属:未酸化的样品中能通过0.45μg 滤膜的金属成分。 金属总量:未经过滤的样品经强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金 属浓度的总量。 2采样和样品 2.1用聚乙烯塱料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液(5.6)中浸泡,使用前用 水冲洗干净。分析金属总量的样品,采集后立即加硝酸(5.1)酸化至PH1~2,正常情况下,每1000 ml 样品加2硝酸(5.1)。 2.2 试样的制备 分析溶解的金属时,样品采集后立即通过0.45μm 滤膜过滤,得到的滤液再按(2.1)中的要求酸化。 直接法 3适用范围 3.1测定浓度范围与仪器的特性有关,表1列出,般仪器的测定范围。 因产生背景吸收,使铅的测定结果偏高。 1987 - 08 01 实施 元 素 浓度范围,mg/L 铜 0.05 ?5 锌 0.05-1 铅 0.2 镉 0.05 ?1 3.2地下水和地面水中的共存离子和化合物在常见浓度下不干扰测定。但当钙的浓度高于1000mg/l 时,抑制镉的吸收,浓度为2000mg/l 时,信号抑制达19%。铁的含量超过100mg/l 时,抑制锌的 吸收。当样品中含盐量很高,特征谱线波长又低于时,可能出现非特征吸收。 如高浓度的钙,
4 原理 将样品或消解处理过的样品直接吸入火焰,在火焰中形成的原子对特征电磁辐射产生吸收,将测 得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的浓度。 5试剂 除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂、去离子水或同等纯度的水。 硝酸 1.42mg/ml,优级纯。 硝酸1.42g/ml ,分析纯。 高氯酸 1.67g/ml ,优级纯。 燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99.6%。 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中的水、 油和其他杂质。 1 + 1硝酸溶液。 用硝酸(5.2)配制。 1 + 499硝酸溶液。 用确酸(5.1)配制。 金属贮备液:1.000g/l 。 称取1.0008光谱纯金属,准确到0.0018,用硝酸(5.1)溶解,必要时加热,直至溶解完全,然 后用水稀释定容至1000ml 。 中间标准溶液。 用硝酸溶液稀释金属贮备液化(5.8)配制,此溶液中铜、锌、铅、镉的浓度分别为50.00、 10.00、100.0 和 10.00mg/l 。 6 仪器 一般实验室仪器和: 原子吸收分光光度计及相应的辅助设备,配有乙炔-空气燃烧器; 灯。仪器操作参数可参照厂家的说明进行选择。 注,实验用的玻璃或塑料器皿用洗涤剂洗净后,在硝酸溶液(5.6)中浸泡 7步骤 7.1 校准 7.1.1 参照表2丨在100ml 容量瓶中,用硝酸溶液5(5.7)稀释中间标准溶液(5.9),配制至少4个 工作标准溶液,其浓度范围应包括样品中被测元素的浓度。 光源选用空心阴极灯或无极 放电 ,使用前用水冲洗干净。 中间标准溶液( 5.9)加人体积mL 0.50 1.00 3.00 5.00 10.0 工作标准溶液浓度mg/l 铜 0.25 0.50 1.50 2.50 5.00 锌 0.05 0.10 0.30 0.50 1.00
重金属(铜、铅、锌、镉、镍、铁、锰)试题 (原子吸收分光光度法) 一、填空题 1、中华人民共和国国家标准GB7475-87规定测定水质Cu、Pb、Zn、Cd的方法是。答:原子吸收分光光度法。 2、原子吸收光度法测定水质Cu、Pb、Zn、Cd,可分为两部分,第一部分为法,适用于地下水和中的Cu、Pb、Zn、Cd测定。第二部分分为法,适用于测定地下水和清洁地面水中低浓度的Cu、Pb、Zn、Cd。 答:直接;地面水;废水;螯合萃取。 3、原子吸收法测定水质Cu、Pb、Zn、Cd分析时均使用符合国家标准或专业标准的试剂和水或等浓度的水(除另有说明外)。 答:分析纯;去离子。 4、原子吸收光度计光源使用灯或无极放电灯。 答:空心阴极。 5、原子吸收法测定某一元素时,所选择的火焰应使待测元素获得最大原子化效率即,测Ti、V等金属时因其金属氧化物离解能较高,宜选用富燃性火焰进行测量,而Cu、Pb、Zn、Cd的氧化物离解能较低测量时选用火焰即可。 答:测量灵敏度;贫燃性。 6、原子吸收分光光度计按其功能主要由四个基本部分组成:①;②; ③;④。 答:光源;原子化器;分光系统;检测放大和读出系统。 7、国家颁布测定水质铁、锰的标准方法有,方法的国标号码是。 答:火焰原子吸收分光光度法;GB11911-89。 8、火焰原子吸收光度法可测定,,中的铁和锰。 答:地面水;地下水;工业废水; 9、标准分析方法中测定铁、锰的检测限分别是和。校准曲线的浓度范围分别为和。 答:0.03mg/L;0.01mg/L;0.1~5mg/L;0.05~3mg/L; 10、火焰原子吸收法测定水质中的铁、锰时,用瓶采集样品,若仅测定 铁锰,样品采集后尽快通过过滤,并立即加滤液,使pH为。答:聚乙烯;可过滤态;0.45μm滤膜;硝酸酸化,1~2。 11、影响铁、锰原子吸收法准确度的主要干扰是,当硅的浓度大于时,
铁锰铜锌铅镉 1.适用范围 1.1 本标准适用水源水、、饮用水和矿泉水中铁锰铜锌铅镉的测定。2技术依据 2.1 根据《中华人民共和国国家标准》生活饮用水标准检验方法。GB/T5750.6—2006 4.2.1所规定的生活饮用水中铁锰铜锌铅镉的检验方法。(火焰原子吸收分光光度法____直接法) 2. 2 GB/T 8538-2008 4.17.1(火焰原子吸收分光光度法____直接法) 2. 3 SOlAAR M5原子吸收使用説明书 3 原理 3.1水样中金属离子被原子化后,吸收来自各种金属空心阴极灯发出的共振线(铁,248.3nm;锰,279.5 nm;铜,32 4.7nm;锌,213.9nm;铅,217.7nm;镉,228.8nm),吸收共振线的量与样品中该元素的含量成正比。在其他条件不变的情况下,根据测量被吸收的谱线在一定浓度范围,与标准系列比较定量。 4 仪器 4.1火焰原子吸收分光光度仪SOLAAR M5。 4.2铁锰铜锌铅镉空心阴极灯。 4.3电热板。 4.4 抽气甁和玻璃沙芯滤器。 4.5 高纯度乙炔气体和由空气压缩机提供的空气。
5.试剂 5.1所用玻璃仪器均需以硝酸(1+9)浸泡过夜,用水反复冲洗,最后用蒸馏水冲洗干净。 5.2 硝酸: MOS级(国药集团)。 5.3 超纯水:自制。 5.4 1%硝酸溶液:取1ml硝酸溶液稀释到100mL。 5.5铁锰铜锌铅镉标准:水中铁锰标准溶液:上海市计量测试技术研究院国家二级标准物质(编号:PbGBW(E)080278 ,CdGBW(E)080279 FeGBW(E)080281 ,MnGBW(E)080505 ,CuGBW(E)080277 ,ZnGBW(E )080280均定值为1 .000g/L)。 5.6铁标准储备液:取1 .000g/L的铁标准溶液10 .00mL用1%HN03溶液稀释到刻度100mL容量瓶、混匀。此溶液浓度为100.0ug/mL。(冰箱4℃六个月)。 5.7锰标准储备液:取1 .000g/L的锰标准溶液用1%HN03溶液逐级稀释到刻度100ml容量瓶、混匀。此溶液浓度为10.0ug/mL。(冰箱4℃六个月) 5.8铜标准储备液:取1 .000g/L的铜标准溶液10 .00mL用1%HN03溶液稀释到刻度100mL容量瓶、混匀。此溶液浓度为100.0ug/mL。(冰箱4℃六个月)。 5.9锌标准储备液:取1 .000g/L的锌标准溶液10 .00mL用1%HN03溶液稀释到刻度100mL容量瓶、混匀。此溶液浓度为10.0ug/mL。(冰箱4℃六个月)。
无机化学实验第四版实验二十一:ds区金属(铜-银-锌-镉-汞)
实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压: 一、实验目的 1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性; 2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件; 3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。 二、实验内容 1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质 1)铜,锌,镉氢氧化物的生成和性质 实验操作实验现象解释或化学反应方程式CuSO4+NaOH 生成蓝色沉淀,溶液无色CuSO4+2NaOH==Cu(OH)2+Na2SO4 ZnSO4+NaOH 生成蓝色沉淀,溶液无色ZnSO4+2NaOH==Zn(OH)2+Na2SO4 CdSO4+NaOH 生成蓝色沉淀,溶液无色CdSO4+2NaOH==Cd(OH)2+Na2SO4 Cu(OH)2+H2SO4沉淀溶解Cu(OH)2+2H2SO4==CuSO4+2H2O +NaOH 沉淀溶解Cu(OH)2+2NaOH==Na2[Cu(OH)2] Zn(OH)2+H2SO4沉淀溶解Zn(OH)2+2H2SO4==ZnSO4+2H2O +NaOH 沉淀溶解Zn(OH)2+2NaOH==Na2[Zn(OH)2] Cd(OH)2+H2SO4沉淀溶解Cd(OH)2+2H2SO4==CdSO4+2H2O +NaOH 沉淀不溶解不反应 2)银,汞氧化物的生成和性质 a.氧化银的生成和性质 b.氧化汞的生成和性质 实验操作实验现象解释或化学反应方程式AgNO3+NaOH 生成棕色沉淀,溶液无色2AgNO3+2NaOH==Ag2O+2NaNO3+2H2 O Hg(NO3)2+NaOH 生成黄色沉淀,溶液无色Hg(NO3)2+2NaOH==HgO+2NaNO3+H2 O 洗涤Ag2O +HNO3沉淀溶解Ag2O+2HNO3==2AgNO3+H2O +氨水沉淀溶解Ag2O+4NH3H2O==2[Ag(NO3)2]+2OH-
HZHJSZ00117 水质镉铜铅锌的测定示波极谱法 HZ-HJ-SZ-0117 水质铜锌示波极谱法(试行) 1 范围 本方法适用于测定工业废水和生活污水中镉铅镍的测定地面水和地下水本方法的检测下限可达106 mol/L í-?ú???á?§3?μ??a?ê?D2a?¨?|钴钴可以忽赂不计抗坏血酸等还原而消除干扰硝酸存在影响锌的测定 2 原理 将速度变化很快的极化电压(一般约为250mV/s)?úμ??????y±??ˉoüD?μ?ê±???úó?ò???é?????2¨?÷×÷?a2aá?1¤???ú3¤óà??ê?2¨1üé? ?ò?-μ?×ó???·′|àíoóó?????ò?????·ü°2?ú?? ?éó?óú?¨á?·??? ?ü??μ?·?μ?????μ×òo?D?ùo?μ??é?ê2?í???óD?ù±??ˉ í-??ó?????èü3?·ü°2·¨?àí? 3.2 支持电介质 称取54g氯化铵浓氨水250mL 溶解后用水稀释至1Lè?1?ó??èD???ì?3y?? 铝锌其蜂电位值(相对于饱和甘汞电极) 表1 锡锌 Cu0Cu2 Cu0的还原波 在盐酸底液中镉形成的稳定络离子有良好的还原波Cd2+Pb2+ 3.2.3 1.0mol/L高氯酸支持电介质(使用时适当稀释) ′×?á?§3?μ??a?ê 1.0mol/L (pH3.0) 3.3 极大抑制剂水溶性聚乙烯醇或者明胶 聚乙烯醇(C H4O)n44.061750土50 2 3.5 盐酸羟胺或抗坏血酸 4 仪器 4.1 极谱分析仪(单扫描示波极谱 4.2 工作电极铂碳电极
4.3 参比电极氯化银电极或饱和甘汞电极 4.5 电解池 使pH在聚乙烯瓶中贮存 不含有机质如未出现沉淀 废水或者污水可取适量加入5mL浓硝酸冷却后继续加热消解至冒高氯酸白色浓烟用水溶解至50mLà?è′oóó??ì?ù?¨á?????1y????òooí?′μóòo?¨èYμ?100mL 6 操作步骤 仪器和电极的准备 6.1 在氨性底液中测定镉锌 6.1.1 校准曲线的绘制10.050.0150.0 加入氨性支持电解质1mL 盐酸羟胺少量摇匀, 转入电解池中 铜镍-0.25V-0.85V然后绘制峰高 6.1.2 样品的测定如有必要应先调到中性在校准曲线上查出样品含量 先按上述程序测定出样品的峰高(h) ?ù′?2a?¨·???(H)HZ-HJ-SZ-0116 6.2 在盐酸底液中测定铅 分别取含量为020.0100.0200.0ìg 的铅及镉标准溶液于10mL比色管中0.1%极大抑制水溶液0.5mL ?ó????êíμ?±ê??×aè?μ??a3??D?ó -0.45V起始电位时测镉)?¨?èD£×??ú?? ò?è?êêá?(含金属10~100ìg)已处理好的水样于10mL比色管中 在校准曲线上查出样品含量 先按上述程序测定出水样的峰高(H) ?ù′???DD2a?¨按阳极溶出伏安法中的一次标准加入法的公式进行计算 (1) 在盐酸支持电解质中镉的峰电位约为-0.6V 由于大量铅的存在对镉的测定有影响 (2) 氨性溶液中铅干扰铜的测定铝较多或为除去铅的干扰而加入了铁盐使铅完全进入沉淀建议采用小体积沉淀法进行分离在样品预处理的最后一次蒸至近干后而是用少量0.01mol/L盐酸将残渣全部润湿后搅拌均匀后搅匀后再加入约20mL水 并将烧杯的洗涤液也并入容量瓶摇匀供测定用铝沉淀不呈絮状 (3) 若水样中几种离子含量相差较大宜采用微分测定技术 例如最好能分别测定
铜、锌、铅、镉测定作业指导书 第1 页共7 页 颁布日期:年月 1 目的 准确检测水质中的铜、锌、铜、镉,为各种环境状况分析提供合理依据。 2 定义 2.1 溶解的金属:未酸化的样品中能通过0.45μm滤膜的金属成分。 2.2 金属总量:未经过滤的样品经强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金属浓度的总量。 3 采样和样品 3.1 用聚乙烯塑料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液(6.6)中浸泡,使用前用不冲洗干净。分析金属总量的样品,采集后立即加硝酸(6.1)酸化至PH1~2,正常情况下,每1000ml样品加2ml硝酸(6.1)。 3.2 试样的制备 分析溶解的金属时,样品采集后立即通过0.45μm滤膜过滤,得到的滤液再按(3.1)中的要求酸化。 第一部分直接法 4 范围 4.1 测定浓度范围与仪器的特性有关,表1表出一般仪器的测定范围。 表1 元素浓度范围,mg/L 铜锌铅镉0.05~5 0.05~1 0.2~10 0.05~1 4.2 地上水和地面水中的共存离子和化合物在常见浓度下不干扰测定。但当钙的浓度高于1000mg/L时,抑制镉的吸收,浓度为2000mg/L时,信号仰制达19%。铁的含量超过100mg/L时,抑制锌的吸收。当样品中含盐量很高,特征谱线波长又低于350nm时,可能出现非特征吸收。如高浓度的钙,因产生背景吸收,使铅的测定结果偏高。 5 原理 将样品或消解处理过的样品直接吸入火焰,在火焰中原子对特征电磁辐射产生吸收,将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的浓度。 6 试剂
第2 页共7 页铜、锌、铅、镉测定作业指导书 颁布日期:年月 除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂、去离子水或同等纯度的水。 6.1 硝酸(HNO3):ρ=1.42g/mL,优级纯。 6.2 硝酸(HNO3):ρ=1.42g/mL,分析纯。 6.3 高氯酸(HClO4):ρ=1.42g/mL,优级纯。 6.4 燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99.6%。 6.5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中的水、油和其他杂质。 6.6 1+1硝酸溶液。 用硝酸(6.2)配制。 6.7 1+499硝酸溶液。 用硝酸(6.1)配制。 6.8 金属贮备液:1.000g/L. 称取1.000g光谱纯金属,准确到0.001g,用硝酸(6.1)溶解,必要时加热,直至溶解完全,然后用水定容至1000mL。 6.9 中间标准溶液 用硝酸溶液(6.7)稀释金属贮备液(6.8)配制,此溶液中铜、锌、铅、镉的浓度分别为50.00、10.00、100.0和10.00mg/L。 7 仪器 一般实验室仪器和: 原子吸收分光光度计及相应的辅助设备,配有乙炔-空气燃烧器;光源选用空心阴极灯或无极放电灯。仪器操作参数可参照厂家的说明进行选择。 注:实验用的玻璃或塑料器皿用洗涤剂洗净后,在硝酸溶液(6.6)中浸泡,使用前用水冲洗干净。 8 步骤 8.1 校准 8.1.1 参照表2,在100ml容量瓶中,用硝酸溶液(6.7)稀释中间标准溶液(6.9),配制至少4个工作标准溶液,其浓度范围应包括样品中被测元素的浓度。