
工艺验证方案 本公司氯化钾产品是非无菌原料药产品,为保证生产工艺在实际生产中的有效性和可靠性,故对其进行工艺验证,本工艺验证采用同步验证的方式。本生产工艺的验证是由质量管理部负责组织,生产技术部、设备工程部、生产车间及QC检验室有关人员参与实施。 本工艺验证方案参考了GMP2010年版的生产工艺验证的指导原则。 验证小组成员 方案制订 方案审核 方案批准
目录 1. 基本情况 (4) 1.1. 概述 (4) 1.2. 生产工艺 (4) 1.2.1. 生产工艺流程图 (4) 1.2.2. 生产工艺的详细描述 (4) 1.2.3. 关键工艺步骤和参数 (4) 2. 验证目的 (5) 3. 验证前提 (5) 3.1. 工艺环境包括公用系统情况 (5) 3.2. 工艺设备情况 (5) 3.3. 所用原辅料和包装材料情况 (5) 3.4. 所用文件的准备情况 (6) 3.5. 人员情况 (6) 4. 验证方案 (6) 4.1. 验证计划 (6) 4.2. 第一步反应(生产XXXXX粗品)的验证(应包括所有重点 考察的生产关键参数、结晶、离心、干燥) (6) 4.2.1第一步反应(生产XXXXX粗品)关键工艺参数验证 (6) 4.2.2第一步反应收率情况验证 (7) 4.2.3第一步反应中间体的质量情况验证 (7) 4.3. 粗品精制工序的验证 (8) 4.3.1溶解脱色验证 (8) 4.3.2 结晶工序验证 (8) 4.3.3 分离工序验证 (9) 4.3.4 干燥工序验证 (10) 4.3.5小批成品收率情况验证 (10) 4.3.6小批成品的质量情况验证 (11) 4.4批混合工艺的验证 (11) 4.4.1批混合工序关键工艺参数验证 (11) 4.4.2批混合效果的验证 (11) 4.5最终成品的质量情况验证 (12)
文件编号:******* 版本号:00 *****工艺再验证方案
*****有限公司
验证方案
目录 1.概述 (3) 1.1产品基本信息 (3) 1.2验证背景 (3) 1.3验证目的 (3) 1.4适用范围 (3) 2.职能部门及职责 (4) 3.风险评估 (4) 3.1目的 (4) 3.2范围 (4) 3.3评估方法 (4) 3.4评估标准 (5) 3.5风险评估结果及风险控制 (5) 4.验证项目、接受标准、实测结果及验证结论 (9) 4.1验证文件确认 (9) 4.2设备、设施及公用系统确认 (10) 4.3关键人员确认 (11) 4.4工艺参数控制确认 (12) 4.5成品质量确认 (14) 4.6稳定性考察试验 (15) 4.7偏差和变更控制 (15)
5.验证结果评定与结论 (15) 6.时间进度安排 (15) 7.附件 附件1:称量情况确认表 附件2:制粒生产过程记录表 附件3:压片生产过程记录表 附件4:包装质量检查记录表 其他附件:合格物料供应商名单、中间产品报告单、成品报告单、生产记录、培训记录、药品生产工艺验证合格证 1.概述 1.1产品基本信息 1.1.1产品名称:*** 1.1.2产品剂型:片剂 1.1.3产品规格:***
1.1.4药品批准文号:国药准字*** 1.1.5制剂批量:*** 1.1.6内包装:**** 1.1.7产品有效期:*** 1.1.8制剂生产工艺流程图: 1.2验证背景 ****为我公司中药制剂品种,制剂生产工艺于***年进行了再验证,验证结果判定为合格。***年月因生产需要,*******。 1.3验证目的 按照GMP及“附录2 确认与验证”的要求,应对*****制剂生产工艺进行再验证,以证明*******按照现行批准的生产工艺仍能生产出符合GMP要求、质量标准及注册标准要
YZ/CP/30-01 武汉诺见生物技术有限公司 验证文件 氟苯尼考粉工艺 验 证 报 告
验证文件 类别:验证报告编号:YZ/CP/30-01部门:共页 氟苯尼考粉工艺 验证报告 版次:□新订□修订 验证形式:前验证()同步验证() 回顾性验证()再验证() 起草:年月日审阅会签: (验证领导小组) 批准:年月日实施日期:年月日
复印数:复印人:批准人: 分发单位: 目录 一、概述 二、验证目的 五、验证范围 四、验证时间 五、验证职责 六、判定标准 七、验证结果判定方法 八、生产工艺流程及说明 九、氟苯尼考粉生产工艺验证中所用的公用系统及设备的验证文件 十、生产要素的评价 十一、质量系统要求的评价 十二、生产工艺变量的评价 十三、验证过程 十四、结果评价与结论 十五、确定再验证周期
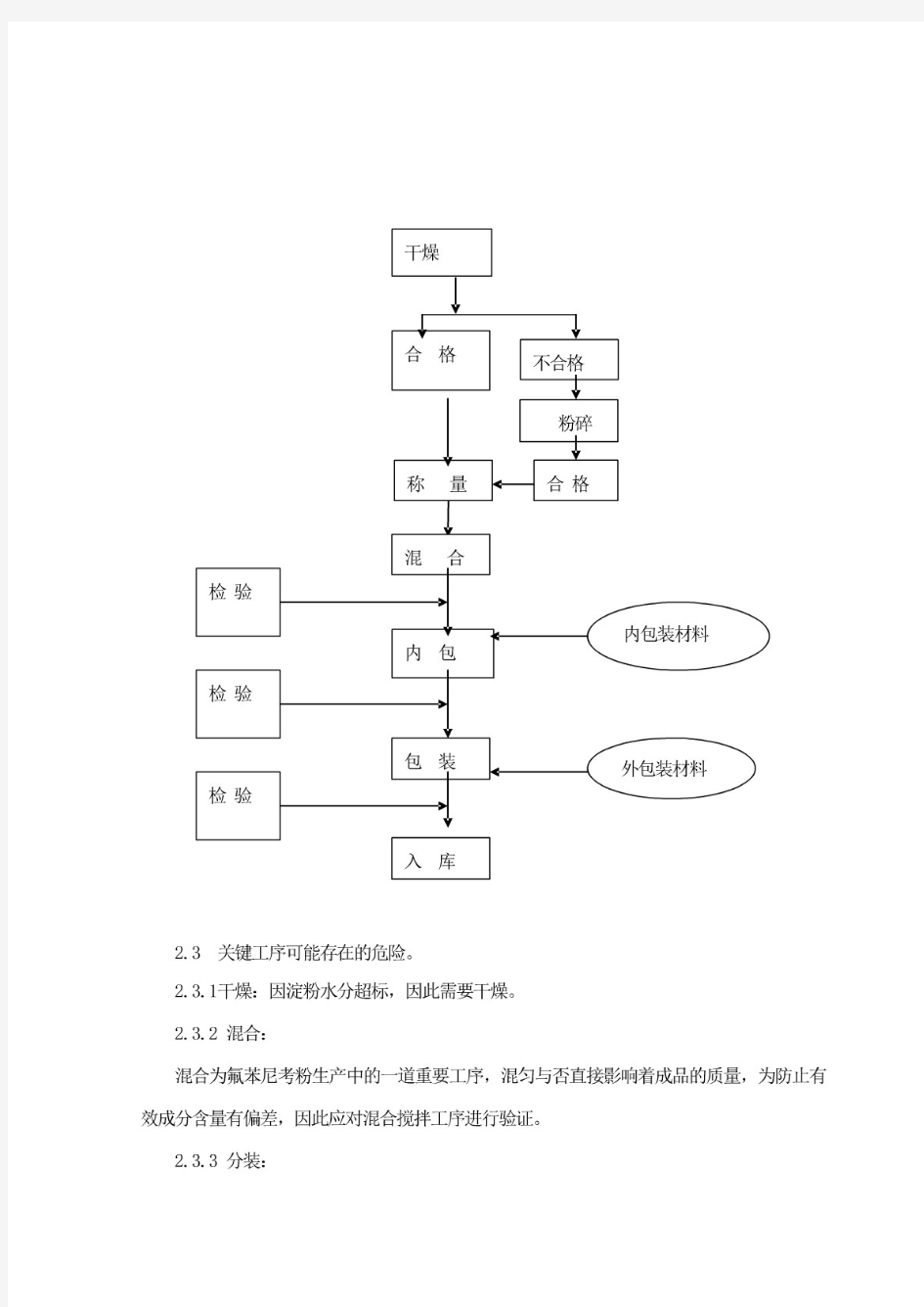
一、概述: 我们对粉/散/预混剂车间的厂房等进行了验证。对主要生产设备热风循环干燥烘箱、V-300混合机、全自动粉剂分装机进行了验证,详见清单。制定了粉剂/预混剂各产品生产工艺规程。制定了粉剂/预混剂各岗位标准操作规程。合理的生产工艺是指导生产者进行规范化操作,生产出合格产品的根本保证。其规范性和可操作性将直接影响兽药的质量,因此必须对兽药产品的生产工艺进行验证。本厂氟苯尼考粉的生产是在一般生产区,该工艺根据兽药GMP有关预混剂生产工艺规定设计,符合预混剂生产要求。 二、验证目的 本工艺验证是在厂房、生产用设备验证的基础上进行的。在于评价生产系统要素和生产过程中等能影响产品质量的各种生产工艺变化因素提供系统的验证计划。对准备投入商业化生产的氟苯尼考粉,用现行工艺生产三个批量(为上市批量)的产品,每批2000袋,从而检验氟苯尼考粉工艺规程、岗位操作规程及有关监控文件的可行性和重现性,使产品确定达到规定的质量标准。 三、验证的范围: 氟苯尼考粉产品质量控制方法、氟苯尼考粉产品生产工艺过程以及各工序的物料平衡等;重点评价在此生产工艺条件下生产出的中间产品、成品能否达到相应标准,各工序的物料平衡是否控制在所制定范围。 四、验证时间:2006年06月09日至2006年06月11日
XXXXX 有限公司 XXXX机型生产 工艺验证方案 起草人: 审核: 批准: 生效日: 制造部工艺组
1、目的 按S1.5L机型的生产工艺规程,有关的管理文件,标准操作规程及验证文件要求,连续二批生产,证实设计的工艺过程的实用性,设计的生产工艺和设计产品质量能够符合质量标准,确认本生产工艺稳定、操作规程合理,设备与生产能力相匹配,质量监控点合理,具有可靠性和重复性,确保生产处于受控状态,确保能生产出合格的产品。 2、范围 本验证方案适用于S1.5L机型工艺验证,以及可能影响生产工艺的各种因素 3、术语和定义 生产工艺: 指通过一项作业或一系列作业并与设备系统、人员、文件及环境有关的将原材料转变为成品的过程。工艺规程: 为生产S1.5L机型的成品,规定所需原辅料的数量、加工说明(包括中间控制)、注意事项的一个或一套文件,包括生产原材料、生产操作要求和质量控制要求等 工艺性能:一个工艺实现能满足产品要求的产品的能力。
控制策略: 源自于现行产品和工艺理解的一组规划过的控制,用于保证工艺性能和产品质量。这些控制可包括与原材料和技术要求、设施和设备运行条件、过程控制、成品质量标准和监控与控制的关联方法与频次相关的参数与属性。 关键性能指标: 用于衡量质量目标以反映一个组织,工艺或体系的性能表现的度量。 受控状态: 生产控制能始终如一地保证持续的工艺性能和产品质量的状态 4 工艺验证条件: 4.1工艺文件(过程流程图、控制计划、PFMEA、工艺指导书、检验指导书、设备点检保养书、整机BOM、装机技术条件、AUDIT检验文件、设备技术协议、现场5S管理制度等)准备齐全并培训到位。 4.2设备联动调式完毕同时生产线设备参数符合合同技术要求和产品装配技术要求 4.3工艺验证参与人员全部经过培训,熟知工艺验证输出物的要求,参与工艺验证的操作人员需经培训取得上岗资格的员工。
Verification department (department):验证科室(部门): Verify completion date: 验证完成日期: Validity: 有效期:
Index 目录 1.Purpose目的 (5) 2.Scope范围 (5) 3.Responsibility职责 (5) 3.1 AAA responsibilities AAA的职责 (5) 3.2 XXX responsibilities XXX的职责 (6) 4.Regulation and Guidance 法规和指南 (8) 5.Abbreviations缩略语 (9) 6.Protocol Description方案说明 (11) 7.Product And Process Description产品和工艺描述 (14) 7.1 Product specification (14) 7.2 Drug approval No. (14) 7.3 Standard Followed: (14) 7.4 Raw Materials and Adjuvants原辅料情况 (14) 7.5 Process description: (16) 7.6 Process Recipe工艺处方: (21) 7.7 List of Production Plants生产车间一览 (26) 7.8 List of Production Equipment 生产设备一览 (29) 7.9 Process Flow Diagram 工艺流程图 (33) 7.10 CPP Identification CPP确认 (34) 7.11 Validation Plan验证计划 (49) 8.Validation prerequisite验证先决条件 (51) 8.1 Personal Identification人员确认 (51) 8.2 Process Documentation Verification 生产文件确认 (51) 8.3 Training Verification 培训确认 (52) 8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 52 8.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (53) 8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (53)
工艺验证方案 1
下载文档 收藏 1工艺验证方案 体外诊断试剂质量管理体系文件 北京生物医学科技有限公司生产工艺验证方案类别:验证方案编号: 部门:XXXXXX 诊断试剂盒(AAAA)工艺验证小组页码:共 23 页,第 1 页 XXXX(XXXX) XXXX(XXXX)诊断试剂盒 (AAAA)工艺验证方案 AAAA)版次: □ 新订□ 替代: 年月日制定人: 审批会签: (验证小组) 批准人: 生效日期: 年年月月日日共 23 页,第 1 页 北京易斯威特生物医学科技有限公司生产工艺验证方案目录一. 目的 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 二、范围 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 三、职责 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 1、验证委员会 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 2、工艺验证小组 2
备科 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 4、生产部 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 5、质量检验部 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 四、验证内容 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 1、文件 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 2、方案概要 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈5 3、验证步骤 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈5 五、时间进度表 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈10 六、验证周期 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈11 七、验证结果评价和建议 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈11 八、附件 3
编号: 药业有限公司生产工艺验证方案 栓剂车间生产工艺验证方案 验证方案制订 验证方案审查 验证方案最终审查及批准
目录1.引言 1.1.概述 1.2.文件 2.目的 3.验证准备 4.验证步骤 4.1.配制 4.2制袋 4.3灌注、冷凝、封口 4.4包装 5.验证周期 6.验证结果及评价
1.引言 1.1概述 本次验证采用下列处方: 理论处方实际处方 甲硝唑 2.00kg 2.08kg 克霉唑 1.6kg 1.632kg 醋酸氯己定 0.08kg 0.088kg 石蜡 1.2kg 1.2kg 羊毛脂 5g 5g S—36#或38# 12kg 12kg 10000枚 10000枚 共进行三批次生产。进行工艺确认。 1.2.文件 1.2.1.栓剂设备操作规程存放处 1.2.2.工艺规程、岗位操作SOP 存放处 1.2.3.关键设备的验证报告存放处 1.2.4.产品质量标准及产品检验操作规程存放处 2.目的:确认双唑泰栓的配制、灌注、冷却、封口、包装等工序的生产工艺过程,栓剂生产的工艺参数,并确认在此工艺条件下,三批双唑泰栓各项检测指标均符合产品法定质量标准要求。 3.验证准备 3.1.关键设备验证已完成。 3.2.公用工程系统已验证,并处于运行状态。 3.3.有关衡器、仪表等均已经过校正。
3.4.原辅材料检验合格,待用。 3.5.所需设备、器具均已清洁。 4.验证步骤 4.1配制、灌封参数验证 检查人: 4.1配制 栓剂配制工艺流程
现场检查设备是否按上述流程配置,检查栓剂配制罐验证报告。结论: 检查人:日期: 4.1.1配料 4.1.1.1环境监测 标准:室温 18~26℃ 相对湿度 45~65% 洁净级别十万级 结论:见外用药车间洁净厂房验证报告。 4.1.1.2.按操作规程进行原辅料备料 批号: 批号: 批号:
XXXXX工艺验证方案 YZS-G-1XX037 类别:验证管理工艺验证方案 制定人:制定日期:年月日 审核人:审核日期:年月日 批准人:批准日期:年月日 颁发部门:生效日期:年月日 复印数:份
目录 1.概述 2.目的 3.产品简介 4.验证内容、方法及标准 4.1粉碎过筛 4.2配料混合 4.3压片 4.4包装 4.5成品质量 4.6各工序收率及物量平衡 5验证结果评定与结论 6.稳定性考察 7.相关文件 8.图一 9.相关记录
1.主题内容 本方案规定了XXXXX生产工艺验证的目的,步骤、标准及评价内容 2.适用范围 本方案适用于XXXXX生产工艺的验证 3.责任人 3.1工艺验证小组 组长: 组员: 3.2其他相关人员 4.验证的内容 4.1概述 XXXXX是我公司的主要产品,在以往的生产过程中,此产品生产工艺是稳定可靠的,但是为符合GMP要求,我公司新建了厂房,引进了先进的设备,因此在该产品正式投入生产前进行工艺验证,进行工艺验证的前提条件是: 1.厂房、设施、设备已经过验证并验证合格可投入使用。 2.相应的文件已批准执行。 3.物料通过供应商审计并审计合格。 4.人员已进行全面健康检查和系统培训且已有健康证和培训上岗证。 本验证方案拟在XXXXX试生产时实施 4.2目的: 本产品工艺验证方案的目的在于通过对XXXXX生产工艺的验证,证明该生产工艺可靠性和稳定性 4.3产品简介: 4.3.1处方:原辅料名称万片的用量 4.3.2工艺流程图(见图一) 4.3.3生产、质、量管理文件 批生产指令及记录 XXXXX批生产指令及记录 生产工艺规程 XXXXX批生产工艺规程 质量标准 XXXXX质量标准及主要物料质量标准
工艺验证方案 本公司产品XXXXX是非无菌原料药产品,为保证生产工艺在实际生产中的有效性和可靠性,故对其进行工艺验证,本工艺验证采用同步验证的方式。本生产工艺的验证是由质量管理部负责组织,生产技术部、设备工程部、生产车间及QC检验室有关人员参与实施。 本工艺验证方案参考了ICH Q7A的生产工艺验证的指导原则。 验证小组成员 方案制订 方案审核 方案批准
目录 1. 基本情况 (4) 1.1. 概述 (4) 1.2. 生产工艺 (4) 1.2.1. 生产工艺流程图 (4) 1.2.2. 生产工艺的详细描述 (4) 1.2.3. 关键工艺步骤和参数 (4) 2. 验证目的 (5) 3. 验证前提 (5) 3.1. 工艺环境包括公用系统情况 (5) 3.2. 工艺设备情况 (5) 3.3. 所用原辅料和包装材料情况 (5) 3.4. 所用文件的准备情况 (6) 3.5. 人员情况 (6) 4. 验证方案 (6) 4.1. 验证计划 (6) 4.2. 第一步反应(生产XXXXX粗品)的验证(应包括所有重点 考察的生产关键参数、结晶、离心、干燥) (6) 4.2.1第一步反应(生产XXXXX粗品)关键工艺参数验证 (6) 4.2.2第一步反应收率情况验证 (7) 4.2.3第一步反应中间体的质量情况验证 (7) 4.3. 粗品精制工序的验证 (8) 4.3.1溶解脱色验证 (8) 4.3.2 结晶工序验证 (8) 4.3.3 分离工序验证 (9) 4.3.4 干燥工序验证 (10) 4.3.5小批成品收率情况验证 (10) 4.3.6小批成品的质量情况验证 (11) 4.4批混合工艺的验证 (11) 4.4.1批混合工序关键工艺参数验证 (11) 4.4.2批混合效果的验证 (11) 4.5最终成品的质量情况验证 (12)
氟苯尼考粉说明书 【兽药名称】 通用名称:氟苯尼考粉 商品名称: 英文名称:Florfenicol Powder 汉语拼音:Fubennikao Fen 【主要成分】氟苯尼考 【性状】本品为白色或类白色粉末。 【药理作用】药效学氟苯尼考属于酰胺醇类广谱抗生素,属抑菌剂,通过与核糖体50S亚基结合抑制细菌蛋白质的合成而发挥作用。对多种革兰氏阳性菌、革兰氏阴性菌有较强的抗菌活性。溶血性巴氏杆菌、多杀性巴氏杆菌和猪胸膜肺炎放线杆菌对氟苯尼考高度敏感。体外氟苯尼考对许多微生物的抗菌活性与甲砜霉素相似或更强,一些因乙酰化作用对酰胺醇类耐药的细菌如大肠杆菌、克雷伯氏肺炎杆菌等仍可能对氟苯尼考敏感。 主要用于敏感菌所致的猪、鸡、鱼的细菌性疾病,如溶血性巴氏杆菌、多杀性巴氏杆菌和猪胸膜肺炎放线杆菌引起的牛、猪呼吸系统疾病。沙门氏菌引起的伤寒和副伤寒,鸡霍乱、鸡白痢、大肠杆菌病等;鱼类巴氏杆菌、弧菌、金黄色葡萄球菌、嗜水单胞菌、肠炎菌等引起的鱼类细菌性败血症、肠炎、赤皮病等。 药动学氟苯尼考内服吸收迅速,约1小时后血液中可达到治疗浓度,1~3小时即可达峰值血药浓度。生物利用度达80%以上。氟苯尼考在动物体内广泛分布,能透过血脑屏障。主要以原形从尿排出,少量随粪便排出。 【药物相互作用】(1)大环内酯类和林可胺类与本品的作用靶点相同,均是与细菌核糖体50S 亚基结合,合用时可产生相互拮抗作用。 (2)可能会拮抗青霉素类或氨基糖苷类药物的杀菌活性,但尚未在动物体内得到证明。 【作用与用途】酰胺醇类抗生素。用于巴氏杆菌和大肠杆菌所致的细菌性疾病。 【用法与用量】以本品计。内服:每1kg体重,猪、鸡0.2~0.3g,一日2次,连用3~5日;鱼0.1~0.15g,一日1次,连用3~5日。 【不良反应】(1)本品高于推荐剂量使用时有一定的免疫抑制作用。 (2)有胚胎毒性,妊娠期及哺乳期家畜慎用。 【注意事项】(1)蛋鸡产蛋期禁用。 (2)疫苗接种期或免疫功能严重缺损的动物禁用。 (3)肾功能不全患畜需适当减量或延长给药间隔时间。 【休药期】猪20日,鸡5日,鱼375度日。 【规格】10% 【包装】 【贮藏】密闭,在干燥处保存。 【有效期】 【批准文号】 【生产企业】
工艺验证报告
* * * *制药厂
1概述 * * * *胶囊的工艺验证是在厂房、设备、公用设施的验证合格后,按既定的验证方案,分别在011001、011101、011102连续生产的三批产品中进行。现将验证工作情况作以下报告。 2验证结果 2.1收料 2.1.1目的:确认该过程不影响原、辅料的质量。 2.1.2环境检查: (1)生产场所的洁净级别,温、湿度符合有关要求。 (2)设备及场所具有清场合格证。 2.1.3结论:经验证该过程可保证物料的质量不受影响,验证记录见附件1。 2.2粉碎、过筛工序 2.2.1目的:确认该工序能够得到细度合格的物料。 2.2.2环境检查: (1)生产场所的洁净级别,温、湿度符合有关要求。 (2)设备及场所具有清场合格证。 2.2.3结论:按方案进行验证,其结果表明该工序能够得到细度达140目 的原料细粉,验证记录见附件2。
2.3称量、配料工序 2.3.1目的:确认该过程能够保证物料的品种、数量符合要求。 2.3.2环境检查: (1)生产场所的洁净级别,温、湿度符合有关要求。 (2)设备及场所具有清场合格证。 2.3.3结论:经验证该过程能保证物料种类、数量的准确无误,验证记录 见附件3。 2.4制粒工序 2.4.1干混过程 2.4.1.1目的:确认该过程能够将物料混合均匀,并确定干混时间。 2.4.1.2环境检查: (1)生产场所的洁净级别,温、湿度符合有关要求。 (2)设备及场所具有清场合格证。 2.4.1.3结论:在环境、设备等符合要求的条件下,按方案进行操作,检 测结果表明:干混2min时,不同点取样,其主药含量测定值之间的RSD大于3%;干混3min和4min时,不同点取样,含量测定值之间的RSD均小于3%。检测结果表明方案中设定3min、4min时间均能使药物混合均匀,考虑到设备等影响因素,将此过程的干混时间定为3min,验证记录见附件4。 2.4.2制粒过程
氟苯尼考粉说明书 兽用处方药 【兽药名称】 通用名称:氟苯尼考粉 商品名称: 英文名称:F l o r f e n i c o l P o w d e r 汉语拼音:F u b e n n i k a oF e n 【主要成分】氟苯尼考 【性状】本品为白色或类白色粉末三 【药理作用】药效学 氟苯尼考属于酰胺醇类广谱抗菌药,对多种革兰氏阳性菌二革兰氏阴性菌及支原体等有较强的抗菌活性三氟苯尼考主要是一种抑菌剂,通过与核糖体50S亚基结合,抑制细菌蛋白质的合成三体外氟苯尼考对许多微生物的抗菌活性与氯霉素二甲砜霉素相似或更强,一些因乙酰化作用对氯霉素耐药的细菌,如大肠杆菌二克雷伯氏肺炎杆菌等仍可能对氟苯尼考敏感三溶血性巴氏杆菌二多杀性巴氏杆菌和猪胸膜肺炎放线杆菌对氟苯尼考高度敏感三 药动学 氟苯尼考内服吸收迅速,约1小时后血液中可达到治疗浓度,1~3小时即可达峰值血药浓度三生物利用度达80%以上三氟苯尼考在动物体内广泛分布,能透过血脑屏障三主要原药从尿排出,少量随粪便排出三 【药物相互作用】(1)大环内酯类和林可胺类与本品的作用靶点相同,均是与细菌核糖体50S 亚基结合,合用时可产生相互拮抗作用三 (2)可能会拮抗青霉素类或氨基糖苷类药物的杀菌活性,但尚未在动物体内得到证明三 【适应证】用于敏感细菌所致的猪二鸡及鱼的细菌性疾病三例如,溶血性巴氏杆菌二多杀性巴氏杆菌和猪胸膜肺炎放线杆菌引起的猪呼吸道感染,沙门氏菌引起的伤寒和副伤寒,鸡霍乱二鸡白痢二大肠杆菌病等;鱼类巴氏杆菌二弧菌二金黄色葡萄球菌二嗜水单胞菌二肠炎菌等引起的鱼类细菌性败血症二肠炎二赤皮病等三 【用法与用量】以本品计三内服:每1k g体重,猪二鸡0.2~0.3g三一日2次,连用3~5日三拌饵投喂:每1k g体重,鱼0.1~0.15g三一日1次,连用3~5日三 【不良反应】(1)本品高于推荐剂量使用时有一定的免疫抑制作用三 (2)有胚胎毒性,妊娠期及哺乳期家畜慎用三 【注意事项】(1)蛋鸡产蛋期禁用三 (2)肾功能不全患畜需适当减量或延长给药间隔时间三 (3)疫苗接种期或免疫功能严重缺损的动物禁用三 【休药期】猪20日,鸡5日;鱼375度日三 【规格】10% 1
生产工艺验证方案 验证名称验证方案编号医用外科口罩生产工艺验证方案DZ-GYYZ-002 药业有限公司
目录 1验证方案的起草与审批 验证方案的起草 验证方案的审核批准 2概述 3验证计划时间表 4人员与职责 5验证前的检查 6验证依据、取样方法及检验依据 验证依据 取样及检验依据 7验证内容 8偏差及变更处理 9验证总结
1验证方案的起草与审批验证方案的起草 验证方案名称医用外科口罩生产工艺验证方案验证方案编号DZ-GYYZ-002验证方案的审核批准 起草人起草日期 审核部门审核人审核日期 生产部 质量部 设备部 验证小组 批准部门批准人批准日期质量负责人 / 管代 2概述 医用外科口罩是我公司主要产品之一,其制作方法为:内外层面料采用丙纶纺粘无纺布材料,中间过滤层用BFE99(聚丙烯)熔喷无纺布材料,鼻夹采用镀锌铁丝、外皮为环保聚乙烯包胶材料,耳带采用涤纶低弹丝和氨纶材料,聚丙烯膜塑料袋等上述材料均应符合国家标准及行业标准。并严格按照材料限定的使用范围使用。该产品具有过滤颗粒物和细菌等特性,主要适用于临床各类人员在非有创操作过程中佩带,覆盖住使用者的口、鼻及下颌,为防止病原体微生物、颗粒物等的直接透过提供一定的物理屏障。 3、该产品工艺过程确定关键工序的情况: a.对成品的质量、性能、功能、寿命、可靠性及成本等有直接影响的工序; b.产品重要质量特性形成的工序; c.工艺复杂,质量容易波动,对工人技艺要求高或总是发生问题较多的工序。 根据以上定义公司目前生产的医用外科口罩产品生产过程的关键工序是开机调试、压合成型、耳带焊接和内包封口。 4、该产品工艺过程生产工艺流程图:
麦芽生产验证方案 文件编号:LT0402200山西振东道地药材部门:质量管理部题目:麦芽生产验证方案第1 页共6 页起草人:日期:审核人:日期:批准人:日期:生效日期:颁发部门:分发部门:变更记载:修订号:修订日期:批准日期:变更原因及目的:1 目的为保证麦芽炮制品生产工艺的可靠性,确定麦芽从原药材.成品炮制的各工艺参数符合确定的质量标准中各检测项目,我们特制定《麦芽工艺验证方案》,对麦芽工艺各环节进行评价。2 范围本方案适用于生产批量定量的前提下(20kg),饮用水系统.电力系统.设备验证合格后的中药饮片车间麦芽的生产工艺验证,同时对相关设备的性能进行验证及评价。3 职责车间工艺技术员:负责验证方案的起草及具体实施及判定炮制中各项技术指标是否符合要求。车间主任:负责验证工作的组织及协调。QC 负责人:负责验证方案中检验方法的审核及检验操作的准确执行。生产部负责人:负责验证方案的审核及监督实施。设备部负责人:负责验证过程中设备性能的验证和评价。质量部 QA 负责人:负责验证方案的审核及监督实施以及对炮制中各项技术指标是否符合要求进行复核性判定。总经理:负责验证方案的批准。4 内容 4.1 概述:
4.1.1 中药饮片车间竣工验收完成后,确认饮用水系统 . 电力系统符合设计要求;文件编号:LT0402200部门:质量管理部题目:麦芽生产验证方案第2 页共6 页生产设备符合工艺要求,且建立完善文件系统包括质量标准,岗位操作规程,设备操作规程。 岗位操作人员进行了相关的 GMP 培训;在 进行了各设备安装确认 . 运行确认 . 计量器具校验合格条件下,开始该项目的三 批工艺验证,以确定麦芽的生产工艺过程中的规范性 . 稳定性,保证在规定的条件下 始终如一地生产出质量可靠的中药饮片,现 制定了《麦芽工艺验证方案》。该生产工艺包括工艺条件.操作程序和设备使用三个方面,文件执行依据是《麦芽生产工艺规程》 .设备操作规程.维护保养 SOP.岗位操作 SOP.清洁SOP.批生产记录。工艺验证的目的是证明上述文件规定的工艺条件.操作程序.设备.原药材能适合生产环境的生产,能生产出符合质量要求的产品,并有良好的重现性及可靠性。我们把生产工艺流程划分为4 各单元操作,即:净制 . 发芽 . 干燥 . 包装。 每个单元操作作为一个验证小节,每项小节包括概述 . 执行文件 . 验证实施项目,验证
××××颗粒工艺验证方案 VA/J—0 /00 起草人:日期:年月日会签人: 固体制剂车间: 日期:年月日生产部: 日期: 年月日质量管理部:日期: 年月日批准人:日期:年月日
××××颗粒工艺验证方案(前处理) 1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。 生产技术总监:负责工艺验证方案及报告的批准。 验证小组: 组长:×××× 副组长:×××× 成员:×××××××× 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产工艺验证的产品批次为连续生产三批。
小儿感冒颗粒工艺验证方案 VA/J—0 /00 起草人:日期:年月日会签人: 固体制剂车间:日期:年月日生产部:日期:年月日质量管理部:日期:年月日批准人:日期:年月日
小儿感冒颗粒工艺验证方案(前处理) 1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。 生产技术总监:负责工艺验证方案及报告的批准。 验证小组: 组长:×××× 副组长:×××× 成员:×××××××× 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产工艺验证的产品批次为连续生产三批。
氟苯尼考粉(水产用) Fubinnikao Fen Florfenicol Powder 本品为氟苯尼考与淀粉等适宜基质配制而成。含氟苯尼考(C12H14C l2FNO4S)应为标示量的90.0%~110.0%。 【性状】本品为白色或类白色粉末。 【鉴别】(1)在含量则定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。 (2)取本品适量,加甲醇制成每1mL中约含氟苯尼考0.2mg的溶液,滤过,取滤液照紫外—可见分光光法(附录23页)测定,在266nm的波长处有最大吸收。 【检查】干燥失重取本品,在105℃干燥至恒重,减失重量不得过10.0%(附录69页)。 其他应符合粉剂项下的有关规定(附录12页)。 【含量测定】照高效液相色谱法(附录32页)测定。 色谱条件与系统适应性试验十八烷基硅烷键合硅胶为填充剂;以乙腈-水-冰醋酸(500:985:15)为流动相,检测波长为224nm。取氟苯尼考和甲砜霉素对照品,加流动相溶解制成每1ml中含氟苯尼考50μg和甲砜霉素30μg的混合溶液,取10ul注入液相色谱仪,记录色谱图,甲砜霉素峰和氟苯尼考峰的分离度不低于4.0,理论板数按氟苯尼考峰计算不低于2500。 测定法取本品约250mg,精密称定,置50mL量瓶中,加流动相适量,超声使溶解,并稀释至刻度,摇匀,滤过;精密量取5mL,置50mL量瓶中,用流动相稀释至刻度,摇匀,精密量取10μl,注入液相色谱仪,记录色谱图。另取氟苯尼考对照品,同法测定。按外标法以峰面积计算,即得。 【作用与用途】用于防治主要淡、海水养殖鱼类由细菌引起的败血症、溃疡、肠道病、烂鳃病,以及虾红体病、蟹腹水病。 【用法与用量】以氟苯尼考计。拌饵投喂:每1kg体重,鱼、虾、蟹10~15mg,一日1次,连用3~5日。 【不良反应】高剂量长期使用对造血系统具有可逆性抑制作用。 【注意事项】药饵不宜久置。
目录 1 概述 (1) 2 验证目的 (1) 3 适用范围 (1) 4 职责 (1) 5 验证人员 (1) 6 验证要求 (1) 7 验证工艺 (2) 8 工艺描述 (2) 9 取样计划及可接受标准 (5) 10 验证过程 (6) 11 验证结果与评价 (8) 12 偏差 (10) 13 稳定性试验 (10) 14 再验证[] (10)
1概述 1.1产品描述 1.2公司生产的*****为无菌原料药,其工艺验证主要为工艺过程的验证,包括 精制结晶、过滤洗涤烘干、包装和无菌生产验证,以及不溶性颗粒的控制。 1.3验证采用同步验证,取连续三批试生产批的数据利用制图(或表)统计分 析方法进行数据分析。 1.4本验证是在厂房设施验证、设备验证、设备清洗验证、工艺用水验证、无 菌生产验证已完成的基础上进行的。 2验证目的 通过验证证明*****无菌原料药的生产工艺处于控制状态,所有被定义为关 键工艺及控制参数范围已被验证,此工艺能恒定地生产出符合预先规定的质 量标准的产品。 3适用范围 适用于公司*****无菌原料药生产工艺的验证 4职责 4.1生产技术部负责验证方案和验证报告的起草、生产计划的安排(包括与各 部门的协调)。 4.2生产车间负责生产的进行和批生产记录的填写。 4.3质量管理部负责检验方法的验证和中间过程、产品的检测。 4.4验证工作组负责验证方案和验证报告的审核和批准。 5验证人员 姓名所在部门职务验证分工 6验证要求 6.1所有原辅料必须通过各个原辅料测试标准规定的所有项目 主要原辅料检测情况 原辅料名称产地批号质量标准检测结果检测报告编号结论备注 6.2所有仪器、仪表均校验合格,所有设备性能确认完好 6.2.1仪器、仪表校验情况
干燥工艺验证方案 方案编号: 验证方案审批 一、验证方案的起草 二、验证方案的审核 三、验证方案的批准 总经理:日期:
目录1.概述 2.验证目的 3.验证人员 4.验证围 5.验证使用文件 6.验证项目及容 6.1 确认容 6.2 验证指标 6.3 方法 6.4 取样 6.5 检验 6.6 结果 7. 再验证 8.验证报告 9.验证合格证
1.概述 1.1.干燥工序为中药饮片加工的常用工序,其工艺采用较常用的热风循环干燥法,较为 稳定,所得产品符合质量标准要求。为进一步证实干燥工艺的稳定性,采用3个品种的干燥作为干燥工序的验证,均属常用中药饮片,其生产工艺积累了我国传统饮片加工经验,产品工艺稳定,符合质量标准要求。 1.2.产品原辅料的供应商均经过严格的审核,能保证其供应的原辅料质量。 1.3.生产所用的设施、设备均已按照清洁规程进行清洁,结果符合验证要求。 1.4.生产所使用的关键设备已经过验证,符合该设备技术要求,详见设备验证文件; 1.5.生产工艺及工艺监控已有一定经验。 2.验证目的 依照饮片生产工艺规程,取3个代表品种各进行三批生产,对其9批干燥工序的工艺参数及产品质量进行统计分析,验证干燥工序的可行性和稳定性,保证该工序生产的产品质量。
4.验证围 干燥工艺过程中的工艺条件及产品性能的确认。 6.验证项目及容 6.1.干燥确认容 6.3.1.工艺条件:干燥工艺条件的可控性; 6.3.2.产品性能:干燥后各品种质量符合该品种《中间产品控质量监控规程》的规定值。 6.2.验证指标 6.2. 1.工艺指标:具体参数见下表。 6.2.2.质量指标 应符合各品种《中间产品质量标准》水分规定,水分不得过超过规定值,各品种水分具体质量指标见下表。
工艺验证方案 * ***制药厂
目录 1验证方案的起草与审批 1.1 验证方案的起草 1.2 验证方案的审批 2 概述 3验证人员 4时间进度表 5验证目的 6工艺流程图 7有关的文件 7.1 工艺规程 7.2 标准操作程序 7.3 质量标准 8 验证内容 8.1 收料 8.2 粉碎、过筛工序 8.3 称量、配料工序 8.4 制粒工序 8.4.1 干混过程 8.4.2 制粒过程 8.5 干燥工序 8.6 整粒工序 8.7 总混工序 8.8 胶囊填充工序
1 验证方案的起草与审批1.1验证方案的起草 1.2
2 概述 盐酸* * * *胶囊为本厂已生产多年的品种,目前搬到新厂房,采用新的设备、公用设施进行生产,为了保证产品质量,须对本品的生产工艺进行验证。 本方案采用同步验证的方式,因已具备以下条件: —生产及工艺条件的监控比较充分,工艺参数的适当波动不会造成工艺过程的失误或产品的不合格; —经多年生产,对产品工艺已有相当的经验及把握; —所采用的检验方法为中国药典规定的方法,可靠稳定。 本次验证是在新的厂房、设备、公用设施的验证合格的基础上对现行生产工艺过程的验证,计划在前三批产品的生产过程中实施。 3 验证人员 4 时间进度表 2001年11月6日至2001年11月25日 2001年11月26日至2001年11月27日 2001年11月27日至2001年11月28日5 验证目的完成各工艺因素验证数据汇总及分析完成工艺验证报告 通过对盐酸* * * *胶囊生产过程中存在的可能影响产品质量的各种工艺因素进行验证,证实在正常条件下,本品工艺处于控制状态,且能够稳定地生产出符合质量标准要求的产品。 6 生产工艺流程
氟苯尼考粉说明书 兽用 【兽药名称】 通用名:氟苯尼考粉 商品名: 英文名: Florfenicol Powder 汉语拼音:Fubennikao Fen 【主要成分】氟苯尼考。 【性状】本品为白色或类白色粉末。 【药理作用】药效学本品抗菌谱与抗菌活性略优于甲砜霉素,对多种革兰氏阳性菌、革兰氏阴性菌及支原体等有较强的抗菌活性。溶血性巴氏杆菌、多杀巴氏杆菌、猪胸膜肺炎放线杆菌对本品高度敏感,对链球菌、耐甲砜霉素的痢疾志贺氏菌、伤寒沙门氏菌、克雷伯氏菌、大肠杆菌及耐氨苄西林流感嗜血杆菌均敏感。药动学内服和肌内注射吸收迅速,血药浓度高,分布广泛,半衰期长,有效浓度维持时间长。猪内服吸收完全,即使在饲喂状况下吸收也较完全。内服生物利用度,猪109%、犊牛 88%、肉鸡55.3%,主要经肾排泄,犊牛静脉注射和内服后分别有50%和 65%的原药从尿排出。静脉注射本品半衰期,牛为2.6小时,猪为6.7小时,鸡为5.4小时;肌内注射半衰期,牛为18.3小时,猪为17.2小时。【适应证】防治猪、鸡敏感菌所致感染。 【用法用量】以氟苯尼考计。内服:每1 kg体重,猪、鸡20~30 mg。一 日2次,连用3~5日。 【不良反应】(1)本品有血液系统毒性,虽然不会引起不可逆的骨髓再生障碍性贫血,但其引起的可逆性红细胞生成抑制却比氯霉素更常见。(2)本品有较强的免疫抑制作用,约比氯霉素强6倍。(3)长期服用可引起消化机能紊乱,出现维生素缺乏或二重感染症状。(4)有胚胎毒性,妊娠期及哺乳期家畜慎用。 【注意事项】(1)蛋鸡产蛋期禁用。(2)肾功能不全患畜要减量或延长给药间隔时间。(3)疫苗接种期或免疫功能严重缺损的动物禁用。 【休药期】猪20日,鸡5日 【规格】20% 【贮藏】密闭,在干燥处保存。
一次性使用医用口罩(非灭菌)工艺验证方案 xxxxxxxxxx有限公司
目录 1 验证方案的起草与审批 验证方案的起草 验证方案的审核批准 2 概述 3 验证计划时间表 4 人员与职责 5 验证前的检查 6 验证依据、取样方法及检验依据验证依据 取样及检验依据 7 验证内容 8 偏差及变更处理 9 验证总结 10.验证合格标准 11.结果与评价 12.再验证周期 13.验证报告 14.验证审查与批准 1 验证方案的起草与审批 1. 1 验证方案的起草
验证方案的审核批准 2. 概述 一次性使用医用口罩(非灭菌)是我公司口罩生产车间产品之一,其制作方法为:内外层面料采用丙纶纺粘无纺布材料,中间过滤层用 BFE99(聚丙烯)熔喷无纺布材料,鼻夹采用镀锌铁丝、外皮为环保聚乙烯包胶材料,耳带采用涤纶低弹丝和氨纶材料,聚丙烯膜塑料袋等上述材料均应符合国家标准及行业标准。并严格按照材料限定的使用范围使用。该产品具有过滤颗粒物和细菌等特性,覆盖住使用者的口、鼻及下颌,为防止病原体微生物、颗粒物等的直接透过提供一定的物理屏障。 该产品工艺过程确定关键验证工序的情况: a.对成品的质量、性能、功能、寿命、可靠性及成本等有直接影响的工序; b.产品重要质量特性形成的工序; c.工艺复杂,质量容易波动,对工人技艺要求高或总是发生问题较多的工序。 根据以上定义一次性使用医用口罩产品生产过程的关键验证工序是开机调试、打板成型、耳带焊接和内包封口。 该产品工艺过程生产工艺流程图:
备注: 10 万级洁净区要求温度 18℃~26℃,湿度 45%~65%. 3 验证计划时间表 4 人员与职责 验证小组职责:负责承担具体验证项目的实施工作,包括验证申请、验证方案的起草、验证的实施、验证报告编写等工作。