
浙江大学医学院神经生物学实验室常用实验流程
目录
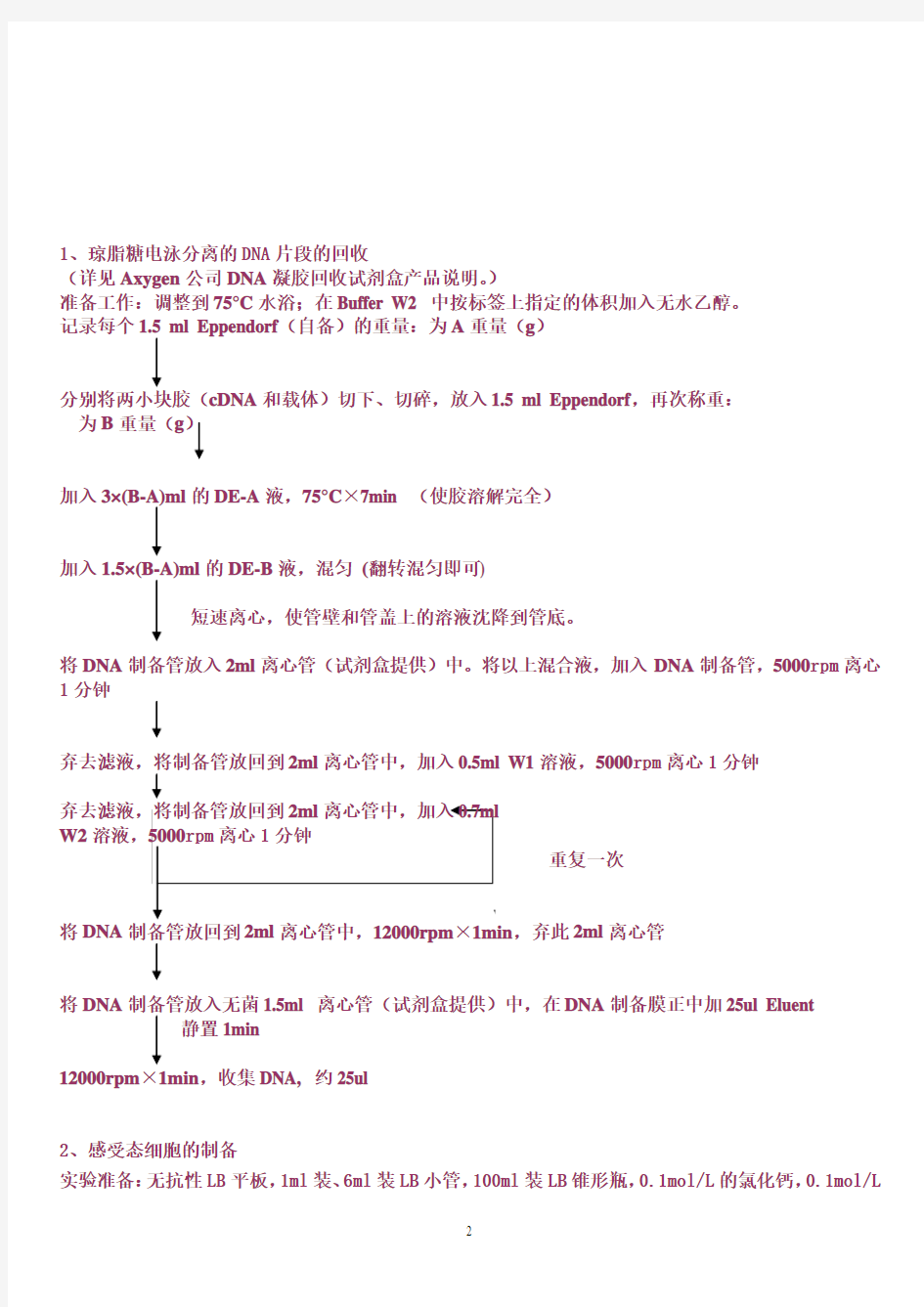
1、琼脂糖电泳分离的DNA片段的回收
2、感受态细胞的制备
3、DNA的转化
4、小量质粒DNA提取和纯化
5、中量质粒DNA提取和纯化
6、聚合酶链式反应操作(PCR)
7、点突变形成
8、诱导表达及检测
9、SDS-PAGE和WESTERN BLOT
10、免疫共沉淀(HEK293T细胞)
11、免疫组化
12、细胞培养注意事项及常用溶液配置方法
13、细胞传代培养(消化法)
14、细胞的复苏
15、细胞冻存
16、海马神经元原代培养
17、免疫细胞化学
18、HEK 293T细胞转染 (10cm培养皿)
19、磷酸钙介导的神经元转染
20 Co--IP
21 MBP-PICKI表达纯化
22 RNA提取步骤
补充磷酸钙转染
溶液配置
1、琼脂糖电泳分离的DNA片段的回收
(详见Axygen公司DNA凝胶回收试剂盒产品说明。)
准备工作:调整到75°C水浴;在Buffer W2 中按标签上指定的体积加入无水乙醇。
记录每个1.5 ml Eppendorf(自备)的重量:为A重量(g)
分别将两小块胶(cDNA和载体)切下、切碎,放入1.5 ml Eppendorf,再次称重:
为B重量(g)
加入3×(B-A)ml的DE-A液,75°C×7min (使胶溶解完全)
加入1.5×(B-A)ml的DE-B液,混匀(翻转混匀即可)
短速离心,使管壁和管盖上的溶液沈降到管底。
将DNA制备管放入2ml离心管(试剂盒提供)中。将以上混合液,加入DNA制备管,5000rpm离心1分钟
弃去滤液,将制备管放回到2ml离心管中,加入0.5ml W1溶液,5000rpm离心1分钟
W2溶液,
重复一次
将DNA,弃此2ml离心管
将DNA制备管放入无菌1.5ml 离心管(试剂盒提供)中,在DNA制备膜正中加25ul Eluent 静置1min
12000rpm×1min,收集DNA, 约25ul
2、感受态细胞的制备
实验准备:无抗性LB平板,1ml装、6ml装LB小管,100ml装LB锥形瓶,0.1mol/L的氯化钙,0.1mol/L
的氯化钙加15%的甘油,50ml离心管。
实验步骤:因为整个过程中没有使用抗生素所以要特别注意无菌操作!
1.铺无抗性的LB平板。为避免意外,一般铺两块无抗性LB平板。
2.用1ml的枪戳几下菌库中的菌种,使得枪头上带有少量冰渣。这个过程要迅速,避免菌种发生冻
融或污染。
3.将冰渣溶于1ml 37℃预热的LB中,充分混匀后,用枪吸取20ul转移至另一只装有1ml 37℃预热的
LB的 EP中,混匀后取100ul涂板。37℃孵育14个小时。观察菌落数量和相关理化特征,用封口膜密封4℃冻存。
4.用牙签挑取单克隆至4~6ml无抗性LB小管中260rpm 12小时(活化)。这一步可以多挑几个克隆,
以防其长不出来和有明显的污染。
5.取500ul菌液到100ml无抗生素的LB锥形瓶中300rpm 3小时。注意观察,控制菌的浓度在OD600时
不要超过0.6。
6.把100ml菌液分装在两只50ml离心管(已灭过菌)中,冰浴10分钟。
7.5000rpm、4℃离心10分钟,弃上清。离心机需要4℃预冷。
8.用0.1mol/l的氯化钙10ml重悬浮。徒手将50ml离心管反复戳于冰上从而使细菌重悬浮。因为感
受态细胞比较脆弱易破损,故重悬浮时不宜使用震荡仪。悬浮要充分!
9. 5000rpm、4℃离心10分钟,弃上清。
10.用0.1mol/L的氯化钙加15%的甘油2ml重悬浮。注意事项同8。
11.以200ul每管分装,分装后冻存于-80℃。注明制备日期和菌名。
注意事项:因为培养基无抗性,故无菌操作是整个感受态制备的关键。制备过程最好带上口罩,所有的用具需要充分灭菌。为了保证感受态的质量所有的步骤都需在冰上进行。
方法二:
做感受态细胞步骤:(材料要灭菌,并无菌冰上操作)
1,从-70度拿出库存的大肠杆菌,用划线涂布法接种于不加任何抗生素的基本培养皿上(取稀释之意,或拿1ml 枪头在冰上没融化的菌中浸一下,放入1ml LB 中,再吸20ul入另一个1ml LB中,再吸另一个的100ul铺板)37度倒置培养12-16小时(DH-5a)
2,挑一克隆于6ml不加任何抗生素的LB中,250r/min 37度,振12小时。培养皿挑好后放入4度冰箱
3,吸500ul 菌液于不加任何抗生素的LB 100ml 锥形瓶中,300r/min 37度,振3小时,然后把锥形瓶放在写有字的纸上,透过菌液可看清纸上的字,并测OD约为0.6(吸1ml),如果每到这个值就再大约摇半小时再测OD约为0.6就可以。
4,将两个50ml试管冰上预冷,再将培养液放入(倒入)其中,冰上10分钟。
5,7号转头4度5000 rpm 10分钟
6,弃干上清,扣干凉1分钟,再各加10ml 0.1mol/L CaCl2 (每50ml 菌液10ml CaCl2) (CaCl2不含甘油,从4度拿出在冰上预冷,用无菌移液管吸)
7,冰上轻旋摩擦开菌斑(要轻,并且所有内容物保持在冰中)之后再放在冰上30分钟。
8,4度4100 rpm 10分钟
9,弃上清,扣干凉1分钟
10,两管各加含甘油CaCl2 2ml (每50ml菌液加2ml甘油CaCl2) (其中15体积甘油Glycerol 85体积CaCl2, 从4度拿出在冰上预冷, 用枪吸), 再用同样的方法冰上轻旋摩擦开菌斑
11,在冰上分装100ul或200ml 的多个管子
12,-80度冷藏
3、DNA的转化
准备工作:制冰,42°C水浴,37°C摇床,37°C预热LB
自制的感受态细胞
加20ul 连接产物
冰上30 '
42 O C水浴90秒(热休克,时间要求精确)
冰上2'
加800ul LB(-) (预先37 O C预热)
摇床,37 O C 225转/分45分钟
400ul菌液涂平板,37 O C温箱中培养过夜
同时做两个对照:
对照组1: 以同体积的无菌双蒸水代替DNA溶液,其它操作与上面相同。此组正常情况下在含抗生素的LB平板上应没有菌落出现。
对照组2: 以同体积的无菌双蒸水代替DNA溶液,但涂板时只取5μl 菌液涂布于不含抗生素的
LB平板上,此组正常情况下应产生大量菌落。
计算转化率
统计每个培养皿中的菌落数。
转化后在含抗生素的平板上长出的菌落即为转化子,根据此皿中的菌落数可计算出转化子总数和转化频率,公式如下:
转化子总数=菌落数×稀释倍数×转化反应原液总体积/涂板菌液体积
转化频率(转化子数/每mg质粒DNA)=转化子总数/质粒DNA加入量(mg)
感受态细胞总数=对照组2菌落数×稀释倍数×菌液总体积/涂板菌液体积
感受态细胞转化效率=转化子总数/感受态细胞总数
[注意] 本实验方法也适用于其它E.coli受体菌株的不同的质粒DNA的转化。但它们的转化效率并不一定一样。有的转化效率高,需将转化液进行多梯度稀释涂板才能得到单菌落平板,而有的转化效率低,涂板时必须将菌液浓缩(如离心),才能较准确的计算转化率。
4、小量DNA提取和纯化
溶液配置:LB液体培养基(1000ml)
蛋白胨(tryptone) 10g
酵母提取物5g
NaCl 10g
调pH到7.2,高压灭菌
LB固体培养基
100ml LB+1.5g Agar B->灭菌;
感受态细胞制备过程中所需平板不需加抗生素,灭菌后LB可直接铺板;
若用于制作转化平板,需待LB自然冷却至50-60 o C,加入60μg/ml氨苄或30ug/ml卡那(实验室内氨苄和卡那浓缩液均为100mg/ml)后铺板。
挑克隆( 摇菌扩增)
1.从冰箱里取LB培养基和转化平板. 将氨苄青霉素取出后置于冰上自然融化
2.点燃酒精灯创造无菌圈. 取15ml培养管( 做好标记), 分别加入4ml液体LB培养基和4μl的
100mg/ml的氨苄青霉素, 使终浓度达到100μg/μl
3.用中号镊子夹取牙签从转化平板挑取单克隆, 迅速投入做好标记的15ml培养管中
4.将培养管盖子在酒精灯上烫一下, 将培养管盖上(注意无菌操作)
5.将15ml培养管置于300rpm 37 o C的摇床上培养12h (扩增)
(详见Axygen日常型质粒DNA小量纯化试剂盒)
准备工作:如果S2溶液出现沉淀,37℃水浴溶解沉淀后再使用(特别是冬天);将所有RNase A 加入到S1溶液中;在Buffer W2 中按标签上指定的体积加入无水乙醇;S3入4℃冰箱(冬天可以省略)。12500rpm×1min×1.5 ml eppendorf (自备)2次回收沉淀
每管(3ml菌液)以0.25ml含RNase A的S1溶液,使沉淀悬浮完全(votex)
每管加入0.25mlS2,上下翻转使菌液裂解,至形成透亮溶液(此步骤<5min,不得votex)
每管加入0.40ml S3(4℃),上下翻转,至凝集块完全产生
12,000rpm×10min
将DNA制备管放入2ml离心管中。将上清加入DNA制备管,5,000rpm离心1分钟
弃去滤液,将制备管放回到2ml离心管中,加入0.5ml W1溶液,5000rpm离心1分钟
W2溶液,
重复一次
将DNA,弃此2ml离心管
将DNA制备管放入无菌1.5ml 离心管(试剂盒提供)中,在DNA制备膜正中加60ul Eluent 静置1min
12000rpm×1min,收集DNA, 约60ul
5、中量质粒DNA提取和纯化
天平,预冷离心机,三蒸水; 预冷P3
1.将菌液倒入EP管, 配平离心, 4 o C 6,000g, 离心15min倒掉上清(主菌斑足够);
2.加入4ml P1(从冰箱中取出), 用振荡器重悬细菌;
3.加入4ml P2(P2在冬天可能有沉淀, 应37 o C温浴), 温和但充分翻转4-6次(快而充分的混匀),室温
静置5min;
4.加入4ml预冷的P3, 温和但充分翻转4-6次, 冰上静置15min;
5.4 o C 20,000g离心30min, 迅速转移上清至另一50ml EP中;
6.4 o C 20,000g离心15min;
7.期间平衡柱子, 4mlBuff QBT至QLAGEN-tip100, 重力自然流尽;
8.将离心好的上清加入QBT至QLAGEN-tip100, 重力自然流尽;
Note: 为避免白色沉淀倒入柱中, 应在倒上清时缓慢旋转EB管,使飘浮的白色沉淀贴在EP管壁上
9.10ml buffer QC灌洗QLAGEN-tip100;
10.重复;
11.取一个7ml管放于柱下, 5ml buffer QF洗脱DNA;
12.另取一个7ml管, 将5ml溶液分别装入两管( 如不分,下一步加完后会超过7ml);
13.每管加入1.75ml室温下保存的异丙醇(混匀), 沉淀DNA;
14.换离心机转子, 4 o C 15,000g离心30min, 小心弃去上清( DNA沉淀有可能悬浮在液体中, 千万不要
将管中的DNA沉淀倒掉);
15.期间准备2ml 70%乙醇;
16.每管加1 ml 70%乙醇清洗DNA沉淀. 4 o C 15,000g离心10min, 小心弃去上清;
17.倒扣风干5-10min. 每种质粒加TE( Ph=8.0) 或无菌水60-100μl( 视菌斑大小)重溶DNA;
18.每种质粒取1μl, 稀释至100μl, 测OD值。
6、聚合酶链式反应操作(PCR)
实验准备:
灭菌的PCR管(0.2 ml);灭菌的10μl、250μl枪头;一对引物;4 种三磷酸脱氧核苷酸混合物(dNTP):模板; DNA Taq酶;10×PCR反应缓冲液(PCR Buffer)
实验步骤:
1.在PCR管中依次混匀下列试剂
5μl 10×PCR Buffer(含有Mg2+)
8μl dNTP (终浓度200-400uM/L)
2μl 引物1(10μM) (终浓度0.5-5.0uM/L)
2μl 引物2(10μM)
1μl 模板(0.2-1.0ug)
O
31μl ddH
2
1μl Taq 酶(2.5U)
50ul反应体系
注意:整个加样过程要在冰上操作,并且要特别注意,避免污染。
2.加样完毕混匀后迅速离心数秒,使管壁上液滴沈至管底,
3.DNA扩增仪条件设置:
95℃×5 min;使得DNA模板完全解链
95℃×1 min;变性
56℃×1 min;退火
注意:退火温度取决于所设计引物的Tm值,尽可能控制引物的(G+C)%在40-60%,并且两条引物的(G+C)%尽可能保持一致,退火时间根据模板长度设定。
72℃×1 min;延伸
注意:延伸的时间要根据模板设定。
go to step 2,for 30 circles;循环
72℃×10 min;补齐
4℃ forever
End
注意:由于现在可供选择的Taq酶很多,要根据自己的实验选择合适的Taq酶,比如要拉长片段的产物要选用保真度高以及能够拉长片段的酶,可以用LA Taq,Pyrobest酶;一般情况可以选用rTaq酶等等。
7、点突变形成
1.引物长度为在突变位点左右12-15BP,总长度为30-40BP,GC比大于40%,两边以G或C结
尾。根据经验,引物总长度短些更好,模版DNA必须为新鲜刚抽提的。
2.
5 μl of 10× KOD-Plus reaction buffer
5 μl of dNTP 2mm each
2 ul MgSO4
1 μl 35 ng of dsDNA template(5–50 ng)
1 μl (125 ng) of oligonucleotide primer #1
1 μl (125 ng) of oligonucleotide primer #2
34 ul ddH2O
1 μl of KOD-Plus
a final volume of 50 μl
Segment Cycles Temperature Time
1 1 95°C 30 seconds
2 X 95°C 30 seconds
55°C 1 minute(55°C-- 50°C<先用55℃退火,如果PCR没有得到条带可再降低温度至50 68°C 7 minute (1 minute/kb of plasmid length)
https://www.doczj.com/doc/6314640172.html,/experiment/mob19/185839.shtml
3.切胶回收(由于突变所用引物比较长,必须切胶回收去掉引物二聚体)
4.酶切去除没有突变的模板质粒:
Dpn1 1ul
10× Tango buffer 5ul
50ul体系
37℃保温 1 hour
5.切胶回收
6.转化铺板
8、蛋白质诱导表达及检测
挑一克隆到5ml LB 试管中
摇床,37 O C 280转/分(过夜)
用无菌吸管转移200ul 菌液
摇床,37 O C 280转/分至OD=0.6
(约2-3 h)
加入0.5mM的IPTG诱导表达2小时(即加3ul/管)
↓
菌液转移到离心管中,12,000rpm离心2分钟
↓
弃上清,沉淀加入1.5?上样缓冲液,混合均匀,沸水中煮5分钟,12,000rpm离心10min
↓
聚丙烯酰胺凝胶电泳
↓
考马斯亮兰染色
↓
用40%及20%脱色液脱色
9、SDS-PAGE和WESTERN BLOT
SDS-聚丙烯酰胺凝胶电泳
制胶模具的准备(根据厂家说明书,本实验室的模具购自Bio-Rad公司)
?
分别灌制分离胶和浓缩胶,分离胶浓度视目的蛋白的大小确定(7.5 - 15 %)
?
蛋白样本加入4×加样缓冲液,100℃煮3-5 min使蛋白完全变性,然后加样
?
100-200 V电泳使分离
?
卸胶,考马斯亮兰染色或Western Blot
Western Blot
取硝酸纤维素膜或PVDF膜,盖在凝胶上,电转移1-3小时(电压100V)
(转移时间由抗原的特性以及转移缓冲液中SDS的含量而定,一般为1小时)
胶为负极,膜为正极
?
取出硝酸纤维素膜或PVDF膜,在TBST缓冲液中短暂漂洗
?
放入封闭液中,温和振荡30分钟
?
把膜放入第一抗体中,温和振荡30分钟后放入4℃冰箱过夜或室温下反应2小时
?
回收第一抗体,在TBST中洗膜30分钟,中间更换TBST 2-3次
?
把膜置于近红外染料标记的二抗(1:5000,用封闭液稀释,并可在4℃避光保存重复使用)中,温和
振荡1-2小时(闭光)
?
在1×TBST中洗膜2-3小时,中间更换4次以上(闭光)
?
沥干膜(干燥状态下,闭光保存可使膜上的荧光信号保持数月甚至更久)
?
扫描(根据特定的红外染料标记的二抗选择700或800nm的Odyssey channel)
?
定量
扫描和定量在Odyssey荧光成像系统(LI-COR Biosciences, USA )中进行。
SDS-PAGE及Westerb-blot常用溶液配制:
4
Stacking Gel Preparation (0.4% gel, 0.125 Mtris, pH 6.8)
考马斯亮兰:
0.1 % 考马斯亮兰+40 %脱色液
40 %脱色液:40 %甲醇+10 %冰乙酸
20%脱色液:20%甲醇+10%冰乙酸
5×running buffer
Tris 15 g
SDS 5 g
甘氨酸72 g ---------1 L,pH 8.3
Transfer buffer
Tris 3.03 g
甘氨酸14.4 g
10 % SDS 5 ml
甲醇200 ml ------------1 L,pH8.1-8.5
10×TBST
Tris 30.3 g
NaCl 80.1 g -----调pH至7.6 +10 ml Tween-20 ---- 1 L
Blotting buffer: 10%脱脂奶粉-TBST
10、免疫共沉淀(HEK293T细胞)
HEK传代转染
1.第1天HEK传代:4ml 培养液重悬细胞,滴8滴到60mm培养皿,4ml 培养液传代。
2.第2天磷酸钙法转染(ddH2O,质粒,HEPES,CaCl2体积均提高3倍)。
3.第4天co-IP。
Co-IP
1.准备:
Aprotinin 1000X 储存液: 1mg Aprotinin,1ml H2O,分装,–20C保存
PMSF 1000X储存液:8.7mg PMSF,500ul无水乙醇,4C保存
1:1 slurry pre-cleaned Protein-A (or G) beads:1:1为体积比,配置时大约是100mg粉末+1000ul ddH2O,4C存放
2. 新鲜配置4ml PBS/1%TritonX-100 plus Aprotinin and PMSF per IP sample,放于冰上。
3. 取25-50 ul 1:1 slurry pre-cleaned Protein-A beads,500 ul PBS洗两遍(2000rpm,2min)
4. 每25-50ul珠子加入10-20ug抗体,加PBS到500 ul,4C下旋转孵育1h
5. 期间取出细胞,观察细胞状态,如有荧光还可在荧光显微镜下观察转染效率。
6. 倒去原培养液,用室温下的PBS洗细胞两次,每次2ml PBS,最后一次洗后尽量将残液吸尽。
7. 用1ml PBS/1%TritonX-100 plus Aprotinin and PMSF刮下细胞。
8.将细胞转移到7ml EP管中,4C下旋转孵育30min-1h促溶。
9. 孵育后4C下14000rpm离心20min。
10. 期间取出孵育好的珠子/抗体,2000rpm离心2min,500 ul PBS/1%TritonX-100 plus Aprotinin and
PMSF 洗一次。
11.从第9步的上清中取出22.5ul,加7.5ul 4×sample buffer做为input样本。
12. 将其余上清(小心用枪吸出上清)加入珠子/抗体重悬珠子,4C下旋转孵育2h或过夜。
13. 2000rpm离心2min,吸弃上清。
13. 珠子用500ul PBS/1%TritonX-100 plus Aprotinin and PMSF洗1次,PBS/1%TritonX-100 plus Aprotinin and PMSF+500mM NaCl洗2次,PBS洗2次。
14. 最后一次洗后尽量吸尽上清,加入30ul 2X sample buffer。
15. 100C煮5min,2000rpm离心2min,转移30ul上清到另一离心管中,-20C保存待做western。
SDS-PAGE
注意事项:
1. 10孔梳子,样品每孔上15ul。
2. 上样时marker道在中间,左右两侧对称上样。
Western Blot
注意事项:
1. 转膜后从中间marker处将膜切成两半,一半用IB一抗检测,一半用IP一抗检测。
11、免疫组化
1. 冷冻切片、涂片、印片或培养细胞等材料4%PF固定20分钟
2. 0.01mol/L,pH 7.4 PBS洗3次,每次10min。
3 triton透膜15min(表面染色不用此步骤)
4. 封闭液封闭30min
5. 滴加经适当稀释的一抗,湿盒4度过夜
6. PBS洗3次,每次10min。
7. 滴加荧光标记二抗,置湿盒,室温或37℃,1-2小时。
8. PBS洗3次,每次10min
9. 50%甘油(0.5mol/L,pH 9.0碳酸盐缓冲液配置,其实用单蒸水配制就好用,浓度随着环境温度适当调整)封片。
10. 荧光镜下观察,拍照。
ABC法
1. 材料:冷冻切片或石蜡切片等。
2. 去内源性酶。
3 10%正常羊血清,室温,15min。
4. 适当稀释的一抗,室温,15-60min。
5. PBS洗3次,每次5-10min。
6. 加生物素标记的二抗,室温,30min。
7. PBS洗3次,每次5-10min。
8. 加ABC复合物,室温,30min。
9. PBS洗3次,每次5-10min。
10.加底物显色,衬染,封片。
冰冻切片:
1、4%多聚甲醛固定组织(一般采用灌注固定)4h以上;
2、30%蔗糖脱水至组织沉底;
3、放入冰冻切片机速冻;
4、冰冻切片10-20um,用APES或多聚赖氨酸处理的玻片贴片;
HE染色:
石蜡切片先作以下处理:
石蜡切片脱蜡步骤(石蜡切片做免疫组化和原位杂交前处理):
1、二甲苯50℃1小时
2、二甲苯常温30分钟
3、100%酒精2分钟
4、95%酒精2分钟
5、85%酒精2分钟
6、75%酒精2分钟
7、蒸馏水冲两次
8、原位杂交或免疫组化步骤,HE染色
HE染色步骤:
1、1g苏木精倒入小烧杯—10ml乙醇,大烧杯加20g硫酸铝钾---200ml水加热溶解,将上述二者混合,烧开后,立即将其放入冷水中,同时倒入0.5g黄色氧化汞-----冷却后过滤即可
2、分色液:70%酒精90ml+ 冰醋酸10ml(数分钟,至颜色适当即可)
3、95%酒精99ml+伊红1g(片刻)
4、95%酒精2缸每次30秒内
5、100%酒精2-3缸每次30秒内
6、100%二甲苯3缸第一缸10分钟,第二、三缸各五分钟
7、封片
(一)苏木素----伊红染色剂:
苏木素2克
100%酒精100ml
甘油100ml
冰酸酸10ml
钾明矾3克
蒸馏水100ml
将苏木素溶于酒精中,再加甘油和冰醋酸,把钾明矾在研钵内研成粉末,溶于蒸馏水,倾入苏木素液,用玻璃棒搅匀,混合液为淡红色,即成熟,此液可长期保存。
(二)Mager氏苏木素液:
苏木素1克
碘酸钠0.2克
钾明矾50克
水合氯醛50克
蒸馏水1000ml
柠檬酸1克
将苏木素及碘酸钠用蒸馏水加温溶解,呈樱桃红色,再加入钾矾, 使溶液变为兰紫色,煮沸5min后,再加入水合氯醛搅拌,此时液体变为红紫色,溶解完后加入柠檬酸,取下冷却,滤过后即可使用。此液能长久保存。
(三)Harris氏苏木素液:
苏木素0.9克铵明矾(或钾)20克
甲液无水酒精10ml 乙液蒸馏水200ml
一氧化汞0.5~1克
甲、乙两液分别溶解,然后两液混合,加热熬沸,再加入一氧化汞, 以玻棒搅至溶液呈深紫色,置于凉水中急速冷却,静置一夜后,滤过密封保存。用前若加入少许5%冰醋酸,则染色效果更好。此液经2~3个月后,着色力减退,故宜少配。
(四)伊红染液:
伊红染料有水溶性和酒精性两种,伊红Y为水溶性的。
1.伊红水溶液:
伊红Y 0.5克
蒸馏水100ml
或
伊红Y 0.5克
蒸馏水100ml
95%酒精25ml
2.伊红酒精液:
伊红0.5克
80%酒精100ml
3.分化液:盐酸1ml加入70%酒精99ml即成。
12、传代细胞的常规培养
12.1无菌操作注意事项:
1.凡是带入超净工作台内的酒精、PBS、培养基、胰蛋白酶的瓶子均要用75%酒精擦拭瓶子的外表面
2.靠近酒精灯火焰操作。
3.器皿使用前必须过火灭菌
4.继续使用的器皿(如瓶盖、滴管)要放在高处,使用时仍要过火。
5.各种操作要靠近酒精灯,动作要轻、准确,不能乱碰。如吸管不能碰到废液缸。
6.吸取两种以上的使用液时要注意更换吸管,防止交叉污染。
12.2器械的清洗和消毒
一、新的玻璃器皿的洗消:
1.自来水刷洗,除去灰尘。
2.烘干。
3.泡酸、清洗:用清洁液(重铬酸钾120g:浓硫酸200ml:蒸馏水1000ml)浸泡12小时,然后从酸缸内捞出器皿用自来水冲洗15次,最后蒸馏水冲洗3-5次和用双蒸水过3次。
4.烘干、包装:洗干净后先烘干,然后用牛皮纸(油光纸)包装。
5.高压消毒:包装好的器皿装入高压锅内盖好盖子,打开开关和安全阀,当蒸气成直线上升时,关闭安全阀,当指针指向15磅时,维持20-30分钟。
6.高压消毒后烘干
二、旧的玻璃器皿的洗消:
1.刷洗、烘干:使用过的玻璃器皿可直接泡入来苏尔液或洗涤剂溶液中,泡过来苏尔溶液(洗涤剂)的器皿要用清水刷洗干净,然后烘干。
2.泡酸、清洗:烘干后泡入清洁液(酸液),12小时后从酸缸内捞出器皿立即用自来水冲洗15次(避免蛋白质干涸后粘附于玻璃上难以清洗),再用蒸馏水冲洗3次。
3.烘干、包装:洗干净的器皿烘干后取出用牛皮纸(油光纸)等包装,以便于消毒储存及防止灰尘和再次被污染。
4.高压消毒:包装好的器皿装入高压锅内,盖好盖子,打开开关和安全阀,随着温度的上升安全阀冒出蒸气,当蒸气成直线冒出3-5分钟后,关闭安全阀,气压表指数随之上升,当指针指向15磅时,调节电开关维持20-30分钟即可。(玻璃培养瓶消毒前可将胶帽轻轻盖上)
5.烘干备用:因为高压消毒后器皿会被蒸气打湿,所以要放入烤箱内烘干备用。
三、载玻片的清洗:
1.将载玻片搓成一片片的,放在玻璃烧杯内。
2.泡酸,过夜。
3.将酸倒掉,用自来水冲洗10分钟,直到无色。
4.用双蒸水冲洗,在摇床上摇,每半小时换一次水。
5.换10次水后,用75%的酒精洗两次,最后用无水乙醇洗一次。
6.在95%的酒精中浸泡。
四、金属器械洗消:
金属器皿不能泡酸,洗消时可先用洗涤剂刷洗,后用自来水冲干净,然后用75%酒精擦拭,再用自来水,然后用蒸馏水冲洗,再烘干或空气中晾干。放入铝制盒内包装好在高压锅内15磅高压(30分钟)消毒,再烘干备用。
12.3细胞培养用液的配制与消毒
器材与试剂:
干粉型培养基、胰蛋白酶,青霉素、链霉素. 纯净水系统、电子天平、PH计、磁力搅拌器。
具体步骤:
一. 水的制备:
细胞培养用水必须非常纯净,不含有离子和其它的杂质。需要用新鲜的双蒸水、三蒸水或纯净水
二.PBS的制备与消毒(也可用于其它BSS,如:Hanks,D-Hanks液的配制):
1.溶解定容:将药品(NaCl 8.0g,KCl 0.2g,Na2HPO4·H2O 1.56g,KH2PO4 0. 24g )倒入盛有900ml 双蒸水的烧杯中,玻璃棒搅动,调节PH值7.0-7.2,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的PBS溶液。
2.移入溶液瓶内待消毒:将PBS倒入溶液瓶(大的吊针瓶)内,盖上胶帽,并插上针头放入高压锅内8磅消毒30分钟。
D-Hanks的配制:
1.溶解定容:将药品(NaCl 8.0g,KCl 0.4g,Na2HPO4 ﹒2H2O 0.06g,KH2PO4 0.06g ,NaHCO3 0.35g,酚红 0.02g)倒入盛有900ml双蒸水的烧杯中,玻璃棒搅动,调节PH值到7.0-7.2,然后把溶液倒入容量瓶中准确定容至1000ml,摇匀即成新配制的溶液。
2.移入溶液瓶内待消毒:将D-Hanks倒入溶液瓶(大的吊针瓶)内,盖上胶帽,并插上针头放入高压锅内8磅消毒30分钟
三. 胰蛋白酶溶液的配制与消毒:
胰蛋白酶的作用是使细胞间的蛋白质水解从而使细胞离散。不同的组织或者细胞对胰酶的作用反应不一样。胰酶分散细胞的活性还与其浓度、温度和作用时间有关,在pH为8.0、温度为37℃时,胰酶溶液的作用能力最强。使用胰酶时,应把握好浓度、温度和时间,以免消化过度造成细胞损伤。因Ca2+、Mg2+和血清、蛋白质克降低胰酶的活性,所以配制胰酶溶液时应选用不含Ca2+、Mg2+的BSS,如:D-Hanks液。终止消化时,可用含有血清培养液或者胰酶抑制剂终止胰酶对细胞的作用。
1.称取胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂溶入小烧杯中的双蒸水(若用双蒸水需要调PH到7.2左右)或PBS(D-hanks)液中。搅拌混匀,置于4℃内过夜。
2.用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器(0.22微米微孔滤膜)抽滤除菌。然后分装成小瓶于-20℃保存以备使用。
注:EDTA溶液对细胞连接结构Ca可螯合,组织分离时 0.25% 胰酶:0.02%EDTA=1:1
附:EDTA(0.02%乙二胺四乙酸二钠)消化液配方:
EDTA 0.20g,用D-Hanks定容至1000ml。10磅20min高压灭菌,使用时调节PH值到7.4。注意EDTA 不能被血清中和,使用后培养瓶要彻底清洗,否则再培养时细胞容易脱壁。
四.谷氨酰胺:
合成培养基中都含有较大量的谷氨酰胺,其作用非常重要,细胞需要谷氨酰胺合成核酸和蛋白质,谷氨酰胺缺乏要导致细胞生长不良甚至死亡。在配制各种培养液中都应该补加一定量的谷氨酰胺。由于谷氨酰胺在溶液中很不稳定,4℃下放置1周可分解50%,故应单独配制,置于-20℃冰箱中保存,用前加入培养液。加有谷氨酰胺的培养液在4℃冰箱中储存2周以上时,应重新加入原来的谷氨酰胺。一般培养液中谷氨酰胺的含量为1~4mmol/L。可以配制200mmol/L谷氨酰胺液贮存,用时加入培养液。配制方法为,谷氨酰胺2.922g溶于三蒸水加至100ml即配成200mmol/L的溶液,充分搅拌溶解后,过滤除菌,分装小瓶,-20℃保存,使用时可向100ml培养液中加入1ml谷氨酰胺溶液。
13、细胞传代培养(消化法)
具体操作:
一. 传代前准备:
1.预热培养用液:把已经配制好的装有培养液、PBS液和胰蛋白酶的瓶子放入37℃水浴锅内预热。
2.用75%酒精擦拭经过紫外线照射的超净工作台和75%的酒精擦拭双手。
3.正确摆放使用的器械:保证足够的操作空间,不仅便于操作而且可减少污染。
4.点燃酒精灯:注意火焰不能太小。
5.准备好将要使用的消毒后的空培养瓶。
6.取出预热好的培养用液:取出已经预热好的培养用液,用酒精棉球擦拭好后方能放入超净台内。
7.从培养箱内取出细胞:注意取出细胞时要旋紧瓶盖,用酒精棉球擦拭显微镜的台面,再在镜下观察细胞。
8.打开瓶口:将各瓶口一一打开,同时要在酒精灯上烧口消毒。
9.准备灭菌的巴斯德管过火后待用。
二.胰蛋白酶消化:
1.加入消化液:小心吸出旧培养液,用PBS清洗(冲洗),加入适量消化液(胰蛋白酶液),注意消化液的量以盖住细胞最好,最佳消化温度是37℃。
2. 显微镜下观察细胞:倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度。
3.吸弃消化液加入培养液:弃去胰蛋白酶液,注意更换吸管,加入新鲜的培养液。
三.吹打分散细胞:
1.吹打制悬:用巴斯德管将已经消化细胞吹打成细胞悬液。
2.吸细胞悬液入离心管:将细胞悬液吸入15ml离心管中。
3.平衡离心:平衡后将离心管放入台式离心机中,以1000转/分钟离心5分钟。
4.弃上清液,加入新培养液:弃去上清液,加入2ml培养液,用滴管轻轻吹打细胞制成细胞悬液。
四.分装稀释细胞:
1.分装:将细胞悬液吸出分装至2-3个培养瓶中,加入适量培养基旋紧瓶盖。
2.显微镜下观察细胞:倒置显微镜下观察细胞量,必要是计数。注意密度过小会影响传代细胞的生长,传代细胞的密度应该不低于5×105/ml。最后要做好标记。
五.继续培养:
用酒精棉球擦拭培养瓶,适当旋松瓶盖,放入CO2培养箱中继续培养。传代细胞2小时后开始贴附在瓶壁上。当生长细胞铺展面积占培养瓶底面积25%时为一个+,占50%为++,占75%时为+++。
传代细胞培养注意事项:
1.严格的无菌操作
2.适度消化:消化的时间受消化液的种类、配制时间、加入培养瓶中的量等诸多因素的影响,消化过程中应该注意培养细胞形态的变化,一旦胞质回缩,连接变松散,或有成片浮起的迹象就要立即终止消化。
14、细胞的复苏
细胞复苏的原则-快速融化:必须将冻存在-196℃液氮中的细胞快速融化至37℃,使细胞外冻存时的冰晶迅速融化,避免冰晶缓慢融化时进入细胞形成再结晶,对细胞造成损害。
具体操作
一. 实验前准备:
1.将水浴锅预热至37℃
2.用75%酒精擦拭紫外线照射30min的超净工作台台面。
3.在超净工作台中按次序摆放好消过毒的离心管、巴斯德管、培养瓶等等。
二.取出冻存管:
1.根据细胞冻存记录按标签找到所需细胞的编号。
2.从液氮罐中取出细胞盒,取出所需的细胞,同时核对管外的编号。
三.迅速解冻:
1.迅速将冻存管投入到已经预热的水浴锅中迅速解冻,并要不断的摇动,使管中的液体迅速融化。
2.约1-2min后冻存管内液体完全溶解,取出用酒精棉球擦拭冻存管的外壁,再拿入超净台内。
3.将冻存的细胞悬液吸到15ml离心管中。
四.平衡离心:
平衡后,放入离心机中1000r/min 离心5min
五.制备细胞悬液:
1.吸弃上清液。
2.向离心管内加入2ml培养液,吹打制成细胞悬液,种植在培养瓶中。
六..培养细胞
将符合细胞计数要求的细胞悬液分装入培养瓶内,将培养瓶放入37℃和5%CO2的培养箱内2-4小时(或者24-48小时)后换液继续培养培养,换液的时间由细胞情况而定。
初学者易犯错误:
1水浴锅未预热或者未预热到37℃。
2.水浴锅内冻存管太多,导致传热不佳,使融化时间延长。
3.离心前忘记平衡,导致离心机损坏和细胞丢失。
15、细胞冻存
实验前准备:
1.冻存液的配制基础培养基:胎牛血清:DMSO=7:2:1
2.37℃完全培养液预热。
3.细胞冻存前24-48小时内传代培养,使细胞处于指数生长期。
具体操作:
1.将细胞消化后,离心收集细胞,用冻存液重新悬起细胞。
2.先将冻存管放入4℃冰箱,约30min。
3.接着置于-20℃冰箱,约30-60min。
4.置于-80超低温冰箱中放置过夜。
5.置于液氮罐中长期保存。
6同时做好冻存记录,在自己的笔记本和冻存记录本上均要记录。
注意事项:
1.使用DMSO前,不需要进行高压灭菌,它本身就有灭菌的作用。高压灭菌反而会破华它的分子结构,以至于降低冷冻保护效果。在常温下,DMSO对人体有害,故在配制时最好戴上手套操作。
2.不宜将冻存细胞放置在0℃~-60℃这一温度范围内过久,低温损伤主要发生在这一温度区内,是“危险温区”。
16、海马神经元原代培养
准备工作:
1)冰盒,解剖工具(1把大剪刀,1 把镊子,2把尖嘴弯镊),100mm dish 2个,15ml tube 1只,60mm dish 4-5个,细胞计数板,timer,塑料袋(装动物尸体)。
2)60mm dish每个放3ml左右EBSS置冰上, 1个100mm dish 加入20ml左右EBSS置冰上,15ml tube 加入13ml左右HBSS置冰上。取1管-20?C保存的trypsin(500ul)放置冰上溶解。
3)打开37?C水浴,预热trituration media(DMEM+10%HS+1%P/S)和培养液(48.5ml NB+2%B27+1%P/S+125μl GluMax)
解剖:
1)从动物房拿怀孕18天母鼠,喷洒70%酒精消毒,剪开腹腔,取出子宫,放入1个100mm dish。2)剪开子宫,取出胎鼠,剪下头,放入加有EBSS的100mm dish.
3)取两把尖嘴弯镊,1把夹住眼窝,固定大脑,另1把镊子沿中轴纵向撕开头皮和头盖骨,用镊子在顶部稍加挤压,取出整个大脑,腹部朝上放入装有EBSS的60mm dish中,每个dish装2到3个大脑。
4)在解剖显微镜下,分离大脑半球,剔除脑膜,取出海马,放入装有13ml HBSS 的tube。
原代培养:
1)在超净工作台,吸出多余HBSS,剩 4.5ml HBSS,加0.5ml 5% trypsin.
2)37?C水浴消化15min, 隔5分钟左右上下颠倒管子,使海马分离。
3)同时从培养箱中取出事先coat了P-L-L的dish,吸干P-L-L,加入4ml 培养液,放回培养箱平衡。
4)消化结束后加入0.5ml FBS。
5)1000 rpm室温离心5min.
6)取2只1.5ml tube, 每只加1ml trituration media。
7)小心取出离心沉淀,加入1.5 ml tube,静置片刻,吸出沉淀放入另一1.5ml tube中。
8)用1ml 加样枪轻轻吹打15次左右,静置片刻,小心取出细胞悬液到15ml tube中。
9)细胞沉淀加1ml trituration media,吹打5次左右,静置片刻,取出细胞悬液合并到15ml tube 中
10)混匀细胞悬液,取10ul细胞悬液加90ul trituration media,细胞计数。
11)取一定量的细胞,按不同浓度种植到60mm dish中,混合均匀加5ul glutamate,培养箱培养。12)每隔4到5天半量换液。
17、免疫细胞化学
1.用PBS洗细胞一次
2.用4% Paraformaldehyde/4% Sucrose in PBS室温固定20mins
3.用0.2% TritonX-100 in PBS室温透膜10mins
4.用PBS洗细胞一次
5.用10% BSA in PBS室温封闭1hr
6.一抗室温作用1hr或4度过夜
7.用PBS洗细胞3次,每次5 min
8.二抗室温作用1hr
9.用PBS洗细胞3次,每次5 min
10.封片
11.将封好的片子在37C放置1hr或者室温过夜使片子干燥,然后显微镜下观察
18、HEK 293T细胞转染 (10cm培养皿)
取一1.5ml离心管A,加入DNA 5ug和无菌水,使其总体积到450ul
往A管中加入50ul CaCL2(2.5M),混合均匀
取一1.5ml离心管B,加入500ul 2x HeBS
逐滴将A管液体加入B管,混合均匀
室温温浴20min
边轻轻摇晃培养皿边逐滴加入AB混合液,
将培养皿放回培养箱培养9hr或过夜
用预热的PBS洗细胞2次
加10ml新鲜培养基继续培养
2-3天后观察结果
HeBS: 2L, PH 7.05 (make 200ml is enough)
NaCl: 32g
KCl 1.42g
实验室安全管理制度及流程 一、实验室安全管理制度 ㈠要严格执行医疗管理法律、法规、医院医疗安全管理规定.加强实验室安全的监督和管理.对可能影响检验工作的安全隐患进行控制。 ㈡实验室和楼道内必须配置足够的安全防火设施。消防设备要品种合适.定期检查保养.大型精密仪器室应安装烟火自动报警装置。 ㈢走廊、楼梯、出口等部位和消防安全设施前要保持畅通.严禁堆放物品.并不得随意移位、损坏和挪用消防器材。 ㈣易燃、易爆药品专人专柜存放保管.并符合危险品的管理要求。剧毒药品应由两人保管.双锁控制.存放于保险箱内。建立易燃、易爆、剧毒药品的使用登记制度。 ㈤普通化学试剂库设在检验科内.由专人负责.并建立试剂使用登记制度。领用时应符合审批手续.并详细登记领用日期、用量、剩余量.并有领用人签字备案。 ㈥凡使用高压、燃气、电热设备或易燃、易爆、剧毒药品试剂时.操作人员不得离开岗位。 ㈦各种电器设备.如电炉、干燥箱、保温箱等仪器.以实验室为单位.由专人保管.并建立仪器卡片。 ㈧做好电脑网络安全工作.防止病毒侵入.防止泄密。 ㈨每天下班时.各实验室应检查水、电安全.关好门窗。等方
面进行安全检查.确保无隐患后.方可锁门离开。值班人员要做好节假日安全保卫工作。 ㈩检验过程中产生的废物、废液、废气、有毒有害的包装容器和微生物污染物均应按属性分别妥善处理.以保证环境和实验室人员的安全和健康。 (十一)任何人发现有不安全因素.应及时报告.迅速处理。 (十二)科主任要定期检查安全制度的执行情况.并经常进行安全教育。每月一次.召开医疗安全工作全员会议.总结发生的差错或事故.分析原因.排查医疗安全隐患和实验室不安全因素.提出整改措施。 二、实验室安全管理流程: ㈠工作人员和实验室安全的一般要求 1、实验室工作区内绝对禁止吸烟.杜绝易燃液体的潜在火种和传染细菌和接触毒物的途径。 2、实验工作区内不得有食物、饮料及可能摄入的其它物质。实验室工作区内的冰箱禁止存放食物。 3、眼睛和面部的防护:处理腐蚀性或毒性物质时.须使用安全镜其它保护眼睛和面部的防护用品。使用、处理能够通过粘膜和皮肤感染的试剂.或有可能发生试剂溅溢的情况时.必须佩 带护目镜、面罩。被血液或其它体液溅到,立即用大量的生理盐水冲洗 4、服装和个人防护装备:除要求符合实验室工作需要的
实验室设置及管理制度
实验室设置及管理制度1.目的:建立实验室的合理设置和科学管理, 防止实验污染,保证检测结果的可靠性。 2.适用范围:本程序适用于分子诊断室的设置、 工作流程和日常管理等。 3. 责任人:科主任及PCR工作人员 4. 总则: 4.1 分子诊断室为检验科下设的专业实验室, 从事临床标本的基因扩增检测及相关科研工 作。 4.2 本实验室采用实时荧光定量PCR技术作为临床基因诊断的主要手段,实验室分为试 剂准备区、样品制备区、扩增及产物分析 区三区。各工作区的实验物品(含加样器、 试管架、吸头、记录纸、笔等),不得混用, 须贴上不同颜色标志予以区别,试剂准备 区为白色标志,样品制备区为蓝色标志, 扩增及产物分析区为粉色标志。 4.3 禁止非本室工作人员进入实验室,参观实 验室等特殊情况须经实验室负责人批准后
方可进入。 4.4 严格遵守从“试剂准备区→标本处理区→扩增分析区”的单一流向制度,不得逆向进入前一工作区。 4.5 进入实验室,必须更换本室有颜色标志的工 作服,每周换洗工作服。 4.6 实验室工作人员必须必须严格遵守实验室 各项规章制度并按照PCR实验室操作程序 进行,操作。 4.7实验开始前必须先做好室内及工作台的清 洁消毒,离心管、吸头等一次性用品均需高 压灭菌处理。 4.8 每年校准PCR仪、加样器、温度计、恒温设备、离心机和生物安全柜等仪器、设备。 4.9 禁止在工作区饮食、吸烟、处理隐形眼睛、化妆及储存食物。 4.10产物分析区排风扇应昼夜工作。 4.11每日工作结束后,认真执行《清洁、废弃物处理的标准操作程序》, 彻底清洁、洗消剂消毒地面和实验台面;将废弃物品放置在指定位置。 4.12离开实验室时,应打开紫外灯,关好水、 电、门、窗。 5. 试剂准备室管理制度
1、室内布置:为方便工作和仪器维修,在大型实验室中,采取房屋 中间摆设大型和主要仪器设备的办法,这不仅便于仪器工作时散热、 故障维修,而且便于清洁卫生。标本处理、分配、加样和一些不需要 上机操作小实验,则在墙边工作台上进行。这样布置对工作人员流动和样本的转运也十分方便。小型实验室因空间受限,工作台一般设在墙边。 2 、水源设计:所有的实验室都安装了清洁池(独立专用洗手池 )和污染池 (洗涤与染色用 ),下水道均直接接入医院污水处理系统。洗 手池用脚踏式控制,不仅符合实验室卫生要求,也比较耐用。污染池 用于洗涤实验污物,为防溅做成深水池。 3、电源设计:实验用仪器及辅助用电设备事先进行定位,装配好电源插座,且和照明电源分开接线,互不干扰。重要仪器设备均配备不间断电源 (UPS 电源 )和专用接地线,并考虑预留了不少今后实验室发展可能会购置的仪器及临时用电源插座。 4、照明设计:实验室内照明设备以荧光灯为主,与工作台面平行半隐形安装在抛光天花板内;走廊上采用白炽灯,不同照明光源相结合,使实验室内产生舒适、美感的视觉享受。检验科大门、急诊窗口、值班室配置醒目灯箱 ,方便群众夜间查找。为有效地保护工作人 员和避免标本污染。细菌室按有关要求安装 4 支 30W 紫外线灯,作为常用的消毒设备,也半隐形在天花板内。 5、窗户置厚布窗帘以防太阳暴晒实验室设备。检验科大门及各
室门为要考虑大型仪器进入,宽度为,最好是推拉门。室内光源均使用荧光灯,照明设备的开关安装在每个工作室的出口或入口处。照明设备安装成与工作台面呈垂直或对角线,这既统一布局又可消除物体遮挡产生的阴影。 6、天花板统一使用防火板吊顶装修,内藏通风排气管道和消防 喷水管道。 7、科室集中使用大型UPS 电源,放于仪器设备集中的实验室角落,单独用一可散热的不锈刚制百叶窗隔离。 8、承受力、对热、酸碱、染液、有机溶剂和冲击的抵抗力是选 用工作台材料的重要因素,实验工作台使用精加工的黒色表面,能有效地减少反射光和眩光,以减轻眼睛的疲劳。供坐着操作的工作台般高度为 76cm ,供站着操作的工作台高度为91cm 。椅子选用高度可调节、可旋转、坐垫和背部靠垫舒适的。 9、各实验室下水管道统一将工作废液引至污水处理设备,医院 院感控制科专人处理后排放。 10、血样检验是工作中最大部分的标本。分离血清时,离心机的高速运转常常对电子设备产生干扰,故在仪器设备集中的工作区隔壁单独设立一标本准备区。 11、考虑微生物的安全防范,将微生物检验室单独设立在人员较少流动的科室里头。严格实行生物安全管理。 12、洗涤室,由科室卫生工人全面进行实验用具的洗涤,废液的处理,污染物的隔离,消毒液的使用。
实验室安全管理制度与流程 一.目的:规范临床实验室的安全管理。 二.适用范围:实验室和工作人员安全的一般要求,防火、用电、化学危险物品、微生物的安全要求,以保证实验室的安全运作,将事故控制在最低限度。 三.工作程序: l工作人员和实验室安全的一般要求 1.1吸烟 实验室工作区内绝对禁止吸烟。点燃的香烟是易燃液体的潜在火种;香烟、雪茄或烟斗都是传染细菌和接触毒物的途径。 1.2食物、饮料及其它 实验工作区内不得有食物、饮料及存在“手接触可能的其它物质。实验室工作区内的冰箱禁止存放食物。食物应放置在允许进食、喝水的休息区内。 1.3化妆品 实验工作区内禁止使用化妆品或进行化妆,并建议经常洗手的实验人员使用护手霜。 1.4眼睛和面部的防护
处理腐蚀性或毒性物质时,须使用安全镜其它保护眼睛和面部的防护用品。但允许面罩或工作人员在实验室的危险区内不要佩戴隐形眼镜,除非同时使用护目镜或面罩。使用、处理能够通过粘膜和皮肤感染的试剂,或有可能发生试剂溅溢的情况时,必须佩带护目镜、面罩或面具式呼吸器。 1.5服装和个人防护装备 除要求符合实验室工作需要的着装外,工作服应干净、整洁。所有人员在各一实验区内必须穿着遮盖前身的长袖隔离服或长袖长身的工作服。当工作中有危险物喷溅到身上的可能时,应使用一次性塑料围裙或防渗外罩。有时还需要佩戴其它防护装备如:手套、护目镜、披肩或面罩等。个人防护服装应定期更换以保持清洁,遇被危险物品严重污染,则应立即更换。盛放被污染的实验服和工作服,应用合适的、有标识并能防渗的包装。清洗时应用足够高的温度和足够长的时间以获得良好的去污效果。 不得在实验室内设值班床,严禁在实验室内住宿。 1.6鞋 在各工作区内,应穿舒适、防滑、软底并能保护整个脚面的鞋。在有可能发生液体溅溢的工作岗位,可加套一次性防渗漏鞋套。帆布鞋可吸收化学物品和有传染性的液体。 1.7头发和饰物 留长发的工作人员应将头发盘在脑后,佩戴帽子。以防止头发接触到被污染物和避免人体脱屑落人工作区,不得佩戴有可能被卷入机
实验室安全操作规范流程为了顺利地做好实验,保证实验成功,保护实验仪器设备,维护每个师生的安全,防止一切实验事故,特制订本安全操作规程。 一、未进实验室时,任课教师就应对本次实验进行预习,掌握操作过程及原理,弄清所有仪器的性能。估计可能发生危险的实验,在操作时注意防范。 二、实验开始前,检查仪器是否完整无损,装置是否正确稳妥。 三、每次实验课,教师必须强调安全注意事项和操作程序。教育学生要遵守纪律,严格按规程操作,发现异常现象立即向老师报告。如果教师未强调注意事项和操作程序,意外事故责任由教师承担;如果学生违反安全注意事项和操作程序,意外事故责任由学生承担。 四、做学生实验时,实验设备和电路按要求连接好后,经老师检查无误,统一供电后方可进行实验。使用电器时要谨防触电,不要用湿的手、物接触电源。实验后任课教师应立即统一切断电源。 五、若发生触电现象,首先切断电源,采取必要的救护措施。
六、灯火加热时要注意安全。在酒精灯快烧尽、灯火还没熄灭时,千万不能注入燃料;酒精灯熄灭时,要用灯帽来罩,不要用口来吹,防止发生意外;不要用一个酒精灯来点燃另一个酒精灯,以免酒精溢出,引起燃烧。点燃的火柴用完后立即熄灭,不得乱扔。 七、在进行力学等实验时,应告诫学生所使用的导轨、配重等物品的坠落,防止意外事故的发生。 八、温度计要轻取轻放,如有破损立即报告老师,不得用手触摸,以免割伤或中毒。汞洒落时,应尽快收集起来,并用硫磺粉盖在洒落的地方。 九、严禁在实验室内吸烟或饮食。实验完毕要细心洗手。 十、演示实验所用实验器材及药品,必须由任课教师亲自领取和归还,不能由学生代领、代还,防止中途丢失而造成事故。 十一、实验完毕后教师离开实验室前,要认真检查门窗和水电,一切无误后方可离开实验室。 阳光学校
检验科员工健康管理制度和就医程序 1、目的: 明确检验科人员健康管理制度和就医程序,规范实验室管理,保证实验室人员的安全。 2、范围: 适用于检验科及血库。 3、职责: 3.1 工作人员:严格遵守次制度。 3.2 组长:监督小组成员严格遵守此制度。 3.3 科室负责人:负责监督全科室人员遵守此制度,及时更新修改相关规定,对健康管理不合格的情况进行纠正处理。 4、具体规定内容: 4.1 检验科指定一人负责科室健康监测工作,每年组织对科室工作人员进行一次健康体检。 4.2 体检具体时间由科室和单位负责体检科根据具体工作情况商定。 4.3 体检内容包括:一般体格检查、心电图、超声检查、X线、输血全套及肝肾功。 4.4 建立健康档案:体检表由体检负责人根据体检结果做出体检结论与建议,检验科对档案进行备份保存。
4.5 检查发现传染性疾病指标异常,立即报告实验室负责人,以便采取相应控制措施。 4.6 就医程序 4.6.1 实验室工作人员出现传染性疾病临床症状或体征应立即报告实验室负责人和生物安全委员会、院感办,同时派专人陪同就诊。 4.6.2 首先到门诊就诊,需要时到医院指定就诊医生处就诊。 4.6.3 就诊时要将所接触的病原微生物种类和危险程度告知医生。 4.6.4 经检查为非传染病按医生治疗原则进行相应的治疗,如为传染性应采取相应隔离、消毒措施,到指定医院就诊。 4.6.5 发现本科室人员患传染病应在2小时内报告实验室负责人和生物安全委员会、院感办和其他卫生部门。 4.6.6 患传染病人员应进行有效的主动免疫和被动免疫。 5相关文件记录 《检验科健康体检表>>
QB 实验室测试检测流程规范 编制: 审核: 批准:
实验室测试检测流程规范 1、目的 明确火乐科技投影产品进行的高温、低温、湿热、插拔寿命、按键寿命及盐雾试验等检测项目及运作流程。 2、适用范围 适用于火乐科技发展有限公司所有投影产品或供应商(包括外包工厂)提供的部件、整机等样品。 3、职责和权限 试验申请人: ?试验检测申请单提交;?试验样品准备; ?试验过程资源协助;LAB工程师: ?试验样品接收和保存;?测试检测环境搭建; ?仪器设备运行维护; ?测试检测原始数据记录;?测试检测报告编写; ?测试检测异常反馈;研发工程师 ?测试检测过程Bug分析;DQE工程师: ?试验项目申请审核; ?测试检测结果判定及反馈;?测试检测质量监督; ?测试检测报告审核; ?测试检测报告归档关闭;质量总监: ?试验项目申请审批; ?测试检测报告审批; 4、测试检测流程
5、测试检测项目
6、测试检测过程 测试执行 ?LAB工程师根据《QA LAB测试检测申请表》,执行相应的测试检测项目,并做好测试记录; ?测试检测过程中,LAB工程师发现bug异常,进行bug登记并告知很情人和研发人员,跟踪bug解决情况,及时复测,关闭bug; ?研发人员及时分析处理bug,并按要求记录bug的分析处理信息,更新bug状态,填制bug 根因;对需要其它人员参与分析处理的时候,需及时将bug分配给下一环节人员; ?DQE跟踪测试用例执行情况,了解影响测试用例执行的因素,及时跟进有关的协调、报告测试状态; ?LAB工程师根据项目的情况,选择有关的报告形式,将测试进展情况及时通报给有关各方; 回归测试 ?所有的测试检测项目完成之后,当研发人员解决完相关bug问题,重新提交试验申请时,需进行回归测试。 ?按照测试计划中对于回归测试的策略对产品进行回归测试,回归测试的用例属于测试用例的一部分或者是全部测试用例,但不能超出原先预定的测试用例的范围,回归测试所运行的用例全部通过时,进入到测试收尾阶段; 7、测试BUG管理机制 BUG严重级别及分类
检验科工作制度 一、认真履行岗位职责,工作人员按时上岗,仪表符合要求,佩戴胸牌,坚守工作岗位,不擅离职守。 二、工作人员主动热情接待患者,态度和蔼,解释耐心,细心周到,严格按照服务流程规范进行操作。 三、检验申请单由医师逐项填写,要求字迹清楚,目的明确。急诊检验单上注明“急”字。 四、收标本时严格执行查对制度。标本不符合要求应重新采集。对不能立即检验的标本,要妥善保管。普通检验,一般应于当天下午下班前发出报告。急诊检验标本随时做完随时发出报告。 五、检验人员必须具有符合规定要求的资质。要认真核对检验结果,填写检验报告单,做好登记,签名后发出报告。检验结果与临床不符合或可疑时,主动与临床科室联系,重新检验。发现检验目的以外的阳性结果应主动报告。院外检验报告应由主任审签。 六、特殊标本发出报告后保留1周,一般标本和用具应立即消毒。被污染的器皿应高压灭菌后方可洗涤,对可疑病原微生物的标本应于指定地点焚烧,防止交叉感染。 七、保证检验质量,定期检查试剂和校对仪器的灵敏度。定期抽查检验质量。 八、建立实验室内质量控制制度,积极参加室间质量控制,以保证检验质量。 九、积极配合医疗,科研,开展新的检验项目和技术革新。 十、菌种,毒种,剧毒试剂,易燃易爆物,强酸,强碱及贵重仪器应指定专人严加保管,定期检查。 十一、保持实验室内的清洁、整齐、安静。做好仪器的维护、保养、登记工作。 十二、工作人员要忠于职守,坚守岗位,严格交接班制度,填写交接班记录。 十三、检验科的医院感染防控工作,应严格按照我院《医院感染控制工作手册》中的制度、流程、预案执行。
检验科日常工作流程 提前10分钟到岗,整理内务、消毒桌面、打扫卫生。检查实验室环境温度、湿度,冰箱、水浴箱温度并记录 接收标本并编号 开机前检查试剂、仪器、耗材 按标准操作规程(SOP)开机并做好记录 扫码录入病人信息及检验项目 做室内质控并检查是否合格 按照仪器标准操作规程(SOP)开始实验操作 打印并审核报告单(检验者、审核者签字) 登记检验结果或打印结果汇总 分类发出检验报告(区分病房、门诊) 按照仪器SOP关机并做好记录 整理消毒桌面、盖好仪器
附件: 传染性非典型肺炎实验室检测工作程序 (暂行) 为做好今冬明春传染性非典型肺炎(以下简称SARS)的实验室检测工作,确保生物安全和检测工作质量,使SARS检测工作能够科学、有序、规范地进行,对SARS的“早发现、早报告、早隔离、早治疗”和防止SARS疫情扩散,特制定本工作程序。 一、 SARS检测实验室的设置 目标:建立国家、省和地(市)级SARS临床标本三级实验室检测网络体系。 1.省级和地市级SARS检测实验室的设置 (1)SARS检测实验室设置的工作程序为:省内选点、省内验收、国家备案、省内公布。 (2)原则上每省指定2个条件较好的实验室负责本省SARS临床标本的病原学检测工作,其中各省、自治区、直辖市疾病预防控制中心作为中心实验室;此外省会城市的疾病预防控制中心或有条件的单位可作为本省的平行中心实验室,北京、天津、上海和重庆市卫生局可在当地选择另外一个符合条件的实验室作为网络实验室。 如果省、市中心实验室不能满足SARS临床标本的检测需求,各省可指定本省具备条件的实验室承担本省SARS检测工作,或协调邻近省份提供帮助,调整后的实验室应报卫生部备案。 (3)各省卫生行政部门负责组织对SARS实验室进行验收,确定本省的SARS 实验室,向全省公布,并将实验室及实验室工作人员的基本情况报卫生部和中国疾病预防控制中心疾病控制与应急处理办公室备案(备案表详见附1)。 2.国家级SARS检测实验室 卫生部在中国疾病预防控制中心病毒病预防控制所和传染病预防控制所设立
国家级SARS检测实验室。实验室及技术人员基本情况应报卫生部备案。 3. 实验室条件及生物安全操作的要求 (1)根据世界卫生组织有关SARS标本操作的指导性意见(见附2)和卫生部的有关规定,各地进行SARS标本检测的实验室应满足生物安全水平2级+(BSL -2级+)(见附3),从事病毒分离等研究的实验室应具备生物安全3级(BSL-3级)的要求。 (2)各地SARS检测实验室和实验室人员须认真遵照卫生部发布的《传染性非典型肺炎实验室生物安全操作指南》、《传染性非典型肺炎病毒研究实验室暂行管理办法》,参照执行《临床基因扩增检验实验室管理暂行办法》(见附4)的有关规定。 二、标本的采集 1、标本采集的人员:医疗机构的医生、护士或当地疾病预防控制中心人员负责标本的采集,并填写采样登记表。标本采集人员应做好个人防护。标本的采集、保存和运输要严格遵守部和有关部门下发的生物安全操作规程操作。 2、采样对象:SARS疑似病例、临床诊断病例(按照卫生部、国家中医药管理局推荐新修订的《传染性非典型肺炎(SARS)诊疗方案》进行诊断)以及其它需要做SARS检测者。 3、标本种类及要求:鼻拭子(或咽拭子)、含漱液、鼻咽或气管抽取液、血液(血清和全血)、粪便、尿液等均可以用于SARS实验室检测,但是为了提高检测的敏感性和便于操作,至少应采集鼻拭子(或咽拭子、)粪便和血清三种标本。标本采集的同时要注意对同一病例采集不同病程的标本,如发病初期、发病第二或第三天再次采集的及恢复期(发病20天以后)等标本。对SARS死亡病例,要做好尸体解剖和标本保藏。 三、标本的送检与接收 1、省内的标本送检与接收要求: (1)各省级实验室应公布标本接收联系方式,并实行24小时标本接受制。 (2)省会城市的医院或当地疾病预防控制中心采集的标本要由采集单位及时将标本和送检登记表(见附5)送本省指定的SARS检测实验室。 (3)省会城市以外的地区应由当地卫生行政部门派专人将标本和送检登记表送至指定实验室。 1、国家实验室标本接收要求
实验室安全管理制度 一.目的:在规范临床实验室的安全管理。 二.适用范围:实验室和工作人员安全的一般要求,防火、用电、化学危险物品、微生物的安全要求,以保证实验室的安全运作,将事故控制在最低限度。 三.实验室安全管理程序 一.目的:在规范临床实验室的安全管理。 二.适用范围:实验室和工作人员安全的一般要求,防火、用电、化学危险物品、微生物的安全要求,以保证实验室的安全运作,将事故控制在最低限度。 三.工作程序: l工作人员和实验室安全的一般要求 1.1吸烟 实验室工作区内绝对禁止吸烟。点燃的香烟是易燃液体的潜在火种;香烟、雪茄或烟斗都是传染细菌和接触毒物的途径。 1.2食物、饮料及其它 实验工作区内不得有食物、饮料及存在“手接触可能的其它物质。实验室工作区内的冰箱禁止存放食物。食物应放置在允许进食、喝水的休息区内。 1.3化妆品 实验工作区内禁止使用化妆品或进行化妆,并建议经常洗手的实验人员使用护手霜。 1.4眼睛和面部的防护 处理腐蚀性或毒性物质时,须使用安全镜其它保护眼睛和面部的防护用品。但允许面罩或工作人员在实验室的危险区内不要佩戴隐形眼镜,除非同时使用护目镜或面罩。使用、处理能够通过粘膜和皮肤感染的试剂,或有可能发生试剂溅溢的情况时,必须佩带护目镜、面罩或面具式呼吸器。 1.5服装和个人防护装备 除要求符合实验室工作需要的着装外,工作服应干净、整洁。所有人员在各一实验区内必须穿着遮盖前身的长袖隔离服或长袖长身的工作服。当工作中有危险物喷溅到身上的可能时,应使用一次性塑料围裙或防渗外罩。有时还需要佩戴其它防护装备如:手套、护目镜、披肩或面罩等。个人防护服装应定期更换以保持清洁,遇被危险物品严重污染,则应立即更换。盛放被污染的实验服和工作服,应用合适的、有标识并能防渗的包装。清洗时应用足够高的温度和足够长的时间以获得良好的去污效果。 不得在实验室内设值班床,严禁在实验室内住宿。 1.6鞋 在各工作区内,应穿舒适、防滑、软底并能保护整个脚面的鞋。在有可能发生液体溅溢的工作岗位,可加套一次性防渗漏鞋套。帆布鞋可吸收化学物品和有传染性的液体。 1.7头发和饰物 留长发的工作人员应将头发盘在脑后,佩戴帽子。以防止头发接触到被污染物和避免人体脱屑落人工作区,不得佩戴有可能被卷入机器或可随人传染性物质的饰物。 1.8胡须 蓄有胡须的男性工作人员必须遵守上项(1.7)规定。 1.9洗手 实验室工作人员在脱下手套后、离开实验室前、接触患者前后、以及在进食或吸烟前都应该洗手。接触血液、体液或其它污染物时,应立即洗手。 1.10眼睛冲洗
医院检验科 检验科工作流程 实验室工作流程 定期检验标本 特殊结果或疑难结果,报各专业组长 调整各类仪器运行状态 检验分析 编号、处理标本 按要求处理标本、存放 当天检验标本 记录仪器有关参数及质控结果 室内质量控制 实验室技术主管核准质 控及分析结果 门诊标本 病区、急诊标本 门诊窗口采集标本、其它标本专用采集管收集 专业人员使用专用标本箱定时收集标本 标本预核收并分类 合格标本 运送至各专业组 不合格标本 及时通知门诊窗口 重新采集 护理人员采集标本、其它标本用专用采集管收集 护理人员使用专用标本箱收集标本送至检验科 临检室预核收 不合格标本 通知相关病区 重新采集 血液标本专用离心机离心 各专业组接收各类标本并核对
标本溢洒处理流程 试管破碎、标本溢洒 做好个人防护,戴双层手套,穿防护服,必要时戴口罩和护目镜 用布或纸巾覆盖受感染性物质污染处 倒上消毒液(有效氯5000mg/L),由外向内进行处理 作用30分钟 将布、纸中以及破碎物品清理掉;玻璃碎片应用镊子清理 再用消毒剂擦拭污染区域 将清理破碎物的容器高压灭菌或放在有效的消毒液内浸泡。纸巾和抹布等放在盛放污染性废弃物的容器内。表格或其他打印或手写材料被污染,应将这些信息复制,并将原件置于盛放污染性废弃物的容器内 填写《异常事件报告单》
临床化学质量控制流程 分析失控原因 标本运送 常规生化质控流程 分析中质量控制 分析前质量控制 分析后质量控制 标本储存 患者准备 标本采集 特殊项目由实验室技术主管签发报告 异常结果,疑难患者结果复核复查 结果在控 离心并处理标本 标本接收并核对 检验后标本留验 危急值报告 测室内质控物 报告质控负责人 检验分析样本 试剂方面 仪器方面 更换试剂后再测 其他方面 消除原因后再测 标准物方面 签发报告 更换标准物后再测 结果失控
平度市蓼兰镇万家卫生院 实验室安全管理流程 l工作人员和实验室安全的一般要求 1.1吸烟 实验室工作区内绝对禁止吸烟。点燃的香烟是易燃液体的潜在火种;香烟、雪茄或烟斗都是传染细菌和接触毒物的途径。 1.2食物、饮料及其它 实验工作区内不得有食物、饮料及存在“手接触可能的其它物质。实验室工作区内的冰箱禁止存放食物。食物应放置在允许进食、喝水的休息区内。 1.3化妆品 实验工作区内禁止使用化妆品或进行化妆,并建议经常洗手的实验人员使用护手霜。 1.4眼睛和面部的防护 处理腐蚀性或毒性物质时,须使用安全镜其它保护眼睛和面部的防护用品。但允许面罩或工作人员在实验室的危险区内不要佩戴隐形眼镜,除非同时使用护目镜或面罩。使用、处理能够通过粘膜和皮肤感染的试剂,或有可能发生试剂溅溢的情况时,必须佩带护目镜、面罩或面具式呼吸器。 1.5服装和个人防护装备 除要求符合实验室工作需要的着装外,工作服应干净、整洁。所有人员在各一实验区内必须穿着遮盖前身的长袖隔离服或长袖长身的工作服。当工作中有危险物喷溅到身上的可能时,应使用一次性塑料围裙或防渗外罩。有时还需要佩戴其它防护装备如:手套、护目镜、披肩或面罩等。个人防护服装应定期更换以保持清洁,遇被危险物品严重污染,则应立即更换。盛放被污染
的实验服和工作服,应用合适的、有标识并能防渗的包装。清洗时应用足够高的温度和足够长的时间以获得良好的去污效果。 不得在实验室内设值班床,严禁在实验室内住宿。 1.6鞋 在各工作区内,应穿舒适、防滑、软底并能保护整个脚面的鞋。在有可能发生液体溅溢的工作岗位,可加套一次性防渗漏鞋套。帆布鞋可吸收化学物品和有传染性的液体。 1.7头发和饰物 留长发的工作人员应将头发盘在脑后,佩戴帽子。以防止头发接触到被污染物和避免人体脱屑落人工作区,不得佩戴有可能被卷入机器或可随人传染性物质的饰物。 1.8胡须 蓄有胡须的男性工作人员必须遵守上项(1.7)规定。 1.9洗手 实验室工作人员在脱下手套后、离开实验室前、接触患者前后、以及在进食或吸烟前都应该洗手。接触血液、体液或其它污染物时,应立即洗手。 1.10眼睛冲洗 眼睛若被血液或其它体液溅到,立即用大量的生理盐水冲洗。 1.11呼吸防护 在没有有效的硬件控制的实验室或实验室不能有效地控制危险因素时,工作人员配戴呼吸防护器具,以防止吸人被有害粉尘、气体、烟雾、蒸气污染的空气。这些防护器具包括:防尘面罩、机械或化学滤筒式呼吸器、导管式呼吸器以及自给式呼吸器,提供的呼吸防护器具必须是根据现有标准专门设计的,对某些特殊危害应能提供足够保护的。
1.目的和适用范围 1.1为了使检验样品和报告得到有效控制管理,使其准确、客观地反映检验结果。 1.2本规定适用于本实验室所检测样品和出具的所有检验报告的管理。 2.职责 2.1实验员负责对样品的监督管理和检测。 2.2质量技术负责人负责检验报告的格式编制或修改意见,由实验室总负责人批准。 3.步骤流程 4.检验要求: 1)实验人员需了解所有仪器设备的使用性质及目的,了解仪器设备的基本控制条件,了解仪器设备的注意事项,了解仪器设备的基本保养。 2)实验人员操作前需经过严格的培训,合格后方可上机操作,对新进人员需作培训考核, 实验人员需按制定规范的操作流程正确操作。 3)实验室人员需了解各种基本物性检验方法与物性标准 5.实验室环境
1)保持实验室温度23±2C,湿度50± 10% 2)实验室必需随时保持环境卫生整洁,有发现脏乱需马上清理干净。 3)每周五进行一次全面大扫除(门、窗、地板、各仪器设备) 6 ?报告拟制 6.1实验员负责拟制检验报告,除客户专用的报告格式外,常报告内容应包括: 1)当天之检验结果需填入材料物性检验日报表中,用以拟制报告。 2)报告上显示公司名称或实验室名称 3)标题,如检验报告 4)检验编号,检验日期 5)客户的名称 6)检测结果 7)检验员和审核人 6.2如果检测结果需要进行解释时,报告中可另作补充,例如: 1)对检测方法的偏离以及特定检测条件的信息,如环境条件 2)特定方法、客户或客户群体要求的附加信息。 6.3检验报告的签发 实验员完成报告后,应对照全部的原始检验记录认真自核,核对无误交给审核人进行报告核查后,将报告发给客户与相关部门。 6.4检验报告的修改 1)若是报告发出后客户提出修改要求,报实验室总负责人审批,视情况而定方可进 行修改。若是对检验结果等重大修改,该申请应拒绝接受修改;若是补充说明等不涉及结果修改,由实验员进行修改,实验室总负责人重新审核批准后,发布一份全新的检验报告,则应进行唯一性标识并在其中注明所代替的原报告编号等。例如:原版报告号20170228-1,回收更改报告号20170228-1A. 2)不论何种原因,导致对报告及修正结果的正确性产生怀疑,应立即书面通知客户,按照相关规定进行检查报告修改,并按《纠正和预防措施控制程序》查找原因,制定纠正预防措施并落实。 6.5当客户要求用电话,图文传真或其它电传方式传送检验结果时,必须满足下列要求, 1)必须是已审核过的报告。
省第二人民医院检验科人力资源管理程序 1目的 人力资源是第一资源。制定程序科学地对人力资源进行合理配置、开发和管理,通过采取测试、评估、培训等一系列手段,为实验室每一位人员找到一个能充分发挥其潜能的岗位。建设一支强有力的学习型的团队,为实验室的服务对象提供高效而优质的服务。 2 范围 适用于本实验室内能影响检测质量的全部人员。 3 职责 3.1医院领导负责检验科主任、副主任的考察和任命。 3.2检验科主任对实验室的全面运行和综合管理负责。 3.3医院人事部、医教部负责新职工的岗前培训。 3.4检验科管理层负责科学配置人员、合理设岗、技能培训、绩效考评。 3.5各组组长负责具体实施本组员工的技术培训及考核工作。
3.6文档管理员负责职工档案管理。 4工作程序 4.1 检验科管理层的建立 检验科管理层是全科的领导者和管理者,主要由检验科主任、副主任组成。大型三甲医院检验科主任应由受过高等教育、具有丰富实验室和/或临床经验的(检验)医师或检验技师担任。一个理想的检验科主任除了要有较高的专业技术水平并有能力跟踪国内、国外检验医学的发展外,还要具有较高的法律意识,能够遵纪守法、以身作则和廉洁自律;具有事业心,能够以科室发展为己任;具有一定的现代管理知识和管理技巧,乐于管理、敢于管理、善于管理;具有一定的人文知识和人格魅力,能够将全科的人力资源凝聚起来并使其获得最大限度的发挥。检验科主任的个人行为和管理行为对实验室的建设和发展常常起着决定性的作用,因此,检验科主任的任用和在任检验科主任的考察、教育、培养以及竞争上岗都是十分重要的问题。医院领导在决定检验科管理层时,最少要考虑以下因素:
检验科生化室工作流程 1.标本的接收与处理 1.1标本的接收 ①严格执行患者、化验单及标本收集器皿的核对制度,保证无差错。 ②认真审核检验申请单,申请单上需标明:患者姓名、性别、年龄、科别、病区及床号、临床诊断、标本采集时间和实验室收到时间等。 ③签收人员应逐一检查标本的质量,避免血少或严重污染等,对不合格、但可以接受 的样本,签收人员要记录标本的缺陷,对于不符合要求的样本,签收人员应拒绝接受, 同时注明拒收原因,并通知临床重新采集标本。 1.2 标本的处理 ①生化室收到临床标本后,应尽快低速离心分离血清或血浆(天冷血清尚未析出,可将 标本放置水浴箱15-20 min),离心速度为3000 r/min左右,时间为5-10 min。不主张用玻璃棒或类似器材去剥离附着于试管壁和管塞上的凝块,因处理不当可导致溶血;如果必须将凝块与试管内壁分开或取下管塞时,一定要小心处理。 2.仪器与试剂 2.1 仪器 ①建立仪器档案:保存每一台仪器的购置论证书、仪器说明书、操作手册。 ②建立仪器操作程序:按照操作手册的要求,建立本室仪器操作程序,并在实际操作中严格按操作程序实施。 ③仪器校准:所有仪器按要求进行校准。校准时,必须选用与仪器配套的校准品,不同系统应选用不同的校准品。所有校准都应有时间、结果、变更和频度的记录和说明。④仪器比对:对具有两台或两台以上同类仪器, 并有相同检测项目,应定期进行仪器间比对实验, 以确保结果的一致性。一般3个月或有以下情况应进行一次比对:质控结果不一致、其中一台仪器经维修保养、更换元器件、试剂更换厂家等。
⑤检测方法选择:原则上在确保质量的前提下,生化室应尽可能选择各项目的推荐方法,如因测定方法和试剂的更换造成临床正常值参考范围发生变动的,应做好对临床的宣传工作。 2.2 试剂 ①试剂选择:参照《卫生部临床检验体外诊断试剂盒质量检定暂行标准》的有关规定,在充分考虑质量的前提下,应尽可能选用和生化检验仪器相配套的试剂,如使用其他商品化试剂应做相应的对照实验并有可行性的报告和记录。 ②试剂的使用和保存:严格按照说明书的要求进行操作和保存,如果是干粉或片剂,一定要注意复溶水的质量。在试剂的使用过程中,应有相应的批号、使用情况及更换记录和说明。 3.室内质控与室间质评 室内质控是为了监测和评价实验室工作质量,以决定常规检验报告能否发出所采取 的一系列检查、控制手段,它代表每天检验结果的准确性;而室间质评既由实验室 以外的某个机构对各实验室常规工作的质量进行监测忽然评定,以评价各实验室工作 质量,逐步提高常规检测的准确性和可比性。以切实做好本室的室内质控为基础,实 验室应积极参加室间质评活动,以增加检验结果的准确度和可比性。各类生化检验项 目应有相应的室内质量控制系统。①质控品选择:选择符合要求的两个浓度质控品。 ②严格按照质控品说明书要求,正确使用和保存。③设定靶值:实验室应对新批号质 控品的各个测定项目确定靶值,靶值必须用本室现行使用的测定方法进行确定;定值 质控品的标定值只能作为确定靶值的参考。④质控方法选择:根据室内质控的要求选 择多规则质控方法。⑤绘制质控图及记录质控结果:根据质控品的靶值和控制限绘制 Levey Jennings控制图(单一浓度水平),或将不同浓度水平的结果绘制在同一图上 的Youden图,将原始质控结果记录在质控图表上,保留打印的原始质控记录。⑥失 控处理及原因分析:填写失控报告,分析误差原因,并采取相应处理措施;根据分析 所得的失控原因,判断结果是真失控还是假失控,以决定当批结果是否发出或重新测 定。
试验检测流程图
试验检测流程图
烘干箱操作规程 一、作业前的准备 1、接上电源后,即可开启工作加热开关。 二、作业中的要求 2、再将控制器旋钮由0℃位置按顺时针方向旋至达到的设置的 温度,此时箱内开始升温,指示灯亮作指示。 3、当温度升到所需工作温度时此时可再把旋钮作微调至指示灯 熄灭处为其恒温(很可能在恒温时,温度仍继续上升,此乃余热影响,此现象约半小时左右即会处于稳定)。当箱内温度稳定时(即所谓“恒温状态”,如温度计上读数超出或低于所需温度,则可控温器再稍微调整,以达到正确程序为止)。 4、恒温时,可关闭一组加热器工作,以免功率过大,影响恒温 灵敏度。 5、温度恒温时,可根据试验需要,令其作一定时间的恒温,在 此过程,可借箱内控制恒温器自动控温,而不需另加人工管理。 6、欲观察工作室试品情况,可开启箱外门、借箱内一玻璃门观 察之。但箱门以不常开启为宜,以免影响恒温,并且当温度升至300℃时,开启箱门可能使玻璃门急骤冷却而破裂。 三、作业后的要求 7、停止工作后,关闭电源,待冷却至室温时,清洁箱内卫生。
仪器设备管理制度 一、仪器设备的管理,包括设备的购置、审批、验收、使用、 维修、养护、保养、检定/校准、标识、降低、封存、报废等。 二、检验仪器设备的购置应由试验单位提出书面购置申请报 告,包公司测试中心审批,经公司主管领导批准后,固定资产部分有公司测试中心购置,低值易耗品由使用单位购置。 三、一起设备到位后,由设备管理员组织开箱验收调试;且检 定/校准。 四、验收合格的检测设备应及时建立设备档案,并编号登入分 帐。 五、贵重、精密、大型检测设备应由专业技术人员根据仪器使 用说明书制定操作规程,经主任审批后上墙。 六、检测仪器设备应严格按操作规程操作,每次使用前后应检 查设备状况,并填写使用记录。 七、试验仪器设备使用过程中若发生故障,维修后进行检定, 合格后方准使用并填写仪器设备维修记录、存档。 八、大型试验设备不得随意搬动,若需搬动,应经室主任同意, 并指定具体的搬运方案,安装后重新进行鉴定/校准。 九、长期不用的试验仪器应每日通电运行两次,每次不少于20 分钟,并在一起设备使用记录中记载
实验室测试流程 版本/修改状态 A/0 页 码 第1页 共3页 实验室测试流程 一、目的 为了对试验项目、实验设施进行有效管理,了解产品、原材料所具有的内在性能,以验证产品、原材料是否满足要求,特制定此程序。 二、范围 适用于实验室对产品或原材料的相关功能、性能的试验、测试活动。 三、术语和定义 3.1 试 验:指通过提供给一系列条件或运行措施,对产品(包括来样)或原材料一个或多个特性的功能性检查。 3.2 实验室:指对产品、在制品、原材料进行化学分析、各种性能试验的场所和设备设施。 3.3原始数据:指在进行试验时实验人员通过技术或分析收集或记录所获取的试验数据。通常不对这些数据进行编辑和处理,而是常常记录在原始记录本中。它不同于试验报告中的结果,因为报告中的结果通常对原始数据进行了编辑、换算和(或)其它的处理以便分析和说明。 3.4 实验报告:指实验人员在实验结束时,对原始记录的数据进行处理,按照标准格式定义的符合性结论。 四、操作流程 4.1 接收、登记实验样品 4.1.1 实验室对品控部和仓库送来的打样布、大货和纱线直接登记接收。 4.1.2实验室测试员应该检查测试样品的大小是否符合送检样品的测试要求,并且确保样品的批号、色号与样品的唯一性。 4.1.3 其他实验要求,由需求部门填写《测试联络函》,将其和待测试实验样品,送到实验室。实验室接到《测试联络函》后,核查委托的项目、标准、批次、数量与样品是否一致,检查待试验样品确无妨碍试验结果的因素,方可接收。如有上述因素,应退回委托实验部门。然后登记,并把《测试联络函》与待试验的样品放在一起,以作为待试验样品的标识。
实验室工作程序 1目的建立实施实验室的质量体系,确保各项性能试验工作满足要求。 2适用范围适用于本公司汽车拉索和软轴产品性能试验室的管理。 3引用标准 3.1Q S-9000 《质量手册》第三版 3.2Q G/LB01.01-2001 《质量手册》第二版 4职责 4.1 品保部是产品性能实验室的归口管理部门,负责全公司新产品、零、部件的试验工作。 4.2品保部长: a 组织贯彻国家有关产品试验的政策、法规、标准。 b 制定试验的规划,并督促执行。 c 负责公司试验室的监督考核工作。 4.3试验室主任: a 执行产品试验标准及操作规程,确保公司新产品性能实验任务准确及时的完成。 b 负责试验设备的日常管理和维护。 4.4试验员 a 负责按操作规程完成零、部件性能试验任务。 b 正确使用试验设备,做好日常维护和保养。 c 认真做好各项试验的记录和审核工作,对试验结果进行整理,
并填写报告单。 4.5资格认定 试验室人员必须经培训考核合格后,由具有资格的单位发给上岗证,持证上岗。 5管理程序 5.1 实验室质量方针 客观公正,实事求是,一切用数据说话。 5.2 实验室工作范围 5.2.1 拉力试验 5.2.2 滑动阻力试验 5.2.3 耐久试验 5.2.4 高低温试验 5.2.5 操作效率试验 5.2.6 盐雾试验 5.3 实验室过程控制 5.3.1 实验室环境控制 a 实验室试验环境温度一般为常温20°± 10 b 实验室应保持清 洁。 5.3.2试验报告的控制 a 试验报告应填写试验报告编号、委托部门、产品零部件名称、 规格、编号 b载入报告的各项数据、试验人员应仔细复核。
医院实验室工作流程 医院实验室工作流程在医学高速发展的今天,随着先进技术的不断引入,临床医学检验获得日新月异的发展:高速度生化分析仪的装备,解决不断增长的检测量的压力;更灵敏的化学发光技术及后续研发投入,深刻地影响和拓展着免疫学检测领域的广度和深度;分子生物学技术、基因芯片、蛋白芯片技术的发展,必将会引领临床医学检验的全新变革,使得个性化的疾病诊断、治疗成为现实。当然,这一切都离不开强大的IT技术的支撑:即如何更有效地整合如此庞大的疾病信息源,将各种实验室、超声、影像学等检测信息综合起来,从多个角度全方位地揭示疾病的信息,从而更好地服务于临床、服务于患者。这是未来临床检验医学发展的趋势,势必对当前传统医疗模式、功能科室布局产生深远影响,充分体现以“疾病管理为核心”的理念。 为了更好地适应这一医疗产业的发展趋势,西门子诊断为目前全球唯一能同时提供体内诊断和体外诊断业务的供应商。西门子医疗集团借助其非常强大的IT技术,将实验室检验与影像学信息实现无缝整合,结合已有的医学基础,将为临床医生在疾病诊断、治疗方面提供更专业、全面的指导和建议,真正成为医疗行业全面解决方案的市场领导者。 西门子诊断与您共同开启诊断新纪元 作为全球最大的体外诊断公司,西门子医学诊断的产品涵盖从生化、免疫、血液、微生物、尿液分析、分子生物学到实验室自动化等方方面面,拥有最广泛的检验菜单和最丰富的产品线组合,配合信息
管理和顾问式服务,西门子医学诊断可以为全球各类医院、实验室和临床诊所等医疗机构提供量身定做的个性化解决方案。我们将继续致力于优化实验室工作流程、提高实验室工作效率和服务质量、整合更广泛的检测菜单,围绕疾病管理理念,更好地服务于临床、服务患者。 西门子诊断引领实验室自动化 目前,西门子诊断通过整合多方面资源,已然在代表体外诊断最高技术水平的实验室自动流水线方面居于全球领先地位:拥有最全面的自动化解决方案(ADVIALabCell、ADVIAWorkCell、StreamLAB、VersaCell);拥有全球最多的自动化流水线用户(高居全球40%以上的自动化市场份额);每天有超过六百万个检测项目在西门子流水线上完成。实验室自动化流水线的引入,将为目前的临床实验室带来全新的变革,更好地应对医学检验所面临的种种挑战: 有限的工作人员却要应对日益增加的工作量;更短的检验结果报告时间;临床对检验结果的准确性要求却更高;对实验室操作人员工作环境改善、生物安全性要求加强等等。面对这些挑战,医院实验室需要改革目前的实验室工作流程、进一步提高实验室管理水平、降低实验室整体运行成本、优化实验室内部人员的配置,将更多的注意力集中于对异常结果的处理上,以不断提高的报告质量来支持医院的长远发展。作为临床实验室发展的未来趋势,实验室自动化流水线正是通过对整个实验室工作流程的优化,以全新的理念、系统的解决方案来应对当前检验医学所面临的这一挑战。 StreamLAB?实验室自动化系统