
P
P
P
Milliplex/Luminex 液相芯片技术在信号通路研究中的应用
前言
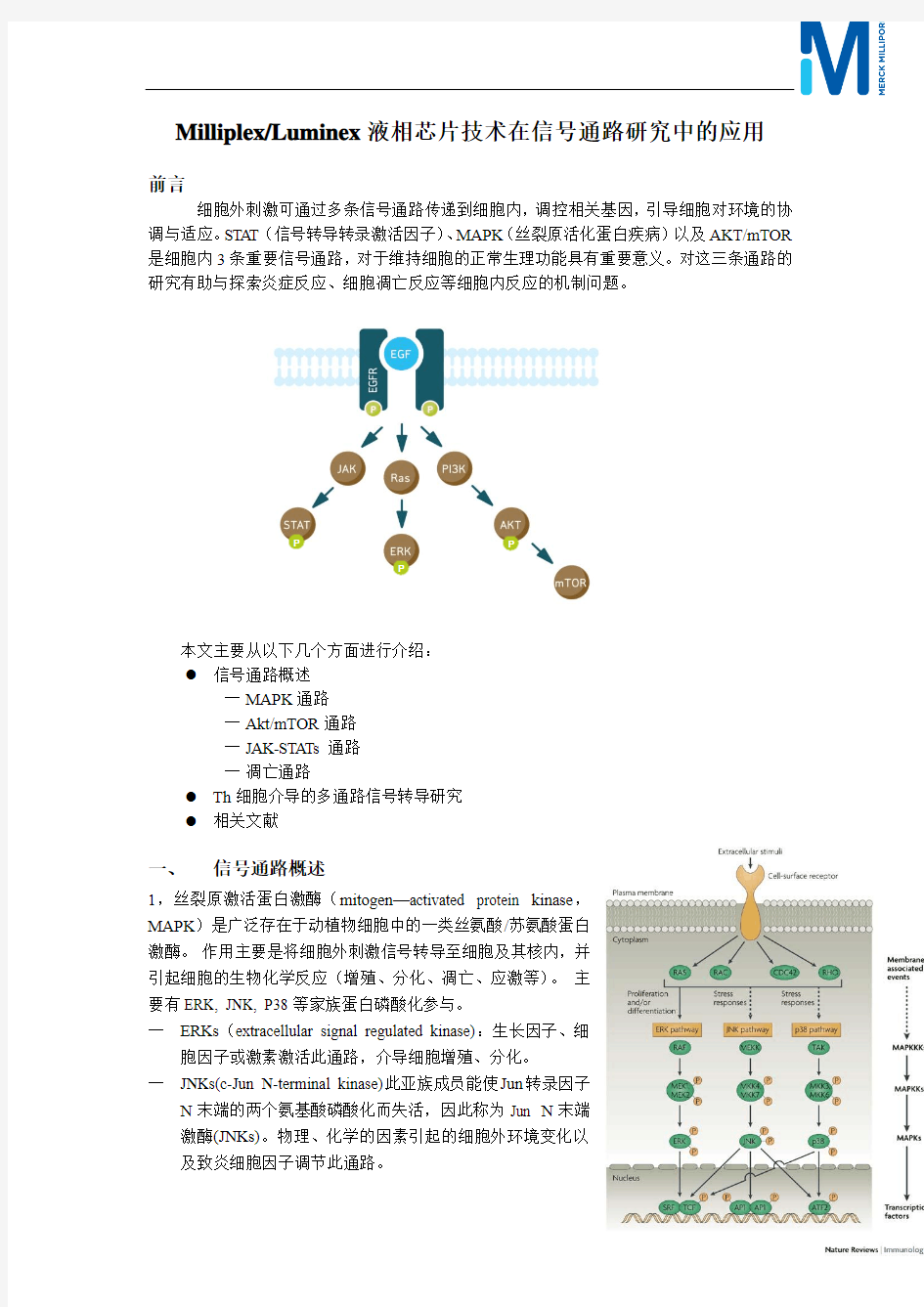
细胞外刺激可通过多条信号通路传递到细胞内,调控相关基因,引导细胞对环境的协调与适应。STAT (信号转导转录激活因子)、MAPK (丝裂原活化蛋白疾病)以及AKT/mTOR 是细胞内3条重要信号通路,对于维持细胞的正常生理功能具有重要意义。对这三条通路的研究有助与探索炎症反应、细胞凋亡反应等细胞内反应的机制问题。
本文主要从以下几个方面进行介绍: ● 信号通路概述
─ MAPK 通路 ─ Akt/mTOR 通路 ─ JAK-STATs 通路 ─ 凋亡通路
● Th 细胞介导的多通路信号转导研究 ● 相关文献
一、 信号通路概述
1,丝裂原激活蛋白激酶(mitogen —activated protein kinase ,MAPK )是广泛存在于动植物细胞中的一类丝氨酸/苏氨酸蛋白激酶。 作用主要是将细胞外刺激信号转导至细胞及其核内,并引起细胞的生物化学反应(增殖、分化、凋亡、应激等)。 主要有ERK, JNK, P38等家族蛋白磷酸化参与。
─ ERKs (extracellular signal regulated kinase):生长因子、细
胞因子或激素激活此通路,介导细胞增殖、分化。 ─ JNKs(c-Jun N-terminal kinase)此亚族成员能使Jun 转录因子
N 末端的两个氨基酸磷酸化而失活,因此称为Jun N 末端激酶(JNKs)。物理、化学的因素引起的细胞外环境变化以及致炎细胞因子调节此通路。
─P38 MAPKs:丝氨酸/络氨酸激酶,参与多种细胞内信息传递过程,能对多种细胞外刺激发生反应,可磷酸化其它细胞质蛋白,并能从胞浆移位至细胞核而调节转录因子的活性来改变基因的表达水平,从而介导细胞生长、发育、分化及死亡的全过程。Milliplex/Luminex提供MAPK通路检测方案
多通路共同研究MAPK,STAT,Akt/mTOR交叉反应检测:
2,Akt/mTOR通路
蛋白激酶B信号通路是癌症中最易失调的信号通路之一,维持和调控广泛的生理过程,如:生长、发育、细胞周期、能量平衡和细胞存活。Akt是一个丝氨酸/苏氨酸磷酸化激酶,目前已发现的它的蛋白底物已超过100个。Akt介导细胞存活/增殖信号,在多种肿瘤细胞中Akt 高度磷酸化。虽然在癌症中Akt基因未突变,但其上游调控蛋白多为原癌基因和肿瘤抑制因子,如胰岛素受体(IR)、胰岛素受体底物(IRS)、磷脂酰肌醇-3激酶(PI3K),第10号染色体缺失性磷酸酶-张力蛋白同源基因(PTEN)等。其下游因子,如哺乳类雷帕霉素靶蛋白(mTOR)复合物,是生长和代谢的关键调控因子。
Akt/ mTOR信号通路中几乎所有蛋白都可被磷酸化修饰调控。为深入理解这条信号通路在正常生理过程和疾病发病过程(如癌症或糖尿病)中发挥的作用,必须能够同步检测细胞中多个蛋白的磷酸化状态。
3,JAK-STAT信号通路
研究证实,JAKs主要由细胞因子受体超家族活化。细胞因子与受体结合后,其受体的胞内部分发生二聚体化,JAKs与二聚体化受体的box功能区结合并发生磷酸化而激活。活化的JAKs 进一步诱发二聚体受体复合物周围的PTK底物活化,包括细胞因子受体型PTK、JAKs家族的成员、STATs等。STA Ts是JAKs激酶底物,同时也是一种含SH2功能域的DNA结合蛋白。STATs可通过SH2功能域与二聚体受体复合物的酪氨酸位点以及JAKs上的KLD功能域结合。STATs的y功能域在JAKs的作用下发生Ty4-,STA Ts被激活。胞浆内活化的STATs 通过SH2功能域形成同源或异源二聚体,这些二聚体通过特定的机制移位到细胞核内。
Milliplex提供的STATs家族蛋白磷酸化检测方案:
4,细胞凋亡通路
细胞凋亡是一个重要的生理过程。在生物体正常发育过程和稳态调控机制起重要作用。目前,哺乳动物细胞中已发现的主要凋亡通路至少有两条:1)内源性凋亡途径:又称为线粒体/细胞色素C介导的通路,细胞色素C从线粒体释放是细胞凋亡的关键步骤。释放到细胞浆的细胞色素C能激活caspase-9,被激活的caspase-9能激活其它的caspase如caspase-3等,从而诱导细胞凋亡。2)外源性凋亡途径:又称为死亡受体通路,在该通路中活化的caspase —8释放到胞质中启动caspase的级联反应,激活下游的效应caspase,导致细胞凋亡。剪切后活化的细胞凋亡蛋白酶- 8、- 9可以激活细胞凋亡蛋白酶- 3和- 7,参与剪切多种关键蛋
白以调控细胞凋亡和细胞结构变化。
Bcl-2(B细胞淋巴瘤/白血病-2)家族成
员是凋亡抑制基因。主要作用于线粒体来调
控细胞凋亡。BH3-only protein Bad蛋白通过
与Bcl - 2蛋白相互作用,抑制其活性来促进
细胞凋亡。抗凋亡因子通过招募Akt磷酸化
BAD,来抑制BAD活性,抑制其介导的细
胞凋亡。磷酸化的BAD与14-3-3蛋白结合
而释放抗凋亡因子如Bcl-2或Bcl–XL,促进
细胞的存活。不可逆的细胞损伤也可通过
AP-1(转录因子活化蛋白-1),JNK(压力应
激通路,C-JUN氨基末端激酶)和P53(DNA
损伤应激通路)激活许多促凋亡因子以诱发
细胞凋亡。
Milliplex提供的凋亡通路研究方案:
除此之外,Milliplex还未血管生成信号通路研究,EGFR信号通路研究,热休克信号通路研究等重要细胞功能研究提供解决方案。同时,Milliplex还提供了单个信号通路蛋白自由自由组,为自由研究信号通路蛋白提供选择。
TGFβ介导的信号通路研究
血管生成信号通路研究组:
EGFR信号通路研究组:
热休克信号通路研究组:
二、Th细胞介导的多通路信号转导研究
T辅助细胞17(Th17)是最近发现的一类T细胞辅助细胞,对免疫系统的建立和功能健全起重要作用。在这项研究中,我们使用PBMC(外周血单核细胞)进行Th17细胞功能诱导分化。观察在CD4+T细胞向Th17细胞分化过程中,由IL-1β,IL-6,IL-23,和TGFβ刺激下,TGFβ,STATs,MAPK及Akt/mTOR和凋亡通路的不同反应。
MILLIPLEX? MAP人类和小鼠Th 17多重检测可为同步化测量由Th1, Th2, Th17, Treg 细胞分泌的细胞因子。
Milliplex提供的炎症因子检测方案:
三、液相芯片技术应用于炎症因子和所介导信号通路研究的相关文献
1.An interferon-inducible neutrophil-driven blood transcriptional signature in human
tuberculosis. Nature. 2010 Aug19;466(7309):973-7.
2.The transcription factor PU.1 is required for the development of IL-9-producing T cells and
allergic inflammation. NatImmunol. 2010 Jun;11(6):527-34.
3.Zcchc11-dependent uridylation of microRNA directs cytokine expression. Nat Cell Biol.2009
Sep;11(9):1157-63.
4.Gerdemann U, Keirnan JM, Katari UL et al. (2012) Rapidly Generated Multivirus-specific
Cytotoxic T Lymphocytes for theProphylaxis and Treatment of Viral Infections. Mol Ther.
2012 Aug;20(8):1622-32.
5. Resumption of HIV replication is associated with monocyte/macrophage derived cytokine
and chemokine changes: resultsfrom a large international clinical trial. AIDS. 2011 Jun 1;25(9): 1207-17.
6. In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses. Nature.
2009 Aug 20;460(7258):1021-5
7. Extrathymic generation of regulatory T cells in placental mammals mitigates
maternal-fetal conflict. Cell. 2012 Jul6;150(1):29-38.
8. Altered microenvironmental regulation of leukemic and normal stem cells in chronic
myelogenous leukemia. Cancer Cell.2012 Apr 17;21(4):577-92
9. The myeloid transcription factor KLF2 regulates the host response to polymicrobial
infection and endotoxic shock.Immunity. 2011 May 27;34(5):715-28
10. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance.
Nat Med. 2011 Feb;17(2):179-88.
11. Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity.
Nature. 2010 Apr 29;464(7293):1367-70.
12. Comparison of the effects of hexavalent chromium in the alimentary canal of F344 rats
and B6C3F1 mice followingexposure in drinking water: implications for carcinogenic modes of action. Toxicol Sci. 2012 Jan;125(1):79-90.
13. Regulation of MRP2/ABCC2 and BSEP/ABCB11 expression in sandwich cultured human
and rat hepatocytes exposed toinflammatory cytokines TNF-{alpha}, IL-6, and IL-1{beta}.
J Biol Chem. 2010 Oct 8;285(41):31185-92.
14. Towne JE, Garka KE, Renshaw BR, Virca GD, Sims JE: Interleukin (IL)-1F6, IL-1F8, and
IL-1F9 signal through IL-1Rrp2 and IL-1RAcP to activate the pathway leading to NF-B and MAPKs. J Biol Chem 2004, 279:13677-13688
15.Zheng et al, Induction of Th17 Differentiation by Corneal Epithelial-Derived Cytokines, J
Cell Physiol. 222(1):95-102 (2010).
【嘉美实验】嘉美生物可提供Luminex、Mllipore的FLEXMAP和Bio-Rad的BioPlex液相芯片检测实验外包服务。Luminex的代表产品 Luminex 100/200以及新推出的Mllipore的FLEXMAP 3D TM 和Bio-Rad公司的BioPlex system都是基于xMAP技术原理,整合了荧光编码微球、激光检测、应用流体学、最新的高速数字信号和计算机运算法则等多项技术,真正实现了“高通量”检测,并荣获2005年度国际临床诊断技术革新奖。是唯一得到美国FDA批准的,也是唯一被纳入美国临床实验室质控网络的高通量诊断技术。被国际业界专家评价为临床诊断的趋势性技术之一。 Luminex\PLEXMAP\BIOPLEX的技术原理 Luminex\PLEXMAP\BIOPLEX的技术优势 高通量,高速度:每个微球作为单独的检测体,可同时进行大量的生物检测,只需要10~20 μl的样本量就可以一次检测多达100个指标(FLEXMAP 3D TM可多达500个指标),最快可达10000次测试/小时,真正实现了“高通量”与“高速度”。 多功能性:xMAP技术可以运用到多种生物检测中,包括免疫分析、基因分型、基因表达、酶分析等。既能检测蛋白,又能检测核酸。除了用于临床外,也能用于科研、CDC、血站、农业、生物及制药专业实验室等。 灵活性高:微球上可连接特异性的探针、抗原或抗体等来满足不同客户的需要。 灵敏度高:检测低限可达0.01pg/ml。 重复性好:类均相反应模式,每个指标有1000-5000个反应单元,分析100次取中位均值。 准确性高:检测范围达3.5-6个数量级,与ELISA和质谱分析具有很强的一致性。 成本低:流式荧光技术联检的试剂用量少,能有效降低临床应用的成本。
高效液相色谱仪(HPLC)校正方法 0.1输液系统: 0.1.1梯度误差G C不超过±3% 0.1.2泵流量设定值误差 S s<±2% 0.1.3流量稳定性误差 S R<±2% 0.2紫外检测器性能 0.2.1基线噪声不超过5×10-4AU,基线漂移不超过5×10-3AU 0.2.2定量测量重复性误差(6次进样)RSD≤1.5% 0.2.3最小检测浓度不超过1×10-7g/ml萘/甲醇溶液 0.2.4可调波长紫外可见光检测器波长示值不超过±2nm(HP1100高效液相色谱仪可由仪器自身完成) 1校正条件 1.1环境温度10-30℃,相对湿度低于65% 1.2校正设备 1.2.1秒表分度值小于0.1 s 1.2.2分析天平最大称量200g,最小分度值0.1mg 1.2.3容量瓶 1.2.4微量注射器 1.3标准物质和试剂 1.3.1HPLC用甲醇、纯水,分析纯的丙酮 1.3.21×10-4g/ml,1×10-7g/ml的萘甲醇溶液 1.3.3紫外波长标准溶液 2校正方法 2.1梯度误差G C的校正 2.1.1进行梯度洗脱程序,A溶剂为水,B溶剂为0.1%丙酮的水溶液,B经5个阶段从0变到100%, 20%—40%—60%—80%—100%,重复测量两次,取平均值,求各段梯度误差Gci,取最大作为仪器梯度误差,公式:Gci=(Li—Lm)/Lm×100% Li:第i段信号值的平均值; Lm :各段输出信号平均值的平均值 可接受标准: -3%≤Gci≤3% 2.2泵流量设定值误差Ss、流量稳定性误差S R的校正 2.2.1将仪器的输液系统、进样器、色谱柱和检测器联接好,以甲醇为流动相,按表一设定流量,待 流速稳定后,在流动相排出口用事先清洗称重过的容量瓶收集流动相,同时用秒表计时,准确的收集10-25
白介素IL-6信号转导及其通路研究概述 细胞因子是一类参与免疫系统的细胞之间通信的蛋白质,除此之外,许多细胞因子在免疫系统之外也具有调节功能。1986年白介素IL-6作为B细胞刺激因子被Kishimoto组分子克隆。IL-6在免疫系统外的活性还有肝细胞刺激因子和骨髓细胞分化诱导蛋白。 白介素IL-6含有184个氨基酸,属于糖基化蛋白质。IL-6可以由多种类型细胞合成和分泌,包括单核细胞、T细胞、成纤维细胞和内皮细胞。IL-6结合受体有两种,一种是特异性受体IL-6R(80kDa I型跨膜蛋白),另一种是gp130,是IL-6家族细胞因子的所有成员的常见受体亚单位。gp130可以在所有细胞表达,但IL-6R的表达受到更多的限制,主要发现于肝细胞、嗜中性粒细胞、单核细胞和CD4+ T细胞。 白介素IL-6受体gp130的二聚化会导致两种细胞内信号通路的启动:经典信号通路和反式信号通路(见下文)。白介素IL-6的受体IL-6R可以在细胞膜经过蛋白质水解,形成可溶性的IL-6R(sIL-6R),在人类中,也可以在翻译阶段进行剪接mRNA,进而产生sIL-6R。在经典信号通路中,IL-6与膜上的IL-6R结合,随后与结合在细胞膜上的gp130结合,启动细胞内信号传导。在IL-6反式信号通路中,IL-6与sIL-6R结合,IL-6和sIL-6R的复合物与细胞膜结合的gp130结合,从而引发细胞内信号。 白介素IL-6是最重要的炎症细胞因子之一。IL-6在通过膜结合和可溶性受体的信号传导中是独特的。有趣的是,这两种途径的生物学后果有很大差异,通过膜结合受体的经典IL-6信号通路主要是再生和保护性的,可溶性IL-6R的IL-6反式信号通路是促炎症的。响应于受体激活的IL-6的细胞内信号传导是通过STA T依赖和STAT独立的信号模块,其由复杂的调节网络调节。IL-6的复杂生物学对该细胞因子的治疗靶向具有影响。 白介素IL-6胞内信号通路可以简单的概述为:IL-6与受体复合物结合后,激活JAK1。JAK1磷酸化gp130细胞质部分内的酪氨酸残基,这些磷酸酪氨酸基序是STAT转录因子,SOCS3反馈抑制剂和衔接蛋白和磷酸酶SHP2的募集位点。SHP2连接到MAPK级联,使Gab1磷酸化,磷酸化的Gab1转移到质膜上,协调正在进行的MAPK和PI3K活化。Src家族激酶独立于受体磷酸化并激活Y AP。 白介素IL-6信号转导第一步:激活JAK。 大多数细胞因子受体缺乏胞内激酶活性,生长因子的受体例外。白介素IL-6胞内信号转导首先激活Janus激酶(JAK),开启酶促反应。通过JAK N末端的同源结构域内(JH)
224 中国医药生物技术 2009年6月第4卷第3期Chin Med Biotechnol, June 2009, V ol. 4, No. 3 DOI:10.3969/cmba.j.issn.1673-713X.2009.03.012 · 综述·Notch信号通路研究进展 王利祥,华子春 1917 年,Morgan 及其同事在果蝇体内发现一种基因,因其功能部分缺失可导致果蝇翅缘出现缺口,故命名该基因为 Notch。随后的研究发现,Notch 从无脊椎动物到脊椎动物的多个物种中表达,其家族成员的结构具有高度保守性,在细胞分化、发育中起着关键作用。迄今研究已阐明 Notch 信号通路的主要成员及核心转导过程,然而随着研究的深入,人们逐渐认识到该通路实际上处于十分复杂的调控网络之中,而这与其在发育过程中功能的多样性相符合。本文结合最新进展,系统阐述 Notch 信号通路的组成,功能,作用机制及调控,并揭示该通路异常与疾病的联系。 1 Notch 受体 Notch 受体是一个相对分子量约为 30 000 的 I 型膜蛋白,由胞外亚基和跨膜亚基组成,2 亚基之间通过 Ca2+ 依赖的非共价键结合形成异源二聚体。胞外亚基包含一组串联排列的 EGFR 和 3 个家族特异性的 LNR 重复序列。EGFR 在 Notch 受体与配体的结合中起关键作用,在果蝇中,Notch 受体的第 11 位和 12 位 EGFR 介导了其与配体的结合。LNR 位于 EGFR 的下游,富含半胱氨酸,介导了 2 亚基之间 Ca2+ 依赖的相互作用。跨膜亚基包括跨膜区、RAM 序列、锚蛋白重复序列、核定位序列、多聚谷氨酰胺序列以及 PEST 序列。RAM 结构域是 Notch 信号效应分子 CBF1/RBPJk 主要的结合部位。ANK 重复序列结构域是 Deltex、Mastermind 等的结合部位,这些蛋白对Notch 信号通路有修饰作用。PEST 结构域与泛素介导的Notch 胞内段降解有关[1]。 2 Notch 配体 Notch 配体与受体一样为 I 型跨膜蛋白。果蝇 Notch 配体有 2 个同源物 Delta 和 Serrate,线虫的 Notch 配体为 Lag 2,故又称 Notch 配体为 DSL 蛋白。脊椎动物体内也发现了多个 Notch 配体,与 Delta 同源性高的称为Delta 样分子,与 Serate 同源性高的被称作 Jagged。目前,发现人的 Notch 配体有 D ll l、3、4和 Jagged l、2。配体胞外 DSL 结构域在进化中高度保守,是配体与受体结合、激活 Notch 信号所必需的。Notch 配体的胞内域较短,仅70 个左右氨基酸残基,功能尚未阐明。近来研究发现,Delta 1 的胞内域能够诱导细胞的生长抑制[2]。有人推测,配体胞内段可能类似与受体胞内段,具有信号转导功能,但具体机制有待进一步研究。3 Notch 信号传递与效应因子 迄今研究发现主要有 6 种信号通路在多细胞生物的生长中发挥关键作用,分别是刺猬、骨形态发生蛋白、无翅、类固醇激素受体、Notch 和受体酪氨酸激酶。Notch 相对于其他信号通路结构较简单,没有第二信使的参与。现有研究提出了 Notch 信号活化的“三步蛋白水解模型”[3]。首先,Notch 以单链前体模式在内质网合成,经分泌运输途径,在高尔基体内被 Furin 样转化酶切割成相对分子质量为180 000 含胞外区的大片段和 120 000 含跨膜区和胞内区的小片段。两者通过 Ca2+依赖性的非共价键结合为异源二聚体,然后被转运到细胞膜。当 Notch 配体与受体结合,Notch 受体相继发生 2 次蛋白水解。第一次由 ADAM 金属蛋白酶家族的 ADAM 10/Kuz 或 ADAM 17/TACE 切割为 2 个片段。N 端裂解产物(胞外区)被配体表达细胞内吞,而 C 端裂解产物随后由早老素 1/2,Pen-2,Aph1 和Nicastrin 组成的γ-促分泌酶复合体酶切释放 Notch 受体的活化形式 NICD。 经典的 Notch 信号通路又称为 CBF-1/RBP-Jκ依赖途径。CBF-1/RBP-Jκ本身是 1 个转录抑制因子,能够特异性地与 DNA 序列“CGTGGGAA”相结合,并招募 SMRT,SKIP,I/II 型组蛋白去乙酰化酶等蛋白形成共抑制复合物,抑制下游基因的转录。当 Notch 信号激活后,NICD 通过上述酶切反应被释放进入胞核,通过 RAM 结构域及 ANK 重复序列与 CBF-1/RBP-Jκ结合使共抑制复合物解离,并募集 SKIP,MAML 1 组成共激活复合体,激活下游基因的转录。Notch 信号的靶基因多为碱性螺旋-环-螺旋转录抑制因子家族成员,如哺乳动物中的 HES、非洲爪蟾中的XHey-1,以及近来发现的 BLBP [3]。此外,存在非CBF-1/RBP-Jκ依赖的 Notch 信号转导途径。最近有研究报道,果蝇 Notch 结合蛋白 Deltex 是某些组织特异性非 Su (H)依赖性信号所必需的,同时发现 Deltex 也具有拮抗Notch 的功能 [4]。 4 Notch 信号途径功能 Notch 信号途径的功能最初是在果蝇神经系统发育的 基金项目:国家自然科学基金(30425009,30730030);江苏省自然科学基金(BK2007715) 作者单位:210093 南京大学医药生物技术国家重点实验室 通讯作者:华子春,Email:zchua@https://www.doczj.com/doc/6b16875426.html, 收稿日期:2009-02-01
附件5 生物芯片类检测试剂注册技术审查指导原则 一、前言 本指导原则主要针对生物芯片类检测试剂的主要原材料、生产工艺及反应体系、产品质量控制等环节提出指导性技术要求。 本指导原则系对生物芯片类检测试剂的一般要求,申请人应依据产品特性确定其中的具体内容是否适用,若不适用,需详细阐述其理由及相应的科学依据。 本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。 本指导原则是在现行法规和标准体系以及当前认知水平下制订的,随着法规和标准的不断完善、科学技术的不断发展,其相关内容也将进行适时的调整。 二、适用范围 根据芯片制作的主要原料和方法,生物芯片可分为核酸芯片、蛋白芯片、细胞芯片、组织芯片等。本指导原则是针对核酸和蛋白为检测靶分子生物芯片的注册技术审查指导原则,其他类型靶分子检测的芯片诊断试剂可参考本指导原则。 三、基本要求 (一)基本原则 1.试剂研制、生产用各种原料、辅料等应制定相应的质量标准,并符合有关法规的要求。
2.试剂生产企业应具备相应的专业技术人员、仪器设备以及适宜的生产环境,获得《医疗器械生产许可证》;同时,应按照《体外诊断试剂生产实施细则(试行)》的要求建立相应的质量管理体系,形成文件和记录,加以实施并保持有效运行;还应通过《体外诊断试剂生产企业质量管理体系考核评定标准(试行)》的考核。 3.生物芯片类试剂在研制时,应当按照科学、规范的原则组织研发,各反应条件的选择和确定应符合基本的科学原理。 4.试剂研制、生产过程中所用的物料及工艺,应充分考虑可能涉及的安全性方面的事宜。 5.生产和质量控制的总体目标:保证试剂使用安全、质量稳定、工艺可控、检测有效。 (二)原材料质量控制 1.核酸检测芯片 核酸芯片检测时,从生物样本中提取的核酸可用荧光标记、金标记和酶标记;检测方法包括光谱学方法和化学显色。下面为荧光标记芯片技术指导原则,采用金标记和酶联显色等的生物芯片诊断试剂可参照核酸芯片和蛋白芯片相关部分。 (1)主要生物原料 核酸检测芯片的主要生物原料包括模板DNA、dNTPs、引物、探针、标记物等。主要生物原料若为企业自己生产,其工艺必须相对稳定,企业应按照工艺要求对这类生物原料进行质量检验,以保证其达到规定的质量标准;若购买,其供应商要求相对固定,不能随意变更供应商,同时,供应商应提供相应的质量保证证明和相应的质检报告,达到生产规定的质量标准。如果主要原料(包括工艺)或其供应商有变更,应依据国家相关法规的要求进行变更申请。
综述与进展 p38M APK信号转导通路与细胞凋亡研究进展 王誉霖1,张励才2 作者单位:1.安徽省宣城市人民医院麻醉科242000;2江苏徐州医学院作者简介: 王誉霖(1978,女,吉林市人,住院医师,硕士。研究方向:疼痛信号转导及调控。 主题词p38丝裂原活化蛋白激酶类;细胞凋亡;综述 中图分类号R345文献标识码A文章编号1674 8166(201012 1665 03 丝裂原活化蛋白激酶(mitog en2activated pr otein kinase,MA PK级联是细胞内广泛存在的丝/苏氨酸蛋白激酶超家族,是将细胞质的信号传递至细胞核并引起细胞核发生变化的重要物质。目前在人类已鉴定了4条MAPK途径:细胞外信号调节蛋白 激酶(ex tra cellular sig nal regulated protein kinase,ERK途径,C Jun 基末端激酶(c Jun N term inal kinase,JN K/应激活化蛋白(stress activated protein kinase,SAPK途 径,ERK5/大丝裂素活化蛋白激酶1(big MAP MAP kinase,BM K1途径和p38M APK(p38mitogen activated protein kinases,p38MA PK 传导途径[1]。p38 信号途径是 MAPK家族中的重要组成部分,多种炎症因子和生长因子及应激反应可使p38MAPK的酪氨酸和苏氨酸双磷酸化,从而激活p38M APK,使它在炎症、细胞应激、凋亡、细胞周期和生长等多种生理和病理过程中起重要作用。因此,p38MAPK 通路参与了多种刺激引起的信号级联反应,表明它在引起多种细胞反应中起重要作用,并且,p38在细胞凋亡中也有着重要的调节效应。1 p38M APK信号转导通路 丝裂原活化蛋白激酶(m ito gen activated pr otein kinase,MA PK级联是细胞内重 要的信号转导系统之一。在哺乳动物细胞M APK通路主要有:细胞外信号调节激酶(extracellular signal r eg ulated kinase,ERK ffi路、p38MA PK 通路、c jun 氨基末端激酶(c jun N term inal kinase,JNK通路和ERK5 通路[1]。其中,p38MAPK 是M APK 家族中的重要成员。
World Journal of Cancer Research 世界肿瘤研究, 2014, 4, 41-46 Published Online October 2014 in Hans. https://www.doczj.com/doc/6b16875426.html,/journal/wjcr https://www.doczj.com/doc/6b16875426.html,/10.12677/wjcr.2014.44008 Review of the ERK5 Signaling Pathway Research Song Luo*, Shengfa Su, Weiwei Ouyang#, Bing Lu# Teaching and Research Section of Oncology, Guiyang Medical University, Guiyang Email: 4567436@https://www.doczj.com/doc/6b16875426.html,, #ouyangww103173@https://www.doczj.com/doc/6b16875426.html,, #lbgymaaaa@https://www.doczj.com/doc/6b16875426.html, Received: Sep. 25th, 2014; revised: Oct. 16th, 2014; accepted: Oct. 20th, 2014 Copyright ? 2014 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). https://www.doczj.com/doc/6b16875426.html,/licenses/by/4.0/ Abstract Extracellular signal regulated kinase 5 (ERK5) is an important part of mitogen activated protein kinase (MAPK) system, and also is a new signal transduction pathway of MAPK signaling system, which has attracted much attention in recent years. ERK5 can be activated by many stimulating factors and plays an important role in cell survival, proliferation and differentiation. Furthermore, ERK5 is closely related to vascular development and proliferation, and other critical functions. This paper focuses on the origin, structure, property, physiological features of ERK5, and the relation-ship between ERK5 and tumor and non-oncologic diseases, and reviews the research direction in the future. Keywords ERK5, Signaling Pathways, MAPK ERK5信号通路研究现状 罗松*,苏胜发,欧阳伟炜#,卢冰# 贵阳医学院肿瘤学教研室,贵阳 Email: 4567436@https://www.doczj.com/doc/6b16875426.html,, #ouyangww103173@https://www.doczj.com/doc/6b16875426.html,, #lbgymaaaa@https://www.doczj.com/doc/6b16875426.html, 收稿日期:2014年9月25日;修回日期:2014年10月16日;录用日期:2014年10月20日 *第一作者。 #通讯作者。
细胞信号转导途径研究方法 一、蛋白质表达水平和细胞内定位研究 1、信号蛋白分子表达水平及分子量检测: Western blot analysis. 蛋白质印迹法是将蛋白质混合样品经SDS-PAGE后,分离为不同条带,其中含有能与特异性抗体(或McAb)相应的待检测的蛋白质(抗原蛋白),将PAGE胶上的蛋白条带转移到NC膜上此过程称为blotting,以利于随后的检测能够的进行,随后,将NC膜与抗血清一起孵育,使第一抗体与待检的抗原决定簇结合(特异大蛋白条带),再与酶标的第二抗体反应,即检测样品的待测抗原并可对其定量。 基本流程: 检测示意图:
2、免疫荧光技术 Immunofluorescence (IF) 免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素制成荧光标记物,再用这种荧光抗体(或抗原)作为分子探针检查细胞或组织内的相应抗原(或抗体)。在细胞或组织中形成的抗原抗体复合物上含有荧光素,利用荧光显微镜观察标本,荧光素受激发光的照射而发出明亮的荧光(黄绿色或桔红色),可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。 采用流式细胞免疫荧光技术(FCM)可从单细胞水平检测不同细胞亚群中的蛋白质分子,用两种不同的荧光素分别标记抗不同蛋白质分子的抗体,可在同一细胞内同时检测两种不同的分子(Double IF),也可用多参数流式细胞术对胞内多种分子进行检测。 二、蛋白质与蛋白质相互作用的研究技术 1、免疫共沉淀(Co- Immunoprecipitation, Co-IP)
Co-IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A”能特异性地结合到免疫球蛋白的FC片段的现象而开发出来的方法。目前多用精制的protein A预先结合固化在agarose的beads 上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原抗体达到沉淀抗原的目的。 当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。进一步进行Western Blot 和质谱分析。这种方法常用于测定两种目标蛋白质是否在体内结合,也可用于确定一种特定蛋白质的新的作用搭档。缺点:可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用。 2、GST pull-down assay GST pull-down assay是将谷胱甘肽巯基转移酶(GST)融合蛋白(标记蛋白或者饵蛋白,GST, His6, Flag, biotin …)作为探针,与溶液中的特异性搭档蛋白(test protein或者prey被扑获蛋白)结合,然后根据谷胱甘肽琼脂糖球珠能够沉淀GST融合蛋白的能力来确定相互作用的蛋白。一般在发现抗体干扰蛋白质-蛋白质之间的相互作用时,可以启用GST沉降技术。该方法只是用于确定体外的相互作用。
高效液相色谱方法的验证 ?方法验证的目的 ?方法验证的内容 ?方法验证的项目及测定方法
方法验证的目的 目的:证明采用的方法适合相应检测的要求。 方法验证是实验室针对特定方法的研究过程,通过设计方案,有步骤、系统地收集、处理实验数据,最终形成文件,以证明所用试验方法准确、灵敏、专属并重现。同一分析方法用于不同的检测项目会有不同的验证要求。
方法验证的内容 ?准确度 ?精密度 ?专属性 ?检测限 ?定量限 ?线性和范围 ?耐用性
准确度 定义:方法测定结果与真实值或参考值的接近程度。一般用回收率%表示。 1. 主成分含量测定 原料药:对照品或方法比对 2. 制剂、中药:标准加样回收 杂质定量 测定:加样回收(n 3 9) 杂质对照品 方法比对 回收率 C-A %=′ B 100% 杂质与主成分的相对含量 A:试验供试品中被测成分的量 (通常为含量测定量的50%) B: 试验供试品中加入的对照品的量 (通常为±20%) C:试验测定值
精密度 定义:在规定测试条件下,同一个均匀供试品,经多次取样测定所得结果之间的接近程度。一般用偏差,相对偏差和相对标准偏差 1. 重复性(n 9) 3 2. 中间精密度 3. 重复性 测定:HPLC方法的精密度测试,应从样品制备开始,设计3个浓度, 分别平行制备3份,以测定含量计算相对标准偏差;或同一样品平行制备6份供试品,分别进样,以峰面积计算相对标准偏差。 同一份供试品连续进样6次,计算得到的相对标准偏差只能表征进样精密度,不能作为方法精密度。
专属性 定义:在其它成分可能存在下,方法能正确测定出被测物的特性。 1. 鉴别反应 2. 含量测定 杂质测定 测定: 限量检查 空白制剂,模拟复方 加速破坏试样测试 DAD峰纯度检查
生物技术通讯 LETTERSINBIOTECHNOLOGYVol.18No.2Mar.,2007 综述 文章编号:1009-0002(2007)02-0336-03 蛋白质组学方法在细胞内信号转导研究中的应用 李敏,周慧,崔银秋 吉林大学生命科学学院生物大分子实验室,吉林长春130021 [摘要]蛋白质组学的新技术为我们研究细胞内的信号转导过程提供了更广泛和崭新的思路,它克服了传统技术的局限 性,实现了对蛋白的高通量分析。简要综述了蛋白质组学技术在信号转导过程中信号分子的确定、定量,磷酸化等翻译后修 饰的识别,以及蛋白质之间相互作用研究等方面的应用。 [关键词]蛋白质组学;信号转导 [中图分类号]Q25FQ503[文献标识码]A ApplyingProteomicMethodstoCellularSignalTransductionResearch LIMin,ZHOUHui,CUIYin-qiu BiomacromoleculeLab,CollegeofLifeScience,JilinUniversity,Changchun130021,China [Abstract]Improvedtechnologiesthathaveemergedinproteomicsprovideusmuchmorecomprehensiveandnewin- sightsintocellularsignaltransductionresearch.Ithasovercomethelimitationsoftraditionalmethodsandrealizedthe high-throughputproteinanalysismode.Inthisletter,theapplyingofproteomictechnologiesindefiningandquantitating signalingmolecules,identifyingpost-translationalmodificationssuchasphosphorylation,andprotein-proteininteractionsre- searchduringcellularsignaltransductionwerereviewed. [Keywords]proteomicsFsignaltransduction 20世纪90年代以来,对细胞内信号转导途径的研究逐渐成为国内外生物学界广泛关注的热点。由于信号的传递在细胞的增殖、分化和生存等过程中都起着十分关键的作用,因而逐渐成为解决许多重要理论及实践问题的基本思路和有力武器。近年来有关细胞信号转导研究的方法层出不穷。传统地,人们主要利用RNA干扰技术、抗体免疫沉淀、32P标记结合蛋白质印迹法(Westernblotting)、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)等方法来检测和鉴定信号传递过程中差异表达的信号分子及关键蛋白的磷酸化。这些方法和技术能够做小量的分析,但无法进行大规模的研究。随着双向电泳(twodimensionalelectrophoresis,2-DE)和质谱技术的不断完善与发展,蛋白质组学方法越来越多地被用于研究胞内信号转导过程。它弥补了传统方法的不足之处,实现了高通量大规模的研究模式。近年来,蛋白质组学方法应用于信号转导的研究,主要在对蛋白表达谱的检测和定量、翻译后修饰的识别,以及蛋白质之间相互作用图谱的绘制等方面。蛋白质组学方法为我们完整地绘制细胞内信号转导网络图提供了更为可靠的依据。以下就近年来该领域的一些新技术及应用做一简要综述。 1信号蛋白的寻找和确定 细胞受到外界的刺激后,首先吸引许多锚定蛋白、衔接蛋白的结合,引起蛋白的相互作用,并随之引发胞内的一系列信号蛋白的改变(如级联磷酸化事件的发生),最终信号传递到核基因,表达或阻抑表达一些特征蛋白,或者作用于某些特定的细胞器,引发其他生物学效应。由此可见,要了解一种信号途径的具体过程,首先要对该过程的特征信号分子及下游所表达的蛋白进行确定。目前,二维电泳结合质谱技术(MALDI-TOF-MS或ESI-MS)已经成为蛋白质组学的首选工具,来获得不同状态下的细胞全蛋白质组。许多研究通过选择性抑制或激活信号通路并筛选2-DE的效应分子成功地鉴定了信号转导过程中的靶标。本文作者所在研究室[1]利用2-DE结合MALDI-TOF-MS,对处于不同生理条件下的NIH3T3细胞的全细胞裂解液进行双向电泳分离及软件分析。在我们筛选的aFGF拮抗剂小肽存在的条件下,鉴定出3种表达量下调、1种表达量上升的蛋白,其中鸟苷酸结合蛋白α-11亚单位和1C型核因子分别参与胞内aFGF信号传导以及转录调控。近来人们又开发出许多以2-DE为基础的改进方法,包括从样本制备、分离到染色等各方面,来对蛋白进行更好的分离分析,如亚细胞分离、差异凝胶电泳(DIGE)技术等[2]。 2-DE的优势是能够更直观地提供信号蛋白的相对分子质量、等电点、相对表达丰度等信息,但它在分离一些pI过大或过小、疏水性强的低丰度蛋白时有很大的困难。最近研究较多的多维蛋白质鉴定技术(multidimensionalproteinidentificationtech-nique,MudPIT)[3]弥补了上述缺陷。MudPIT能够更有效地检测疏水蛋白,且在分析来自胞内细胞器的蛋白时具有更高的效率。最常用的是二维液相色谱(2D-LC),它首先对蛋白复合物进行酶 [收稿日期]2006-08-30 [基金项目]吉林省科技发展计划项目(20040411-3) [作者简介]李敏(1982-),女,硕士研究生 [通讯作者]崔银秋,(E-mail)cuiyq@jlu.edu.cn 336
信号通路研究思路
证明一个药物能通过抑制P38表达而发挥保护细胞的作用,需要做的是: 要证明你的药物是通过抑制P38表达而发挥保护作用,首先要证明P38表达增加会导致损伤。 其次,要证明你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 首先证明P38表达增加会导致损伤。 这里需要建立一个损伤模型。正如你提到的,钙离子导致P38mapk的增高,如果某种损伤可以通过钙离子导致P38mapk的增高,那么你就建立起了一个损伤模型。这时,对P38做个RNA干扰,使其表达下降,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说P38mapk的增高会导致损伤。 这里最好不要用P38的抑制剂SB来处理,因为这个抑制剂是针对P38活性的抑制剂,抑制的是P38的磷酸化,而不是表达量。 如果说明的问题是p38磷酸化水平增加而导致损伤,那么我建议用抑制剂。这时还可以用Dominant-negative。抑制剂的实验证实该药物不影响P38表达,而影响其活化。(应该首先考虑选用抑制剂,因为目前一些药物的作用机制不是抑制靶点的表达,而是抑制靶点的激活。如果在此应用RNAi的话,很可能会漏掉这个机制或增加实验步骤。) 其次,要证明你的药物存在保护作用。
当然就是用你的药物先处理一下,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 用你的药物先处理一下,再来损伤刺激,再检测P38表达,如果用药组相对于没有用药组P38表达下降,那么可以说你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 这一步看似不必要,其实是最重要的步骤,而国内的文章往往忽略了这一关键环节。 这里建议还是用RNA干扰P38表达,再用你的药物处理,再进行损伤刺激,如果用药组与没有用药组的损伤程度一致,那么才可以说你的药物是由于抑制了P38表达而发挥保护作用。 抑制剂也有其局限性,有时是“致命”的,主要原因是抑制剂缺乏特异性。虽然我们在文章里看到用抑制剂的时候都说是什么什么的特异性抑制剂,但真的那么特异吗?其实往往是作者为了写文章发文章的需要而夸大了抑制剂的特异性。细胞里无数的信号通路,谁也不能保证抑制剂在作用于靶分子时不会影响其他信号通路。其实无论什么抑制剂,对剂量的要求都相对比较苛刻,为什么?就是因为一旦浓度高了,就不知道会干扰到其他哪些信号通路,从而产生很多说不清道不明的现象。 PI3K的抑制剂---LY294002和wortmannin,它们都能抑制PI3K和相关的激酶,但LY294002的浓度达到200μM常用来抑制DNA依赖的蛋白激酶(DNA-PK);wortmannin在浓度超过3μM常用来抑制运动失调性毛细血管扩张基因
1 JAK-STAT信号通路 1) JAK与STAT蛋白 JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。 (1) 酪氨酸激酶相关受体(tyrosine kinase associated receptor) 许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生长激素)、EGF(表皮生长因子)、PDGF (血小板衍生因子)以及IFN(干扰素)等等。这些细胞因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK的结合位点。受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2) 酪氨酸激酶JAK(Janus kinase) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosine kinase, RTK),而JAK却是一类非跨膜型的酪氨酸激酶。JAK是英文Janus kinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸化多个含特定SH2结构域的信号分子。JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAK homology domain, JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3) 转录因子STAT(signal transducer and activator of transcription)STAT被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3
证明一个药物能通过抑制P38表达而发挥保护细胞的作用,需要做的是: 要证明你的药物是通过抑制P38表达而发挥保护作用,首先要证明P38表达增加会导致损伤。 其次,要证明你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 首先证明P38表达增加会导致损伤。 这里需要建立一个损伤模型。正如你提到的,钙离子导致P38mapk的增高,如果某种损伤可以通过钙离子导致P38mapk的增高,那么你就建立起了一个损伤模型。这时,对P38做个RNA干扰,使其表达下降,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说P38mapk的增高会导致损伤。 这里最好不要用P38的抑制剂SB来处理,因为这个抑制剂是针对P38活性的抑制剂,抑制的是P38的磷酸化,而不是表达量。 如果说明的问题是p38磷酸化水平增加而导致损伤,那么我建议用抑制剂。这时还可以用Dominant-negative。抑制剂的实验证实该药物不影响P38表达,而影响其活化。(应该首先考虑选用抑制剂,因为目前一些药物的作用机制不是抑制靶点的表达,而是抑制靶点的激活。如果在此应用RNAi的话,很可能会漏掉这个机制或增加实验步骤。) 其次,要证明你的药物存在保护作用。 当然就是用你的药物先处理一下,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 用你的药物先处理一下,再来损伤刺激,再检测P38表达,如果用药组相对于没有用药组P38表达下降,那么可以说你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 这一步看似不必要,其实是最重要的步骤,而国内的文章往往忽略了这一关键环节。 这里建议还是用RNA干扰P38表达,再用你的药物处理,再进行损伤刺激,如果用药组与没有用药组的损伤程度一致,那么才可以说你的药物是由于抑制了P38表达而发挥保护作用。 抑制剂也有其局限性,有时是“致命”的,主要原因是抑制剂缺乏特异性。虽然我们在文章里看到用抑制剂的时候都说是什么什么的特异性抑制剂,但真的那么特异吗?其实往往是作者为了写文章发文章的需要而夸大了抑制剂的特异性。细胞里无数的信号通路,谁也不能保证抑制剂在作用于靶分子时不会影响其他信号通路。其实无论什么抑制剂,对剂量的要求都相对比较苛刻,为什么?就是因为一旦浓度高了,就不知道会干扰到其他哪些信号通路,从而产生很多说不清道不明的现象。 PI3K的抑制剂---LY294002和wortmannin,它们都能抑制PI3K和相关的激酶,但LY294002的浓度达到200μM常用来抑制DNA依赖的蛋白激酶(DNA-PK);wortmannin在浓度超过3μM常用来抑制运动失调性毛细血管扩张基因突变(ATM)以及DNA-PK。相对而言,MEK1/2
液相芯片技术及其临床应用 生物芯片主要包括基因芯片和蛋白芯片两大类,按寻址方式和最终检测载体又可分为固相芯片(flat microarrays)和液相芯片(1iquid chip or microsphere arrays)。近年来,液相芯片以其独特的优点及临床实用性,正受到越来越多的重视。现就液相芯片的技术原理、特点及临床应用前景作简要介绍。 【摘要】液相芯片技术是一种利用混悬在液相中的分类编码微球作为反应及信号检测载体的检测技术,它充分利用发展成熟的流式细胞术检测原理,对临床大多数生物分子(如核酸、蛋白质等)进行高通量分析。目前已在研究和临床检测中得到了广泛的应用,现就其技术原理、特点及临床应用作简要介绍。 【关键词】芯片分析技术流式细胞术 生物芯片主要包括基因芯片和蛋白芯片两大类,按寻址方式和最终检测载体又可分为固相芯片(flat microarrays)和液相芯片(1iquid chip or microsphere arrays)。近年来,液相芯片以其独特的优点及临床实用性,正受到越来越多的重视。现就液相芯片的技术原理、特点及临床应用前景作简要介绍。 液相芯片技术原理 1.微球编码与反应原理:固相芯片通过空间位置寻址来识别不同点阵元素(即区别不同的特异性反应),液相芯片则通过反应载体——微球所具有的物理、光学信号(如大小或颜色)来识别点阵元素?。液相芯片技术是一种以经过特殊编码、可识别的微球(encoded microspheres or beads)作为生物分子(抗原、抗体、蛋白质、核酸等)反应及信号检测载体的阵列分析技术。液相芯片采用的分子杂交反应类型与固相芯片类似,只是所有的反应在混悬于液相中的微球表面上进行,故也称为悬浮式点阵技术(suspension array technology,SAT)。 SAT技术主要包括点阵信号识别和检测信号识别两部分,现以临床最常用的双位点夹心法来说明液相芯片的基本技术原理。SAT主要由微球、探针分子(A)、被检测物(B)、报告分子(c)4个部分构成。 微球的主要化学成分为聚苯乙烯,其表面修饰的羧基功能基团在一定条件下可以共价结合任何含有氨基的目标分子,对其表面进行不同的化学结构修饰,可使结合的目标分子更具选择性。将微球采用物理或化学方法进行编码分类,不同编码类别的微球即可区分不同的特异性反应。微球编码方式多种多样],如微球大小、颜色、荧光金属纳米技术等,其中最常用的是荧光编码技术,即在制备过程中掺人两种或多种不同颜色分类荧光分子,根据加入比例不同将同种大小的微球进行独特编码。 探针分子是可以和微球表面的羧基等基团偶联并能与被检测物特异性结合的生物分子。报告分子的作用是为每种不同的特异性反应提供检测信号,其可以是一种能与被检测物特异性结合的荧光染料,也可以是标记有荧光的、能与被检测物结合的其他物质(如抗体、抗原、核酸等)。为了和微球分类荧光有明显区别,一般以绿色荧光作为报告分子的标记荧光,任何一种可以激发绿色荧光的荧光染料均可作为报告分子的荧光标记物。 将不同编码类别的微球分别与不同的探针分子反应结合后,混合在一起,再依次加入样品及报告分子,不同微球上的探针分子与样品中需要检测的各种目标分子进行特异性结合,报告分子与目标分子特异性结合,即构成了一个液相芯片系统。因此,可在同一混悬体系中对同一样品中的多种目标分子进行同时分析。 2.检测原理:微球编码技术不同,信号的检测方式也各不相同。流式细胞术是目前应用最广、技术最成熟的一种信号识别和检测技术。 微球单个逐一通过检测通道时受到双色激光(如红色和绿色)同时照射,第一束激光激发微球的分类荧光,根据荧光编码确定微球的类别,即微球内部的两种荧光物质受激发后可发射两种不同波长的荧光,不同类别微球内这两种荧光物质比例不同,则荧光强度比率也不同,从而将不同的特异性反应区分开来(定性、分类);第二束激光激发报告分子