
2020届届届届届届届届届届届届届
届届届——届届届届届届(届届届)
一、单选题(本大题共16小题,共32分)
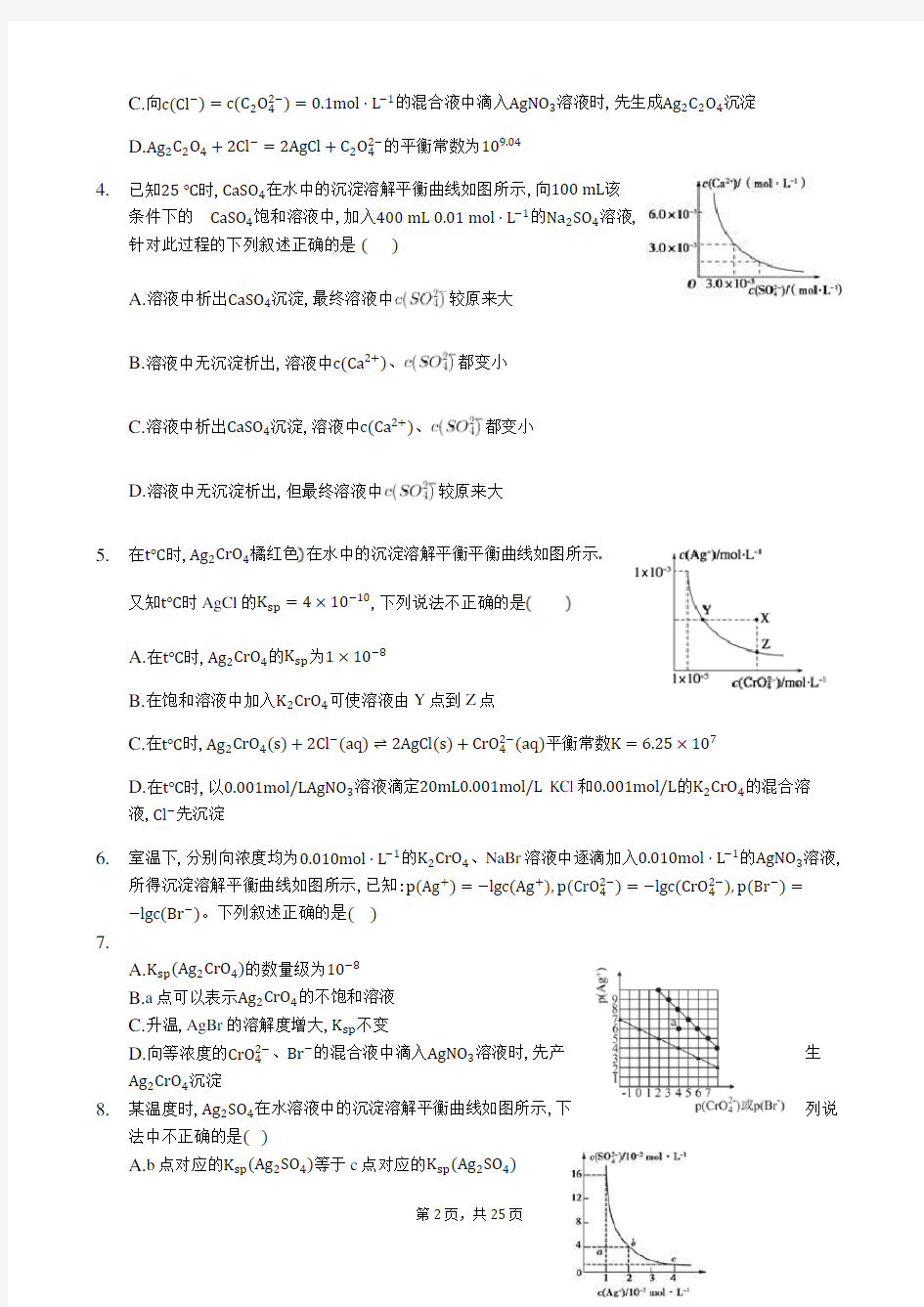
1.已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中,加
入400mL0.01mol·L?1的Na 2SO4溶液。下列叙述正确的是
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42?)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42?)都变小
C.溶液中无沉淀析出,但最终溶液中c(SO42?)较原来大
D.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42?)都变小
2.根据下列图示所得出的结论不正确的是
甲乙丙丁
A.图甲表示2SO2(g)+O2(g)?2SO3;ΔH<0速率与时间关系曲线,说明t1时改变的条件是增大体系的
压强
B.图乙是常温下碳钢浸没在NaCl溶液中腐蚀速率与NaCl浓度的关系曲线,说明在NaCl浓度较高时溶
液中O2的浓度减少,正极反应减慢导致腐蚀速率降低
C.图丙是金刚石与石墨氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
D.图丁是常温下AgCl和Ag2CrO4的沉淀溶解平衡曲线,说明阴影区域只有Ag2CrO4沉淀
3.常温下,用AgNO3;溶液分别滴定浓度均为0.01mol·L?1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图
像如图所示(不考虑C2O42?的水解)。下列叙述正确的是()
A.K sp(Ag2C2O4)=10?7
B.a点表示的是AgCl的不饱和溶液
C.向c(Cl?)=c(C2O42?)=0.1mol?L?1的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl?=2AgCl+C2O42?的平衡常数为109.04
4.已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该
条件下的CaSO4饱和溶液中,加入400mL0.01mol·L?1的Na2SO4溶液,
针对此过程的下列叙述正确的是()
A.溶液中析出CaSO4沉淀,最终溶液中较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、都变小
D.溶液中无沉淀析出,但最终溶液中较原来大
5.在t℃时,Ag2CrO4橘红色在水中的沉淀溶解平衡平衡曲线如图所示
又知t℃时AgCl的K sp=4×10?10,下列说法不正确的是
A.在t℃时,Ag2CrO4的K sp为1×10?8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C.在t℃时,Ag2CrO4(s)+2Cl?(aq)?2AgCl(s)+CrO42?(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/LAgNO3溶液滴定20mL0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶
液,Cl?先沉淀
6.室温下,分别向浓度均为0.010mol·L?1的K2CrO4、NaBr溶液中逐滴加入0.010mol·L?1的AgNO3溶液,
所得沉淀溶解平衡曲线如图所示,已知:p(Ag+)=?lgc(Ag+),p(CrO42?)=?lgc(CrO42?),p(Br?)=?lgc(Br?)。下列叙述正确的是()
7.
A.K sp(Ag2CrO4)的数量级为10?8
B.a点可以表示Ag2CrO4的不饱和溶液
C.升温,AgBr的溶解度增大,K sp不变
D.向等浓度的CrO42?、Br?的混合液中滴入AgNO3溶液时,先产生
Ag2CrO4沉淀
8.某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说
法中不正确的是()
A.b点对应的K sp(Ag2SO4)等于c点对应的K sp(Ag2SO4)
B.采取蒸发溶剂的方法可使溶液从a点变到b点
C.该温度下,K sp(Ag2SO4)=1.6×10?5
D.0.02mol·L?1的AgNO3溶液与0.2mol·L?1的Na2SO4溶液等体积混合无沉淀生成
9.t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正
确的是()
A.曲线Y表示?lg c(Ag+)
mol?L?1与?lg c(Cl
?)
mol?L?1
的变化关系
B.t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应
的饱和溶液
C.t℃时,AgCl(s)+I?(aq)?AgI(s)+Cl?(aq)的平衡常数K=
1×106
D.t℃时,向浓度均为0.1mol/L的KI与KCl混合溶液中加入AgNO3溶液,当Cl?刚好完全沉淀时,此时
c(I?)=1×10?5mol/L
10.在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的K sp=1.8×10?10.
不正确的是()
11.
A.t℃时,Y点和Z点时Ag2CrO4的K sp相等
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Ag2CrO4的K sp为1×10?8
D.t℃时,将0.01mol?L?1AgNO3溶液滴入20mL0.01mol?L?1 KCl和0.01mol?L?1K2CrO4的混合溶液
中,Cl?先沉淀
12.一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数如下:
物质Fe(OH)2Cu(OH)2Fe(OH)3 K SP(25℃)8.0×10? 2.2×10?20 4.0×10?38
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是()
A.该溶液中c(SO42?):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
13.下列说法正确的是
化学式电离常数
HClO K=3×10—8
K1=4.3×10—7
H2CO3
K2=5.6×10—11
A.用坩埚灼烧MgCl2·6H2O的化学方程式为:MgCl
·6H2O=△MgCl2+6H2O
2
B.根据表中提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3?)>c(ClO?)>
c(OH?)
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42—),则加
入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
14.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=?lgc(Ba2+),p(SO42ˉ)=
?lgc(SO42ˉ)。下列说法不正确的是
15.
A.该温度下,K sp(BaSO4)=1.0×10?10
B.a点的K sp(BaSO4)等于b点的K sp(BaSO4)
C.加入BaCl2可以使溶液由a点变到c点