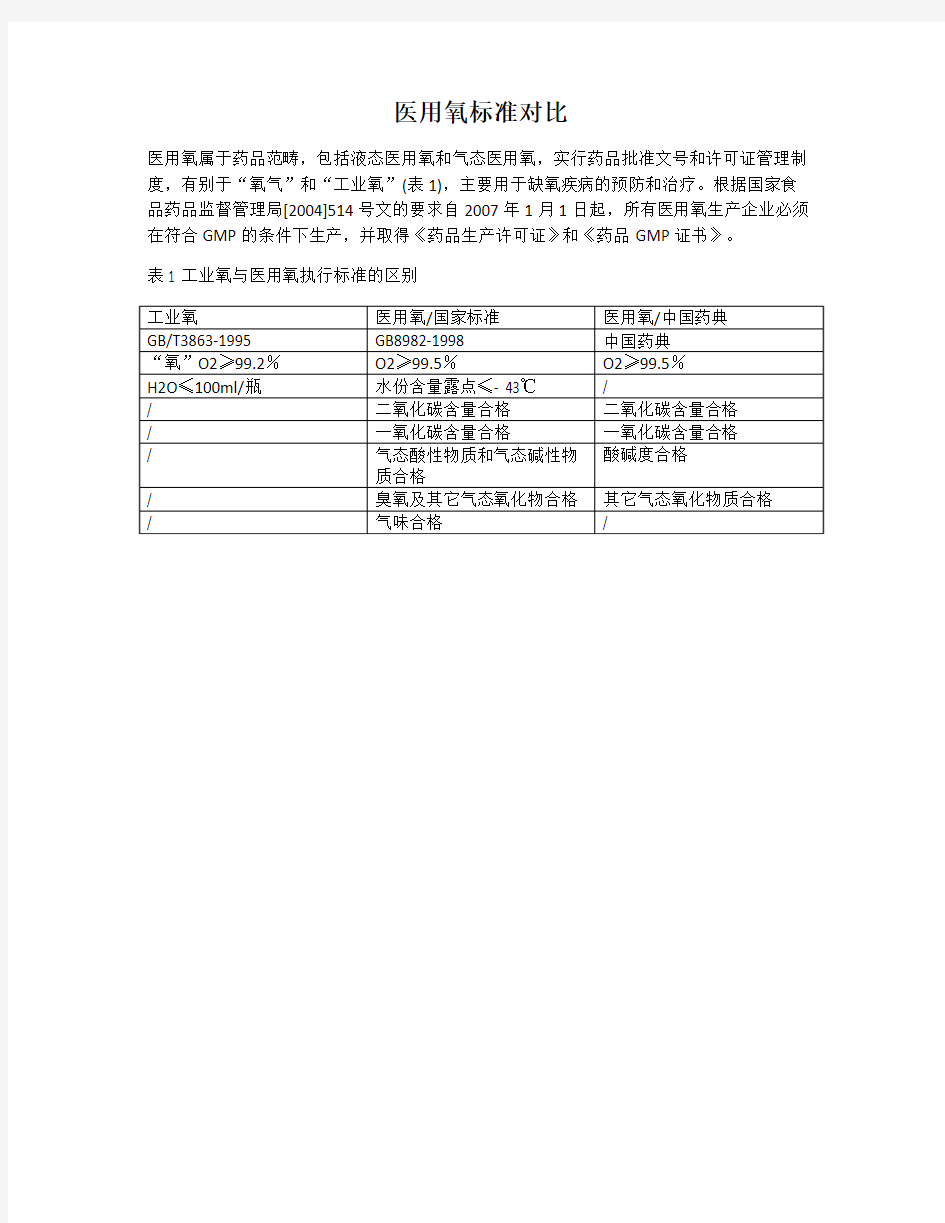
医用氧标准对比
医用氧属于药品范畴,包括液态医用氧和气态医用氧,实行药品批准文号和许可证管理制度,有别于“氧气”和“工业氧”(表1),主要用于缺氧疾病的预防和治疗。根据国家食品药品监督管理局[2004]514号文的要求自2007年1月1日起,所有医用氧生产企业必须在符合GMP的条件下生产,并取得《药品生产许可证》和《药品GMP证书》。
表1 工业氧与医用氧执行标准的区别
我国汽油标准与国外汽油标准的对 比 欧阳光明(2021.03.07) 目前国际上较为先进的汽油质量标准分为美、欧、日、《世界燃油规范》四大标准体系。其中,欧盟汽油标准和《世界燃油规范》最具影响力,被许多国家引用。 1.欧盟汽油标准 EN 228汽油质量标准是欧洲统一实施的汽油标准。EN 228标准主要由两部分组成,第一部分限定了密度、辛烷值以及硫含量、苯含量等指标的最大值。第二部分根据气候和季节将汽油的挥发性划分成不同的等级,分别执行。由于欧洲国家较多,具体情况差别较大,因此欧洲一些先进国家在满足欧洲统一法规的大前提下,又制定了符合自己国情的实施标准。 为了进一步降低汽车污染物的排放, EN 228-2002汽油质量标准(与欧Ⅲ排放法规相对应),将汽油硫含量降到150μg/g、芳烃含量降到42%、要求苯含量不大于1.0%,铅含量不大于5 mg/L,并对各种氧化物的含量加以限制。2005年,欧洲将开始执行欧Ⅳ排放标准,将清洁汽油中的硫含量降为50μg/g,芳烃、苯、烯烃含量分别降为35%、1.0% 和18%。2007年10月1日起推行无硫汽油(欧Ⅴ排放标准),使硫含量低于10μg/g,并出台了EN 228-2008汽油质量标准,于2009年1月1日开始强制执行,该标准为最新的欧盟汽油标准。欧盟汽油规格主要指标的变化见表1。 表1 欧盟汽油规格主要指标的变化
《世界燃油规范》是美国汽车制造商协会(AAMA)、欧洲汽车制造商协会(ACEA)、日本汽车制造商协会(JAMA)根据所属的30个汽车公司的研究成果联合发表的,主要是汽车制造商和发动机制造商针对环保要求,对汽车燃料提出的基本要求。世界燃油规范要求清洁汽油降低硫含量,减少尾气中SO x的排放,抑制尾气转化器中催化剂中毒;降低烯烃含量,避免发动机进油系统和喷嘴堵塞,减少发动机进气阀和燃烧室中生成沉积物,减少汽车尾气中1,3-丁二烯的排放,避免汽油辛烷值分布不均;降低苯和芳烃含量,减少致癌物;降低蒸汽压和T90,减少挥发性有机化合物(VOC)、毒物(TOX)的排放;提高辛烷值,提高汽车动力性能,减少污染物的排放。 2006年9月,世界燃油规范进行了第四次修订,将无铅汽油标准划分为四类: 1类:汽车市场对排放污染控制没有或极少要求,主要考虑汽车或发动机本身的技术状况。 2类:市场上有严格的排放控制和其它要求。 3类:市场上有超前的排放控制要求和其它要求。 4类:市场上有更超前的排放控制要求,满足最新汽车复杂的NOX排放后处理控制技术,实现超低排放。 《世界燃油规范》不允许汽油中加入含有锰、铅等金属的添加剂,可加入无灰的汽油清净剂,并根据不同的类别对硫、烯烃、芳烃和苯的含量分别加以限制,其中硫含量的下降幅度最大。《世界燃油规范》不仅对汽油的组分有限制指标外,还对汽油的性能评定方面提出了严格的要求。《世界燃油规范》指标见表2。
总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。药典收载的凡例与通则对未载入本版药典但经国务院药品监督管理部门颁布的其他中药标准具同等效力。 三、凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定。 四、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 五、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of The People's Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP。 七、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 正文 八、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音与英文名);(2)有机物的结构式; (3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称及编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。 十三、正文按药品中文名称笔画顺序排列,同笔画数的字按起笔笔形一丨丿丶乛的顺序排列;通则包括制剂通则、通用检测方法和指导原则,按分类编码;索引分按汉语拼音顺序排序的中文索引以及英文名和中文名
单位简介: 中国电子技术标准化研究院(工业和信息化部电子工业标准化研究院,工业和信息化部电子第四研究院,简称“电子标准院”、“电子四院”),创建于1963 年,是工业和信息化部直属事业单位,是国家从事电子信息技术领域标准化的基础性、公益性、综合性研究机构。 电子标准院以电子信息技术标准化工作为核心,通过开展标准科研、检测、计量、认证、信息服务等业务,面向政府提供政策研究、行业管理和战略决策的专业支撑,面向社会提供标准化技术服务。电子标准院承担55 个IEC、ISO/IEC JTC1 的TC/SC 国内技术归口和17 个全国标准化技术委员会秘书处的工作,与多个国际标准化组织及国外著名机构建立了合作关系,为标准的应用推广、产业推动和国际交流合作发挥了重要的促进作用。 电子标准院建有政府授权和权威机构认可的实验室、认证机构和工作站,在深圳、广州、上海、苏州等地设有分支机构,依托赛西实验室、赛西认证、赛西培训、赛西信息服务等平台,面向市场和客户提供专业的试验检测、计量校准、认证评估、培训咨询等服务,在电子信息和工业领域的标准化和合格评定方面发挥着核心的技术基础作用。 待遇:择优解决北京户口、事业编制。 基本要求: 1、学历:硕士及以上; 2、政治素质高,思想品德好,遵纪守法,爱岗敬业; 3、热爱标准化事业,具有良好的协作和开拓创新精神; 4、身体健康,具备履行岗位职责的身体素质和心理素质; 应聘方式:1.登录中国电子技术标准化研究院官网“人才招聘”模块内“招聘系统”应聘相关岗位。 2.投递至邮箱:cesihr@https://www.doczj.com/doc/683777829.html,.(邮件名称及简历文件名称均为“姓名+学校+学历+专业+意向岗位”) 招聘流程:简历投递——简历筛选——部门面试——笔试——面试及考察——体检——公示——正式录用。
我国医用制氧机行业发展状况分析 作者:田卉 一、医用制氧机工作原理 医用制氧机是以变压吸附(PSA)技术为基础,利用分子筛物理吸附和解吸技术,从空气中提取氧气的新型设备。其以空气为原料,以分子筛为吸附剂,在常温低压下,利用分子筛加压时对氮气容量增加,减压时对氮气吸附容量减少的特性,形成加压吸附,减压解吸的循环过程。同时空气中的二氧化碳、一氧化碳、气态酸和碱及其它气态氧化物等被吸附或过滤,从而使产出的氧气纯度达到93%±3(v/v),且保证制造出的氧气不含对人体有害的成分,从而使氧气达到医用氧的要求。整个制氧过程为低压物理吸附过程,无化学反应,安全可靠,原料为空气,对环境无污染。且与医院传统用氧方式(液态氧、钢瓶氧)相比,PSA医用制氧机更为安全、便捷、经济,同时也更环保。 图一:医用制氧机系统工作原理示意图 二、行业基本情况 1、行业概述 根据国民经济行业分类标准,医用制氧机属于“C358医疗仪器设备及器械制造”行业,该行业涉及到医药、机械、电子、塑料等多个行业,是一个多学科交叉、知识密集、资金密集的高技术产业。随着全球经济的增长、人口数量的持续增加、社会老龄化程度的提高,以及人们健康保健意识的不断增强,全球医疗器械市场在近十年中的大多数年份保持高于全球GDP和药品市场的速度增长。根据欧盟医疗器械委员会的统计数据,2002 年至2013 年全球医疗器械市场销
售总额复合增长率7.58%,即便是在全球经济衰退的2008年和2009 年,全球医疗器械行业依然逆流而上,分别实现6.99%和7.02%的增长率,高于同期药品市场增长率。 表一:全球医疗器械市场规模(单位:亿美元)医疗器械市场是当今世界经济中发展最快、国际贸易往来最为活跃的市场之一。美国、欧洲、日本共同占据超过80%的全球医疗器械市场,处于绝对领先地位,其中美国是世界上最大的医疗器械生产国和消费国,其消费量占世界市场的39%。中国医疗器械行业同发达国家相比虽然存在差距,但随着改革开放的深入,国家支持力度的不断加大以及全球一体化进程的加快,中国医疗器械行业得到了突飞猛进的发展。《中国医疗器械行业市场前瞻与投资预测分析报告前瞻》显示,2005年中国已成为仅次于美国和日本的世界第三大医疗器械市场,在2006年,中国医疗器械进出口额首超百亿美元大关,进出口总值为105.52亿美元,同比增长17.57%,累计顺差额31.90亿美元。2014年我国医疗器械销售规模达到2,556亿元,进出口总额为885.33亿美元,同比增长8.19%,成为仅次于美国的全球第二大医疗器械市场。中国最新研发的医疗器械产品也逐步走在了国际医疗器械行业的尖端。 根据产业信息网发布的《2015-2020年中国医疗器械产业调研及投资咨询报告》显示,随着我国经济的快速发展、老年人口数量的不断上升,市场对医疗器械的需求不断增加。现我国医疗器械行业已成为一个产品门类比较齐全、创新能力不断增强、市场需求旺盛的朝阳产业。中国医疗器械的市场销售规模从2001
《中国药典》2015年版四部 凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药 品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版 标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药, 二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。除特别注明 版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。本部药典收载的 凡例与通则对未载入本部药典的其他药品标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则与药品质量检定有关的共性问题的统一规定。 四、凡例和通则中采用“除另有规定外”这一用语,表示存在与凡例或通则 有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加 物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia of the People’s Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为 ChP。 正文
八、《中国药典》各品种项下收载的内容为标准正文。正文系根据药物自身 的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规 定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音 与英文名);(2)有机物的结构式;(3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药 物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种 进行相同检查项目的检测时所应釆用的统一的设备、程序、方法及限度等;指导 原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典 收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。
xxxxx气体有限公司 关于医院使用液态医用氧的分析报告 当前医疗机构用氧出现瓶装氧、制氧机,液体氧共同存在的局面。随着市场的发展需要,医院向智能化、人性化的现代建设步伐加快,供氧也逐步向中心供给变革。现就我院使用中心供氧的方式作如下分析。 一、医用中心供氧的方式: 医用氧中心供给系统的氧气来源主要有集合瓶装氧、制氧机制氧、液态氧三种方式。选择哪种方式供氧根据各自医院每月实际需氧量、氧气价格、安全方便及地盘面积等因素来决定。 二、瓶装氧、制氧机,液体氧的特点: 1、瓶装氧: 优点: 一是可满足使用者的各种氧要求;二是使用简便;三是瓶中氧气余量观察简单;四是独立供氧无需外接设备及电源,而且可在室内的任何位置使用。 缺点: 一是要有专业的运输工具;二是笨重搬运困难,易倾倒伤人;三是钢瓶是压力容器,不能同易燃易爆品混放,存在一定的安全隐患。 2、制氧机制氧:
优点: 一是安全可靠,以空气为原料,工作压力低,设备停机时,会自动把吸附塔和管道内的压力卸掉,彻底消除了安全隐患。 二是操作简单有效,启动迅速,装置在开启后30分钟内便可达到设计要求的氧气产量和纯度,制取氧的灵便快速是其它制氧方式无法比拟的。 缺点: 一是初期投资较高;二是故障率较高,后期维护成本较高;三是需配备专业操作人员值守;四最重要是制氧机的氧纯度只能达到99(除深冷制氧设备可达99.6),达不到中国药典99.5的标准。 3、液态氧: 优点: 使用人力少、占用面积小、随时供氧、方便、经济、安全、便于管理等。 缺点: 由于液态氧是低温液体,需要使用低压压力容器进行盛装,国家对压力容器的安装、使用要求比较严格,需到地方质检部门办理压力容器使用登记申报手续,并每年需进行安全检验和安全评价。 三、使用中心供氧方式的可行性分析: (一)、液态氧可满足医用氧纯度要求医疗用氧对氧气本身的质量有很高的要求,氧浓度太低会降低患者的吸氧效果,氧气杂质
我国汽油标准与国外汽油标准的对比 目前国际上较为先进的汽油质量标准分为美、欧、日、《世界燃油规范》四大标准体系。其中,欧盟汽油标准和《世界燃油规范》最具影响力,被许多国家引用。 1.欧盟汽油标准 EN 228汽油质量标准是欧洲统一实施的汽油标准。EN 228标准主要由两部分组成,第一部分限定了密度、辛烷值以及硫含量、苯含量等指标的最大值。第二部分根据气候和季节将汽油的挥发性划分成不同的等级,分别执行。由于欧洲国家较多,具体情况差别较大,因此欧洲一些先进国家在满足欧洲统一法规的大前提下,又制定了符合自己国情的实施标准。 为了进一步降低汽车污染物的排放, EN 228-2002汽油质量标准(与欧Ⅲ排放法规相对应),将汽油硫含量降到150μg/g、芳烃含量降到42%、要求苯含量不大于1.0%,铅含量不大于5 mg/L,并对各种氧化物的含量加以限制。2005年,欧洲将开始执行欧Ⅳ排放标准,将清洁汽油中的硫含量降为50μg/g,芳烃、苯、烯烃含量分别降为35%、1.0% 和18%。2007年10月1日起推行无硫汽油(欧Ⅴ排放标准),使硫含量低于10μg/g,并出台了EN 228-2008汽油质量标准,于2009年1月1日开始强制执行,该标准为最新的欧盟汽油标准。欧盟汽油规格主要指标的变化见表1。 2. 《世界燃油规范》 《世界燃油规范》是美国汽车制造商协会(AAMA)、欧洲汽车制造商协会(ACEA)、日本汽车制造商协会(JAMA)根据所属的30个汽车公司的研究成果联合发表的,主要是汽车制造商和发动机制造商针对环保要求,对汽车燃料提出的基本要求。世界燃油规范要求清洁汽油降低硫含量,减少尾气中SO x的排放,抑制尾气转化器中催化剂中毒;降低烯烃含量,避免发动机进油系统和喷嘴堵塞,减少发动机进气阀和燃烧室中生成沉积物,减少汽车尾气中1,3-丁二烯的排放,避免汽油辛烷值分布不均;降低苯和芳烃含量,减少致癌物;降低蒸汽压和T90,减少挥发性有机化合物(VOC)、毒物(TOX)的排放;提高辛烷值,提高汽车动力性能,减少污染物的排放。 2006年9月,世界燃油规范进行了第四次修订,将无铅汽油标准划分为四类:
表面粗糙度高度参数有3种: 1.轮廓算数平均偏差: 轮廓算数平均偏差Ra是指在取样长度L内,被测轮廓上各点到基准线的距离Yi的绝对值的算数平均平均值。 2.微观不平度十点高度: 微观不平度十点高度Rz是指在取样长度L内,被测轮廓上五个最大轮廓峰高Ypi的平均值与五个最大轮廓谷底Yvi的平均值之和。 3.轮廓最大高度: 轮廓最大高度Ry是指在取样长度L内,被测轮廓的峰顶线与轮谷线之间的距离。 表征微观不平度高度特性的评定参数Ra、Rz、Ry的数值愈大则表面越粗糙。 在高度评定参数中,Ra的概念颇为直观,Ra值反应实际轮廓微观几何形状特性的信息量最大,且Ra值用触针式电动轮廓仪测量比较容易。因此对于光滑表面和半光滑表面,普遍采用Ra作为评定参数。但受测量仪器的限制,极光滑和极粗糙的表面不能用Ra评定。 评定参数Rz的概念较为直观,Rz值通常用非接触式的光切显微镜测量。但Rz值只反应取样长度内峰高和谷底的十个点,不能反应峰顶的尖锐和平顿的几何形状特性,因此Rz值不如Ra值反应得微观几何形状特性全面。 评定参数Ry的概念简单,Ry值得测量方便,但Ry值不及Rz、Ra值反应的微观几何形状特性全面。Ry值与Ra、Rz值连用控制微观不平度的谷深用来评定某些不允许出现较大加工痕迹和受交变应力作用的表面。 RMS值实际就是有效值,就是一组统计数据的平方的平均值的平方根。 因为RMS系统是英制单位 一般的有: RMS*25.4/1000=RA 举例: RMS64 = 64*25.4/1000= RA 1.6 几个常用的如下: RMS250 = RA6.4 RMS125 = RA3.2 RMS64 = RA1.6 RMS32 = RA0.8 表面粗糙度外国与中国标准对照 N1--0.025um;N2--0.05um;N3--0.1um; N4--0.2um;N5--0.4um;N6--0.8um; N7--1.6um;N8--3.2um;N9--6.3um; N10--12.5um;N11--25um; 日本表面粗糙度的老标准。 对应关系:
研究所代码 代码研究所 80005 中国科学院武汉岩土力学研究所 80007 中国科学院力学研究所 80008 中国科学院物理研究所 80009 中国科学院高能物理研究所 80010 中国科学院声学研究所 80012 中国科学院理论物理研究所 80014 中国科学院上海原子核研究所 80017 中国科学院近代物理研究所 80018 中国科学院国家天文台南京天文光学技术研究所80019 中国科学院国家天文台长春人造卫星观测站80020 中国科学院武汉物理与数学研究所 80021 中国科学院紫金山天文台 80022 中国科学院上海天文台 80023 中国科学院云南天文台 80024 中国科学院国家授时中心 80025 中国科学院国家天文台 80026 中国科学院声学研究所东海研究站 80027 中国科学院渗流流体力学研究所 80028 中国科学院新疆理化技术研究所 80029 中国科学院自然科学史研究所 80030 中国科学院理化技术研究所 80032 中国科学院化学研究所 80033 中国科学院广州化学研究所 80035 中国科学院上海有机化学研究所 80036 中国科学院成都有机化学研究所 80037 中国科学院长春应用化学研究所 80038 中国科学院大连化学物理研究所 80039 中国科学院兰州化学物理研究所 80040 中国科学院上海硅酸盐研究所 80041 中国科学院过程工程研究所 80042 中国科学院生态环境研究中心 80043 中国科学院山西煤炭化学研究所 80045 中国科学院福建物质结构研究所 80046 中国科学院青海盐湖研究所 80053 中国科学院兰州地质研究所 80054 中国科学院古脊椎动物与古人类研究所 80055 中国科学院南京地质古生物研究所 80057 中国科学院测量与地球物理研究所 80058 中国科学院大气物理研究所 80060 中国科学院地理科学与资源研究所 80061 中国科学院南京地理与湖泊研究所
医用氧项目 投资商业计划书xxx(集团)有限公司
医用氧项目投资商业计划书目录 第一章基本情况 第二章项目建设背景分析 第三章项目市场空间分析 第四章项目规划分析 第五章建设方案设计 第六章运营管理模式 第七章项目风险应对说明 第八章 SWOT分析 第九章进度计划 第十章投资规划 第十一章经济效益可行性 第十二章综合评价说明
摘要 该医用氧项目计划总投资11352.98万元,其中:固定资产投资9135.50万元,占项目总投资的80.47%;流动资金2217.48万元,占项目总投资的19.53%。 达产年营业收入21403.00万元,总成本费用16590.01万元,税金及附加215.41万元,利润总额4812.99万元,利税总额5692.26万元,税后净利润3609.74万元,达产年纳税总额2082.52万元;达产年投资利润率42.39%,投资利税率50.14%,投资回报率31.80%,全部投资回收期4.65年,提供就业职位323个。 报告根据我国相关行业市场需求的变化趋势,分析投资项目项目产品的发展前景,论证项目产品的国内外市场需求并确定项目的目标市场、价格定位,以此分析市场风险,确定风险防范措施等。
第一章基本情况 一、项目名称及建设性质 (一)项目名称 医用氧项目 (二)项目建设性质 该项目属于新建项目,依托xx循环经济产业园良好的产业基础和创新氛围,充分发挥区位优势,全力打造以医用氧为核心的综合性产业基地,年产值可达21000.00万元。 二、项目承办单位 xxx(集团)有限公司 三、战略合作单位 xxx有限责任公司 四、项目建设背景 xx循环经济产业园把加快发展作为主题,以经济结构的战略性调整为主线,大力调整产业结构,加强基础设施建设,积极推进对外开放,加速观念创新、体制创新、科技创新和管理创新,努力提高经济的竞争力和经济增长的质量和效益。该项目的建设,通过科学的产业规划和发展定位可成为xx循环经济产业园示范项目,有利于吸引科技
第三节药品标准 一、药品标准概述 1.药品标准是指对药品的质量指标、生产工艺和检验方法所作的技术要求和规定,内容包括药品的名称、成分或处方的组成;含量及其检查、检验方法;制剂的辅料;允许的杂质及其限量要求以及药品的作用、用途、用法、用量;注意事项;贮藏方法等。中药材、中成药、化学原料药及其制剂,生物制品等应根据各自的特点设置不同的项目。 2.国家药品标准《药品管理法》规定,国务院药品监督管理部门颁布的《中国药典》和药品标准为国家药品标准。 国家药品标准包括《中国药典》及增补本,经国家食品药品监督管理局批准的药品注册标准和颁布的其他药品标准,以及与药品质量指标、生产工艺和检验方法相关的技术指导原则和规范。 二、药品标准的分类 依据《药品管理法》规定,我国的药品标准分为国家药品标准和炮制规范。 1.国家药品标准分类《中国药典》、国家食品药品监督管理局颁布的药品标准和药品注册标准。 (1)《中国药典》由国家药典委员会编纂,国家食品药品监督管理局颁布。《中国药典》是国家药品标准的核心,是国家为保证药品质量、保护人民用药安全有效而制定的法典。 《中国药典》于1953年编纂出版第一版以后,相继于1963年、1977年分别编纂出版。从1985年起每5年修订颁布新版药典,现行版为2010年版《中国药典》。 2010年版《中国药典》是新中国成立以来第九版药典,本版药典收载品种总计4567个,与2005年版《中国药典》相比新增品种1386个;一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。药用辅料标准新增130多种。 (2)国家食品药品监督管理局颁布的药品标准这类药品标准是指未列入《中国药典》而由国家食品药品监督管理局颁布的药品标准,以及与药品质量指标、生产工艺和检验方法相关的技术指导原则和规范。 (3)药品注册标准是指国家食品药品监督管理局批准经申请人特定药品的标准,生产该药品的生产企业必须执行该注册标准。 根据《标准化法》规定和国际惯例,国家标准是市场准入的最低标准,原则上行业标准高于国家标准,企业标准应高于行业标准。所以,药品注册标准不得
书山有路勤为径,学海无涯苦作舟 美国国家标准技术研究院(NIST)的质谱计校准技术 国外对质谱计校准技术的研究工作开展的相对比较早,其中美国的质谱计校准技术是随着航天技术而发展的,从阿波罗计划到火星探测,NASA 在航天器上都搭载了不同的质谱计作为主要测量工具进行了多次探测。同时,美国真空学会在1993 年提出质谱计的四种校准方法,并建立了相应的校准装置。这四种方法分别是直接比对法、压力衰减法、小孔流导法、原位置校准法。真空技术网(chvacuum/)就主要分别讲述下这四种校准方法的详细内容。 1、直接比对法是将质谱计读数与参考标准规的读数直接进行比对,实现对质谱计的校准,其校准装置的工作原理如通过一个阀门控制气体流量,单一气体进入校准室,采用参考标准规测量气体压力,然后和质谱计的读数进行比对校准。参考标准规推荐使用磁悬浮转子规和电离规,由于参考标准规测量的是全压力,其灵敏度与气体种类有关,只能用于单一气体在质谱计和参考标准规重叠的测量范围内进行校准。 2、压力衰减法是通过小孔对压力进行衰减,以衰减后的压力作为标准压力进行校准,其工作原理如1.分压力质谱计 2.微调阀 3.旁通限流孔 4,5,7,10.隔断阀 6.参考标准规8.校准室9.机械泵11.热传导规12.分子泵13.放气阀 在气体引入系统和校准室之间并联一个隔断阀和旁通限流小孔,当校准 比较高的压力时,可以关闭割断阀4 和5,打开隔断阀7,利用质谱计和参考标准规进行直接比对; 当校准比较低的压力时,关闭隔断阀4 和7,打开隔断阀5,由于限流小孔的衰减作用,使得校准室的压力比气体引入系统的压力低几个数量级,测量限流小孔上下端的压力,计算得到限流小孔的衰减率,通过测量
一、主要品牌 鱼跃新松杭氧海龟氧立得海尔英维康 二、适用人群 各种老慢支、肺心病、心血管、肺气肿疾病等各种老年病。急性、慢性缺血缺氧性病症和因缺氧引起的继发性疾病,能够起到有效的作用。 三、基本原理 家用制氧机基本有三种: 化学反应制氧、膜过滤制氧、变压吸附制氧;变压吸附家用制氧机: 进口分子筛的,氧浓度在82%以上的(医用氧的标准是82%)。进口分子筛的制氧机可以连续24h开机,而且氧浓度比国产分子筛的稳定,一般氧浓度在93%左右。可以起到医疗的作用。价位国产的一般在2千以上,进口的在3千以上。 如果有肺部疾病的可以买一个带雾化的制氧机。(代表品牌鱼跃) 膜家用制氧机: 安全: 无需任何添加剂,从空气中稳定制出最佳吸氧浓度,符合国际A级用氧标准,最适合家庭长期氧疗使用。 省钱: 每小时耗电45W,除用电以外,无需任何费用;吸氧一小时仅花五分钱。 优质: 本机采用世界顶级富氧膜制氧技术,同进藏列车的制氧技术相同。 轻便:
它体积小,重量轻,相当于一个暖瓶的重量,可随意移动。 智能: 按照国际通用人性化技术,开机即出氧,操作很简单。 舒适: 特有的保湿功能,不用加水即能产生湿润的氧气,同时采用最先进的耳麦式供气方式,轻松吸氧很时尚。(代表品牌海氧之家) 化学家用制氧机: 化学制氧机的优点就是小巧,不占地,但是相比较其他分子筛制氧的机器制氧的质量和后期的消耗来说就差多了,它制氧机的过程中需要一直有纯净水,此外制出的氧气流量也没有那么大,如果把流量调大一些氧气浓度就很低,一般保健的话用没有问题。(代表品牌氧立得) 四、价格区间 1000~8000不等 五、使用中的缺点 化学制氧: 使用麻烦(每次使用后需清洗),使用费用高,化学药剂对身体有负面作用。 膜制氧: 膜过滤制氧,价格高些,但是是一次性投入(除了电费)。 分子筛制氧: 噪音大,体积大,寿命短,价格贵,耗电量大,3000元至两万元不等,医疗器械店。
药典与药品标准 1.药典 药典是一个国家记载药品规格,质量标准的法典。大多数由国家组织药典委员会编纂,并由政府颁发施行,具有法律的约束力。药典中收载医疗必需、疗效确切、毒副作用小、质量稳定的常用药物及其制剂,规定其质量标准,制备要求,鉴别,杂质检查,功能主治及用法用量等,作为药物生产,检验,供应与使用的依据。药典在一定程度上反映了该国家药物生产、医疗和科技的水平,也体现出医药卫生工作的特点和服务方向。药典在保证人民用药有效安全,促进药物研究和生产上起着重大作用。 新中国成立后,已颁布施行的《中华人民共和国药典》(简称《中国药典》)有1953 、1963 、1977、1985、1990、1995、2000及2005年共八版。除1953年版为一部,2005年版为三部外,其余均分为一部、二部两册。一部收载中药材和中药成方及单方制剂,二部收载化学药品、生化药品、抗生素、放射性药品、生物制品等各类制剂。将《中国生物制品规程》并入药典,设为药典三部。《中国药典》分别由凡例、正文、附录、和索引组成。 目前世界上有38个国家的药典及《国际药典》。我国经常参阅的主要有美国药典(U. S. P.)、英国药典(B.P.)和日本药局方(J. P)等。 2.药品标准 药品标准是国家对药品质量规格及检验方法所做的技术规定,是药品生产、供应、使用、检验和管理部门共同遵循的法定依据。 我国药品标准分为二级。《中国药典》和部(局)颁标准属国家药品标准;各省、自治区、直辖市药品监督管理部门及卫生部门批准的属地方药品标准。药品标准具有法规性质,属强制性标准。凡正式批准生产的药品及药用辅料要执行《中国药典》和部(局)颁标准。中药材、中药饮片分阶段,分品种实施,暂可参照执行省、自治区、直辖市药品监督局制订的《炮制规范》。 药品标准,英美法等国有国家处方集(NF),英国尚有准药典(BPC)等,日本有《日本药局方外药品成分规格》等。 “中华人民共和国卫生部药品标准”中药成方制剂自1989年第一册颁布以来,至1998年8月已发布至20册,总计收载中药成方制剂4061种。
某研究院PA+GF标准
————————————————————————————————作者:————————————————————————————————日期: ?
研究院企业标准 Q/20194000-7·138-2004 改性尼龙 2004-12-04发布2004-12-31实施
目次 前言 (Ⅱ) 1 范围........................................................................... (1) 2规范性引用文件................................................... 错误!未定义书签。 3 分类与标记?错误!未定义书签。 4 要求.................................................................................2 5 试验方法.............................................................................3 6 检验规则.............................................................................3 7标志、标签、使用说明书............................................................... 4 8 包装、运输、贮存..................................................................... 5
一. 常用国内外紧固件材料的标准及牌号对照 表<-> 钢中国GB 美国ASTM 德国DIN 日本工业JIS 英国BS 种标准种类代号标准种类代号标准种类代号牌号标准种类代号标准种类代号A194 Gr.1 Gr.2 GB669 45 Gr.2H G4051 S43C 4882 Gr.2H S45C Gr.2HM GB669 35 A307 Gr.A G3101 SS4l 5708 SS41 碳 素GB669 20 Gr.B G4051 S20C 1769 钢GB669 25 S25C GB669 30 A325 1 型1654 Cq85 1.1172 CG4051 S33C 8189 2 型 3A型 3B型 3C型 3D型 3E型 3F 型 YB6 1Cr5Mo A193 Gr.B5 G4107 SNB5 Gr.B6 GBl220 1Crl3 Gr.B6X 17440 X15Crl3 1.4024 4882 Gr.B6 GB307735CrMOA A193 Gr.B7 17200 42CrMo4 1.7225 G4107 SNB7 4882 Gr.B7 合 金 Gr.B7M 钢 和 YB6 15CrM01V Gr.B16 17240 21CrMoV57 1.7709 SNBl6 Gr.B16 不 GBl220 0Crl8Ni9 GL B8 17440 X5CrNi189 1.4301 G4303 SUS-304 GL.B8 锈 钢 Gr.B8A GBl220 1Crl8NillNb Gr.B8C X10CrNiNbl89 1.4550 SUS-347 Gr.B8C Gr.B8CA GBl220 0C17Nil2M02 Gr.B8M X5CrNiMo1810 l.4401 SUS-316 Gr.B8M Gr.B8MA Gr.B8N Gr.B8NA
RRRRRR集团股份有限公司文件 RRR文〔2019〕18号签发人:XXX 关于成立XXXX标准化技术研究院的请示 XXX质量技术监督局: 为推动RR省OO食品药品标准化技术(修)订工作,完善地方OO 食品安全体系,规范企业在OO食品药品生产经营行为,实现OO食品药品安全科学管理的标准化技术要求,拟成立XXX研究院,该院为民办非企业性质,以校企(XX股份有限公司、XX大学、XX大学、XX 大学、XX技术研究院共同合作)共建模式,依托“XXX”的优势资源,以RR省OO食品药品标准化技术研究院(筹)为平台,充分发挥技术、 - 1 -
人才、信息等优势;以OO食品、药品成分中的硒元素形态和定量标准化技术研究;OO食品研究与开发及OO食品标准研究;现有药品的OO 定量化研究与OO药品标准制定;OO中药材及OO中成药的质量标准研究;OO医药原料的质量标准研究为主要业务范围。通过技术研发促进硒产业标准化全方位发展,加快科技成果转化和应用,为WW脱贫致富和OO功能性农业建设作出新的贡献,推动硒产业集群标准化发展和技术创新的全面升级。 RR省OO食品药品标准化技术研究院(筹)人员组建的基本情况如下:省略 成立后的RR省OO技术研究院将以OO食品药品标准化技术研究制定与相关公益技术指导服务为经营宗旨,为推进全州X产业发展及全民大健康作出一份应用的贡献。成立的RR省OO食品药品标准化技术研究院按照要求需在RR省民政厅注册,现申请RR省质量技术监督局作为业务主管单位,望贵局及WW州质量技术监督局给予业务指导和把关。特此请示,望批复。 - 2 -
XX股份有限公司 二〇一九年十一月六日 (联系人:XXX 联系电话:XXX) 主送:WW质量技术监督局 抄送:WW州民政局 XXX股份有限公司2019年11月6日印发 - 3 -
医用氧年度质量回顾分析(2012.1.1~2012.12.31) 气体供应公司
医用氧(气态)产品年度质量回顾分析报告回顾周期:2012年1月1日-2012年12月31日
目录 一、基本情况概述 二、人员情况: 三、培训情况: 四、人员体检情况 五、对不合格中间体、成品和物料的控制: 六、变更控制、维护、验证回顾: 七、生产工艺和处方变更情况: 八、稳定性考察情况概述 九、自检情况 十、不良反应情况概述 十一、产品质量投诉、退货产品召回情况 十二、向药品监管部门的提交的申报项目及批准情况概述十三、结论
医用氧年度质量回顾分析 一、基本情况概述 1、回顾期限:2012年1月1日- 2012年12月31日 2、回顾年度的生产品种、批次、数量,不合格批次、数量; 医用氧(气态):采用深冷法空气分离制取医用液氧,经低温液氧泵、换热器后得到高压医用气氧,压入高压无缝钢瓶,钢瓶规格一般为6m3/瓶。瓶装医用氧成品经检验合格后出厂。 生产情况: 进行年度质量回顾分析的品种: 本年度医用氧(气态)成品检验无不合格批次。 二、人员情况: 人员变更情况:公司企业负责人发生了变更,由“!!!”变更为“!!!”,并于年月日在!!!省食品药品监督管理局进行了变更备案。 三、培训情况: 公司于2011年底制定详细的年度培训计划,由办公室与质量管理部共同负责组织,通过专家讲课、参加培训班、部GMP培训等方式对员工进行培训并考核。培训及考核容主要有《药品管理法》、《药品生产质量管理规》、生产知识、安全知识等方面。 药品检验人员!!!、!!!检验证书于年月到期,因此今年不需参加培训。
云计算安全工作组简介 美国国家标准技术研究所的云计算安全工作组(一) 年月份成立。 云安全标准制定路线图 开发出一种具有权威性的“云安全服务体系架构”,这种架构能够映射到其他云计算体系中去;识别云安全面临威胁,并对威胁进行相应地分类;确定哪些安全服务能解决云中可能遇到威胁;针对相应地威胁,对安全控制做一个形式化映射确定安全管理(包括合规)域,并将安全控制映射到域中;云安全战略实施与评估; 相关云安全标准 . 《云计算梗概和建议》 阐述了云计算的益处和已知的问题,概述云技术的主要大类,为组织应如何面对云计算所带来的机遇和风险,以及它们之间的关系提供了指导和建议。 . 《云计算标准路线图》 分析了云计算标准现状、存在问题,提出了有关改进建议。 . 《云计算定义》 对云计算的定义、服务模式、部署模式进行了正式界定。
. 《云计算参考体系架构》 提出了云计算参考框架及类型划分。 . 《美国政府云计算技术路线图》 包括三卷。第一卷主要提出政府应用云计算的大需求,以及应用云计算过程中需要考虑的各种因素;第二卷主要对政府应用云计算提供一些理论指导和案例,分析现有的不足,强调了安全问题,并提出一些指导性建议;第三届主要为政府部门部署云计算提供技术指引。 . 《公有云中的安全和隐私指南》 提供公有云计算的概况以及在安全和隐私方面的挑战,论述了公有云环境的威胁、技术风险和保护措施,并为规划出合理的信息技术解决方案提供了一些见解。提到联邦政府,美国商务部的分支机构美国国家标准与技术研究院,在过去的一年肯定一直在忙着发布各种专门的提案和报告,解决云计算建议,安全性及相关问题。 . 《完全虚拟化技术安全指南》年月 虚拟机隔离、虚拟机监控以及虚拟面临的安全威胁 相关云安全标准草案
论医用制氧机与液氧(罐)供氧政策分析 [摘要]对医用制氧机与液氧(罐)供氧政策分析,提出(医院供氧系统中)液氧供氧系统明显优于制氧机供氧系统的理论并进行政策分析。 [关键词]医用制氧机液氧(罐)供氧系统政策分析 中图分类号: tq116.14 文献标识码:a 文章编号: 名词定义: 1、医用中心供氧系统:氧气气源集中在中心供氧站,气源氧气通过减压装置和管道输送到手术室、抢救室、治疗室和各个病房的终端处,提供医疗使用。 《医用中心吸引系统、医用中心供氧系统产品技术审查规范》(京药监械〔2009〕49号) 2、医用氧:指低温空气分离法制取的医用氧,不包括医用分子筛变压吸附法制取的医用氧。(出自2006年12月23日《上海市食品药品监管局、上海市卫生局关于进一步规范医用氧生产和使用的通知》) 3、中心供氧站供氧方式有:氧气瓶组供氧、液氧供氧及液氧与气瓶组联合供氧(yy/t0187-94 医用中心供氧系统通用技术条件)。 4、医用制氧机—分子筛制氧设备: 医用分子筛制氧设备。该类产品适用于以医疗、保健为目的,以沸石分子筛为吸附剂,用变压吸附法(psa)制取医用氧气的医用
分子筛设备。 产品的结构组成 1、单人用的制氧设备至少应由制氧主机、流量计和湿化器等组成。 2、多人用制氧设备至少应由气源、分子筛吸附分离装置、控制装置、氧气流量检测装置和产品气滤器等部分组成。 分子筛变压吸附制氧机依据的是1998年颁布的行业标准《医用分子筛制氧设备通用技术规范》,其规定的氧气纯度只有90%,远远低于2010版《中国药典》规定的99.5%的氧纯度。 根据《医用分子筛制氧设备通用技术规范》规定,分子筛制氧只适用于单台制氧,不能用于管道供氧,以医疗保健为目的。 1、医用制氧机制氧(分子筛氧)的监管的政策分析: 国家食品药品监督管理局的“144号”文件,让各地方药监局对分子筛氧的监管陷入真空状态。尽管之后的2006年11月,国家药监局又下发了“586号”文件,否决了之前的“144号”文件。 由此,监管政策不一致、未有统一的用氧标准,致使分子筛氧的质量问题以及合法性问题,成为医用氧行业内久而未决的一大弊病。更加剧了医用氧市场的混乱和不公平竞争。 事实上对于分子筛氧的合法性问题,至今未有明确的法律规定。尽管2010年3月15日,郴州儿童医院工业氧事件爆发后,国家药监局下发了《关于加强医用氧监管工作的通知》(国食药监法