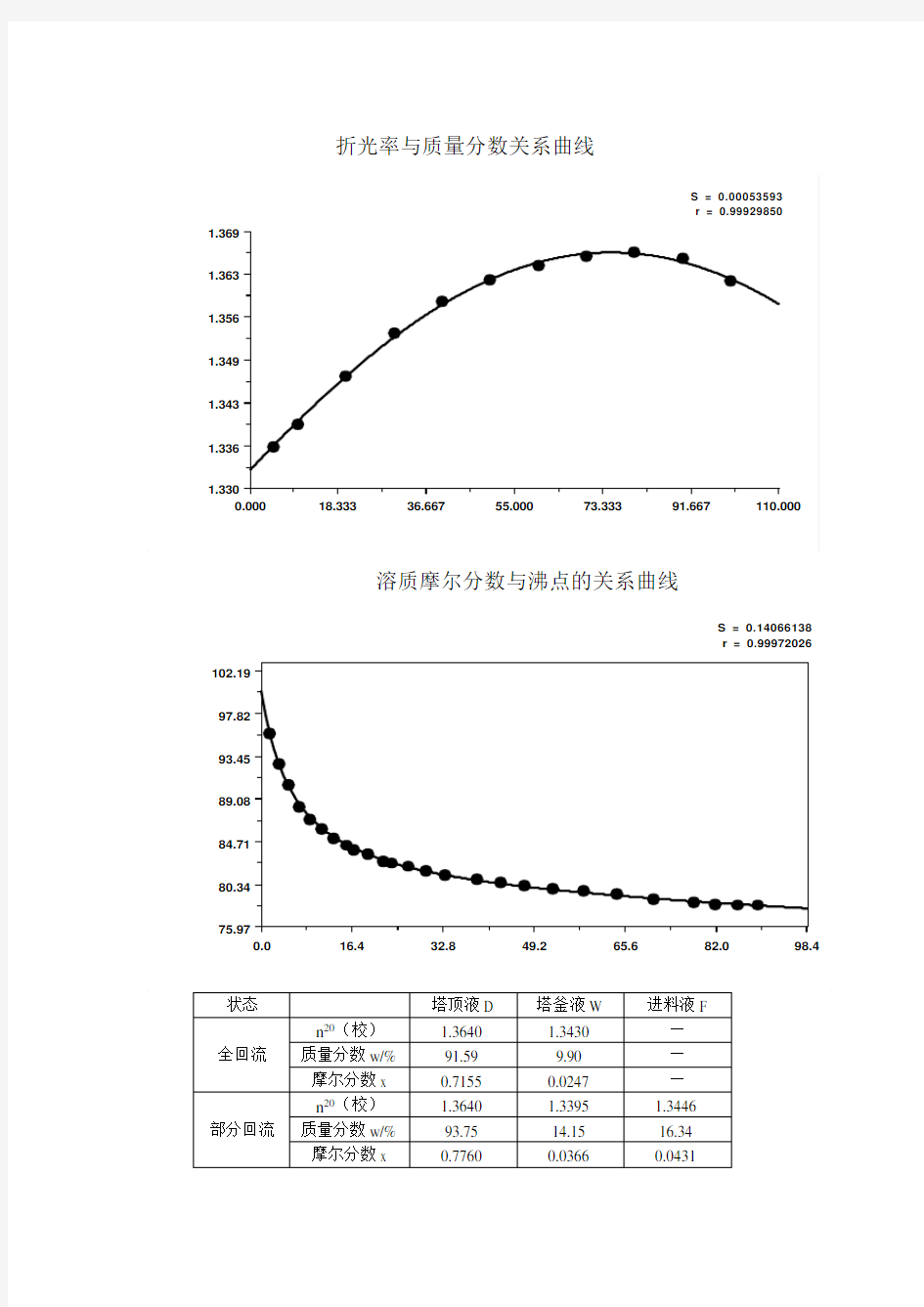
折光率与质量分数关系曲线
S = 0.00053593r = 0.99929850
0.000
18.33336.66755.00073.33391.667110.000
1.330
1.3361.343
1.349
1.356
1.363
1.369
溶质摩尔分数与沸点的关系曲线
S = 0.14066138r = 0.99972026
0.0
16.4
32.8
49.2
65.6
82.0
98.4
75.97
80.3484.7189.0893.4597.82102.19
状态 塔顶液D 塔釜液W 进料液F 全回流
n 20(校) 1.3640 1.3430 — 质量分数w/% 91.59 9.90 — 摩尔分数x 0.7155 0.0247 — 部分回流
n 20(校)
1.3640 1.3395 1.3446 质量分数w/% 93.75 14.15 16.34 摩尔分数x
0.7760
0.0366
0.0431
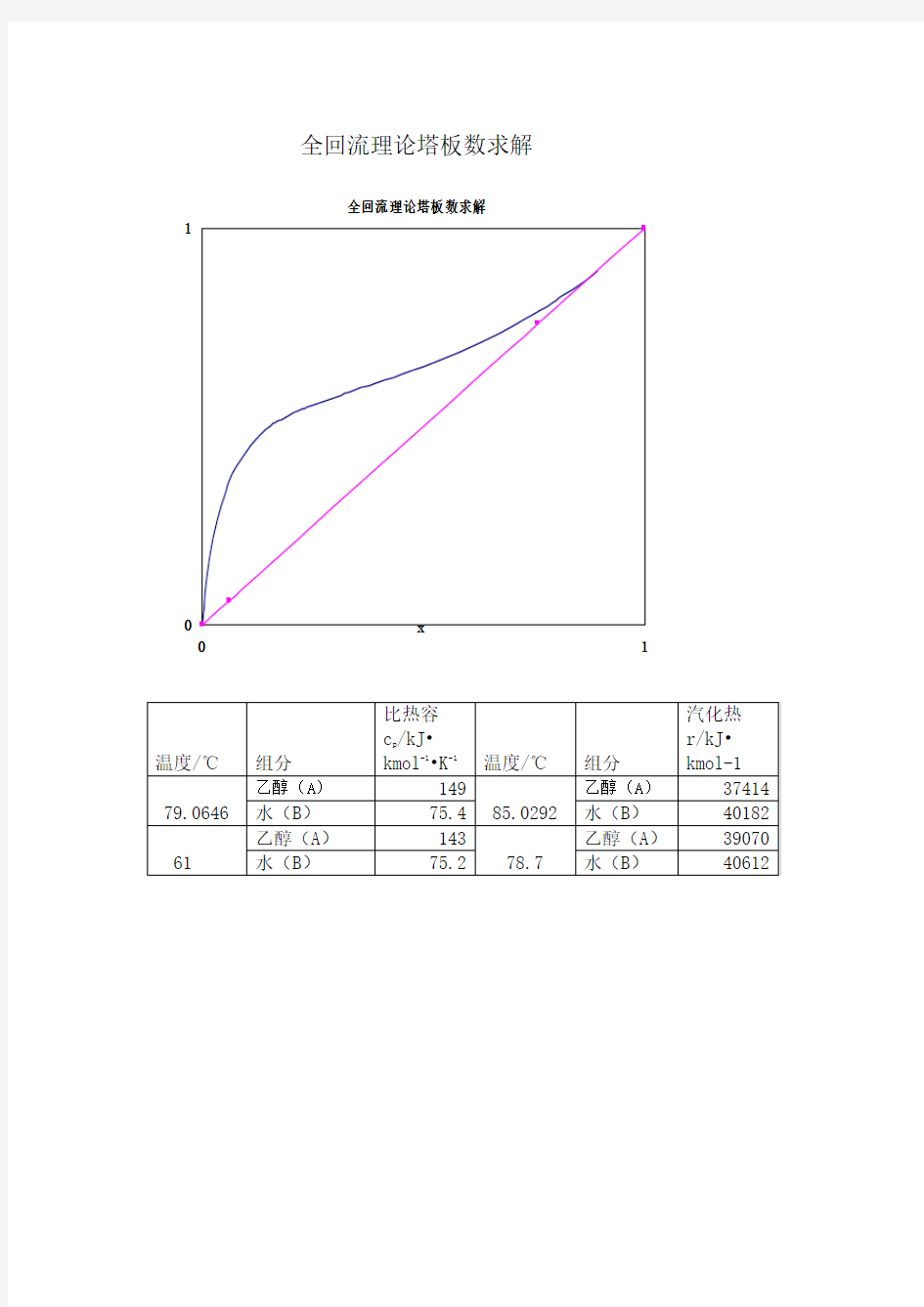
全回流理论塔板数求解
全回流理论塔板数求解
01
1
x
y
温度/℃ 组分
比热容
c p /kJ ?
kmol -1?K -1 温度/℃
组分 汽化热
r/kJ ?
kmol-1 79.0646 乙醇(A )
149
85.0292 乙醇(A ) 37414 水(B )
75.4 水(B ) 40182 61 乙醇(A )
143 78.7 乙醇(A ) 39070 水(B )
75.2 水(B ) 40612
部分回流理论塔板数求解
01
1
x
y
温度/℃ 组分 比热容c p /kJ ?kmol -1?
K -1 温度/℃
组分
汽化热r/kJ ?kmol-1 79.0646 乙醇(A ) 149
85.0292
乙醇(A )
37414 水(B ) 75.4 水(B ) 40182 61 乙醇(A ) 143
78.7
乙醇(A ) 39070 水(B ) 75.2 水(B )
40612
状态
温度/℃
折光率
n D
折光率n w
折光率
n F
全回流
19 1.3620 1.3410 20 1.3616 1.3406 20(校)
1.3640 1.3430 部分回流
19 1.3620 1.3375 1.3426 20 1.3616 1.3371 1.3422 20(校)
1.3640
1.3395
1.3446
一、关于溶解度的计算的类型 1溶解度概念:在一定温度下,某物质在100克溶剂中达到饱和状态时所溶解的溶质质量 为该物质在这种溶剂里的溶解度。 溶解度公式:溶解度=m溶质/m溶剂x 100g (1)四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,100g溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g) 2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。 (1)大多数物质的溶解度随着温度的升高而增大 ①影响很大,如硝酸钾,表现为曲线陡 ②影响不大,如氯化钠(食盐),表现为曲线平缓 (2)极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 2、溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)X 溶液密度(克/ 毫升) 3、溶液的稀释:m 浓溶液x a% =m 稀溶液x b% ( a> b) 其中:m稀溶液= m浓溶液+ m水 若用溶质质量分数不同 (a%、b%)的溶液A、B ,配制中间溶质质量分数的溶液 (c%), 贝U:m A x a% + m B X b% =( m A + m B)x c%
初中化学总复习溶解度曲线专题练习 9.右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。下列 说法错误的是( ) A . t 1 C 时,三种物质溶解度大小的顺序是 B > C > A 温度/ C t 1 B. t 2C 时,A 和B 两种物质的饱和溶液中溶质质量相同 C. t 3C 时,在100g 水里分别加入三种物质各 mg ,只有b 能形成饱和溶液 D ?从混。有少量C 的A 物质中提取较纯净的 A ,最适宜用蒸发溶剂的方法 10.右图是a 、b 、c 三种固体的溶解度曲线,下列说确的是 ( ) A . b 的溶解度一定小于 a 的溶解度 B ?当a 中含有少量b 时,可以用降温结晶的方法提纯 a C. 通过降低温度可将 c 的不饱和溶液变为饱和溶液 D. a 的饱和溶液从t 2C 降温至t i C 时变为不饱和溶液 11?有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是 () 0-o A. a 物质的溶解度随着温度的升高而增大 B. 在t 2C 时,a 、b 两种物质的溶液中溶质的质量分数一定相等 C. 将a 、b 两种物质的饱和溶液从 t 3C 降温至t i C, a 有晶体析出 D. t 3C 时,a 物质的溶解度大于 b 物质的溶解度 12. a 、b 、c 三种物质的溶解度曲线如右图所示。现有 t i C 时的a 、 三种物质的饱和溶液,将其都升温至 t 2C 时,下列说法中,正确的是 A. b 溶液 为饱和溶液 I. h h 温哎代 —> 淋£ ,b 无晶体析出 A 溶解 度” g B. a 溶液中有晶体析出 C. c 溶液为不饱和溶液 D. b 溶液中的溶质质量分数最大 13?右图所示为甲、乙两物质(均不含结晶水)的溶解度曲线。50C 时,取甲、 乙两种物质各 50g ,分别加人100g 水中,使之充分溶解。下列有关说法不 正确的是 ........... () A. 上述混合物在 20 C 时,甲和乙形成溶液的质量相等 B. 在0C 时,溶液中溶质的质量分数甲小于乙 C. 温度高于50 C 时,甲和乙形成的溶液都变为不饱和溶液 D. 50C 时,将甲、乙两种物质的混合物分别降温至 20C ,溶液中未溶解晶 体的质量相等 14、右图是a 、b 两种固体物质的溶解度曲线图, 下列说法中不正确的是 ( A.任何温度下,a 的溶解度大于b 的溶解度 B. a 的溶解度受温度变化的影响比 b 的大 C. t 1 C 至t 2 C 之间b 曲线以下区域为 a 、b 两物质的不饱和溶液 D. 对于a 与b 混合溶液,可利用冷却结晶的方法来分离 15.甲、乙两物质的溶解度曲线如右图所示。下列叙述中,正确的是 -( A . t 1C 时,甲和乙的溶解度均为 30 B. t 2C 时,甲和乙的饱和溶液中溶质质量分数相等 C. t 2C 时,在t 1 t 2温度/C 20 30 50世度 (覽) )溶 解 度50 g 40 30
一、关于溶解度的计算的类型 1、溶解度槪念:在二趣度下,某物质在100克溶剂中达到饱和状态时所溶解的溶质质量 为该物质在这种溶剂里的潘解度。 溶解度公式J溶解度二m辭Jm侑n X lOOg 注意: (1)四个关键词:一世的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,lOOg溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g) 2、溶解度曲线:温度为横坐标?溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。(1)大多数物质的溶解度随着温度的升高而增大 ①影响很大,如硝酸钾,表现为曲线陡 ②影响不大?如氯化钠(食盐),表现为曲线平缓 (2)极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等二、溶质质量分数的计算 "溶质质量分数=吟 2、溶液质量与体积之间的换算:溶液质量(克)=溶液体积(亳升)X溶液密度(克/ 亳升) 3、溶液的稀释J m細液X a% = m财波X b% (a>b)其中J m财液=m畑液+ m 水 若用溶质质量分数不同(a%、b%)的溶液A、B,配制中间溶质质量分数的溶液(C%), 贝Ij: maXa% + n^Xb% = (nu + mJ Xc% 三、溶解度与质量分数的比较。
溶液是否饱和 一泄达到饱和 不一宦 单位 g 关系式 溶解度=X100g 溶质的质量分数=X lOOg 初中化学总复习溶解度曲线专题练习▲ ff i I 解T 严 Zf 9?右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。下列 说法错误的是(〉 bt 时,三种物质溶解度大小的顺序是B>C>A tJC 时,A 和B 两种物质的饱和溶液中溶质质虽相同 t 「C 时,在iOOg 水里分别加入三种物质各mg,只有b 能形成饱和溶液 从'混?有少量C 的A 物质中提取较纯净的A.最适宜用蒸发溶剂的方法 A- B. C ? D ? 10.右图是a 、b 、c 三种固体的溶解度曲线,下列说法正确的是( ) b 的溶解度一泄小于a 的溶解度 A- 当a 中含有少量b 时,可以用降温结晶的方法提纯a 通过降低温度可将C 的不饱和溶液变为饱和溶液 a 的饱和溶液从t2°C 降温至tJC 时变为不饱和溶液 111 - B. C ? D. 11. 有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是() a 物质的溶解度随着温度的升高而增大 在t2°C 时,a 、b 两种物质的溶液中溶质的质量分数一宦相等 将a 、b 两种物质的饱和溶液从t3°C 降温至tfC. a 有晶体析出力无晶体析出 t3°C 时,a 物质的溶解度大于b 物质的溶解度 溶’ A. B. C ? D. 12. a 、b 、c 三种物质的溶解度曲线如右图所示。现有t/C 时的a 、b 、c 譬 三种物 质的饱和溶液,将其都升温至t 「C 时,下列说法中,正确的是()< b 溶液为饱和溶液 ■ a 溶液中有晶体析出 A. B. C 溶液为不饱和溶液 b 溶液中的溶质质量分数最大 13. 右图所示为甲、乙两物质(均不含结晶水)的溶解度曲线。50°C 时,取甲、 乙两种物质^$50g,分別加人lOOg 水中,使之充分溶解。下列有关说法不 正确的是() A. 上述混合物在20°C 时,甲和乙形成溶液的质量相等 B. 在0°C 时,溶液中溶质的质呈分数甲小于乙 C. 温度高于50°C 时,甲和乙形成的溶液都变为不饱和溶液 D. 50°C 时,将甲、乙两种物质的混合物分别降温至20°C,溶液中未溶解晶 体的质量相等 14、 右图是6 b 两种固体物质的溶解度曲线图,下列说法中不正确的是( C ? 0 t2温度/'C ias/t b c b ° X 溶* 度 X 溶 〉解 tl XI
2020-2021学年高一化学易混易错归纳与专练(人教版必修1)易错专题09 溶解度、溶质质量分数和物质的量浓度之间的关系 易错点一溶质的质量分数与物质的量浓度之间的换算 【易错典例】 例1 某氯化镁溶液的密度为1.16 g·cm?3,其中镁离子的质量分数为 4.1%,500 mL 该溶液中Cl?的物质的量浓度约等于 A.4.0 mol·L?1B.2.4 mol·L?1 C.2.1 mol·L?1D.1.26 mol·L?1 【答案】A 【解析】MgCl2中Mg离子的质量分数为24 95 ,溶液中镁离子的质量分数为4.1%,则溶液中氯化镁的质量分数 为:4.1% 24 95=16.2%,溶液中氯化镁的物质的量浓度为:c=1000×1.16×16.2% 95 mol/L ≈1.98 mol/L,则 c(Cl?)=2c(MgCl2)=2×1.98 mol/L ≈4.0 mol/L,故选A。【解题必备】 溶质的质量分数ω与物质的量浓度c c=n V = /1000 m M mρ 质质 液液 / = /1000 m M m ω ρ ? 质质 液液 / = 1000 M ρω 液 质 (密度的单位为g·cm?3或g·mL?1) 【变式体验】 将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL?1。 (1)该溶液中NaOH的物质的量浓度为______。 (2)该溶液中NaOH的质量分数为______。 (3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为______,NaOH的质量分数为______,溶液的密 度为______,含NaOH的质量为______,含NaOH的物质的量为______。 (4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________。 【答案】(1)6.1 mol·L?1 (2)20% (3)6.1 mol·L?120% 1.219 g·mL?1 2.44 g0.061 mol (4)0.61 mol·L?1
溶解度、质量分数、物质的量浓度 一、知识概要 (一)有关溶解度的计算 在一定温度下的饱和溶液中,溶质、溶剂、溶液间有一定量的关系。由此可进行以下计算:(1)根据饱和溶液溶质、溶剂的量推算溶解度;(2)根据溶解度求算饱和溶液所含的溶剂和溶质量;(3)根据溶解度求算饱和溶液在蒸发掉一定量溶剂后析出的结晶量;(4)由于物质在不同温度下溶解度不同,可以根据不同温度下的溶解度求算出一定量饱和溶液由于温度改变(或同时有溶剂量改变),析出结晶的量。(5)饱和溶液中溶解度与溶质的质量分数的换算。 一定温度下,某饱和溶液溶质的溶解度: 解题时要熟练运用下列比列关系:饱和溶液中 (二)有关质量分数、物质的量浓度的计算 有关质量分数的计算比较简单,但注意两点:一是含结晶水化合物的浓度均按无水物含量计算;二是有些溶质溶解后与水发生了反应,其不能直接按原物质的量表示,如SO3、Na2O2溶于水,溶液浓度按H2SO4、NaOH含量计算。 与物质的量浓度有关的计算有:(1)配制一定物质的量浓度所需溶质、溶剂量或浓溶液稀释用量的计算;(2)根据所溶溶质的量求算物质的量浓度、离子物质的量浓度;(3)物质的量浓度与质量分数的换算。 二、例题分析 例1已知某饱和氯化钠溶液体积为VmL溶液密度为dg/cm3,质量分数为w%,物质的量浓度为Cmol/L,溶液中含NaCl的质量为mg。 (1)用w表示在该温度下NaCl的溶解度是__ __。 (2)用m、V表示溶液的物质的量浓度是__ __。 (3)用w、d表示溶液的物质的量浓度是__ __。 (4)用c、d表示溶液的质量分数是_ ___。 解析:本题没有给出具体数值,只给出抽象符号。 解题关键是:一要准确把握饱和溶液溶解度、质量分数的本质区别和相互联系,二要理解密度是质量分数与物质的量浓度相互换算的桥梁。 (1)要求把饱和溶液的质量分数换算为溶解度: (2)要求用VmL溶液中的溶质质量m来表示物质的量浓度: (3)要求把质量分数(W%)换算为物质的量浓度: (4)要求把物质的量浓度换算为质量分数,实质是(3)小题的逆运算:
专题训练--溶质质量分数和溶解度 一、基础知识要点: 1、 溶质质量分数概念:溶质质量与溶液质量之比,可用小数或者是百分数表示。 2、 科学上用溶质的质量分数来定量表示溶液的组成。 3、 有关计算公式:溶质质量分数=溶质质量÷溶液质量 液 质M M a % 4、 溶解度与溶质质量分数的比较 二、有关溶质质量分数基础知识专题训练; 1、食盐水的浓度5%,它表示 克溶液里有 克食盐水和 克 水。10千克这样的食盐水中含食盐 千克,含水 克。 2、 克氯化钠溶于 克水中,可制的60克5%的食盐溶液: 克
10%的氯化钠溶液蒸干可得氯化钠20克,克10%的氯化钠溶液中含水45克。 3、现有20℃时10%的硝酸钾溶液50克:(要求列式计算) ⑴加入10克硝酸钾后,其质量分数为 ⑵加入50克水后,其质量分数为 ⑶加入10克硝酸钾和15克水后,其质量分数为 ⑷蒸发掉10克水后,其质量分数为 ⑸加入20%的硝酸钾溶液50克后,其质量分数为 ⑹已知20℃时,硝酸钾的溶解度为31.6克,现加入20克硝酸钾,其饱和溶液的质量分数为 4、T℃时,将某物质a 克溶于水恰好制成V毫升饱和溶液(此时溶液密度为d克/ 厘米3)则T℃时该物质溶液为,饱和溶液质量分数为。 5、配制50克5%的氯化钠溶液,其步骤是:(1)(2)(3) 6、在一定温度下,A物质的溶解度为25克,则此温度下,该物质的饱和溶液的质量分数为 :在一定温度下,B物质的饱和溶液的溶质质量分数为40%,则此温度下,B物质的溶解度为克 7、从60克15%的食盐溶液中取出20克溶液,则这20克溶液中溶质的质量分数为 8、现将20℃100克15%的食盐溶液升温到60%时(溶液中溶质和溶剂的量不变)溶液中溶质的质量分数为:现将20℃100克15%的食盐溶液恒温蒸发水分,则溶液中溶质质量分数在(增大或减少),当溶液成为20℃时的时,溶液浓度达到最大,其最大值为(20℃时,食盐的溶解度为36克) 9、向20℃时100克食盐饱和溶液中加入3克食盐,则此时食盐中溶质的质量分数是多大? 10、已知20℃时,食盐的溶解度为36克,40克水中加入18克食盐,充分溶解后,能得到食盐溶液多少克?这种溶液的溶质质量分数为多少? 11、已知40℃,A物质饱和溶液的质量分数为40%,求A物质在40℃时的溶解度。
【基本知识回顾】 (1) 某浓度的食盐溶液取出部分后,剩余溶液的浓度( ) A. 变小 B. 变大 C.不变 D.无法确定 (2) 将40C 时的硝酸钾饱和溶液冷却到 20C ,在温度变化前后, 溶液中保持不变的是( ) A. 溶质质量 B.溶剂质量 C.溶液质量 D.溶液浓度 (3) 下列关于饱和溶液的叙述中正确的是( ) A ?饱和溶液一定是浓溶液 B ?在相同温度下,同一溶质的饱和溶液一定比不饱和溶液浓 C ?在一定温度下,某物质的饱和溶液溶解溶质的量一定达到了最大值 D ?浓溶液一定是饱和溶液 ( ) B ?不饱和溶液降低温度后一定变成饱和溶液 D .溶质可以是固体、气体或液体 (5) .对于多数固体溶质的不饱和溶液,要使之成为饱和溶液,可采用的方法有( ) ① 降低温度;②升高温度;③加同种溶质;④加溶剂;⑤恒温蒸发溶剂。 A. ①③⑤ B.②③④ C.①②③ D.②③⑤ 溶液的是 () (7)判断正误: (1) 向20C 时氯化钠饱和溶液中加入 1克氯化钠,溶液的质量增加。 (2) 随水量的增加,能溶解的物质增加,所以溶解度随溶剂量的增大而增大。 (3) 将氢氧化钙的不饱和溶液变成饱和溶液,克采用加溶剂、降温的方法。 (4) 一定温度下,100克氯化钾的饱和溶液中有氯化钾 10克,则:该温度下氯化钾的溶解度为 10克。 一、溶解性和溶解度 (4).关于溶液的说法中正确的是 A .溶液一定是无色透明的液体 C.浓溶液可能是不饱和溶液
1、物质的溶解性:一种物质在另一种物质中的溶解能力。 2、饱和溶液与不饱和溶液:在一定温度和一定量溶剂里,不能再溶解某种溶质的溶液叫这种溶质的饱和溶液; 还能溶解某种溶质的溶液叫这种溶质的不饱和溶液。 3、物质的溶解度:在一定温度下,某固体在100 g溶剂里溶解达到饱和状态时所溶解的溶质质量溶解 (用S表示度) 溶解度(g):ioog = 溶质质量(g):溶剂质量(g) 溶解度(g):〔I00g+溶解度(g)〕=溶质质量(g):饱和溶液的质量(g) 即:s: 100 = m溶质:m溶剂 S:(100+s)=m溶质:m溶液 4、溶解度和溶解性的关系:溶解度是衡量物质溶解性的尺度。 5、固体物质的溶解度曲线: ①横坐标表示___________ ,纵坐标表示______________ . ②同一条溶解度曲线上的点表示同种物质在____________ 的溶解度。 ③两条曲线交点的含义_____________________________________ ④诲解度曲线施反映出固体物质涪解度爻温度彰响情氓(本盾意义): a大多数固体物质的溶解度随温度的升高而__________ ,例如____________ ; b少数固体物质的溶解度受温度的影响不大,例如; c 极少数固体物质的溶解度随温度的升高而,例如。 应用溶解度曲线可以比较不同物质在同一温度下的溶解度,知道温度或溶解度求对应的溶解度或温度 6、溶解度曲线意义: ①可判断某物质在一定条件下的溶解度。 ②可以比较不同物质在相同温度下或某一温度范围内溶解度的大小。 ③反映物质的溶解度随温度的变化规律。 7、过滤和结晶 (一)过滤 1. 过滤:把不溶于液体的固体物质跟液体分离的一种方法。 2. 原理:固体颗粒大,不能通过滤纸,而滤液可以通过滤纸。 3.注意问题:“一贴二低三靠”,即 一贴:滤纸紧贴漏斗内壁; 二低:滤纸边缘低于漏斗边缘; 液面低于滤纸边缘; 三靠:烧杯紧靠玻璃棒; 玻璃棒紧靠滤纸三层的部 分; 漏斗的下端紧靠烧杯内 壁。 二)结晶 1. 晶体:具有规则几何外形的固体。 2. 结晶:晶体从溶液中析出的过程。
溶解度与质量分数计算 1、要配制50℃的KCl饱和溶液,(50℃时KCl的溶解度是42.6g) ⑴25gKCl应溶解在______克水中,⑵在25g水中能溶解_______克KCl。 2、在t℃时,CuSO4的溶解度为Sg,在该温度下,把Sg无水硫酸铜粉末加入(100+S)g饱和硫酸铜溶液中,得到 一定量的蓝色晶体,若要把此晶体溶解成饱和溶液,应加水的质量为() A (100+S)g B 100g C (100-98/25)g D 无法确定 3、在60℃的恒温条件下,200g的甲物质溶液蒸发掉20g水,能析出10g不含结晶水的甲物质,再蒸发20g水 又能析出20g不含结晶水的甲物质,那么原溶液中质量分数为______;在此温度下甲物质的溶解度为 _________. 4、某温度下,在100g水中加入mgCuSO4或加入ngCuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合 () A m=160n/250 B m=1600n/(2500+9n) C m=1600n/(2500+16n) D m=1600n/(2500+25n) 5、某温度时,化合物甲的饱和溶液mg中含溶质ag,化合物乙的饱和溶液mg中含有溶质bg,则在此温度时,甲、 乙两化合物的溶解度之比是_________。 6、某物质Wg,在t℃时溶于水成VmL饱和溶液,其物质的相对分子质量为m。该溶液的密度为ρ,则该溶液的 质量分数为______________, 此温度下,某物质的溶解度为__________________。 7、设CuSO4在某温度下的溶解度为Sg,则CuSO4·5H2O在同温度下的溶解度为_______________________. 8、30℃时的一定质量的硫酸铜溶液,若保持温度不变加入25g胆矾或去掉55g水后,均得到饱和溶液,求30℃ 硫酸铜的溶解度是_______。 9、已知某盐在不同温度下的溶解度如表,若把质量分数为22%的该盐由50℃逐渐冷却,则开始析出晶体的温度 范围是() 30-40℃ 10、参照物质的溶解度,以NaOH固体、水、碳酸钙固体、盐酸为原料制取33g纯碳酸氢钠。 ⑵若用固体NaOH17.86g,则需用水________________克。 11、用一定浓度的硫酸溶液,逐滴滴入氯化钡溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原 氯化钡溶液的质量,则硫酸溶液的质量分数为_______________________。 一、有关多因素变化时的计算 1、把60℃时300g硝酸钾饱和溶液蒸发掉40g水,再冷却到10℃时,问有多少克硝酸钾晶体析出?(硝酸钾溶 解度60℃时为110g,10℃时为21g.) 2、向268g20℃时的KCl饱和溶液中加入50g水,并把温度升高到40℃,问要使溶液继续饱和,还需要加入多 少克氯化钾?(已知KCl20℃时溶解度为34g,40℃时为40g。) 3、将80℃时的500g硫酸铜溶液,蒸发掉100g水,再冷却到30℃,问可析出硫酸铜晶体多少克?(已知硫酸 铜溶解度80℃时为55g,30℃时为41g。) 4、将30℃的含有某溶质的溶液136g分成等量的两份,向其中一份加入该溶质10g,结果只溶解了2g就不再溶 解了;另一份冷却至0℃,析出溶质(不含结晶水)5.5g,此时溶液的质量分数为20%。则该物质在30℃时的 溶解度为多少克? 5、将100g50%的硫酸铜溶液的温度从t1℃降到t2℃后过滤,得滤液80g。下列说法中正确的是()
对于密度>1g/cm3的溶液(如硫酸、普通盐溶液等),等体积混合,W混>1/2(W1+W2). 对于密度<1g/cm3的溶液(如乙醇、氨水等溶液),等体积混合,W混<1/2(W1+W2). 只要是等质量混合,必有W混=1/2(W1+W2). 这里的相对大小也适合物质的量浓度。 对于密度>1g/cm3的溶液(如硫酸、普通盐溶液等),等体积混合,c混>1/2(c1+c2). 对于密度<1g/cm3的溶液(如乙醇、氨水等溶液),等体积混合,c混<1/2(c1+c2). 速解等体积溶液混合后的浓度 例1:已知25%的氨水的密度为,5%的氨水的密度为,若将上述两溶液等体积混合,所得氨水的质量分数是() A. 等于15% B. 大于15% C. 小于15% D. 无法估算 解析:这是一类同溶质不同浓度的溶液等体积混合,求解混合溶液的质量分数的选择题。通常已知混合前两溶液的质量分数,且浓溶液的质量分数是稀溶液的整倍数,要估算混合后的质量分数,关键是要弄清两溶液的密度及其与水的密度的相对大小关系。下面对其计算规律以氨水为例讨论归纳如下: 设浓氨水的质量分数为,其密度为,稀氨水的质量分数为a,其密度为,且。若将其等质量混合,混合后的质量分数为: 即混合溶液的质量分数为其稀浓溶液浓度的平均值; 若将其等体积混合,混合后的质量分数为 说明:从A步到B步 即将不同质量分数的氨水等体积混合,其混合溶液的质量分数小于按等质量混合的浓度,亦即小于稀浓溶液浓度的平均值,故选C项。 例2:密度为的氨水,质量分数为25%,该氯水用等体积的水稀释后,所得溶液的质量分数是() A. 等于12.5% B. 大于12.5% C. 小于12.5% D. 无法确定 解析:由上述讨论可知,此题与例1完全相似,差别在于用水替代了稀氨水,只需将水当成质量分数为0%的氨水即可,故选C项。
溶解度和溶质的质量分数(基础) 【学习目标】 1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。 2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。 3.初步学会配制一定溶质质量分数的溶液。 【要点梳理】 要点一、饱和溶液、不饱和溶液 1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。 2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。 3.饱和溶液、不饱和溶液的转化方法: 大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体): 4.判断溶液是否饱和的方法: 一般说来,可以向原溶液中再加入少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。 【要点诠释】 1.饱和溶液、不饱和溶液概念的理解 (1)首先要明确“一定条件”、“一定量的溶剂”。在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。 (2)必须明确是某种溶质的饱和溶液或不饱和溶液。如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。 2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。 要点二、溶解度、溶解度曲线 1.固体的溶解度: 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。如果不说明溶剂,通常所说的溶解度是指物质在水里的溶解度。 2.正确理解固体的溶解度概念需要抓住四个因素: (1)一定温度。同一种固体物质在不同温度下对应的溶解度是不同的,因此必须指明温度。 (2)100g溶剂。此处100 g是指溶剂质量,不能误认为溶液质量。 (3)饱和状态。在一定温度下,某固态物质在100 g溶剂里所溶解的最大质量为这种物质在这种溶剂里的溶解度。 (4)单位:g 3.影响固体溶解度的因素: (1)溶质、溶剂的性质;(2)温度。 4.固体物质的溶解度与溶解性的关系:
1溶解度概念:在一定温度下,某物质在 100克溶剂中达到饱和状态时所溶解的溶质质量 初中化学总复习溶解度曲线专题练习 溶 甲 / / /乙 解& —— 度4( /g 3( 2( 7 /门 1 ( _ 为该物质在这种溶剂里的溶解度。 溶解度公式: 溶解度=m 溶质/m 溶剂X 100g 注意: (1) 四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2) 溶解度就是一定温度下,100g 溶剂中能溶解的溶质的最大质量 (3) 溶解度单位为克(g ) 2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。 (1)大多数物质的溶解度随着温度的升高而增大 ①影响很大,如硝酸钾,表现为曲线陡 ②影响不大,如氯化钠(食盐),表现为曲线平缓 (2)极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 溶质质量 1、溶质质量分数 =、宀、亠” 100°。 溶液质量 2、 溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)X 溶液密度(克/ 毫升) 3、 溶液的稀释: m 浓溶液X a % = m 稀溶液X b % (a > b ) 其中:m 稀溶液=m 浓溶液+ m 水 若用溶质质量分数不同 (a %、b %)的溶液A 、B,配制中间溶质质量分数的溶液 (c %), 贝U : m A X a % + m B X b % =( RA + m B )x c %
A. t 「C 时,三种物质溶解度大小的顺序是 B > C > A B. t 2C 时,A 和B 两种物质的饱和溶液中溶质质量相同 C. t 3C 时,在100g 水里分别加入三种物质各 mg 只有b 能形成饱和溶液 D. 从混有少量C 的A 物质中提取较纯净的 A,最适宜用蒸发溶剂的方法 10. 右图是a 、b 、c 三种固体的溶 解度曲线,下列说法正确的是 ( ) A. b 的溶解度一定小于 a 的溶解度 B. 当a 中含有少量b 时,可以用降温结晶的方法提纯 a C. 通过降低温度可将 c 的不饱和溶液变为饱和溶液 D. a 的饱和溶液从t 2C 降温至t i C 时变为不饱和溶液 11. 有关a 、b 两种物质的溶 解度曲线如图所示,下列叙述不正确的是 () A. a 物质的溶解度随着温度的升高而增大 B. 在t 2C 时,a 、b 两种物质的溶液中溶质的质量分数一定相等 C. 将a 、b 两种物质的饱和溶液从 t 3C 降温至t 1C, a 有晶体析出 D. t 3C 时,a 物质的溶解度大于 b 物质的溶解度 12. a 、b 、c 三种物质的溶解度曲线如右图所示。现有 tJC 时的a 、 三种物质的饱和溶液,将其都升温至 t 2C 时,下列说法中,正确的是 A. b 溶液为饱和溶液 B. a 溶液中有晶体析出 C. c 溶液为不饱和溶液 D. b 溶液中的溶质质量分数最大 13. 右图所示为甲、乙两物质(均不含结晶水)的溶解度曲线。50C 时,取甲、乙两种物质各 50g ,分别加人100g 水中,使之充分溶解。下列有关说法不正确的是 ....... () A. 上述混合物在 20 C 时,甲和乙形成溶液的质量相等 B. 在0C 时,溶液中溶质的质量分数甲小于乙 C. 温度高于50 C 时,甲和乙形成的溶液都变为不饱和溶液 D. 50C 时,将甲、乙两种物质的混合物分别降温至 20C ,溶液中未溶解晶体的质量相等 14、右图是a 、b 两种固体物质的溶解度曲线图,下列说法中不正确的是( ) A. 任何温度下,a 的溶解度大于b 的溶解度 B. a 的溶解度受温度变化的影响比 b 的大 C. t 1 C 至t 2 C 之间b 曲线以下区域为 a 、b 两物质的不饱和溶液 D.对于a 与b 混合溶液,可利用冷却结晶的方法来分离 ,b 无晶体析出 b 、 c ()
一、关于溶解度的计算的类型 1、溶解度概念:在一定温度下,某物质在100 克溶剂中达到饱和状 态时所溶解的溶质质量为该物质在这种溶剂里的溶解度。 溶解度公式:溶解度=m 溶质/m 溶剂 × 100g 注意: (1) 四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,100g 溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g ) 2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。 (1) 大多数物质的溶解度随着温度的升高而增大 ①影响很大,如硝酸钾,表现为曲线陡 ②影响不大,如氯化钠(食盐),表现为曲线平缓 (2) 极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 1、溶质质量分数 = 00100 溶液质量 溶质质量 2、溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)× 溶液密度(克/毫升) 3、溶液的稀释:m 浓溶液 × a % = m 稀溶液 × b % (a >b ) 其中:m
稀溶液= m浓溶液+ m水 若用溶质质量分数不同(a%、b%)的溶液A、B,配制中间溶质质量分数的溶液(c%), 则: m A×a%+ m B×b%=(m A+ m B)×c% 三、溶解度与质量分数的比较。 比较项目溶解度溶质的质量分数 意义 表示物质溶解 性的度量,受外 界温度、压强等 影响 表示溶液中溶质质 量的多少,不受外 界条件限制 温度要求一定不一定 溶剂量要求100g不一定 溶液是否饱 和 一定达到饱和不一定单位g 关系式溶解度=×100g 溶质的质量分数= ×100g 初中化学总复习溶解度曲线专题练习 9.右图所示曲线a、b、c分别代表A、B、C三种物质的溶解度曲线。下列说法错误的是() A.t1 ℃时,三种物质溶解度大小的顺序是B>C>A B.t2℃时,A和B两种物质的饱和溶液中溶质质量相同C.t3℃时,在100g水里分别加入三种物质各mg,只有b 能形成饱和溶液 50- 40- 30- 20- 10- 甲 乙 温度/ t1t2 溶 解 度 /g
溶解度曲线和溶质质量分数计算 1、把少量下列物质分别放到水中,充分搅拌,可以得到溶液是的() A.蔗糖 B.面粉 C.植物油 D.钡餐 2、下列物质中,属于溶液的是() A.糖水 B.牛奶 C.米粥 D.豆浆 3、根据图4信息判断,下列叙述不正确 ...的是() A.硝酸钾的溶解度随温度升高而增大 B.t 1 ℃时,氯化钠和硝酸钾的溶解度相同 C.将t 2℃时的硝酸钾饱和溶液降温到t 1 ℃,有晶体析出 D.t 2 ℃时,80g 硝酸钾溶于100g水中可制得饱和溶液 4、A、B、C三种不含结晶水的固体物质的溶解度曲线如图, 下列说法中不正确 ...的是() A.t1℃时,A的饱和溶液65 g中含有溶剂50 g B.将t2℃ A、B、C三种物质的饱和溶液降温至t1℃时, 溶液中溶质的质量分数保持不变 C.在t2℃,A、B两种溶液中溶质的质量分数相同 D.要从A溶液中得到A,通常可采用蒸发溶剂使其结晶的方法 5、下列有关粗盐提纯的实验操作不正确的是 ( ) 6、下图是氢氧化钙的溶解度曲线。在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发忽略不计),不可能出现的情况是 A.溶液变浑浊 B.溶液变为不饱和 C.溶液质量变小 D.溶质质量分数变小 7、(1)汽油与酒精分别加入蒸馏水中,能形成溶液的是▲。 (2)白糖固体放入口中有清凉感觉。请从溶解现象推测其可能原因是▲。 (3)右图是a、b两种固体物质的溶解度曲线。 ①当温度低于20℃时,溶解度:a ▲ b (选填“>”“<”或“=”); ② t℃时,将a、b两物质的饱和溶液均加热至40℃ (a、b不分解,水分未蒸发),两种溶液中溶质的质量分数: a ▲b(选填“>”“<”或“=”)。 8、右图是甲、乙两种固体物质的溶解度曲线。 (1)t 2 ℃时,甲物质的溶解度为; (2)从图中你还能获得哪些信息?(任填一条); (3)分析t 1 ℃时,将10g乙物质放入100g水中,充分溶解后 所得的溶液是(填“饱和”或“不饱和”)溶液。欲使 t 2 ℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法 (任填一种方法)。 9、现有30℃的不饱和硝酸钾溶液,与该溶液有关的量有: ①水的质量;②溶液中溶质KNO 3 的质量;③硝酸钾的质量分数; ④30℃时硝酸钾的溶解度;⑤溶液的质量。用序号填空: Ⅰ.在该不饱和溶液中加少量硝酸钾至饱和,不变的量有
专题训练--溶质质量分数和溶解度 一、基础知识要点: 1、 溶质质量分数概念:溶质质量与溶液质量之比,可用小数或者是百分数表示。 2、 科学上用溶质的质量分数来定量表示溶液的组成。 3、 有关计算公式:溶质质量分数=溶质质量÷溶液质量 液 质M M a % 4、 二、有关溶质质量分数基础知识专题训练; 1、食盐水的浓度5%,它表示 克溶液里有 克食盐水和 克水。10千克这样的食盐水中含食盐 千克,含水 克。 2、 克氯化钠溶于 克水中,可制的60克5%的食盐溶液: 克10%的氯化钠溶液蒸干可得氯化钠20克, 克10%的氯化钠溶液中含水45克。 3、现有20℃时10%的硝酸钾溶液50克:(要求列式计算) ⑴ 加入10克硝酸钾后,其质量分数为 ⑵ 加入50克水后,其质量分数为 ⑶ 加入10克硝酸钾和15克水后,其质量分数为 ⑷ 蒸发掉10克水后,其质量分数为 ⑸ 加入20%的硝酸钾溶液50克后,其质量分数为 ⑹ 已知20℃时,硝酸钾的溶解度为31.6克 ,现加入20克硝酸钾,其饱和溶液的质量分数为 4、T ℃时,将某物质a 克溶于水恰好制成V 毫升饱和溶液(此时溶液密度为d 克/ 厘米3)则T ℃时该物质溶液 为 ,饱和溶液质量分数为 。 5、配制50克5%的氯化钠溶液,其步骤是:(1) (2) (3) 6、在一定温度下,A 物质的溶解度为25克,则此温度下,该物质的饱和溶液的质量分数为 :在一定温度下,B 物质的饱和溶液的溶质质量分数为40%,则此温度下,B 物质的溶解度为 克 7、从60克15%的食盐溶液中取出20克溶液,则这20克溶液中溶质的质量分数为 8、现将20℃100克15%的食盐溶液升温到60%时(溶液中溶质和溶剂的量不变)溶液中溶质的质量分数
溶解度和质量分数的计算 【学习目标】 1.学会浓溶液稀释的计算。 2.知道配制某一溶质的质量分数的溶液的方法和步骤。 3.巩固对溶解度的涵义的理解。 4.理解溶解度计算的基本思路。 【知识要点】 一、配制溶质质量分数一定的溶液 1. 用固体配制溶液: ①步骤: 计算、称量、溶解。 ②所用仪器:托盘天平、胶头滴管、量筒、药匙、烧杯、玻璃棒。 例:配制溶液的质量分数为10%的氯化钠溶液50g. 步骤: (1)计算:溶质的质量:g g 5%1050=?;溶剂的质量:g g g 45550=-; 水的体积: mL mL g g 45/145= (2)称量:用托盘天平称量5g 氯化钠倒入烧杯中,用50mL 量筒量取45mL 水倒入烧杯中. (3)溶解:用玻璃棒搅拌,加速固体物质的溶解速率,待氯化钠完全溶解得到的溶液即为10%的氯化钠溶液50g.实验操作步骤如下图所示. 2. 用浓溶液配制稀溶液: ①步骤: 计算、量取、溶解。 ②所用仪器: 胶头滴管、量筒、烧杯、玻璃棒。 二、有关溶液的计算依据 溶液浓缩方法:加入溶质,蒸发溶剂,加入高浓度的浓溶液. 溶液稀释方法:加入溶剂,加入低浓度的稀溶液。 1.加溶剂稀释和蒸发溶剂浓缩(没有晶体析出)的计算依据,变化前后溶液中溶质的质量相等,可用下列关系式表示:2211w m w m ?=?,已知三量通过方程可求另一量. 2.加溶质增浓的计算:加入溶质溶解后,溶质和溶液质量都增加.
增浓后的溶质质量分数= %100?++加入的溶液的质量 原溶液质量加入的溶质质量 原溶质质量. 3.两种浓度不同的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一定大于小浓度,小于大浓度的溶质的质量分数。 混合溶液中溶质的质量分数= %1002121?++的质量 溶液的质量溶液中溶质质量 溶液中溶质质量溶液 溶液中溶质质量=溶液质量×该溶液中溶质的质量分数. 三、溶解度与饱和溶液中溶质、溶液、溶剂的关系 一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为100g ,此时所溶解溶质形成饱和溶液时的质量称为溶解度。由此可得以下关系: 溶解度——————100g 溶剂—————100+溶解度 (溶质质量) (溶剂质量) (饱和溶液质量) 可得出以下正比例关系: 或 式中W 溶质、W 溶剂、W 饱和溶液分别表示某温度下饱和溶液中溶质、溶剂和溶液的质量,S 表示该温度时该溶质的溶解度。 【典型例题】 例1. 在一定温度下,n 克某物质恰好溶于一定量的水中形成m 克饱和溶液,求该物质在此温度下的溶解度。 例2 .已知在20℃时KNO 3的溶解度为31.6g 。现有20℃时的KNO 3饱和溶液131.6g ,求其中含KNO 3和H 2O 各几克?
溶解度与质量分数
————————————————————————————————作者: ————————————————————————————————日期: ?
溶解度与质量分数 知识梳理: 物质的溶解性, 即物质溶解能力的大小。这种能力既取决于溶质的本性,又取决于它跟溶剂之间的关系。 溶解度: 1、固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数,用字母s表示,其单位是“g/100g水”。 2、气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。 3、溶解度是指在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的克数. 溶解度的变化: 固体: 大部分固体随温度升高溶解度增大,如硝酸钾. 少部分固体溶解度受温度影响不大,如食盐(氯化钠) . 极少数物质溶解度随温度升高反而减小,如氢氧化钙。 气体: 当压强一定时,气体的溶解度随着温度的升高而减少 当温度一定时,气体的溶解度随着气体的压强的增大而增大。 溶解度曲线 溶解度曲线的意义与应用可从点、线、面和交点四方面来分析。 1.点 溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2.线 溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况 3.面 对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。 4.交点 两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。 溶质质量分数: 根据稀释前后溶质的总量不变进行运算,无论是用水,或是用稀溶液来稀释浓溶液,都可计算。 典型例题: 1.固体溶解度的影响因素:(内因:溶质的性质,溶剂的性质。外因:受温度影响)。 (1)大多数物质溶解度:随着温度的______溶解度_______。如______、NH4C l等。 (2)少数物质的溶解度: 随着温度的______溶解度_______如______等 (3)极少数物质的溶解度:随着温度的______溶解度_______如______等。 当温度一定时,压强越____,在一定体积溶剂中溶解气体体积也越____。反之,溶解的也越_____。 2.气体溶解度的影响因素:(气体的溶解度受________和_________两个因素的影响) 当温度一定时,压强越____,溶解度越____,反之,压强越____,溶解度越____。 当压强一定时,温度越____,溶解度越____,反之,温度越____,溶解度越____。 练习:养鱼专业户在炎热的夏天和下暴雨之前的闷热天气里,都要给鱼塘增氧,否则鱼塘会缺氧而出现翻塘死鱼现象,鱼塘缺氧的原因是______________________. 1.溶液的基本特征是()
溶解度与质量分数计算 一、有关溶解度和质量分数的计算 1、要配制50℃的KCl饱和溶液,(50℃时KCl的溶解度 是42.6g) ⑴25gKCl应溶解在多少克水中?⑵在25g水中能溶解多少克KCl? 2、在t℃时,CuSO4的溶解度为Sg,在该温度下,把Sg无水硫酸铜粉末加入(100+S)g饱和硫酸铜溶液中,得到一定量的蓝色晶体,若要把此晶体溶解成饱和溶液,应加水的质量为() A (100+S)g B 100g C (100-98/25)g D 无法确定 3、在60℃的恒温条件下,200g的甲物质溶液蒸发掉20g 水,能析出10g不含结晶水的甲物质,再蒸发20g水又能析出20g不含结晶水的甲物质,那么原溶液中质量分数为_______________;在此温度下甲物质的溶解度为____________.
4、某温度下,在100g水中加入mgCuSO4或加入ngCuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合() A m=160n/250 B m=1600n/(2500+9n) C m=1600n/(2500+16n) D m=1600n/(2500+25n) 5、某温度时,化合物甲的饱和溶液mg中含溶质ag,化合物 乙的饱和溶液mg中含有溶质bg,则在此温度时,甲、乙两化合物 的溶解度之比是_____________。 6、某物质Wg,在t℃时溶于水成VmL饱和溶液,其物质的相 对分子质量为m。该溶液的密度为ρ,则该溶液的质量分数为 ______________, 此温度下,某物质的溶解度为 __________________。 7、设CuSO4在某温度下的溶解度为Sg,则CuSO4·5H2O在同温 度下的溶解度为_______________________.