
黄连的药典比较中国药典和日本药局方关于黄连的比较
0845622 张禄
2010/11/30
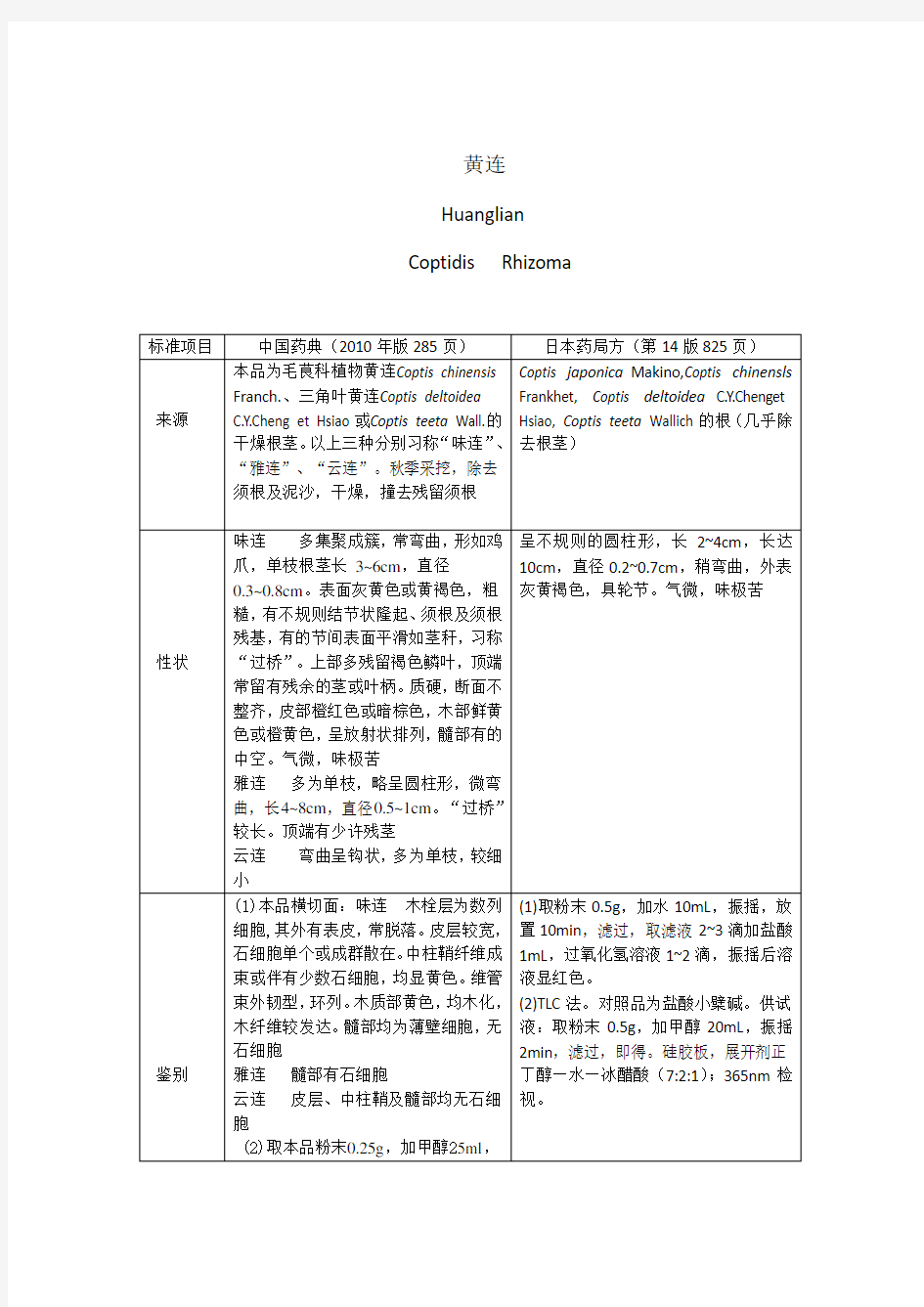
黄连
Huanglian Coptidis Rhizoma
不同点比较如下:
(1)来源:日本药典中来源植物比中国药典多Coptis japonica Makino。中国药典对不同黄连的药用部位命名不同,划分比较详细。
(2)性状:中国药典性状主要描述药材的形状、长度、颜色、断面情况、气味、明显特征“过桥”;日本药典主要描述药材的形状、长度、表面颜色、气味、轮节。(3)鉴别:中国药典用显微鉴别来观察药品的显微结构,日本药典用化学显色的方法鉴别。两国药典也都用TLC法鉴别,中国药典用黄连对照药材和盐酸小檗碱两者与待测药材作对照,日本药典只用盐酸小檗碱一种作对照。
(4)检查:中国药典检查水分和总灰分的含量。日本药典检查干燥失重、灰分和酸不溶灰分的含量。
(5)含量测定:两国药典在含量测定上都采用高效液相色谱法,但中国药典测定时注入盐酸小檗碱对照品,测定待测品小檗碱、表小檗碱、黄连碱和巴马汀的含量。而日本药典测定时未注入对照品,只注入待测品,并计算盐酸小檗碱的含量。
0845622 张禄
2010版中国药典凡例(二部) 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。除特别注明版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》二部。 二、国家药品标准由凡例与正文及其引用的附录共同构成。本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。 四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia(药典)of The People’s Republic(共和国)of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。 正文 八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。 附录 十、附录主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文品种收载的中文药品名称系按照《中国药品通用名称》推荐的名称及其命名原则命名,《中国药典》收载的药品中文药品名称均为法定名称;药品英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names, INN)。 有机药物化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应
一、目的: 二、范围: 本标准适用于样品羟值的测定。 三、职责: 1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录; 2、化验室负责人:监督检查检验员执行本操作规程。 四、内容: 1、定义:羟值系指供试品1g中含有的羟基,经用以下方法酰化后,所需氢氧化钾的重量(mg)。 1.1仪器: 电子天平(万分之一)、具塞锥形瓶(250ml)、胖肚移液管(5ml,A级)、量筒(20ml)、恒温水浴锅、碱式滴定管(50ml,A级)、滴管。 1.2试剂: 1.2.1吡啶AR 1.2.2氢氧化钠滴定液(1mol/L):见EK/SOP-QC8005氢氧化钠滴定液(1、0.5、0.1mol/L)配制与标定操作规程 1.2.3甲酚红-麝香草酚蓝混合指示液:见EK/SOP-QC8003指示剂与指示液配制操作规程1.2.4吡啶-水(3:5):取吡啶30ml和水50ml混合均匀,即得。 1.2.5酰化剂:取对甲苯磺酸14.4g,置500ml碘瓶中,加乙酸乙酯360ml,振摇溶解后,缓缓加入醋酐120ml,摇匀,放置3日后备用。 1.3测定方法: 除另有规定外,按表中规定的重量,精密称取供试品,置250ml的干燥碘瓶中,精密加入酰化剂5ml,用吡啶少许湿润瓶塞,稍拧紧,轻轻摇动使完全溶解,置50℃±1℃水浴中25分钟(每10分钟轻轻摇动)后,放冷,加吡啶-水(3:5)20ml,5分钟后加甲酚红-麝香草酚蓝混合指示液8~10滴,用氢氧化钾(或氢氧化钠)滴定液(1mol/L)滴定至溶液显灰蓝色或蓝色;同时做空白试验。 1.4计算结果: D W F 1. 56 A - B + ? ? = ) ( 供试品的羟值 式中: B为空白试验消耗氢氧化钠滴定液(1mol/L)的体积(ml); A为供试品消耗氢氧化钠滴定液(1mol/L)的体积(ml); 羟值检验操作规程 编写/修订人/日期年月日部门/姓名 审核人/日期年月日部门/姓名 批准人/日期年月日部门/姓名 执行日期2020年11月01日颁发部门品质部 分发部门品质部
2020年版《中国药典》通则调整—9101 药品质量标准分析方法验证指导原则(蓝色字体表示新增内容,红色字体表示删减内容) 药品质量标准分析方法验证(analytical method validation)的目的是证明采用建立的方法适合于相应检测要求。在建立药品质量标准时,分析方法需经验证;在药品生产工艺变更、制剂的组分变更、原分析方法进行修订时,则质量标准分析方法也需进行验证。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证。 质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。 验证的分析项目有:鉴别试验、限量或定量检查、原料药或制剂中有效成分含量测定,以及制剂中其他成分(如防腐剂等,中药中其他残留物、添加剂等)的测定。药品溶出度、释放度等检查中,其溶出量等的测定方法也应进行必要验证。鉴别试验、杂质测定(限度或定量分析)、含量测定和特性参数(如:药物溶出度、释放度等)。 验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。在分析方法验证中,须用标准物质进行试验。由于分析方法具有各自的特点,并随分析对象而变化,因此需要视具体情况拟订验证的指标。表1 中列出的分析项目和相应的验证指标可供参考。
方法验证内容如下。 三一、专属性 专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。鉴别反应、杂质检査和含量测定方法,均应考察其专属性。如方法专属性不强,应采用多种不同原理的方法予以补充。 1.鉴别反应 应能区分可能共存的物质或结构相似的化合物。不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。 2.含量测定和杂质测定 采用的色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明各成分在图中的位置,色谱法中的分离度应符合要求。 在杂质对照品可获得的情况下,对于含量测定,试样中可加入杂质或辅料,考察测定结果是否受干扰,并可与未加杂质或辅料的试样比较测定结果。对于杂质检查,也可向试样中加入一定量的杂质,考察各成分包括杂质之间能否得到分离。 在杂质或降解产物不能获得的情况下,可将含有杂质或降解产物的试样进行测定,与另一个经验证了的方法或药典方法比较结果。也可用强光照射、高温、高湿、酸(碱)水解或氧化的方法进行加速破坏,以研究可能存在的降解产物和降解途径对含量测定和杂质测定的影响。含量测定方法应比对两种方法的结果,杂质检査应比对检出的杂质个数,必要时可采用光二极管阵列检测和质谱检测,进行峰纯度检查。 一二、准确度 准确度系指采用该所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。准确度应在规定的线性范围内测定试验。准确度也可由所测定的精密度、线性和专属性推算出来。
总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。药典收载的凡例与通则对未载入本版药典但经国务院药品监督管理部门颁布的其他中药标准具同等效力。 三、凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定。 四、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 五、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of The People's Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP。 七、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 正文 八、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音与英文名);(2)有机物的结构式; (3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称及编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。 十三、正文按药品中文名称笔画顺序排列,同笔画数的字按起笔笔形一丨丿丶乛的顺序排列;通则包括制剂通则、通用检测方法和指导原则,按分类编码;索引分按汉语拼音顺序排序的中文索引以及英文名和中文名
《中国药典》2015年版四部 凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药 品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版 标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药, 二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。除特别注明 版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。本部药典收载的 凡例与通则对未载入本部药典的其他药品标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则与药品质量检定有关的共性问题的统一规定。 四、凡例和通则中采用“除另有规定外”这一用语,表示存在与凡例或通则 有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加 物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia of the People’s Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为 ChP。 正文
八、《中国药典》各品种项下收载的内容为标准正文。正文系根据药物自身 的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规 定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音 与英文名);(2)有机物的结构式;(3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药 物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种 进行相同检查项目的检测时所应釆用的统一的设备、程序、方法及限度等;指导 原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典 收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。
一、目的: 制订详尽的工作程序,规范检验操作,保证检验数据的准确性。 二、范围: 本标准适用于参考美国药典标准检验品种重金属的测定。 三、职责: 1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录; 2、化验室负责人:监督检查检验员执行本操作规程。 四、内容: 1、特殊试剂: 1.1硝酸铅原液:将159.8毫克的硝酸铅溶于100毫升水中,加入1毫升硝酸,然后用水稀释至1000毫升。制备此溶液并将其储存在无可溶性铅盐的玻璃容器中。 1.2标准铅溶液:临用新制,用水稀释10.0毫升硝酸铅原液至100.0毫升。每毫升标准铅溶液含有相当于10微克的铅。以每克被测物质100微升标准铅溶液为基础制备的对比溶液包含相当于每百万份被测物质1部分的铅。 2、方法一: 2.1 pH 3.5乙酸盐缓冲液:溶解25克醋酸铵在25毫升水中,加入6mol/l盐酸38毫升。如果需要调节,可用6mol/l氢氧化铵或6mol/l盐酸调节pH值为3.5,用水稀释至100毫升,并混合。 2.2标准制备:将标准铅溶液(20微克铅)2毫升放入50毫升比色管中,用水稀释至25毫升。使用pH计或短程pH指示纸作为外部指示剂,用1mol/l乙酸或6mol/l氢氧化铵调节到 3.0到 4.0之间的pH,用水稀释至40毫升,混匀。 2.3供试品制备:按照各专著的指示,将试验准备的溶液放入50mL比色管中,或使用各专著中指定体积的酸,溶于水中,用水稀释至25mL,单位为按公式计算的待测物质: 2.0/(1000L) 其中L是重金属限度,占百分数。使用pH计或短程pH指示剂纸作为外部指示剂,用1mol/l 乙酸或6 mol/l氢氧化铵调节pH值在3-4之间,用水稀释至40毫升,并混合。 2.4 监测制备:在第三根50mL比色管中,放入按供试品制备指示制备的溶液25mL,并加入2.0mL标准铅溶液。使用pH计或短程pH指示剂纸作为外部指示剂,用1mol/l乙酸或6mol/l氢氧化铵调节pH值在3-4之间,用水稀释至40毫升,并混合。 2.5方法:在含有标准制剂、供试品制剂和监测制剂的三个试管中,加入2毫升pH 3.5的乙酸缓冲液,然后加入1.2毫升硫代乙酰胺-甘油基TS,用水稀释至50毫升,混合,静置2分钟,在白色表面向下观察:来自试验制剂的溶液的颜色不比来自标准制剂的溶液的颜色深,来自监测制剂的溶液的颜色等于或比来自标准制剂的溶液的颜色深。[注--如果监视器制剂的颜色比标准制剂的颜色浅,则对被测试物质使用方法II而不是方法I]。 3、方法二: 3.1注:此方法不回收汞。
—、范围:本标准规定了微生物限度的检查方法和操作要求;适用于检品 需氧菌总数、霉菌和酵母菌总数、控制菌的检查。 二、 引用标准:《中国药典》( 通则1105-1106) 三、 目录1.微生物限度标准 2.设备.仪器及用具 3?消毒液、稀释剂.试液及培养基 4. 检查总则(通则1105:非无菌产品微生物限度检查:微生 物计数法,通则1106非无菌产品微生物限度检查:控制菌检查法) 5. 微生物计数法检查 6. 控制菌检查法 7. 实验技术 &附件 1. 微生物限度标准 非无菌药用原料及辅料的微生物限度标准 *未做统一规定。 L1成品微生物限度标准
(1).” 一”为不得检出。 (2).目测霉变者以不合格论。 (3).”无”为标准依据或无相应规定。 1.2工艺用水微生物限度标准 1.3内包装材料微生物限度标准 说明:1?”一”为每100 cm2中不得检出。2.目测霉变者以不合格论。3.”无”为标准依据或无相应规定。 2.设施、仪器及用具
2.1、设施: 2丄1?微生物限度检查室及相关设施:微生物计数试验环境应符合微生物限度检查的要求。检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区域、工作台直及环境应定期进行监测。 2.12其它设备:高压蒸汽灭菌器;细菌培养箱(30?35?);霉菌培养箱(25-280 ;电炉(或其它适宜的加热装置);恒温水浴;电热干燥箱(250~300匕);电冰箱。生化试剂储存箱。 2.2仪器及器mi 2.2.1.菌落计数器;显微镜(1500X);电子天平或药物天平(感量O.lg); pH系列比色计。 222?玻璃器皿:锥形瓶(250?300ml,内装玻璃珠若干).研钵(玻璃或陶瓷制,f 10?12cm)、培养皿(f 9cm).量筒(100ml).试管(18x 180mm)及塞、吸管(lml分度0.01, 10ml分度0.1)、载玻片、盖玻片、玻璃消毒缸(带盖)。 2.2.3新购的玻璃器皿的清洁:先用流水冲洗,浸泡于1%?2%盐酸(工业用)液中约2?6小时,除去游离碱质,再用流水冲洗。用于化学分析的玻璃仪器,需用重洛酸钾清洁液浸泡数分钟后,再用流水冲洗,最后以纯化水涮洗2?3次,晾干备用。 2.3用过的玻璃器皿: 231未被病原微生物污染的器皿:可随时洗涤。用清水冲洗(或浸泡),除容量仪器外, 可用毛刷和肥皂粉,内外刷洗,再用清水涮洗干净,晾干备 用。容量仪器宜用清洁液浸泡或涮洗,再用流水冲洗,最后以纯化水涮洗 2~3 次。
《中国药典》三部2015版 凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其相关内容的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成,药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等;药典二部收载化学药品、抗生素、生化药品、放射性药品等;药典三部收载生物制品;各部内容分别包括凡例、正文(各论)和通则。本版药典新增第四部,集中收载药典通则和药用辅料,为便于药典使用,对部分正文(各论)品种常用的通则亦列于各部之后。除特别注明版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》三部。 二、国家生物制品标准由凡例、生物制品通则、总论与正文(各论)及其引用的检测方法通则(简称通则)共同构枸成。本部药典收载的凡例、生物制品通则、总论、通则对未载入本版药典但经国务院药品监督管理部门颁布的其他生物制品国家标准具同等效力。 三、凡例是为正确使用《中国药典》进行质量检定的基本原则,是对《中国药典》正文(各论)、生物制品通则、总论、通则及与质量检定有关的共性问题的统一规定。 生物制品通则是对各论生产和质量管理规范的原则性要求。 总论是对某一类别生物制品生产及质量控制的通用性技术要求。 四、凡例、生物制品通则、总论和通则中采用“除另有规定外”这一用语,表示存在与凡例、生物制品通则、正文(总论) 或通则有关规定不一致的情况时,则在正文(各论)中另作规定,并按此规定执行。 五、正文(各论)所设各项规定是针对符合中国现行《药品生产质量管理规范》(Good manufacture Practices, GMP ) 的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China;英文简称为 Chinese Pharmacopoeia;英文缩写为Ch. P . 。 正文(各论) 七、药典各品种项下收载的内容为标准正文(各论)。正文(各论)系根据生物制品自身的理化与生物学特性,按照批准的原材料、生产工艺、贮藏、运输条件等所制定的,用以检测生物制品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 八、正文(各论)内容根据品种和剂型的不同,按顺序可分别列有:(1)品名(包括中文通用名称、汉语拼音与英文名称(2)定义、组成及用途;(3)基本要求;(4)制造;(5)检定(原液、半成品、成品)(6)保存、运输及有效期;(7)使用说明(预防类制品)。 通则 九、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照生物制品剂型分类,针对剂型特点所规定的统一技术要求;通用检测方法系各论品种进行相同检查项目的检测时所应采用的统一的设备、程序及方法等;指导原则系为执行药典、考察生物制品质量、起草与复核生物制品标准所制定的指导性规定。 名称及编排 十、本版药典收载的生物制品的中文名称系参照《中国药品通用名称》中生物制品通用名称命名原则命名,《中国
附录XII A 无菌检查法 无菌检查法系用于检查药典要求无菌的生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。 无菌检查应在洁净度万级下的局部洁净度百级的单向流空气区域内或隔离系统中进行,其全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。隔离系统应按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。日常检验还需对试验环境进行监控。 无菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。 培养基 培养基的制备:培养基按以下处方制备,亦可用按该处方生产的符合规定的脱水培养基。配制后应采用验证合格的灭菌程序灭菌。制备好的培养基应保存在2~25℃避光的环境,若保存于非密闭容器中,一般可在3周内使用;若保存于密闭容器中,一般可在1年内使用。 1、硫乙醇酸盐流体培养基 酪胨(胰酶水解)15.0g 酵母浸出粉 5.0g 葡萄糖 5.0g 氯化钠 2.5g L-胱氨酸0.5g 新配制的0.1%刃天青溶液 1.0mL 硫乙醇酸钠0.5g (或硫乙醇酸0.3mL) 琼脂0.75g 水1000mL 除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调pH值为弱碱性,煮沸,滤清,加入水葡萄糖和刃天青溶液,摇匀,调pH值使灭菌后为7.1±0.2。分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2,灭菌。在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经1000℃水浴加热至粉红色消失(不超过20分钟)后,迅速冷却,只限加热一次,并防止被污染。 2、改良马丁培养基 胨 5.0g 磷酸氢二钾 1.0g 酵母浸出粉 2.0g 硫酸镁0.5g 葡萄糖20.0g 水1000mL 除葡萄糖外,取上述成分混合,微温溶解,调pH值约为6.8,煮沸;加入putaotang 溶解后,摇匀,滤清,调pH值使灭菌后为6.4±0.2,分装,灭菌。 3、选择性培养基 按上述硫乙醇盐流体培养基或改良马丁培养基的处方及制法,在培养基灭菌或使用前加入适宜的中和剂、灭活剂或表面活性剂,其用量同方法验证试验。 4、营养肉汤培养基 胨10.0g 氯化钠 5.0g 牛肉浸出粉 3.0g 水1000mL 取上述成分混合,微温溶解,调pH值为弱碱性,煮沸,滤清,调pH值使灭菌后为7.2±0.2,分装,灭菌。 5、营养琼脂培养基 按上述营养肉汤培养基的处方及制法,加入14.0g琼脂,调pH值使灭菌后为7.2±0.2,分装,灭菌。
该版药典中现代分析技术得到进一步扩大应用,除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用;药品的安全性保障得到进一步加强,除在凡例和附录中加强安全性检查总体要求外,在品种正文标准中增加或完善安全性检查项目;对药品质量可控性、有效性的技术保障得到进一步提升,除在附录中新增和修订相关的检查方法和指导原则外,在品种正文标准中增加或完善有效性检查项目;为适应药品监督管理的需要,制剂通则中新增了药用辅料总体要求;积极引人了国际协调组织在药品杂质控制、无菌检查法等方面的要求和限度。此外,该版药典也体现了对野生资源保护与中药可持续发展的理念,不再收载濒危野生药材。 第九届药典委员会还完成了《中国药典》2005年版增补本、《药品红外光谱集》(第四卷)、《临床用药须知》(中药材和饮片第一版、中成药第二版、化学药第五版)、《中药材显微鉴别彩色图鉴》及《中药材薄 层色谱彩色图集》(第一册、第二册)的编制工作。 2015年版(第十版)2010年12月国家食品药品监督管理局(2013年3月22日更名为国家食品药品监督管理总局)组建第十届药典委员会。本届药典委员遴选工作按照新修订的《新增委员遴选办法》和《第十届药典委员会委员遴选工作方案》,向全社会公开征集新增委员候选人,并采取差额选举、无记名投票的方式选举新增委员。本届委员会共有委员351名,其中续聘委员248名,新增委员103名。时任第十一届全国人大常委会副委员长桑国卫任名誉主任委员,时任卫生部部长陈竺任主任委员,时任卫生部副部长、国家药品监督管理局局长邵明立任常务副主任委员。本届委员会下设执行委员会和23个专业委员会。执行委员会委员共计67名,其中院士委员28名、资深专家3名、各专业委员会主任20名、相关部委专家4名、总局相关技术单位负责人7名。根据药典标准工作需要,本届委员会以第九届药典委员会专业委员会设置为基础,对专业委员会的设立进行了适当调整;为加强化学药标准的制定工作,增设了化学药品第三专业委员会,扩大化学药委员的人数;同时,根据实际工作需要,取消政策与发展委员会、标准信息工作委员会和注射剂工作委员会。 2010年12月第十届药典委员会成立暨全体委员大会召开。会议审议通过了“《中国药典》2015年版编制大纲”,编制大纲明确了《中国药典》2015年版编制工作的指导思想、基本原则、发展目标和主要任务。 按照《国家药品安全“十二五”规划》的要求,国家药典委员会以实施“国家药品标准提高行动计划”为基础,组织各专业委员会和相关机构开展药典编制工作。药典委员会常设机构首次将I S O 9001质量管理体系引入药典编制的全过程管理,按照规范的“中国药典编制工作程序”开展品种遴选、课题立项、试验研究、标准起草、复核和审定等各项工作,稳步推进本版药典编制工作。2015年2月4日《中国药典》2015年版经第十届药典委员会执行委员会全体会议审议通过,于2015年6月5日经国家食品药品监督管理总局批准颁布,自2015年12月1日起实施。 本版药典进一步扩大药品品种的收载和修订,共收载品种5608种。一部收载品种2598种,其中新增品种440种、修订品种517种、不收载品种7种。二部收载品种2603种,其中新增品种492种、修订品种415种、不收载品种28种。三部收载品种137种,其中新增品种13种、修订品种105种、新增生物制品通则1个、新增生物制品总论3个、不收载品种6种。本版药典首次将上版药典附录整合为通则,并与药用辅料单独成卷作为《中国药典》四部。四部收载通则总数317个,其中制剂通则38个、检测方法240个(新增27个)、指导原则30个(新增15个)、标准品、标准物质及试液试药相关通则9个。药用辅料收载270种,其中新增137种、修订97种、不收载2种。 本版药典完善了药典标准体系的建设,整体提升质量控制的要求,进一步扩大了先进、成熟检测技术的应用,药用辅料的收载品种大幅增加,质量要求和安全性控制更加严格,使《中国药典》的引领作用和技术导向作用进一步体现。 在编制本版药典的过程中,还完成了《中国药典》2010年版第一、二、三增补本,《红外光谱集》(第五卷),《中国药品通用名称》,《国家药品标准工作手册》(第四版),《中国药典注释》的编制和修订工作,组织开展了《中国药典》2015年版英文版、《临床用药须知》2015年版的编制工作。
凡例 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其所载同品种或相关内容的上版药典标准或原国家药品标准即停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品及相关通用技术要求,四部收载通用技术要求和药用辅料。除特别注明版次外,《中国药典》均指现行版。 本部为《中国药典》四部。 二、《中国药典》主要由凡例、通用技术要求和品种正文构成。 凡例是为正确使用《中国药典》,对品种正文、通用技术要求以及药品质量检验和检定中有关共性问题的统一规定和基本要求。 通用技术要求包括《中国药典》收载的通则、指导原则以及生物制品通则和相关总论等。 《中国药典》各品种项下收载的内容为品种正文。 三、药品标准由品种正文及其引用的凡例、通用技术要求共同构成。 本版药典收载的凡例、通则/生物制品通则、总论的要求对未载入本版药典的其他药品标准具同等效力。 四、凡例和通用技术要求中釆用“除另有规定外”这一用语,表示存在与凡例或通用技术要求有关规定不一致的情况时,则在品种正文中另作规定,并据此执行。 五、品种正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》未检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of the People's Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP。 通用技术要求 七、通则主要包括制剂通则、其他通则、通用检测方法。制剂通则系为按照药物剂型分类,针对剂型特点所规定的基本技术要求。通用检测方法系为各品种进行相同项目检验时所应采用的统一规定的设备、程序、方法及限度等。 指导原则系为规范药典执行,指导药品标准制定和修订,提高药品质量控制水平所规定的非强制性、推荐性技术要求。 生物制品通则是对生物制品生产和质量控制的基本要求,总论是对某一类生物制品生产和质量控制的相关技术要求。 八、制剂生产使用的药用辅料,应符合相关法律、法规、部门规章和规范性文件,以及本版药典通则0251〈药用辅料〉的有关要求。 品种正文 九、本部品种正文系根据药用辅料的特性,按照生产工艺、用途、贮藏运输条件等所制定的技术规定。 十、药用辅料品种正文内容一般包括:(1)品名(包括中文名、汉语拼音名与英文名);(2)有机物的结构式;(3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示;(13)附图、附表、附、注等。 名称与编排 十一、药用辅料通用名应符合中国药用辅料通用名命名原则的有关规定。 十二、有明确化学结构的药用辅料其化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。 十三、本部品种正文按中文名称笔画顺序排列,同笔画数的字按起笔笔形一丨丿丶乛的顺序排列;通用技术要求按分类编码排列;索引分按汉语拼音顺序排序的中文索引以及英文名和中文名对照的索引。
2015 年版《中国药典》四部介绍 及其在中药分析鉴定中得应用 李峰 2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。2015年版《中国药典》最大得变动之一就是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便得问题。2015年版《中国药典》四部就是保证《中国药典》执行得重要基础,就是2015年版《中国药典》水平与特色得重要体现,也就是系统阐述药品检测技术、传播药典知识得良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用与行业健康必将发挥积极得作用。 一、2015年版《中国药典》四部介绍 2015年版《中国药典》四部内容包括凡例、通则与药用辅料。药典通则涵盖了通用性要求、检验方法、指导原则以及试剂与标准物质等药品标准得共性要求,就是药典标准得基础,不但反映了我国药品质量控制整体状况与药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。现就2015年版《中国药典》四部整体情况简要介绍如下。 1、2015年版《中国药典》四部增修订整体情况 2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。 2、2015年版《中国药典》四部主要特点 2、1 整体提升质控水平 《中国药典》凡例、通则、总论就是药典得重要组成部分,对药品标准得检测方法与限度进行总体规定,对药典以外得其她药品国家标准具同等效力。通过对2010年版《中国药典》相关内容得全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制得要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求得药典标准体例。药品标准控制更加全面化、系统化、规范化。 2、2 药典标准体系更加完善 2015年版《中国药典》四部首次纳入“国家药品标准物质通则”以及“国家药品标准物质制备指导原则”、“药包材通用要求”与“药用玻璃材料与容器”等指导原则,进一步完善了药用辅料与药包材通用性要求,从影响药品质量得等各方面,包括原料药及其制剂、药品标准物质、药用辅料与药包材得制定控制要求,形成了全面
中国药典凡例试卷 部门:姓名:试卷得分: 一.单选题(本大题共10小题,每题只有一个正确选项,选对的得2分,选错的不得分) 1.下列说法中不正确的是() A.凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》 正文、附录及与质量检定有关的共性问题的统一规定。 B.任何违反GMP或有未经批准添加物质所生产的药品,若符合《中国药典》或按照 《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 C.涉及牛源的应取自无牛口蹄疫病地区的健康牛群。 D.供直接分装成注射用无菌粉末的原料药,应按照注射剂项下相应的要求进行检查, 并应符合规定。 2.INN中文翻译为() A.国际纯粹与和化学联合会 B.世界卫生组织 C.国际非专利药名 D.世界动物卫生组织 3.现有10g的溶质,经充分搅拌后,能溶解于1000~10000ml的溶剂中,则按凡例规定,该物质的溶解度是() A.易溶 B.溶解 C.略溶 D.微溶 4.原料药的含量(%),除另有注明者外,均按()计。如规定上限为100%以上时,系指用本药典规定的分析方法测定时可能达到的数值,它为药典规定的限度或允许偏差,并非真实含有量;如未规定上限时,系指不超过() A.数量 100% B.重量 100% C.重量 % D.数量 % 5.表示溶液100g中含有溶质若干毫升可用下列哪个符号表示() A.%(ml/g) B.%(g/g) C.%(ml/ml) D.%(g/ml) 6.下列哪一组符号均可表示重量或体积的比例() ppt pph ppb ppt 7.现有一瓶溶液,发现溶液后标示“(1-10)”,代表了() A. 固体溶质加溶剂制成10ml的溶液 B. 液体溶质加溶剂制成10g的溶液
中国药典2015年版丁公藤 一枝黄花 Yizhihuanghua SOLIDAGINIS HERBA 本品为菊科植物一枝黄花SoZWago decMrrens Lour.的干燥全草。秋季花果期采挖,除去泥沙,晒干。 【性状I本品长30?100cm。根茎短粗,簇生淡黄色细根。茎圆柱形,直径〇. 2?0. 5cm;表面黄绿色、灰棕色或暗紫红色,有棱线,上部被毛;质脆,易折断,断面纤维性,有髓。单叶互生,多皱缩、破碎,完整叶片展平后呈卵形或披针形,长 1?9cm,宽0. 3?1. 5cm;先端稍尖或钝,全缘或有不规则的疏锯齿,基部下延成柄。头状花序直径约〇.7cm,排成总状,偶有黄色舌状花残留,多皱缩扭曲,苞片3层,卵状披针形。瘦果细小,冠毛黄白色。气微香,味微苦辛。 【鉴别】(1)叶表面观:上表皮细胞多角形,垂周壁略呈念珠状增厚。下表皮细胞垂周壁波状弯曲,气孔不定式,略下陷。非腺毛有两类:表皮非腺毛由3个细胞组成,壁薄,顶端 1个细胞常萎缩成鼠尾状,较小;叶缘非腺毛睫毛状由3?7个细胞组成,壁稍厚,长180?500M m。 (2)取本品粉末2g,加石油醚(60?90°C)50ml,超声处理 30分钟,放冷,滤过,弃去石油醚液,药渣挥干溶剂,加70%乙醇30ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加甲醇lml 使溶解,作为供试品溶液。另取一枝黄花对照药材2g,同法制成对照药材溶液。再取芦丁对照品,加甲醇制成每lml 含0. 5 m g的溶液,作为对照品溶液。照薄层色谱法(通则 0502)试验,吸取供试品溶液5?10M1、对照药材溶液和对照品溶液各5fJ,分别点于同一以含4%磷酸氢二钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲醇-甲酸-水(8 : 1 : 1 : 1)为展开剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,晾干,置紫外光灯(365mn)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点;再喷以5%三氯化铁乙醇溶液,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。 【检查】水分不得过13.0% (通则0832第二法)。 总灰分不得过8.0%(通则2302)。 酸不溶性灰分不得过4.0% (通则2302)。 【浸出物】照水溶性浸出物测定法(通则2201)项下的热浸法测定,不得少于17. 0%。 【含量测定】照高效液相色谱法(通则0512)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-甲醇-0.4%醋酸溶液(16 : 8 : 76)为流动相;检测波长为360nm。理论板数按芦丁峰计算应不低于 2500。 对照品溶液的制备取芦丁对照品适量,精密称定,加甲醇制成每lml含0. lmg的溶液,即得。 供试品溶液的制备取本品粉末(过三号筛)约2g,精密称定,置具塞锥形瓶中,精密加人70%乙醇50ml,称定重量,加热回流40分钟,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。 测定法分别精密吸取对照品溶液与供试品溶液各l 〇pl,注人液相色谱仪,测定,即得。 本品按干燥品计算,含无水芦丁(C2 7H3。0, s )不得少于0. 10%。 饮片 【炮制】除去杂质,喷淋清水,切段,干燥。 【性味与归经】辛、苦,凉。归肺、肝经。 【功能与主治】清热解毒,疏散风热。用于喉痹,乳蛾,咽喉肿痛,疮疖肿毒,风热感冒。 【用法与用置】9?15g。 【贮藏】置干燥处。 丁公藤 Dinggongteng ERYCIBES CAULIS 本品为旋花科植物丁公藤■而〇6加Benth?或光叶丁公藤Craib的干燥藤莲。全年均可采收,切段或片,晒干。 【性状】本品为斜切的段或片,直径1?l〇cm。外皮灰黄色、灰褐色或浅棕褐色,稍粗糙,有浅沟槽及不规则纵裂纹或龟裂纹,皮孔点状或疣状,黄白色,老的栓皮呈薄片剥落。质坚硬,纤维较多,不易折断,切面椭圆形,黄褐色或浅黄棕色,异型维管束呈花朵状或块状,木质部导管呈点状。气微,味淡。 【鉴别】取本品粉末3g,加乙醇40ml,浸渍过夜,加热回流6小时,滤过,滤液加6mol/L盐酸溶液6ml,加热回流3小时,蒸干,残渣加乙醇l〇ml使溶解,作为供试品溶液。另取东莨菪内酯对照品,加乙醇制成每lml含0. 25mg的溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取上述两种溶液各3^1,分别点于同一硅胶G薄层板上,以环己烷?三氯甲烷-乙酸乙酯-甲酸(6 : 10 : 7 : 1.2)为展开剂,展开,取出,晾干,置紫外光灯(365mn)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同的亮蓝色荧光斑点。 【检查】水分不得过12.0%(通则0832第二法)。 总灰分不得过10.0%(通则2302)。 【漫出物】照醇溶性浸出物测定法(通则2201)项下的热浸法测定,用乙醇作溶剂,不得少于3. 0%。 【含量测定】照高效液相色谱法(通则0512)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-水-冰醋酸(32 : 68 : 0? 16)为流动相;检测