
一.钠及其化合物
知识点
(一)钠的性质
1.钠的物理性质
金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
(1)实验过程
将钠用镊子从煤油中取出,用滤纸吸干煤油,然后在玻璃片上将钠用小刀切下一小块(豆粒大小),进行观察,并注意切面的变化.
(2)注意事项
①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤.
②取出钠后要迅速吸干煤油,并要放到玻璃上切割.
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险.
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察.
(3)实验现象:切面银白色,但迅速变暗(4Na+O2=2Na2O等),失去金属光泽.
(4)实验结论:金属钠硬度很小(质软),具有银白色金属光泽,很容易被空气氧化.
2.钠的化学性质
钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:
①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)
②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)
(2)钠与水反应:2Na+2H2O =2NaOH +H2↑
现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。3.钠的存放和取用
由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。取用时一般先用镊子把钠从煤油
中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途
自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
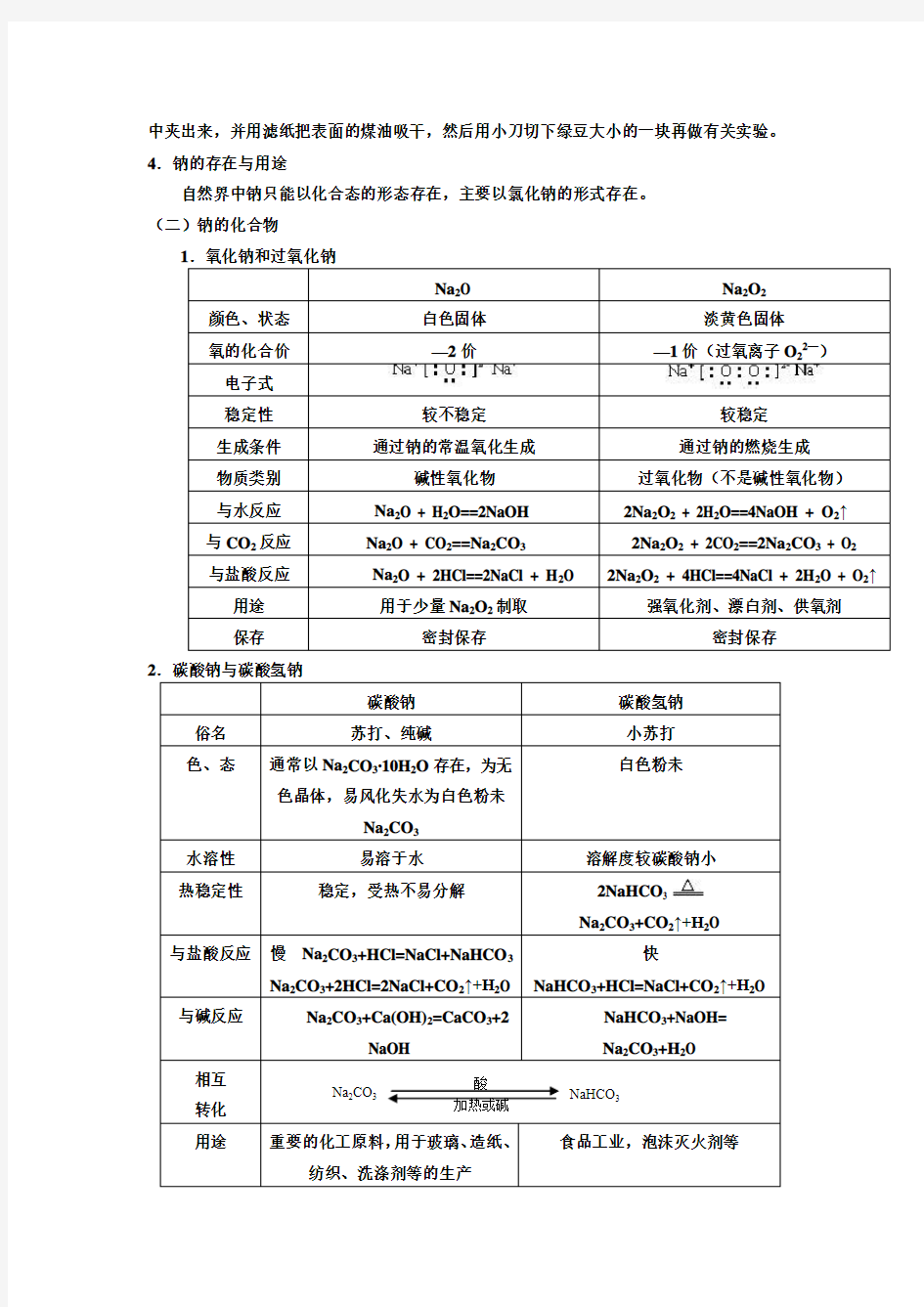
(二)钠的化合物 1.氧化钠和过氧化钠
Na 2O Na 2O 2 颜色、状态
白色固体 淡黄色固体 氧的化合价
—2价 —1价(过氧离子O 22—) 电子式
稳定性
较不稳定 较稳定 生成条件
通过钠的常温氧化生成 通过钠的燃烧生成 物质类别
碱性氧化物 过氧化物(不是碱性氧化物) 与水反应
Na 2O + H 2O==2NaOH 2Na 2O 2 + 2H 2O==4NaOH + O 2↑ 与CO 2反应
Na 2O + CO 2==Na 2CO 3 2Na 2O 2 + 2CO 2==2Na 2CO 3 + O 2 与盐酸反应
Na 2O + 2HCl==2NaCl + H 2O 2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ 用途
用于少量Na 2O 2制取 强氧化剂、漂白剂、供氧剂 保存
密封保存 密封保存 2.碳酸钠与碳酸氢钠
碳酸钠 碳酸氢钠 俗名
苏打、纯碱 小苏打 色、态 通常以Na 2CO 3·10H 2O 存在,为无
色晶体,易风化失水为白色粉未
Na 2CO 3
白色粉未 水溶性
易溶于水 溶解度较碳酸钠小 热稳定性 稳定,受热不易分解 2NaHCO 3
Na 2CO 3+CO 2↑+H 2O
与盐酸反应 慢 Na 2CO 3+HCl=NaCl+NaHCO 3
Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O
快 NaHCO 3+HCl=NaCl+CO 2↑+H 2O 与碱反应 Na 2CO 3+Ca(OH)2=CaCO 3+2
NaOH
NaHCO 3+NaOH= Na 2CO 3+H 2O 相互
转化
用途 重要的化工原料,用于玻璃、造纸、
纺织、洗涤剂等的生产 食品工业,泡沫灭火剂等
Na 2CO 3 NaHCO 3 酸 加热或碱
重难点
考点一 钠的性质
金属钠是一种柔软 ,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g
/cm 3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有
很强的还原性,是一种活泼的金属元素。
例题
1.钠与水反应时的现象与钠的下列性质无关的是 ( )
A .钠的熔点低
B .钠的密度小
C .钠的硬度小
D .钠有强还原性
〖解析〗钠投入水中,浮在水面上,说明钠的密度小于水;熔化成闪亮的小球,说明钠与
水的反应是放热反应,钠的熔点较低;钠能与水反应,生成NaOH 和H 2,说明钠的还原性
很强。 〖答案〗 C
2. 下列关于钠的说法不正确的是[ ]
A 、金属钠和氧气反应,条件不同,产物不同
B 、钠钾合金通常状况下呈液态,可作原子反应堆的导热剂
C 、钠的化学活泼性很强,少量的钠可保存在有机溶剂4CCl 中
D 、由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属
〖解析〗 224Na O Na O +=,22222Na O O Na O +=
,A 正确;B 的说法是正确的,
这是钠的重要用途之一;钠的保存原则是将钠与空气和水隔绝,故应保存在密度小于钠的
有机溶剂中,4()()CCL Na ρρ>,故C 不正确;盐溶液中的金属阳离子周围有一定数目的
水分子包围着,不能和钠直接接触,另外,钠跟水反应速率很快,故不能从盐溶液中置换
出金属。 〖答案〗 C 、D
练习
1. 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A 、HCl
B 、NaOH
C 、24K SO
D 、4CuSO
2. 在烧杯中加入水和苯(密度:0.88g/cm 3)各50mL 。将一小粒金属钠(密度:0.97g/cm 3)
投入烧杯中。观察到的现象可能是 ( )
A 钠在水层中反应并四处游动
B 钠停留在苯层中不发生反应
C 钠在苯的液面上反应并四处游动
D .钠在苯与水的界面处反应并可能作上、下跳动
3. 将
4.6g 金属钠投入到9
5.4g 水中,所得溶液中溶质的质量分数 ( )
A.等于4.6%
B. 等于8%
C.小于8%
D.大于8%
4.有人设计出一种在隔绝空气的条件下让钠与水反应的方法。实验时,往100mL 大试管中
先加入40mL 煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加入滴有
酚酞的水,至胶塞,并加紧弹簧夹(如图)。仔细观察,回答下列问题:
(1)有关钠的现象:
(2)大试管中溶液颜色的变化:
(3)装置中液面的变化:大试管内 ;
长颈漏斗内 。
(4)简述检验产生气体的方法:
考点二 过氧化钠的性质
1. 一定量的Na 2O 2与一定量的CO 2和H 2O (g )混合物反应,可视为
Na 2O 2首先与CO 2反应,剩余的Na 2O 2再与H 2O (g )反应。
2. Na 2O 2 与CO 2、H 2O (g )、CO 、H 2及(CO)m H n 等气体在一定条件下反应,固体质量
增加规律
(1) CO 2、H 2O (g )分别与Na 2O 2反应
Na 2O 2 ??→?CO2Na 2CO 3,从组成上看相当于吸收了CO 2中的CO 部分,所以固体物
质质量增加等于参加反应的CO 2等物质的量CO 的质量。 Na 2O 2 ??→?H2O 2NaOH 从组成上看相当Na 2O 2于吸收H 2O 了中的H ,所以固体物质质
量增量等于参加反应的H 2O 等物质的量的H 2的质量。
(2)通式符合(CO)m H n 的可燃物,如CO 、H 2、CH 3OH 等与少量O 2(起引发作用)和足量
Na 2O 2置于同一密闭容器,用电火花引燃,充分反应后固体质量增量等于可燃物的质量。
3. Na 2O 2与酸性氧化物反应的特例
一般情况下,Na 2O 2和Na 2O 分别与酸性氧化物反应,区别在产物上,Na 2O 2多了O 2。
但是,当酸性氧化物具有还原性,如SO 2与Na 2O 2反应时,除了发生:2Na 2O 2+2SO 2====2Na 2SO 3+O 2外,还会同时发生Na 2O 2+SO 2====Na 2SO 4的反应。
例题
1. 2.1g CO 和2H 组成混合气体与足量的2O 充分反应后,立即通入足量的22Na O 固体
中,固体质量增加( )
A 、2.1g
B 、3.6 g
C 、7.2 g
D 、不可确定
〖解析〗 CO 和2H 与2O 燃烧的化学方程式为:2222CO O CO +=点燃,22222H O H O +=点燃;
2CO 、2H 跟22Na O 的反应分别为:
222232222CO Na O Na CO O +=+,2222224H O Na O NaOH O +=+↑。
从4个化学方程式可以看出:增加的质量恰好为CO 和2H 混合气体的质量,即
2222322,2H CO Na O Na CO Na O NaOH ??→??→。 〖答案〗 A
2. 下列对Na2O2的叙述中,正确的是()
A.Na2O2中氧元素化合价为-1
B.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
C.Na2O2与水反应时,Na2O2是氧化剂,水是还原剂
D.Na2O2与二氧化碳反应时,Na2O2只作氧化剂
〖解析〗本题考查有关过氧化钠的知识。在Na2O2中Na呈现+1价,所以O的价态为-1价,A项正确。Na2O2在与水反应的同时有氧气生成,所以不能做干燥剂,B项错。与水和CO2反应时,Na2O2既是氧化剂又是还原剂,C、D项错。〖答案〗 A
练习
1. 事实上许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4Na2O2+2SO3=2Na2SO4+O2。据此,你认为下列方程式正确的是()A.2 Na2O2+2Mn2O7=4NaMnO4+O2B.Na2O2+2NO2=2NaNO2+O2
C.2 Na2O2+2N2O3=4NaNO2+O2 D.2 Na2O2+2N2O5=4NaNO3+O2
2. 取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是()
A. H2
B. CO2
C.C6H12O6
D.C12H22O11
考点三碳酸钠与碳酸氢钠
1. Na2CO3与盐酸的互滴反应
(1)向盐酸里逐渐滴加入Na2CO3溶液(开始时酸过量)开始就有气体放出;
(2)向Na2CO3溶液里逐滴加入盐酸(开始时酸不足)开始无气体产生:
HCl+Na2CO3=NaCl+NaHCO3(无气泡)HCl+NaHCO3=NaCl+CO2↑+H2O
可见不同的滴加顺序产生不同的现象,利用这种现象不用其他试剂就可鉴别Na2CO3溶液和盐酸。
2.碳酸氢钠和碳酸钠的制法
(1)制取NaHCO3的方法
①减压低温蒸干NaHCO3溶液。NaHCO3遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHCO3晶体。
②往饱和Na2CO3溶液中通入CO2,过滤得到晶体。Na2CO3+CO2+H2O=2NaHCO3
(2)制取Na2CO3的方法
往饱和食盐水中依次通人足量的NH3、CO2(氨碱法),利用NaHCO3的溶解性小于NH4HCO3的溶解性原理,使NaHCO3从溶液中析出:NH3+H2O+CO2=NH4HCO3 NH4HCO3 +NaCl=NaHCO3↓+NH4Cl 2NaHCO3?→
??Na2CO3 +CO2↑+H2O(工业方法)
例题
1. 可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是 ( )
A .加热时无气体放出
B .滴加盐酸时有气泡放出
C .溶于水后滴加稀BaCl 2溶液有白色沉淀生成
D .溶于水后滴加澄清石灰水有白色沉淀生成
〖解析〗解决此题关键要掌握Na 2CO 3和NaHCO 3的性质异同,特别是与澄清石灰水的
反应,两者都会产生白色沉淀,因此无法鉴别,而加BaCl 2溶液,现象不同,仅Na 2CO 3
与BaCl 2反应中有BaCO 3沉淀生成。 〖答案〗 C
2. 某干燥粉末可能由2Na O 、22Na O 、23Na CO 、3NaHCO 、NaCl 中的一种或几种组成。
将该粉末与足量的盐酸反应,有气体X 逸出,X 通过足量的NaOH 溶液后体积缩小(同温、
同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质
量大于原混合粉末的质量,下列判断正确的是( )
A 、粉末中一定有2Na O ,22Na O ,3NaHCO
B 、粉末中一定不含有23Na CO 和NaCl
C 、粉末中一定不含有2Na O 和NaCl
D 、无法肯定粉末里是否含有23Na CO 和NaCl
〖解析〗 与盐酸反应产生气体的物质可能有22Na O 、23Na CO 和3NaHCO ,气体X 通过
足量的NaOH 溶液后体积缩小(而不是气体全部消失),说明X 由2O 和2CO 组成,原粉末
中22Na O 、23Na CO 和3NaHCO 至少有一种一定存在。将原混合粉末加热,有气体放出,
说明混合物中一定有3NaHCO ,但3NaHCO 受热分解会使混合物粉末质量减少,而实际
剩余固体的质量都增加了,原因只能是发生了反应:222222Na O O Na O += 。综上分析,
混合物中有2Na O 、22Na O 、3NaHCO ,无法确定混合物中是否有23Na CO 和NaCl 。
〖答案〗 A 、D
练习
1. 下列物质的溶液既能与H+反应,又能与OH-反应的是( )
A .MgSO 4
B .Na 2CO 3
C .NaHCO 3
D .(NH 4)2SO 4
2.将一小块金属钾投入下列物质的溶液中,既能放出气体,又有沉淀析出的是( )
A .MgCl 2
B .BaCl 2
C .CuCl 2
D .NaHCO 3
3. 下列关于纯碱晶体(Na 2CO 3·10H 2O )的叙述中,错误的是 ( )
A .将晶体放置在空气中质量会减轻
B .加热晶体则生成NaHCO 3
C .Na 2CO 3可作为干燥剂使用
D .晶体溶于水后呈碱性
二.氯及其化合物
知识点
一、氯气的性质及用途:
1.物理性质:
常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
附:氯气的毒性:毒作用原理:对粘膜和肺有强烈刺激作用,空气的允许浓度0.001mg·L-1;解毒方法:呼吸新鲜空气,吸稀氨水;防护方法:用潮湿毛巾捂住口、鼻部;闻氯气气味的方法:用手在瓶口轻轻扇动,使极少量氯气,飘入鼻孔.
2.化学性质:氯气是化学性质很活泼的非金属单质。
(1)与金属反应(与变价金属反应,均是金属氧化成高价态)
如:①2Na+Cl2 2NaCl(产生白烟)
②Cu+Cl2CuCl2(产生棕黄色的烟)
③2Fe+3Cl22FeCl3(产生棕色的烟)
注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
(2)与非金属反应
如:①H2+Cl22HCl(发出苍白色火焰,有白雾生成)——可用于工业制盐酸
H2+Cl22HCl(会发生爆炸)——不可用于工业制盐酸
②2P+3Cl22PCl3(氯气不足;产生白雾)
2P+5Cl22PCl5(氯气充足;产生白烟)
(3)与水反应:Cl2+H2O = HCl+HClO
液氯、新制的氯水和久置的氯水比较
液氯新制氯水久置氯水分类纯净物混合物混合物
颜色黄绿色黄绿色无色
成分Cl2Cl2、H2O、HClO、H+、Cl―、
ClO―、极少量的为OH―
H+、Cl―、H2O、极少量的OH―
稀盐酸
性质氧化性氧化性、酸性、漂白性酸性
(4)与碱反应
Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气)
2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O
漂白粉
漂白粉的主要成分:氯化钙和次氯酸钙;漂白粉的有效成分:次氯酸钙;优点:稳定性:次氯酸钙> 次氯酸(有利于保存)。漂白粉漂白原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO(这也是漂白粉长期保存,容易失效的原因)
Ca (ClO )2 + 2HCl = CaCl 2 + 2HClO (采用此法,可加快漂白粉的漂白速度)
(5)与某些还原性物质反应
如:① 2FeCl 2+Cl 2 = 2FeCl 3 ② SO 2+Cl 2+2H 2O = 2HCl + H 2SO 4 ○3 2KI +Cl 2 = 2KCl + I 2(使湿润的淀粉-KI 试纸变蓝色,用于氯气的检验)
重难点
考点1 氯水的成分的复杂性和多样性 成分 表现的性质
反应实例 Cl 2
①呈黄绿色
②强氧化性 ③加成反应 Cl 2+Mg Cl 2+2KI Cl 2+H 2SO 3+H 2O Cl 2+CH 2=CH 2→ H +
强酸性 2H ++CaCO 3 滴入紫色石蕊试液先 ,后 HCl
O
①弱酸性 ②强氧化性 HClO+OH -ClO -+H 2O 漂白、杀菌、消毒 Cl -
沉淀反应 Cl -+Ag +AgCl ↓
例题 1.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的 ( )
A .将NaHCO 3固体加入新制氯水,有无色气泡(H +)
B .使红色布条褪色(HCl )
C .向FeCl 2溶液中滴加氯水,再滴加KSCN 溶液,发现呈血红色(Cl 2)
D .滴加AgNO 3溶液生成白色沉淀(Cl -)
【解析】氯水中存在H +,与NaHCO 3反应产生CO 2,与H +相关;氯水使红色布条褪
色是因为氯水中存在HClO ,而不是因为氯水中存在HCl ;氯水中存在Cl 2能氧化Fe 2+→Fe 3+,
故滴加KSCN 溶液,溶液呈血红色;氯水中存在Cl -能与AgNO 3溶液生成白色沉淀。
【答案】B 【方法技巧】解此题的关键是掌握氯水中含有的各种粒子以及他们对应的性
质。强酸性——H +的性质;漂白性——HClO 的性质;强氧化性——Cl 2、HClO 的性质。
2.自来水常用氯气进行消毒.如果在实验室用自来水配制下列物质的溶液,不.
会产生明显药品变质问题的是 ( )
A .FeCl 2
B .Na 2SO 3
C .NaOH
D .AlCl 3
【解析】Cl 2会氧化FeCl 2、Na 2SO 3,Cl 2与NaOH 反应生成NaCl 、NaClO 、H 2O 。
【答案】D
练习
1. 下列关于氯水的叙述正确的是 ( )
A .新制氯水可使蓝色石蕊试纸先变红后褪色
B .新制氯水中只含Cl 2和H 2O 分子
C.氯水放置数天后pH将变小D.光照氯水有气泡逸出,该气体是Cl2
2.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题:
(1)产生上述现象的原因可能有两种(简要文字说明)
①是由于;
②是由于。
(2)简述怎样用实验证明红色褪去的原因是①或者是②:。
考点2 漂白粉
漂白粉的主要成分:氯化钙和次氯酸钙;漂白粉的有效成分:次氯酸钙;优点:稳定性:次氯酸钙> 次氯酸(有利于保存)。漂白粉漂白原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO(这也是漂白粉长期保存,容易失效的原因)Ca(ClO)2 + 2HCl = CaCl2 + 2HClO (采用此法,可加快漂白粉的漂白速度)
例题
1.浓盐酸和Ca(ClO)2能发生反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是()
①CO2②HCl③H2O④O2
A.①②③B.②③④C.②③D.①④
【解析】贮存很久的漂白粉中有CaCO3,故制得的Cl2中含有CO2、挥发的HCl和水蒸气。【答案】A
2.下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是()
①Ca(ClO)2②H2SO3③氯水④NaOH⑤浓HCl
A.①②④B.②③⑤C.②③D.①④⑤
【解析】①Ca(ClO)2水解呈碱性,②H2SO3被氧化为H2SO4,③最终变
为HCl,④呈碱性,⑤不断挥发,pH增大.【答案】C
练习
1. 漂白粉在空气中放置易失效的主要原因是()
A.Ca(ClO)2不稳定,易分解B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应D.Ca(ClO)2跟空气中的CO2反应
2. 市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用
时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是()
A、Cl2
B、H2SO4
C、NaClO
D、KMnO4