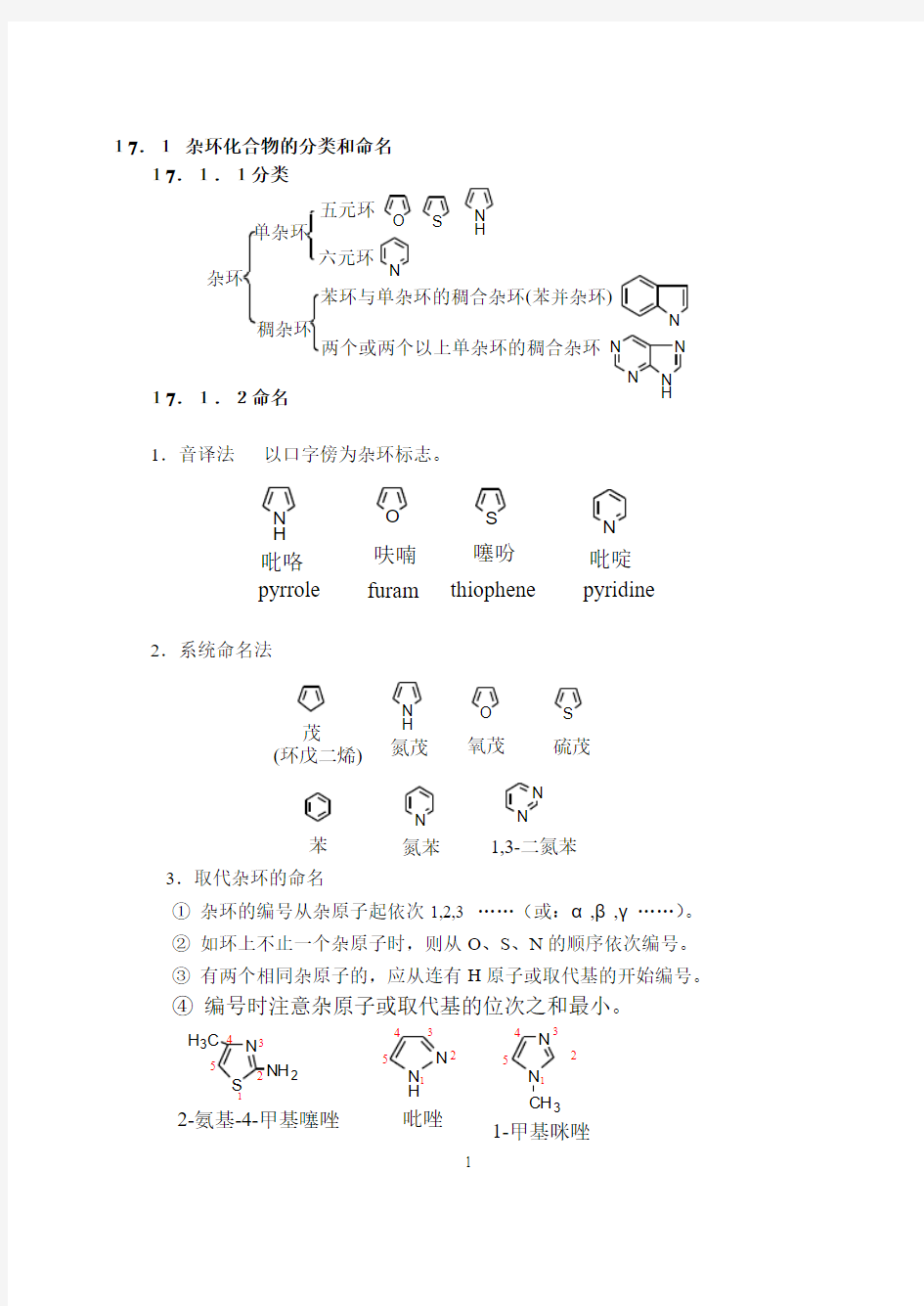
17.1 杂环化合物的分类和命名 17.1.1分类
17.1.2命名
1.音译法 以口字傍为杂环标志。
2.系统命名法
3.取代杂环的命名
① 杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。 ② 如环上不止一个杂原子时,则从O 、S 、N 的顺序依次编号。 ③ 有两个相同杂原子的,应从连有H 原子或取代基的开始编号。 ④ 编号时注意杂原子或取代基的位次之和最小。
杂环单杂环
五元环六元环苯环与单杂环的稠合杂环(苯并杂环)
两个或两个以上单杂环的稠合杂环O S N H 稠杂环
N
N
N N N
H N O S N H 吡咯呋喃噻吩吡啶N pyrrole furam thiophene pyridine N S
NH 2
H 3C
5
1
24
3
2-氨基-4-甲基噻唑N H
N 1234
5
N N 1
2
3
4
5
CH 3
吡唑
1-
甲基咪唑
O S
N H
N
茂(环戊二烯)氮茂氧茂硫茂N
N
苯氮苯1,3-二氮苯
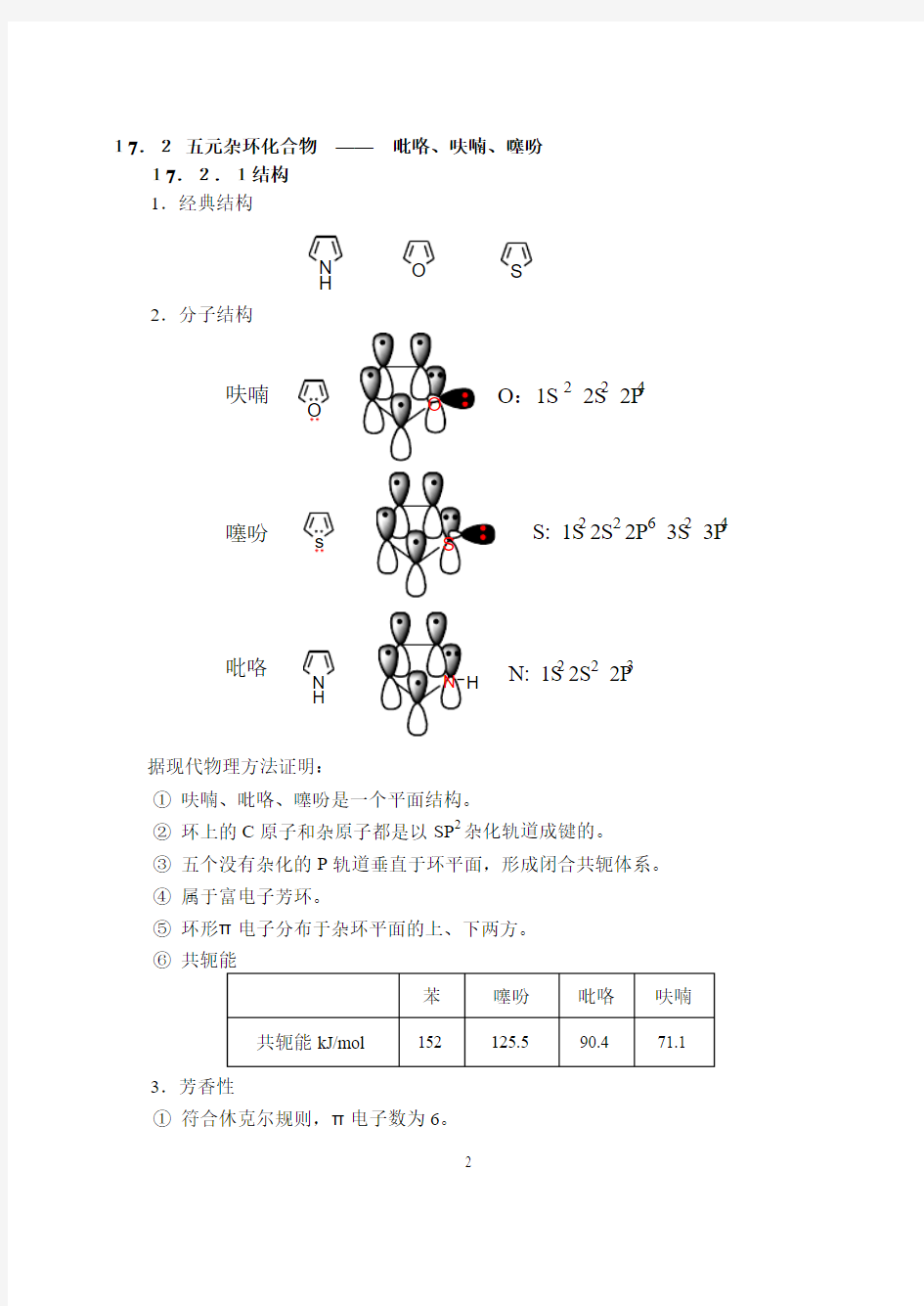
17.2 五元杂环化合物 —— 吡咯、呋喃、噻吩
17.2.1结构 1.经典结构
2.分子结构
据现代物理方法证明:
① 呋喃、吡咯、噻吩是一个平面结构。
② 环上的C 原子和杂原子都是以SP 2杂化轨道成键的。 ③ 五个没有杂化的P 轨道垂直于环平面,形成闭合共轭体系。 ④ 属于富电子芳环。
⑤ 环形π电子分布于杂环平面的上、下两方。 ⑥
3.芳香性
① 符合休克尔规则,π电子数为6。
O S N
H O
呋喃
O :1S 2 2S 2 2P
4
噻吩
s
S: 1S 2 2S 2 2P 6 3S 2 3P 4
N H
吡咯
N: 1S 2 2S 2 2P 3
② 芳香性比较(易取代、难加成、难氧化):
苯>噻吩> 吡咯>呋喃
③ 解释
环的稳定性:苯 > 噻吩 > 吡咯 > 呋喃 17.2.2呋喃、噻吩、吡咯的制备
帕尔-诺尔合成法:用1,4-二酮合成。
17.2.3化学性质
O
S
N
0.1383nm
0.1371nm
0.1431nm
0.1423nm
0.1371nm
0.1714nm
0.1429nm
0.1370nm
0.1383nm
O
S
N
S
N
1.73D
1.90D
1.58D
1.81D
0.51D
0.70D
非芳香性的杂环化合物只有诱导效应。
芳香体系的杂环化合物有诱导效应和共轭效应。
O
280℃
Ni 催化脱羰基O
650℃
C H 3C H 2C H 2C H 3
+S
S
CH 3CH=CHCH 3CH 3CH 2CH=CH
2
+SO 2
S
O
+NH 3
Al 2O 3N
H
O O
R
R
O R S
R
N H
R
R
1.亲电取代反应 ① 卤代
② 硝化
乙酰硝酸酯是较为温和的砂化剂,用时临时制备。
O
O
O
O
Cl Br
Cl
+
呋喃与卤素反应激烈,卤素稍过量,常得到多卤化物。
Cl
80%
S
Cl
Cl S
Cl Cl
Cl Cl
+
78%
36%
14%
加成产物13%
O CH 3CO 2NO 2O O H NO 2H CH 3COO NO 2
吡啶35%
加成物S
+
322S
NO 2
S
NO 270%
5%
N H
83%
11%
HONO 2+N H NO 2N H NO 2
N H
从偶极矩来看,N 的供电性强,使吡咯上C 原子电子云密度增加的多。极易取代 。
H
80%
S
95% H 2SO 4
S
SO 3H 噻吩-2-磺酸
③ 磺化
噻吩在室温下可直接磺化,生成溶于水的α-噻吩磺酸。这个反应常用来除去粗苯中的噻吩。吡咯和呋喃对酸敏感,吡咯在酸性条件下易聚合;呋喃遇酸要开环,故需与吡啶三氧化硫为磺化剂。
④ 乙酰化
⑤ 亲电取代反应小结 a .亲电取代反应的活性
吡咯 > 呋喃 > 噻吩 >> 苯
溴化相对速度: 3*1018 6*1011 5*1011 1
O
22O
N +
SO 3-
呋喃-2-磺酸吡啶盐
3H
41%
N H
N H
N H
+
SO 3-H
3H
吡咯-2-磺酸吡啶盐
90%
O 0℃
3O
C OC H 3
N H
乙酐N H
COCH 3
N H
COCH 3
CH 3CO
+
60%
S 34
S
COCH 3
70%
乙酐
S
S
+
B .亲电基团一般进入杂原子的邻位
静态时,α-位上的电子云密度较其它位大。
2.加成反应
邻位的电子云密度丰富所以取代发生在α位。
O
O
3CH 2CH 2CH 2OH
N H
H
O
+Br O
Br H
Br
H O
OC H 3H
H 3C O
H CH 3OH
-50℃
N H
-0.06-0.10
+0.32O -0.02-0.03
+0.10S -0.04-0.06
+0.20
呋喃加成反应的较容易。 3.特征反应 ① 呋喃的双烯特征
② 吡咯的弱酸性和弱碱性
弱酸性 吡咯N 原子上的H 原子都有微弱的酸性
酸性比较: 苯酚 > 吡咯 > 乙醇
Ka : 1.3*10-10 10-15 10-18
弱碱性
苯胺 > 吡咯
K b 3.8*10-10 2.5*10-14
4.鉴别反应
① 呋喃使盐酸浸过的松木片显绿色。 ② 噻吩和吲哚醌在硫酸作用下发生兰色反应。 噻吩在浓硫酸的作用下与松木片能呈现兰色反应。 ③ 浸盐酸的松木片遇吡咯蒸气显红色。 17.2.4糠醛(α—呋喃甲醛) 1.制备
O
30℃
+
外型(主)
内型
N H
- K +
gX
C 6H 5COCl CH 3I
甲苯6H 5N-CH
3
N H
吡咯红树脂化
△
2.化性 ① 催化加氢
② 氧化
顺丁烯二酸酐
③ 歧化
④ 安息香缩合
⑤ 合成四氢呋喃作为溶剂
(C 5H 8O 4)n 稀酸
2水解
戊糖
O
CHO
C
CH 稀酸
△
-3H 2O
C H O
+
H 2
CuO,Cr O 150℃
O
C H 2H 2OH
O
C H O
O
C OOH
4
中性或碱性氧化
O
CHO O O
+320℃2O
2253O O C H O
+ 浓NaOH H 2OH
O
C OOH
+
O
O
CH O
C OH O
KCN 溶液
O
Ni 催化脱羰基
O
HCl
NaCN
3.糠醛遇苯胺醋酸盐溶液显深红色。4.用途:①糠醛是良好的溶剂;
②广泛用于油漆及树脂工业; ③合成苯酚糠醛塑料。
17.2.5噻唑和咪唑
1.噻唑:是稳定的环,在空气中不会自动氧化。
青霉素G 中四元环内酰胺很不稳定,对酸、碱都很敏感,特别容易被酸水解。口服后在胃中水解,β内酰胺的四元环打开而失效,现口服青霉素就是将其中-CH 2C 6H 5换为
2.咪唑
① 碱性比噻唑强。
可与强酸生成稳定的盐。
② 有微弱的酸性。
H 2C CH 2CH 2CN
CH 2已二醇
还原
N
s
1
2
3
45
N
N
C N
s
NH 3 Cl CH 3C H 2
CH 3
CH 2CH 2OH
嘧啶环噻唑环
维生素B 1
+
-+
Cl -N s
HOOC
CO
CH-NH-CO-CH
2C 6H 5
氢化噻唑环
青霉素G
CH 3
CH 3N N H
12
34
5
HCl
N N H
N H N H
+
-N H N H
Cl -
+N S 1
23
45 噻 唑 或
1,3-硫氮茂
③ 易发生亲电取代反应。
④ 互变异构现象
17.2.6吲哚 1.结构
靛蓝为蓝色固体,熔点391℃,不溶于水,是我国古代使用得很广泛的一种蓝色染料。医药上可用作清热解毒剂,治疗腮腺炎。由于靛蓝不溶于水,因此染色时应先用保险粉(Na 2S 2O 4)将它还原为靛白,靛白能溶于碱溶液,对纤维有很强的亲和力,可以附着于织物上。将浸过靛白溶液的织物,取出晾干,靛白在空气中很容易被氧化成靛蓝,并牢固地附着在织物纤维上。靛蓝现已由苯胺为原料合成。
2.性质 与吡咯相似 ① 弱碱性
② 也有松木片反应呈红色。
③ 在空气中颜色变深,渐渐变成树脂状。 ④ 亲电取代反应(β位)
β位的电子云密度较α位大,故进β位 吡咯亲电取代是进入α位。
-
N N H
NH NaNH
2N N
-Na +
N N Na +
-
N N H
12
34
5
NH N
1
2
3
4
5CH 3
CH 3
4-甲基咪唑5-甲基咪唑
N H
H N
O
N H
CH 3
N H
O
N H
CH 2COOH
β甲基吲哚
β-吲哚乙酸
靛蓝(反式)
N H
-0.065-0.041
+0.28
17.3 六元杂环化合物
17.3.1吡啶
1.吡啶的来源和制取
吡啶存在于煤焦油、页岩油、骨焦油中。吡啶的衍生物广泛存在于自然界。例维生素PP 、维生素B 6。辅酶Ⅰ及辅酶Ⅱ也含有吡啶环。
工业上从煤焦油提取吡啶和甲基吡啶。
工业上大量的合成:
重要的实验室合成法:(汉茨施Hantzsch 合成法)
N H
3H 2
O O
70%
H
97%
3
KMnO 4
O 2OH NH 3
N NH 3N
C H ≡C H +C H 2OH OC H 3+232
2.结构
吡啶的键合情况和苯相似。它们的碳原子和氮原子都认为是sp 2杂化的,吡啶环中五个碳原子和一个氮原子各供一个p 电子,它们的p 轨道与环的平面垂直,互相重叠而成闭合共轭体系。
3.性质
① 碱性及其成盐
吡啶 > 吡咯 三甲胺 > 吡啶 > 苯胺 PK b 4.2 8.8 9.4
苯胺分子中的氮原子上的未共用的电子对和苯环产生p-π,使N 原子上的电子云密度减小,而吡啶分子中N 原子上的未共用的电子对,不参与环上的共轭体系,所以吡啶的碱性比苯胺强。由于吡啶分子中氮原子的未共用的电子对处于sp 2杂化轨道上,而脂肪胺分子中氮原子的未共用的电子对处于sp 3杂化轨道上。sp 2杂化轨道s 成份大于sp 3杂化轨道s 成份,离核近,电子更靠近核,不容易与质子结合,所以吡啶的碱性比脂肪胺弱。
② 亲电取代 ·比苯难
··进入吡啶环的β位
···H +介质对亲电取代不利
N
N
1.17D
2.22D
C C H ROOC CH 3OH
N
H H
H C O H
H C H COOR CH 3HO 乙酸乙酯甲醛氨
乙酸乙酯
N H
COOR CH 3
ROOC C H 3
24
HNO 3N
COOR CH 3
R OOC CH 3
N +CH 3N +
CH 3
I 290~300℃
N CH 3+I -+N +
I -CH 3
③亲核取代 ·比苯容易 ··进入α位
④ 氧化 吡啶环对氧化剂稳定
⑤ 还原 较苯容易
吡啶和吡咯性质比较:
N
1.43
0.84
1.01
0.87
—
δ 1.01
0.84
N
N
Br N
NO 2N
SO 3H 39% 3-溴吡啶
3-硝基吡啶
3-吡啶磺酸
N
+
NaNH 2
C 6H 5NMe 2
2回流
N NHNa
N
NH 2
N C H 3KMnO 4β-吡啶甲酸(烟酸)
N C OOH
-N N C OOH C OOH
HNO 3△N H 2/Pt 乙酸
N
17.3.2嘧啶 1.结构
2.性质
① 无色结晶,熔点22℃,易溶于水。 ② 碱性比吡啶弱得多。 ③ 亲电取代反应比吡啶困难。 ④ 亲核取代反应比吡啶容易。 17.4喹啉 1.结构
2.制备——Skraup 合成法
3.化性
① 碱性比吡啶稍弱,可与酸成盐(pKa=9.1) ② 亲电取代
N
N 1
234
5
6N N
HO
N
N
HO
OH
NH 2N
N
HO
OH
CH 3尿嘧啶胞嘧啶胸腺嘧啶
N
1
2
34567
N
Br +
N
N
NO 2
3+
浓H 2SO 4NH 2
CHOH C H 2O H
CH 2OH +
N
84~91%
③ 亲核取代
④ 还原
⑤ 氧化
17.5嘌呤及其衍生物
1. 尿酸
2. 黄嘌呤 3. 咖啡碱、茶碱和可可碱
N
2
N
H
KMnO 4
N
N
H +
HOOC
N N H
N N 12
345
6
7
899-H 嘌呤
7-H 嘌呤
NH
N N N 12
3
45
6
7
8
9
NH N H
HN N H
尿酸
N N H N N
O O
O
OH
HO
OH
N N H
HN N H 黄嘌呤
N
N H N N
O
O
OH
HO
4. 腺嘌呤、鸟嘌呤
N N
N N O O
CH 3CH 3
CH 3
咖啡碱
N N H
N N O
O
CH 3CH 3
茶碱
N N
HN N O
O
CH 3
CH 3
可可碱
NH
N N N
腺嘌呤
NH 2N
N H
HN N
O H 2N
鸟嘌呤
有机物的命名 1、烷烃的命名 烷烃通常用系统命名法,其要点如下: (1)直链烷烃根据碳原子数称“某烷”,碳原子数由1到10用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,如CH3CH2CH2CH3叫丁烷,自十一起用汉数字表示,如C11H24,叫十一烷。 (2)带有支链烷烃的命名原则: A.选取主链。从烷烃构造式中,选取含碳原子数最多的碳链为主链,写出相当于这一碳链的直链烷烃的名称。 B.从最靠近取代基的一端开始,用1、2、3、4……对主链进行编号,使取代基编号“依次最小”。 C.如果有几种取代基时,应依“次序规则”排列。 D.当具有相同长度的碳链可选做主链时,应选定具有支链数目最多的碳链为主。例如: 2、脂环烃的命名 脂环烃分为饱和的脂环烃和不饱和的脂环烃。饱和的脂环烃称为环烷烃,不饱和的脂环烃称环烯烃或环炔烃。它们的命名是在同数目碳原子的开链烃的名称之前加冠词“环”。 连有取代基的环烷烃,命名时使取代基的编号最小。 取代的不饱和环烃,要从重键开始编号,并使取代基有较小的位次。 环之间有共同碳原子的多环化合物叫多环烃。根据环中共用碳原子的不同可分为螺环烃和桥环烃。 螺环烃分子中两个碳环共有一个碳原子。螺环烃的命名是根据成环碳原子的总数称为螺某烷,在螺字后面的方括号内,用阿拉伯数字标出两个碳环除了共有碳原子以外的碳原子数目,将小的数字排在前面,编号从较小环中与螺原子(共有碳原子)相邻的一个碳原子开始,经过共有碳原子而到较大的环进行编号,在此编号规则基础上使取代基及官能团编号较小。如
脂环烃分子中两个或两个以上碳环共有两个或两个以上碳原子的称为桥环烃。桥环烃中多个环共用的两个碳原子称为“桥头碳”,命名使先确定“桥”,并由桥头碳原子之一开始编号,其顺序是先经“大桥”再经“小桥”。环数大写于前,方括号内标出各桥的碳原子数,最后写某烷。如 3、含单官能团化合物的命名 含单官能团化合物的命名按下列步骤: (1)选择主链:选择含官能团的最长碳链为主链作为母体,称“某烯”、“某炔”、“某醇”、“某醛”、“某酸”等(而卤素、硝基、烷氧基则只作取代基),并标明官能团的位置。 (2)编号:从靠近官能团(或取代基)的一端开始编号。 (3)词头次序:同支链烷烃,按“次序规则”排列。如: 4、含多官能团的化合物命名 含多官能团的化合物按下列步骤命名: (1)选择主链(或母体):开链烃应选择含尽可能多官能团(尽量包含碳碳双键或碳碳三键)的最长碳链为主链(或母体);碳环,芳环,杂环以环核为母体。按表13-2次序优先选择一个主要官能团作词尾,即列在前面的官能团,优先选作词尾。 表13-2 引用作词尾和词头的官能团名称 官能团词尾词头 (某)酸羧基 —SO 3H (某)磺酸磺基 (某)酸(某)酯酯基 C OH O C OR O
:命名 1. 2. 3. CH 3CH 2C(CH 2CH 3)2CH 2CH 3 4. CH 3CH 2CH(CH 3) CH 2CH (CH 3)2 5. 6. (CH 3)4C 7.(CH 3)3CCH 2Br 8. (CH 3)2CHCH 2CH 2CH(CH 2CH 3) 2 9. 10. 11.(CH 3CH 2)2C=CH 2 12. (CH 3)2CHCH 2CH=C(CH 3)2 13. 14. 15. 16. 17. 18. CH 3(CH 2)3CH(CH 2)3CH 3 C(CH 3)2CH 2CH(CH 3)2C C CH 32CH 3 CH 3CH 3CH 2CH 3CH 2CH 2CHCH 2CH 2CH 3CH 3C C H C(CH 3)3(CH 3)2CH H CH 3CH 2-C-CH 2CH 2CH 3CHCH 3 C C H CH 2CH 2CH 3CH 3 CH 3CH 2 CH 3-C-CHCH 3 CH 3 Cl CH(CH 3)2CH 3CHCH 2CHCH 2Br C 2H 5CH 3C H CH(CH 3)2C 2H 5CH 3CH 3CH 2C CH 3CH 2CH 2CH 3CH(CH 3)2 C C Cl Br C 6H 5 H
19. 20.CH2=CHC≡CH 21.CH3CH=CHC≡CH 22.(CH3)2C=CH-C≡C-CH3 23.CH3CH (C2H5)C≡CCH3 24.(CH3) 3CC≡C-(CH2) 2-C (CH3) 3 25. 26.27.28.29.30.31.32.33.34. Cl Cl CH3 H3C C H(C H3)2 H3C CH(CH3)2 CH3 Cl SO3H CH2CH2CH3 NO2 SO3H OH OH SO3H O2N NO2 OH CH3 COOH C Cl C F CH3 CH3
2.1 用系统命名法(如果可能得话,同时用普通命名法)命名下列化合物,并指出(c )与(d) 中各碳原子得级数。 a. CH 3(CH 2)3CH(CH 2)3CH 3 C(CH 3)22CH(CH 3)2 b. C H C H C H H C H H C H H C H H H c. CH 322CH 3)2CH 23 d. CH 3CH 2CH CH 2CH 3 CH CH 2CH 2CH 3 CH 3CH 3 e. C CH 3 H 3C 3 H f. (CH 3)4C g. CH 3CHCH 2CH 3 2H 5 h. (CH 3)2CHCH 2CH 2CH(C 2H 5)2 1。 答案: a 、 2,4,4-三甲基-5-正丁基壬烷 5-bu ty l-2,4,4-t rimethylnon ane b 、 正己 烷 hexane c 、 3,3-二乙基戊烷 3,3-diethylpen tane d 、 3-甲基-5-异丙基辛烷 5-i sopro pyl-3-methyl oc tan e e 、 2-甲基丙烷(异丁烷)2-meth ylpropane (iso-buta ne) f 、 2,2-二甲基丙烷(新戊烷) 2,2-dimethylp ro pa ne (n eopentan e) g 、 3-甲基戊烷 3-methy lpentane h 、 2-甲基-5-乙基庚烷 5-et hyl -2-me th yl he ptane 2、3 写出下列各化合物得结构式,假如某个名称违反系统命名原则,予以更正。 a 、 3,3-二甲基丁烷 b 、 2,4-二甲基-5-异丙基壬烷 c 、 2,4,5,5-四甲基-4-乙基庚烷 d 、 3,4-二甲基-5-乙基癸烷 e 、 2,2,3-三甲基戊烷 f 、 2,3-二甲基-2-乙基丁烷 g、 2-异丙基-4-甲基己烷 h 、 4-乙基-5,5- 二甲基辛烷 答案 : a. 错,应为2,2-二甲基丁烷 C b. c. d. e. f. 错,应为2,3,3-三甲基戊烷 错,应为2,3,5-三甲基庚烷 g. h. 3.1 用系统命名法命名下列化合物 a. b.c. (CH 3CH 2)2C=CH 2CH 3CH 2CH 2CCH 2(CH 2)2CH 3 2 CH 3C=CHCHCH 2CH 3 C 2H 5CH 3 d. (CH 3)2CHCH 2CH=C(CH 3)2 答案: a 、 2-乙基-1-丁烯 2-ethyl-1-butene b、 2-丙基-1-己烯 2-prop yl-1-hexe ne c 、 3,5-二甲基-3-庚烯 3,5-d imethyl-3-hep tene d、 2,5-二甲基-2-己烯 2,5-dimet hyl -2-h ex en e 3、2写出下列化合物得结构式或构型式,如命名有误,予以更正。
第一部分有机化学命名法 1.带支链烷烃 主链选碳链最长、带支链最多者。 编号按最低系列规则。从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何)。例如, 命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列。 取代基次序IUPAC规定依英文名第一字母次序排列。我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子。例如, 称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面。 2.单官能团化合物 主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……)。卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置。 编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面。例如,
3.多官能团化合物 (1)脂肪族 选含官能团最多(尽量包括重键)的最长碳链为主链。官能团词尾取法习惯上按下列次序, —OH>—NH2(=NH)>C≡C>C=C 如烯、炔处在相同位次时则给双键以最低编号。例如, (2)脂环族、芳香族 如侧链简单,选环作母体;如取代基复杂,取碳链作主链。例如: (3)杂环 从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号。例如:
4.顺反异构体 (1)顺反命名法 环状化合物用顺、反表示。相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式。例如, (2)Z,E命名法 化合物中含有双键时用Z、E表示。按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E。 次序规则是: (Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:为最小; (Ⅱ)同位素质量高的优先,如D>H; (Ⅲ)二个基团中第一个原子相同时,依次比较第二、第三个原子; (Ⅳ)重键 分别可看作 (Ⅴ)Z优先于 E,R优先于S。 例如
目录lin 湛
第一章绪论 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。 答案: NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么? 答案: NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。因为两者溶液中均为Na+,K+,Br-, Cl-离子各1mol。由于CH4与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。 答案: 写出下列化合物的Lewis电子式。 答案: 下列各化合物哪个有偶极矩?画出其方向。 答案: 根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键? 答案: 电负性O>S,H2O与H2S相比,H2O有较强的偶极作用及氢键。 下列分子中那些可以形成氢键? b. CH3CH3 c. SiH4 d. CH3NH2 e. CH3CH2OH f. CH3OCH3 答案: d. CH3NH2 e. CH3CH2OH 醋酸分子式为CH3COOH,它是否能溶于水?为什么? 答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。 第二章饱和烃 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。 答案:C29H60 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d)中各碳原子的级数。答案: a. 2,4,4-三甲基-5-正丁基壬烷5-butyl-2,4,4-trimethylnonane b. 正己烷 hexane ,3-二乙基戊烷 3,3-diethylpentane -甲基-5-异丙基辛烷5-isopropyl-3-methyloctane e.2-甲基丙烷(异丁烷)2-methylpropane(iso-butane) ,2-二甲基丙烷(新戊烷) 2,2-dimethylpropane(neopentane)
高中化学有机物的系统命名练习题 一、单选题 1.烷烃的命名正确的是( ) A.4-甲基-3-丙基戊烷 B.3-异丙基己烷 C.2-甲基-3-丙基戊烷 D.2-甲基-3-乙基己烷 2.下列有机物的命名正确的是( ) A.2-乙基丁烷 B.2,2-二甲基丁烷 C.3,3 -二甲基丁烷 D.2,3,3一三甲基丁烷 3.下列有机物的命名正确的是( ) A.:1,2—二甲基丙烷B.CH3CH2CH=CH2:3—丁烯 C.CH2ClCHClCH3:1,2—二氯丙烷D.:1,5—二甲基苯 4.下列有机物的命名正确的是( ) A.CH3CHCH CH2 CH32—甲基—3—丁烯B. CH2CH3 乙基苯 C.CH3CHCH3 C2H5 2—乙基丙烷D. CH 3CHOH CH 3 1—甲基乙醇 5.下列有机物命名正确的是() A. CH3CH2CH2CH2OH 1-丁醇 B.2-乙基丙烷 C. 二甲苯 D. 2—甲基—2—丙烯 6.根据有机化合物的命名原则,下列命名正确的是( ) A.;3-甲基-1,3-丁二烯 B.;2-羟基丁烷 C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 D.CH3CH(NH2)CH2COOH 3-氨基丁酸 7.下列有机物命名正确的是( )
A.;1,3,4-三甲苯 B.;2-甲基-2-氯丙烷 C.;2-甲基-1-丙醇 D.;2-甲基-3-丁炔 8.下列有机物的命名正确的是( ) A. 2-羧基丁烷 B. 3-乙基-1-丁烯 C. 1,3-二溴丙烷 D. 2,2,3-三甲基戊烷 9.下列有机物的命名中,正确的是( ) A. ;2-乙基戊烷 B. ;3-甲基-2-戊烯 C. ;2-甲基戊炔 D. ;1-甲基-5-乙基苯 10.某烷烃的结构为:,下列命名正确的是()A.1,2-二甲基-3-乙基戊烷 B.3-乙基-4,5-二甲基已烷 C.4,5-二甲基-3-乙基已烷 D.2,3-二甲基-4-乙基已烷 11.有机物的正确命名为( ) A.2-乙基-3,3-二甲基戊烷 B.3,3-二甲基-4-乙基戊烷 C.3,3,4-三甲基己烷 D.2,3,3-三甲基己烷
有机化学的命名总结 姓名:蒲露年级:2012级 专业:化工与制药类学号;2012115153 学习有机化学这本书的人一定知道,有机化学这本书的每一章的前几节必定是有机化合物的命名,零零散散贯彻了整本书。其重要性,纷繁性不言而喻。但是仔细研究就会外线,有机化合物的命名看起来很零散,实际上很有规律。 有机化学命名原则根据IUPAC命名法及1980年中国化学学会命名原则,按各类化合物分述如下。 取代基的顺序规则 当主链上有多种取代基时,由顺序规则决定名称中基团的先后顺序。一般的规则如下: 1.取代基的第一个原子质量越大,顺序越高; 2.如果第一个原子相同,那么比较它们第一个原子上连接的原子的顺序;如有双键或三键,则视为连接了2或3个相同的原子。 3.以次序最高的官能团作为主要官能团,命名时放在最后。其他官能团,命名时顺序越低名称越靠前。 主链或主环系的选取 1.以含有主要官能团的最长碳链作为主链,靠近该官能团的一端标为1号碳。2.如果化合物的核心是一个环(系),那么该环系看作母体;除苯环以外,各个环系按照自己的规则确定1号碳,但同时要保证取代基的位置号最小。 3.支链中与主链相连的一个碳原子标为1号碳。 数词 1.位置号用阿拉伯数字表示。 2.官能团的数目用汉字数字表示。 3.碳链上碳原子的数目,10以内用天干表示,10以外用汉字数字表示。 总的命名规则 1.带支链烷烃主链选碳链最长、带支链最多者。编号按最低系列规则。从靠侧
链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何)。例如,命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列。取代基次序IUPAC规定依英文名第一字母次序排列。我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子。例如,称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面。 2.单官能团化合物 主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……)。卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置。编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面。 3.多官能团化合物 (1)脂肪族 选含官能团最多(尽量包括重键)的最长碳链为主链。官能团词尾取法习惯上按下列次序,—OH>—NH2(=NH)>C≡C>C=C如烯、炔处在相同位次时则给双键以最低编号。例如, (2)脂环族、芳香族 如侧链简单,选环作母体;如取代基复杂,取碳链作主链。 (3)杂环 从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号。 4.顺反异构体 (1)顺反命名法 环状化合物用顺、反表示。相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式。 (2)Z,E命名法 化合物中含有双键时用Z、E表示。按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E。 次序规则是: (Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:
命名规则 烷烃的命名 普通命名法: 碳原子数目+烷 碳原子数为1~10用天干(甲、乙、丙、……壬、癸)表示 不同的异构体用词头“正”、“异”和“新”等区分 碳原子数为10以上时用大写数字表示 IUPAC命名法(系统命名法): 1.选择主链(母体) (1)选择含碳原子数目最多的碳链作为主链,支链作为取代基。 (2)分子中有两条以上等长碳链时,则选择支链多的一条为主链。 2.碳原子的编号 (1)从最接近取代基的一端开始,将主链碳原子用1、2、3……编号 (2)从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号。 (3)若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系列编号最小(最低系列原则)为原则。 3.烷烃名称的写出 A将支链(取代基)写在主链名称的前面 B取代基按“次序规则”小的基团优先列出烷基的大小次序:甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基。 C相同基团合并写出,位置用2,3……标出,取代基数目用二,三……标出。
D表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开。 烷烃的命名归纳为十六个字:最长碳链,最小定位,同基合并,由简到繁。 环烷烃的命名 普通环烷烃的命名 以环为母体,名称用“环”开头。 环外基团作为环上的取代基。 取代基位置数字取最小 若取代基碳链较长,则环可作为取代基(称环基) 相同环连结时,可用词头“联”开头。联环丙烷 2'环烷烃的顺反异构:假定环中碳原子在一个平面上,以环平面为 2参考11' 平面,两取代基在同一边的叫顺式(cis-),否则叫反式(trans-) 桥环烃的命名 3'3 桥头碳:几个环共用的碳原子 环的数目:断裂二根C—C键可成链状烷烃为二环;断裂三根C—C键可成链状烷烃为三环桥头碳原子数:不包括桥头C,由多到少列出 环的编号方法:从桥头开始,先长链后短链 环的数目【桥头碳原子数多到少列出用.隔开】组成桥环的碳原子总数 螺环烃的命名
2.1 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。 a. CH 3(CH 2)3CH(CH 2)3CH 3 C(CH 3)22CH(CH 3)2 b. C H C H C H H C H H C H H C H H H c. CH 322CH 3)2CH 23 d. CH 3CH 2CH CH 2CH 3 CH CH 2CH 2CH 3 CH 3CH 3 e. C CH 3 H 3C 3 H f. (CH 3)4C g. CH 3CHCH 2CH 3 2H 5 h. (CH 3)2CHCH 2CH 2CH(C 2H 5)2 1。 答案: a. 2,4,4-三甲基-5-正丁基壬烷 5-butyl -2,4,4-trimethylnonane b. 正己 烷 hexane c. 3,3-二乙基戊烷 3,3-diethylpentane d. 3-甲基-5-异丙基辛烷 5-isopropyl -3-methyloctane e. 2-甲基丙烷(异丁烷)2-methylpropane (iso -butane) f. 2,2-二甲基丙烷(新戊烷) 2,2-dimethylpropane (neopentane) g. 3-甲基戊烷 3-methylpentane h. 2-甲基-5-乙基庚烷 5-ethyl -2-methylheptane 2.3 写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。 a. 3,3-二甲基丁烷 b. 2,4-二甲基-5-异丙基壬烷 c. 2,4,5,5-四甲基 -4-乙基庚烷 d. 3,4-二甲基-5-乙基癸烷 e. 2,2,3-三甲基戊烷 f. 2,3-二甲基-2-乙基丁烷 g. 2-异丙基-4-甲基己烷 h. 4-乙基-5,5- 二甲基辛烷 答案: a. 错,应为2,2-二甲基丁烷 C b. c. d. e. f. 错,应为2,3,3-三甲基戊烷 错,应为2,3,5-三甲基庚烷 g. h. 3.1 用系统命名法命名下列化合物 答案: a. 2-乙基-1-丁烯 2-ethyl -1-butene b. 2-丙基-1-己烯 2-propyl -1-hexene c. 3,5-二甲基-3-庚烯 3,5-dimethyl -3-heptene d. 2,5-二甲基-2-己烯 2,5-dimethyl -2-hexene 3.2写出下列化合物的结构式或构型式,如命名有误,予以更正。 a. b.c. (CH 3CH 2)2C=CH 2CH 3CH 2CH 2CCH 2(CH 2)2CH 3 2 CH 3C=CHCHCH 2CH 3 C 2H 5CH 3 d. (CH 3)2CHCH 2CH=C(CH 3)2
一烃的衍生物性质对比 1.脂肪醇、芳香醇、酚的比较 2.苯、甲苯、苯酚的分子结构及典型性质比较 3.醛、羰酸、酯(油脂)的综合比较
4.烃的羟基衍生物性质比较 5.烃的羰基衍生物性质比较 6.酯化反应与中和反应的比较 7.烃的衍生物的比较
二、有机反应的主要类型
三、烃及其重要衍生物之间的相互转化关系
要点精讲 一、有机化合物的分类 1.按碳的骨架分类 2.按官能团分类 (1)官能团:决定化合物特殊性质的原子或原子团 又:链状烃和脂环烃统称为脂肪烃。 二、有机化合物的结构特点 1.有机化合物中碳原子的成键特点 (1)碳原子的结构特点 碳原子最外层有4个电子,能与其他原子形成4个共价键。 (2)碳原子间的结合方式 碳原子不仅可以与氢原子形成共价键,而且碳原子之间也能形成单键、双键或三键。多个碳原子可以形成 长短不一的碳链和碳环,碳链和碳环也可以相互结合,所以有机物种类纷繁,数量庞大。 2.有机化合物的同分异构现象 (1)概念 化合物具有相同的分子式,但具有不同结构的现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。 (2)同分异构体的类别 ①碳链异构:由于分子中烷基所取代的位置不同产生的同分异构现象,如正丁烷和异丁烷; ②位置异构:由于官能团在碳链上所处的位置不同产生的同分异构现象,如1--丁烯和2--丁烯; ③官能团异构:有机物分子式相同,但官能团不同产生的异构现象,如乙酸和甲酸甲酯; ④给信息的其他同分异构体:顺反异构,对映异构。 3.同分异构体的书写方法 (1)同分异构体的书写规律 ①烷烃 烷烃只存在碳链异构,书写时应注意要全面而不重复,具体规则如下:成直链,一条线;摘一碳,挂中间,往边移,不到端;摘二碳,成乙基;二甲基,同、邻、间。 ②具有官能团的有机物 一般书写的顺序:碳链异构→位置异构→官能团异构。
第一章 烷烃(试题及答案) 一、命名下列化合物 1.CH CH 3CH 3 C CH 2CH 23CH 3CH 3 2. C 2H 5CH 3CH 3C CH 2CH 2CH 33CH 2CH 2 2,2,3-甲基己烷 4,4-二甲基-5-乙基辛烷 3. C 2H 5 CHCH CH 3CH 3CH 3 4. CH C 2H 5CH CH CH 3CH 3 CH 2CH 2CH 3CH 3CH 2 2,3-二甲基戊烷 2,6-二甲基-3-乙基辛烷 5. CH C 2H 5CH CH CH 3CH 3CH 3 CH 3CH 2 6.CH C 2H 5CH CH CH 33C 2H 5CH 3CH 2 2,4-二甲基-3-乙基己烷 2,5-二甲基-3-乙基庚烷 7. CH C 2H 5CH CH 3CH 3 CH 2CH 2CH 3 CH 2CH 2CH 3 8.CH 2CH 3C (C 2H 5)2(CH 3) 2,6-二甲基-5-乙基壬烷 3-甲基-3-乙基戊烷 9. CH 2CH 2CH CH 2CH 3 CH CH 332CH 2CH 3 10. (CH 3)2CH CH 2CH 2(C 2H 5)2 3-甲基-5-乙基辛烷 2-甲基-5-乙基庚烷 二、写出下列化合物的结构式 1. 2,2,4-三甲基戊烷 2. 4-甲基-5-异丙基辛烷 (CH 3)3CCH 2CH(CH 3)2 CH 2CH 2CH CH CH 33CH 2CH(CH 3)2 2CH 3 3.2-甲基-3-乙基庚烷 4. 4-异丙基-5-丁基癸烷 CH CH 3CH(CH 3)2(CH 2)32H 5 CH 2(CH 2)4CH CH CH 3CH 3 CH 2CH 3 3)2(CH 2)3 5.2-甲基-3-乙基己烷 6. 2,4-二甲基-3-乙基己烷 CH 2CH 2CH CH 3CH(CH 3)2CH 2CH 3 CH 2CH CH 3CH CH 3CH(CH 3)2CH 2CH 3 7.2,2,3,3-四甲基戊烷 8.2,4-二甲基-4-乙基庚烷 (CH 3)3C C 2H 5CH 3CH 3C (CH 3)2CH CH 2CH 3 2H 5CH 3 CH 2C CH 2 9. 2,5-二甲基己烷 10. 2,2,3-三甲基丁烷 (CH 3)2CHCH 2CH(CH 3)2CH 2 (CH 3)3C CH(CH 3)2 三、回答问题 1.2,2-二甲基丁烷的一氯代产物
大学有机化学知识点总结 一、有机化合物的命名 命名是学习有机化学的“语言”,因此,要求学习者必须掌握。有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。 1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等。 2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。 3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。要牢记命名中所遵循的“次序规则”。 4、次序规则:次序规则是各种取代基按照优先顺序排列的规则 (1)原子:原子序数大的排在前面,同位素质量数大的优先。几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H (2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3- (3)不饱和基团:可看作是与两个或三个相同的原子相连。不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH- 次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名 烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。 按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基 >丁基>丙基>乙基>甲基。 (1)、几何异构体的命名:烯烃几何异构体的命名包括顺、反和Z、E两种方法。简单的化合物可以用顺反表示,也可以用Z、E表示。用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式。如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示。按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型。必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系。有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型。例如: CH3-CH2 Br C=C (反式,Z型) H CH2-CH3 CH3-CH2 CH3 C=C (反式,E型) H CH2-CH3
第 一部分 有机化学命名 法 1.带支链烷烃 主链 选碳链最长、带支链最多者。 编号 按最低系列规则。从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何)。例如, 命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列。 取代基次序IUPAC 规定依英文名第一字母次序排列。我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子。例如, 称2-甲基-3-乙基戊烷,因—CH 2CH 3>—CH 3,故将—CH 3放在前面。 2.单官能团化合物 主链 选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……)。卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置。 编号 从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面。例如, 3.多官能团化合物
(1)脂肪族 选含官能团最多(尽量包括重键)的最长碳链为主链。官能团词尾取法习惯上按下列次序, (=NH)>C≡C>C=C —OH>—NH 2 如烯、炔处在相同位次时则给双键以最低编号。例如, (2)脂环族、芳香族 如侧链简单,选环作母体;如取代基复杂,取碳链作主链。例如: (3)杂环 从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号。例如: 4.顺反异构体 (1)顺反命名法 环状化合物用顺、反表示。相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式。例如, (2)Z,E命名法 化合物中含有双键时用Z、E表示。按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E。 次序规则是:
有机化学总结 一、有机化合物的命名 (1)、几何异构体的命名烯烃几何异构体的命名包括顺、反和Z、E两种方法。 简单的化合物可以用顺反表示,也可以用Z、E表示。用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式。如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示。按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型。必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系。有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型。例如: CH3-CH2 Br C=C (反式,Z型) H CH2-CH3 CH3-CH2 CH3 C=C (反式,E型) H CH2-CH3 脂环化合物也存在顺反异构体,两个取代基在环平面的同侧为顺式,反之为反式。 (2)、光学异构体的命名光学异构体的构型有两种表示方法D、L和R、S, D 、L标记法以甘油醛为标准,有一定的局限性,有些化合物很难确定它与甘油醛结构的对应关系,因此,更多的是应用R、S标记法,它是根据手性碳原子所连四个不同原子或基团在空间的排列顺序标记的。光学异构体一般用投影式表示,要掌握费歇尔投影式的投影原则及构型的判断方法。例如: COOH 根据投影式判断构型,首先要明确, H NH2 在投影式中,横线所连基团向前, CH2-CH3竖线所连基团向后;再根据“次序 规则”排列手性碳原子所连四个基团的优先顺序,在上式中: -NH2>-COOH>-CH2-CH3>-H ;将最小基团氢原子作为以碳原子为中心的正四面体顶端,其余三个基团为正四面体底部三角形的角顶,从四面体底部向顶端方向看三个基团,从大到小,顺时针为R,逆时针为S 。在上式中,从-NH2-COOH -CH2-CH3为顺时针方向,因此投影式所代表的化合物为R构型,命名为R-2-氨基丁酸。 (3)、双官能团化合物的命名双官能团和多官能团化合物的命名关键是确定母体。 常见的有以下几种情况: ①当卤素和硝基与其它官能团并存时,把卤素和硝基作为取代基,其它官能团为母体。 ②当双键与羟基、羰基、羧基并存时,不以烯烃为母体,而是以醇、醛、酮、羧酸为母体。 ③当羟基与羰基并存时,以醛、酮为母体。 ④当羰基与羧基并存时,以羧酸为母体。 ⑤当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号。 (4).杂环化合物的命名由于大部分杂环母核是由外文名称音译而来,所以,一般采用音译法。要注意取代基的编号。 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(
有机化合物命名规则大全 有机化合物种类繁多,数目庞大,即使同一分子式,也有不同的异构体,若没有一个完整的命名(nomenclature)方法来区分各个化合物,在文献中会造成极大的混乱,因此认真学习每一类化合物的命名是有机化学的一项重要内容。现在书籍、期刊中经常使用普通命名法和国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry)命名法, 后者简称IUPAC命名法。 一、链烷烃的命名 1. 系统命名法 (1)直链烷烃的命名 直链烷烃(n?alkanes)的名称用“碳原子数+烷”来表示。当碳原子数为1?10时,依次用天干——甲、乙、丙、丁、戊、己、庚、辛、壬、癸——表示。碳原子数超过10时,用数字表示。例如:六个碳的直链烷烃称为已烷。十四个碳的直链烷烃称为十四烷。烷烃的英文名称是alkane,词尾用ane。表1列出了一些正烷烃的中英文名称: 表1 正烷烃的名称
以上20个碳以内的烷烃要比较熟悉,以后经常要用。烷烃的英文名称变化是有规律的,认真阅读上表即可看出。表中的正(n ?)表示直链烷烃,正(n ?)可以省略。 (2)支链烷烃的命名 有分支的烷烃称为支链烷烃(branched ?chain alkanes )。 (i )碳原子的级 下面化合物中含有四种不同碳原子: CH 3 C CH 33C CH 3H C H H CH 3 (i) (i) (i) (i) (i) (ii)(iii)(iv) ① 与一个碳相连的碳原子是一级碳原子,用1?C 表示(或称伯碳,primary carbon ),1?C 上的氢称为一级氢,用1?H 表示。 ② 与两个碳相连的碳原子是二级碳原子,用2?C 表示(或称仲碳,secondary carbon ),2?C 上的氢称为二级氢,用2?H 表示。 ③ 与三个碳相连的碳原子是三级碳原子,用3?C 表示(或称叔碳,tertiary carbon ),3?C 上的氢称为三级氢,用3?H 表示。 ④ 与四个碳相连的碳原子是四级碳原子,用4?C 表示(或称季碳,quaternary carbon ) (ii )烷基的名称 烷烃去掉一个氢原子后剩下的部分称为烷基。英文名称为alkyl ,即将烷烃的词尾?ane 改为?yl 。烷基可以用普通命名法命名,也可以用系统命名法命名。表2列出了一些常见烷基的名称。
有机化学复习总结 一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1 )伞形式: COOH OH H 3 2)锯架式:CH 3 OH H H OH C 2H 5 3) 纽曼投影式: H H 4)菲舍尔投影式:COOH CH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅 式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型, 在相反侧,为E 构型。 CH 3 C H C 2H 5CH 3C C H 2H 5Cl (Z)-3-氯-2-戊烯 (E)-3-氯-2-戊烯 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式; 在相反侧,则为反式。
有机化合物命名的四大基本原则 官能团次序规则 -COOH > -SO3H > -COOR > -COX > -CONH2 > -COOCO- > -CN > -CHO > -CO- > -OH > -SH > -NH2 > -C三C- > -C=C- > -OR > -SR > -F > -Cl > -Br > -I > -NO2 > -NO 即羧酸>磺酸>羧酸酯>酰卤>酰胺>酸酐>腈>醛>酮>醇>硫醇>酚>硫酚>胺>炔烃>烯烃>醚>硫醚>卤代烃>硝基化合物>亚硝基化合物 当有机化合物含有多个官能团时,要以最优先的官能团为主官能团,其他官能团作为取代基备注:-CHO在作为主官能团的时候叫醛基,作为取代基时叫甲酰基 最长碳链原则 (1)当有机物不含有官能团时,要选择含有碳原子最多的碳链作为主链 (2)如果发现有机物含有多个相同个数碳原子的最长碳链,应该选择含支链最多的最长碳链作为主链 (3)如果发现有机物含有多个含支链个数相同的最长碳链,应考虑所有取代基的位次,要选择能使所有取代基的位次尽量小的并且含支链最多的最长碳链为主链(取代基编号规则详见最低系列原则) (4) 如果发现有机物含有多个碳原子数相同、支链数相同、所有取代基占据的位次也相同的最长碳链,要选择能使最不优先的取代基占据最小位次的最长碳链。 (5)当有机化合物含有官能团时,一定要把主官能团选入主链,还要尽可能多的把该物质含有的所有官能团选入主链,并且最优先的作为命名母体的官能团必须在主链上,其余的原则与(1)-(3)相同 最低系列原则 (1)主链选定以后,要从主链的一边向另一边给主链编号,编号时,要优先让主官能团的编号(即位次)最小,但有特例,如烯炔烃的命名 (2)如果发现无论从主链的哪一边编号主官能团的位次都相同时,要尽量扰让所有的取代基的位次最小。 (3)如果发现无论从主链的哪一边编号时,主官能团和所有取代基所占据的位次均相同时,应给最不优先的取代基最小的位次 取代基次序规则 所有的取代基,如–COOH –Cl –OCH3等,都含有“-”部分,和“-”部分直接相连的原子称为取代基的第一个原子,取代基的次序规则如下: (1)取代基的第一个原子的原子序数越大,该取代基越优先,孤对电子的原子序数默认是0,同位素中质量数大的同位素优先,比如 -NH2 的第一个原子是氮,原子序数是7 而 -CHO 的第一个原子是碳,原子序数是6,由于7 > 6,所以氨基比甲酰基优先 (2)如果取代基的第一个原子相同,则看取代基的第一个原子与什么原子相连,比如异丙基和异丁基,他们的第一个原子都是碳原子,而与异丙基的第一个原子相连的原子分别是“碳碳氢”,与异丁基的第一个原子相连的原子分别是“碳氢氢”按照顺序比较“碳碳氢”和“碳氢氢”的区别,发现碳和碳相同,最后的氢和氢也相同,但中间碳比氢的原子序数大,所以,异丙基比异丁基优先。 (3)如果取代基的第一个和第二个原子均相同,就继续向外推至第三个,第四个原子进行比较,直到比出那个取代基优先为止
第一章绪论 (一)用简练的文字解释下列术语。 (1)有机化合物(2)键能(3)极性键(4)官能团 (5)实验式(6)构造式(7)均裂(8)异裂 (9)sp2杂化(10)诱导效应(11)氢键(12)Lewis酸 【解答】 (1)有机化合物—碳氢化合物及其衍生物。 (2)键能—形成共价键的过程中体系释放出的能量,或共价键断裂过程中体系所吸收的能量。 (3)极性键—由不相原子形成的键,由于成键原子的电负性不同,其吸引电子的能力不同,使电负性较强原子的一端电子云密度较大,具有部分负电荷,而另一端则电子云密度较小,具有部分正电荷,这种键具有极性,称为极性键。云对称地分布在两个成键原子之间,这种键没有极性,称为极性键。 (4)官能团—分子中比较活泼而容易发生反应的原子或基团,它常常决定着化合物的主要性质,反映化合物的主要特征。 (5)实验式—表示组成物质的元素原子最简整数比的化学式。 (6)构造式—表示分子构造的化学式。 (7)均裂—成键的一对电子平均分给两个成键原子或基团,这种断裂称均裂。(8)异裂—成键的一对电子完全为成键原子中的一个原子或基团所占有,形成正、负离子,这种断裂称异裂。
(9)sp2杂化—2s轨道和两个2p轨道杂化。 (10)诱导效应—由于分子内成键原子的电负性不同,而引起分子中电子云密度分布不平均,且这种影响沿分子链静电诱导地传递下去,这种分子内原子间相互影响的电子效应,称为诱导效应。 (11)氢键—当氢原子与电负性很强且原子半径较小的原子(如N,O,F等原子)相连时,电子云偏向电负性较大的原子,使氢原子变成近乎氢正离子状态,此时若与另一个电负性很强的原子相遇,则发生静电吸引作用,使氢原子在两个电负性很强的原子之间形成桥梁,这样形成的键,称为氢键。 (12)Lewis酸—能够接受未共用电子对的分子或离子。 (二)下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis结构式。 【解答】 (三)试判断下列化合物是否为极性分子。 (1)HBr (2)I 2(3)CCl 4 (4)CH 2 Cl 2 (5)CH 3 OH (6)CH 3 OCH 3 【解答】 (1)、(4)、(5)、(6)为极性分子,其中(6)中C—O—C键角非180o;(2)、(3)为非极性分子。 (四)根据键能数据,乙烷分子在受热裂解时,哪种键首先断裂?为什么?这个过程是吸热还是放热? 【解答】