
第一节《元素周期表》
班级姓名组别组名
【考点解读】
⒈元素周期表的应用 2.同位素原子中质子数、中子数、质量数间的关系【知识梳理】
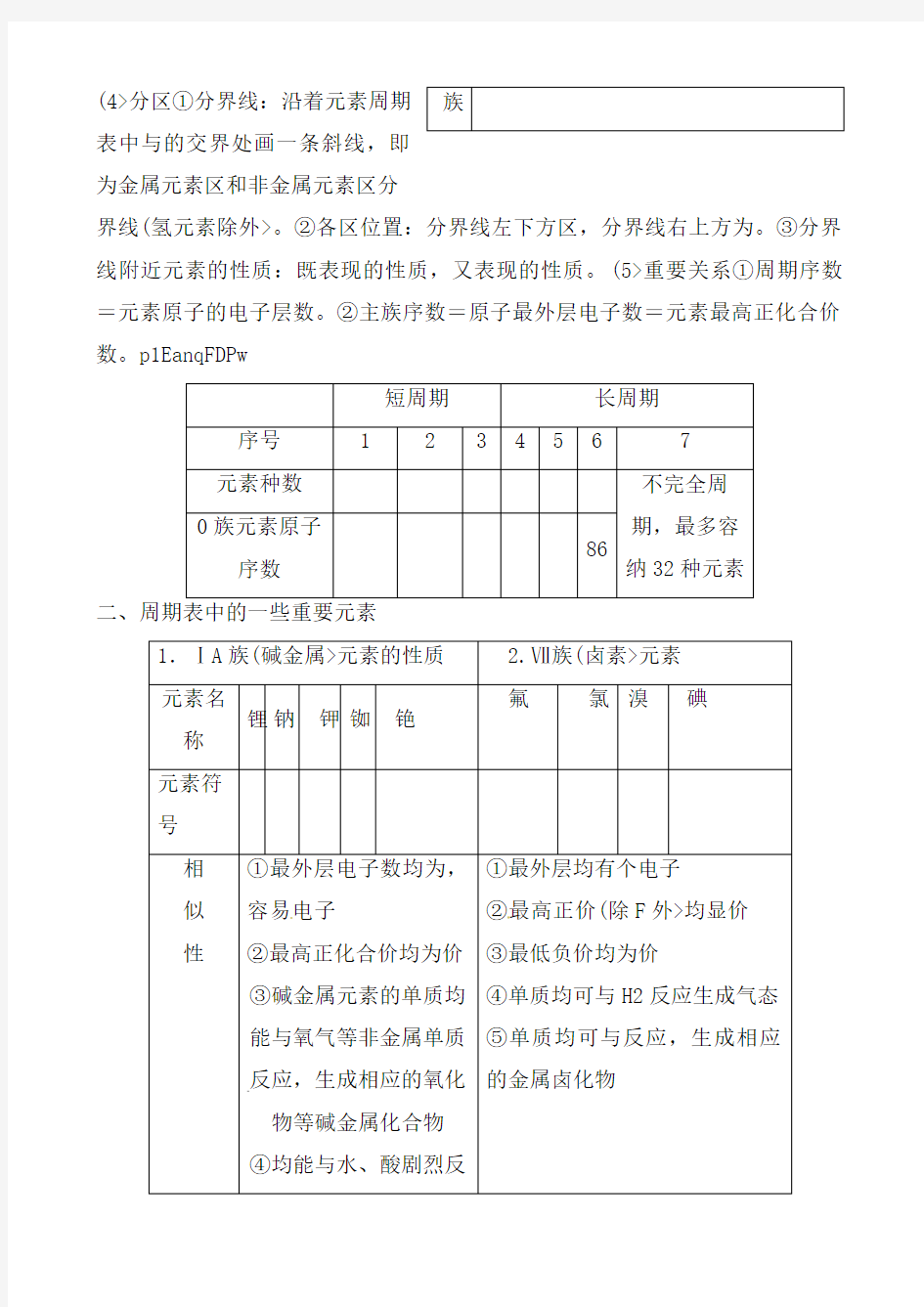
一、元素周期表
1.原子序数
对于一个原子:原子序数====-。
2.元素周期表
(1>编排原则:
①按递增顺序从左到右排列;②将相同的元素排成一横行,共有个横行。③把相同的元素按递增的顺序从上到下排成一纵列,共有列。b5E2RGbCAP
(2>周期7个横行,7个周期(3>族18列,16个族
表中与的交界处画一条斜线,即
为金属元素区和非金属元素区分
界线(氢元素除外>。②各区位置:分界线左下方区,分界线右上方为。③分界线附近元素的性质:既表现的性质,又表现的性质。(5>重要关系①周期序数=元素原子的电子层数。②主族序数=原子最外层电子数=元素最高正化合价
数。p1EanqFDPw
容易电子②最高正价
④氢氧化物的碱性
1.原子的表示方法
2.微粒间的基本关系
(1>对于原子质量数(A>=。质子数==。
(2>对于离子离子所带电荷=质子数-。
3.核素和同位素
(1>核素:具有一定数目和一定数目的一种原子,可用符号表示。
(2>同位素:相同而不同的同一种元素的不同核素互称为同位素。
(3>同位素的特征
①同位素化学性质几乎完全。②在自然界中同种元素的各种核素所占的原子百分数
问题:如何根据原子序数确定元素在周期表中的位置?同周期ⅡA族与ⅢA族元素原子序数差的关系如何?
4. 元素、核素、同位素“三素”的比较
(1>元素:具有相同的核电荷数(即质子数>的同类原子的总称。
判断不同微粒是否属于同一元素的要点是:单原子核与质子数相同,而不管微粒是处于何种状态(游离态或化合态>或价态(各种可能的负价、0价、各种可能的正价>。DXDiTa9E3d
(2>核素:具有一定数目的质子和一定数目的中子的一种原子叫做核素。换言之,核素是一种具体原子的另一称呼。RTCrpUDGiT
(3>同位素:具有相同质子数和不同中子数的同种元素的原子,互称同位素。换言之,同一元素的不同核素,互称同位素。5PCzVD7HxA
同位素中“同”的含义:是指元素符号、质子数、电子数、电子排布、在周期表中位置相同、原子的化学性质等相同,它们的物理性质略有差异。jLBHrnAILg
四. 微粒半径大小比较的思维模型<特别说明以上方法仅适用于主族元)
【及时巩固】
1.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( >xHAQX74J0X
A.金属性:Y>ZB.氢化物的沸点:X>WC.离子的还原性:X>WD.原子及离子半径:Z>Y>X
2. 下列说法正确的是( >A.相邻周期的同一主族的两种元素,其原子序数之差都相同B.同周期的ⅡA元素与ⅢA元素的原子序数之差都相同C.某种元素的相对原子质量取整数,就是其质量数D.若发现了115号元素,则该元素肯定位于第七周期第ⅤA族LDAYtRyKfE
3.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( >Zzz6ZB2Ltk
A.错误!(A-N+m> mol
B.错误!(A-N> mol
C.错误! (A-N> mol
D.错误! (A-N +m> moldvzfvkwMI1
4.(2009·全国理综Ⅱ,9>某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( >A.它是副族元素B.它是第六周期元素C。它的原子核内有63个质子D.它的一种同位素的核内有89个中子rqyn14ZNXI
5。下列粒子半径大小的比较正确的是(>
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+C.Na<Mg<Al <S D.Cs<Rb<K<NaEmxvxOtOco
申明:
所有资料为本人收集整理,仅限个人学习使用,勿做商业用途。