
选修电解池基本知识点归
纳总结
Ting Bao was revised on January 6, 20021
电解池及电化学防护
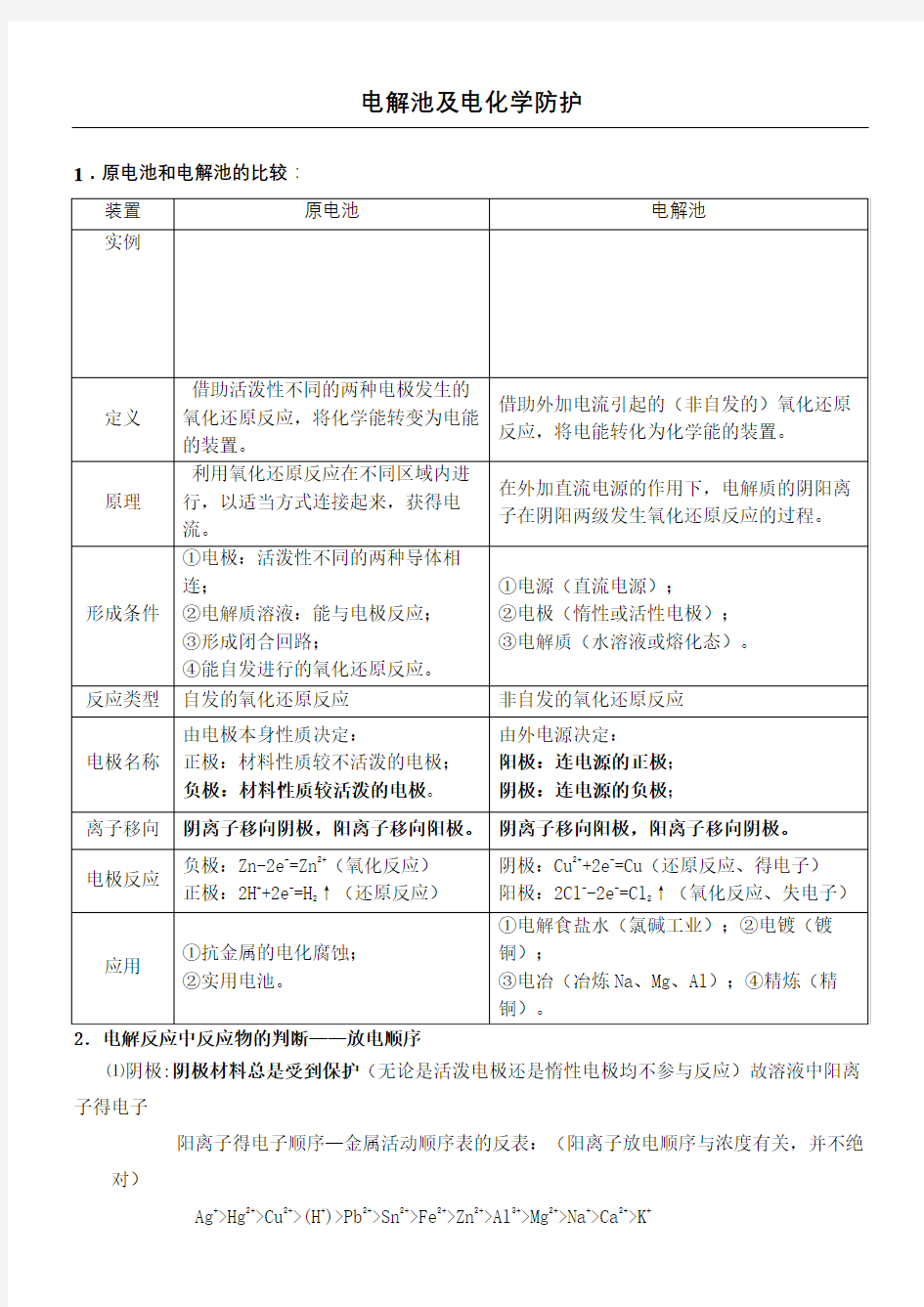
1.原电池和电解池的比较:
2.电解反应中反应物的判断——放电顺序
⑴阴极:阴极材料总是受到保护(无论是活泼电极还是惰性电极均不参与反应)故溶液中阳离子得电子
阳离子得电子顺序—金属活动顺序表的反表:(阳离子放电顺序与浓度有关,并不绝对)
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
⑵阳极A.若阳极是活性电极时:电极本身被氧化,溶液中的离子不放电
B.阳极材料是惰性电极(C、Pt、Au、Ti等)时:
阴离子失电子:S2->I->Br->Cl->(OH-)>NO
3
-等含氧酸根离子>F-
3.电解反应方程式的书写步骤:
①分析电解质溶液中存在的离子;
②看阳极电极材料,确定阳极参加反应的物质。若阳极材料为活性电极,则电极材料本身放
电。
若阳极材料为惰性电极,则阳极是溶液中的阴离子按照放电顺序进行放电。
③确定电极、写出电极反应式;
④写出电解方程式。
如:(阳极材料为惰性电极材料)
⑴电解NaCl溶液(放氢生碱型):溶质、溶剂均发生电解反应,pH增大。(活泼金属的无
氧酸盐)
2NaCl+2H
2OH
2
↑+Cl
2
↑+2NaOH
⑵电解CuSO
4
溶液(放氧生酸型):溶质、溶剂均发生电解反应,pH减小。(不活泼金属的含氧酸盐)
2CuSO
4+2H
2
O2Cu+O
2
↑+2H
2
SO
4
⑶电解CuCl
2
溶液(电解电解质本身):溶剂不变,实际上是电解溶质,pH增大。(不活泼金属的无氧酸盐)
CuCl
2Cu+Cl
2
↑
电解盐酸(电解电解质本身):(无氧酸)
2HClH
2↑+Cl
2
↑
⑷电解稀H
2SO
4
、NaOH溶液、Na
2
SO
4
溶液(电解水型):溶质不变,实际上是电解水,pH分别
减小、增大、不变。酸、碱、盐的加入增加了溶液导电性,从而加快电解速率(不是起催化作用)。(含氧酸、强碱和活泼金属的含氧酸盐)
阳极:4OH--4e-2H
2O+O
2
↑
阴极:4H++4e-2H
2
↑
电解方程式:2H
2O2H
2
↑+O
2
↑,
⑸若阳极材料为活性电极,如用铜电极电解Na
2SO
4
溶液:
Cu+2H
2OCu(OH)
2
+H
2
↑(注意:不是电解水。)
4.电镀(电解精炼铜)
(1)定义:利用电解原理在某些金属表面镀上已薄层其他金属或合金的方法。其
实质是一种特殊情况下的电解。
(2)构成:阴极:待镀金属制品阳极:镀层金属(粗铜)电镀液:含镀层金属离
子的电解质溶液
如:在铁制品表面电镀铜:
阳极(铜):Cu-2e-==Cu2+
阴极(铁制品):Cu2++2e-==Cu
电解精炼铜的结果:阳极上粗铜逐渐溶解,杂质Ag、Pt等沉积在电解槽的底部,形成阳极泥(阳极),阴极上纯铜逐渐析出。理论上电解质溶液浓度在
电镀过程中保持不变(只需更换阴极电极)。
5.金属的腐蚀?
(1)概念:金属或合金与周围的物质发生反应而引起损耗的现象。
(2)实质:属原子电子变成阳离子的过程.即金属发生了反应。
(3)类型:根据与金属不同,可分为化学腐蚀(金属跟接触到的干燥气体如(O2、Cl2、SO2等)
或非电解质液体(如石油)等直接发生而引起的腐蚀)和电化学腐蚀(不纯的金属跟电解质溶液接触时,会发生电化学反应,比较活泼的金属失去电子而被氧化)
(4)电化学腐蚀的两种类型
6.金属的防护?
(1)电化学保护?
①牺牲阳极的阴极保护法
被保护的金属上连接一种更的金属,被保护的金属作原电池的正极。
②外加电流的阴极保护法
被保护的金属与电源的极相连,作电解池的阴极。
(2)其他防护
①改变金属内部组织结构,如制成不锈钢等。
②金属表面加保护层,如在金属表面喷油漆、涂油脂、电镀或表面钝化等方法。
小学数学基础知识整理 一、小学数学基础知识整理(一到六年级) 小学一年级九九乘法口诀表。学会基础加减乘。 小学二年级完善乘法口诀表,学会除混合运算,基础几何图形。 小学三年级学会乘法交换律,几何面积周长等,时间量及单位。路程计算,分配律,分数小数。 小学四年级线角自然数整数,素因数梯形对称,分数小数计算。 小学五年级分数小数乘除法,代数方程及平均,比较大小变换,图形面积体积。 小学六年级比例百分比概率,圆扇圆柱及圆锥。 二、必背定义、定理公式 三角形的面积=底×高÷2。公式S= a×h÷2 正方形的面积=边长×边长公式S= a×a 长方形的面积=长×宽公式S= a×b 平行四边形的面积=底×高公式S= a×h 梯形的面积=(上底+下底)×高÷2 公式S=(a+b)h÷2 内角和:三角形的内角和=180度。 长方体的体积=长×宽×高公式:V=abh 长方体(或正方体)的体积=底面积×高公式:V=abh 正方体的体积=棱长×棱长×棱长公式:V=aaa 圆的周长=直径×π公式:L=πd=2πr 圆的面积=半径×半径×π公式:S=πr2
圆柱的表(侧)面积:圆柱的表(侧)面积等于底面的周长乘高。公式:S=ch=πdh=2πrh 圆柱的表面积:圆柱的表面积等于底面的周长乘高再加上两头的圆的面积。公式:S=ch+2s=ch+2πr2 圆柱的体积:圆柱的体积等于底面积乘高。公式:V=Sh 圆锥的体积=1/3底面×积高。公式:V=1/3Sh 分数的加、减法则:同分母的分数相加减,只把分子相加减,分母不变。异分母的分数相加减,先通分,然后再加减。 分数的乘法则:用分子的积做分子,用分母的积做分母。 分数的除法则:除以一个数等于乘以这个数的倒数。 三、读懂理解会应用以下定义定理性质公式 (一)、算术方面 1、加法交换律:两数相加交换加数的位置,和不变。 2、加法结合律:三个数相加,先把前两个数相加,或先把后两个数相加,再同第三个数相加,和不变。 3、乘法交换律:两数相乘,交换因数的位置,积不变。 4、乘法结合律:三个数相乘,先把前两个数相乘,或先把后两个数相乘,再和第三个数相乘,它们的积不变。 5、乘法分配律:两个数的和同一个数相乘,可以把两个加数分别同这个数相乘,再把两个积相加,结果不变。如:(2+4)×5=2×5+4×5 6、除法的性质:在除法里,被除数和除数同时扩大(或缩小)相同的倍数,商不变。O除以任何不是O的数都得O。
高中化学知识点原电池 和电解池 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】
原电池和电解池1.原电池和电解池的比较: 一原电池; 原电池的形成条件
原电池的工作原理属于放热的氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。 原电池的构成条件有三个: (1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。 (2)两电极必须浸泡在电解质溶液中。 (3)两电极之间有导线连接,形成闭合回路。 只要具备以上三个条件就可构成原电池。而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。 形成前提:总反应为自发的氧化还原反应 电极的构成: a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极; b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极; c.金属与化合物—
外研版高中英语选修六1-6单元知识点归纳 Module 1 【词条1】lack 【点拨】lack动词, 意为"缺乏,没有"。如: He is good at his job but he seems to lack confidence. What he lacks in experience he makes up for in enthusiasm. 【拓展】 1. lack的常用短语有:be lacking"欠缺,缺乏";be lacking in"缺乏(某种品质、特点等)";lack (for) nothing"应有尽有"。如: Money for the project is still lacking. I think the film is lacking in pace. They have got everything ready and they lack for nothing. 2. lack还可作名词,常与of连用,意为"缺乏,没有"。for lack of "因为缺乏……"。如: The work had to be stopped for lack of funds. The flowers withered for lack of water. 【词条2】reply 【点拨】名词,意为"回答,答复",常与介词to 连用。如: Is it a reply to the first or the second letter? To my anger, she made no reply to my question. 其常用在短语in reply to中,意为"作为对……的回答,回复"。如: What did he do in reply to your challenge? 【拓展】reply也可作动词,意为"回答,答复",reply (to ... / that ...) 。如: The teacher gave me no chance to reply to her question. Lily replied that she knew nothing about it. 【词条3】apology 【点拨】apology名词,意为"道歉,歉意",常用于短语:offer / make an apology to sb."向某人道歉", accept an apology"接受道歉"。如: It’s impolite of you to leave without a word of apology. In my judgment, we should accept their apology. You’d better make an apology for your absence. 【拓展】其动词形式为apologize,意为"道歉,表示歉意",常用短语为: apologize to sb.(for sth.)"(因某事)向某人道歉"。如: I must apologize for not being able to meet you that day. I think Tom might have apologized to Jane for what he did. 经典短语透视 【短语1】think of 【点拨】think of可意为"想起,想出"。如: The photo made me think of my child-hood. It was Tom who thought of the good plan.
第二单元分数乘法 1.分数乘整数的意义和整数乘法的意义相同,就是求几个相同加数的和的简便运算。 2.分数乘整数的计算法则:分数乘整数,用分数的分子和整数相乘的积作分子,分母不变。 (为了计算简便,能约分的要先约分,然后再乘。) 注意:当带分数进行乘法计算时,要先把带分数化成假分数再进行计算。 3.一个数与分数相乘,可以看作是求这个数的几分之几是多少。 4.分数乘分数的计算法则:分数乘分数,用分子相乘的积作分子,分母相乘的积作分母。 (为了计算简便,可以先约分再乘。) 注意:当带分数进行乘法计算时,要先把带分数化成假分数再进行计算。 5.整数乘法的交换律、结合律和分配律,对分数乘法同样适用。 乘法交换律: a × b = b × a 乘法结合律: ( a × b )×c = a × ( b × c ) 乘法分配律:( a + b )×c = a c + b c a c + b c = ( a + b )×c 6.乘积是1的两个数互为倒数。 7.求一个数(0除外)的倒数,只要把这个数的分子、分母调换位置。 1的倒数是1。0没有倒数。 真分数的倒数大于1;假分数的倒数小于或等于1;带分数的倒数小于1。 注意:倒数必须是成对的两个数,单独的一个数不能称做倒数。 8.一个数(0除外)乘以一个真分数,所得的积小于它本身。 9.一个数(0除外)乘以一个假分数,所得的积等于或大于它本身。 10.一个数(0除外)乘以一个带分数,所得的积大于它本身。
11.分数应用题一般解题步骤。 (1)找出含有分率的关键句。 (2)找出单位“1”的量(以后称为“标准量”)找单位“1”:在分率句中分率的前面;或“是”、“占”、“比”、“相当于”的后面 (3)画出线段图,标准量与比较量是整体与部分的关系画一条线段即可,标准量与比较量不是整体与部分的关系画两条线段即可。 (4)根据线段图写出等量关系式:标准量×对应分率=比较量。求一个数的几倍:一个数×几倍;求一个数的几分之几是多少:一个数×几 。 几 写数量关系式技巧: (1)“的”相当于“×”“占”、“是”、“比”相当于“ = ”(2)分率前是“的”:单位“1”的量×分率=分率对应量 (3)分率前是“多或少”的意思:单位“1”的量×(1 分率)=分率对应量(5)根据已知条件和问题列式解答。 12.乘法应用题有关注意概念。 (1)乘法应用题的解题思路:已知一个数,求这个数的几分之几是多少? 单位“1”×对应分率=对应量 (2)找单位“1”的方法:从含有分数的关键句中找,注意“的”前“是、比、相当于、占、等于”后的规则。 (3)甲比乙多几分之几表示甲比乙多的数占乙的几分之几,乙比甲少几分之几表示乙比甲少的数占甲的几分之几。 (甲-乙)÷乙 = 甲÷乙-1(甲-乙)÷甲 = 1-乙÷甲
选修六知识点归纳总结 ▲环境问题的表现:资源短缺,环境污染,生态破坏,全球环境变化 ▲环境问题产生的原因:(1)自然原因自然原因引起的环境问题,主要指火山爆发,地震,山崩,泥石流,台风,海啸,寒潮,水旱等自然界固有的自然灾害 (2)人为原因 1.资源的有限性与人类需求的无限性的矛盾(根本性的原因)2.短期经济利益与长远环境效益的矛盾3.局部利益与整体利益的矛盾4.个人行为和大众利益的矛盾 解决当代环境问题的关键是在尽可能短的时期内,控制世界人口的增长,使世界人口稳定在适度的规模 当代环境问题的特点: 1、危害的不可预见性 2、过程的不可逆性 3、规模的全球性 两种不同的环境观: 传统的环境观:人地关系:人地对立,基本观点:征服自然。后果:资源枯竭和环境破坏 新的环境观:天人合一,人地归一,保持平衡与协调。良性方向发展 可持续发展的概念和内涵 (1)概念可持续发展就是既满足当代人的需求,又不对后代人满足其自身需求能力构成危害的发展。它是一个涉及经济、社会、文化技术和自然环境的综合概念。 (2)基本思想①鼓励经济增长;②要保证资源的可持续利用和良好的生态环境;③谋求社会的全面进步。 (3)中国的可持续发展——《中国21世纪议程》 ▲水体富营养化:水体富营养化发生在淡水水体,称为“水华”;发生在海洋,称为“赤潮” 1、形成条件:较为封闭的海湾、湖泊等水体中,由于水体的流动性差,自净能力弱 河道中不的净化作用见课本 2、污染物:氮磷等植物营养元素 3、污染源:工业废水、生活污水、农业废水 4、危害——①水生植物和鱼类死亡②水质变坏③湖泊变沼泽 5、湖泊沼泽化本身是一种自然现象,进程缓慢。人类活动(水体富营养化与围湖造田)加快了这一进程 海洋石油污染 1、污染源:近海石油的开采、加工和运输,海上油轮泄漏 2、污染物:石油 3、危害: 直接危害:油污染能直接导致海鸟、海兽的毛、皮丧失防水和保温性能,或因堵塞呼吸和感觉器官而大量死亡。油膜和油块能粘住大量的鱼卵和幼鱼,并阻碍海藻的光合作用,底栖动物则还要受沉降到海底的石油的影响。 间接危害:石油在氧化分解过程中,因大量消耗水中的溶解氧,也会间接地对生物造成危害 4、常发区域:世界的主要港湾、主要航线附近、海上油井周围 5、怎样清除石油 ①分散:喷洒强效洗涤剂,不宜在近岸或渔场使用 ②沉降:撒粉状石灰,危害海底生物 ③吸收:利用麦秆等吸收石油,静水环境 ④围栏:小面积油污,静水环境 ⑤放任:任其自然分解 ⑥燃烧:油层达2mm,造成大气污染▲水污染的危害:①危害人体健康②降低农作物的产量和质量③影响渔业生产的产量和质量④制约工业的发展⑤加速生态环境的退化和破坏⑥造成经济损失 水污染的防治措施 (1)工业水污染防治对策 1.宏观性控制对策:优化产业结构与工业结构 2.技术性控制对策。如积极推行清洁生产,提高工业用水重复利用率,实行污染物排放总量控制 制度,促进工业废水与城市生活污水的集中 3.管理性控制对策,如完善法律法规,加大执法力度,健全环境监测网络 (2)城市水污染防治对策 1. 将水污染防治纳入城市的总体规划 2.城市废水的防治的防治应遵循集中与分散相结合的原则 3.在缺水地区应积极将城市水污染的防治与城市废水资源化相结合 4.加强城市地表和地下水源的保护 5.大力开发低耗高效废水处理与回用技术 (三)农村水污染防治对策 1.发展节水型农业 2.合理利用化肥和农药 3.加强对畜禽排泄物,乡镇企业废水及村镇生活污水的有效处理 固体废弃物(通常称为垃圾)是指在生产建设、日常生活和其他活动中产生的污染环境的固态、半固态废弃物质 城市垃圾的特点 1、数量大 2、品种多 3、变化大 当代垃圾产生的环境问题 1、自然环境对固体废弃物具有一定的自净能力,例如沙土掩埋、微生物分解等,使垃圾回归土壤 2、传统方式:用垃圾和粪便堆肥,使有机质回归土壤,不会造成环境污染 注意:上述两种方式,不能处理所有的固体废弃物。 3、固体废弃物的危害: ①污染大气②污染水体③污染土壤④占用耕地⑤影响环境卫生⑥危害人体健康 固体废弃物污染防治与综合利用 (一)固体废物减量化 1.对城市固体废物:逐步改变燃料结构,净菜进城、减少垃圾生产量,加强产品的生态设计,推行垃圾分类收集,搞好产品的回收、利用的再循环 2、对工业固体废物:淘汰落后生产工艺,推广清洁生产工艺,发展物质循环利用工艺 (二)固体废物资源化与综合利用 1.物质回收利用,如从废弃物中回收提取有用成分,如纸,重金属等 2.物质转换利用,如废渣生产建筑材料、水泥,进行堆肥,产生农肥,取代某种工业原料等 3.能量转换利用,如能有机废物的焚烧处理回收热量、发电,利用垃圾厌氧消化产生沼气 (三)固体废物的无害化处理处置 影响大气污染扩散和自净的因素: ⑴污染物排放量大小:若排放量小,则易扩散 ⑵气象条件:风速、风向、气温、湿度、云况、辐射等 凡是有利于增大风速、增强湍流的气象条件,都有利于污染物的扩散; 出现逆温天气,大气层异常稳定时,不利于大气污染物的扩散 ⑶地形:盆地、河谷地形,不利于污染物扩散
原电池总复习知识点总结 一、定义: 将化学能直接转变成电能的装置。 二、构成原电池的条件: ①电解质溶液 ②两个导体做电极 ③形成闭合回路(或在溶液中接触) ④有能自发进行的氧化还原反应 三、原理 四、原电池电极的判断 (1)由组成原电池的两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。(2)根据外电路电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。 (3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。 (4)根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应。因此可以根据总化学方程式中化合价的升降来判断。 (5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。(但铅蓄电池放电时正负极质量都增大)
(6)根据电极上产生的气体判断:原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。 (7)根据某电极附近pH的变化判断 析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。 五、电极反应式的书写 (1)准确判断原电池的正负极是书写电极反应的关键 如果原电池的正负极判断失误,电极反应式的书写一定错误。上述判断正负极的方法是一般方法,但不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:负极:Cu -2e-=Cu2+正极:NO3-+ 4H++ 2e-=2H2O + 2NO2↑ 再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为: 负极:2Al + 8OH--2×3e-=2AlO2-+ 2H2O正极:6H2O + 6e-=6OH-+ 3H2↑(2)要注意电解质溶液的酸碱性。在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH-,在碱溶液中,电极反应式中不能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以CO32-离子形式存在,而不是放出CO2气体。 (3)要考虑电子的转移数目 在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。防止由总反应方程式改写成电极反应式时所带来的失误,同时也可避免在有关计算中产生误差。 (4)要利用总的反应方程式 从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。
小学六年级数学知识点归纳总结 六年级上册 知识点概念总结 1.分数乘法:分数乘法的意义与整数乘法的意义相同,就是求几个相同加数和的简便运算。 2.分数乘法的计算法则: 分数乘整数,用分数的分子和整数相乘的积作分子,分母不变;分数乘分数,用分子相乘的积作分子,分母相乘的积作分母。但分子分母不能为零.。 3.分数乘法意义 分数乘整数的意义与整数乘法的意义相同,就是求几个相同加数的和的简便运算。一个数与分数相乘,可以看作是求这个数的几分之几是多少。 4.分数乘整数:数形结合、转化化归 5.倒数:乘积是1的两个数叫做互为倒数。 6.分数的倒数 找一个分数的倒数,例如3/4把3/4这个分数的分子和分母交换位置,把原来的分子做分母,原来的分母做分子。则是4/3。3/4是4/3的倒数,也可以说4/3是3/4的倒数。 7.整数的倒数 找一个整数的倒数,例如12,把12化成分数,即12/1,再把12/1这个分数的分子和分母交换位置,把原来的分子做分母,原来的分母做分子。则是1/12,12是1/12的倒数。 8.小数的倒数: 普通算法:找一个小数的倒数,例如0.25,把0.25化成分数,即1/4,再把1/4这个分数的分子和分母交换位置,把原来的分子做分母,原来的分母做分子。则是4/1 9.用1计算法:也可以用1去除以这个数,例如0.25,1/0.25等于4,所以0.25的倒数4,因为乘积是1的两个数互为倒数。分数、整数也都使用这种规律。
10.分数除法:分数除法是分数乘法的逆运算。 11.分数除法计算法则:甲数除以乙数(0除外),等于甲数乘乙数的倒数。 12.分数除法的意义:与整数除法的意义相同,都是已知两个因数的积与其中一个因数求另一个因数。 13.分数除法应用题:先找单位1。单位1已知,求部分量或对应分率用乘法,求单位1用除法。 14.比和比例: 比和比例一直是学数学容易弄混的几大问题之一,其实它们之间的问题完全可以用一句话概括:比,等同于算式中等号左边的式子,是式子的一种(如:a:b);比例,由至少两个称为比的式子由等号连接而成,且这两个比的比值是相同(如:a:b=c:d)。 所以,比和比例的联系就可以说成是:比是比例的一部分;而比例是由至少两个比值相等的比组合而成的。表示两个比相等的式子叫做比例,是比的意义。比例有4项,前项后项各2个. 15.比的基本性质:比的前项和后项都乘以或除以一个不为零的数。比值不变。 比的性质用于化简比。 比表示两个数相除;只有两个项:比的前项和后项。 比例是一个等式,表示两个比相等;有四个项:两个外项和两个内项。 16.比例的性质:在比例里,两个外项的乘积等于两个内项的乘积。比例的性质用于解比例。
最新高中化学原电池和电解池知识点总结最新高中化学原电池和电解池知识点总结 一原电池; 原电池的形成条件 原电池的工作原理原电池反应属于放热的氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。 原电池的构成条件有三个:
(1)电极材料由两种金属活动性不同的金属或由金属与导电的材料(非金属或某些氧化物等)组成。 (2)两电极必须浸泡在电解质溶液中。 (3)两电极之间有导线连接,形成闭合回路。 只要具备以上三个条件就可构成原电池。而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。形成前提:总反应为自发的氧化还原反应 电极的构成: a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极; b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极; c.金属与化合物—铅蓄电池,铅板作负极,二氧化铅作正极; d.惰性电极—氢氧燃料电池,电极均为铂。电解液的选择:电解液一般要能与负极材料发生自发的氧化还原反应。原电池正负极判断: 负极发生氧化反应,失去电子;正极发生还原反应,得到电子。
选修六知识点 -----高二英语备课组 Unit 1 Art 1.achieve one’s aim 实现某人的目标without one’s aim 漫无目标的 with the aim of 意在…,以…为目标aim at doing sth /aim to do sth 意欲,力求做某事 be aimed at (doing) sth.目的在于…,旨在… 2.be typical of……是特有的,是典型的… E.g. It’s typical of him to forget. 3.be possessed of sth. 具有(某种品质或特征)be possessed with/by 被…控制 take the possession of sth 占有某物,拿到某物 in possession of /in the possession of 归…所有(用法与in charge of & in the charge of相同) 4.a great deal 大量(a great deal of 修饰不可数名词) 5.make an attempt to do/at doing sth 尝试做…at one’s first attempt 第一次尝试 in an attempt to do sth 试图做某事attempt to do/ at doing sth 尝试做某事 6. on the one hand…on the other hand (般指两个相反或相对的方面)一方面…另一方面 for one thing ..for another thing…常陈述情况一致的两个方面,用于解释原因,表列举 7.be worth doing = be worthy of being done = be worthy to be done 值得做… be well worth doing sth.(主动表被动)It’s worthwhile to do/doing sth. 值得做… 8.have/lose faith in 对某人信任/失去对某人的信任 9.keep one’s figure 保持身材have a good figure 身材苗条figure out 算出,解决,理解 10. would rather do ..than…= would do …rather than… I would rather go on foot than take a bus.= I would go on foot rather than take a bus. 11. in preference to 优先于have a preference for 更喜欢… 12.appeal to (对某人)有吸引力;(使某人)感兴趣appeal for 恳求/呼吁… 13 win/earn reputation 赢得名声have a reputation for 以…而闻名. establish reputation 建立名誉 a good /bad reputation 好/坏名声 live up to one’s reputation 名不虚传…不负盛名… 14.动词不定式作后置定语: 1.用在序数词、形容词最高级后. E.g. He is the first to come here. 2.用在被序数词、形容词最高级、next、last、only等修饰的名词后. Eg. The best way to solve the problem is to make a plan. 15.more than + 数词表示“多于,超过”I have taught English more than 15 years. more than + 名词表示“不仅仅”The museum displays more than the visual delights of art. more than + 动词/形容词/副词表示“非常”I’m more than pleased to help you . more than + 句子表示“超过…的能力范围”The beauty is more than I can describe. 16. 句型what is known to us all is that…= it is known to us all that …= As is known to us all, … 17. 短语:It was evident that…很显然…It is predicted that …据预测…concentrate..on 集中,全神贯注于in perspective 用透视画法by coincidence 巧合地break away from 挣脱,脱离scores of 许多.in the flesh 活着的,亲自,本人 every two years= every second year = every other year 每2年be allergic to 对…过敏 be well worth a visit 很值得参观to be specific 具体地说be specific to 特有的;独特的attitude to/towards 对…的态度convince sb of sth /that…使某人相信… Unit 2 Poems 1.convey sth to sb 向某人表达/传递某物convey sb/sth from A to B把…从A地运送到B地2.take one’s time 不急,慢慢来take sth seriously 认真对待某事 take sth for granted 认为…理所应当 3.run out of 用完了…表示主动意义,run out …用完了,主语通常为时间、食物、金钱等We are running out of the money. = The money is running out. (钱快要用完了) 4.be made up of=be composed of =consist of由……组成
三.电解池 1、定义:借助外加电流引起的氧化还原反应,把电能转化为化学能的装置。 装置原电池电解池 实例 原理 形成条件①电极:两种不同的导体相连; ②电解质溶液:能与电极反应。 ①电源; ②电极(惰性或活性电极); ③电解质(水溶液或熔化态)。 反应类型自发的氧化还原反应非自发的氧化还原反应 电极名称由电极本身性质决定: 正极:材料性质较不活泼的电极; 负极:材料性质较活泼的电极。 由外电源决定: 阳极:连电源的正极; 阴极:连电源的负极; 电极反应负极:Zn-2e-=Zn2+(氧化反应) 正极:2H++2e-=H2↑(还原反应) 阴极:Cu2+ +2e- = Cu (还原反应) 阳极:2Cl--2e-=Cl2↑ (氧化反应) 应用①抗金属的电化腐蚀; ②实用电池。 ①电解食盐水(氯碱工业);②电镀(镀 铜);③电冶(冶炼Na、Mg、Al);④精 炼(精铜)。 ⑴阴极A.阴极材料(金属或石墨)总是受到保护。 B.阳离子得电子顺序—金属活动顺序表的反表:K+ ①分析电解质溶液中存在的离子; ②看阳极电极材料,确定阳极参加反应的物质。若阳极材料为活性电极,则电极材料本身放电。若阳极材料为惰性电极,则阳极是溶液中的阴离子按照放电顺序进行放电③确定电极、写出电极反应式; ④写出电解方程式。 如:(阳极材料为惰性电极材料) ⑴电解NaCl溶液(放氢生碱型): 2NaCl+2H2O 电解 ====H2↑+Cl2↑+2NaOH,溶质、溶剂均发生电解反应,PH增大。 ⑵电解CuSO4溶液(放氧生酸型): 2CuSO4 + 2H2O 电解 ====2Cu + O2↑+ 2H2SO4溶质、溶剂均发生电解反应, PH减小。 ⑶电解CuCl2溶液(电解电解质本身): CuCl2电解 ==== Cu+Cl2↑ 电解盐酸: 2HCl 电解 ==== H2↑+Cl2↑溶剂不变,实际上是电解溶质,PH增大。 ⑷电解稀H2SO4、NaOH溶液、Na2SO4溶液(电解水型): 2H2O 电解 ==== 2H2↑ + O2↑,溶质不变,实际上是电解水,PH分别减小、增大、不变。酸、碱、盐的加入增加了溶液导电性,从而加快电解速率(不是起催化作用)。 ⑸电解熔融NaOH: 4NaOH 电解 ====4Na + O2↑ + H2O↑若阳极材料为活性电极如 用铜电极电解Na2SO4溶液: Cu +2H2O 电解 ==== Cu(OH)2 + H2↑ (注意:不是电解水。) 5、电镀(电解精炼铜) 1、定义:利用电解原理在某些金属表面镀上已薄层其他金属或合金的方法。其实质是一种特殊情况下的电解。 2、构成: 阴极:待镀金属制品阳极:镀层金属电镀液:含镀层金属离子的电解质溶液 如:在铁制品表面电镀铜: 阳极:Cu — 2e—== Cu2+ 阴极:Cu2+ + 2e—== Cu 太全啦! | 小学1-6年级数学知识点总结! 一、概念 (一)整数 1、整数的意义 自然数和0都是整数。 2、自然数 我们在数物体的时候,用来表示物体个数的1,2,3……叫做自然数。 一个物体也没有,用0表示。0也是自然数。 3、计数单位 一(个)、十、百、千、万、十万、百万、千万、亿……都是计数单位。 每相邻两个计数单位之间的进率都是10。这样的计数法叫做十进制计数法。 4、数位 计数单位按照一定的顺序排列起来,它们所占的位置叫做数位。 5、数的整除 整数a除以整数b(b ≠ 0),除得的商是整数而没有余数,我们就说a能被b整除,或者说b能整除a 。 如果数a能被数b(b ≠ 0)整除,a就叫做b的倍数,b就叫做a的约数(或a的因数)。倍数和约数是相互依存的。 因为35能被7整除,所以35是7的倍数,7是35的约数。 一个数的约数的个数是有限的,其中最小的约数是1,最大的约数是它本身。例如:10的约数有1、2、5、10,其中最小的约数是1,最大的约数是10。 一个数的倍数的个数是无限的,其中最小的倍数是它本身。3的倍数有:3、6、9、12……其中最小的倍数是3 ,没有最大的倍数。 个位上是0、2、4、6、8的数,都能被2整除,例如:202、480、304,都能被2整除。 个位上是0或5的数,都能被5整除,例如:5、30、405都能被5整除。。 一个数的各位上的数的和能被3整除,这个数就能被3整除,例如:12、108、204都能被3整除。 一个数各位数上的和能被9整除,这个数就能被9整除。 能被3整除的数不一定能被9整除,但是能被9整除的数一定能被3整除。 一个数的末两位数能被4(或25)整除,这个数就能被4(或25)整除。例如:16、404、1256都能被4整除,50、325、500、1675都能被25整除。 (2)保护森林(措施):①坚持以营林为主,合理采伐;②促进珍贵树种的更新;③提高木材的综合利用率(对木材进行深加工,提高附加值);④加强自然保护区的建设,保护生态环境,开展生态旅游;⑤健全森林保护的法律法规;⑥加强环境教育,提高公民保护意识;⑦加强森林的管理和保护2.草地退化及其防治: (1)我国草地退化原因:A.过度农垦B.过度放牧C.过度樵采,滥挖药材D.鼠害和虫害(主 要是蝗虫)严重E.气候异常等 (2)我国草地保护:实行禁牧、轮牧制度;改变逐水草而居的游牧方式为牲畜舍饲、半舍饲方式;加 强牧场的基本建设;建立饲草料基地;建设“草库伦”等。 3.湿地干涸及其恢复 (1)湿地日益减少:①土壤侵蚀、泥沙淤积;②环境污染造成富营养化;③围湖、围海造田; ④大量引水灌溉和河流的截留改向,使水量减少。 (2)湿地环境效益:天然的蓄水库,能够调节气候、涵养水源、调节径流、蓄洪防旱、降解污染物、 保护生物多样性 保护措施:①建立湿地自然保护区;②发展生态旅游;③加强宣传,提高公民的湿地保护意识; ④加强立法和管理,防治湿地污染;⑤退耕还湿(生态退耕)。 ▲2.水污染的防治措施 减少化肥和农药的使用量;建设污水处理厂,工业废水、生活污水经处理后排放;防治石油泄漏。(2016.03洛阳二练)“水华”是水体富营养化的一种特征,水温、光照强度等都会对藻类的水华生物生长繁殖产生影响。 据新华社合肥8 月10 日电,安徽省巢湖市饮 用水源地周边连日来出现明显蓝藻集聚。安徽省环 保厅已两次发出蓝藻水华红色预警,这引发了公众对 于饮用水安全的担忧。 分析7、8 月份巢湖“水华”现象严重的原因。 参考答案:受伏旱影响,7、8 月份高温少雨,盛夏用 水量增加,导致湖水补给量减少(4 分);流人该湖 的污染水体所占比重大,水体富养化加重(3 分); 7、8 月份气温高、光照强,水华生物生长繁殖速度快 (3 分)。 考点四固体废弃物污染及其危害 1.城市垃圾的特点:数量大、品种多、变化大。 2.固体废弃物污染的危害 (1)污染途径 (2)危害 原电池与电解池比较: 二、电池符号图为 Cu - Zn 电池。左池:锌片插在 1mol·dm-3 的ZnSO 4溶液中。右池:铜片插在 1 mol·dm-3的CuSO 4 溶液中。两池 之间倒置的 U 形管叫做盐桥(盐桥是由饱和KCl溶液和琼脂装入U形管中制成)。检流计表明电子从锌片流向铜片。左侧为负极,右侧为正极。 此Cu - Zn 电池可表示如下:(-)Zn | Zn2+(1mol·dm-3)‖Cu2+(1mol·dm-3) | Cu(+)负极: Zn-2e-== Zn2+正极: Cu2++2e-== Cu总反应: Zn+Cu2+== Zn2++ Cu ☆写电池符号应注意事项:?正、负极:(-) 左, (+) 右?界面“|”: 单质与“极棒”写在一起,写在“|”外面。?注明离子浓度(c),气态时用分压(p),物质状态:固态(s), 液态(l) 等?盐桥: “||” 三、金属腐蚀与防护:1.金属腐蚀:金属(或合金)跟周围接触到的气体(或液体)反应而腐蚀损耗的过程。⑴本质:金属原子失电子而被氧化M –ne- ====M n+(2) 分类:①化学腐蚀:金属与其他物质直接氧化反应金属被氧化(不是电解质溶液)(无电流产生)②电化腐蚀:不纯金属或合金发生原电池反应活泼金属被氧化电解质溶液(有电流产生)⑶钢铁腐蚀: 2.金属腐蚀的防护⑴金属腐蚀的原因:金属本身的组成和结构是锈蚀的根据;外界条件(如:温度、湿度、与金属接触的物质)是促使金属锈蚀的客观因素。 ⑵防护:①改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。②在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)③电化学保护法:牺牲阳极阴极保护法、外加电流阴极保护法。 四、电解及其应用 1.电解的原理:使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程叫做电解。电解质在溶解或熔化状态下电离出自由离子,通电时,自由移动的离子定向移动,阳离子移向阴极,在阴极获得电子发生还原反应;阴离子移向阳极,在阳极失去电子发生氧化反应。电解质导电过程就是电解过程。 2.电解反应离子放电顺序(不考虑浓度等其他因素)放电:阳离子得电子而阴离 子失电的过程。上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。⑵阴离子放电顺序 (注明:若阳极材料是金属(除Pt、Au外),电极首先发生氧化反应而进入溶液。)3.电镀:利用电解原理在某些金属表面镀上一层金属或合金的过程,金属叫镀件,薄层镀层。阴极:镀件→待镀金属阳极: 高中地理选修六知识点总结 一、环境与环境问题 环境问题的表现:资源短缺,环境污染,生态破坏,全球环境变化 可持续发展概念:可持续发展就是既满足当代人的需求,又不对后代人满足其自身需求能力构成危害的发展。 可持续发展基本思想:①经济可持续发展;②生态可持续发展;③社会可持续发展。 二、环境污染与防治 地理环境的自净能力的概念:指环境对外来物质具有一定的消纳、同化能力。环境污染的原因:在一定的时间、空间范围内,环境的自净能力是有限的,污染物排放超过其环境其自净能力,就会产生环境污染。自净机理:物理净化,化学净化,生物净化。 水体富营养化:水体富营养化发生在淡水水体,称为“水华”;发生在海洋,称为“赤潮” 形成条件:较为封闭的海湾、湖泊等水体中,由于水体的流动性差,自净能力弱。 污染物:氮磷等植物营养元素。 污染源:工业废水、生活污水、农业废水。 危害——①水生植物和鱼类死亡,②水质变坏,③湖泊变沼泽。 湖泊沼泽化是一种自然现象,进程缓慢。人类活动(水体富营养化与围湖造田)加快了这一进程。海洋石油污染:近海石油的开采、加工和运输,海上油轮泄漏污染物。 危害:油污染能直接导致海鸟、海兽的毛、皮丧失防水和保温性能,或因堵塞呼吸和感觉器官而大量死亡。油膜和油块能粘住大量的鱼卵和幼鱼,并阻碍海藻的光合作用,底栖动物则还要受沉降到海底的石油的影响。 怎样清除石油? ①分散:喷洒强效洗涤剂,不宜在近岸或渔场使用;②沉降:撒粉状石灰,危害海底生物;③吸收:利用麦秆等吸收石油,静水环境;④围栏:小面积油污,静水环境;⑤放任:任其自然分解;⑥燃烧:油层达2mm,造成大气污染。 水污染的危害:①危害人体健康;②降低农作物的产量和质量;③影响渔业生产的产量和质量;④制约工业的发展;⑤加速生态环境的退化和破坏;⑥造成经济损失 水污染的防治措施:①优化产业结构,积极推行清洁生产,提高工业用水重复利用率。②加强生活污水的防治和地表水、地下水源的保护。③发展节水型农业,合理利用化肥和农药,减少农业用水污染。④完善法律法规,加大执法力度,健全水环境监测网络。 当代垃圾产生的环境问题:①大气②污染水体③污染土壤④占用耕地⑤影响环境卫生⑥危害人体健康。 影响大气污染扩散和自净的因素:①污染物排放量大小:若排放量小,则易扩散。②气象条件:风速、风向、气温、湿度、云况、辐射等凡是有利于增大风速、增强湍流的气象条件,都有利于污染物的扩散;出现逆温天气,大气层异常稳定时,不利于大气污染物的扩散。③地形:盆地、河谷地形,不利于污染物扩散。 可吸入颗粒物——直径小于10微米: 可吸入颗粒物的利:刺激并锻炼人的免疫机能。 可吸入颗粒物的弊:①如果颗粒物含有毒有害成分时,出现免疫功能障碍,危害健康。②颗粒物中如果含有较多病菌和病毒时,可能引发传染病。③长期过量颗粒物,积聚在肺部,可能使人患“尘肺病”。④有些颗粒物沉积在肺部,还可能引起恶性病变。 为什么北方城市的大气污染物以可吸入颗粒物为主? ①北方降水少,天气干燥,多大风,有些地区荒漠化严重,导致自然降尘多; ②燃煤;③机动车尾气;④建筑工地扬尘。 怎样治理可吸入颗粒物污染? ①使用清洁能源,代替燃煤;②制定汽车尾气排放标准,达标排放;③扩大绿化面积,建筑工地控制扬尘;④加大对污染企业的治理力度,减少污染物排放,达标排放。 酸雨――PH值小于5.6的降水,PH值小于4.5的为重酸雨;形成酸雨的大气污染物主要有硫氧化物和氮氧化物;小学1-6年级数学知识点总结【完整版】
选修六《环境保护》知识点总结
高中化学原电池与电解池知识点总结
高中地理选修六知识点总结