
新大学化学第四章习题
一 判断题
1 √;
2 X ;
3 X ;
4 √;
5 X ;
6 X ;
7 X ; 8√; 9 X ; 10√; 11 X ; 12√;13√;14 X
二 选择题
15B; 16A; 17B; 18D; 19C; 20C; 21D; 22D; 23D; 24B; 25B; 26B; 27D; 28D; 29C; 30A; 31C; 32A; 33A; 34C; 35C
三 填空题
36 (1) 4s; (2) 3p; (3) 3d; (4) 3d 3=4>1>2
37 Cr; 3,2,1; 3,2,-1; 3,2,0; 3,2,2; 3,2,-2
38 Fe 2+
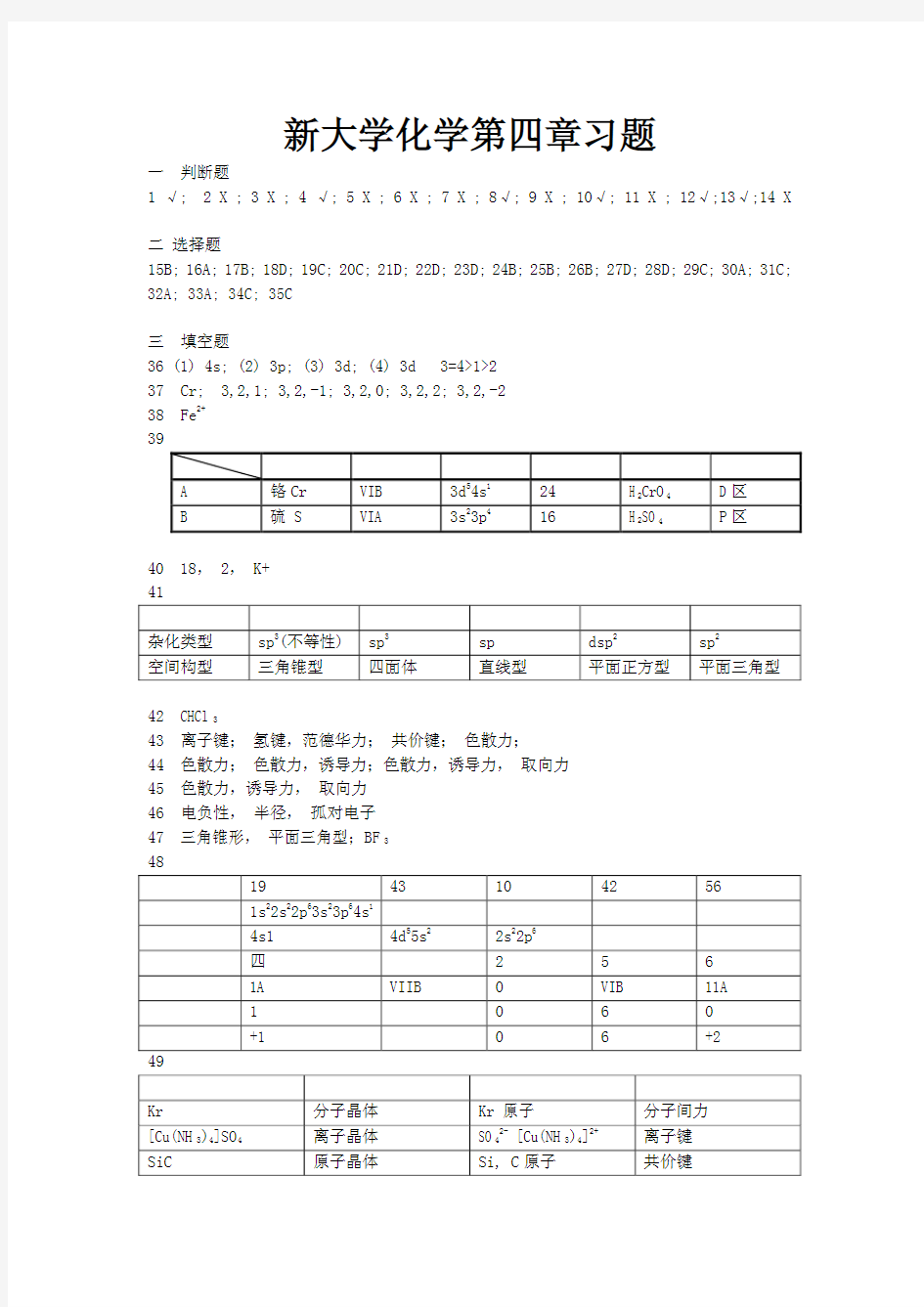
39
A 铬 Cr VI
B 3d 5 4s 1 24 H2CrO4 D 区
B 硫 S VIA 3s 2 3p 4 16 H2SO4 P 区
40 18, 2, K+ 41 杂化类型 sp 3 (不等性) sp 3 sp dsp 2 sp 2 空间构型 三角锥型 四面体 直线型 平面正方型 平面三角型 42 CHCl3 43 离子键; 氢键,范德华力; 共价键; 色散力; 44 色散力; 色散力,诱导力;色散力,诱导力, 取向力 45 色散力,诱导力, 取向力 46 电负性, 半径, 孤对电子 47 三角锥形, 平面三角型;BF3 48 19 43 10 42 56 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 4s1 4d 5 5s 2 2s 2 2p 6 四 2 5 6 1A VIIB 0 VIB 11A 1 0 6 0 +1 0 6 +2 49 Kr 分子晶体 Kr 原子 分子间力 [Cu(NH3)4]SO4 离子晶体 SO4 2- [Cu(NH3)4] 2+ 离子键 SiC 原子晶体 Si, C 原子 共价键 Zn 金属晶体 Zn 2+ , 自由电子 金属键 四 问答题 50 与最外层电子数有关。 51 Na 3s 1 , 很容易失去外层的1 个电子成为 2s 2 2p 6 的稳定结构 Mg 3s 2 很容易失去外层的 2个电子成为 2s 2 2p 6 的稳定结构 52 Fe 3+ 9~17 电子构型, O 2- , 8 电子构型; Ba 2+ 8电子构型; Cr 3+ 9~17 电子构型, Li + , 2 电子构型; Sn 4+ 18 +2 电子构型; Cd 2+ , 18 电子构型, Pb 2+ , 18+2 电子构型;Bi 3+ , 18+2 电子构型; Be 2+ , 2 电子构型。 53 (1) NaCl BeCl2? (2) MgO>BaO? (3) CaF2> CaBr2 54 HF>CO>Ne>H2 均为分子晶体, 分子间作用力与分子量或原子量有关,HF 中还有氢键。 55 原子间靠共用电子对结合起来的化学键叫共价键。 金属原子、金属正离子和自由电子之间产生的结合力为金属键。 56 (1) 钠的卤化物为离子晶体,而硅的卤化物为分子晶体,离子晶体的熔点比分子晶 体的高。 (2)离子键的大小与半径有关,半径越大;离子键越弱。分子间作用力的大小与分子 量有关,分子量越大,熔点越高。 立体化学 (一) 在氯丁烷和氯戊烷的所有异构体中,哪些有手性碳原子? 解:氯丁烷有四种构造异构体,其中2-氯丁烷中有手性碳: CH 3 C CH 3CH 3Cl CH 3 CH 2CH 3 Cl CH 3CH 2CH 2CH 2Cl *3 Cl CH 3CH 2 氯戊烷有八种构造异构体,其中2-氯戊烷(C 2*),2-甲基-1-氯丁烷(C 2*),2-甲基-3-氯丁烷(C 3*)有手性碳原子: CH 3 C CH 3CH 3 CH 2Cl CH 3(CH 2)4Cl CH 3CH 2CH 2CHCH 3 Cl CH 3CH 22CH 3 Cl CH 3CHCHCH 3 CH 3 CH 3CHCH 2CH 3 CH 2Cl CH 3CCH 2CH 3 CH 3Cl CH 3CHCH 2CH 2Cl CH 3 * * * (二) 各写出一个能满足下列条件的开链化合物: (1) 具有手性碳原子的炔烃C 6H 10; (2) 具有手性碳原子的羧酸C 5H 10O 2 (羧酸的通式是C n H 2n+1COOH)。 解: (1) CH 3CH 2CHC CH 3* (2) CH 3CH 2CHCOOH 3 * (三) 相对分子质量最低而有旋光性的烷烃是哪些?用Fischer 投影式表明它们的构型。 解: CH 2CH 3CH 2CH 2CH 3H CH 3 和 CH 2CH 3 CH 2CH 2CH 3H CH 3 CH 2CH 3CH(CH 3)2H CH 3 和 CH 2CH 3 CH(CH 3)2 H CH 3 (四) C 6H 12是一个具有旋光性的不饱和烃,加氢后生成相应的饱和烃。C 6H 12不饱和烃是什么?生成的饱和烃有无旋光性? 解:C 6H 12不饱和烃是CH 2CH 32H CH 3 或CH 2CH 3 2 H CH 3,生成的饱和烃无旋光性。 《大学化学(1)》模拟试题 参考答案与评分标准 注意事项: 1. 请考生按要求在试卷装订线内填写姓名、学号和年级专业。 2. 请仔细阅读各种题目的回答要求,在规定的位置填写答案。 3. 不要在试卷上乱写乱画,不要在装订线内填写无关的内容。 4. 满分100分,考试时间为120分钟。 一、选择题(本大题共10个小题,每个2分,共20分, 将1个或2个正确答案的代码填入括号内,选错或未选均 无分) 1. 已知:A + B → M + N (θ m r H ?)1 = 35 kJ·mol -1 2M + 2N → 2D (θm r H ?)2 = - 80 kJ·mol -1 则A + B → D 的 ( θ m r H ?)3 是( C )。 (A)-10 kJ·mol -1 (B)-45 kJ·mol -1 (C)-5 kJ·mol -1 (D)25 kJ·mol -1 2. 下列说法正确的是( C )。 (A) 热的物体比冷的物体含有更多的热量; (B) 同一种状态可能有多个热力学能值; (C) 热是一种传递中的能量; (D) 物体温度越高,则所含热量越高。 3.在平衡系统中 PCl 5(g) PCl 3(g) + Cl 2(g) ΔrH θ m >0 欲增大生成物Cl 2平衡时的浓度,需采取下列哪些措施( B D )。 (A)加大压力 (B)加大PCl 5浓度 (C)降低温度 (D)升高温度 4. 如果一个反应的吉布斯自由能变为零,则反应 ( D )。 (A) 能自发进行 (B) 是吸热反应 (C) 是放热反应 (D) 处于平衡状态 5.下列物质中含有氢键的是( B D )。 (A)HBr (B) HF (C) CCl 4 (D) H 2SO 4 6.在标准条件下,下列反应均为正方向进行: Cr 2O 72-+6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O 2Fe 3++Sn 2+=2Fe 2++Sn 4+ 它们中间最强的氧化剂和最强的还原剂是( B )。 (A) Sn 2+和Fe 3+ (B) Cr 2O 72-和Sn 2+ (C)Cr 3+和Sn 4+ (D) Cr 2O 72-和Fe 3+ 7.下列各物质只需克服色散力就能沸腾的是( B )。 (A)H 2O (B)Br 2(l ) (C)NH 3(l ) (D)C 2H 5OH 8.下列各离子变形性最强的是( B )。 (A)O 2- (B)S 2- (C)F - (D)Na + 9. 已知H 3PO 4的电离常数:K 1 = 7.5 ? 10-3,K 2= 6.23 ? 10-8,K 3 = 3.6 ? 10-13,则0.10 mol·dm -3 H 3PO 4溶液中氢离子浓度(mol·dm -3)为 ( B ) (A) 0.1 (B) 2.7 ? 10-2 (C) 2.4 ? 10-2 (D) 7.5 ? 10-3 10. 下列物质中熔点最高的是( C ) (A)SnCl 2 (B) AlCl 3 (C) SiC (D)KCl 二、填空题(本大题共30个空格,每空1分,共30分, 填错或未填均无分) 1. 在298.15K 和100kPa 下,H 2O(l)→H 2O(s)过程中△H θ < 0,△S θ < 0 △G θ > 0(填 > 、< 或 =) 2. 将Ni + 2Ag + = 2Ag + Ni 2+ 氧化还原反应设计为一个原电池。则原电池符号为 (-)N i ︱Ni 2+(c 1)‖Ag +(c 2)︱Ag (+) 。 ()()为则原电池的电动势,已知Θ+Θ+Θ=-=E V Ag A V Ni N ,80.0/g 25.0/i 2?? 1.05V ,为Θ ?m r G -202.618kJ ·mol -1 ,该氧化还原反应的平 衡常数为 3.16×1035 。(F= 96485 C mol -1) 《无机化学》下册期末习题集 一、选择题 C) 1、下列金属单质中哪种单质的熔 点最高( A Cr B Mo C W D Cu ) 2、下列金属单质中哪种单质的熔点 最低(C A Ag B Cu C Hg D Pb ) 3、下列金属单质中哪种单质的硬度 最大(B A Cu B Cr C W D Mo ) 4、下列金属单质中哪种单质的密度 最大(B A W B Os C Cu D Re 5、下列金属单质中哪种单质的导电 C ) 性最好( A Al B Cu C Ag D Pb 6、焰色反应中呈红色火焰的金 C ) 属是( A Na B K C Li D Ba 7、下列物质中哪个是超氧化物(C) A Na2O2 B BaO2 C KO2 D SO3 8、铜与浓硝酸反应的产物 A) 是( A NO2 B NO C N2O D NH4NO3 ) 9、锌与稀硝酸反应的产物是 (C A NO2 B NO C N2O D NH4NO3 C ) 10、镧系元素常见的氧化 数是( A +1 B +2 C +3 D +4 B) 11、CaH2与水反应的产 物是( A O2 B H2 C OHˉ D H 2O2 B Cl B Cl 12、MnO4-酸性介质中的还原产物是( D )A MnO42- B MnO2 C MnO D Mn2+ 13、在碱性介质中,Cr(VI)以离子存在的形式是( A )A CrO42- B Cr2O72- C Cr6+ D CrO314、在酸性介质中,Cr2O72-的还原产物是( B )A CrO42- B Cr3+ C Cr2+ D Cr2O315、下列物质中,只能做氧化剂的是( D )A MnO42- - C Br2 D Cr2O72-16、下列物质中,既能做氧化剂也能做还原剂的是( C ) A MnO42- - C Br2 D Cr2O72-17、为防止 FeSO4 溶液变质,通常向其中加入( A ) A Fe B Sn C Zn D Fe2+ 1 第一章化学反应基本规律 1、在标准态的规定中,下述表达不正确的是( ) A、标准压力P?=100.00KPa B、T=298.15K C、b?=1.00mol·kg-1 D、纯固体或纯液体处于标准压力。 2、在标准条件下,下列反应式中能表示CO2的Δf H m?(298.15K)的 反应式为( ) A、C(金刚石)+ O2(g)= CO2(g) B、C(石墨)+O2(g)= CO2(g) C、CO(g)+1/2O2(g)= CO2(g) D、CO2(g)=CO(g)+1/2O2(g) 3、已知下列反应在一定温度下的热效应: 4Fe2O3(s)+Fe(s)=3Fe3O4(s), Δr H m?=-74 kJ·mol-1 4Fe(s)+3O2(g)=2Fe2O3(s), Δr H m?=-1664kJ·mol-1 则可计算出Fe3O4(s)的标准摩尔生成焓等于( ) 4、等压过程,高温非自发,低温自发的条件是( ) 5、等温条件下,某反应Δr G m?=10kJ·mol-1,这表示该反应在标准状态下( ) A、自发进行 B、非自发进行 C、自发与否,需具体分析 6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。 已知热分解反应CO(g)= C(s)+O2(g)的Δr H m?=110.5kJ·mol-1, Δr S m?=-0.089kJ·mol-1·K-1这一方法正确与否?解释其原因: 7、(1)U,S,H,G均为( ) (2)Δr H m>0为( ) (3)Δr G m <0为( ) (4)K?为( ) 8、反应的Δr H m? <0,温度升高时(T2>T1)则平衡常数( ) 当Δr H m?>0,温度升高时则( ) 9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g) 则其反应速率方程式为( ) A、υ=kc(C)c(CO2) B、υ=kc(O2)c(CO2) C、υ=kc(CO2) D、υ=kc(O2) 10、升高温度,可增加反应速度,主要因为( ) A、增加了分子总数 B、增加了活化分子百分数 C、降低了活化能 D、促进平衡向吸热方向移动 11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为 167kJ·mol-1。则当反应温度自900K升高到1000K 时,1000K 的反应速率为原来的( ) 倍。 12、加入催化剂,能使反应速率加快,则其平衡常数也随之增 大。正确与否( ) 13、质量作用定律适用于( ) A、化学方程式中反应物和产物的系数均为1的反应 普通化学练习题 一、选择题(将唯一正确答案的序号填入括号内, 每题2分,共15题,计30分。) 1.下面对功和热的描述正确的是A A.都是途径函数,无确定的变化途径就无确定的数值 B.都是途径函数,对应于某一状态有一确定值 C.都是状态函数,变化量与途径无关 D.都是状态函数,始终态确定,其值也确定 2.已知在等温等压条件下进行的某反应A(g)+B(g)=C(g)+D(l)的?H<0、?S<0,则该 反应 A A.低于某温度时正向自发 B.高于某温度时正向自发 C.任意温度时正向均自发 D.任意温度时正向均非自发 3.下列说法正确的是D A.?H>0的反应都是自发反应。 B.某反应的?Gθ(298K)=10KJ·mol-1, 表明该反应在298K温度下不可能自发进行。C.已知?(Fe3+/Fe2+>?(Cu2+/Cu),则反应Fe3+(aq)+Cu(s) = Cu2+(aq)+Fe 2+(aq)向左进行。D.对于AB2型难溶电解质来讲,k sp越大,则其溶解度越大。 4.下列说法错误的是D A.Ag+与Cl-混合,不一定有沉淀生成。 B.反应A(g)+B(g)=C(g),?Hθ<0; 达到平衡后,若升高温度,则平 衡常数Kθ减小。 C.电极电势越小,则其对应的还原态物质的还原性越强。 D.在H2S(g)的饱和溶液中,C eq(H+)是C eq(S2-)的2倍。 5.下列溶液的浓度均为0.01 mol·dm-3,渗透压最大的是D A.C6H12O6+(葡萄糖) B.HAc C.NaCl D.Na2SO4 6.已知? (Cu2+/Cu)>?(Zn2+/Zn),其中最强的还原剂是D A.Cu2+ B.Cu C.Zn2+ D.Zn 7.下列电极电势与C(H+)无关的是A A.?(Fe3+/Fe2+) B.?( H+/H2) C.?(O2/OH-) 8.在标准条件下,?f H mθ、S mθ、?f G mθ均为零是C A.H2O(l) B.H2(g) C.H+(aq) D.H2O2 (l) 9.某温度时,下列反应已达到平衡CO(g)+H2O(g)=CO2 (g)+H2 (g),?Hθ<0,为要 提高CO的转化率,可采取方法D A.增加总压力 B.减少总压力 模拟题(一) 一、判断题(每小题2分,共20分) ()1、用佛尔哈德法的反滴定法测定Cl- 时,加入硝基苯后,滴定时可剧烈摇动。 ()2、重量分析法中,一般同离子效应将使沉淀的溶解度减小。 ()3、0.010mol·L-1H3BO3溶液的pH值是5.62[K(H3BO3)=5.8×10-10]。()4、难溶物A2B的溶解度为s,则其Ksp=4s3。 ()5、配位滴定时,MIn的稳定性应小于M-EDTA,否则EDTA不能夺取MI n中的M,在终点时看不到溶液颜色的改变,这种现象称为指示剂的僵化。()6、用KMnO4溶液滴定NaC2O4溶液时,事先加入适量MnSO4对反应速率有所加快人,但会对测定结果有一定影响。 ()7、间接碘量法中,淀粉指示剂加入的时间是滴定至近终点的时候。 ()8、在含有Fe3+和Fe2+的溶液中,加入NH4F溶液将使Fe3+/Fe2+电极电位值降低。 ()9、三元弱酸H3A溶液中,物种HA2-的分布分数为: ()10、拉乌尔定律总是既适用于溶液中的溶质又适用于溶剂。 二、单选题(每小题2分,共20分) ()1、处于恒温条件一密闭容器内,有水及相平衡的水蒸气。现充入不溶于水也不与水反应的气体,则水蒸气的压力 A、增加; B、减少; C、不变; D、不能确定。 ()2、测得人体血液的冰点降低值Δt f=0.56K。已知K f=1.86 K·mol-1·kg,则在体温37℃时血液的渗透压是 A、1776kPa; B、388 kPa; C、776 kPa; D、194 kPa。 ()3、原子轨道角度分布图中,从原点到曲面的距离表示 A、ψ值的大小; B、Y值的大小; C、r值的大小; D、4πr2dr值的大小。 ()4、3d电子的径向分布函数图有 A、1个峰; B、2个峰; C、3个峰; D、4个峰。 ()5、中心原子采用sp2杂化的分子是 A、NH3; B、BCl3; C、PCl3; D、H2O。 ()6、下列反应中,反应的Δf Hθm与产物的Δf Hθm相同是 A、2H2(g)+O2(g)→2H2O(g); B、NO(g)+1/2O2(g) →NO2; C(金刚石)→C(石墨);D、H2(g)+1/2O2(g)→H2O(g)。 ()7、反应2A+B→D的有关实验数据在表中给出,此反应的速率常数K/mo -26-1 大学化学课后习题答案.. 第一章化学反应热 教学内容 1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热 效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、 标准态、标准生成焓、反应进度等概 念;熟悉热力学第一定律;掌握化学 反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和 离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 2 系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有 ..能量交 ..物质交换,只有 换); 孤立系统(体系与环境之间没有物质交换,也没有能量交换) 系统与环境之间具有边界,这一边界 可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有 时油是连续相。 3 4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过 这些宏观性质描述的,这些宏观性质 又称为系统的状态函数。 状态函数的特点:①状态函数之间往 往相互制约(例如理想气体状态 方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关, 与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末 态相同,而途径不同时,状态函 数的 4 有机化学 一、命名下列化合物或根据名称写出其结构式 1.11.对苯醌 2,3-二甲基戊烷 2.12.4-甲基-2-戊酮肟 糠醛 3.13.二乙胺 CH 3CH 2-NH-CH 2CH 3 格氏试剂 4. 14.N,N-二甲基苯胺 5-甲基-二氢呋喃-2(3H)-酮 5.15.D - -吡喃葡萄糖 2-羟基-2-苯甲酸 3(CH 3)2CHCHCH 2CH 3 O CHO CH 3CH 2MgBr H COOH OH 6H 5 O O CH 3 6.16.邻苯二甲酰亚胺顺-1,2-二甲基环己烷 7.17.二苯醚 苯基重氮盐酸盐 8.18.4-氨基吡啶 1-苯-1-乙醇 9.19.2,4二硝基苯肼 2 NH NH 2 NH 反-2,3-二氯-2-戊烯 10.C O C O O 20.水杨酸 邻苯二甲酸酐 二、用结构式表示下列名词术语 1.季铵碱2.对映异构体R4N+OH- Cl Cl Cl CH3 CH3 - + N2 Cl OH CHCH3 C CH3CH2C Cl CH3 Cl 3.构造异构体 C H 3CH 3CH 3 C H 3CH 3 三、完成下列反应式 1. C C 3CH 3CH C C 3 CH 3CH H H 2. + 3. C O Cl + C 2H 5OH -4 H 2 CH 3I 2 CH CH 3C ⑴⑵⑵⑴C 2H 5ONa H 3O + /H 2O/OH - H + O O O O 2CH 3 25KMnO 4/H + ①②-NaOBr NH 3 4. 四、用化学方法鉴别下列各组化合物 1. 取少量三种试剂分别置于试管中,加入氨的衍生物,若反应产生的物质有特殊颜色,则为 O ;再取少量剩余试剂,分别置于试管中,加入Na,有气泡产生,则为OH , 其余一个为. 2. 取少量三种试剂分别置于试管中,分别滴入适量的氯化亚铜的氨溶液,产生棕色的沉淀物 为,取其余两种试剂置于两支不同的试管中,滴家少量溴水,若 溴水褪色为ChemPaster 剩下的即为ChemPaster . 五、推测结构 化合物A(C 9H 10O 2),能溶于氢氧化钠,易使溴水褪色,可与羟胺作用,能发生碘仿反应,但不发生托伦反应。A 用LiAlH 4还原后得B (C 9H 12O 2),B 也能发生碘仿反应。A 用锌汞齐/浓盐酸还原生成C(C 9H 12O),C 在碱性条件下与碘甲烷作用生成D (C 10H 14O ),D 用高锰酸 OH CH 3CHCH 2CH 2 COOH △ 25H + OH O 1.判断: Q和W是过程函数,而?U是状态函数。(错) 2.填空(1)在恒压条件下,反应中体系的焓变在数值上等于(恒压反应热)。(2)热力学第一定律的数学表达式为(?U= Q - W )。 (3)体系分为三种类型:( 、、敞开体系、封闭体系、孤立体系)。3.填空:已知反应2H2O(g)=2H2(g)+O2(g), ?r HΘ=483.6 kJ?mol-1, 则?f HΘ(H2O,g)=(-241.8 )kJ?mol-1。 1.Q和W是过程函数,而?U是状态函数。 2.填空(1)在恒压条件下,反应中体系的焓变在数值上等于(恒压反应热)。 (2)热力学第一定律的数学表达式为(?U= Q - W )。 (3)体系分为三种类型:( 敞开体系、封闭体系、孤立体系)。 3. ?f H?(H2O,g)=(-241.8 )kJ?mol-1 ?已知(1) 4NH3(g) +3O2(g) = 2N2(g)+ 6H2O(l) , ?r H1?= -1523kJ?mol-1 ?(2) H2(g) +(1/2)O2(g) = H2O(l) , ?r H2?= -287 kJ?mol-1 试求反应(3) N2(g) +3H2(g) =2NH3(g)的?r H3?。 ?已知(1) 4NH3(g) +3O2(g) = 2N2(g)+ 6H2O(l) , ?r H1?= -1523kJ?mol-1 ?(2) H2(g) +(1/2)O2(g) = H2O(l) , ?r H2?= -287 kJ?mol-1 试求反应(3) N2(g) +3H2(g) =2NH3(g)的?r H3?。 ?解:因为反应式(3) =3? (2)-(1/2)? (1) ?所以?r H3Θ = 3 ?r H2Θ- (1/2)??r H1Θ =3 ?(-287 )- (1/2)?(-1523) =-99.5 kJ ?mol-1 1.判断:(1)稳定单质在298K时的标准摩尔生成焓和标准摩尔熵均为零。() (2)化学反应的熵变与温度无关。() (3)化学反应的熵变随温度升高显著增加。() 2.填空:某反应在恒温下?H>0, ?S>0,则反应自发进行的温度条件是()。 3.选择: (1)同一聚集状态的物质B的熵值与温度有关,其规律是() A. S(高温) 第一章化学反应热 教学内容 1.系统、环境等基本概念;2. 热力学第一定律;3. 化学反应的热效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有 ..能量交换); ..物质交换,只有 孤立系统(体系与环境之间没有物质交换,也没有能量交换) . 学习帮 系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为 的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有时油是连续相。 4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。 状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末态相同,而途径不同时,状态函数的 . 学习帮 大学化学课后习题答案(大学版)第1_2_3_章 第1章 化学反应基本规律 1.2 习题及详解 一.判断题 1. 状态函数都具有加和性。 (×) 2. 系统的状态发生改变时,至少有一个状态函数发生了改变 。 (√) 3. 由于CaCO 3固体的分解反应是吸热的,故CaCO 3的标准摩尔生成焓是负值 。 (×) 4. 利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。 (×) 5. 因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的ΔS 大大增加 。 (×) 6. ΔH, ΔS 受温度影响很小,所以ΔG 受温度的影响不大 。 (×) 7. 凡ΔG θ 大于零的过程都不能自发进行。 (×) 8. 273K ,101.325KPa 下,水凝结为冰,其过程的ΔS<0, ΔG=0 。 (√) 9.反应Fe 3O 4(s)+4H 2(g) → 3Fe(s)+4 H 2O(g)的平衡常数表达式为2244 (/)(/)H O T H p p K p p θθθ= 。 (√) 10.反应2NO+O 2→2NO 2的速率方程式是:) ()(22O c NO kc v ?=,该反应一定是基元反应。 (×) 二.选择题 1. 某气体系统经途径1和2膨胀到相同的终态,两个变化过程所作的体积功相等且无非体积功,则两过程( B ) A. 因变化过程的温度未知,依吉布斯公式无法判断ΔG 是否相等 B. ΔH 相等 C. 系统与环境间的热交换不相等 D. 以上选项均正确 2. 已知 CuCl 2(s)+Cu(s)→2CuCl(s) Δr H m Θ(1) =170KJ?mol -1 Cu(s)+Cl 2(g) → CuCl 2(s) Δr H m Θ(2) =-206KJ?mol -1 则Δf H m Θ(CuCl,s )应为( D )KJ.mol -1 A.36 B. -36 C.18 D.-18 3. 下列方程式中,能正确表示AgBr(s)的Δf H m Θ的是( B ) A. Ag(s)+1/2Br 2(g)→ AgBr(s) B. Ag(s)+1/2Br 2(l)→AgBr(s) C. 2Ag(s)+Br 2(l)→ 2AgBr(s) D. Ag +(aq)+Br -(aq)→ AgBr(s) 4. 298K 下,对参考态元素的下列叙述中,正确的是( C ) A. Δf H m Θ≠0,Δf G m Θ=0,S m Θ=0 第四章 化学平衡 本章总目标: 1:了解化学平衡的概念,理解平衡常数的意义; 2:掌握有关化学平衡的计算; 3:熟悉有关化学平衡移动原理。 各小节目标: 第一节:化学平衡状态 1:熟悉可逆反应达到平衡的特征——反应体系中各种物质的生成速率分别等于其消耗的速率,各种物质的浓度将不再改变。 2:了解平衡常数、平衡转化率这两个概念的意义。 第二节:化学反应进行的方向 学会运用标准平衡常数判断化学反应的方向:Q K θ>时,反应向逆向进行。 Q K θ<向正反应方向进行。Q K θ=时体系达到平衡状态。 第三节;标准平衡常数K θ与r m G θ ?的关系 1:掌握化学反应等温式(ln r m r m G G RT Q θ ?=?+),当体系处于平衡状态的时候Q K θ=ln r m G RT K θ θ??=-。 2:重点掌握运用公式r m r m r m G H T S θθθ ?=?-?进行热力学数据之间的计算。 第四节:化学平衡的移动 1:熟悉温度、浓度、压强对化学平衡的影响, 2:熟练地根据条件的改变判断平衡移动的方向。。 习题 一 选择题 1.可逆反应达平衡后,若反应速率常数k 发生变化,则标准平衡常数( )(《无机化学例题与习题》吉大版) A.一定发生变化 B. 一定不变 C. 不一定变化 D. 与k 无关 2.反应:2CO (g )+O 2(g 2(g )在300K 时的Kc 与Kp 的比值约 为( ) A.25 B.2500 C.2.2 D.0.04 3.反应的温度一定,则下列的陈述中正确的是()(《无机化学例题与习题》吉大版) A.平衡常数能准确代表反应进行的完全程度 B.转化率能准确代表反应进行的完全程度 C. 平衡常数和转化率都能准确代表反应进行的完全程度 D. 平衡常数和转化率都不能代表反应进行的完全程度 4.相同温度下:2H2(g)+S2(g2S(g)Kp1 2Br2(g)+2H2S(g2(g)Kp2 H2(g)+Br2(g)(g)Kp3则Kp2等于() A. Kp1? Kp3 B.(Kp3)2/ Kp1 C. 2Kp1? Kp3 D. Kp3/ Kp1 5.下列反应中,K?的值小于Kp值的是()(《无机化学例题与习题》吉大版) A. H2(g)+Cl2(g)== 2HCl(g) B. 2H2(g)+S(g)== 2H2S(g) C. CaCO3(s) == CaO(s)+CO2(g) D.C(s)+O2(g)== CO2(g) 6.N2(g)+3H2(g3(g),H=-92.4KJ?mol-1,473K时,三种混合气体达平衡。要使平衡向正方向移动,可采用方法() A.取出1molH2 B.加入NH3以增加总压力 C.加入稀有气体以增加总压力 D.减小容器体积以增加总压力 7.298K时,Kp?的数值大于Kc的反应是() A.H2(g)+S(g2S(g) B.H2(g)+S(s2S(g) C.H2(g)+S(s2S(l) D.Ag2CO3(s2O(s)+CO2(g) 8.已知300K和101325Pa时,下列反应:N2O4(g2(g)达到平衡时有20﹪的N2O4分解成NO2,则此反应在300K时的平衡常数Kp的数值为() A.0.27 B.0.05 C.0.20 D.0.17 9.在某温度下平衡A+B== G+F的H<0,升高温度平衡逆向移动的原因是( ) (《无机化学例题与习题》吉大版) A.v正减小,v逆增大 B.k正减小,k逆增大 C. v正和v逆都减小, D. v正增加的倍数小于v逆增加的倍数 10.已知下列前三个反应的K值,则第四个反应的K值为() (1)H2(g)+1/2O22O(g) K1 (2)N2(g)+O2K2 (3)2NH3(g)+5/2O22O(l) K3 (4)N2(g)+3H23K A.K1+K2-K3 B.K1?K2/K3 C.K1?K3/K2 D.K13?K2/K3 11.下面哪一种因素改变,能使任何反应平衡时产物的产量增加() A.升高温度 B.增加压力 C.加入催化剂 D.增加起始物 第一章 化学反应热 教学内容 1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有物质交换,只有能量交换); 孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为 的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有时油是连续相。 4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些 宏观性质描述的,这些宏观性质又称为系统的状态函数。 状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末态相同,而途径不同时,状态函数的 变量是相同的。 7*.容量性质 这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。 8*.强度性质 这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。 9.功(W) 温差以外的强度性质引起的能量交换形式[W=W体+W有]。 环境对系统做功,其符号为(+);反之为(–)。功不是状态函数,是过程量。因为功总是与系统变化的途径有关。例如盐酸与锌单质在烧杯中发生氧化还原反应时会有热效应,但是系统并不做功(W有= 0)。但是,若将其组成原电池,系统就可以对环境做电功(W有<0)。又例如一个带活塞的汽缸膨胀,分别经过①向真空中膨胀;②向大气中等外压膨胀。设活塞的两个过程的始、末状态相同,则W体1=0;而W体2 = p环境(V2–V1)≠0。 10.热(Q) 系统与环境之间因温差引起的能量交换形式。系统吸收热量,热的符号为(+),系统放热为(–)。热是与变化途径有关的物理量,任何一个系统只能说它在某过程中吸收或放出多少热量,不能说它本身含有多少热量,所以热不是状态函数。 2013年全国高校自主招生化学模拟试卷九 命题人:南昌二中高三(01)班张阳阳 第1题 (共6分) 实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。 (1)请用化学方程式解释: ①稀盐酸洗涤产品可除去哪些主要杂质? ②为什么加HCl洗涤时突然起火? (2)请设计一个实验来验证你的解释。(不必画出装置图,也不必指出具体化学药品,不要写方程式, 只要简明指出方法。) 第2题(共8分) (1) 根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、杂化轨道同相应的键合原子成键。其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。 (2) 最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物 质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。此前医学家已用甘草甜素作为有效成分开发出药物,治疗丙肝与艾滋病等,并取得了一定效果。甘草甜素(甘草素)是甘草的根和茎中所含的一种五环三萜皂苷,其结构如图1所示: 甘草甜素的(A)苷键构型为,将其水解可得到一分子的甘草次酸(如图2)和两分子的(填名称) ,其结构为: 。 第3题(共6分) 提出查理定律的查理很幸运,碰巧开始时没有以N2O4来研究气体行为,否则他或许会得出一种相当特殊的温度效应。 对于平衡N 2O 4(g) 2NO 2 (g),在 298K 时其K p = 0.1 p θ ,而p K p 2 2 14α α-=,α为N 2O 4的离解度,p 为平衡体系的总压。假设,298 K 时,查理把0.015 mol 的N 2O 4放于一只2.44×103-m 3 的烧杯中,当离解达到平衡后,他将看到平衡压力等于0.205p θ 。其对应的α = 0.33 (1) 在保持体积不变的前提下,查理做把温度升高10%的实验,即把温度升高至328K 。根据理想气体定律,其压力也应只增大10%,即等于0.226p θ ,但查理发现这时的压力为0.240p θ 。自然,问题是出在N 2O 4的离解度增加上了。试求此时的α和K p 。 (2) 若NO 2在298K 下的标准摩尔生成自由能为51.463kJ ·mol 1 -,试计算N 2O 4在298K 下的标准摩尔 生成自由能。 第4题(共6分) 世界各国科学家,从关注人类生存质量角度出发,将保护地球自然生态环境研究作为重大任务之一。并对与之相关的宇宙空间的复杂体系如太阳系进行了初步研究。结果发现太阳是一个巨大能源。它时刻都在向太空发射大量能量,其能量来源就是太阳时刻不停地进行着的链式聚变反应。在那里,氢原子核在极高温度下发生聚变反应。这种反应放出的能量,一方面用以维持反应必需的高温,另一方面则向太空辐射出能量。其中一种重要的聚变过程是碳一氮循环。这一循环是由一系列由碳-氮作媒介的反应组成的,并按下列步骤进行: ① N C H 13712611→+ ② e x y v e C H ++→+ 137 ③ N C H x y x y ''→+11 ④ O N H n n x y x y →+''11 ⑤ e x y x y v e N O n n ++→+'''''' ⑥ He C N H x x y ' ''''''''+→+212611 上述过程,放出的净能量为25.7MeV 。每消耗1kg 1 1H 约产生6.2×1014 J 的能量。核聚变反应是太阳能够在几十亿年内稳定地发光释能的主要原因。 (1) 在上述过程中x= ,y= ;x ′= ,y ′= ;x '''= ,y ''' (均填数值)。 (2) 写出与净能量产生对应的反应方程式: 。 (3) 在反应中碳原子的作用是 。 第5题 (共7分) (1) 吸取KIO 4和KIO 3试液25.00mL ,在弱碱性条件下加入过量Ⅺ溶液使IO 4- 还原成IO 3 - ,并析出碘,用0.1000mol ·L 1 -亚砷酸钠溶液滴定耗去10.00mL 。 (2) 另取25.00mL 该试液,在强酸性条件下,加入过量KI 溶液,释放出的I 2,用 附录8 习题选答 习题1 1.2 600nm(红), 3.31×10-19J, 199KJ·mol-1 550nm(黄), 3.61×10-19J, 218KJ·mol-1 400nm(蓝), 4.97×10-19J, 299KJ·mol-1 200nm(紫), 9.93×10-19J, 598KJ·mol-1 1.3 6.51×10-34J·s 1.4 (1)100eV电子 12 2.6pm (2)10eV中子 9.03pm (3)1000m/sH原子0.399nm 1.5 子弹~10-35m, 电子~10-6m 1.6 Dx=1.226×10-11m<< 10-6m 1.8 (2),(4) 是线性厄米算符. 1.9 (1) exp(ikx)是本征函数, 本征值ik. (2), (4)不是. 1.10 1.12 , 本征值为±√B 1.13 1.16 当两算符可对易, 即两物理量可同时测定时,式子成立. 1.18 (1) (2) =0 1.19 0.4l~0.6l间, 基态出现几率0.387,第一激发态出现几率0.049. 1.20 (1) 基态n x=n y=n z=1 非简并 (2) 第一激发态211, 121, 112 三重简并 (3) 第二激发态221, 122, 212 三重简并 1.23 λ=239nm. 习题2 2.1 (1) E0=-1 3.6eV, E1=-3.4eV. (2) =0 2.4 ψ1s波函数在r=a0, 2a0处比值为2.718 ψ2在r=a0, 2a0处比值为7.389. 2.6 3d z2 , 3d xy各有2个节面: 3d z2是2个圆锥节面, 3d xy是XZ,YZ面. 2.9 (1) 2p轨道能量为- 3.4eV 角动量为 (2) 离核平均距离为5a0. (3) 极大值位置为4a0. 1 《无机及分析化学》模拟试题(1) 【闭卷】 本试题一共三道大题,满分100分。考试时间120分钟。 注:1.答题前,请准确、清楚地填各项,涂改及模糊不清者、试卷作废。 2.试卷若有雷同以零分计。 一、选择题(每题2分,共50分) 1. 含有Cl -和Br -的混合溶液,欲使Br -氧化为Br 2而不使Cl -氧化,应选择 ( ) (θ /Sn Sn 24++? =0.15 V ,θ/Cl Cl 2-?=1.3583 V ,θ/Br Br 2-?=1.087 V , θ /Cr O Cr 3272+- ?=1.33 V , θ/Mn MnO 24+-?=1.51 V , θ/Fe Fe 23++?=0.771 V ) A. SnCl 4 B. K 2Cr 2O 7 C. KMnO 4 D. Fe 3+ 2. 已知下列反应的平衡常数 PbSO 4(S) 2++SO 42- K sp Θ(1) PbS (S) 2++S 2- K sp Θ(2) 反应PbSO 4+S PbS+SO 4- 的K 为 ( ) A. K SP Θ(1) . K sp Θ(2) B. K sp Θ(1) /K sp Θ(2) C. K sp Θ(2) /K sp Θ(1) D. ( K sp Θ(1) /K sp Θ(2) )2 3. 0.04mol·L -1的H 2CO 3的水溶液, K 1Θ﹑K 2Θ分别为它的电离常数,该溶液的c (H +)浓度和c (CO 32-)的浓度分别为 ( ) A. 0 4.0θ1?K , K 1Θ B. 04.0θ1?K , 04.0θ2?K 2 C. 04.0θ2θ1??K K , K 2Θ D. 04.0θ 1?K , K 2Θ 4. 已知某一元弱酸的浓度为c ,用等体积的水稀释后,溶液的c (H +)浓度为 ( ) A. 2c B. c K a 2θ C. c K a ?θ 21 D. 2c K a ?θ 5. θ/Cr O Cr 3 272+-?的数值随pH 的升高而 ( ) A. 增大 B. 不变 C. 减少 D. 无法判断 6. 用AgNO 3处理[Fe(H 2O)5Cl]Br 溶液,产生的沉淀主要是 ( ) A. AgBr B. AgCl C. AgBr 和AgCl D. Fe(OH)3 7. 已知K f Θ[Ag(NH 3)2+]大学-立体化学练习题和答案
大学化学(1)》模拟试题分解
大学无机化学下册期末习题集
大学化学习题与答案
大学普通化学综合练习题1
浙江工业大学无机及化学分析模拟题
大学化学课后习题答案..
药学《有机化学》山东大学网络教育考试模拟题与答案
大学化学习题
大学化学课后习题答案
大学化学课后习题1,2,3答案
大学无机化学第四章试题及答案
大学化学课后习题答案.
2013年全国高校自主招生化学模拟试卷(9)及答案
厦门大学结构化学习题集答案
中国矿业大学《无机及分析化学》模拟试题(1)