金属盐类溶度积表
- 格式:doc
- 大小:732.32 KB
- 文档页数:17
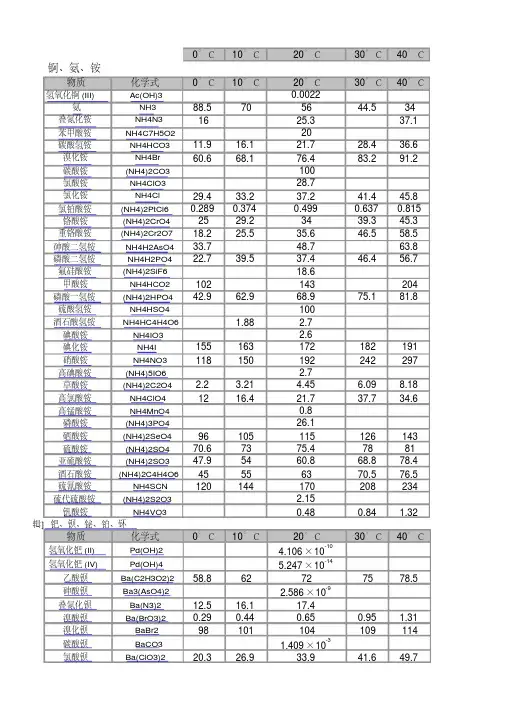
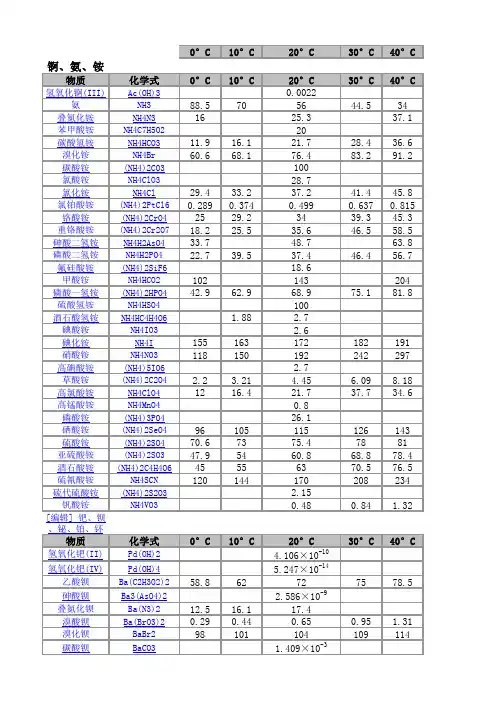
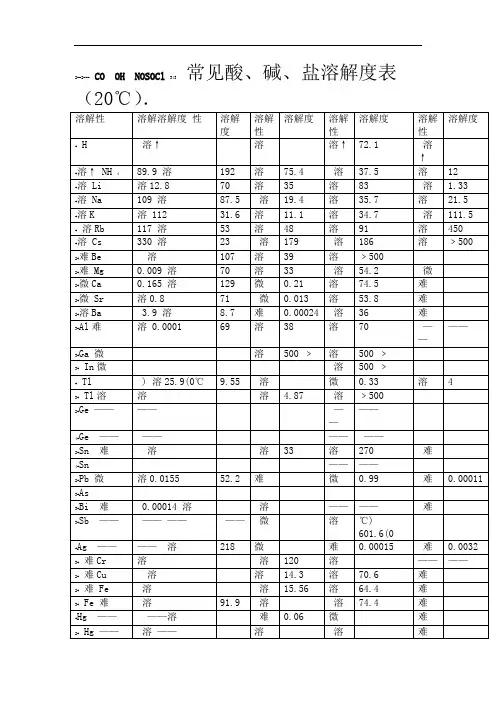
化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=B aSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
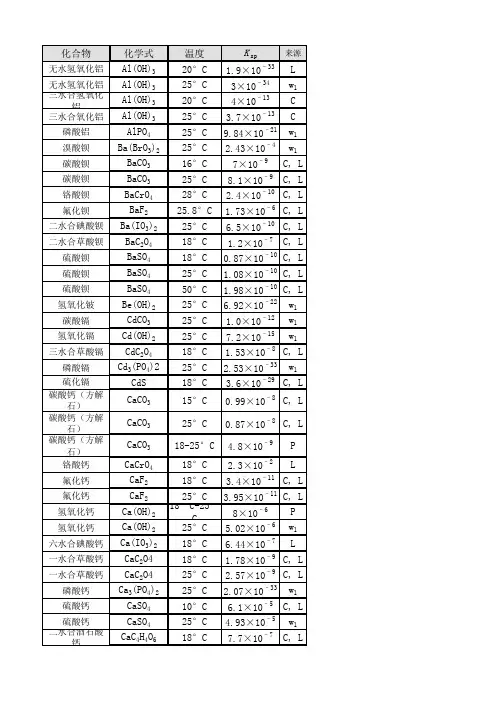

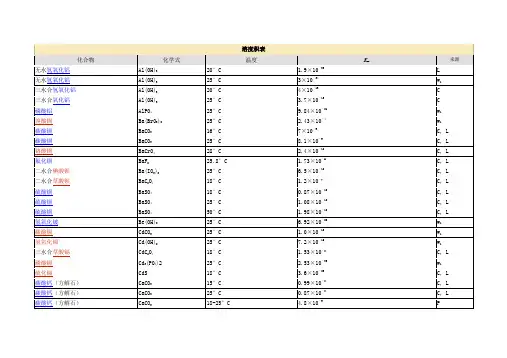
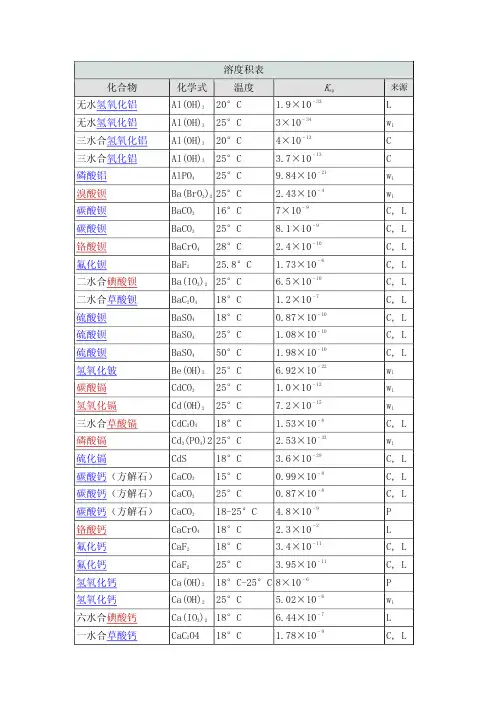
溶度积表化合物化学式温度Ksp来源无水氢氧化铝Al(OH)3 20°C 1.9×10–33 L 无水氢氧化铝Al(OH)3 25°C 3×10–34 w1 三水合氢氧化铝Al(OH)3 20°C 4×10–13 C 三水合氧化铝Al(OH)3 25°C 3.7×10–13 C 磷酸铝AlPO4 25°C 9.84×10–21 w1 溴酸钡Ba(BrO3)2 25°C 2.43×10–4 w1 碳酸钡BaCO3 16°C 7×10–9 C, L 碳酸钡BaCO3 25°C 8.1×10–9 C, L 铬酸钡BaCrO4 28°C 2.4×10–10 C, L 氟化钡BaF2 25.8°C 1.73×10–6 C, L 二水合碘酸钡Ba(IO3)2 25°C 6.5×10–10 C, L 二水合草酸钡BaC2O4 18°C 1.2×10–7 C, L 硫酸钡BaSO4 18°C 0.87×10–10 C, L 硫酸钡BaSO4 25°C 1.08×10–10 C, L 硫酸钡BaSO4 50°C 1.98×10–10 C, L 氢氧化铍Be(OH)2 25°C 6.92×10–22 w1 碳酸镉CdCO3 25°C 1.0×10–12 w1 氢氧化镉Cd(OH)2 25°C 7.2×10–15 w1 三水合草酸镉CdC2O4 18°C 1.53×10–8 C, L 磷酸镉Cd3(PO4)2 25°C2.53×10–33 w1 硫化镉CdS 18°C3.6×10–29 C, L 碳酸钙(方解石)CaCO3 15°C 0.99×10–8 C, L 碳酸钙(方解石)CaCO3 25°C 0.87×10–8 C, L 碳酸钙(方解石)CaCO3 18-25°C4.8×10–9 P 铬酸钙CaCrO4 18°C 2.3×10–2 L 氟化钙CaF2 18°C 3.4×10–11 C, L 氟化钙CaF2 25°C 3.95×10–11 C, L 氢氧化钙Ca(OH)2 18°C-25°C 8×10–6 P氢氧化钙Ca(OH)2 25°C5.02×10–6 w1 六水合碘酸钙Ca(IO3)2 18°C6.44×10–7 L 一水合草酸钙CaC2O4 18°C 1.78×10–9 C, L 一水合草酸钙CaC2O4 25°C 2.57×10–9 C, L 磷酸钙Ca3(PO4)2 25°C 2.07×10–33 w1 硫酸钙CaSO4 10°C 6.1×10–5 C, L 硫酸钙CaSO4 25°C 4.93×10–5 w1 二水合酒石酸钙CaC4H4O6 18°C7.7×10–7 C, L 氢氧化亚铬Cr(OH)2 25°C 2×10–16 w2 氢氧化铬Cr(OH)3 25°C 6.3×10–31 w2 氢氧化钴Co(OH)2 25°C 1.6×10–15 w2 硫化钴CoS 18°C 3×10–26 C, L 硫化钴CoS 18°C-25°C 10–21 P 碳酸铜CuCO3 25°C 1×10–10 P 氢氧化铜Cu(OH)2 18°C-25°C 6×10–20 P 氢氧化铜Cu(OH)2 25°C 4.8×10–20 w1 碘酸铜Cu(IO3)2 25°C 1.4×10–7 C, L 草酸铜CuC2O4 25°C 2.87×10–8 C, L 硫化铜CuS 18°C8.5×10–45 C, L 溴化亚铜CuBr 18°C-20°C 4.15×10–8 C 氯化亚铜CuCl 18°C-20°C 1.02×10–6 C 氢氧化亚铜(与氧化亚铜平衡)Cu(OH) 25°C 2×10–15 w1 碘化亚铜CuI 18°C-20°C 5.06×10–12 C 硫化亚铜Cu2S 16°C-18°C 2×10–47 C, L 硫氰化亚铜CuSCN 18°C 1.64×10–11 C, L 氢氧化铁Fe(OH)3 18°C 1.1×10–36 C, L 碳酸亚铁FeCO3 18°C-25°C 2×10–11 P 氢氧化亚铁Fe(OH)2 18°C 1.64×10–14 C, L 氢氧化亚铁Fe(OH)2 25°C 1×10–15; 8.0×10–16 P; w2 草酸亚铁FeC2O4 25°C 2.1×10–7 C, L 硫化亚铁FeS 18°C 3.7×10–19 C, L 溴化铅PbBr2 25°C 6.3×10–6; 6.60×10–6 P; w1 碳酸铅PbCO3 18°C 3.3×10–14 C, L 铬酸铅PbCrO4 18°C 1.77×10–14 C, L 氯化铅PbCl2 25.2°C 1.0×10–4 L 氯化铅PbCl2 18°C-25°C 1.7×10–5 P 氟化铅PbF2 18°C 3.2×10–8 C, L 氟化铅PbF2 26.6°C 3.7×10–8 C, L 氢氧化铅Pb(OH)2 25°C 1×10–16; 1.43×10–20 P; w1 碘酸铅Pb(IO3)2 18°C 1.2×10–13 C, L 碘酸铅Pb(IO3)2 25.8°C 2.6×10–13 C, L 碘化铅PbI2 15°C 7.47×10–9 C 碘化铅PbI2 25°C 1.39×10–8 C 草酸铅PbC2O4 18°C 2.74×10–11 C, L 硫酸铅PbSO4 18°C 1.6×10–8 C, L 硫化铅PbS 18°C 3.4×10–28 C, L 碳酸锂Li2CO3 25°C 1.7×10–3 C, L 氟化锂LiF 25°C 1.84×10–3 w1 磷酸锂Li3PO4 25°2.37×10–4 w1 磷酸铵镁MgNH4PO4 25°C 2.5×10–13 C, L 碳酸镁MgCO3 12°C 2.6×10–5 C, L 氟化镁MgF2 18°C 7.1×10–9 C, L 氟化镁MgF2 25°C 6.4×10–9 C, L 氢氧化镁Mg(OH)2 18°C 1.2×10–11 C, L 草酸镁MgC2O4 18°C 8.57×10–5 C, L 碳酸锰MnCO3 18°C-25°C 9×10–11 P 氢氧化锰Mn(OH)2 18°C 4×10–14 C, L 硫化锰(粉色)MnS 18°C 1.4×10–15 C, L 硫化锰(绿色)MnS 25°C 10–22 P 溴化汞HgBr2 25°C 8×10–20 L 氯化汞HgCl2 25°C 2.6×10–15 L 氢氧化汞(与氧化汞平衡)Hg(OH)2 25°C 3.6×10–26 w1 碘化汞HgI2 25°C 3.2×10–29 L 硫化汞HgS 18°C 4×10–53 to 2×10–49 C, L 溴化亚汞HgBr 25°C 1.3×10–21 C, L 氯化亚汞Hg2Cl2 25°C 2×10–18 C, L 碘化亚汞HgI 25°C 1.2×10–28 C, L 硫酸亚汞Hg2SO4 25°C 6×10–7; 6.5×10–7 P; w1 氢氧化镍Ni(OH)2 25°C 5.48×10–16 w1 硫化镍NiS 18°C 1.4×10–24 C, L 硫化镍NiS 18°C-25°C 10–27 P 硫化镍NiS 18°C-25°C 10–21 P 酒石酸钾KHC4H4O6 18°C 3.8×10–4 C, L 高氯酸钾KClO4 25°C 1.05×10–2 w1 高碘酸钾KIO4 25° 3.71×10–4 w1 乙酸银AgC2H3O2 16°C 1.82×10–3 L 溴酸银AgBrO3 20°C 3.97×10–5 C, L 溴酸银AgBrO3 25°C 5.77×10–5 C, L 溴化银AgBr 18°C 4.1×10–13 C, L 溴化银AgBr 25°C 7.7×10–13 C, L 碳酸银Ag2CO3 25°C 6.15×10–12 C, L 氯化银AgCl 4.7°C 0.21×10–10 C, L 氯化银AgCl9.7°C 0.37×10–10 L 氯化银AgCl 25°C 1.56×10–10 C, L 氯化银AgCl 50°C 13.2×10–10 C, L 氯化银AgCl 100°C 21.5×10–10 C, L 铬酸银Ag2CrO4 14.8°C 1.2×10–12 C, L 铬酸银Ag2CrO4 25°C 9×10–12 C, L 氰化银Ag2(CN)2 20°C 2.2×10–12 C, L 重铬酸银Ag2Cr2O7 25°C 2×10–7 L 氢氧化银AgOH 20°C 1.52×10–8 C, L 碘酸银AgIO3 9.4°C 0.92×10–8 C, L 碘化银AgI 13°C 0.32×10–16 C, L 碘化银AgI 25°C 1.5×10–16 C, L 亚硝酸银AgNO2 25°C 5.86×10–4 L 草酸银Ag2C2O4 25°C 1.3×10–11 L 硫酸银Ag2SO4 18°C-25°C 1.2×10–5 P 硫化银Ag2S 18°C 1.6×10–49 C, L 硫氰化银AgSCN 18°C 0.49×10–12 C, L 硫氰化银AgSCN 25°C 1.16×10–12 C, L 碳酸锶SrCO3 25°C 1.6×10–9 C, L 铬酸锶SrCrO4 18°C-25°C 3.6×10–5 P 氟化锶SrF2 18°C 2.8×10–9 C, L 草酸锶SrC2O4 18°C 5.61×10–8 C, L 硫酸锶SrSO4 2.9°C 2.77×10–7 C, L 硫酸锶SrSO4 17.4°C 2.81×10–7 C, L 溴化铊TlBr 25°C 4×10–6 L 氯化铊TlCl 25°C 2.65×10–4 L 硫酸铊Tl2SO4 25°C 3.6×10–4 L 硫氰化铊TlSCN 25°C; 2.25×10–4 L 氢氧化锡Sn(OH)2 18°C-25°C 1×10–26 P 氢氧化锡Sn(OH)2 25°C 5.45×10–27; 1.4×10–28 w1; w2 硫化锡SnS 25°C 10–28 P 氢氧化锌Zn(OH)2 18°C-20°C 1.8×10–14 C, L 二水合草酸锌ZnC2O4 18°C 1.35×10–9 C, L 硫化锌ZnS 18°C 1.2×10–23 C, L参考资料:L=Lange's 10th ed.; C=CRC 44th ed.; P=General Chemistry byPauling, 1970 ed.; w1=网络来源1; w2=网络来源2。
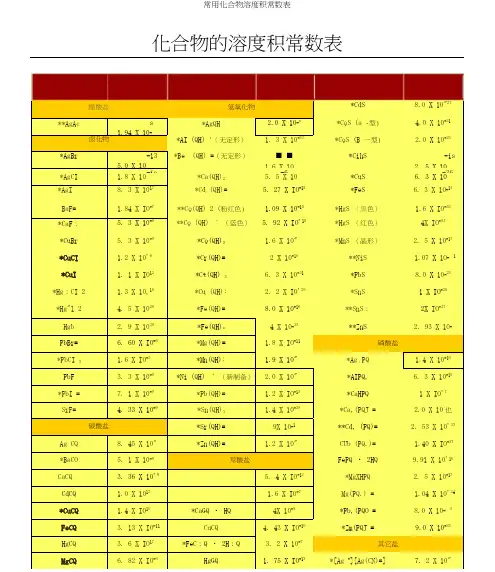

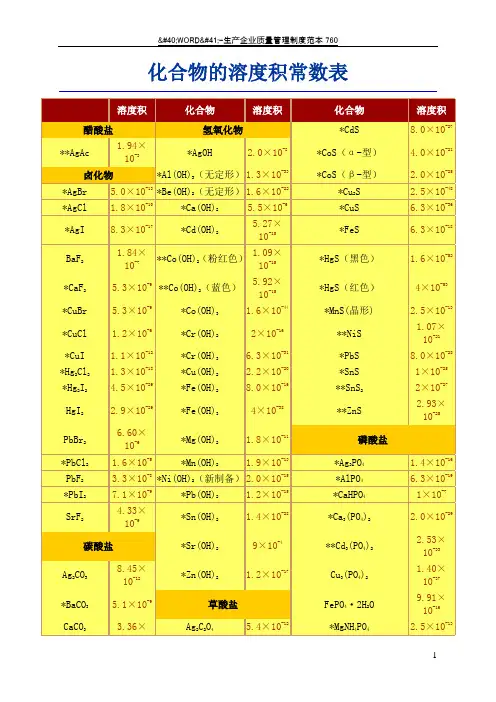
化合物的溶度积常数表化合物的溶度积常数表化合物溶度积醋酸盐**AgAc 1.94×10-3卤化物化合物溶度积氢氧化物*AgOH 2.0×10-8*Al(OH) 3(无定 1.3×10-33形)化合物溶度积*CdS 8.0×10-27*CoS(α -型)4.0×10-21*CoS(β -型) 2.0×10-25*AgBr*AgCl *AgIBaF2*CaF 2 *CuBr *CuCl *CuI *Hg 2Cl2 *Hg 2I 2 HgI 2 PbBr2 *PbCl 2PbF2*PbI 2 SrF2-135.0×101.8×10-108.3×10-171.84×10-75.3× 10-95.3× 10-91.2× 10-61.1×10-121.3×10-184.5×10-292.9×10-296.60×10-61.6× 10-53.3× 10-87.1× 10-94.33×10-9*Be(OH) 2(无定-22形) 1.6×10*Ca(OH) 2 5.5×10-6*Cd(OH) 2 5.27×10-15**Co(OH) 2(粉红-15色) 1.09×10**Co(OH) 2(蓝色)5.92×10-15*Co(OH) 3 1.6×10-44*Cr(OH) 2 2× 10-16*Cr(OH) 3 6.3×10-31*Cu(OH) 2 2.2×10-20*Fe(OH) 2 8.0×10-16*Fe(OH) 3 4× 10-38*Mg(OH) 2 1.8×10-11*Mn(OH) 2 1.9×10-13*Ni(OH) 2(新制-15备) 2.0×10*Pb(OH) 2 1.2×10-15*Sn(OH) 2 1.4×10-28-4*Cu 2 S-482.5×10*CuS 6.3×10-36*FeS 6.3×10-18*HgS (黑色) 1.6×10-52*HgS (红色)4× 10-53*MnS( 晶形 ) 2.5×10-13**NiS 1.07×10-21*PbS 8.0×10-28*SnS 1× 10-25**SnS 2 2× 10-27**ZnS 2.93×10-25磷酸盐1.4×10-163 4*Ag PO*AlPO 4 6.3×10-19*CaHPO 4 1× 10-73 4 2 2.0×10-29*Ca (PO )-33碳酸盐2 3 8.45×10-12Ag CO*BaCO 3 5.1× 10-9 CaCO 3 3.36×10-9 CdCO 3 1.0×10-12 *CuCO 3 1.4×10-10 FeCO3 3.13×10-11 Hg 2CO3 3.6×10-17 MgCO 3 6.82×10-6*Sr(OH) 2 9× 10*Zn(OH) 2 1.2×10-17草酸盐2 2 45.4×10-12Ag C O 1.6×10-7*BaC O*CaC2O4·H2O×-94 10CuC2O 4 4.43×10-102O4·2H2O×-7*FeC 3.2 10Hg2C2O4 1.75×10-13**Cd 3 4 ) 22.53×10(PO1.40×10-37Cu 3 (PO4)24·2H2 ×-16FePO O 9.91 10*MgNH 4 4 2.5×10-13PO3 4 21.04×10-24Mg (PO )*Pb 3(PO4)2 8.0×10-43*Zn 3(PO4)2 9.0×10-33其它盐*[Ag +][Ag(CN) 2-] 7.2×10-11MnCO 3× -11 2 O 4· 2H 2O × -6 *Ag 46] × -412.24 10 MgC 4·2H 2 4.83 10[Fe(CN)1.6 10NiCO 3×-7 2 O O × -7*Cu 26]×-161.42 10 MnC 1.7010 [Fe(CN) 1.3 10 *PbCO 37.4×10-14**PbC 2O 48.51×10-10AgSCN1.03×10-12SrCO 3×-10*SrC 2O 4·H 2×-7CuSCN×-155.6 10O 1.6 104.8 10ZnCO 3×-102 O 4·2H2O ×-9*AgBrO 3×-51.4610ZnC1.38105.3 10铬酸盐硫酸盐*AgIO 3× -82·H 23.01024×-1224× -5Cu(IO 3 ) O×-8Ag CrO 1.1210*Ag SO 1.4 107.4 10*Ag 2Cr 2 O 72.0× 10-7*BaSO 41.1×10-10**KHC 4H 4O 6(酒石酸氢 3× 10-4钾 )*BaCrO 4 1.2×10-10 *CaSO 4 9.1×10-6 **Al(8- 羟基喹啉 )35× 10-33 *CaCrO 4 7.1× 10-4 Hg 2SO 4 6.5×10-7 *K 2Na[Co(NO 2)6]· H 2O 2.2×10-11 *CuCrO 4 3.6× 10-6 *PbSO 4 1.6×10-8 *Na(NH 4)2[Co(NO 2)6] 4× 10-12 *Hg 2CrO 42.0× 10-9*SrSO 43.2×10-7**Ni( 丁二酮肟 )24× 10-24*PbCrO4-13硫化物**Mg(8- 羟基喹啉 )2-162.8×104× 10*SrCrO 4 -5 2 -50 **Zn(8- 羟基喹啉 ) 2-252.2× 10 *Ag S 6.3×105× 10 摘 自 David R.Lide, Handbook of Chemistry and Physics, 78th. edition, 1997-1998* 摘自 J.A.Dean Ed. Lange's Handbook of Chemistry, 13th. edition 1985** 摘自其他参考书。
化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=B aSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
化合物的溶度积常数表化合物的溶度积常数表化合物溶度积化合物溶度积化合物溶度积醋酸盐氢氧化物*CdS 8.0×10-27 **AgAc 1.94×10-3*AgOH 2.0×10-8*CoS(α-型) 4.0×10-21卤化物*Al(OH)3(无定形)1.3×10-33*CoS(β-型)2.0×10-25*AgBr 5.0×10-13*Be(OH)2(无定形)1.6×10-22*Cu2S2.5×10-48*AgCl 1.8×10-10*Ca(OH)2 5.5×10-6*CuS 6.3×10-36 *AgI 8.3×10-17*Cd(OH)2 5.27×10-15*FeS 6.3×10-18BaF2 1.84×10-7**Co(OH)2(粉红色)1.09×10-15*HgS(黑色) 1.6×10-52*CaF2 5.3×10-9**Co(OH)2(蓝色) 5.92×10-15*HgS(红色)4×10-53 *CuBr 5.3×10-9*Co(OH)3 1.6×10-44*MnS(晶形) 2.5×10-13 *CuCl 1.2×10-6*Cr(OH)22×10-16**NiS 1.07×10-21 *CuI 1.1×10-12*Cr(OH)3 6.3×10-31*PbS 8.0×10-28 *Hg2Cl2 1.3×10-18*Cu(OH)2 2.2×10-20*SnS 1×10-25 *Hg2I2 4.5×10-29*Fe(OH)28.0×10-16**SnS22×10-27 HgI2 2.9×10-29*Fe(OH)34×10-38**ZnS 2.93×10-25 PbBr2 6.60×10-6*Mg(OH)2 1.8×10-11磷酸盐*PbCl2 1.6×10-5*Mn(OH)2 1.9×10-13*Ag3PO4 1.4×10-16PbF2 3.3×10-8*Ni(OH)2(新制备)2.0×10-15*AlPO4 6.3×10-19*PbI27.1×10-9*Pb(OH)2 1.2×10-15*CaHPO41×10-7 SrF2 4.33×10-9*Sn(OH)2 1.4×10-28*Ca3(PO4)2 2.0×10-29碳酸盐*Sr(OH)29×10-4**Cd3(PO4)2 2.53×10-33 Ag2CO38.45×10-12*Zn(OH)2 1.2×10-17Cu3(PO4)2 1.40×10-37 *BaCO3 5.1×10-9草酸盐FePO4·2H2O 9.91×10-16 CaCO3 3.36×10-9Ag2C2O4 5.4×10-12*MgNH4PO4 2.5×10-13 CdCO3 1.0×10-12*BaC2O4 1.6×10-7Mg3(PO4)2 1.04×10-24 *CuCO3 1.4×10-10*CaC2O4·H2O 4×10-9*Pb3(PO4)28.0×10-43 FeCO3 3.13×10-11CuC2O4 4.43×10-10*Zn3(PO4)29.0×10-33 Hg2CO3 3.6×10-17*FeC2O4·2H2O 3.2×10-7其它盐MgCO3 6.82×10-6Hg2C2O4 1.75×10-13*[Ag+][Ag(CN)2-] 7.2×10-11MnCO3 2.24×10-11MgC2O4·2H2O 4.83×10-6*Ag4[Fe(CN)6] 1.6×10-41 NiCO3 1.42×10-7MnC2O4·2H2O 1.70×10-7*Cu2[Fe(CN)6] 1.3×10-16 *PbCO37.4×10-14**PbC2O48.51×10-10AgSCN 1.03×10-12 SrCO3 5.6×10-10*SrC2O4·H2O 1.6×10-7CuSCN 4.8×10-15 ZnCO3 1.46×10-10ZnC2O4·2H2O 1.38×10-9*AgBrO3 5.3×10-5铬酸盐硫酸盐*AgIO3 3.0×10-8 Ag2CrO4 1.12×10-12*Ag2SO4 1.4×10-5Cu(IO3)2·H2O 7.4×10-8*Ag2Cr2O7 2.0×10-7*BaSO4 1.1×10-10**KHC4H4O6(酒石酸氢钾)3×10-4*BaCrO4 1.2×10-10*CaSO49.1×10-6**Al(8-羟基喹啉)35×10-33 *CaCrO47.1×10-4Hg2SO4 6.5×10-7*K2Na[Co(NO2)6]·H2O 2.2×10-11 *CuCrO4 3.6×10-6*PbSO4 1.6×10-8*Na(NH4)2[Co(NO2)6] 4×10-12 *Hg2CrO4 2.0×10-9*SrSO4 3.2×10-7**Ni(丁二酮肟)24×10-24 *PbCrO4 2.8×10-13硫化物**Mg(8-羟基喹啉)24×10-16 *SrCrO4 2.2×10-5*Ag2S 6.3×10-50**Zn(8-羟基喹啉)25×10-251997-1998* ** 摘自其他参考书。
化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。