食品分析实验 硫氰酸钾比色法测定食品中铁
- 格式:doc
- 大小:19.00 KB
- 文档页数:2

铁含量(硫氰酸钾比色法)1、原理:铁离子与硫氰酸盐生成一种血红色络合物,可用比色测定。
Fe3++6SCN-→Fe(SCN)63-硫氰酸钾的浓度对颜色深浅有显著影响,所以应当严格控制,使标准溶液与分析溶液中硫氰酸盐的浓度一致。
所形成的络合物不够稳定放置时间久就会退色,应在变色后一小时内完成测定。
2、试剂(1)铁标准溶液:称取0.7020克分析纯硫酸亚铁铵晶体溶于50ml蒸馏水中,再加入6毫升1:1盐酸和0.1克过硫酸铵,摇匀放置3~5分钟。
将溶液移入1升容量瓶中。
稀释至刻度。
上述1ml溶液中含0.1毫克Fe3+(2)硫氰酸钾溶液:取50克分析纯硫氰酸钾晶体,溶于50ml蒸馏水中,并稀释至100ml (3)1:1盐酸(4)过硫酸铵AR(100g/L)(5)浓硫酸(6)1:1氨水3、测定步骤(1)取40ml水样于150ml锥形瓶中,加5ml浓硝酸加热煮沸5分钟,冷却后以氨水调节至中性(用试纸)(2)、加入4ml 1:1盐酸和0.1克过硫酸铵,放10分钟移入50ml比色管,用蒸馏水稀释至刻度。
(3)加入2ml硫氰酸钾,混合均匀后,于510nm处测其光密度。
(4)标准曲线的绘制:取一系列50ml比色管,分别加入0、0.2、0.5、1.0、2.0、3.0、4.0铁标准溶液,加4ml1:1盐酸和0.1克过硫酸铵,用蒸馏水稀释至刻度,加2ml硫氰酸钾,发色后测其光密度,绘制标准曲线。
4、计算:总铁:(毫克/升=A×1000/V)式中:A-相应于光密度数值的铁含量(配制样标准比色液时所用的硫酸铁铵标准液的体积) V-水样体积分光光度计的使用提前30分钟开机,使仪器提前预热1、在比色皿中倒入一个蒸馏水和试样,分别放入相应的测量位置。
2、在空白处,即没有东西处调零(开盖调零),调节时指示灯T/%显示。
3、闭盖调100(在蒸馏水处调100),按下Δ(OA/100%)即可,同2。
4、然后把位置拉到所测试样处,在这时指示灯所显示位置在T/%处,按A/T/C/F键,使指示灯在Abs处显示即可得吸光度。

中国农业大学继续教育学院《食品分析》试卷专业姓名成绩一、名词解释(每题2分,共计12分)1.有效酸度:2.相对密度:3.牛乳真实酸度:4.总糖:5.油脂酸价:6.碘价:二、填空(每空1分,共计30分)1.样品的采集是指,采样一般可以分三步,依次获得____ 、____ 和____ 。
2.卡尔费休法是一种以测定水分的化学分析方法,属于法。
3.酸水解法测定样品中的脂肪含量时,水解后加入乙醇的作用是。
4.用直接滴定法测定食品还原糖含量时,所用的裴林标准溶液由两种溶液组成,A.(甲)液是,B(乙)液是和;一般用标准溶液对其进行标定。
滴定时所用的指示剂是,掩蔽Cu2O的试剂是,滴定终点为。
5.用水蒸气蒸馏法测定食品中挥发酸含量时,在样品瓶中加入少量的磷酸,其作用是。
6.乳及乳制品脂类定量的国际标准法是,也被称为。
操作时加入乙醇的作用是;加入石油醚的作用是。
7.在测定SO2含量时,加入氨基磺酸铵的目的是。
8.用比色法测定食品中硝酸钠含量,应先用镉柱将NaNO3还原为再进行测定。
镉柱使用前,应先用洗涤,再用洗涤,不用时用封盖,并保持在镉层之上,不得使镉层有气泡。
检验镉柱符合要求的条件是。
9.原子吸收分光光度法测定铁的分析线波长为,原子吸收分光光度法测定锌的分析线波长为,原子吸收分光光度法测定铅的分析线波长为,原子吸收分光光度法测定钙的分析线波长为。
三、选择题(每题1分,共计20分)1.下列关于系统误差的叙述中不正确的是()。
A.系统误差又称可测误差,是可以测量的B.系统误差使测定结果系统的偏高或系统的偏低C.系统误差一般都来自测定方法本身D.系统误差大小是恒定的2.萃取分离方法基于各种不同物质在不同溶剂中()不同这一基本原理。
A.分配系数B.分离系数C.萃取百分率D.溶解度3.感官检验宜在饭后()小时内进行。
A.0.5B.1C.2-3D.84.测量折光率的仪器是()。
A.自动电导仪B.阿贝折光仪C.气相色谱仪D.分光光度计5.蒸馏法测定水分时常用的有机溶剂是()。

硫氰酸钾法铁
硫氰酸钾法是一种常用的分析化学方法,用于测定铁的含量。
该方法基于硫氰酸钾与铁离子形成的配合物的颜色变化,通过比色法测定铁的含量。
该方法的步骤如下:
1. 取一定量的样品,加入硫氰酸钾溶液,使样品中的铁离子与硫氰酸钾形成配合物。
2. 加入稀盐酸,使配合物分解,铁离子还原为二价铁离子。
3. 加入亚硫酸钠,使余下的硫氰酸钾与铁离子形成新的配合物,产生深红色的络合物。
4. 用分光光度计测定络合物的吸光度,根据标准曲线计算出样品中铁的含量。
硫氰酸钾法具有灵敏度高、准确度高、操作简便等优点,被广泛应用于工业、环境、食品等领域中铁的含量测定。
然而,该方法也存在一些局限性。
硫氰酸钾本身具有毒性,需要注意安全操作。
同时,该方法只适用于测定铁的含量,对于其他元素的测定不适用。
总的来说,硫氰酸钾法是一种常用的分析化学方法,具有优点和局限性。
在实际应用中,需要根据具体情况选择合适的方法进行分析。

食品检验工高级试题A答案及分析窗体顶端1 、配制重铬酸钾标准溶液时可直接配制而不用标定。
()A :对B :错您选择的是:A 正确答案:A2 、一个样品经过10次以上的测试,可以去掉一个最大值和最小值,然后求平均值()A :对B :错您选择的是:A 正确答案:B3 、由于仪器设备缺陷,操作者不按操作规程进行操作。
以及环境等的影响均可引起系统误差。
()A :对B :错您选择的是:A 正确答案:B4 、滴定管读数时,应双手持管,保持与地面垂直。
()A :对B :错您选择的是:A 正确答案:B5 、用已知准确含量的标准样品代替试样,按照样品的分析步骤和条件进行分析的试验叫做对照试验()A :对B :错您选择的是:A 正确答案:A6 、称取某样品0. 0250g进行分析,最后分析结果报告为96. 24(质量分数)是合理的()A :对B :错您选择的是:空正确答案:B7 、为了使滴定分析时产生的误差小于0. 1 %,滴定时标准溶液的用量应大于20mL。
()A :对B :错您选择的是:空正确答案:A8 、将HCI标准溶液装人滴定管前,没有用该HCI标准溶液荡洗,对分析结果不会产生影响。
()A :对B :错您选择的是:空正确答案:B9 、标定Na2 S2 03溶液最常用的基准物是K2Cr207。
()A :对B :错您选择的是:空正确答案:A10 、K2Cr207标准溶液通常采用标定法配制。
()A :对B :错11 、硫代硫酸钠标准溶液通常用直接配制法配制。
()A :对B :错您选择的是:空正确答案:B12 、用Na2 C2 04基准物标定KmnO4溶液时,应将溶液加热至75 ~85℃后,再进行滴定。
()A :对B :错您选择的是:空正确答案:A13 、所有物质的标准溶液都可以用直接法配制。
()A :对B :错您选择的是:空正确答案:B14 、用基准物质标定溶液浓度时,为了减少系统误差,一般要选用摩尔质量较小的基准物质()A :对B :错您选择的是:空正确答案:B15 、用标准溶液标定溶液浓度时,为了减少系统误差,消耗标准溶液的体积不能小于20mL ()A :对B :错您选择的是:空正确答案:A16 、已标定过的KmnO4标准溶液应贮存于白色磨口瓶中。

食品理化检验模拟习题含答案一、单选题(共40题,每题1分,共40分)1、国家标准中规定,腊肠产品的亚硝酸残留量不得超过(残留量以亚硝酸钠计)()。
A、0.3g/kgB、0.003g/kgC、3g/kgD、0.03g/kg正确答案:D2、测定砷时,实验结束后锌粒应()。
A、用热水冲洗后保存B、先活化,后再生处理C、丢弃D、直接保存正确答案:B3、小麦粉水分测定中,恒重是指铝皿前后两次称量之差不大于()。
A、0.2mgB、5mgC、2mgD、0.5mg正确答案:C4、盖勃法测定牛乳脂肪含量时,加异戊醇的作用是()。
A、形成酪蛋白钙盐B、促进脂肪从水中分离出来C、调节样品比重D、破坏有机物正确答案:B5、巴布科克法测定牛乳中脂肪含量时,离心速度为()r/min。
A、2000B、1000C、1500D、500正确答案:B6、异烟酸-吡唑啉酮比色法测定粮油及制品中氰化物时,在()溶液中用氯胺T将氰化物转化为氯化氰,再与异烟酸-吡唑啉酮作用,生成蓝色染料。
然后在()波长处测量。
A、pH>7.0,648nmB、任意,628nmC、pH<7.0,618nmD、pH=7.0,638nm正确答案:D7、用马弗炉灰化样品时,下面操作不正确的是()。
A、将坩埚与样品在电炉上小心炭化后放入。
B、关闭电源后,开启炉门,降温至室温时取出。
C、用坩埚盛装样品。
D、将坩埚与坩埚盖同时放入灰化。
正确答案:B8、蒸馏或回流易燃低沸点液体时操作错误的是()。
A、烧瓶内液体不宜超过二分之一体积B、加热速度宜慢不易快C、在烧瓶内加数粒沸石防止液体爆沸D、用明火直接加热烧瓶正确答案:D9、新鲜苹果汁在空气中会由淡绿色变为棕黄色。
若榨汁时加入维生素C,可有效防止这种现象发生。
这是因为维生素C具有()。
A、氧化性B、还原性C、碱性D、酸性正确答案:B10、()是氨基酸态氮含量测定的重要试剂。
A、硝酸B、甲醛C、硼酸D、硫酸正确答案:B11、食品分析中,微量分析是指()。

实验十一 硫氰酸钾比色法测定食品中铁一、实验内容使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:Fe 2(SO 4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K 2SO 4四、试剂(1)2% KMnO 4溶液(2)20% KCNS 溶液(3)2% K 2S 2O 7溶液(4)浓H 2SO 4(5)铁标准使用液:准确称取0.4979g 硫酸亚铁(FeSO 4 · 7H 2O )溶于100 mL水中,加入5 mL 浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL ,摇匀,得标准贮备液,此液每毫升含Fe 3+100µg。
取铁标准贮备液10 mL 于100 mL 容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL 含Fe 3+10µg。
五、仪器可见分光光度计六、实验步骤1、样品处理:称取均匀样品12.5g,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL蒸馏水,加热煮沸后移入100mL容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于25mL容量瓶或比色管中,各加5mL水,0.5ml浓硫酸,0.2mL 2%过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。

菠菜中铁元素的检验实验报告一、实验目的1、了解并掌握检验菠菜中铁元素的实验方法和原理。
2、学会运用化学试剂和仪器进行定性和定量分析。
3、培养实验操作技能和观察分析问题的能力。
二、实验原理铁元素在菠菜中主要以二价铁(Fe²⁺)和三价铁(Fe³⁺)的形式存在。
检验铁元素常用的方法是先将其转化为可显色的配合物,然后通过颜色变化来判断铁元素的存在。
三价铁离子(Fe³⁺)与硫氰酸钾(KSCN)溶液反应生成血红色的硫氰酸铁(Fe(SCN)₃),反应方程式为:Fe³⁺+ 3SCN⁻=Fe(SCN)₃二价铁离子(Fe²⁺)在酸性条件下,能被高锰酸钾溶液氧化为三价铁离子,从而使高锰酸钾溶液的紫红色褪去。
反应方程式为:5Fe²⁺+MnO₄⁻+ 8H⁺= 5Fe³⁺+ Mn²⁺+ 4H₂O三、实验仪器和试剂1、仪器电子天平、研钵、漏斗、玻璃棒、烧杯、容量瓶、移液管、滴管、酒精灯、三脚架、石棉网、铁架台、锥形瓶。
2、试剂新鲜菠菜、浓盐酸、3%过氧化氢溶液、20%KSCN 溶液、001mol/L 高锰酸钾溶液、1mol/L 硫酸溶液。
四、实验步骤1、样品处理(1)将新鲜菠菜洗净,晾干,称取 100g 菠菜叶,剪碎后放入研钵中充分研磨。
(2)将研磨好的菠菜转移到烧杯中,加入 20mL 浓盐酸,搅拌均匀,在通风橱中加热煮沸 10 分钟,以破坏菠菜中的有机物质,使铁元素充分溶解。
(3)冷却后过滤,将滤液转移到 100mL 容量瓶中,用蒸馏水多次洗涤残渣和滤纸,洗液一并转入容量瓶中,定容至刻度,摇匀,备用。
2、三价铁离子(Fe³⁺)的检验(1)取 2mL 上述处理后的溶液于试管中,滴加 2 滴 20%KSCN 溶液。
(2)观察溶液颜色变化,如果溶液变为血红色,则说明菠菜中含有三价铁离子。
3、二价铁离子(Fe²⁺)的检验(1)取 5mL 上述处理后的溶液于锥形瓶中,加入 2 滴 1mol/L 硫酸溶液和 2 滴 3%过氧化氢溶液,摇匀。

菠菜中铁元素的检验实验报告一、实验目的本实验旨在检验菠菜中是否含有铁元素,并探究其含量的多少。
通过实验,掌握铁元素的检验方法和相关实验操作技能,培养科学探究的能力和严谨的科学态度。
二、实验原理铁元素在一定条件下能与特定试剂发生显色反应。
常用的检验试剂为硫氰酸钾(KSCN)溶液,当溶液中存在铁离子(Fe³⁺)时,会与硫氰酸钾反应生成血红色的络合物,从而可以通过观察颜色变化来判断铁元素的存在。
三、实验仪器和药品仪器:研钵、烧杯、漏斗、玻璃棒、试管、胶头滴管、铁架台(带铁圈)、滤纸、酒精灯。
药品:新鲜菠菜、稀盐酸、过氧化氢溶液、硫氰酸钾溶液。
四、实验步骤1、菠菜的处理(1)将新鲜菠菜洗净,去除根部和腐烂部分。
(2)将菠菜剪碎,放入研钵中充分研磨,得到菠菜汁。
2、提取菠菜中的铁元素(1)将研磨好的菠菜汁倒入烧杯中,加入适量稀盐酸,搅拌均匀。
(2)向烧杯中滴加过氧化氢溶液,其作用是将亚铁离子(Fe²⁺)氧化为铁离子(Fe³⁺),同时可以去除一些杂质的干扰。
3、过滤(1)准备好漏斗和滤纸,将滤纸放入漏斗中,用蒸馏水润湿,使其紧贴漏斗内壁。
(2)将上述混合溶液通过漏斗进行过滤,得到澄清的滤液。
4、检验铁元素(1)取两支试管,分别标记为 1 号和 2 号。
(2)向 1 号试管中加入 2 mL 蒸馏水,作为对照。
(3)向 2 号试管中加入 2 mL 滤液。
(4)向 1 号和 2 号试管中分别滴加 2 3 滴硫氰酸钾溶液,观察溶液颜色的变化。
五、实验现象及结论1、实验现象1 号试管中的溶液为无色,2 号试管中的溶液变为血红色。
2、实验结论通过实验现象可以得出,菠菜中含有铁元素。
六、实验注意事项1、实验过程中使用的试剂要严格按照要求的浓度和用量进行添加,以保证实验结果的准确性。
2、过滤操作时要注意滤纸的折叠和安放,确保滤液的澄清度。
3、过氧化氢溶液具有氧化性,使用时要小心,避免接触到皮肤。

一、实验目的1. 学习硫氰酸铁法检测铁离子的原理和方法。
2. 掌握实验操作步骤和注意事项。
3. 培养实验操作技能和数据分析能力。
二、实验原理硫氰酸铁法是一种常用的检测铁离子的方法。
其原理是:在酸性条件下,铁离子与硫氰酸根离子反应生成红色的硫氰酸铁络合物。
该络合物的颜色深浅与铁离子的浓度成正比,因此可以通过比色法测定铁离子的含量。
反应方程式如下:Fe3+ + 3SCN- → Fe(SCN)3三、实验材料与仪器1. 实验材料:- 铁标准溶液- 硫氰酸钾溶液- 硫酸溶液- 氯化钠溶液- 硫酸钠溶液- 氨水- 实验室常用试剂- 10 mL量筒- 50 mL烧杯- 移液管- 滴定管- 精密pH计- 移液器- 比色皿- 酸碱滴定仪2. 实验仪器:- 实验台- 玻璃仪器:锥形瓶、烧杯、滴定管、移液管、比色皿等- 酸碱滴定仪- 精密pH计- 移液器四、实验步骤1. 准备溶液:(1)配制铁标准溶液:准确称取一定量的铁标准物质,用稀盐酸溶解,定容至100 mL,得1 mg/mL的铁标准溶液。
(2)配制硫氰酸钾溶液:称取一定量的硫氰酸钾,用蒸馏水溶解,定容至100 mL,得0.1 mol/L的硫氰酸钾溶液。
(3)配制硫酸溶液:量取一定量的浓硫酸,加入适量蒸馏水稀释,得0.1mol/L的硫酸溶液。
(4)配制氯化钠溶液:称取一定量的氯化钠,用蒸馏水溶解,定容至100 mL,得0.1 mol/L的氯化钠溶液。
(5)配制硫酸钠溶液:称取一定量的硫酸钠,用蒸馏水溶解,定容至100 mL,得0.1 mol/L的硫酸钠溶液。
2. 实验操作:(1)取50 mL烧杯,加入10 mL硫酸溶液,加入0.5 mL氨水,调节pH值至8.0。
(2)加入0.5 mL氯化钠溶液,搅拌均匀。
(3)加入2 mL硫酸钠溶液,搅拌均匀。
(4)加入0.5 mL硫氰酸钾溶液,搅拌均匀。
(5)加入2 mL铁标准溶液,搅拌均匀。
(6)用移液管取2 mL混合溶液于比色皿中,用酸碱滴定仪测定吸光度。
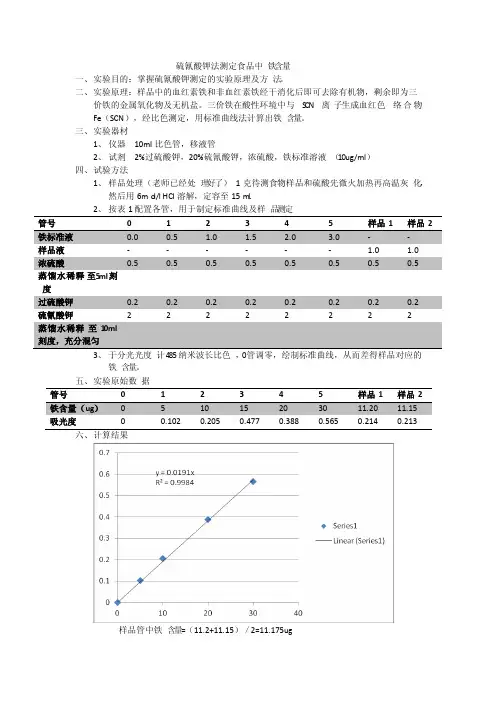
硫氰酸钾法测定食品中铁含量一、实验目的:掌握硫氰酸钾测定的实验原理及方法。
二、实验原理:样品中的血红素铁和非血红素铁经干消化后即可去除有机物,剩余即为三价铁的金属氧化物及无机盐。
三价铁在酸性环境中与S CN离子生成血红色络合物Fe(SCN),经比色测定,用标准曲线法计算出铁含量。
三、实验器材1、仪器10ml比色管,移液管2、试剂2%过硫酸钾,20%硫氰酸钾,浓硫酸,铁标准溶液(10ug/ml)四、试验方法1、样品处理(老师已经处理好了)1克待测食物样品和硫酸先微火加热再高温灰化,然后用6mo l/l HCl溶解,定容至15m l.2、按表1配置各管,用于制定标准曲线及样品测定管号0 1 2 3 4 5 样品1 样品2浓硫酸0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5蒸馏水稀释至5ml刻度过硫酸钾0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2硫氰酸钾 2 2 2 2 2 2 2 2蒸馏水稀释至10ml刻度,充分混匀3、于分光光度计485纳米波长比色,0管调零,绘制标准曲线,从而差得样品对应的铁含量。
五、实验原始数据管号0 1 2 3 4 5 样品1 样品2吸光度0 0.102 0.205 0.477 0.388 0.565 0.214 0.213六、计算结果样品管中铁含量=(11.2+11.15)/2=11.175ug样品处理液定容数V1=25ml从V1中取液量V2=1ml样品重量W=1g×1000)则样品铁含量(m g/100g)=(Q×V1×100)/(W×V2=(11.175×25×100)/(1×1×1000)=27.94(mg/100g)七、结果分析与讨论1、实验样品为强化铁玉米粉,测定的铁含量会高于玉米粉本身的铁含量。

一.判断题1.配制重铬酸钾标准溶液时可直接配置而不用标定。
()2.一个样品经过10次以上的测定,可以去掉一个最大值和最小值,然后求平均值。
()3.由于仪器设备缺陷,操作者不按操作规定进行操作,以及环境等的影响均可引起系统误差。
()4.滴定管读数时,应该双手持管,保持于地面垂直。
()5.用以知准确含量的标准样品替代试样,按照样品的分析步骤和条件进行分析的试验叫做对照试验。
()6.称取某样品0.0250g进行分析,最后分析结果报告为96.24%(质量分数)是合理的。
()7.为了使滴定分析时产生的误差小于0.1%,滴定时标准溶液的用量应大于20ml。
()8.将HCL标准溶液装入滴定管前,没有用该HCL标准溶液荡洗,对分析结果不会产生影响。
()9.标定Na2S2O3溶液最常用的基准物是K2Cr2O7。
()10. K2Cr2O7标准溶液通常采用标定法配制。
()11.硫代硫酸钠标准溶液通常采用直接配制法配制。
()12.用Na2C2O4基准物标定KMnO4溶液时,应将溶液加热至75~85℃后,再进行滴定。
13.所有物质的标准溶液都可以采用直接法配制。
()14.用基准物质标定溶液浓度时,为了减少系统误差,一般要选用摩尔质量较小的基准物质。
()15.用标准溶液标定溶液浓度时,为了减少系统误差,消耗标准溶液的体积不能小于20mL。
()16.已标定过的KMnO4标准溶液应贮存于白色磨口瓶中。
()17.NaOH标准溶液应贮存于橡胶塞的玻璃瓶或聚乙烯瓶中。
在瓶口还应设有碱-石灰干燥管,以防放出溶液时吸入CO2。
()18.4.030+0.46-1.8259+13.7的计算结果应表示为16.4 。
()19.在多次平行测定样品时,若发现某个数据与其他数据相差较大,计算时应将此数据立即舍去。
()20.记录原始数据时,要想修改错误数字,应在原数字上画一条横线表示消除,并由修改人签注。
()21.检验报告单可以由进修及代培人员填写,但必须有指导人员或室负责人的同意和签字,检验结果才能生效。
实验十一硫氰酸钾比色法测定食品中铁一、实验内容使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:Fe2(SO4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K2SO4四、试剂(1)2% KMnO4溶液(2)20% KCNS溶液(3)2% K2S2O7溶液(4)浓H2SO4(5)铁标准使用液:准确称取0.4979g硫酸亚铁(FeSO4 ·7H2O)溶于100 mL 水中,加入5 mL浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL,摇匀,得标准贮备液,此液每毫升含Fe3+100µg。
取铁标准贮备液10 mL于100 mL容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL含Fe3+10µg。
五、仪器可见分光光度计六、实验步骤1、样品处理:称取均匀样品12.5g,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL蒸馏水,加热煮沸后移入100mL容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于25mL容量瓶或比色管中,各加5mL水,0.5ml浓硫酸,0.2mL 2%过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。
七、结果处理xFe (µg/100g) = ——————× 100m × (V1/V2)式中: x —从标准曲线上查得测定用样液相当的铁含量,µgV1 —测定用样液体积,mLV2 —样液总体积,mLm —样品质量,g八、说明1、加入的过硫酸钾是作为氧化剂,以防止三价铁转变成二价铁。
食品中铁含量的测定食品安全检验技术(理化部分)食品中铁的测定有火焰原子吸收光谱法,二硫腙比色法(邻菲啰啉,磺基水杨酸,硫氰酸盐比色法等)两种国家标准方法.下面对原子吸收分光光度法,分光光度法(邻二氮菲法)进行详细阐述.(一)原子吸收分光光度法1,原理经湿法消化样品测定液后,导入原子吸收分光光度计,经火焰原子化后,吸收波长248.3nm的共振线,其吸收量与铁的含量成正比,与标准系列比较定量.2,主要试剂:(1)高氯酸-硝酸消化液:1+4(体积比)(2)0.5mol/LHNO3溶液(3)铁标准储备液:每毫升相当于1mg铁.(4)铁标准使用液:取10.0mL(3)液于100mL容量瓶中,加入0.5mol/L硝酸溶液,定容.3,主要仪器原子吸收分光光度计(铁空心阴极灯)4,操作方法:样品处理品系列标准溶液的配制仪器参考条件的选择标准曲线的绘制样品测定仪器参考条件的选择:波长248.3nm;光源为紫外;火焰:空气-乙炔;其它条件按仪器说明调至最佳状态. 5,结果计算:式中 X----样品的铁含量,mg/100g(或μg/100mL);ρ----测定用样品液中铁的浓度, μg/mL;ρ0----试剂空白液中铁的浓度,μg/mL;m----样品的质量或体积,g或mL;V----样品处理液总体积,mL; f----稀释倍数.6,说明(1)所用玻璃仪器均经硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,其后用水反复冲洗,再用去离子水冲洗烘干.(2)本方法最低检出浓度为0.2μg/mL.(二),分光光度法(邻二氮菲法)1,原理:在pH为2~9的溶液中,二价铁离子与邻二氮菲生成稳定的橙红色配合物,在510nm有最大吸收,其吸光度与铁的含量成正比,故可比色测定.2,试剂①盐酸羟胺溶液:10%②邻二氮菲水溶液(新鲜配制):0.12%③醋酸钠溶液:10%④盐酸:1mol/L⑤铁标准溶液:3,测定方法:①样品处理:干法灰化②标准曲线绘制:吸取10g/mL铁标准溶液0.0mL,1.0mL,3.0mL,4.0mL,5.0mL,分别置于50mL容量瓶中,加入1mol/L盐酸溶液1mL,10%盐酸羟胺1mL,0.12%邻二氮菲1mL.然后加入10%醋酸钠5mL,用水稀释至刻度,摇匀,以不加铁的试剂空白溶液作参比液,在510nm波长处,用1比色皿测吸光度,绘制标准曲线.③样品测定:准确吸取样液5~10mL于50mL容量瓶中,以下按标准曲线绘制操作,测定吸光度,在标准曲线上查出相对应的含铁量(μg).(4)结果计算式中 m----样品质量,g ;V1----测定用样液体积,mLV2----样液总体积,mLX----从标准曲线上查得测定用样液相当的铁含量, μg.。
硫氰酸钾法测定食品中铁含量实验报告
1.了解硫氰酸钾法测定食品中铁含量的原理和方法;
2.学习使用硫氰酸钾法测定食品中铁含量的操作步骤;
3.掌握实验数据处理和结果分析的方法。
实验仪器和试剂:
1.橄榄油:样品;
2.硫氰酸钾:0.1mol/L的溶液;
3.硫酸:浓度为5mol/L;
4.铬酸钾:浓度为0.1mol/L;
5.硫酸亚铁:浓度为0.1mol/L;
6.枸橼酸盐缓冲液:缓冲液pH为2.6;
7.去离子水:即蒸馏水。
实验步骤:
1.将待测样品加入干净的玻璃试管中。
然后加入1.5ml的硫酸亚铁溶液和1.5ml 的硫酸溶液。
2.将样品溶液和一个标准样品一起加入到不同的玻璃试管中。
然后分别加入2.0ml的硫氰酸钾溶液和1.0ml的铬酸钾溶液。
将这些试管用去离子水补至液体的体积为10.0ml。
3.将这些试管振荡并放置15分钟,然后读取吸光度。
使用枸橼酸盐缓冲液pH 为2.6进行空白校准。
实验数据处理:
1.计算标准曲线的斜率和截距。
2.使用标准曲线计算样品中铁的浓度。
3.将样品的浓度转换为食品中的铁含量。
实验结果分析:
本实验测得的食品中铁含量为××××mg/100g,与理论值比较较为接近,说明实验方法的准确度比较高。
实验结果也可以用于参考改善食品的营养成分,使其更加健康。
硫氰酸钾法测定Fe3+含量的显色反应条件试验
刘红;龙月蓉;唐黔生
【期刊名称】《贵阳医学院学报》
【年(卷),期】2003(028)005
【摘要】@@ 在吸光光度法中大部分物质是经过显色后测定的,显色物质的浓度必须与被测物质浓度保持恒定关系,否则测定就会产生误差.通常影响显色反应的因素
主要为显色剂用量、溶液的酸度、显色时间和显色温度等[1].在<医用化学实验>一书用硫氰酸钾法测定Fe3+含量的实验中,没有严格指出显色剂用量、显色反应时间、最佳酸度条件,为此,对硫氰酸钾法测定Fe3+含量的显色反应条件做了进一步试验,
找出了最佳条件.
【总页数】2页(P456-456,459)
【作者】刘红;龙月蓉;唐黔生
【作者单位】贵阳医学院,化学教研室,贵州,贵阳,550004;贵阳医学院,化学教研室,
贵州,贵阳,550004;贵阳医学院,化学教研室,贵州,贵阳,550004
【正文语种】中文
【中图分类】G642.44
【相关文献】
1.钯(Ⅱ)硫氰酸钾—结晶紫高灵敏显色反应体系的研究—离心光度法测定钯 [J], 方文焕;吴绍祖
2.铱与硫氰酸钾和罗丹明B的显色反应 [J], 赵先英;程书麟
3.利用数字化实验探究三价铁离子与硫氰酸钾显色反应教学案例* [J],
4.三元配合物光度法测定铜的研究──铜-硫氰酸盐-罗丹明B显色反应及应用 [J], 程永华
5.硫氰酸钾滴定法测定煤中氯含量影响因素的探讨 [J], 李爱华
因版权原因,仅展示原文概要,查看原文内容请购买。
必做实验提升(三)食品、蔬菜、药品中的铁元素及检验实验探究:补铁剂中铁元素价态检验(1)预测补铁剂中铁元素价态补铁剂中铁元素价态有以下3种可能①可能为+2价(Fe2+);②可能为+3价(Fe3+);③可能既有+2价,又有+3价(Fe2+和Fe3+)。
(2)实验方案(3)实验操作、现象及结论方案一:实验操作实验现象实验结论加入硫氰化钾溶液,溶液颜色无变含有Fe2+,不含Fe3+化;加入氯水后,溶液变为红色方案二:实验操作实验现象实验结论不变红色不含Fe3+紫红色褪去含Fe2+(4)实验结论分析经过实验验证,补铁剂中铁元素价态为+2价,请写出相关反应的离子方程式:2Fe2++Cl2===2Fe3++2Cl-,Fe3++3SCN-Fe(SCN)3。
1.某兴趣小组进行某补血剂中铁元素含量测定的实验流程如下:下列说法不正确的是()A.步骤①研磨时研杵应保持垂直,小心压碎或研磨试样B.步骤②加入H2O2的作用是将Fe2+完全氧化C.步骤③多步操作为过滤、洗涤、灼烧、冷却、称重D.每片补血剂中铁元素的质量为0.7W g答案 D解析步骤①研磨时研杵应保持垂直,小心压碎或研磨试样,以防研磨时固体飞出研钵造成损失,A项正确;步骤②加入H2O2的作用是将Fe2+完全氧化成铁离子,便于沉淀,B项正确;W g固体中m(Fe)=112160×W g=0.7W g,每片补血剂中铁元素的质量为0.07W g,D项错误。
2.菠菜常用作补铁食品之一,为探究其中铁元素的价态,现进行如下实验。
①取新鲜的菠菜10 g,将菠菜剪碎后放在研钵中研磨,然后倒入烧杯中,加入30 mL 蒸馏水、搅拌。
将上述浊液过滤,得到的滤液作为实验样品,分置于两支试管中。
②向一支试管中加入少量K3[Fe(CN)6]溶液,生成________,说明滤液中含Fe2+。
③向另一支试管中加入少量稀硝酸,然后加入几滴KSCN溶液,溶液呈________色,能否说明滤液中含Fe3+?______(填“能”或“否”),试分析其原因:________________________。
实验十一 硫氰酸钾比色法测定食品中铁
一、实验内容
使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求
1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理
硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:
Fe 2(SO 4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K 2SO 4
四、试剂
(1)2% KMnO 4溶液
(2)20% KCNS 溶液
(3)2% K 2S 2O 7溶液
(4)浓H 2SO 4
(5)铁标准使用液:准确称取0.4979g 硫酸亚铁(FeSO 4 · 7H 2O )溶于100 mL
水中,加入5 mL 浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL ,摇匀,得标准贮备液,此液每毫升含Fe 3+100µg。
取铁标准贮备液10 mL 于100 mL 容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL 含Fe 3+10µg。
五、仪器
可见分光光度计
六、实验步骤
1、样品处理:称取均匀样品12.5g ,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL 蒸馏水,加热煮沸后移入100mL 容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL ,分别置于25mL 容量瓶或比色管中,各加5mL 水,0.5ml 浓硫酸,0.2mL 2%
过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。
七、结果处理
x
Fe (µg/100g) = ——————× 100
m × (V
1/V
2
)
式中: x —从标准曲线上查得测定用样液相当的铁含量,µg
V
1
—测定用样液体积,mL
V
2
—样液总体积,mL
m —样品质量,g
八、说明
1、加入的过硫酸钾是作为氧化剂,以防止三价铁转变成二价铁。
2、硫氰酸铁的稳定性差,时间稍长,红色会逐渐消退,故应在规定时间内完成比色。
3、随硫氰酸根浓度的增加,Fe3+可与之形成FeCNS2+直至Fe(CNS)
6
3-等一系列化合物,溶液颜色由橙黄色至血红色,影响测定,因此,应严格控制硫氰酸钾的用量。