2015年下期化学第三单元原子结构考试题
(总分75分)
班级____姓名________
得分:
相对原子质量:H—1 C—12 N —14 O—16 S—32 Ca—40 Fe—56 Mg—24 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 答案
一、选择题(每小题3分,共30分)
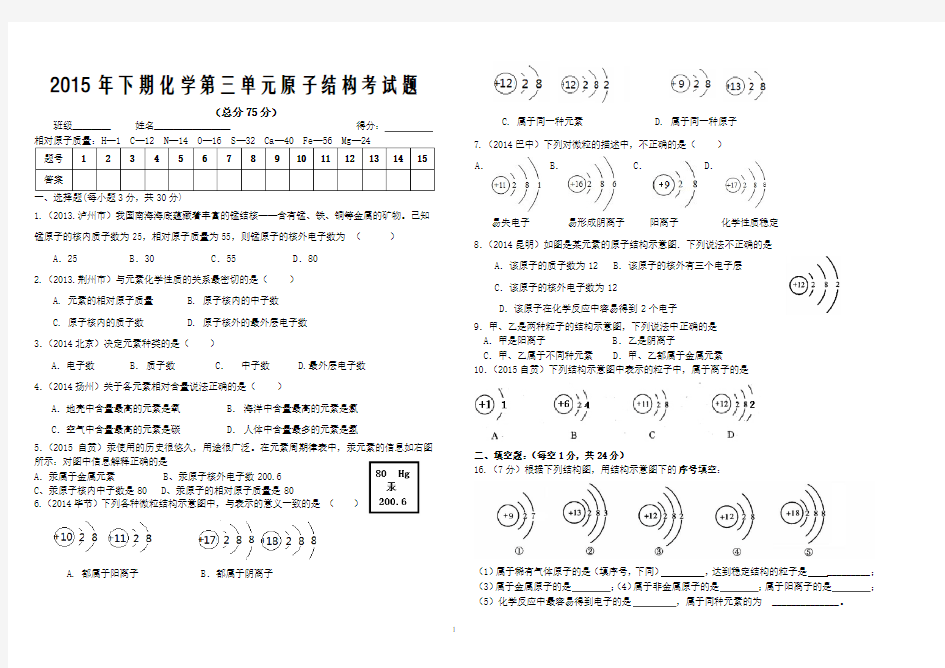
1.(2013.泸州市)我国南海海底蕴藏着丰富的锰结核——含有锰、铁、铜等金属的矿物。已知锰原子的核内质子数为25,相对原子质量为55,则锰原子的核外电子数为()A.25 B.30 C.55 D.80
2.(201
3.荆州市)与元素化学性质的关系最密切的是()
A. 元素的相对原子质量
B. 原子核内的中子数
C. 原子核内的质子数
D. 原子核外的最外层电子数
3.(2014北京)决定元素种类的是()
A.电子数B.质子数C.中子数 D.最外层电子数
4.(2014扬州)关于各元素相对含量说法正确的是()
A.地壳中含量最高的元素是氧B.海洋中含量最高的元素是氯
C.空气中含量最高的元素是碳D.人体中含量最多的元素是氢
5.(2015自贡)汞使用的历史很悠久,用途很广泛。在元素周期律表中,汞元素的信息如右图所示:对图中信息解释正确的是
A.汞属于金属元素 B、汞原子核外电子数200.6
C、汞原子核内中子数是80
D、汞原子的相对原子质量是80
6.(2014毕节)下列各种微粒结构示意图中,与表示的意义一致的是()
A. 都属于阳离子 B.都属于阴离子
C. 属于同一种元素
D. 属于同一种原子
7.(2014巴中)下列对微粒的描述中,不正确的是()
A.
易失电子
B.
易形成阴离子
C.
阳离子
D.
化学性质稳定
8.(2014昆明)如图是某元素的原子结构示意图.下列说法不正确的是
A.该原子的质子数为12 B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
9.甲、乙是两种粒子的结构示意图,下列说法中正确的是
A.甲是阳离子 B.乙是阴离子
C.甲、乙属于不同种元素 D.甲、乙都属于金属元素
10.(2015自贡)下列结构示意图中表示的粒子中,属于离子的是
二、填空题:(每空1分,共24分)
16.(7分)根据下列结构图,用结构示意图下的序号填空:
(1)属于稀有气体原子的是(填序号,下同),达到稳定结构的粒子是 _________;(3)属于金属原子的是;(4)属于非金属原子的是;属于阳离子的是;(5)化学反应中最容易得到电子的是,属于同种元素的为______________。
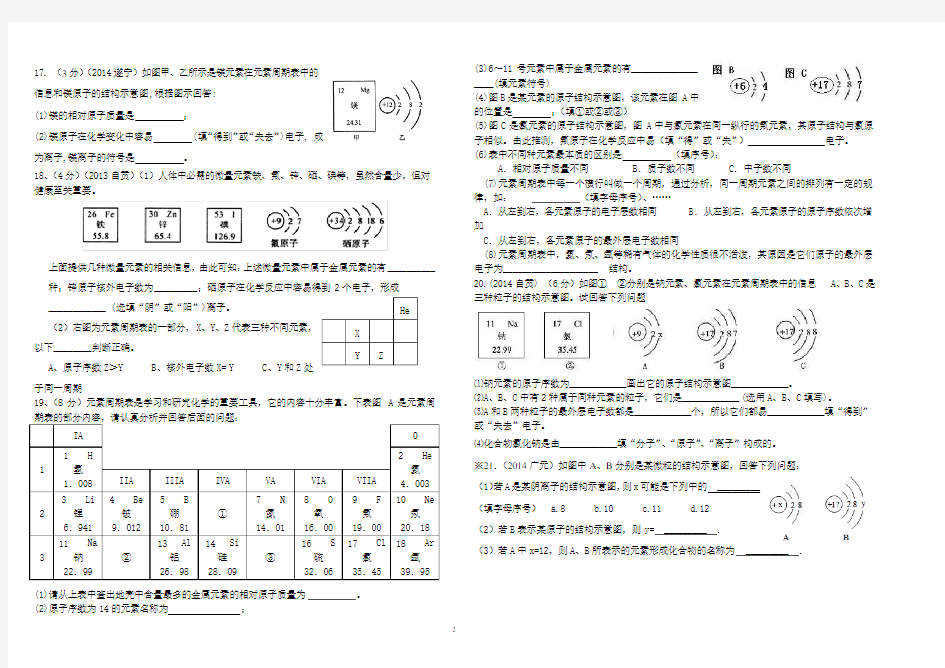
17. (3分)(2014遂宁)如图甲、乙所示是镁元素在元素周期表中的
信息和镁原子的结构示意图,根据图示回答:
(1)镁的相对原子质量是;
(2)镁原子在化学变化中容易 (填“得到”或“失去”)电子, 成
为离子,镁离子的符号是。
18、(4分)(2013自贡)(1)人体中必需的微量元素铁、氟、锌、硒、碘等,虽然含量少,但对健康至关重要。
上面提供几种微量元素的相关信息,由此可知:上述微量元素中属于金属元素的有__________种;锌原子核外电子数为_________;硒原子在化学反应中容易得到2个电子,形成
____________ (选填“阴”或“阳”)离子。
(2)右图为元素周期表的一部分,X、Y、Z代表三种不同元素,
以下________判断正确。
A、原子序数Z>Y
B、核外电子数X= Y
C、Y和Z处
于同一周期
期表的部分内容,请认真分析并回答后面的问题:
IA 0
1 1 H
氢
1.008
2 He
氦
4.003 IIA IIIA IVA VA VIA VIIA
2 3 Li
锂
6.941
4 Be
铍
9.012
5 B
硼
10.81
①
7 N
氮
14.01
8 O
氧
16.00
9 F
氟
19.00
10 Ne
氖
20.18
3 11 Na
钠
22.99
②
13 Al
铝
26.98
14 Si
硅
28.09
③
16 S
硫
32.06
17 Cl
氯
35.45
18 Ar
氩
39.95
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为。
(2)原子序数为14的元素名称为;
(3)6~11号元素中属于金属元素的有_______
__(填元素符号)
(4)图B是某元素的原子结构示意图,该元素在图A中
的位置是;(填①或②或③)
(5)图C是氯元素的原子结构示意图,图A中与氯元素在同一纵行的氟元素,其原子结构与氯原
子相似。由此推测,氟原子在化学反应中易(填“得”或“失”)电子。
(6)表中不同种元素最本质的区别是(填序号):
A.相对原子质量不同 B.质子数不同 C.中子数不同
(7)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规
律,如:(填字母序号)、……
A.从左到右,各元素原子的电子层数相同 B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(8)元素周期表中,氦、氖、氩等稀有气体的化学性质很不活泼,其原因是它们原子的最外层
电子为____________________ 结构。
20.(2014自贡) (6分)如图①②分别是钠元素、氯元素在元素周期表中的信息A、B、C是
三种粒子的结构示意图。试回答下列问题
⑴钠元素的原子序数为______画出它的原子结构示意图______。
⑵A、B、C中有2种属于同种元素的粒子,它们是______(选用A、B、C填写)。
⑶A和B两种粒子的最外层电子数都是______个,所以它们都易______填“得到”
或“失去”电子。
⑷化合物氯化钠是由______填“分子”、“原子”、“离子”构成的。
※21.(2014广元)如图中A、B分别是某微粒的结构示意图,回答下列问题:
(1)若A是某阴离子的结构示意图,则x可能是下列中的_________
(填字母序号) a.8 b.10 c.11 d.12
(2)若B表示某原子的结构示意图,则y= _________ .
(3)若A中x=12,则A、B所表示的元素形成化合物的名称为_________ .
He
X
Y Z
第一章《原子结构与性质》单元测试题 第Ⅰ卷(选择题共48分) 一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)1.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是 A.只有①B.只有②C.只有③D.①②③ 2.下列能级中轨道数为3的是 A.S能级B.P能级C.d能级D.f能级 3.下列各原子或离子的电子排布式错误的是 A.Al 1s22s22p63s23p1B.S2-1s22s22p63s23p4 C.Na+1s22s22p6D.F 1s22s22p5 4.具有下列电子排布式的原子中,半径最大的是 A.ls22s22p63s23p1B.1s22s22p3C.1s22s2sp2D.1s22s22p63s23p4 5.生活中的下列现象与原子核外电子发生跃迁无关的是 A.焰色反应B.节日里燃放的焰火C.金属导线可以导电D.夜空中的激光 6.某元素的电离能( 此元素位于元素周期表的族数是 A.ⅡA B.ⅢA C.ⅤA D.ⅣA 7.元素电负性随原子序数的递增而增强的是 A.Na<K<Rb B.N<P<As C.O <S <Cl D.Si <P <Cl 8.对Na、Mg、Al的有关性质的叙述正确的是 A.碱性:NaOH
原子结构习题精选一 一、选择题 1.据报道,科学家发现了一种新元素,它的原子核内有161个中子,质量数272。该元素的质子数为()。(全国高考题) (A)111 (B)161 (C)272 (D)433 2.根据元素的核电荷数,不能确定的是()。 (A)原子核内质子数(B)原子核内中子数 (C)原子最外层电子数(D)原子核外电子数 3.氢原子的电子云图中的小黑点表示的意义是()。 (A)一个黑点表示一个电子(B)黑点的多少表示电子个数的多少 (C)表示电子运动的轨迹(D)电子在核外空间出现机会的多少 4.三种元素的微粒都有相同的电子层结构,已知,则它们核内质子数(依次 用表示)的关系为()。 (A)(B) (C)(D) 5.元素的化学性质主要决定于原子的()。 (A)质子数(B)中子数(C)核外电子数(D)最外层电子数 6.下列微粒中与离子具有不相同的质子数和相同的电子数,该微粒可能为()。 (A)(B)(C)(D) 7.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是 (A)电子数(B)最外层电子数 (C)电子层数(D)次外层电子数
8.据报道,某些建筑材料会产生放射性氡,从而对人体产生伤害。该原子的中子数和质子数之差是()。(上海市高考题) (A)136 (B)50 (C)86 (D)222 9.核内中子数为N的离子,质量数为A,则n g它的氧化物中所含质子的物质的量是()。(上海市高考题) (A)(B) (C)(D) 10.下列叙述中,正确的是()。 (A)两种微粒,若核外电子排布完全相同,则其化学性质一定相同 (B)凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 (C)两原子,如果核外电子排布相同,则一定属于同种元素 (D)不存在两种质子数和电子数均相同的阳离子和阴离子 11.(1)~(4)题是关于下面8种微粒的问题,请分别选答。 ①②③④ ⑤⑥⑦⑧ (1)中子数相同的微粒是()。 (A)④⑦(B)①②③(C)①②(D)④⑥⑦ (2)关于这些微粒的结构示意图的判断,正确的是()。 (A)⑥与⑦的相同(B)④与⑥的相同 (C)④与⑤的相同(D)前三项都不对
高中物理-《原子结构》单元测试题 一、选择题 1.卢瑟福粒子散射实验的结果是 A.证明了质子的存在 B.证明了原子核是由质子和中子组成的 C.说明了原子的全部正电荷和几乎全部质量都集中在一个很小的核上 D.说明原子中的电子只能在某些不连续的轨道上运动 2.英国物理学家卢瑟福用α粒子轰击金箔,发现了α粒子的散射现象。图中O 表示金原子核的位置,则能正确表示该实验中经过金原子核附近的α粒子的运动轨迹的图是( ) 3.氢原子辐射出一个光子后,根据玻尔理论,下述说法中正确的是( ) A.电子绕核旋转的半径增大B.氢原子的能量增大 C.氢原子的电势能增大D.氢原子核外电子的速率增大 4.下列氢原子的线系中波长最短波进行比较,其值最大的是 ( ) A.巴耳末系B.莱曼系C.帕邢系D.布喇开系 5.关于光谱的产生,下列说法正确的是( ) A.正常发光的霓虹灯属稀薄气体发光,产生的是明线光谱 B.白光通过某种温度较低的蒸气后将产生吸收光谱 C.撒上食盐的酒精灯火焰发出的光是明线光谱 D.炽热高压气体发光产生的是明线光谱 6.仔细观察氢原子的光谱,发现它只有几条分离的不连续的亮线,其原因是( ) A.观察时氢原子有时发光,有时不发光 B.氢原子只能发出平行光 C.氢原子辐射的光子的能量是不连续的,所以对应的光的频率也是不连续的 D.氢原子发出的光互相干涉的结果 7.氢原子第三能级的能量为 ( ) A.-13.6eV B.-10.2eV C.-3.4eV D.-1.51eV 8.下列叙述中,符合玻尔氢原子的理论的是
1 2 3 4 5 ∞ ( ) A .电子的可能轨道的分布只能是不连续的 B .大量原子发光的光谱应该是包含一切频率的连续光谱 C .电子绕核做加速运动,不向外辐射能量 D .与地球附近的人造卫星相似,绕核运行,电子的轨道半径也要逐渐减小 9.氦原子被电离一个核外电子后,形成类氢结构的氦离子。已知基态的氦离子能量为E 1=-54.4 eV,氦离子能级的示意图如图所示。在具有下列能量的光子中,不能被基态氦离子吸收而发生跃迁的是 ( ) A .40.8 eV B .43.2 eV C .51.0 eV D .54.4 eV 10.μ子与氢原子核(质子)构成的原子称为μ氢原子,它在原子核物理的研究中有重要作用。图为μ氢原子的能级示意图。假定光子能量为E 的一束光照射容器中大量处于n =2能级的μ氢原子,μ氢原子吸收光子后,发出频率为ν1、ν2、ν3、ν4、ν5和ν6的光,且频率依次增 大 , 则E 等 于 ( ) A .h (ν3-ν1) B .h (ν5+ν6) C .h ν3 D .h ν4 11.已知氢原子基态能量为-13.6eV,下列说法中正确的有 ( ) A .用波长为600nm 的光照射时,可使稳定的氢原子电离 B .用光子能量为10.2eV 的光照射时,可能使处于基态的氢原子电离 C .氢原子可能向外辐射出11eV 的光子 D .氢原子可能吸收能量为1.89eV 的光子 12.红宝石激光器的工作物质红宝石含有铬离子的三氧化二铝晶体,利用其中的铬离子产生激光。铬离子的能级如图所示,E 1是基态,E 2是亚稳态,E 3是激发态,若以脉冲氙灯发出波长为λ1的绿光照射晶体,处于基态的铬离子受激发跃迁到E 3,然后自发跃迁到E 2,释放波长为λ2的光子,处于亚稳态E 2的离子跃迁到基态时辐射出的光就是激光,这种激光的波长为( ) A .122 1λλλλ- B .2121λλλλ- C .2121λλλλ- D .2 11 2λλλλ-
原子结构与元素周期表试卷及答案 一、选择题(本题只有一个正确选项) 1、(奉贤二模,2)下列化学用语正确的是 A .硫的原子结构示意图: B .2-丁烯的结构式: C .乙酸的化学式:C 2H 4O 2 D .原子核内有8个中子的氧原子:188O 2、(奉贤二模,3)3He 可以作为核聚变材料,以下关于3He 的说法正确的是 A .比4He 少一个电子 B .比4He 少一个质子 C .与4He 的同分异构体 D .是4He 的同位素 3.(静安二模,1)在日本核电站附近检测到放射性原子131I 。关于131I 原子和127I 原子的 叙述错误的是 C A.它们互称为同位素 B.它们的化学性质几乎完全相同 C.它们相差4个质子 D.它们的电子数相同 4.(静安二模,2)下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子 层电子能量有差异的是 C A . B. C.1s 22s 22p 3 D. 5.(静安二模,15)氯元素的相对原子质量为35.5,由23Na 、35Cl 、37Cl 构成的11.7g 氯化 钠中,37Cl 的质量为 B A. 1.75g B. 1.85 g C.5.25 g D. 5.85g 6.(卢湾二模,2)下列化学用语正确的是 C A .聚丙烯的结构简式: B .丙烷分子的比例模型: C .磷原子最外层电子排布式:3s 23P 3 D .羟基的电子式为: 7. (卢湾二模,3)下列各项说法或比较中正确的是 C A .氧化性:Ag + >Cu 2+ >Fe 3+ B .热稳定性:HF >H 2Se >H 2O C .酸性:CH 3COOH>H 2CO 3 >H 2SiO 3 D .离子半径:Cl ->S 2->Mg 2+ 8 (卢湾二模,6)右表为元素周期表前四周期的一部分,下列有关X 、W 、Y 、R 、Z 五种 元素的叙述中,正确的是 B A .常温常压下,五种元素的单质中只有一种是气态 B .Y 的阴离子的还原性大于Z 的阴离子的还原性 C .W 的氢化物比X 的氢化物稳定 D .Y 与W 元素的最高价氧化物对应水化物的酸性比较,前者弱 于后者 9. (卢湾二模,8)下列各选项所述的两个量,前者一定大于后者的是 B A .F 2和Br 2的沸点 B .纯水在25℃和80℃时的pH X W Y R Z
一选择题 1.下列有关原子的说法中正确的是( ) A.原子都是由质子、中子和核外电子构成的 B.原子的类别是由原子核内的质子数所决定的 C.原子中不存在带电微粒,因而整个原子不显电性 D.原子的质量主要集中在质子和电子上 2.碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量之比为( ) :1 :12 :1 :2 3. 锂电池可用作心脏起搏器的电源。已知一种锂原子核内有3个质子和4个中子,则该锂原子的核外电子数为( ) D 7 4 下列物质由离子构成的是( ) A .铜 B .氯化钠 C .氧气 D .金刚石 ( 5.我市发展将有六大特色,其中之一是“打造主城休闲避暑养生区和主城近郊最大的负氧离子库”。空气中氧分子得到电子就能形成负氧离子(如O 22-),O 22-与O 2不相同的是( ) A .质子数 B .电子数 C .含氧原子个数 D .相对原子质量之和 6.某阳离子的结构示意图(右图所示)为则x 的数值可能是( ) A .9 B .10 D .17 7.已知一种粒子的核电荷数,一定能知道( ) 8.请判断以下说法,其中你认为正确的是( ) A . 原子是最小的微粒 B . 一切物质都是由分子组成的 [ C . 带电的原子是离子 D . 原子都是由质子、中子、电子构成的 9.下列有关原子知识的归纳中,你认为不正确的是( ) A . 原子是构成物质的一种粒子 " B . 原子在化学变化中可以再分 C . 同类原子的质子数一定相等 A . 相对原子质量 B . 相对分子质量 . C . 中子数 D . 质子数
D.原子里的质子数和中子数不一定相等 10.元素的化学性质与原子的()关系密切. 核电荷数B.核外电子数C.质子数D.最外层电子数 : A. 11.下列说法正确的是() 分子是保持物质性质的粒子 { A. B.质子数相同的粒子一定是同一种元素 C.离子在化学变化中都不能再分 D.| 原子是化学反应中不能再分的粒子 12.某元素原子的核外有三个电子层,最外层上有1个电子,这种元素是() A.非金属元素B.金属元素C.稀有气体元素D.# 无法确定 13.化学上用符号“Z A X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知a b X n+和c d Y m﹣的电子层排布完全相同,则下列关系正确的是() A.b﹣a=d﹣c B.a+n=c﹣m C.a﹣n=c+m D.| b﹣n=d+m 二、填空题 14.在分子、原子、质子、中子、电子、原子核这些粒子中选择填空: (1)能保持物质化学性质的粒子是; (2)化学变化中的最小微粒是; (3)能直接构成物质的粒子是; (4)构成原子核的粒子是; (5)带正电的粒子是; (6)带负电的粒子是; (7)不带电的粒子是; (8)质量与氢原子质量近似相等的粒子是; (9)质量最小的的是;
高中化学-《原子结构》测试题(含答案) 一、单选题 1.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3; ③1s22s22p5。则下列有关比较中正确的是() A.简单氢化物的还原性:③>①>② B.电负性:③>①>② C.阴离子半径:①>②>③ D.最高价氧化物的水化物酸性:③>①>② 2.下列说法正确的是 A.N元素的电负性大于O元素 B.基态Fe原子的外围电子排布图为 C.在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量 D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 3.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是() A.原子半径:d>c>b>a B.4种元素中b的金属性最强 C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强 4.具有下列电子层结构的原子,其第一电离能由大到小排列正确的是 ①3p 能级上只有一对成对电子的原子②最外层电子构型为3s23p6 的原子 ③其3p 能级为半充满的原子④正三价的阳离子结构与氖相同的原子 A.②③①④B.③①②④C.①②③④D.②④①③ 5.主族元素W、X、Y、Z 的原子序数依次增加,且均不大于20。这四种元素可组成结构为Z+[Y–W≡X]–的化合物。该化合物与某种金属阳离子反应可得到血红色溶液。下列说法正确的是 A.Z 的焰色反应为黄色 B.简单氢化物的沸点:W>X C.该化合物中Y 不满足8 电子稳定结构
D.Y 的最高价氧化物对应水化物的酸性比W 的强 6.砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是 A.砷原子最外层有3个电子B.砷化氢(AsH3)比NH3稳定 C.砷酸(H3AsO4)的酸性强于磷酸D.砷的+3价化合物的毒性强于+5价化合物 7.R为1~18号元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的含氧酸根离子有:~R2O42-~RO42-,~R2O32-,~RO32-,下列叙述判断正确的是() A.当它可以形成~时,可以形成~ B.当它可以形成~时,可以形成~和~ C.当它可以形成~时,不可能形成~ D.当它形成~时,也可以形成~ 8.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 A.元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 B.元素X与元素Y只能形成一种化合物 C.元素Y、R分别与元素X形成的化合物的热稳定性:X m Y>X m R D.元素W、R的最高价氧化物对应水化物都是强酸 9.下列离子中外层d轨道达全充满状态的是() A.Cu+B.Fe3+C.Co3+D.Cr3+ 10.已知元素周期表前三周期元素的离子a W3+、b X+、c Y2-、d Z-都具有相同的电子层结构,下列关系正确的是 A.原子序数a>d B.质子数c>d C.a+3=c-2D.原子半径X 原子结构测试题 一、选择题 1、同种元素的原子一定具有 A .不同的质量数 B .相同中子数 C .相同的质子数 D .不同的电子数 2、下列关于原子的叙述正确的是 A .11H 表示氢原子核的质子数是1,中子数也是1。 B .14 C 表示碳的一种同位素原子中含有7个质子和7个中子。 C .919F -表示该微粒的质量数为19,电子数为9。 D .2324Na Mg 和表示两种原子含有相同的中子数。 3、下列讲法正确的是 A .原子核差不多上由质子和中子构成的 B .不同元素原子的质量数一定不等 C .质子数相同的不同微粒,化学性质可能相同 D .质子数相同的不同微粒具有相同的电子数 4、科学家最近制造出第112号新元素(核电荷数为112),其原子的质量数为277,这是迄今已知元素中最重的原子。关于该新元素的下列叙述正确的是 A .其原子核内中子数和质子数差不多上112 B .其原子核内中子数为165,核外电子数为112 C .其原子质量是12C 原子质量的277倍 D .其原子质量与12C 原子质量之比277∶12 5、有关等物质的量的612C 原子和614 C 原子,下列叙述正确的是 含有相同数目的原子 含有相同物质的量的质子 属于同种元素 具有相同的质量 中子数相等 电子数相等 完全燃烧时消耗氧气的质量相等 具有几乎相同的化学性质 A .只有 B .只有 C .全正确 D .除 外都正确 6、若某阳离子X2+有m 个电子,其质量数为a ,则核内中子数为 A .m 2+ B .m 5+ C .a m 2-- D .a m + 7、简单离子a 2a n A + 核外有x 个电子,A 的质量数可表示为 A .()2x n + B .()2x n - C .2x D .()n 2x + 8、下列微粒中,电子数目最多的是: A .H2O B .NH3 C .Na + D .Al 9、下列离子的电子排布与氩原子核外电子排布不同的是: A .Mg2+ B .S2- C .K+ D .Cl - 10、某元素原子核外电子排布为:L 层电子数是K 层和M 层电子数之和的两倍,则某元素是: A .钠 B .镁 C .氖 D .氯 11、比较多电子原子中电子能量大小的依据是: A .原子核的电荷数 B .所处的电子层 C .电子离核远近不同 D .不能比较 12、下列微粒中与OH -离子具有不相同的质子数和相同的电子数, 该微粒可能为: A .F - B .Mg2+ C .NH2- D .CH4 原子结构试题及答案 一、原子及其核外电子排布 1.下列对不同时期原子结构模型的提出时间排列正确的是() ①电子分层排布模型②“葡萄干布丁”模型③量子力学模型④道尔顿原子学说 ⑤核式模型 A.①③②⑤④B.④②③①⑤ C.④②⑤①③D.④⑤②①③ 2.下列微粒:①质子,②中子,③电子,在所有原子中一定含有的微粒是() A.①②③B.仅有①C.①和③D.①和②3.某元素原子序数为33,则: (1)此元素原子共有________个运动状态不同的电子,有________个未成对电子。 (2)有________个电子层,________个能级,________个原子轨道。 (3)它的电子排布式为_______________________________________________________。4.有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p 能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试写出: (1)X的元素符号________,Y的元素符号________。 (2)Z的电子排布式________,Q的电子排布图______________________,T的电子排布 图________________________________________________________________________。 (3)Y的单质在Q的单质中燃烧的化学方程式 ________________________________________________________________________ ________________________________________________________________________。 二、元素周期表及其结构 5.下列有关元素周期系的叙述正确的是() A.元素周期系中ⅠA族元素又称为碱金属元素 B.元素周期系中每一周期元素的种类均相等 C.元素周期系的形成原因是核外电子排布的周期性变化 D.每一周期的元素最外层电子数均是1→8,周而复始 6.某元素原子的价电子排布式是3s23p4,则它在周期表中的位置是() A.第二周期第ⅣA族 B.第三周期第ⅣA族 C.第四周期第ⅡA族 课题1 原子的构成 一、填空题 1.原子是由居于原子中心的带电的和核外带电的构成的。 2.填下表。 3.原子显电中性的原因是因为和核外相等,但相反。 4.有一种原子,它的原子核内有12个中子,核外有11个电子,则它的原子核内一定有个质子并带有个单位的正电荷。 二、选择题 5.化学变化中的最小粒子是 A.分子 B.原子 C.质子 D.中子 6.我们已学过的构成物质的粒子 A.只有分子 B.有电子、中子和质子 C.有分子和原子 D.只有原子 7.在同一原子里,其数目相同的是 A.中子数和质子数 B.电子数和质子数 C.中子数和电子数 D.电子数和原子质量 8.核电荷数取决于 A.原子核的大小 B.原子核内质子数 C.原子核内中子数 D.原子核内质子数和中子数 9.原子核 A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.是不能再分的粒子 10.关于原子的叙述错误的是 A.原子还能再分 B.原子均有质子、中子和电子构成 C.原子在不断地运动着 D.原子的质量主要集中在原子核上 11.下列关于相对原子质量的说法正确的是 A.相对原子质量是原子的质量跟一种碳原子质量的比值 B.相对原子质量是一个比值 C.相对原子质量是原子质量的简称 D.相对原子质量在一般化学计算中可采用它的近似值 12.原子的质量主要取决于原子的 A.质子数和中子数 B.质子数和电子数 C.中子数 D.核外电子数 13.有一个原子核内有8个中子和8个质子,另一个原子的核内有10个中子,核外有8个电子,则它们不相同的是 A.核电荷数 B.核外电子数 C.质子数 D.相对原子质量 14.一个氧分子是由两个氧原子构成的,则一个氧分子内含有的质子数是 A.8 B.16 C.32 D.64 三、判断题 15.原子核是由电子和质子组成的。() 16.在原子里,质子数一定等于中子数和电子数。() 17.原子核中的中子数可以大于、等于或小于其中的质子数。() 18.氧化汞中含有氧分子,受热分解可放出氧气。() 19.相对原子质量就是一个原子的质量。() 四、连线题 20.将下面左右两边相关的内容用短线连接起来。 《原子结构》练习题 1. 最近医学界通过用放射性14C标记的C 60,发现一种C 60 的羧酸衍生物在特定条件下可通过断裂DNA杀 死细胞,从而抑制艾滋病,则有关14C的叙述正确的是() A.与14N 含有的中子数相同 B.是C 60 的同素异形体 C.与C 60 中普通碳原子的化学性质不同 D.与12C互为同位素 2. 据报道,月球上有大量3He存在,以下关于3He的说法正确的是() A.是4He的同分异构体 B.比4He 多一个中子 C.是4He 的同位素 D.比4He少一个质子 3. X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是 ()A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大 C.X的原子半径比Y的大 D.X的元素的最高正价比Y的大 4. 2002年由德.法.美及波兰等多国科学家组成的科研小组合成了非常罕见的45 26 Fe原子,有关Fe的说法正确的是() A.它是一种新元素 B.它是一种新核素 C.45 26Fe与56 26 Fe互为同素异形体 D.这种铁原子发生衰变放出两个质子后变成43 26 Fe 5. 某元素的原子最外电子层只有2个电子,该元素() A.一定是IIA族元素 B.一定是金属元素 C.可能是金属元素 D.一定是+2价元素 6. 不具有放射性的同位素称为稳定同位素。近20年来,稳定同位素分析法在科学研究中有着广泛应用。下 列说法中,正确的是() A.34S原子核内的中子数为16 B.13C和15N原子核内的质子数相差2 C.16O与18O互为同位素 D.2H与1H的质子数.中子数.电子数均不相同 7. 613C可以用于含碳化合物的结构分析。613C表示的碳原子( ) A.核外有13个电子,其中6个能参与成键 B.核内有6个质子,核外有7个电子 C.质量数为13,原子序数为6,核内有7个中子 D.质量数为13,原子序数为6,核内有7个质子 8. A、B均为原子序数1~20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个,则B的原子序数 是() A.n+4 B.n+6 C.n+8 D.n+10 9.下列表达中,错误的 ...是()A.铝原子结构示意图: B.1 1H.2 1 H、3 1 H是氢的三种核素 C.Na+和O2-的核外电子数相等 D.NaOH、Mg(OH)2、Al(OH)3的碱性依次增强 10. 下列各组微粒中,核外电子层结构相同的是() A.Mg2+、S2-、Na+、F- B. Na+、F-、S2-、Ar C.K+、Ca2+、S2-、Ba2+ D.Mg2+、O2-、Na+、F- 11. 铀元素有234U、235U、238U等多种同位素,用做核燃料的是235 92 U。下列有关说法正确的是 () A.235 92 的中子数为235 B.234U、235U、238U是铀的三种不同核素 C.234U、235U互为同分异构体 D.235U、238U的中子数相同 12. 1996年科学家在宇宙中发现了H3分子,H3和H2属于() A.同位素B.同素异形体C.同分异构体D.同一物质 13. 和Na+离子具有相同质子数和电子数的微粒是() A.NH4+B.F-C.H2O D.NH3 14. 下列离子中,其核外电子排布与氩原子核外电子排布不同的是() A.Mg2+ B.S2—C.K+D.Cl— 1-1原子结构 1、首先提出原子结构模型并开始涉及原子内部结构的科学家是 A.卢瑟福B.玻尔C.汤姆生D.道尔顿 2、下列对不同时期原子结构模型的提出时间由早到晚排列正确的是 ①电子分层排布模型②“葡萄干布丁”模型③量子力学模型 ④道尔顿原子学说⑤核式模型 A.①③②⑤④B.④②③①⑤C.④②⑤①③D.④⑤②①③ 3、下列各电子能层,含有f能级的是 A.K层B.L层C.M层D.N层 4、在同一个原子中,M能层上的电子与Q能层上的电子的能量 A.前者大于后者B.后者大于前者 C.前者等于后者D.无法确定 5、不同的原子不可能具有相同的 A.质子数B.中子数C.质量数D.质子数和中子数 6、下列关于多电子原子核外电子的运动规律的叙述正确的是 A.核外电子是分层运动的B.所有电子在同一区域里运动 C.能量高的电子在离核近的区域运动 D.能量低的电子在离核近的区域绕核运动 7、在M能层中,能级数目为 A.1 B.3 C.9 D.18 8、以下能级符号错误的是 A.6s B.2d C.3f D.7p 9、在M能层中,最多能容纳的电子数为 A.2 B.8 C.18 D.32 10、下列能级中可容纳电子最多的是 A.6s B.4p C.3d D.4f 11、各能层最多容纳的电子数为________。在多电子原子中,任一能层的能级总是从____能级开始。而且能级数等于该能层的____,例如第四能层有_个能级,分别是_________。 12、用“>”、“<”、“=”表示下列能级的能量高低关系: (1)1s____2s____3s___4s;2p____3p___4p____5p;3d___4d____5d;(2)2s____2p;3s___3p____3d;4s____4p____4d____4f; 原子结构及元素 一、选择题 1.【2018年山东省德州市】近日,中国在四川某地发现了一个超大规模的锂矿,储量高达52万吨,被称之为“中国锂谷”。锂矿是重要的国家战略资源,有着21世纪改变世界格局的“白色石油”和“绿色能源金属”之称。下图是锂原子结构示意图和锂元素在元素周期表中的相关信息。下列说法正确的是( ) A.锂元素属于非金属元素 B.锂原子在化学反应中易得电子 C.锂原子的相对原子质最是6.94lg D.锂原子核内有3个质子 【答案】D 2.【2018年湖北省随州市】下图是元素周期表中提供的碘元素部分信息及碘原子结构示意图。下列说法错误的是 A.碘单质(I2)是由碘原子直接构成的 B.碘的相对原子质量为127,原子核内质子数为53 C.碘原子核外共有53个电子,最外层有7个电子 D.碘元素属于非金属元素,碘原子在化学反应中容易得到电子 【答案】A 3.【2018年湖南省岳阳市】硒是人体必需的一种微量元素,严重缺硒可能诱发皮肤病和癌症。硒的原子结构示意图及其在元素周期表中的某些信息如图所示,下列分析正确的是() A.硒属于金属元素 B.硒的相对原子质量为78.96g C.硒原子的核电荷数为34 D.硒原子的核外有6个电子 【答案】C 4.【2018年湖北省咸宁市】1869年发现了元素周期律并编制出元素周期表的科学家是 A.道尔顿 B.阿伏加德罗 C.门捷列夫 D.侯德榜 【答案】C 5.【2018年湖北省咸宁市】稀土是一种重要的战略资源。铈是一种常见的稀土元素,下列有关铈的说法正确的是 A.铈属于非金属元素 B.铈原子的中子数是58 C.铈原子的核外电子数是58 D.铈原子的相对原子质量是140.1g 【答案】C 6.【2018年安徽省】硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。下列有关硼的说法正确的是 A.相对原子质量为10.81g B.属于金属元素 C.原子的核电荷数为5 D.原子核外有6个电子 【答案】C 7.【2018年广州市】下图为某粒子的结构示意图,下列说法正确的是 A.该粒子有12个质子 B.该粒子有2个电子层 C.该粒子属于非金属元素 D.该粒子已达到相对稳定结构 【答案】A 8.【2018年安徽省】归纳法是学习化学的重要方法之一,下列图示正确的是 原子结构练习题 一:选择题 1.下列各电子能层,含有f能级的是 A.K层B.L层C.M层D.N层 2.下列关于多电子原子核外电子的运动规律的叙述正确的是 A.核外电子是分层运动的B.所有电子在同一区域里运动 C.能量高的电子在离核近的区域运动D.能量低的电子在离核近的区域绕核运动 3、在M能层中能级数目为()A.1 B.3 C.9 D.18 4、以下能级符号错误的是()A.6s B.2d C.3f D.7p 5、在M能层中,最多能容纳的电子数为( ) A.2 B.8 C.18 D.32 6、下列能级中可容纳电子最多的是 ( ) A.6s B.4p C.3d D.4f 7、某元素的原子3d能级上有1个电子,它的N能层上电子数是 A.0 B.2 C.5 D.8 8、下列各原子或离子的电子排布式错误的是 A.Ca2+:1s22s22p63s23p6B.O 1s22s22p6 C.P:1s22s22p63s23p3D.Br:1s22s22p63s23p63d104s24p5 9、主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为 A.ns2np2和ns2np4B.ns1和ns2np4 C.ns2和ns2np5D.ns1和ns2 10、某元素正二价离子的最外层电子排布为3d9,则该元素的原子序数为 A.29 B.30 C.31 D.32 11、某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素原子的最外层电子排布是 A.2s22p3B.2s22p5C.3s23p3D.3s23p5 12.基态碳原子的最外能层的各能级中,电子排布的方式正确的是() A B C D 13.下图中,能正确表示基态硅原子的是 A B C D 14.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是 A B C D 15.各能级最多容纳的电子数是该能级原子轨道数的二倍,其理论依据是() A.构造原理B.泡利原理 C.洪特规则 D.能量最低原理 16.4p能级只填充一半电子的原子,其原子序数是 ( ) A.15 B.33 C.35 D.51 高考物理新近代物理知识点之原子结构经典测试题及答案解析(4) 一、选择题 1.一个氢原子从2n =能级跃迁到4n =能级,该氢原子( ) A .吸收光子,能量减少 B .吸收光子,能量增加 C .放出光子,能量增加 D .放出光子,能量减少 2.如图所示是卢瑟福的α粒子散射实验装置,在一个小铅盒里放有少量的放射性元素钋,它发出的α粒子从铅盒的小孔射出,形成很细的一束射线,射到金箔上,最后打在荧光屏上产生闪烁的光点。下列说法正确的是( ) A .该实验是卢瑟福建立原子核式结构模型的重要依据 B .该实验证实了汤姆孙原子模型的正确性 C .α粒子与原子中的电子碰撞会发生大角度偏转 D .绝大多数的α粒子发生大角度偏转 3.一个氢原子从n =3能级跃迁到n =2能级,该氢原子( ) A .放出光子,能量增加 B .放出光子,能量减少 C .吸收光子,能量增加 D .吸收光子,能量减少 4.下列说法正确的是( ) A .β衰变现象说明电子是原子核的组成部分 B .在光电效应实验中,只增加入射光的强度,饱和光电流不变 C .在核反应方程41417 278He N O X +→+中,X 表示的是中子 D .根据玻尔理论,处于基态的氢原子吸收光子发生跃迁后,其电子的动能减少 5.氢原子光谱在可见光区域内有四条谱线 ,都是氢原子中电子从量子数n >2的能级跃迁到n =2的能级发出的光,它们在真空中的波长由长到短,可以判定 A .对应的前后能级之差最小 B .同一介质对的折射率最大 C .同一介质中的传播速度最大 D .用照射某一金属能发生光电效应,则 也一定能 6.图甲所示为氢原子能级图,大量处于n =4激发态的氢原子向低能级跃迁时能辐射出多种不同频率的光,其中用从n =4能级向n =2能级跃迁时辐射的光照射图乙所示光电管的阴极K 时,电路中有光电流产生,则 原子结构 单元测试题 1、在光电效应实验中,如果需要增大光电子到达阳极时的速度,可采用的方法是 ( ) A .增加光照时间. B .增大入射光的波长. C .增大入射光的强度. D .增大入射光频率. 2、根据玻尔理论,在氢原子中,量子数n 越大,则 ( ) A .电子轨道半径越小 B .核外电子运动速度越大 C .原子能量越大 D .电势能越小 3、如图所示,在α粒子散射实验中,α粒子穿过某一金属原子核附近的示意图,A 、B 、C 分别位于两个等势面上,则以下说法中正确的是 ( ) A .α粒子在A 处的速度比在 B 处的速度小 B .α粒子在A 处的速度最大 C .α粒子在A 、C 两处的速度大小相等 D α粒子在B 处的速度比在c 处的速度要小 4、氢原子处于基态能级时能量为-13.6 eV ,处于第一激发态时能量为-3.4 eV ,下列哪种方 法可以把静止的氢原子从基态激发到第一激发态 ( ) A 、用10.3 eV 的光子打击氢原子 B 、用能量为10.1 eV 的光子打击氢原子 C 、用能量为10.1 eV 的电子碰撞氢原子 D 、用能量大于10.2 eV 的电子碰撞氢原子 5、氢原子从能级A 跃迁到能级B ,吸收频率为v 1的光子,从能级A 跃迁到能级C 时释放频率为v 2的光子,若v 1<v 2,则当它从能级C 跃迁到能级B 时将 ( ) A 、放出频率为v 2-v 1的光子 B 、放出频率为v 2+v 1的光子 C 、吸收频率为v 2-v 1的光子 D 、吸收频率为v 2+v 1的光子 6、氢原子核外电子由离核较远的轨道跃迁到离核较近的轨道时 ( ) A .要吸收光子,电子的动能、电势能都减小 B .要吸收光子,电子的动能增大.电势能减小 C .要放出光子,电子的动能、电势能都减小 D .要放出光子,电子的动能增加,电势能减小 7、现有N(很大)个氢原子被激发到量子数为4的能级上, 若这些受激氢原子最后都回到基态,假定处在量子数为n 的激发态的氢原子跃迁到各较低能级的原子数都是处在该激发态能级上的原子总数的)1/(1 n ,则在此过程中发出的光子数是 ( ) A 、N B 、3N/2 C 、11N/6 D 、5N/3 8、德国物理学家弗兰克林和赫兹进行过气体原子激发的实验研究.如图甲,他们在一只阴极射线管中充了要考察的汞蒸气.阴极发射出的电子受阴极K 和栅极R 之间的电压U R 加速,电子到达栅极R 时,电场做功eU R .此后电子通过栅极R 和阳极A 之间的减速电压U A .通过阳极的电流如图乙所示,随着加速电压增大,阳极电流在短时间内也增大,但是到达一个特定的电压值U R 后,观察到电流突然减小.在这个电压值上,电子的能量刚好能够激发和它们碰撞的原子.参加碰撞的电子交出其能量,速度减小,因此到达不了阳极,阳极电流减 小.eU R 即为基态气体原子的激发能.得到汞原子的各条能级 比基态高以下能量值:4.88 eV ,6.68 eV ,8.78 eV ,10.32 eV .若 一个能量为7.97 eV 的电子进入汞蒸气后,则测量它的能量大 约是 ( ) A .4.88 eV 或7.97 eV B .4.88 eV 或6.68 eV C .2.35 eV 或7.97 eV D .1. 29 eV 或0.09 eV 或7.97 eV 高中物理-原子结构测试题 (高考体验卷) 一、选择题(本题共10小题,每小题4分,共40分.在每小题给出的四个选项中,至少有一个选项正确;全部选对的得4分,选不全的得2分,有选错或不答的得0分) 1.(·北京理综)一个氢原子从n=3能级跃迁到n=2能级,该氢原子() A.放出光子,能量增加 B.放出光子,能量减少 C.吸收光子,能量增加 D.吸收光子,能量减少 解析:由玻尔原子模型、跃迁的特点,由高能级向低能级跃迁过程中能量减少,减少的能量以光子形式放出,选项B正确. 答案:B 2.(·福建理综)在卢瑟福α粒子散射实验中,金箔中的原子核可以看作静止不动,下列各图画出的是其中两个α粒子经历金箔散射过程的径迹,其中正确的是() 解析:α粒子运动时受到原子核的排斥力作用,离原子核距离远的α粒子受到的排斥力小,运动方向改变的角度也小,离原子核距离近的α粒子受到的排斥力大,运动方向改变的角度就大,C项正确. 答案:C 3.(·上海单科)卢瑟福利用α粒子轰击金箔的实验研究原子结构,正确反映实验结果的示意图是() 解析:α粒子散射实验的实验现象:(1)绝大多数的α粒子穿过金箔后仍沿原来的方向前进;(2)少数α粒子发生了较大的偏转;(3)极少数α粒子的偏转角θ超过90°,甚至有个别α粒子被反弹回来.据此可知本题只有选项D正确. 答案:D 4.(·全国高考)已知氢原子的基态能量为E1,激发态能量E n=,其中n=2,3,…用h表示普朗克常量,c 表示真空中的光速.能使氢原子从第一激发态电离的光子的最大波长为() A.- B.- C.- D.- 解析:根据激发态能量公式E n=可知氢原子第一激发态的能量为,设能使氢原子从第一激发态电离的最大波长(设波长为λm)的光子能量为ΔE,则有+ΔE=0,且ΔE=h,联立解得λm=-,所以本题正确选项只有C. 答案:C 5.(·四川理综)如图为氢原子能级示意图的一部分,则氢原子() 第三单元 物质构成的奥秘 课题2 原子的结构 一选择题 1.下列有关原子的说法中正确的是( ) A.原子都是由质子、中子和核外电子构成的 B.原子的类别是由原子核内的质子数所决定的 C.原子中不存在带电微粒,因而整个原子不显电性 D.原子的质量主要集中在质子和电子上 2.碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量之比为( ) A.12:1 B.2:12 C.2:1 D.1:2 3. 锂电池可用作心脏起搏器的电源。已知一种锂原子核内有3个质子和4个中子,则该锂原子的核外电子数为( ) A.1 B.3 C.4 D 7 4 下列物质由离子构成的是( ) A .铜 B .氯化钠 C .氧气 D .金刚石 5.我市发展将有六大特色,其中之一是“打造主城休闲避暑养生区和主城近郊最大的负氧离子库”。空气中氧分子得到电子就能形成负氧离子(如O 22-),O 22- 与O 2不相同的是( ) A .质子数 B .电子数 C .含氧原子个数 D .相对原子质量之和 6.某阳离子的结构示意图(右图所示)为则x 的数值可能是( ) A .9 B .10 C.12 D .17 7.已知一种粒子的核电荷数,一定能知道( ) 8.请判断以下说法,其中你认为正确的是( ) 9.下列有关原子知识的归纳中,你认为不正确的是( ) 10.元素的化学性质与原子的( )关系密切. 11.下列说法正确的是( ) 12.某元素原子的核外有三个电子层,最外层上有1个电子,这种元素是() 13.化学上用符号“Z A X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知a b X n+和c d Y m﹣的电子层排布完全相同,则下列关系正确的是() 二、填空题 14.在分子、原子、质子、中子、电子、原子核这些粒子中选择填空: (1)能保持物质化学性质的粒子是; (2)化学变化中的最小微粒是; (3)能直接构成物质的粒子是; (4)构成原子核的粒子是; (5)带正电的粒子是; (6)带负电的粒子是; (7)不带电的粒子是; (8)质量与氢原子质量近似相等的粒子是; (9)质量最小的的是; (10)在同一原子中数目相等的是。 15.下面是五种粒子的结构示意图: (1)图中粒子共能表示种元素。A所表示的元素位于元素周期表的第周期。原子结构测试题
原子结构试题及答案
人教版九年级化学上册原子的结构练习题
九年级化学中考《原子结构》练习题
原子结构练习题
2018年化学中考试题分类练习:06原子结构及元素(含答案)
原子结构练习题.doc
高考物理新近代物理知识点之原子结构经典测试题及答案解析(4)
原子结构 单元测试题
高中物理-原子结构测试题
初三化学上册原子的结构练习题