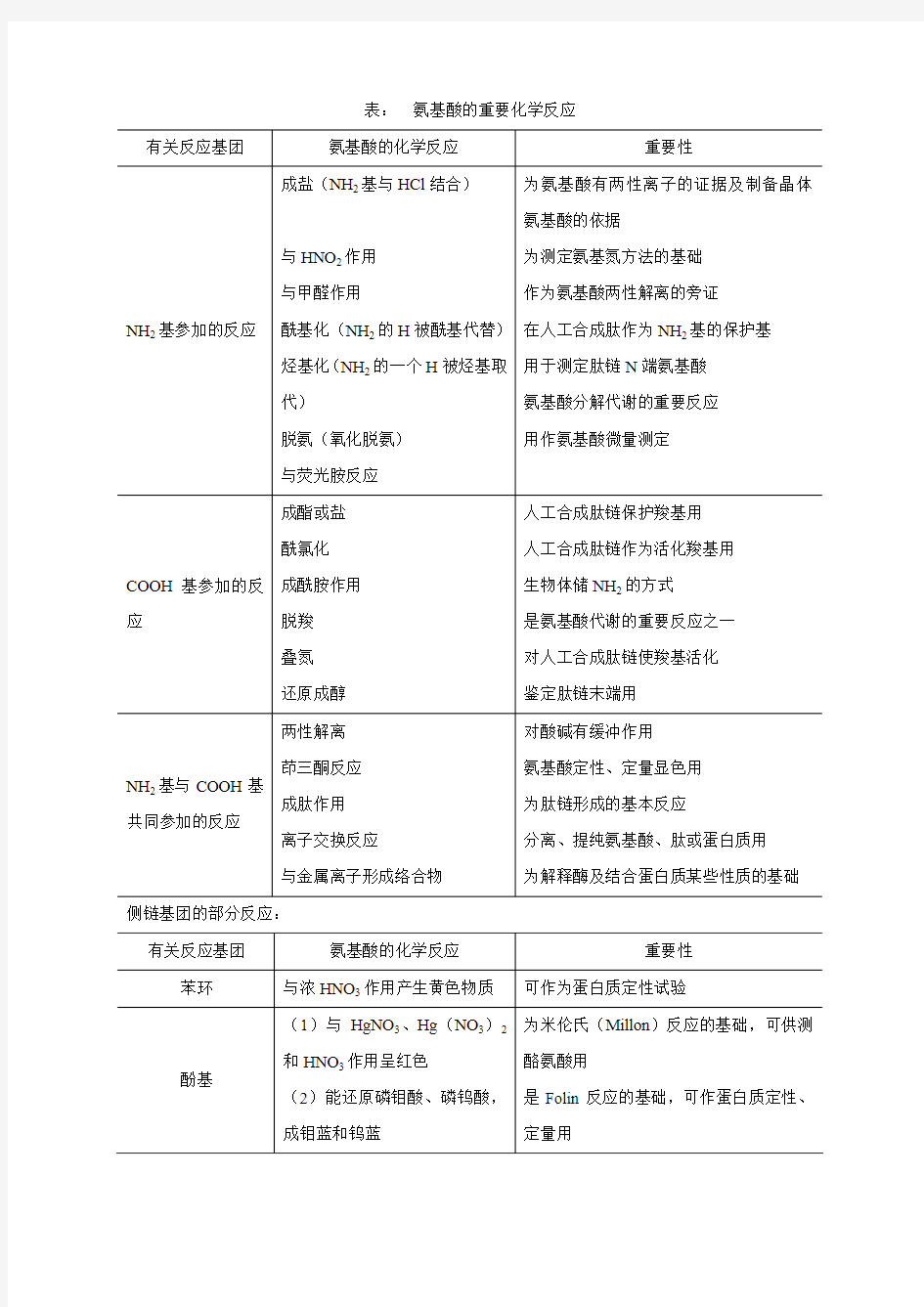

表:氨基酸的重要化学反应
侧链基团的部分反应:
常见的化学反应及现象综合 1.澄清石灰水中通入二氧化碳气体(复分解反应) Ca(OH)2 + CO2 = CaCO3↓ + H2O 现象:石灰水由澄清变浑浊。 相关知识点:这个反应可用来检验二氧化碳气体的存在。 2.镁带在空气中燃烧(化合反应) 2Mg + O2 = 2MgO 现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。 相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。 (3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。 3.水通电分解(分解反应) 2H2O = 2H2↑ + O2↑ 现象:通电后,电极上出现气泡,气体体积比约为1:2 相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8; (3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电 4.生石灰和水反应(化合反应) CaO + H2O = Ca(OH)2 现象:白色粉末溶解
相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。(4)发出大量的热 5.实验室制取氧气 ①加热氯酸钾和二氧化锰的混合物制氧气(分解反应) 2KClO3MnO2催化2KCl + 3O2↑ 相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。 ②加热高锰酸钾制氧气(分解反应) 2KMnO4 = K2MnO4 + MnO2 + O2↑ 相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。 ③过氧化氢和二氧化锰制氧气(分解反应) 2H2O2 MnO2催化2H2O + O2↑ 共同知识点:(1)向上排空气法收集时导管要伸到集气瓶下方,收集好后要正放在桌面上;(2)实验结束要先撤导管,后撤酒精灯,避免水槽中水倒流炸裂试管;(3)加热时试管要略向下倾斜,避免冷凝水回流炸裂试管;(4)用排水集气法收集氧气要等到气泡连续均匀地冒出再收集;(5)用带火星的小木条放在瓶口验满,伸入瓶中检验是否是氧气。 6.木炭在空气中燃烧(化合反应) 充分燃烧:C + O2 = CO2 不充分燃烧:2C + O2 = 2CO 现象:在空气中发出红光;在氧气中发出白光,放热,生成一种使澄清石灰水变浑浊的无色气体。 相关知识点:反应后的产物可用澄清的石灰水来进行检验。
氨基酸 氨基酸定义 氨基酸(amino acids):含有氨基和羧基的一类有机化合物的通称。生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上。 氨基酸的结构通式:构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。 氨基酸分类 天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。 1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。共有8种其作用分别是: ①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化; ②色氨酸(Tryptophane):促进胃液及胰液的产生; ③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗; ④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能; ⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能; ⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺; ⑦亮氨酸(Leucine ):作用平衡异亮氨酸; ⑧缬氨酸(Viline):作用于黄体、乳腺及卵巢。 其理化特性大致有: 1)都是无色结晶。熔点约在230°C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。 2)有碱性[二元氨基一元羧酸,例如赖氨酸(lysine)];酸性[一元氨基二元羧酸,例如谷氨酸(Glutamic acid)];中性[一元氨基一元羧酸,例如丙氨酸(Alanine)]
氨基酸的常见化学反应 ? -氨基的反应 ?亚硝酸反应 ?范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法) ?注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较 慢. ?与酰化试剂的反应 ?Aa+酰氯,酸酐-→Aa被酰基化 ?丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量. ?烃基化反应 ?Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代. ?与2,4-二硝基氟苯(DNFB,FDNB)反应 ?最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa ?与苯异硫氰酸酯(PITC)的反应 ?Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋白 质的Aa顺序分析方面占有重要地位(Edman降解法) ?形成西佛碱反应 ?Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘s base) ?前述甲醛滴定:甲醛与H2N-CH2-COO-结合,有效地减低了后者的 浓度,所以对于加入任何量的碱, [H2N-CH2-COO- ]/ [+H3N-CH2-COO- ]的比值总要比不存在甲醛的情况下小得多。加入 甲醛的甘氨酸溶液用标准盐酸滴定时,滴定曲线B并不发生改变。 ?脱氨基反应 ?Aa在生物体内经Aa氧化酶催化即脱去α-NH2而转变成酮酸 ?α-COOH参加的反应 ?成盐和成酯反应 ?Aa + 碱-→盐 ?Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水) ?Aa-COOH + 醇-→酯 ?Aa+ EtOH ---→氨基酸乙酯的盐酸盐 ?当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反 应性能被掩蔽或者说COOH被保护,NH2的化学性能得到 了加强或活化,易与酰基结合。Aa酯是制备Aa的酰氨or 酰肼的中间物 ?成酰氯反应 ?当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作 用生成酰氯 ?用于多肽人工合成中的羧基激活 ?叠氮反应 ?氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼 和亚硝酸变成叠氮化合物 ?用于多肽人工合成中的羧基激活 ?脱羧基反应
高三化学教案化学反应速率 高三化学教案化学反应速率 教学目标 知识目标 使学生理解浓度、压强、温度和催化剂等条件对化学反应速率的影响; 使学生能初步运用有效碰撞,碰撞的取向和活化分子等来解释浓度、压强、温度和催化剂等条件对化学反应速率的影响。能力目标 培养学生的观察能力及综合运用知识分析解决问题、设计实验的能力,培养学生的思维能力,阅读与表达能力。 情感目标 通过从宏观到微观,从现象到本质的分析,培养学生科学的研究方法。 教学建议 化学反应速率知识是学习化学平衡的基础,学生掌握了化学反应速率知识后,能更好的理解化学平衡的建立和化学平衡状态的特征,及外界条件的改变对化学平衡的影响。 浓度对化学反应速率的影响是本节教学的重点。其原因是本节教学难点。这部分教学建议由教师引导分析。而压强、温度、催化剂的影响可在教师点拨下由学生阅读、讨论完成。关于浓度对化学反应速率的影响:
1.联系化学键知识,明确化学反应得以发生的先决条件。(1)能过提问复习初中知识:化学反应的过程就是反应物分子中的原子重新组合成生成物分子的过程。 (2)通过提问复习高中所学化学键知识:化学反应过程的实质是旧化学键的断裂和新化学键的形成。 (3)明确:旧键的断裂和新键的生成必须通过反应物分子(或离子)的相互接触、碰撞来实现。 2.运用比喻、图示方法,说明化学反应得以发生的必要条件是活化分子发生有效碰撞。 (1)以运动员的投篮作比喻。 (2)以具体的化学反应为例,让学生观看HI分子的几种可能的碰撞模式图(如制成动画教学软件加以模拟会收到更好的效果),进一步说明化学反应得以发生的必要条件。 3.动手实验,可将教材中的演示实验改成边讲边做,然后据实验现象概括出浓度对化学反应速率影响的规律。有条件的学校,也可由学生动手做,再由学生讨论概括出浓度对化学反应速率的影响规律---增大反应物的浓度可以增大化学反应速率。 4.通过对本节所设铁与盐酸反应的讨论,并当堂课完成课后习题二、2,综合运用本节所学内容反馈学生掌握情况,巩固本节所学知识。 教材分析
各种氨基酸的生产工艺 1、谷氨酸 (1)等电离交工艺方法——从发酵液中提取谷氨酸,即将谷氨酸发酵液降温并用硫酸调PH值至谷氨酸等电点(pH3.0- 3.2),温度降到10 以下沉淀,离心分离谷氨酸,再将上清液用硫酸调pH至1.5上732强酸性阳离子交换树脂,用氨水调上清液pH10进行洗脱,洗脱下来的高流分再用硫酸调pH1.0返回等电车间加入发酵液进行等电提取,离交车间的上柱后的上清液及洗柱水送去环保车间进行废水处理。 该工艺方法的缺点是:废水量大,治理成本高,酸碱用量大。 (2)连续等电工艺——将谷氨酸发酵液适当浓缩后控制40℃左右,连续加入有晶种的等电罐中,同时加入硫酸,控制等电罐中PH值维持在3.2左右,温度40℃进行结晶。 该工艺方法废的优点是:水量相对较少;缺点是:氨酸提取率及产品质量较差。 (3)发酵法生产谷氨酸的谷氨酸提取工艺——谷氨酸发酵液经灭菌后进入超滤膜进行超滤,澄清的谷氨酸发酵液在第一调酸罐中被调整pH值为3.20~3.25,然后进入常温的等电点连续蒸发降温结晶装置进行结晶,分离、洗涤,得到谷氨酸晶体和母液,将一部分母液进入脱盐装置,脱盐后的谷氨酸母液一部分与超滤后澄清的谷氨酸发酵液合并;另一部分在第二调酸罐中被调整pH值至4.5~7,蒸发、浓缩、再在第三调酸罐中调pH值至3.20~3.25后,进入低温的等电点连续蒸发降温结晶装置,使母液中的谷氨酸充分结晶出来,低温的等电点连续蒸发降温结晶装置排出的晶浆被分离、洗涤,得到谷氨酸晶体和二次母液。(4)水解等电点法 发酵液-----浓缩(78.9kPa,0.15MPa蒸汽)----盐酸水解(130 ℃,4h )----过滤-----滤液脱色-----浓缩-----中和,调pH至3.0-3.2(NaOH或发酵液) -----低温放置,析晶-------谷氨酸晶体 此工艺的优点:设备简单、废水量减少、生产成本低、酸碱用量省 (5)低温等电点法 发酵液-----边冷却边加硫酸调节pH4.0-4.5-----加晶种,育晶2h-----边冷却边加硫酸调至pH3.0-3.2------冷却降温------搅拌16h------4 ℃静置4h------离心分离 --------谷氨酸晶体 此工艺的优点:设备简单、废水量减少、生产成本低、酸碱用量省 (6)直接常温等电点法 发酵液-----加硫酸调节pH4.0-4.5-----育晶2-4h-----加硫酸调至pH3.5-3.8------育晶2h------加硫酸调至pH3.0-3.2------育晶2h------冷却降温------搅拌16-20h------沉淀2-4h-------谷氨酸晶体 此工艺的优点:设备简单、操作容易、生产周期短、酸碱用量省。 2、L-亮氨酸 (1)浓缩段 原料:蒸汽 将一次母液通入浓缩罐内,通入蒸汽,温度120度,气压-0.09Mpa,浓缩时间6h,结晶。终点产物:结晶液(去一次中和段) (2)一次中和段 辅料:硫酸,纯水 结晶液进入一次中和罐,通入硫酸,纯水,温度80,中和时间4h,过滤 终点产物:1,滤液(回收利用)2,滤渣(去氨解段)
《影响化学反应速率因素》说课稿 《影响化学反应速率因素》说课稿 2020-09-06 《影响化学反应速率因素》说课稿 作为一名为他人授业解惑的教育工作者,总不可避免地需要编写说课稿,借助说课稿我们可以快速提升自己的教学能力。那么你有了解过说课稿吗?下面是小编帮大家整理的《影响化学反应速率因素》说课稿,供大家参考借鉴,希望可以帮助到有需要的朋友。 一、教材分析 1、地位与作用:本节选自高中化学人教版选修4《化学反应原理》的第二章第二节,是化学反应原理的重要组成部分,与生产生活密切相关。就全章内容来看,既是第一节化学反应速率的理论延伸,也是第三节化学平衡的研究基础,起着承上启下的重要作用。 2、教材处理:○1为了加强学生自主探究,一改教材边实验边理论的方式,采用先理论猜想后实验验证的科学发现的次序,使实验的开放性更强,方案均由学生设计。○2为了使现象对比更明显,增加caco3和不同浓度盐酸反应的实验。二、学情分析 1、已有的知识:○1必修2中,学生对影响化学反应速率的因素存在一定的感性认识; ○2在本册绪言中学习了碰撞理论相关知识。 2、已具备的能力:○1学生初步具备简单化学实验方案的设计能力,能够合作完成实验探究; ○2具备一定的观察、分析、质疑和表达能力。 3、可能遇到困难:○1抽象思维还不成熟,困惑于宏观现象的微观解释,尤其是压强对速率的影响; ○2对实验方案的选择和评价,缺乏多角度的综合分析能力。三、教学目标 1、知识与技能:○1能初步运用碰撞理论解释浓度、压强、温度和催化剂等条件对化学反应速率的影响; ○2自主设计实验方案,探究外界因素对化学反应速率的影响。 2、过程与方法:○1通
教案精选:高一化学《浓度对化学反应速率 影响》教学设计 教案精选:高一化学《浓度对化学反应速率影响》教学设计 知识目标: 使学生理解浓度、压强、温度和催化剂等条件对化学反应速率的影响; 使学生能初步运用有效碰撞,碰撞的取向和活化分子等来解释浓度、压强、温度和催化剂等条件对化学反应速率的影响。 能力目标: 培养学生的观察能力及综合运用知识分析解决问题、设计实验的能力,培养学生的思维能力,阅读与表达能力。 情感目标: 通过从宏观到微观,从现象到本质的分析,培养学生科学的研究方法。 教材分析 遵照教学大纲的有关规定,作为侧重理科类学生学习的教材,本节侧重介绍化学反应速率和浓度、压强、温度、催化剂等条件对化学反应速率的影响,以及造成这些影响的原
因,使这部分知识达到大纲中所规定的B层次或C层次的要求。本知识点,按最新教材来讲。 教材从一些古代建筑在近些年受到腐蚀的速率大大加快等事实引出化学反应速率的概念,并通过演示实验说明不同的反应具有不同的反应速率,以及浓度、温度等对化学反应速率的影响。教材注意联系化学键的有关知识,从化学反应的过程实质是反应物分子中化学键的断裂、生成物分子中化学键的形成过程,以及旧键的断裂和新键的形成都需要通过分子(或离子)的相互碰撞才能实现等,引出有效碰撞和活化分子等名称。并以运动员的投篮作比喻,说明只有具有足够能量和合适取向的分子间的碰撞才能发生化学反应,教材配以分子的几种可能的碰撞模式图,进一步说明发生分解反应生成和的情况,从中归纳出单位体积内活化分子的数目与单位体积反应物分子的总数成正比,也就是和反应物的浓度成正比,从而引导学生理解浓度对化学反应速率的影响以及造成这种影响的原因。接着,教材围绕着以下思路:增加反应物分子中活化分子的百分数→增加有效碰撞次数→增加化学反应速率,又进一步介绍了压强(有气体存在的反应)、温度、催化剂等条件对化学反应速率的影响以及造成这些影响的原因,使学生对上述内容有更深入的理解。 教材最后采用讨论的方式,要求学生通过对铁与盐酸反应的讨论,综合运用本节所学习的内容,进一步分析外界条
常见的化学反应及现象综合 1、澄清石灰水中通入二氧化碳气体(复分解反应) Ca(OH)2 + CO2 = CaCO3↓ + H2O 现象:石灰水由澄清变浑浊。 相关知识点:这个反应可用来检验二氧化碳气体的存在。 2、镁带在空气中燃烧(化合反应) 2Mg + O2 = 2MgO 现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。 相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃 ;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。 3、水通电分解(分解反应) 2H2O = 2H2↑ + O2↑ 现象:通电后,电极上出现气泡,气体体积比约为1:2 相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气与氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电 4、生石灰与水反应(化合反应) CaO + H2O = Ca(OH)2 现象:白色粉末溶解 相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰就是氧化钙,熟石灰就是氢氧化钙。(4)发出大量的热 5、实验室制取氧气 ①加热氯酸钾与二氧化锰的混合物制氧气(分解反应) 2KClO3MnO2催化2KCl + 3O2↑ 相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量与化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体就是氯化钾与二氧化锰的混合物,进行分离的方法就是:洗净、干燥、称量。
高中化学人教版选修4《影响化学反应速率 的因素》说课教案 一、教材分析 1、地位与作用: 本节选自高中化学人教版选修4《化学反应原理》的第二章第二节,是化学反应原理的重要组成部分,与生产生活密切相关。就全章内容来看,既是第一节化学反应速率的理论延伸,也是第三节化学平衡的研究基础,起着承上启下的重要作用。 2、教材处理: 1为了加强学生自主探究,一改教材边实验边理论的方式,采用先理论猜想后实验验证的科学发现的次序,使实验的开放性更强,方案均由学生设计。 2为了使现象对比更明显,增加CaCO3和不同浓度盐酸反应的实验。 二、学情分析 1、已有的知识: 1必修2中,学生对影响化学反应速率的因素存在一定的感性认识; 2在本册绪言中学习了碰撞理论相关知识。 2、已具备的能力: 1学生初步具备简单化学实验方案的设计能力,能够合作完
成实验探究; 2具备一定的观察、分析、质疑和表达能力。 3、可能遇到困难: 1抽象思维还不成熟,困惑于宏观现象的微观解释,尤其是压强对速率的影响; 2对实验方案的选择和评价,缺乏多角度的综合分析能力。 三、教学目标 1、知识与技能: 1能初步运用碰撞理论解释浓度、压强、温度和催化剂等条件对化学反应速率的影响; 2自主设计实验方案,探究外界因素对化学反应速率的影响。 2、过程与方法: 1通过“联系旧知-提出问题-理论猜想-实验验证-现实应用”的科学发现方法来学习化学反应速率; 2通过设计方案-动手实验-交流讨论-自评互评,掌握对比法、控制变量法、定性实验方案选择原则等科学方法。 3、情感态度与价值观: 1让学生在操作、观察、讨论、联系的过程中感受成功的喜悦,体会化学对生产生活的重要性; 2培养学生的团队协作精神及创新、求实的科学态度,激发学生的研究兴趣。 4、教学重点和难点:
常见反应的现象 CO 2 SO 2 2P 2 2H 2 Fe 2 2Al 2 2 2CuO 2 2 2 2HgO
CO 2 2H 2H 2 3 +CuO C+2CuO
CO+CuO 描述实验现象时要注意不能说出生成物的名称,但可以根据生成物的化学性质来描述生成物。
常见物质的颜色、气味 固体 ●红色:红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO ●红褐色:氢氧化铁Fe(OH)3 ●黄色:金Au、硫S ●绿色:碱式碳酸铜Cu2(OH)2CO3 ●紫黑色:高锰酸钾晶体KMnO4 ●淡蓝色:固态氧O2 ●蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O ●银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……) ●黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO等●深灰色:石墨C ●灰白色:大多数磷肥 ●无色:金刚石C、干冰CO2、冰H2O ●白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。 ●有刺激性气味的固体:碳酸氢铵NH4HCO3 液体 ●淡蓝色:液态氧O2 ●蓝色:含有Cu2+的溶液 ●浅绿色:含有Fe2+的溶液 ●黄色:含有Fe3+的溶液 ●银白色:汞Hg ●我们学过的大多数液体都是无色的。 ●有特殊气味的液体:乙醇C2H5OH ●有刺激性气味的液体:醋酸CH3COOH 气体 ●红棕色气体:二氧化氮NO2 ●有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等 ●有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等 ●我们学过的大多数气体都是无色无味的。 ●计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧 O3等 ●能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等
化学反应的速率和限度(第2课时) 三维目标 知识与技能 1.理解可逆反应、化学反应平衡的概念 2.化学反应限度的本质原因及外部特征。 3.学习实验研究的方法,能设计并完成一些化学实验。通过实验探究响形成化学反应平衡的概念及化学反应限度的概念 过程与方法 1.通过科学探究的基本方法,提高科学探究的能力。 2.通过探究实验认识化学平衡与反应限度,并用得到的结论去指导去分析和解决实际问题。 情感、态度与价值观 1、培养学生参与化学科技活动的热情。 2、培养学生将化学知识应用于生产、生活实践的意识。 3、培养学生对与化学有关的社会和生活问题做出合理判断的能力。 教学重点 化学反应速率和反应限度概念;了解影响化学反应速率和反应限度的因素。
教学难点:化学反应限度的本质原因及外部特征。 教具准备 多媒体课件、投影仪。 教学过程 【创设情境】科学史话: 高炉尾气之谜 【引导发现】某些化学反应的反应物并不是按化学方程式中的相应物质的计量关系完全转变为生成物。 【提出概念】化学反应存在着限度问题 【探究问题】反应平衡状态的宏观特征,反应平衡状态微观本质,影响化学反应限度的因素 【收集信息】小组讨论、交流,阅读教材。 【概念建立】 1、可逆反应 概念:同一条件下正反应和逆反应均能进行的化学反应。 2、化学平衡状态 宏观特征:反应物的浓度和生成物的浓度不在改变,一种表明静 止的状态。 微观本质:正逆反应的速率相等,单位时间内各物质的生成量和 消耗量相等。
3、影响限度的因素 【实际应用】化学反应条件的控制 目的:促进有利的反应,抑制有害的反应。 措施:通过控制反应条件,促进反应的限度以提高原料的利用率或转化率。 板书设计 化学反应的速率和限度 二、化学反应的限度 1、可逆反应 概念:同一条件下正反应和逆反应均能进行的化学反应。 2、化学平衡状态 宏观特征:反应物的浓度和生成物的浓度不在改变,一种表明静 止的状态。 微观本质:正逆反应的速率相等,单位时间内各物质的生成量和 消耗量相等。 3、影响限度的因素 三、化学反应条件的控制 目的:促进有利的反应,抑制有害的反应。 措施:通过控制反应条件,促进反应的限度以提高原料的利用率
蛋白质降解及氨基酸代谢 1、细胞内的蛋白质降解 (1)不依赖ATP的溶酶体途径,主要降解细胞通过胞吞作用摄取的外源蛋白、膜蛋白及长寿命的细胞内蛋白。在营养充足的细胞内没有选择性。饥饿细胞:选择性降解含有五肽Lys-Phe-Glu-Arg-Gln或相关的序列的胞内蛋白。 (2)依赖ATP的泛素途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白(调节蛋白),此途径在不含溶酶体的红细胞中尤为重要。(选择性降解) 2、细胞内蛋白质降解的意义 (1)清除异常蛋白; (2)细胞对代谢进行调控的一种方式; (3)在需要时降解供肌体需要。 3、氨基酸的分解代谢主要在肝脏中进行。包括:脱氨基作用(最主要的反应)和脱羧基作用。 4、氧化脱氨基作用:α-氨基酸在酶的催化下氧化生成α-酮酸,此时消耗氧并产生氨。 5、L谷氨酸——α-酮戊二酸+ NH3 是L-Glu脱氢酶催化下的可逆反应,一般情况下偏向于谷氨酸的合成,因为高浓度氨对机体有害。L-谷氨酸脱氢酶为不需氧脱氢酶,辅酶为NAD+或NADP+,此酶为别构酶,此反应与能量代谢密切相关,ADP、GDP是其别构激活剂。
6、转氨基作用:指在转氨酶催化下将α-氨基酸的氨基转给另一个α-酮酸,结果原来的α-氨基酸生成相应的α-酮酸,而原来的α-酮酸则形成了相应的α-氨基酸。它是体内各种氨基酸脱氨基的主要形式,其逆反应也是体内生成非必需氨基酸的途径。 7、转氨酶种类很多:其中谷草转氨酶(GOT)在心脏中活力最大,其次为肝脏;谷丙转氨酶(GPT)在肝脏中活力最大,用于诊断肝功能。转氨酶的辅酶均为磷酸吡哆醛(VB6的磷酸酯)。 8、联合脱氨基作用:(1)转氨酶与L-谷氨酸脱氢酶作用相偶联:大多数转氨酶优先利用α-酮戊二酸作为氨基的受体,生成Glu,约占生物体的10%;(2)转氨基作用与嘌呤核苷酸循环相偶联:肝脏中90%谷氨酸经转氨基作用转化为天冬氨酸。 9、脱羧基作用:氨基酸经脱羧基作用生成伯胺类化合物和CO2。AA脱羧酶专一性很强,每一种AA都有一种脱羧酶,辅酶都是磷酸吡哆醛。AA脱羧反应广泛存在于动、植物和微生物中,有些产物具有重要生理功能。但大多数胺类对动物有毒。体内的胺氧化酶能将胺氧化为醛和氨,醛进一步氧化成脂肪酸。 10、NH3去向。(1)重新利用:合成AA、核酸。(2)贮存:高等植物将氨基氮以Gln和Asn的形式储存在体内。(3)排出体外:高等动物通过尿素循环在肝中将NH3生成尿素,通过肾脏排出体外。 11、尿素循环(鸟氨酸循环):在排尿动物体内由NH3合成尿素是在肝脏中通过一个循环机制完成的,这一个循环称为尿素循环。 过程:(1)NH3、CO2与鸟氨酸作用合成瓜氨酸;(2)瓜氨酸与天
高一化学《化学反应速率》说课稿3 尊敬的各位评委、老师大家,晚上好!今天我给大家介绍的是人教版《普通高中课程标准实验教科书化学(必修2)》第二章第三节《化学反应速率和限度》的第一课时《化学反应速率》的教学设计。我将从教材分析、教法分析、学法分析、教学程序、板书设计、教学反思等六个方面给大家介绍我对这一课时的教学设计。 1.教材分析 1.1地位与作用 化学反应速率是人教版高中化学必修2的第二章《化学反应与能量变化》中的第三节内容。第三章的第一、二节主要讨论的是化学反应中的物质的变化及能量变化的根本问题,第三节是前两节知识的拓展和延续,也是化学知识在社会发展、农业发展以及现实生活中的应用。同时为选修4《化学反应原理》中化学反应速率和化学平衡的学习打好基础。 第三节从日常生活中常见(如溶洞的形成、钢铁的生锈、牛奶的变质等)的化学现象,引出反应速率的概念。通过化学实验(使用催化剂与未使用催化剂的比较、不同催化剂的催化效率比较等)探究和“思考与交流”中温度、比表面积、反应物的状态、溶液浓度及催化剂的使用等,从而总结影响化学反应速率的因素,为化学反应限度概念的学习打基础的同时了解化学反应速率对人来生活的影响。 这部分的内容在云南省学业水平考试中要求:学生了解速率的含义,浓度、温度和催化剂对化学反应速率的影响;在普通高中化学课程标准中的要求:通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。 在历年的高考中化学反应速率是常考题,经常是化学反应速率和化学平衡一起出现,所以能否掌握这部分内容将影响到后续内容的学习和知识的迁移,以及学生对化学的学习兴趣。 1.2教学目标 1.2.1知识与技能 ①了解化学反应速率的概念 ②理解化学反应速率的表达式、单位及其意义。 ③认识影响化学反应速率的条件。 1.2.2过程与方法 ①通过日常生活中的常见的化学现象引入化学反应速率的概念。
-氨基的反应 亚硝酸反应 范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法) 注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较 慢. 与酰化试剂的反应 Aa+酰氯,酸酐-→Aa被酰基化 丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量.烃基化反应 Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代. 与2,4-二硝基氟苯(DNFB,FDNB)反应 最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa 与苯异硫氰酸酯(PITC)的反应 Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋白 质的Aa顺序分析方面占有重要地位( Edman降解法)形成西佛碱反应 Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘s base) 前述甲醛滴定:甲醛与H2N-CH2-COO-结合,有效地减低了后者的浓 度,所以对于加入任何量的碱, [H2N-CH2-COO- ]/ [+H3N-CH2-COO- ] 的比值总要比不存在甲醛的情况下小得多。加入甲醛的甘氨酸溶液 用标准盐酸滴定时,滴定曲线B并不发生改变。 脱氨基反应 Aa在生物体内经Aa氧化酶催化即脱去α-NH2而转变成酮酸 α-COOH参加的反应 成盐和成酯反应 Aa + 碱-→盐 Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水) Aa-COOH + 醇-→酯 Aa+ EtOH ---→氨基酸乙酯的盐酸盐 当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反应性 能被掩蔽或者说COOH被保护,NH2的化学性能得到了加强或 活化,易与酰基结合。Aa酯是制备Aa的酰氨or酰肼的中间 物 成酰氯反应 当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作 用生成酰氯 用于多肽人工合成中的羧基激活 叠氮反应 氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼 和亚硝酸变成叠氮化合物
实验一 蛋白质和氨基酸的呈色反应 一、目的要求 验证蛋白质特性;学习和掌握蛋白质呈色反应的原理和方法;学习几种常用 的鉴定蛋白质和氨基酸的方法。 二、实验原理 蛋白质中的某些化学键或氨基酸残基中的某些化学基团可以与某些特殊试 剂形成特定的有色物质。这些反应称为蛋白质的呈色反应。 各种蛋白质的氨基酸残基不完全相同。因此,呈色反应产物的颜色也不完全 一样。呈色反应不是蛋白质所特有,一些非蛋白物质也能呈现类似的呈色反应。因此,不能仅以呈色反应结果来判别被测物质是否为蛋白质。 三、呈色反应 双缩脲反应 1.原理 两分子尿素经加热至180°C 后可以缩合成一分子双缩脲,并放出一分子氨。 双缩脲在碱性溶液中与铜离子结合生成紫红色络合物,此反应称为双缩脲反应。 多肽及所有蛋白质均具有肽键,与双缩脲分子中亚酰胺键结构相同,也能发 生此反应,因此,蛋白质在碱性溶液中与铜离子也能呈现出类似于双缩脲的颜色反应。 2.器材与试剂 1)器材 试管、药匙、电炉、试管夹、滴管。 2)试剂 〈1〉蛋白质溶液(10%卵清蛋白溶液):吸取鸡蛋清溶液10ml ,加蒸馏水稀 释,定容至100ml 。 〈2〉10%氢氧化钠溶液。 〈3〉1%硫酸铜(CuSO4)溶液。 〈4〉0.1%甘氨酸(Gly)溶液:称0.1g 甘氨酸溶于蒸馏水中,稀释至100ml 。 〈5〉结晶尿素。 3.实验步骤 双缩脲反应实验 1234 尿素+ 加热后的尿素+ 蛋白质溶液/滴3 0.1%Gly/滴3 10%NaOH/滴5555 1%CuSO 4/滴1111 显色现象 试管 试剂/滴 (1)制备双缩脲:取结晶尿素少许(约火柴头大小),放入干燥的小试管中。 微火加热至尿素熔解至硬化,刚硬化时立即停止加热,尿素放出氨,此时双缩脲
《化学反应速率和限度》说课 巨野教研室姜亚杰 教材为化学必修2第二章第三节《化学反应的速率与限度》。新课标将本节分为两课时,下面我将从教材分析,目标分析,过程分析,教学评价,效果分析等几个方面谈一谈关于《化学反应速率和限度》第一课时的设计。 一、教材分析: 1、地位作用:通过以前的元素化合物知识的学习,学生知道了物质的性质不同,例如知道金属的活泼性,有的能跟酸反应,有的不能跟酸反应。意识到化学反应中有的比较快,有的比较慢。但是没有从根本上认识化学反应的快慢。本节教学目的不是让学生深入认识化学反应速率,而是让他们认识化学反应有快慢之分,引导学生从化学反应快慢这一全新的视角,继续认识化学反应。 2、教学重点、难点 教学重点:了解化学反应速率的概念;知道影响化学反应速率的因素。 教学难点:影响化学反应速率的因素。 在实际生活生产中,很多方面都涉及到化学反应速率问题,所以把化学反应速率的概念,了解影响化学反应速率的因素定为本节重点。而学习的目的在于应用,对影响化学反应速率的因素原理的学习显的尤其重要,对如何根据具体外界条件的变化,来判断化学反应速率的变化这一难点,本节课通过实验探究分析比较的方法得以突破。 二、目标分析 根据新大纲人才培养的素质要求和学生的实际,确立以下三维目标。 知识与技能目标: 知道化学反应速率的概念,认识浓度、温度、催化剂等对化学反应速率的影响。 过程与方法目标: 结合化学实验培养学生的观察能力、记录实验现象及设计简单实验的能力。 情感态度与价值观: 通过学习过程,使学生初步学会从化学视觉去观察生活、生产和社会中有关化学反应速率的问题。 教学指导思想: 化学反应速率和化学平衡是重要的化学基本理论,是解决生产、生活中与化学反应有关问题的重要依据。因此,在教学过程中,要紧密联系生产、生活实际。 本节课虽然属于化学基本理论教学,但并不枯燥。在进行教学时,我首先让学生利用已有知识和生活经验预测影响化学反应速率的因素;再组织学生进行实验探究,验证假设,得出结论;最后再回到生产、生活中,利用所学新知识解决实际问题。 三、教学流程 1、创设情境,引入新课 为学生提供阅读材料——硫酸制造工业的发展,并提出问题:你对化学反应的研究方向有哪些新发现?从而使学生体会化学反应快慢是可以改变的,而如何使化学反应加快是化学反应研究的又一重要内容。进入本节课主题——化学反应的快慢。 2、主题探究 ⑴自学探究阅读P40 第3自然段内容思考: 用什么方法表示化学反应的快慢呢?化学反应过程中还有哪些物理量发生了变化?还可以怎样表示某一化学反应的反应速率?
化学反应类型 1、化学反应四种基本反应类型 ①化合反应:由两种或两种以上物质生成另一种物质的反应 ②分解反应:由一种反应物生成两种或两种以上其他物质的反应 ③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应 ④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应 2、氧化还原反应 氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应 氧化剂:提供氧的物质 、C、CO) 还原剂:夺取氧的物质(常见还原剂:H 2 3、中和反应:酸与碱作用生成盐和水的反应
氧化反应
氧化还原反应 +CuO Cu+H 3 3 CO+CuO Cu+CO 2Fe+3CO 3 3Fe+4CO 4 CO+FeO Fe+CO
四种基本反应类型 ①化合反应:由两种或两种以上物质生成另一种物质的反应。 如:A + B = AB ②分解反应:由一种反应物生成两种或两种以上其他物质的反应。 如:AB = A + B ③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。 如:A + BC = AC + B 2Mg+O 2 2MgO CO 2+H 2O=H 2CO 3 有 参加时,化合价改变 2CO+O 2 2CO 2 2H 2O 2H 2↑+O 2↑ CaCO 3 CaO+CO 2↑ 有 生成时,化合价改变 2KMnO 4 △ 2K 2MnO 4+MnO 2+O 2↑ H 2 △ Cu+H 2O (或C+CuO ) Zn+H 2SO 4=ZnSO 4+H 2↑(金属与酸) 化合价 变 Fe+CuSO 4=FeSO 4+Cu (金属与盐)
《影响化学反应速率的因素》说课稿 一、教材分析 1.教材所处的地位和作用: 本节内容在全书和章节中的作用是:《影响化学反应速率的因素》是人教版高中化学教材选修四,第二章第二节内容。在此之前学生已学习了第一节化学反应速率为基础,这为过渡到本节的学习起着铺垫作用。本节内容为化学平衡及化学平衡移动的学习奠定基础,以及为其他学科和今后的学习做好准备。 学情分析 教学对象是高二理科学生,经过前一段的化学学习,他们已经储备了一定的相关知识:,积累了一些化学方程式,掌握了基本的实验技能,基本上都养成了良好的思考、讨论、探究的习惯,必修二中初步学习了温度、压强、催化剂、浓度、接触面积等因素对化学反应速率的影响等对本节内容奠定了一定基础,新课标的理念和学生的学习经历决定着该部分内容的教学目标不是在知识的深度和广度上而是要注重培养学生的科学精神,科学的探究方法,学以致用,根据上述情况,我为本节课制定了如下教学目标: 教学目标: 1、知识与技能 掌握浓度、压强、温度、催化剂对反应速率的影响。
能运用碰撞理论解释影响化学反应速率的因素。 2、过程与方法 通过实验观测浓度、压强、温度、催化剂对反应速率的影响。 3、通过小组讨论用碰撞理论解释影响化学反应速率的因素 4.情感态度与价值观 1、通过实验,培养学生严谨求实的科学态度。 2. 通过教学初步培养学生分析问题,解决实际问题,收集处理信息,团结协作,语言表达能力以及通过师生双边活动,初步培养学生运用知识的能力,培养学生加强理论联系实际的能力, 3 通过浓度、压强、温度、催化剂对反应速率的影响,学生从现实的生活经历与体验出发,激发学生学习兴趣。 教学重点:浓度对化学反应速率的影响 根据:其他条件对反应速率的影响均可归结为活化分子的浓度的影响 教学难点:用碰撞理论解释解释影响因素 教学手段:采用探究发现式教学。 三、教学过程 1、引入:让学生带着以下几个问题阅读课本的第一段内容 2、我们能通过计算出一个化学反应的速率,能否改变反应速率呢? 3、影响化学反应速率的因素是什么?我们人类能否控制这个因素?
初中常见的化学式 (1)单质类 氢气氧气氮气 氯气溴碘氦 气氖气碳磷 硫硅 (2)金属单质 钠:镁:铝:钾: 钙:铁:锌:铜: 钡 : 银: 汞: 锰: (3)化合物类: 1、氧化物: 水: 过氧化氢: 一氧化碳: 二氧化碳: 二氧化氮: 二氧化硫: 三氧化硫: 氧化镁: 氧化铜: 氧化亚铁: 氧化铁: 四氧化铁: 氧化铝: 二氧化锰: 氧化镁: 氧化钠: 2、常见的酸类: 盐酸:硝酸:硫酸: 磷酸:碳酸:硫化氢: 3、常见的碱: 氢氧化钠:氢氧化铜:氢氧化铁 氢氧化亚铁:氢氧化钙:氢氧化钾:
氢氧化钡:氢氧化镁:氢氧化锌: 氢氧化铝: 4、盐类 硝酸钠:硝酸钾:硝酸铜: 硝酸铁:硝酸亚铁:硝酸钙: 硝酸钡:硝酸镁:硝酸锌: 硝酸铝:硝酸铵:碳酸钠: 碳酸钾:碳酸铜:碳酸钙: 碳酸锌:碳酸镁:碳酸铵: 硫酸钠:硫酸钾:硫酸铜: 硫酸铁:硫酸亚铁:硫酸钙: 硫酸钡:硫酸锌:硫酸镁: 硫酸铝:硫酸铵:氯酸钾: 氯化钠:氯化铵:氯化铁: 氯化亚铁:氯化铜:氯化锌: 高锰酸钾:碳酸氢钠:碳酸氢铵:碱式碳酸铜: (4)常见有机物 甲烷:乙炔:甲醇: 乙醇:乙酸: (5)常见的化肥 尿素:硝酸铵:硫酸铵: 碳酸氢铵:氯化铵: (6)常见的结晶水合物 碱式碳酸铜:明矾:
蓝矾: 常见的化学反应现象及其反应方程式 两种物质生成另一种物质的反应) 燃烧:(1)在空气中燃烧:发出,放出,。 (2)在氧气中燃烧:发出,放出。 共同点:都能生成使变浑浊的气体是:。 反应方程式:(1)充分燃烧: (2)不充分燃烧: 2、硫燃烧:(1)在空气中燃烧:发出微弱的火焰,生成 的气体。这气体是。放出,。 (2)在氧气中燃烧:发出火焰,生成 的气体。这气体是。放出。 反应方程式:。 3、磷在氧气中燃烧:产生大量的,这白是:。 放出。(注:是白烟而不是白雾,白烟是固体,雾是液 体) 反应方程式:。 4、铁在氧气中燃烧(铁在空气中不能燃烧)现象:剧烈燃烧, ,生成黑色固体叫同时放出。
《化学反应的速率》说课稿 尊敬的各位评委、老师,大家好!今天,我说课的内容是人教版《普通高中课程标准实验教科书化学(必修2)》第二章第三节《化学反应速率和限度》中的第一课时《化学反应速率》。 下面我将从教材分析、教学目标、重点难点、学情分析、教法学法、教学设计、设计反思七个方面谈一谈关于《化学反应速率》的设计: 一、说教材 《化学反应速率》是人教版《普通高中课程标准实验教科书化学(必修2)》第二章第三节《化学反应速率和限度》中的内容。在前面两节中,教材着重探讨化学能向其他形式的能量(如热能和电能)的转化,并指出化学反应中的物质变化及伴随发生的能量变化是化学反应的两大基本特征。本节内容是对前两节内容的拓展和完善。通过学习使学生对化学反应特征的认识更深入、更全面,在头脑中建立起一个有关化学反应与能量的完整而又合理的知识体系。从日常生活中学生熟悉的大量化学现象和化学实验入手,引出反应速率的概念。在此基础上又通过实验探究,总结影响化学反应速率的因素。这部分内容是后面学习化学反应限度概念的基础,同时也为《普通高中课程标准实验教科书化学(选修4)化学反应原理》中第二章《化学反应速率和化学平衡》作好铺垫。 二、教学目标 目标内容的选择依据: (1)普通高中《化学课程标准(实验)》要求学生通过实验认识化学反应的速率,通过实验探究了解温度、催化剂对过氧化氢分解反应速率的影响。 (2)《**省普通高中学业水平考试标准与说明(化学)》中要求学生了解化学反应速率的含义,了解浓度、温度和催化剂对化学反应速率的影响。 (3)纵观历年高考,化学反应速率是常考题,经常是化学反应速率和化学平衡一起出现。 根据本部分内容在全章和整个高中的地位作用以及根据新课标人才培养的素质要求和学生的实际,我确定了以下教学目标: 三维目标 知识与技能
氨基酸代谢习题 (一)填空(42分) 1.氨基酸的降解反应包括()和()作用。 2.转氨酶和脱羧酶的辅酶通常是()。 3.谷氨酸经脱氨后产生()和氨,前者进入()进一步代谢。 4.尿素循环中产生的()和()两种氨基酸不是蛋白质氨基酸。 5.尿素分子中两个N原子,分别来自()和()。 6.氨基酸脱下氨的主要去路有()、()和()。 7.生物体中活性蛋氨酸是(),它是活泼()的供应者。 (二)选择题(24分) 1.转氨酶的辅酶是: A.NAD+ B.NADP+ C.FAD D.磷酸吡哆醛 2.参与尿素循环的氨基酸是: A.组氨酸B.鸟氨酸C.蛋氨酸D.赖氨酸 3.γ-氨基丁酸由哪种氨基酸脱羧而来: A.Gln B.His C.Glu D.Phe 4.L-谷氨酸脱氢酶的辅酶含有哪种维生素: A.维生素B1 B.维生素B2 C.泛酸D.维生素PP 5.在尿素循环中,尿素由下列哪种物质产生: A.鸟氨酸B.精氨酸C.瓜氨酸D.半胱氨酸 6.下列哪种氨基酸是其前体参入多肽后生成的: A.脯氨酸B.羟脯氨酸C.天冬氨酸D.异亮氨酸 7.组氨酸经过下列哪种作用生成组胺的: A.还原作用B.羟化作用C.转氨基作用D.脱羧基作用8.氨基酸脱下的氨基通常以哪种化合物的形式暂存和运输: A.尿素B.氨甲酰磷酸C.谷氨酰胺D.天冬酰胺 (三)是非判断题(15分) ()1.蛋白质的营养价值主要决定于必需氨基酸的组成和比例。 ()2.谷氨酸在转氨作用和使游离氨再利用方面都是重要分子。 ()3.氨甲酰磷酸可以合成尿素和嘌呤。
()4.磷酸吡哆醛只作为转氨酶的辅酶。 ()5.在动物体内,酪氨酸可以经羟化作用产生去甲肾上腺素和肾上腺素。(四)问答题(19分) 1.什么是尿素循环,有何生物学意义?(9分) 2.为什么说转氨基反应在氨基酸合成和降解过程中都起重要作用?(10分)