
植物组织培养
一、实验目的
1、掌握植物细胞无菌培养技术。
2、了解不同激素对细胞的不同诱导作用。
二、实验原理
植物组织培养是20世纪60年代以来植物细胞生物学中发展起来的一项生物技术。它是借用无菌操作方法,培养植物的离体器官,组织或细胞,使其在人工合成的培养基上,通过细胞的分裂、增殖、分化、发育,最终长成完整的再生植株。
植物组织培养技术的研究,不仅具有重大的理论意义,而且在生产实践中也已显示了广阔的应用前景。组织分化与形态建成问题,快速繁殖与去除病毒,花药培养与单倍体育种,幼胚培养与试管受精,抗体突变体的筛选于体细胞无体系变异,悬浮细胞培养与次生物质生产以及超低温种质保存等方面的深入研究与实际应用,都必须借助植物组织培养技术的基本程序和方法,深刻理解植物细胞的全能性。
三、实验用品
1、材料
半夏无菌苗。
2、仪器
卧式灭菌锅、超净工作台、烘箱、培养箱或培养室。
3、用具
镊子、刀、牛皮纸、marker笔、棉线。
4、器皿
试剂瓶(50、100、1000ml)、三角瓶(100ml)、刻度吸管(0.5、1、5、10ml)、培养皿(直径9~11cm)。
5、药品与试剂
1).药品(见下表)
2).70%酒精
四、实验方法
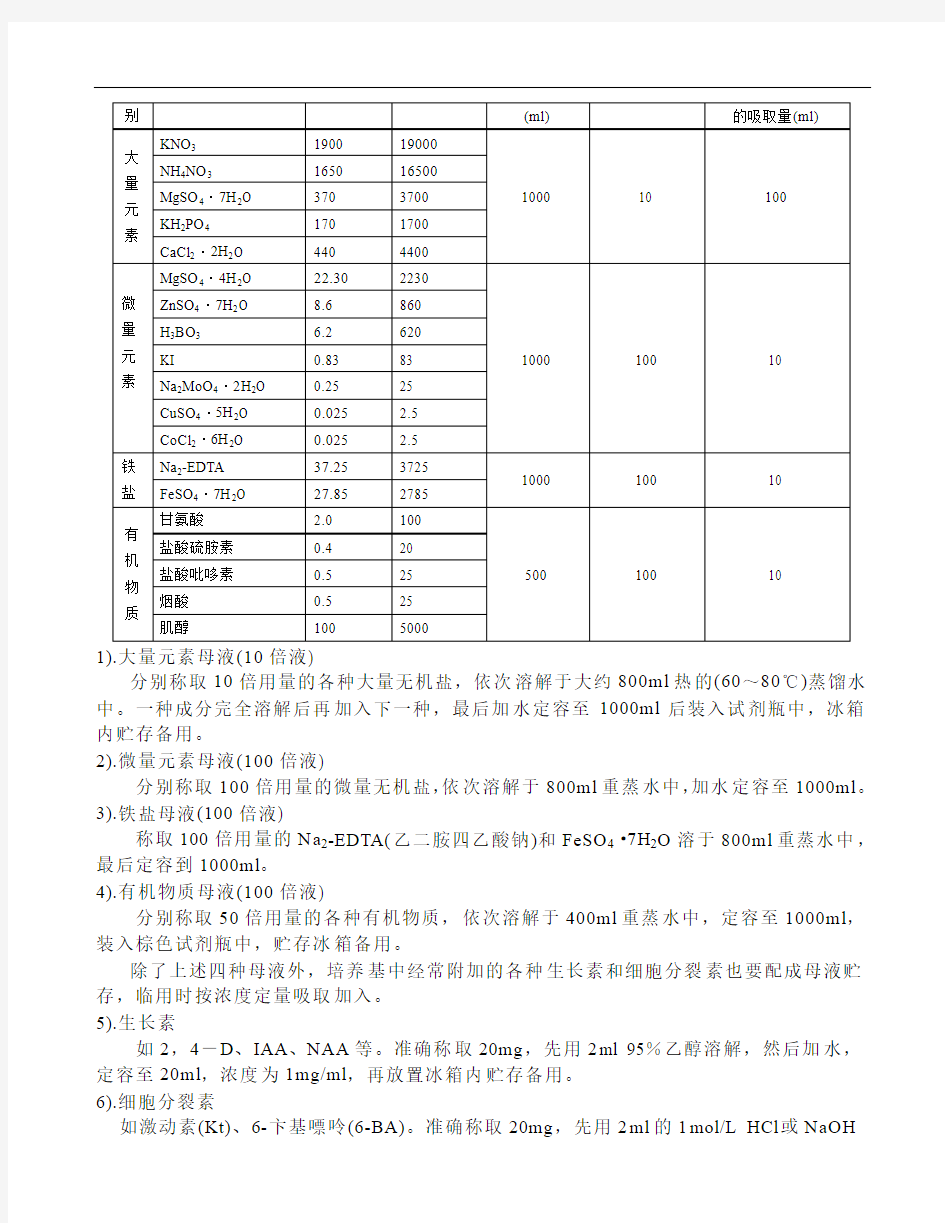
1、培养基的配制
配制培养基前先要配制母液。母液分大量元素、微量元素、铁盐及有机物质四类。(各类成分浓度、用量详见下表)。
表1 M S培养基母液配制(单位:mg)
1).大量元素母液(10倍液)
分别称取10倍用量的各种大量无机盐,依次溶解于大约800ml热的(60~80℃)蒸馏水中。一种成分完全溶解后再加入下一种,最后加水定容至1000ml后装入试剂瓶中,冰箱内贮存备用。
2).微量元素母液(100倍液)
分别称取100倍用量的微量无机盐,依次溶解于800ml重蒸水中,加水定容至1000ml。
3).铁盐母液(100倍液)
称取100倍用量的Na2-EDTA(乙二胺四乙酸钠)和FeSO4·7H2O溶于800ml重蒸水中,最后定容到1000ml。
4).有机物质母液(100倍液)
分别称取50倍用量的各种有机物质,依次溶解于400ml重蒸水中,定容至1000ml,装入棕色试剂瓶中,贮存冰箱备用。
除了上述四种母液外,培养基中经常附加的各种生长素和细胞分裂素也要配成母液贮存,临用时按浓度定量吸取加入。
5).生长素
如2,4-D、IAA、NAA等。准确称取20mg,先用2ml 95%乙醇溶解,然后加水,定容至20ml,浓度为1mg/ml,再放置冰箱内贮存备用。
6).细胞分裂素
如激动素(Kt)、6-卞基嘌呤(6-BA)。准确称取20mg,先用2ml的1mol/L HCl或NaOH
溶解,然后加水,定容至20ml,浓度为1mg/ml,再放置冰箱内贮存备用。
2、1L培养基的配制与分装
1).取1000ml烧杯一只,加大量元素10倍母液100ml,微量元素100倍母液10ml,铁盐100倍母液10ml,有机物质100倍母液10ml。然后加水至800ml,加蔗糖30g,NAA 终浓度0.25mg/L,6-BA0.75mg/L。待蔗糖充分溶解后用1mol/L的NaOH或HC l调酸碱度为pH5.8-6.0。
2).取一个250mL的烧杯,加200mL蒸馏水。煮沸后加8g琼脂条,待煮到一定境界后,液体为白色,糊了就会有点偏黄,但液体中最好不要还可见条状的琼脂。煮琼脂时顺便把刚才的800mL液体也加热至50-60度,待琼脂煮好后再混合就能避免琼脂凝固。分装到培养用三角瓶中,每只50ml三角瓶约装20-30ml培养基。分装时要避免把培养基倒在瓶口上,如果这样做了就用滤纸擦一擦,否则培养时容易引起杂菌污染。
3).把牛皮纸裁成适当大小的长方形,背靠背折起来,使成正方形,紧密裹在瓶口上,随后便可进行灭菌。
培养基的种类和附加成分是根据培养物的种类、外植体的来源以及具体的实验目的和要求来确定的。培养基中附加的蔗糖浓度均为0.8%(m/v)。
3、培养基的灭菌
把装好培养基的三角瓶放入高压灭菌锅中,盖好锅盖,我们此次用的是卧式灭菌锅,用法比较特别。首先最重要的是要确保水加够,然后放气阀为确保安全是一直开着的,先将旋钮打在关闭上,打开电源,当第一次加热的显示灯灭了之后,转换旋钮至灭菌,当第二次加热灯灭的时候,开始计时20min,然后关闭电源,打到慢排至压力降到0.05MPa再打到快排,降到0.02MPa后再换成全排,降至零后再换成关闭,打开盖子透气,让纸慢慢变干。放气过程有声音,所以也可以通过声音来判断是否该转换。
3、超净台的操作
两小时前先用70%酒精擦拭超净台,擦好后关上挡风玻璃,按D打开紫外,接种前15分钟,关闭紫外,打开大风,稍微将挡风玻璃打开一点。
先在外面把手洗干净,然后在超净台内先用70%酒精浸泡过的棉球擦拭工作台的台面。放入培养瓶和接种工具,接种用的镊子、解剖刀、接种针及培养皿等可事前放入,点燃酒精灯,用酒精棉球擦拭手。把镊子、解剖刀、接种针灯插入盛70%酒精的广口瓶中。
取一瓶半夏的无菌苗,先将整瓶苗分装到各个培养皿内的吸水纸上以防交叉感染,吸干水后,把叶子切成3×5mm大的小片,打开三角瓶,把叶片投入瓶内,用接种针拨匀,重新盖上牛皮纸,扎上棉线。用记号笔在瓶壁上写明培养材料、培养基代号,标明接种日期。
全部接种工作都是在严格无菌条件下进行的,所以要特别认真、仔细、以防杂菌污染。
五、培养和观察
接种完毕后取出培养瓶,置26~28℃恒温培养箱室内,先暗处理三天再移置在光照条件下培养,定期进行观察。一般三天染细菌(长菌处有浑浊的液体),七天染真菌(长菌处有霉和普通的霉差不多)如有污染则弃之,培养3~4周后观察实验结果。
五、实验结果
1、计算接种成功率(指没被污染的叶片数占总叶片的百分比)和诱导成功率(指诱导出细胞的叶片数占总叶片的百分比)。如果没有添加植物激素结果又会怎样?为什么?
2、人工条件下培养的植物离体器官、组织或细胞,经过分裂、增殖、分化、发育,最终长成完整植株的过程说明什么问题?
细胞内DNA和RNA的显示
一、目的要求
1、掌握显示细胞内DNA和RNA的方法。
2、熟悉细胞内DNA和RNA的分布位置。
二、实验原理
核酸是酸性的,它们对于碱性染料派洛宁和甲基绿具有亲和力。利用这两种染料的混合液处理细胞,可使其中的DNA和RNA呈现出不同的颜色,这种颜色上的差异由DNA 和RNA聚合程度的不同所引起,因为甲基绿分子上有两个相对的正电荷,它与聚合程度较高的DNA分子有较强的亲和力,可使DNA分子染成蓝绿色;而派洛宁分子中仅一个正电荷,可与低聚分子RNA相结合使其染成红色。这样细胞中的DNA和RNA可被区别开
来。
三、器材与试剂
1、器材:光学显微镜、载玻片、盖玻片、染色缸、染色架、注射器。
2、材料:鸡血。
3、试剂:0.2mo l/L醋酸缓冲溶液、2%甲基绿染液、1%派洛宁染液、甲基绿·派洛宁混合染液。
4、试剂的配制
(1)2mol/L醋酸缓冲溶液:用2ml注射器抽取1.2ml冰乙酸加入到98.8ml蒸馏水中,混匀。再称取醋酸钠(NaAC·3H2O)2.72g溶于100ml蒸馏水中,使用时按2:3的比例混合两液即成。
(2)2%甲基绿染液:称取2.0g去杂质甲基绿溶于100ml0.2mol/L的醋酸缓冲溶液中即成。
甲基绿粉中往往混有影响染色效果的甲基紫,它们必须预先除去,其方法是将甲基绿溶于蒸馏水中,放在分液漏斗中加入足量的氯仿(三氯甲烷)用力振荡,然后静置,弃去含甲基紫的氯仿,再加入氯仿重复数次,直至氯仿中无甲基紫为止,最后放入40 C温箱中干燥后备用。
(3)1%派洛宁染液:称取1g派洛宁(吡罗红)溶于100ml0.2/L醋酸缓冲溶液中混匀。
(4)甲基绿派洛宁混合染液:将2%的甲基绿液和1%的派洛宁液以5:2的比例混合均匀即可。该液应现配现用,不宜久置。
四、内容与方法
1、取鸡血一小滴在干净的载玻片一端,用另一载玻片的一端紧贴血滴,待血液沿其边缘展开后,以30~400角向玻片的另一端推去,制成较薄的血涂片,室温下晾干。
2、固定:将晾干的血涂片浸入70%乙醇中固定10分钟,取出后在室温下晾干。
3、染色:滴甲基绿派洛宁混合染液于血膜上,染色15min。
4、冲洗:用蒸馏水冲洗标本片,并用吸水纸吸去玻片上多余的水分,但不要吸得过干。
5、分化:将血涂片在95%酒精中迅速地过一下,进行分色,取出晾干。
6、观察:光镜下可见细胞质呈现红色,细胞核呈绿色。
五、作业与思考
1、简述DNA和RNA的染色原理。
2、细胞核中核仁理论上应被染成何种颜色?为什么?
鸡血细胞体外融合
一、实验目的
(1)了解聚乙二醇诱导体外细胞融合的基本原理。
(2)通过PEG诱导鸡血细胞之间的融合实验,初步掌握细胞融合的基本方法。
(3)
二、实验原理
细胞融合又称体外细胞杂交,是指用人工方法使两个或两个以上的体细胞融合成异核体细胞,随后,异核体细胞同步进入有丝分裂,核膜崩溃,来自两个亲本细胞的基因组和在一起形成只含有一个细胞核的杂种细胞。细胞融合技术是研究细胞遗传、基因定位、细胞免疫、病毒和肿瘤的重要手段。依据融合过程采用的助融剂的不同,细胞融合可分为:1.病毒诱导的细胞融合,如仙台病毒;2.化学因子诱导的细胞融合,如PEG;3.电场诱导的细胞融合;4.激光诱导的细胞融合。
PEG是乙二醇的多聚合物,存在一系列不同分子质量的多聚体。PEG可改变各类细胞的膜结构,使两细胞接触点处脂类分子发生疏散和重组,引起细胞融合。该方法应用相对分子质量为400-6000的PEG溶液引起细胞的聚集和粘连,产生高频率的细胞融合。融合的频率和活力与所用PEG的分子质量、浓度、作用时间、细胞的生理状态与密度等有关。
三、实验仪器、材料和试剂
(1)仪器、用具:注射器、离心管、离心机、水浴锅、滴管、显微镜烧杯、容量瓶、载玻片、盖玻片、酒精灯等。
(2)材料:鸡血细胞。
(3)试剂:
1)0.85%NaCl溶液
2)GKN液:8.0gNaCl, 0.4g KCl, 1.77g Na2 HPO4·2H2O, 0.69g NaH2PO4·H2O, 2.0g 葡萄糖,0.01g 酚红,溶于1L蒸馏水中。
3)50%(m/v)PEG溶液:取50g PEG4000 水浴融化后冷却至50~60℃加50m预热至50~60℃的GKN液,混匀,至于37℃备用。
4)Hanks 原液(10×):
80.0g NaCl, 1.2g Na2 HPO4·2H2O, 4.0g KCl , 0.6g KH2PO4 , 2.0g MgSO4·7H2O, 10.0g 葡糖糖,1.4g CaCl2
○1称取1.4g CaCl2,溶于30~50mL蒸馏水中。
○2取1L的烧杯及容量瓶各一个,先在烧杯中放入800mL蒸馏水,然后按上述
配方顺序,逐一称取药品。必须在前一药品完全溶解之后,方可加入下一药品,
直到葡糖糖完全溶解后,再将已溶解的CaCl2溶液加入,最后加水至1L。
5)Hanks液:
Hanks 原液100mL
蒸馏水896mL
0.5%酚红4mL
配好的hanks液保存于4度冰箱。
四、方法与步骤
1.制作鸡血细胞储备液
取来鸡血后,按照100U肝素/5mL全血的比例制成抗凝全血,然后再在其中加入4倍体积的0.85%NaCl溶液,制成红细胞储液,置于4℃冰箱内可供一周使用。
2.细胞悬液的制备
取鸡血细胞储备液1mL,加入4mL0.85%NaCl 溶液,混匀后,1200r/min离心5min,弃去上清液,再加入5mL0.85%NaCl溶液按上述条件离心一次。最后,弃去上清液,加入3mL的GKN溶液制成鸡血细胞悬液。
3.鸡血细胞的收集
吸取1mL鸡血细胞悬液放入离心管中,加入4mL Hanks液混匀,1000r/min离心5min。
弃去上清液,用手指轻弹离心管底部,使沉淀的血细胞团块松散。
4.PEG诱导细胞融合(KEY)
吸取1mL 37度的50%PEG溶液,沿着管壁迅速加入然后立即轻轻摇匀(此步非常容易造成血液凝集,不要拿离水浴锅太长时间)。37度水浴两到两分半钟。
5.终止PEG作用
缓慢加入5mL Hanks液,轻轻吹打混匀,置于37度水浴锅中静置5min。
6.制备细胞悬液
用吸管轻轻吹打细胞团块分散(KEY),1000r/min离心5min,使细胞完全沉降。弃去上清液,加800mLHanks,混匀。
7.镜检
在载玻片上滴一小滴细胞悬液,盖上盖玻片,先在10倍镜下找到细胞,再在40倍镜下看,如看到有疑似融合的,先调焦做第一次确定,如若确定通过,再用100倍镜确定(另外,视野较暗会比较容易观察)。
Feulgen反应
一、实验目的
学习Feulgen反应的原理与操作步骤。
二、实验原理
Feulgen反应是由Feulgen和Rossenbeck 于1924年创立,是特异性显示DNA的最经典方法。它主要包括DNA水解和显色两个反应步骤。DNA在60℃条件下经稀酸(1mo l/L HCL)水解,分子中的嘌呤碱基与脱氧核糖间的糖苷键断裂,在脱氧核糖的一端形成游离的醛基,这些醛基在原
位与Schiff试剂反应,形成紫红色的化合物,因此,细胞内含有DNA的部位会呈现紫红色阳性反应。福尔根反应即可进行DNA定位显示,又可用显微分光光度计惊醒定量分析。
Feulgen反应对组织中的DNA高度专一,组织中除DNA外还有多糖、RNA和其他自由醛基,固定液也可能产生一些醛基。但是,自由的醛基可能被盐酸酸解消除,绝大多数RNA经1M盐酸在60℃温度下处理会降解为可溶性成分,而多糖在此反应条件下则不会产生裸露的醛醛基。材料不经过水解或预先用热的三氯醋酸或DNA酶处理,得到的反应是阴性的,从而证明了Feulgen反应的专一性。
三、实验用品
1、材料:
洋葱根尖
2、器材:
解剖刀、镊子、水浴锅、载玻片、盖玻片、
3、药品与试剂:
1mol/L盐酸:
取82.5ml密度1.19g/ml浓盐酸加蒸馏水至1000ml。
Schiff试剂:
称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角瓶),时时震荡,继续煮5min (勿使之沸腾),使之充分溶解。然后冷却至50℃时用滤纸过滤,滤液中加入10ml1mol/LHCl,冷却至25℃时,加入0.5gNa2S2O5充分震荡后,塞紧瓶塞,在室温暗处理静止至少24h(有时需2~3d),使其颜色褪至淡黄色,然后加入0.5g活性炭,用力震荡1min,然后用粗滤纸过滤于棕色瓶中,封严瓶塞,外包黑纸。滤液应为无色也无沉淀,贮于4℃冰箱中备用。如有白色沉淀,就不能在使用,如颜色变红,可加入少许偏重亚硫酸钠或偏重亚硫酸钾,使之再转为无色,仍可使用。
亚硫酸水:
200ml自来水、10ml 10%偏重亚硫酸钠或偏重亚硫酸钾溶液、10ml 1mo l/L HCl,使用前,三者混匀使用。
四、实验步骤
1、将洋葱根尖放在1mo l/L HCl中,在60℃水浴锅中保温8~10min。
2、蒸馏水水洗。
3、Schiff 试剂遮光染色30min。
4、用新鲜配制的亚硫酸水溶液洗涤3次,每次1min。
5、水洗5min。
6、将根尖放在载玻片上,镊子捣碎,盖上盖玻片,压片。
7、镜检,细胞中凡是有DNA的部位应呈现紫红色的阳性反应。
8、找出根尖正在分裂的细胞,并找出它的前、中、后、末、间等五个时期。
对照组:
先将材料放在5%三氯醋酸中90℃水浴15min,其他步骤同实验组。
细胞凝集反应
一、实验目的
了解细胞膜的结构与功能。
二、实验原理
细胞膜是双层脂镶嵌蛋白质结构,脂和蛋白质又能与糖分子结合为细胞表面的分枝状外被。目前认为:细胞间的联系,细胞的生长和分化,免疫反应和肿瘤发生都和细胞表面的分枝状糖分子有关。
凝集素(lectin)是一类含糖(少数例外)的并能与糖专一结合的蛋白质,它具有凝集细胞和刺激细胞分裂的作用。凝集素使细胞凝集是由于它与细胞表面的糖分子连接,在细胞间形成“桥”的结果,加入与凝集素互补的糖可以抑制细胞的凝集。
三、实验用品
1、土豆块茎
2、显微镜、粗天平、载玻片、滴管2支、离心管2支。
3、PBS缓冲液
NaCl 7.2g
Na2HPO4 1.48g
KH2PO40.43g
H2O 1000ml
4、2%的红细胞
四、实验步骤
1、2%的红细胞的制备:
取一定量的红细胞,用生理盐水洗5次,每次2000r/min,离心5min,最后按压积红细胞体积用生理盐水配成2%红细胞液。
2、称取去皮土豆块茎2g,加10mlPBS缓冲液,浸泡2h,浸提液中含有可溶性淀粉土豆凝集素。
3、用滴管吸取土豆凝集素和2%红细胞液各一滴,置于载玻片上,充分混匀,静置20min
后,于倒置显微镜下观察血球凝集现象。
4、以PBS液加2%血细胞液作对照实验。
五、实验报告:
简图表示血细胞凝集原理。
细胞膜的渗透性
一、实验目的
了解细胞膜的渗透性及各类物质进入细胞的速度。
二、实验原理
将红细胞放入数种等渗溶液中,由于红细胞对各种溶质的透性不同,有的溶质可以渗入,有的溶质不能渗入,渗入的溶质能够提高红细胞的渗透压,所以水分进入细胞,引起溶血,溶质渗入速度不同,因此溶血时间也不同。
三、实验材料和试剂
1、器材
50ml小烧杯,10ml移液管,试管,试管架。
2、材料:动物血液
3、试剂:0.17mol/L氯化钠、0.17mol/L氯化铵、0.32mol/L硝酸铵、
0.17mo l/L硝酸钠
0.12mol/L草酸铵和0.12mo l/L硫酸钠
0.32mo l/L葡萄糖、0.32mo l/L甘油、0.32mol/L乙醇和0.32mol/L丙酮
四、实验方法
1、动物血液的稀释:取1份血液,加入10份0.17mol/L氯化钠溶液即可。
2、低渗溶液:取试管一支,加入10ml蒸馏水,再加入1ml稀释的血液,注意观察溶液颜色的变化,由不透明的红色逐渐澄清,说明红细胞发生破裂造成100%红细胞溶血,使光线比较容易透过溶液。
3、红细胞的渗透性:
取试管一支,加入0.17mo l/L氯化钠溶液10ml,再加入1ml稀释的血液,并轻轻摇动,注意颜色有无变化?有无溶血现象?为什么?
取试管一支,加入0.17mo l/L氯化铵溶液10ml,再加入1ml稀释的血液,并轻轻摇动,
注意颜色有无变化?有无溶血现象?若发生溶血,记下时间(自加入稀释血液到溶液变成红色透明澄清所需时间)。
分别在另外几种溶液中进行同样的实验。步骤同上。
五、实验结果讨论与分析
将观察倒的现象列入下表,对实验结果进行比较和分析。
试管编号是否溶血时间结果分析
1.10mlNaCl+1ml稀释血液
2. 10mlNH4Cl+1ml稀释血液
3. 10mlNH4Ac+1ml稀释血液
4. 10mlNaNO3+1ml稀释血液
5. 10ml草酸铵+1ml稀释血液
6. 10mlNa2SO4+1ml稀释血液
7. 10ml葡萄糖+1ml稀释血液
8. 10ml甘油+1ml稀释血液
9. 10ml乙醇+1ml稀释血液
10. 10ml丙酮+1ml稀释血液
人外周血细胞培养及染色体制备
Ⅰ微量全血培养
1966年以前基本上用Moorhead等1960年建立的人体外周血白细胞培养技术,它的优点是方法比较完善。缺点是取血量较多,手续较麻烦。近三十年来国内外绝大多数均采用微量全血培养技术,不但取血量少,而且可略去一些操作过程,如离心、分离血浆等,计数时,既方便,也节省人力与物力,便于推广应用。
一、实验目的
在体外培养外周血淋巴细胞,制备人的染色体
二、实验原理
在活体情况下,进入外周血的小淋巴细胞不能进行增殖,存活一定时间后就死去,由新进入外周血的小淋巴细胞补充。但在人工离体培养条件下,培养基中的PHA (phytohemagglutinin,植物血细胞凝集素)有刺激小淋巴细胞转化并进行分裂的能力。此时如加入适量秋水仙素(或秋水酰胺),便可使许多分裂细胞停滞于中期。采用常规制片技术,即可得到大量含染色体的标本。
三、实验用品
材料
人静脉血
器材
超净工作台、恒温箱、离心机、显微镜、移液管(5ml)、链霉素瓶(或25ml组织培养方瓶)、血浆瓶(100ml)、注射器(1ml、2ml)、烧杯(100ml)、量筒(50ml)、剪刀、镊子、酒精灯、精密PH试纸
试剂
RPMI-1640液(或Eagle’s液),小牛血清、肝素、PHA、双抗(青、链霉素)、5%NaHCO3、2%碘酒、75%酒精、2ug/ml秋水仙素(或2ug/ml秋水酰胺)、淋巴细胞培养基组成,包括人工合成培养液、血清、PHA、肝素、抗菌素等。人工合成培养液有很多种,一般常用的有TC-199、McCoy5A、Ham F-10、Ham F-12、RPMI-1640等,PHA(,植物血细胞凝集素)是从豆子(四季豆、雪山大豆、鸡子豆等)经0.85%生理盐水浸渍后提取的一种糖蛋白。
四、实验方法
培养基的制备
将无菌室紫外线灯开放1~2小时,洗和刷手,穿上无菌衣,拖鞋进入无菌室,开启超净工作台,关闭超净工作台的紫外线灯。用75%酒精擦洗手和各种试剂瓶,然后将
RPMI-1640培养液(或其他培养液)、血清、肝素、双抗、PHA等移入工作台上。
取10ml培养瓶(链霉素瓶)1个,内装:
RPMI-1640液 4 ml
小牛血清 1 ml
肝素(600IU/ ml)0.03ml
PHA(5mg/ml) 0.04ml
青、链霉素(青霉素10 000 IU/ ml、链霉素10 000 ug/ml)0.05 ml
(1 ml注射器、5#针头、5滴,相当于最终浓度为青霉素100 IU/ ml,链霉素100 ug/ml)混匀后吸一滴测PH,如偏酸,可加5%NaHCO3,、如偏碱,可加1mo l/L HCl,调整至PH6.8~7.0
采血
用肥皂和水洗净供血者之手,再用2%碘酒、75%酒精擦指尖,待酒精完全挥发干后,用无菌采血针或三棱针刺破指尖,用无菌吸管吸血0.3~0.4ml移入培养瓶,轻轻摇动,使血与培养液混匀即可培养。或用2ml注射器,7#针头,先吸取肝素少许湿润针筒,从肘静脉采血1~2ml,每个培养瓶接种全血0.3ml左右。亦可去产院取脐带血作培养。
培养
在37±0.5℃温养箱中培养68~72小时,终止培养前6~10小时加秋水仙素(2ug/ml),(或秋水酰胺2ug/ml)用1ml注射器接5#针头加3~4滴,使最终浓度为0.05~0. 2 μg/ml。
Ⅱ人淋巴细胞染色体标本的制作
一、实验目的
初步掌握染色体标本制作方法及其原理
了解人染色体的形态与数目
二、实验原理
被秋水仙素(或秋水酰胺)停滞于中期的大量分裂细胞,用低渗溶液处理(一般用KCL或其他低渗液)使样品中的红细胞膜破裂,并使分裂细胞和转化的淋巴细胞膨胀,结合离心技术,即可去掉红细胞碎片。再用固定液(甲醇:冰醋酸=3:1)使已膨胀的分裂细胞和转化的淋巴细胞膜破裂,随着分裂细胞膜破裂,染色体被释放出来,并且将其形态固定下来(通过低渗和固定,同时也使细胞质和染色体上部分蛋白质丢失)。然后采用空气干燥法制片,即可得到满意的染色体标本。
三、实验用品
材料
培养三天的人血
器材
恒温水浴(37±0.5℃)、相差显微镜,水平离心机,药物天平(称量100g),烧杯(100ml),尖底离心管(10ml),吸管,清洁载玻片(制片前放置于40%乙醇溶液中,冰箱4℃至少保存1小时),量筒(50ml),废液杯(500ml),磨口试剂瓶(100ml),酒精灯,橡皮头,试管架,定时钟
试剂
低渗液:0.4%KCL(potassium chloride AR)
固定液:甲醇(methyl alcolnol AR),冰醋酸(冰乙酸acetic acid glacial AR)每次在使用前按3:1新鲜配制
3.Giemsa 原液配制
Giemsa 染粉1g
甘油(AR)33ml
甲醇(AR)45ml
将染粉倾入研钵,加几滴甘油,在研钵内研磨至无颗粒为止。此时将全部剩余甘油倒入,置(60±0.5℃)温箱中保温2小时,加入甲醇搅拌均匀,保存于棕色瓶中备用
4.0.067mol/L磷酸盐缓冲液配制(pH6.8)
Na2HPO4.12H2O 11.81g
(或Na2HPO4.2H2O 5.92g)
KH2PO4 4.50g
用蒸馏水溶解至1 000ml
四、实验方法
经37±0.5℃培养72小时的外周血细胞,终止培养前6~10小时加秋水仙素(2μg/ml),(或秋水酰胺2μg/ml),最终浓度为0.01~0.02 μg/ml。
1.由温箱取出培养瓶,用吸管将贴在瓶壁上的细胞轻轻冲散,并用吸管移至尖底离心管内。
2.以1500r/min离心8min。
3.用吸管小心吸去上清液,连同细胞和上清液约留1 ml,随即用吸管将细胞团块轻轻冲散。
4.加入8ml 0.4%KCl(或0.075mol/L)液,于37±0.5℃水浴低渗处理10min。同时配置固定液(甲醇3份,冰醋酸1份)。
5.预固定:加1ml新配置的固定液于已低渗的细胞中,用吸管吹打均匀。立即以1 500r/min 离心8min,用吸管除净全部上清液及沉淀上层较透明部分(红细胞碎片)。
6.加新配置的固定液5~6ml,固定20min。
7. 1000r/min 离心6min,如此反复固定2~3次。
8.固定的细胞经离心后,吸去上层固定液,视管底的细胞多寡加入少量新配置的固定液,将细胞团块轻轻打散成悬液。
9.在干净、湿、冷之载玻片上加2~3滴细胞悬液,在酒精灯上文火烘干(在比较干燥的地方可以不用)。
10.在相差显微镜下观察有无分裂相,如果分裂相不多、分散不好,染色体短,就不要再继续试验。如果只是分散不好,可用固定液重固定一次,再滴片。
11.在相差显微镜下选择分裂相多,染色体分散好的,用Giemsa染色。
12.Giemsa 原液和磷酸盐缓冲液(pH6.8)1:10配置成Giemsa磷酸盐缓冲液染液,将玻片标本面朝上平放于玻璃支架上,每片滴加染液3~4ml ,染色10min。
13.自来水细流冲洗1~2s ,空气干燥。即可作显微摄影,进一步分析用。
五、实验结果
取一张人的淋巴细胞染色制片,用Giemsa染液染色。在低倍镜下可观察到中期分裂相。可见散在中期分裂相间的被去掉细胞膜和细胞质的转化大小不同的间期淋巴细胞核。
六、作业
先在低倍镜下观察中期分裂相的形态,再提高倍镜观察,计算一个中期分裂相的染色体数目。
选择分散适度,染色体不重叠的中期分裂相,绘制染色体图,注明染色单体,着丝粒,长短臂,次缢痕和随体的位置,以及染色体的类型,并注明性别。
在制作人的淋巴细胞染色体标本时应注意些什么问题?
细胞生物学实验: 《细胞生物学实验》是高等教育出版社出版的一本书籍,作者是王崇英、高清祥。 内容简介: 《细胞生物学实验(第3版)》在保留第2版简明、可操作性强等特点的基础上,删除了相对陈旧和不适用的实验,增加了反映目前细胞生物学研究现状和发展趋势的实验,并对每个实验的结构体系进行了调整,强化了要点提示及注意事项,增加了预期实验结果。全书共3篇7章42个实验和11个附录。第一篇7个实验介绍了“普通光学显微镜”、“特殊光学显微镜”、“激光扫描共聚焦荧光显微镜”、“双光子激光扫描荧光显微镜”和“电子显微镜”的原理及使用方法;第二和第三篇从基础性、综合性和设计性实验层面安排了35个实验,涵盖了“细胞形态结构和生理活动”、“细胞分裂与染色体标本制备”、“细胞培养、遗传转化及基因表达”、“染色体分析技术”以及“细胞周期与细胞凋亡”等内容,旨在培养学生的基本实验技能和综合创新能力;附录部分提供了“实验室注意事项”、“实验报告的书写要求”、“离心机转数与离心力换算表及公式”、“常用缓冲液的配制”和“常用细胞生物学词汇”等资料。书后附有部分实验的彩色图片和照片。《细胞生物学实验(第3版)》配有数字课程(基础版)网站。网站内容包括部分实验内容的录像片段、彩色图片和照片,供学有余力的学生学习和教师教学参考。《细胞生物学实验(第3版)》适合作为综合性大学、师范、农林、医学等院校相关专业本科生的细
胞生物学实验教材使用,也可供研究生、相关科研及实验技术人员参考。 目录: 第一篇显微镜技术 光学显微镜及其使用 普通光学显微镜及其使用 特殊光学显微镜及其使用 暗视野显微镜 相差显微镜 偏振光显微镜 微分干涉相差显微镜 荧光显微镜 激光扫描共聚焦荧光显微镜和双光子激光扫描荧光显微镜 激光扫描共聚焦荧光显微镜 双光子激光扫描荧光显微镜 电子显微镜及其使用 透射电子显微镜技术 透射电子显微镜的原理、用途与使用方法 透射电子显微镜样品制备(超薄切片) 扫描电子显微镜技术 扫描电子显微镜的原理、用途与使用方法 扫描电子显微镜样品制备
细胞生物学实验指导
细胞生物学实验指导目录 一.显微镜的使用 实验一、几种光学显微镜的使用 实验二、参观电子显微镜及生物超薄切片标本制备 二.细胞形态结构 实验三、细胞大小的形态观察——测微尺的使用 实验四、细胞活体染色技术 实验五、植物细胞骨架光学显微观察 实验六、胞间连丝观察 三.细胞化学 实验七、鉴定RNA的细胞化学方法——Branchet反应 实验八、DNA显色的观察——Feulgen反应 实验九、固绿染色法鉴定细胞内酸性蛋白与碱性蛋白 实验十、多糖及过氧化酶的显示 实验十一、核仁组成区的银染显示与观察 四.细胞生理 实验十二、细胞膜的通透性 实验十三、细胞电泳 五.细胞和组织培养技术 实验十四、植物原生质体的分离和融合 实验十五、植物细胞的培养与观察 实验十六、动物细胞融合 实验十七、动物细胞的培养与观察 六.细胞化学成分的分离 实验十八、细胞器的分离、纯化——细胞分级分离 实验十九、荧光的细胞化学测定 实验二十、细胞活力的鉴别 实验一几种光学显微镜的使用
一、实验目的 了解几种光学显微镜的结构、工作原理、主要用途和使用方法;掌握使用普通显微镜提高分辨力的方法。 二、实验原理 (一)基本原理 一般实验室经常使用的光学显微镜都是由物镜、目镜、聚光器和光阑组成,普通显微镜它们的放大原理及光路图如下: AB物体.A1B l第一次成像,A2B2第二次成像,O l目镜.O2物镜, F1为O l的前焦点,F2为O2的前焦点 各种光学显微镜的光学放大原理基本相同,各种特殊用途的光镜不过只是在光源、物镜、聚光器等方面作了改动,或在其它方面增设了某些特殊的设备。 (二)几种光学显微镜 l、普通光学显微镜: 普通光学显微镜也叫复式显微镜,是最常见,最简单的显微镜。它适于观察一般固定的,有色的透明度较高的标本。其最大分辨力一般为0.2微米,从构造上可分光学、机械和电子三大系统。 2、暗视野显微镜: 暗视野显微镜是以丁达尔现象(Tyndall phenomenon)(即光的微粒散射现象)为基础设计的,它使用了特殊的聚光器进行斜射照明,因光源中心束不直入物镜,所以视野黑暗,而被检细胞器因斜射照明发生衍射和反射,所以发亮可见。暗视野显微镜可用增加光照方法增加物体与背景的反差,因而可观察到0.2—0.004微米直径的微小粒子,但它分不清被检物的细微构造,它常用于观察物体的存在与运动。而暗视野显微镜与普通光学显微镜的区别,主要在于聚光器的不同,致使照明方法有别。确切地说,称暗视野显微镜为暗视野照明更为贴切。它是照明光线仅照亮被检样品而不进入物镜。使视野背景暗黑,样品明亮的照明方法。 3、相差显微镜: 相差是指同一光线经过折射率不同的介质其相位发生变化并产生的差异。相位是指在某一时间上,光的波动所达到的位置。
一、名词解释 1.分配常数:又称分配系数,是指一种分析物在两种不相混合溶剂中的平衡常数。 2.多肽链的末端分析:确定多肽链的两末端可作为整条多肽链一级结构测定的标志,分为氨基端分析和羧基端分析。 3.连接酶:指能将双链DNA中一条单链上相邻两核苷酸连接成一条完整的分子的酶。 4.预杂交:在分子杂交实验之前对杂交膜上非样品区域进行封闭,用以降低探针在膜上的非特异性结合。 5.反转录PCR:是将反转录RNA与PCR结合起来建立的一种PCR技术。首先进行反转录产生cDNA,然后进行常规的PCR反应。 6.稳定表达:外源基因转染真核细胞并整合入基因组后的表达。 7.基因敲除:是指对一个结构已知但功能未知或未完全知道的基因,从分子水平上设计实验,将该基因从动物的原基因组中去除,或用其它无功能的DNA片断取代,然后从整体观察实验动物表型,推测相应基因的功能。 8.物理图谱:人类基因组的物理图是指以已知核苷酸序列的DNA片段为“路标”,以碱基对(bp,kb,Mb)作为基本测量单位(图距)的基因组图。 9.质谱图:不同质荷比的离子经质量分析器分开后,到检测器被检测并记录下来,经计算机处理后所表示出的图形。 10.侧向散射光:激光束照射细胞时,光以90度角散射的讯号,用于检测细胞内部结构属性。
11.离子交换层析:是以离子交换剂为固定相,液体为流动相的系统中进行的层析。 12.Edman降解:从多肽链游离的N末端测定氨基酸残基的序列的过程。 13.又称为限制性核酸内切酶(restriction endonuclease):是能够特异识别双链DNA序列并进行切割的一类酶。 14.电转移:用电泳技术将凝胶中的蛋白质,DNA或RNA条带按原位转移到固体支持物,形成印迹。 15.多重PCR:是在一次反应中加入多对引物,同时扩增一份模板样品中不同序列的PCR 过程。 16.融合表达: 在表达载体的多克隆位点上连有一段融合表达标签(Tag),表达产物为融合蛋白(有分N端或者C端融合表达),方便后继的纯化步骤或者检测。 17.同源重组:发生在DNA同源序列之间,有相同或近似碱基序列的DNA分子之间的遗传交换。 18.遗传图谱又称连锁图谱(linkage map),它是以具有遗传多态性的遗传标记为“路标”,以遗传学距离为图距的基因组图。 19.碎片离子:广义的碎片离子为由分子离子裂解产生的所有离子。 20.前向散射光:激光束照射细胞时,光以相对轴较小角度向前方散射的讯号用于检测细胞等离子的表面属性,信号强弱与细胞体积大小成正比。 21.亲和层析:利用共价连接有特异配体的层析介质分离蛋白质混合物中能特异结合配体的目的蛋白或其他分子的一种层析法。(利用分子与其配体间特殊的、可逆性的亲和结合
1. 什么是细胞培养? 细胞生物学实验 指从动物活体体内取出组织,并将其分散为单个细胞(机械或酶消化),在体外模拟体内的生理环境,使其在人工培养条件下保持生长、分裂繁殖、细胞的接触性抑制以及细胞衰老过程等生命现象。 最常见的细胞一般有两种,一种是原代细胞,另一种是传代细胞。 原代细胞是指动物组织经过胰酶或胶原酶等酶类的消化,使其分散,从而获得单个细胞,再使这些单个细胞生长于培养容器中的过程。大多数组织可以制备原代细胞,但制备的方法略有不同,制备的细胞生长快慢及难易程度也不相同。 不同的原代细胞,其形态也不尽相同。一般将10代以内的细胞称之为原代细胞。 传代细胞一般指无限繁殖的细胞系,理论上这类细胞可以无限次的传代。做实验的时候也会经常使用这类细胞,如Hela、293、Vero 等细胞。 2. 细胞的生长周期 游离期:细胞刚接种到新的培养容器中到贴壁前的一段时期,这个时期的长短由细胞类型决定,从几分钟到几个小时不等。 贴壁期:细胞从游离状态变为贴附到培养器皿表面并展现出一定细胞形态的时期。 潜伏期:细胞在完成贴壁后,并不会马上进行增殖,会进行增殖所必须的物质和能量的储备,这个时候称之为潜伏期。
对数生长期:细胞在完成物质和能量储备后,开始大量的增殖的时期。这个时期的细胞活力旺盛,且状态稳定,我们所做的绝大多数实验都是在这个时期开展的。 停止期:随着细胞的生长,细胞密度越来越大,由于营养物质的消耗、细胞间的接触抑制等因素,细胞生长缓慢,甚至停止生长。这个时候,我们就要给细胞进行传代了,使细胞可以继续进行增殖,保持旺盛的活力。 3. 细胞生长所需要营养条件 细胞的培养所需要的营养成份一般来自于基础培养基(比如DMEM培养基)和血清。 基础培养基:主要是提供细胞生长所需要的氨基酸(组成蛋白质的基本单位)、维生素(细胞代谢中辅酶的组成成分)、无机离子(K+,Na+等)、碳水化合物(碳源和能量来源)和一些激素等营养物质。 血清:主要是提供一些基础培养基不能提供的生长因子和低分子的营养物质,此外它还有促进细胞的贴壁、中和有害重金属离子等作用。如果只提供基础培养基而不提供血清,绝大多数细胞是无法生长的。血清对于我们实验的重要性就不言而喻了,那么什么样的血清才算是合格的血清呢? 合格的血清需要通过各种检测,包括无细菌,无真菌,无支原体检测,无病毒污染。血清一般呈现为淡黄色,透明状液体,由于含有大量的蛋白质等成分,会略有黏稠。以全式金公司的TransSerum EQ Fetal Bovine Serum (FS201-02)为例,它通过了牛腹泻病毒、牛副
细胞生物学实验 实验一不同显微镜的使用及细胞一般形态结构的观测[实验目的] 通过本实验,使学生巩固普通光学显微镜的使用,学习相差显微镜、暗视野显微镜和荧光显微镜的使用方法,学习显微测量及显微摄影的操作方法,增强对细胞的形态和真实大小的感性认识。 通过本实验操作,要求学生掌握细胞形态结构的基本观测方法与技术,为进一步的细胞生物学研究打好基础。 [实验原理] 应用显微镜的成像原理(详见翟中和等主编《细胞生物学》,第三章第一节),同时借助显微镜的镜台测微尺和目镜测微尺,两尺配合使用,进行测量和运算,观察细胞形态,得出细胞的大小。 该实验完成需时6学时。 [实验材料、试剂和仪器] 一、仪器 普通光学显微镜、相差显微镜、暗视野显微镜、荧光显微镜、显微拍摄系统、37℃温箱、镜台测微尺、目镜测微尺等。 二、材料 洋葱根尖切片标本,念珠藻永久装片,兔肝细胞标本,夹竹桃花丝毛细胞,人口腔上皮细胞等。 三、试剂 生理盐水,10μg/mL罗丹明123染液(溶于甲醇,避光于4℃保存) [实验步骤] 一、暗视野显微镜观察夹竹桃花丝毛细胞 1、取一张清洁的载玻片,滴上一滴生理盐水。用镊子轻轻夹下一根夹竹桃花丝,置生理盐水中,盖上盖玻片,略微压片,用滤纸条吸去盖玻片四周多余的水分。 2、将上述装片置于显微镜载物台上,在10×物镜下找到夹竹桃花丝毛细胞清晰的图像。 3、换上暗视野聚光器,调节至最佳位置,通过聚光器上的调中螺旋调节聚光器的中心位置,得到最好的暗视野图像效果。 4、观察夹竹桃花丝毛细胞内部的显微结构和细胞质环流现象,并拍照。 5、换用高倍物镜观察时,要换用与高倍镜相匹配的暗视野聚光器,重复以上调节步骤。 二、相差显微镜观察夹竹桃花丝毛细胞 1、取一张清洁的载玻片,滴上一滴生理盐水。用镊子轻轻夹下一根夹竹桃花丝,置生
细胞生物学实验测试题 1、试述荧光显微镜的原理和用途。(并操作) 原理:荧光显微镜是以紫外线为光源,用以照射被检物体,使之发出荧光,然后在显微镜下观察物体的形状及其所在位置。 (滤光镜片:获得所需波长的激发光;光源:高压汞灯) 用途:荧光显微镜用于研究细胞内物质的吸收、运输、化学物质的分布及定位等。细胞中有些物质,如叶绿素等,受紫外线照射后可发荧光; 另有一些物质本身虽不能发荧光,但如果用荧光染料或荧光抗体染色后,经紫外线照射亦可发荧光,荧光显微镜就是对这类物质进行定性和定量研 究的工具之一。 2、试述酸性磷酸酶显示法的原理及主要步骤。 原理:酸性磷酸酶(ACP)是溶酶体的标志酶,通常酸性磷酸酶在pH 为5左右时发挥作用能水解磷酸酯而释放出磷酸基,PO43-与底物中硝酸 铅反应生成磷酸铅沉淀物。由于这些沉淀物是无色的,需再与黄色的硫化 铵反应,生成棕黄色到棕黑色的硫化铅沉淀而被显示出来。其反应过程如 下: β-甘油磷酸钠+酸性磷酸酶→甘油+PO43- PO43-+Pb(NO3)2 →Pb3(PO4)2↓ Pb3(PO4)2+(NH4)2S →PbS↓(棕黑色) 主要步骤: 1、前处理:获取小白鼠或大白兔腹腔液(猪肝) 2、制片: (1)、将腹腔液(肝细胞悬液)滴一滴于冰冻的干净载玻片上,用牙签涂开,自然干燥。 (2)、放入10%中性福尔马林固定液中固定30min。 (3)、蒸馏水中漂洗,3-5次。(洗去固定液) (4)、磷酸酶作用液,37°C,30Min。 (5)、蒸馏水中漂洗3次,5min一次。(洗去游离铅离子) (6)、1%硫化铵处理(3-5min); (7)、吉姆沙染液复染15min;(使细胞核、轮廓显示出来) (8)、制片观察。 结果:阳性细胞内有大小不等的棕色或棕黑色的颗粒即为酸性磷酸酶。 对照实验:标本放入作用液前先用高温(50℃)处理 30min,使酶失去活 性,做好标记,其他步骤相同。 3、试述DNA的Feulgen染色法的原理及主要步骤。 原理:DNA经稀盐酸(1mol/L HCL溶液)处理后,可使嘌呤碱与脱氧
细胞生物学实验指导 细胞生物学的发展总是依赖于技术和实验手段的进步,所以学习细胞生物学的技术和方法至关重要。 实验一普通显微镜及其使用(装片观察) 一、目的要求: 1、掌握显微镜的构造、油浸系的原理、使用方法、保护要点。 2、参观了解其他各类显微镜。 二、材料:普通光学显微镜及其他显微镜、细菌标本片、香柏油、二甲苯、擦镜纸。 三、方法和步骤: 1、介绍普通光学显微镜的构造 机械部分:镜座、镜臂、镜筒、转换器、载物台、调焦螺旋。 光学部分:接目镜、物镜、反光镜、聚光器。 2、油镜的原理及使用方法 原理:油镜头的晶片细小,进入镜中的光线亦少,光线经聚光器,通过载玻片进油镜时,由于空气介质和玻璃介质的折射率不一样,光线因折射而损失,使视野更暗。在载玻片和油镜之间加上和玻璃折光系数相同的香柏油,光线直接进入镜头,不发生折射,视野明亮,便于观察。 3、如何维护显微镜:机械部分的维护,光学部分的维护。 4、注意事项: (1)观察油镜载片时,先在载片上有菌影的地方滴1-2滴香柏油,然后放载物台中央,眼侧面看,慢慢降低油镜浸入香柏油中,镜头几乎接触标本。再用左眼在接目镜观察,同时慢慢旋动粗螺旋提起镜筒至能模糊看到物象时,再转动微调螺旋,直至看清晰为止。注意镜头离开油,就不能看清,重新按刚才的步骤进行。 (2)油镜使用过后,立即用擦镜纸擦拭镜头,如油渍已干,则可用香柏油粘二甲苯擦拭镜
头,再用干净擦镜纸擦去二甲苯。 5、观察几种细菌标本片。 6、示教看相差显微镜和荧光显微镜。 四、作业及思考题: 1、油镜的原理是什么? 2、光线强弱如何调节?与哪些部件有关? 实验二、细胞膜的渗透性 实验目的 了解细胞膜的渗透性及各类物质进入细胞的速度。 实验原理 将红细胞放入数种等渗溶液中,由于红细胞对各种溶质的透性不同,有的溶质可以渗入,有的不能渗入,渗入的溶质能够提高红细胞的渗透压,所以促使水分进入细胞,引起溶血,由于溶质透入速度互不相同,因此溶血时间也不相同。 实验用品 一、器材 50ml烧杯, 试管(1~10cm), 10ml移液管, 试管架。 二、材料 羊血。 三、试剂0.17mol/L氯化钠,0.17mol/L氯化胺,0.17mol/L醋酸胺,0.17mol/L硝酸钠,0.12mol/草酸胺,0.12mol/硫酸钠,0.32mol/葡萄糖,0.32mol/甘油,0.32mol/乙醇,0.32mol/丙酮。 实验方法 一、羊血细胞悬液 取50ml小烧杯一个,加1份羊血和10份0.17mol/L氯化钠,形成一种不透 明的红色液体,此即稀释的羊血。
实验室规则和要求 一般规定 1.上课第一天请先熟悉环境,牢记“安全”是进行任何实验最重要的事项。 2.在实验室内请穿著实验衣(最好长及膝盖下),避免穿著凉鞋、拖鞋(脚 趾不要裸露)。留有长发者,需以橡皮圈束于后,以防止引火危险或污染实验。 3.在实验室内禁止吸烟、吃东西、饮食、化妆、嚼口香糖、嬉戏奔跑,食 物饮料勿存放于实验室的冰箱中,实验桌上勿堆放书包、书籍、衣服外 套及杂物等。 4.所有实验仪器、耗材、药品等均属实验室所有,不得携出实验室外。每 组分配之仪器、耗材请在课程开始前确定清点与保管,课程结束后如数 清点缴回。公用仪器请善加爱惜使用。实验前后,请把工作区域清理擦 拭,并随时保持环境清洁。 5.实验前详阅实验内容,了解实验细节的原理及操作,注意上课所告知的 注意事项。实验进行中有任何状况或疑问,随时发问,切勿私自变更实 验程序。打翻任何药品试剂及器皿时,请随即清理。实验后,适切记下 自己的结果,严禁抄袭,确实关闭不用之电源、水、酒精灯及瓦斯等。 6.身体不适、睡眠不足、精神不济或注意力无法集中,请立即停止实验。 实验时间若延长,请注意时间的管制及自身的安全,不可自行逗留实验 室。 7.实验完毕,请清理实验室、倒垃圾、灭菌、关闭灯光及冷气,离开实验 室前记得洗手。 8.任何意外事件应立即报告教师或实验室管理人员,并应熟知相关之应变 措施。
药品 1.使用任何药品,请先看清楚标示说明、注意事项,翻阅物质安全资料, 查明是否对人体造成伤害,使用完毕请放回原位。 2.新配制的试剂请清楚注明内容物、浓度、注意事项及配制日期,为避免 污染,勿将未用完的药剂倒回容器内。 3.挥发性、腐蚀性、有毒溶剂(如甲醇、丙酮、醋酸、氯仿、盐酸、硫酸、 -巯基乙醇、甲醛、酚等)要在排烟柜中戴手套量取配制,取用完应随即盖好盖子,若不小心打翻试剂,马上处理。 4.有毒、致癌药剂例如丙稀酰胺(神经毒)、溴化乙啶(突变剂)、SDS(粉 尘)请戴手套及口罩取用,并勿到处污染,脱下手套后,养成洗手的好 习惯。 5.使用后的实验试剂和材料,应放在专用的收集桶内。固体培养基、琼脂 糖或有毒物品不得倒入水槽或下水道中。 6.使用刻度吸管取物时,切勿用嘴吸取,请用自动吸管或吸耳球。 仪器 1.使用仪器前先了解其性能、配备及正确操作方法,零件及附件严禁拆卸, 勿私自调整,并注意插座电压(110V或220V)之类别。 2.使用离心机时,离心管要两两对称、重量平衡,离心机未停下不得打开 盖子。冷冻离心机于开机状态时,务必盖紧盖子,以保持离心槽之低温并避免结霜。 3.电源供应器有高电压,切勿触摸电极或电泳槽内溶液,手湿切勿开启电 源。
实验一普通光学显微镜的构造和使用 一、目的要求 1了解显微镜的基本构造和使用方法 2 掌握油镜的原理和使用方法 二、显微镜的基本结构及油镜的工作原理 1.显微镜的基本构造 光学部分:接目镜、接物镜、照明装置(聚光镜、虹彩光圈、反光镜等)。 机械部分:镜座、镜臂、镜筒、物镜转换器、载物台、载物台转移器、粗调节器、细调节器等部件。 2.显微镜的放大倍数和分辨率 放大倍数=接物镜放大倍数×接目镜放大倍数 显微镜的分辨率:表示显微镜辨析物体(两端)两点之间距离的能力3.油镜的使用原理 当光线由反光镜通过玻片与镜头之间的空气时,由于空气与玻片的密度不同,使光线受到曲折,发生散射,降低了视野的照明度。若中间的介质是一层油(其折射率与玻片的相近),则几乎不发生折射,增加了视野的进光量,从而使物象更加清晰。 三、器材 1.永久切片 2. 溶液或试剂:香柏油、二甲苯。 3. 仪器或其他用具:显微镜、擦镜纸等。 四、操作步骤 1.观察前的准备 (1)显微镜的安置,检查零件是否齐全,镜头是否清洁。 (2)调节光源 2.显微镜观察
(1)低倍镜观察 (2)高倍镜观察 (3)油镜观察:高倍镜下找到清晰的物象后,提升聚光镜,在标本中央滴一滴香柏油,使油镜镜头浸入香柏油中,细调至看清物象为止。3.显微镜用毕后的处理 观察完毕,上升镜筒,用擦镜纸和二甲苯清洗镜头,后将镜体全部复原。 五、思考题 1.用油镜观察时应注意哪些问题?在载玻片和镜头之间滴加什么油?起什么作用? 2.为什么在使用高倍镜及油镜时应特别注意避免粗调节器的误操作? 实验二胞间连丝的观察 一、实验目的 观察植物细胞的胞间连丝,加深对胞间连丝功能的认识. 二、实验原理 植物细胞的细胞壁上有许多原生质的细丝,称胞间连丝。相邻细胞的胞间连丝相互联接,在细胞间的物质运输与信息传递中起桥粱作用,并使细胞的各种生理活动协调一致,使植物体成为统一的有机体。用合适的植物细胞为材料,经简单处理,即能方便地看到胞间连丝。 三、实验材料 红辣椒表皮细胞临时装片、柿胚乳细胞间胞间连丝切片 四、实验步骤
细胞生物学实验讲义 实验一不同细胞形态观察、大小测量,结构比较 一、实验目的 利用光学显微系统对生命的基本组成单位——细胞进行观察,了解不同细胞的形态、结构和大小区别。 二、实验原理 细胞是生物体的基本结构单位。构成生物机体的细胞是多种多样的。要对细胞进行研究,首先要从其形态结构入手。所以,要借助显微镜的成像及放大原理,在显微镜下,才能观察到细胞的基本形态结构。 三、实验内容和步骤 A、血涂片的制作 1.取末梢血1 滴,置载玻片一端,取另一边缘光滑的载玻片作为推片,放在血滴前面慢慢后移,接触血滴后稍停。血液即沿推片散开,将推片与载玻片保持30~45°角,向前平稳均匀推动推片,载片上便留下一层薄血膜。血涂片制成后,立即在空气中挥动,使其迅速干燥,以免血细胞变形。 2.操作 ①将干燥血片用甲醇固定3-5分钟。 ②将固定的血片置于被pH6.4 -6.8磷酸盐缓冲液稀释10-20倍的Giemsa染液中,浸染10-30分钟(标本较少可用滴染法)。 ③取出用水冲洗,待干后镜检。 注意: ①取血滴不宜过多,以免涂片过厚,影响观察。 ②要使涂片厚薄均匀、拿片角度和速度都要适中,用力要均匀。涂片时,血滴愈大,角度愈大,推片速度愈快则血膜愈厚,反之血膜愈薄。 ③涂片一般在后半部为好,白细胞在边缘和尾端较多。 B、洋葱表皮临时制片的制作 1.准备:擦净载玻片和盖玻片 2.制片 1)把载玻片平放在实验台上,用滴管在载玻片的中央滴一滴清水 2)用刀片在洋葱鳞片叶内侧表皮上,划出2-5平方毫米的小方格,然后用镊
子撕下方格内的表皮放在载玻片的水滴中。 3)用镊子将表皮展平。 4)用镊子夹起盖玻片,使它的一侧先接触载玻片上的水滴,慢慢放平。3.染色 1)用滴管在盖玻片的一侧滴适量稀释的碘酒。 2)用吸水纸在盖玻片的另一侧吸染液。 4.观察 C、人的口腔上皮细胞临时制片的制作 1.准备:擦净载玻片和盖玻片 2.制片 1)把载玻片平放在实验台上,用滴管在载玻片的中央滴一滴生理盐水。 2)用凉开水漱口,取消毒牙签在口腔侧壁上轻刮几下,将刮下的碎屑在载 玻片的液滴中涂抹均匀。 3)用镊子夹起盖玻片,使它的一侧先接触载玻片上的液滴,慢慢放平。 3.染色 a)用滴管在盖玻片的一侧滴适量碘液。 b)用吸水纸在盖玻片的另一侧吸碘液。 4.观察 四、实验准备 1.器材:普通光学显微镜,牙签、酒精棉球、载玻片。 2.材料:洋葱表皮,口腔上皮,血涂片,永久制片。 3.试剂:碘液,Giemsa染液,生理盐水,甲醇,香柏油。 五、作业 描绘你所观察到的各种细胞的结构及大小(以比例尺表示)。 1、血液涂片(必做)。 2、永久制片,洋葱表皮,人口腔上皮选做其一。 实验二植物细胞微丝束的观察 一、实验目的 掌握考马斯亮蓝R250染植物细胞内微丝束的方法。了解在微丝束细胞内的分布特点。 二、实验原理
细胞生物学实验教案 【经典学习资料,收藏必备】
实验一、细胞形态结构与几种细胞器的观察 【实验目的】 在普通光学显微镜下识别细胞和细胞器的形态结构,掌握生物绘图的方法。 【实验原理】 细胞在形态上是多种多样的,有球形、椭圆形、扁平形、立方形、梭形、星形等。虽然细胞的形状各异,但是它们却有共同的基本结构特点,都由细胞膜(动物)、细胞壁(植物)、细胞质和细胞核组成。细胞中的各种细胞器,如线粒体、高尔基体、中心体、核仁、染色体等,一般经过一定固定染色处理后,大多数在光学显微镜下是可以看见的(图)。细胞器的形态结构在普通光学显微镜下与电子显微镜下所看到的结构有很大的差别。 (自拍图) (a)(b) (c)(d) 图 1 细胞形态结构 a. 柿胚乳细胞示胞间连丝; b. 马蛔虫受精卵分裂中期示中心粒; c. 兔的神经细胞中高尔基体; d.小鼠肝细胞线粒体 【实验仪器、材料和试剂】 1. 仪器:复式显微镜、擦镜纸 2.材料:洋葱根尖切片、小白鼠肝切片、兔神经节切片、马蛔虫受精卵切片3.香柏油或石蜡油、二甲苯 【方法与步骤】
一、洋葱根尖切片细胞的观察 先用低倍镜观察根尖的纵切面,注意分生区、伸长区、成熟区细胞的异同,然后再仔细观察细胞的形态结构,特别注意细胞的形状、大小,以及细胞壁、细胞核、核仁、细胞质、液泡的形态结构。 二、兔神经节细胞切片高尔基体的观察 先在低倍镜下找到兔神经节细胞,然后转用高倍镜观察,可看到细胞内淡黄色的背景上有黄褐色的细胞核,核的周围分布着许多深褐色的(硝酸银镀染)高尔基体,呈弯曲的线状,颗粒状,少量分散在细胞质。 三、小白鼠肝细胞切片线粒体的观察 先用低倍镜后用高倍镜观察,可见到许多肝小叶,每小叶有许多紧密排列成索状的多角形的肝细胞,细胞中央有大而圆的细胞核。这时,转用油镜观察,可见到细胞质内分布着许多被苏木精染成深紫色的线粒体,呈颗粒状和线状。 四、马蛔虫受精卵切片中心体的观察 1.取马蛔虫受精卵切片,在显微镜下找到充满子宫腔的受精卵,每个马蛔虫受精卵外围有一层较厚的卵膜,膜内有宽大的围卵腔,各围卵腔内有处在不同分裂期的卵细胞。找到分裂中期的细胞,在细胞中央被染成蓝色条状或棒状的结构,这就是染色体。在染色体两侧可见各有一个较小的,亦被染成蓝色的小粒,称中心粒。在中心粒的周围可见呈放射状的星丝。 实验一、细胞的显微测量 【实验目的】 掌握显微测微计的基本原理及使用方法。 【实验原理】 细胞长度、面积、体积的测量是研究正常的或病理组织细胞的基本方法之一。在显微镜下用来测量细胞长度的工具叫显微测量计,由目镜测微尺(ocular micrometer)和镜台测微尺(stage micrometer)组成,两尺要配合使用。目镜测微尺是放在目镜内的一直径为2cm圆形玻片上,里面有100等分格的刻度尺。每一小格表示的实际长度随不同的显微镜、不同放大倍数的物镜而不同。镜台测微尺是一块特制的载玻片,在它的中央由一片圆形盖片封固着一具有精细刻度的标尺,标尺全长为lmm,分为100等份的小格,每小格的长度为0.01 mm(10μm),标尺的外围有一小黑环,便于找到标尺的位置。显微测量时,先用镜台测微尺标定目镜测微尺每小格所表示的实际长度。在测量细胞时,移去镜台测微尺,换上被测标本,用目镜测微尺即可测得观察标本的实际长度。 【实验仪器、材料和试剂】 (一)仪器:显微镜、目镜测微尺、镜台测微尺、解剖剪、解剖镊、注射器、载玻片、盖玻片、试管、无菌采血针 (二)材料:血涂片 (三)试剂:生理盐水、瑞氏(Wright)染色液 【方法与步骤】
细胞培养基本理论 一细胞培养概述 细胞培养(cell culture)模拟机体内生理条件,将细胞从机体中取出,在人工条件下使其生存、生长、繁殖和传代,进行细胞生命过程、细胞癌变、细胞工程等问题的研究。 群体培养(mass culture)将大量细胞置于培养瓶中,让其贴壁或悬浮生长,形成均匀的单层细胞或单细胞悬液。 克隆培养(clone culture)即将少数的细胞加入培养瓶中,贴壁后彼此间隔距离较远,经过繁殖每一个细胞形成一个集落,称为克隆。 组织培养(tissue culture)指把活体的组织取出,分成小块,直接置于培养瓶底或通过胶原纤维血浆支持物的培养瓶底来进行培养。 特点:1.,组织不失散,细胞保持原有的组织关系。2,形成生长(cut growth)或形成由扁薄细胞构成的单层细胞培养物。3,在体外生长时,细胞间呈相互依存、互相影响的关系。 器官培养(organ culture)将活体中器官或器官一部分取出,在体外生长、生存,并使其保持器官原有的结构和功能特征的培养。 特点:1,培养的器官在合适的条件下能生长和分化,存活数周或1 年。2,观察受限,只能用组织切片的方法观察或用透射电镜、扫描电镜观察。 细胞培养优点:.1.活细胞:同时、大量、均一性、重复性;2.可控制:各种物理、化学、生物等因素可调控;3.研究方法多样:倒置、荧光、电子、激光共焦显微镜、流式细胞术、免疫组织化学、原位杂交、同位素标记;4.应用广:不同物种、年龄、组织,正常或异常缺点:人工所模拟的条件与体内实际情况仍不完全相同;当细胞被置于体外培养后, 生活在缺乏动态平衡的环境中,时间久了,必然发生变化。 三细胞的形态和类型由不同生长方式造成的差异 呈悬浮生长时,因生长在液体环境中,胞内渗透压高于周围液体环境,因此胞体基本呈圆形。呈贴附于支持物上生长的细胞,开始为圆形,很快过渡成扁平形,并逐渐恢复至原先的细胞形态. 细胞来源:成纤维型细胞;上皮型细胞;其它,不定型 细胞按生长方式:贴壁型细胞(Monolayer cells);悬浮型细胞(Suspension cells)绝大多数有机体细胞属贴壁型细胞,只有少数细胞类型如某些肿瘤细胞和白细胞可在悬浮状态下生长。 按细胞形态(贴壁细胞):成纤维型细胞;上皮型细胞;其它,不定型 贴壁型生长细胞或锚着依存性细胞 处于体外培养状态下的贴附生长型细胞在形态上表现单一而失去了在体内原有的某些特征。形态各异反映其胚层起源。如来源于内外胚层的细胞多呈上皮型;来自中胚层的则易呈成纤维细胞型。分为成纤维型细胞;皮型细胞;游走型细胞;多形型细胞 贴壁型细胞形态比较 成纤维型细胞:梭形或不规则三角形;中央有卵圆形核;胞质向外伸出长短不同的突起;中胚层间质起源 上皮型细胞:扁平不规则多角形;细胞中央有圆形核;紧密相连单层膜样生长;内、外胚层细胞如皮肤、表皮衍生物、消化管上皮等 游走型细胞:散在生长,一般不连成片;细胞质经常伸出伪足或突起;活跃的游走或变形运动;羊水细胞培养的早期 多形细胞型:难以确定规律和稳定的形态;如神经组织的细胞等
细胞生物学实验 班级:生科142 姓名:旷江 学号:10143131 组号: 2 小组成员:旷江、韦立尧、莫霞指导老师:范立强、李鹏飞 华东理工大学 应用生物学系
摘要 本次细胞生物学实验通过细胞形态与结构的观察技术,细胞化学,细胞生理,细胞培养与分析,细胞周期分析,细胞成分分离与分析,细胞增殖与染色等技术对动植物细胞进行细胞形态结构的观察、细胞生理过程的研究、细胞培养与细胞分析、细胞冻存与复苏等,以此来研究动植物细胞的结构、功能和各种生命规律。 关键词:细胞增殖、细胞染色、冻存复苏、生理过程、形态结构
Abstract The cell biology experiment was carried out by cell morphology and structure observation technique, cytochemistry, cell physiology, cell culture and analysis, cell cycle analysis, cell fractionation and analysis, cell proliferation and staining. Observation of cell physiological processes, cell culture and cell analysis, cell cryopreservation and resuscitation, in order to study the structure of animals and plants, functions and a variety of laws of life. Key words: cell proliferation, cell staining, cryopreservation, physiological processes, morphological structur
常用分子生物学和细胞生物学实验技术介绍 (2011-04-23 11:01:29)转载▼ 标签:分子生物学细胞生物学常用实用技术基本实验室技术生物学实验教育 常用的分子生物学基本技术 核酸分子杂交技术 由于核酸分子杂交的高度特异性及检测方法的灵敏性,它已成为分子生物学中最常用的基本技术,被广泛应用于基因克隆的筛选,酶切图谱的制作,基因序列的定量和定性分析及基因突变的检测等。其基本原理是具有一定同源性的原条核酸单链在一定的条件下(适宜的温室度及离子强度等)可按碱基互补原成双链。杂交的双方是待测核酸序列及探针(probe),待测核酸序列可以是克隆的基因征段,也可以是未克隆化的基因组DNA和细胞总RNA。核酸探针是指用放射性核素、生物素或其他活性物质标记的,能与特定的核酸序列发生特异性互补的已知DNA或RNA片段。根据其来源和性质可分为cDNA探针、基因组探针、寡核苷酸探针、RNA探针等。 固相杂交 固相杂交(solid-phase hybridization)是将变性的DNA固定于固体基质(硝酸纤维素膜或尼龙滤膜)上,再与探针进行杂交,故也称为膜上印迹杂交。 斑步杂交(dot hybridization) 是道先将被测的DNA或RNA变性后固定在滤膜上然后加入过量的标记好的DNA或RNA探针进行杂交。该法的特点是操作简单,事先不用限制性内切酶消化或凝胶电永分离核酸样品,可在同一张膜上同时进行多个样品的检测;根据斑点杂并的结果,可以推算出杂交阳性的拷贝数。该法的缺点是不能鉴定所测基因的相对分子质量,而且特异性较差,有一定比例的假阳性。 印迹杂交(blotting hybridization)
冻存细胞的复苏 1、于液氮罐中取出冻存管。 2、37℃水浴锅中摇动,使之快速融化。 3、超净台内酒精棉球擦拭,打开冻存管,吸出细胞悬液,注入离心管中,再滴加2倍培养液,混匀。 4、离心:1500转/分,3分钟,弃上清。 5、吸取2-3ml培养液加入到离心管中,吹打制悬,接种到培养瓶中,37℃培养。 组织块法培养骨骼肌细胞 1、将新生大鼠处死,再用酒精棉球擦拭其全身消毒,带入超净台内于肩关节和髋关节处剪取四肢(去爪),置培养皿中。 2、PBS液中,清理血污,剥去皮肤。 3、用PBS液洗涤两次,并剔除脂肪,结缔组织,血液等杂物。 4、用将肌组织从骨骼上剪切下来,PBS液清洗后转移至干净培养皿中。 5、加少量培养液,将组织剪成1mm3小块,用吸管将其转移到培养瓶,贴附与瓶底面。翻转瓶底朝上,将培养液加至瓶中,培养液勿接触组织块。入37℃培养箱静置0.5-1小时,轻轻翻转培养瓶,使组织浸入培养液中(勿使组织漂起),37℃继续培养。 贴壁细胞的传代和冻存 1、超净台中打开细胞培养瓶,用吸管将培养液吸出。 2、加入PBS液,使其覆盖培养瓶底部,轻轻摇动后倒掉。 3、加入消化液,以覆盖整个培养瓶底部,盖好瓶盖,于倒置显微镜下观察,待 见到细胞质回缩、细胞间隙增大后于超净台内倒掉消化液。 4、加培养液终止消化。 5、用吸管吸取培养瓶中的培养液,反复吹打瓶壁,制备细胞悬液。 6、将细胞悬液吸入离心管中,离心1500转/分,3分钟,倒掉上清。 7、加入3ml培养液于离心管中,吹打制悬。 8、取2ml细胞悬液进行接种后,剩余细胞悬液继续离心1500转/分,3分钟。 9、去上清,加入1ml冻存液,制悬,转移到冻存管,再按照-4℃1小时→-20℃ 2小时→-80℃2小时→液氮的顺序进行冻存。 细胞计数
第五章物质的跨膜运输与信号传递 一.教学目标:1深刻理解被动运输、主动运输和内吞外排的概念,以及物质跨膜运输的重要意义;2.理解细胞信号传递的主要特点,掌握甾类激素信号 通路、cAMP信号通路、磷脂酰肌醇信号通路和EGF受体信号通路的主 要环节。 二.重点:跨膜运输的方式和细胞通讯的信号通路。 三.难点:跨膜运输的机制。 四.授课方式与教学方法:讲授、讨论、多媒体辅助教学。 五.教学内容: 细胞膜是细胞与细胞外环境之间的一种选择性通透屏障,物质的跨膜运输对细胞的生存和生长至关重要。多细胞生物是一个繁忙而有序的细胞社会,这种社会性的维持不仅依赖于细胞的物质代谢与能量代谢,还有赖于细胞通讯与信号传递,以协调细胞的行为。 第一节物质的跨膜运输 一.被动运输(passive transport) ◆定义:通过简单扩散或协助扩散实现物质由高浓度向低浓度方向的跨膜转运。转运的动力来自物质的浓度梯 度,不需要细胞提供能量。 ◆类型:简单扩散(simple diffusion)、协助扩散(facilitated diffusion) ◆膜转运蛋白: ?1.载体蛋白(carrier proteins)——通透酶(permease)性质; 介导被动运输与主动运输。 ?2.通道蛋白(channel proteins)——具有离子选择性,转运速率高;离子通道是门控的;只介导被动运输膜转运蛋白通道蛋白(被动运输)膜转运蛋白 载体蛋白单运输 (被动运输+主动运输) 共运输 协同运输 对向运输 细胞膜上的运输蛋白: 载体蛋白:通过构象变化运输物质 通道蛋白:形成通道、运输物质 载体蛋白:膜上一类转运蛋白,可特异的、可逆的与某物质结合,通过构象变化将物质从膜的一侧运到另一侧。又称通透酶,与运输物质的结合与酶的动力学相似。 通道蛋白:形成亲水的通道,允许一定大小和一定电荷的离子通过。因运转的几乎都是离子,又称离子通道. 通道蛋白形成通道:
第二节细胞生物学实验方法与技术 细胞生物学是生命科学中的重要分支,它以生命基本单位细胞为研究对象,应用近代物理、化学和实验生物学方法,从显微、亚显微和分子水平来揭示细胞生命活动及规律,其中包括细胞的生长、发育、分裂、分化、遗传、变异(包括癌变)、兴奋、运动、代谢、衰老与死亡等基本生命现象,并且利用与调控细胞的行为活动,已达到为生产实践尤其为医药卫生事业服务。当前细胞生物学与医药保健事业联系的较为紧密的热点问题主要有以下几种:1)真核细胞基因结构及其表达调控;2)细胞膜、膜系、受体与信号传递研究;3)细胞生长、分化、衰老、癌变、死亡,尤其是程序性细胞死亡的研究;4) 细胞工程,包括基因工程及体细胞核移植的研究。 一、细胞培养常用方法 1、细胞原代培养(primay culture)又称初代培养,即直接从机体取下细胞、组织、或器官、让他们在体外维持与生长。原代细胞的特点是细胞或组织刚离开机体,他们的生物状态尚未发生很大的改变,一定程度上可反映他们在体内的状态,表现出来源组织或细胞的特性,因此用于药物实验尤其是药物对细胞活动、结构、代谢、有无毒性或杀伤作用等研究是极好工具。常用的原代培养方法有组织快培养法及消化培养法。前者方法简单,细胞也较易生长,尤其是培养心肌有时能观察到心肌组织块的搏动。细胞从组织块外长并铺满培养皿或培养瓶后即可进行传代。 2、细胞的传代培养当细胞生长至单层汇合时,便需要进行分离培养否则会因无繁殖空间、营养耗竭而影响生长,甚至整片细胞脱离基质悬浮起来直至死亡。为此当细胞达到一定密度时必须传代或再次培养,目的是借此繁殖更多的细胞,另一方面是防止细胞的退化死亡。 二、器官培养方法 器官培养(organ culture)是指用特殊的装置使器官、器官原基或它们的一部分在体外存活,幷保持其原有的结构和功能。器官培养可模拟体内的三维结构,用于观察组织间的相互反应、组织与细胞的分化以及外界因子包括药物对组织细胞的作用。 器官培养方法很多,最经典的方法即表玻皿器官培养法;一种最常用的方法是不锈钢金属网格法及Wolff培养法和扩散盒培养法,实验者可根据情况选择采用。 三、放射自显影术测定 放射自显影术(autoradiography)是利用放射性同位素电离辐射对核子乳胶的感光作用,显示标本或样品中放射物的分布、定量以及定位的方法。放射性同位素能在紧密接触的感光乳胶中记录下它存在的部位和强度,准确显示出形态与功能的定位关系。现已可将放射自显影术与电镜以及生物分子结合起来。不但可以研究放射性物质在组织和细胞内的分布代谢,而且可以揭示核酸合成及其损伤等改变,目前已在生命科学各领域被广泛应用。 四、染色体分析技术 染色质或染色体是遗传物质在细胞水平的形态特征。前者是指当细胞处于合成期时遗传物质经碱性染料着色后,呈现出细丝状弥漫结构;当细胞进入分裂期时,染色质细丝高度螺旋化凝聚为形态有特征的染色体。特别是在分裂中期,复制后的染色体达到最高程度的凝聚,称为中期染色,是进行染色体形态观察分析的最佳时期。染色体分析应用领域越来越广,主要用于以下几方面:1)为临床诊断提供新手段;2)研究不育和习惯性流产发生的遗传基础; 3) 通过检查胎儿的染色体,预防有染色体异常患儿出生(先天愚型);4)根据染色体的多肽性进行亲子和异型配子的起源研究;结合DNA重组技术可以将基因定位于染色体的具体
细胞生物学实验汇总
————————————————————————————————作者:————————————————————————————————日期:
实验一、二:细胞凝集反应和细胞膜通透性的观察 【基本原理】 细胞膜表面的有分支状糖外被,细胞间的联系、细胞的生长和分化、免疫反应、肿瘤的发生等都和细胞表面的分支状糖分子有关。凝集素(lectin)是一类含糖并能与糖分子专一结合的蛋白质,它具有凝集细胞和刺激细胞分裂的作用。凝集素使细胞凝集是由于它与细胞表面的糖分子连接,在细胞表面间形成“桥”的结果,加入与凝集素互补的糖可以抑制细胞的凝集。 细胞膜是细胞与外界环境进行物质交换的结构。可选择性地让某些物质进出细胞,各种物质出入细胞的方式是不同的,水是生物界最普遍的溶剂,水分子可以按照物质浓度梯度从渗透压低的一侧通过细胞膜向渗透压高的一侧扩散,以至于在高渗环境中,动物细胞会失水而收缩;在低渗环境中,动物细胞会吸水膨胀直至破裂。 本实验将红细胞分别放于各种等渗溶液中,由于红细胞膜对不同溶质的通透性不同,使得不同溶质透入细胞的速度相差很大,有些溶质甚至不能透入细胞。当溶质分子进入细胞后可引起渗透压升高,水分子随即进入细胞,使细胞膨胀,当膨胀到一定程度时,红细胞膜会发生破裂,血红素溢出,此时,原来不透明的红细胞悬液突然变成红色透明的血红蛋白溶液,这种现象称为红细胞溶血。由于各种溶质进入细胞的速度不同,所以不同的溶质诱导红细胞溶血的时间不同,相反可通过测量溶血时间来估计细胞膜对各种物质通透性的大小。 【方法步骤】 1.制备土豆凝集素液和红细胞悬浮液,制备无血清的鸡红细胞悬液,使凝集素液和红细胞悬液混合,静置后,在光镜(低倍)下观察凝集素使红细胞凝集的现象。(以PBS 缓冲液加2%血细胞作对照实验)[土豆凝集素的制备:称取土豆去皮块茎2g , 加10 mL PBS 缓冲液,浸泡2h(浸出的粗提液中含有可溶性土豆凝集素) , 载玻片上滴一滴土豆凝集素,再滴一滴2%红细胞液,充分混匀静置20 min , 低倍显微镜下观察血球凝集现象。] 2.观察10%的鸡红细胞悬液,可见该悬液为一种不透明的红色液体 3.观察溶血现象取一支试管,再加入4ml 蒸馏水,加入0.4ml 鸡红细胞悬液,混匀后注意观察溶液颜色的变化,可见溶液由不透明的红色变成透明的红色液体(可将试管贴靠在书上,隔着试管看书中的字,如发现溶血则文字可被看清)。 4.观察鸡红细胞对不同物质的通透性 (1)取一支试管,和0.17M 的Nacl 溶液4ml,加入0.4ml 鸡红细胞悬液,轻轻摇匀,用上述方法观察是否出现溶血现象,如出现溶血,记下发生溶血所需要的时间(从加入4ml 溶液算起) (2)按上述方法分别加入下列9种溶液是否导致红细胞溶血并记录实验结果。 ①0.17M 氯化铵②0.17M 硝酸钠③0.17M 硫酸钠④0.17M 醋酸胺 ⑤0.17M 草酸铵⑥0.17M 葡萄糖⑦0.17M 甘油⑧0.17M 乙醇 ⑨0.17M 丙酮 【实验结果】 1、土豆凝集素能使鸡红细胞凝集,PBS 对照液中红细胞分散均匀。对照组未凝血,实验组凝血。 2、氯化钠、硝酸钠、硫酸钠溶液不溶。醋酸铵>草酸铵>氯化铵>乙醇>甘油>丙酮>葡萄糖。膜通透性大小主要取决于分子大小和分子极性。小分子比大分子容易通过,非极性比极性易通过,带电荷离子高度不透。