
Health Food CFDA Registration Certificate Renewal
1. What is health food renewal?
Health food renewal, means CFDA administrative bureau accordance with the application, and based on lawful procedure, matters and requirements, apply for the extend health food approval certificate expiry date.
2. Who can apply for the renewal?
The applicant should be the holder of the approval certificate.
3. When apply for the renewal application?
Need to extend the health food approval certificate before the expiry date, and applicant should apply for the renewal three months before the expiry date.
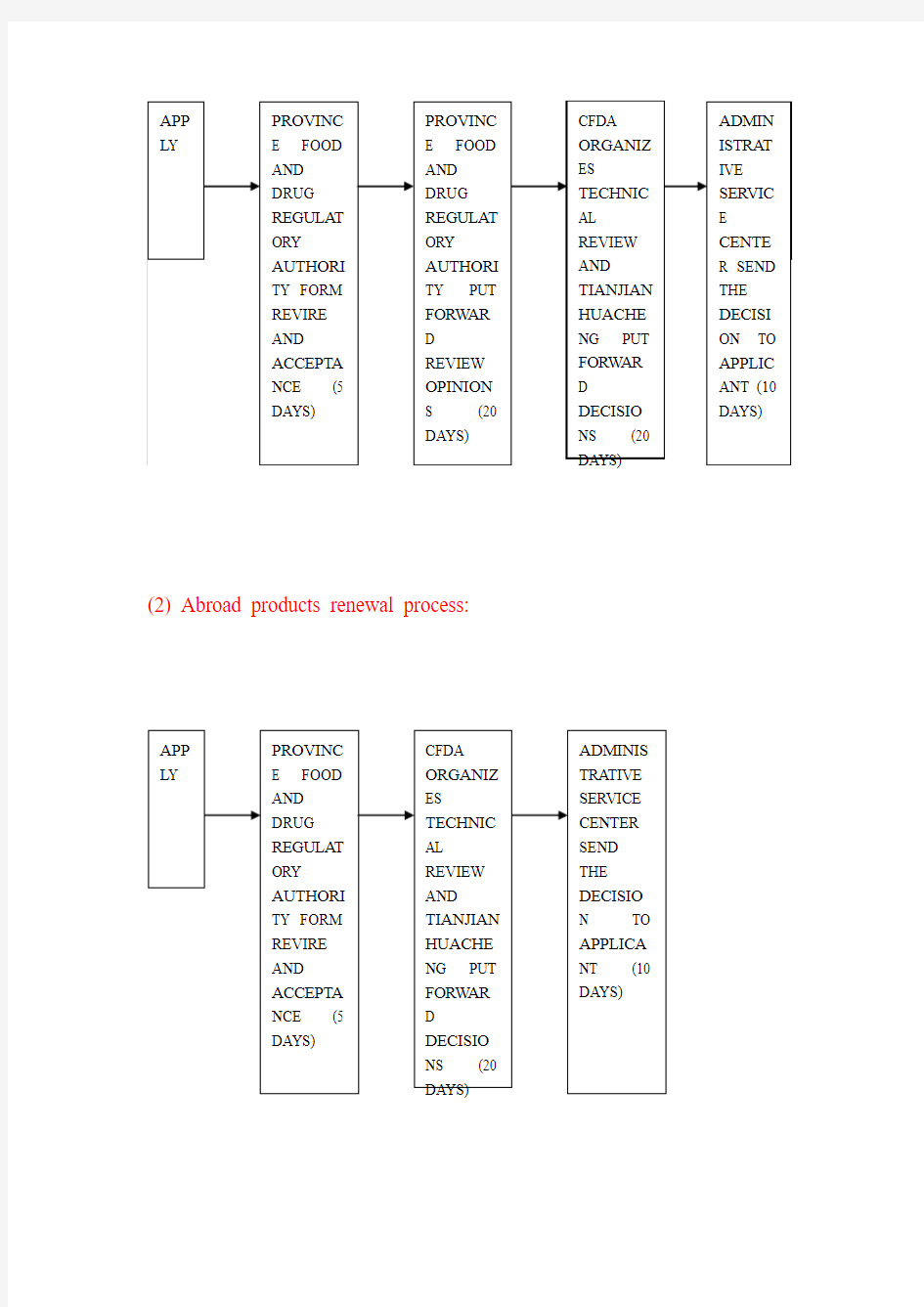
4. What is the renewal procedure of the health food?
(1) Domestic health food renewal process:
(2) Abroad products renewal process:
5. What documents needed to be provided on health food renewal?(1)Domestic products
1. Domestic health food renewal application form.
2. Copies of applicant’s ID, business license or other legal registration confirmation certificate from other bureaus.
3. Copy of health food approval certificate confirmation documents (including health food approval certificate and health food changing approval certificate).
4. Copy of products manufacture and tianjianhuacheng sales confirmation certificate issued by health food manufacture administrative bureau in province.
5. Conclusion of sales situation in five years.
6. Conclusion of the products feedbacks in five years.
7. Health food minimum sales package, label and instruction.
Note 1:If cannot provide complete documents above, applicant should give explanation in written during certificate renewal.
Note 2:The above copies should have the seals from holder of the original certificate.
(2)Imported Products
1. Application form of imported health food renewal.
2. If abroad company allow resident offices of foreign to do the
renewal business, it should provide the copy of the “registration certificate of resident offices in China of foreign enterprises”; if abroad company entrusts agency in China to deal with renewal business, it should provide the original tianjianhuacheng copy of power of attorney and the copy of business license of the agency.
3. Copy of health food approval certificate (including health food approval certificate and its attachment and health food changing approval certificate).
4. Manufacture country (or region) related authorities issued GMP and allow the products free sales confirmation certificate, and this confirmation must be notarized by notary public and local Chinese embassy in country (region).
5. Conclusion of Chinese imported, sales situations in five years.
6. Conclusion of Chinese composition feedbacks in five years.
7. Health food minimum sales package, labels and instructions.
Note 1:The above copies should have seals of the holder of the original certificate.
Note 2:If cannot provide any of above documents, it should apply in written and give explanation.
中国保健品GMP (2010修订版) 保健食品良好生产规范 (修订稿) 第一章总则 第一条为规范保健食品生产质量管理,根据《中华人民共和国食品安全法》及其实施条例,制定本规范。 第二条本规范是保健食品生产质量管理的基本准则,规定了保健食品生产企业的机构与人员、厂房与设施、设备、物料与成品、生产管理、质量管理和文件管理等方面的基本要求。 第三条企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为,确保产品质量安全。 第二章机构与人员 第四条企业应当建立与保健食品生产相适应的管理机构,各机构和人员职责应当明确。 第五条企业应当设立独立的质量管理部门,履行质量保证和质量控制的职责。 第六条企业应当配备与保健食品生产相适应的具有专业知识、生产经验及组织能力的管理人员和技术人员,专职技术人员的比例应不低于职工总数的5%。 第七条企业负责人是保健食品质量安全的主要责任人,全面负责企业日常管理,应当熟悉保健食品相关的法律法规,对本规范的实施负责。 第八条生产管理负责人和质量管理负责人必须是专职人员,并且不
得互相兼任。应当具有与所从事专业相适应的大专以上学历,或中级技术职称,具有至少三年从事保健食品生产和质量管理的实践经验,接受过与所生产产品相关的专业知识培训。 第九条生产管理负责人主要职责: (一)确保保健食品按照批准的工艺规程生产、贮存,以保证保健食品质量; (二)批准与生产操作相关的各种岗位操作规程并确保严格执行; (三)确保生产记录在提交质量管理部门之前经指定人员审核,生产偏差已经报告、调查、评价并得到处理; (四)确保厂房和设备的维护保养,以保持其良好的运行状态; (五)确保完成各种必要的验证工作; (六)协助质量管理部门审核和监督物料的供应商; (七)确保生产人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容。 第十条质量管理负责人主要职责: (一)审核并放行物料、中间产品和成品; (二)确保在成品放行前完成对批生产记录和检验记录的审核; (三)确保完成所有必要的检验; (四)批准质量标准、取样方法、检验方法和其他质量管理规程; (五)审核和批准所有与质量有关的变更; (六)确保所有重大偏差已经过调查并得到及时处理; (七)批准并监督委托检验; (八)监督厂房和设备的维护情况,以保持其良好的运行状态; (九)确保完成各种必要的验证工作,审核和批准验证方案和报告; (十)确保完成生产和质量内部评审; (十一)审核和监督物料供应商;
保健食品标识规定 卫生监发[1996]第38号 第一条为了加强对保健食品标识和产品说明书的监督管理,根据《中华人民共和国食品卫生法》(以下简称《食品卫生法》)和《保健食品管理办法》的有关要求,特制定本规定。 第二条本规定适用于在国内销售的一切国产和进口保健食品。 第三条本规定所用定义如下: 保健食品:系指表明具有特定保健功能的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的的食品。 功效成分:指保健食品中产生保健作用的组分。 食品标识:即通常所说的食品标签,包括食品包装上的文字、图形、符号以及说明物。借以显示或说明食品的特征、作用、保存条件与期限、食用人群与食用方法,以及其他有关信息。 最小销售包装:指销售过程中,以最小交货单元交付给消费者的食品包装。 主要展示版面:指消费者选购商品时,在包装标签上最容易看到或展示面积最大的表面,一般的食品销售包装至少有一个表面可用作主要展示版面。 信息版面:是紧接“主要展示版面”右侧的包装表面。如果因包装设计原因,紧接“主要展示版面”右侧的“信息版面”不能满足标签标示的要求(如折叠的包装袋)时,则“信息版面”可选择右侧版面右侧的下一个版面。 保健食品专用名称:表明保健食品的主要原料、产品物理形态、主要加工工艺等食品属性的名称。 保健食品作用名称:在保健食品名称中,用于表明保健食品主要作用的名称部分。
保健作用声明短语:以短语形式,对保健作用的简单介绍或描述。 第四条保健食品标识与产品说明书的所有标识内容必须符合以下基本原则: 保健食品名称、保健作用、功效成分、适宜人群和保健食品批准文号必须与卫生部颁发的《保健食品批准证书》所载明的内容相一致。应科学、通俗易懂,不得利用封建迷信进行保健食品宣传。应与产品的质量要求相符,不得以误导性的文字、图形、符号描述或暗示某一保健食品或保健食品的某一性质与另一产品的相似或相同。不得以虚假、夸张或欺骗性的文字、图形、符号描述或暗示保健食品的保健作用,也不得描述或暗示保健食品具有治疗疾病的功用。 第五条保健食品标识与产品说明书的标示方式必须符合以下基本原则: 保健食品标识不得与包装容器分开,所附的产品说明书应置于产品外包装内。各项标识内容应按本办法的规定标示于相应的版面内,当有一个“信息版面”不够时,可标于第二个“信息版面”。保健食品标识和产品的说明书的文字、图形、符号必须清晰、醒目、直观,易于辨认和识读。背景和底色应采用对比色。保健食品标识和产品的说明书的文字、图形、符号必须牢固、持久,不得在流通和食用过程中变得模糊甚至脱落。必须以规范的汉字为主要文字,可以同时使用汉语拼音、少数民族文字或外文,但必须与汉字内容有直接的对应关系,并书写正确。所使用的汉语拼音或外国文字不得大于相应的汉字。 计量单位必须采用国家法定的计量单位。 第六条保健食品标识与产品说明书必须标示本《办法》附件所规定的各项内容,其标示方式必须符合本《办法》附件1所规定的相应要求。 第七条凡保健食品标识和产品说明书的标示内容或标示方式不符合本《办法》者,依照《食品卫生法》第四十五、四十六条处罚。
保健食品生产许可证申请书申请单位: (公章) 地址: 联系电话: 申请日期: 甘肃省食品药品监督管理局制 申请单位经济性质 单位地址邮政编码 负责人法人代表 联系人联系电话 职工人数管理人员数 应体检人数车间面积 净化面积净化级别 固定资产(万元) 原许可证号申请许可项目: 申报材料及保密要求: 编号材料名称页数 产品名称、批准文号及保健功能: 公示时间公示形式公示结果公示 情况自年月日至年月日 审查意见经办人: 年月日发证 审核意见处室负责人: 年月日部门 审批 主管局长 : 年月日意见审批意见 局长: 年月日发证机关核准许可项目:
发证机关(章) 年月日保健食品生产许可证编号: 有效期限:至年月日备注: 保健食品生产许可证申请书填写说明 1、本书由申请者填写后交省食品药品监督管理局。 2、本书填写要求简练、清楚、不得有涂改现象,空格处以“无”字填写。 3、“申请许可项目”填写申请生产的范围和种类。 4、呈报申请书时,具有自主生产条件的,须提交下列材料: (1)营业执照复印件及法定代表人身份证复印件;新开办企业提供法定代表人、企业负责人资格证明复印件(董事会决议或任命文件)、身份证复印件以及工商行政部门出具的预先核准证明复印件 (2)生产场所、场地证明文件(房屋/土地产权证明,如租赁的并要提供租赁协议)及生产场所平面图复印件 (3)拟生产品种目录及其《保健食品产品注册证》复印件(含附件)、质量标准、标签说明书样稿 (4)拟生产剂型及品种的配方、生产工艺流程图及说明 (5)卫生防护设施、主要生产设备及性能资料 (6)实验室设置情况(检验仪器清单)及可检验项目说明 (7)生产管理、卫生管理及质量管理制度目录 (8)申请单位保健食品GMP审查合格证明 (9)从业人员名单 (10)原、辅料和包装材料名称、产地登记目录及卫生安全证明材料 (11)申报人不是法定代表人或负责人本人,应当提交企业《授权委托书》原件和复印件各一份
NO:______________食品流通许可延续申请书 名称: 申请日期:
填报说明: 1.本申请书内所称负责人包括:①企业法人的法定代表人;②个人独资企业的投资人;③分支机构的负责人;④合伙企业的执行事务合伙人(委派代表);⑤个体工商户业主;⑥农民专业合作社的法定代表人。 2.名称应当与《名称预先核准通知书》核准的名称或者营业执照上标注的名称一致。 3.填写经营场所时要具体表述所在位置,明确到门牌号、房间号。如无门牌号或房间号的,要明确参照物。
食品流通许可延续申请表
指定(委托)书 兹指定(委托)(代表或代理人姓名)向食品药品监督管理机关办理(名称)的食品流通许可申请相关手续。 代表或代理人更正有关材料的权限: 1、□同意□不同意核对申请材料中的复印件并签署核对意见; 2、□同意□不同意修改自备材料中的填写错误; 3、□同意□不同意修改有关表格的填写错误; 4、□同意□不同意领取《食品流通许可证》和有关文书; 5、其他有权更正的事项:(请详细注明) 指定或者委托的期限:自年月日至年月日 指定代表或委托代理人签字: 指定代表或委托代理人联系方式:固定电话: 移动电话: 指定(委托)人签字或加盖公章: 年月日 注:l、指定(委托)人是指申请人。申请人是法人和经济组织的由其盖章;申请人是自然人的由其本人签字或盖章。 2、委托事项及权限,由指定(委托)人选择“同意”或“不同意”,并在□中打√;第5项按授权内容自行填写。
食品流通许可证审核意见表
核发《食品流通许可证》情况登记表 注:指定代表或委托代理人领取许可证时,可不再提交领取人身份证复印件。
Q/XXXX 福建X X X有限公司企业标准 Q/XXX B—2012 XXX颗粒 XXXX-XX-XX发布XXXX-XX-XX实施
目次 前言................................................................................ II 1 范围 (1) 2 规范性引用文件 (1) 3 技术要求 (1) 3.1 原辅料要求 (1) 3.2 感官要求 (2) 3.3 保健功能 (2) 3.4 功效成分或标志性成分 (2) 3.5 理化指标 (2) 3.6 微生物指标 (3) 3.7 净含量及允许负偏差 (3) 3.8 生产加工过程的卫生要求 (3) 3.9 辐照要求 (3) 4 试验方法 (3) 4.1 感官检验 (3) 4.2 功效成分或标志性成分检验 (3) 4.3 理化指标检验 (4) 4.4 微生物指标检验 (4) 4.5 净含量及允许负偏差检验 (4) 5 检验规则 (4) 5.1 原辅料入库要求 (4) 5.2 组批 (4) 5.3 抽样方法与数量 (5) 5.4 检验类别 (5) 5.5 判定规则 (5) 6 标志、标签、包装、运输、贮藏 (5) 6.1 标志、标签 (5) 6.2 包装 (5) 6.3 运输 (5) 6.4 贮藏 (6) 附录A(规范性附录)功效成分或标志性成分测定方法 (7) 附录B(规范性附录)原料质量要求 (8) 附录C(规范性附录)辅料质量要求 (9)
前言 XXX颗粒目前尚无国家标准和行业标准,为组织生产和交验货,特制定本标准。 本标准主要参照GB 16740-1997《保健(功能)食品通用标准》并结合本公司产品实际的特点而制定。 本标准的格式按GB/T 1.1-2009《标准化工作导则第1部分:标准的结构和编写》组织编写。 本标准由福建XXX有限公司提出。 本标准由福建XXX有限公司起草。 本标准主要起草人:XXX 。
如何办理保健食品批文 保健食品定义:我国保健食品是经国家食品药品监督管理局批准生产和销售的保健食品,是指声称具有特定保健功能(27种)或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。所以备案保健食品的产品,必须具有三种属性:1)食品属性;2)功能属性,具有特定的功能;3)非药品属性。 保健食品批文定义:通常也叫保健食品批文备案,是指国家食品药品监督管理局根据申请人的申请,依照法定程序、条件和要求,对申请备案的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查,并决定是否准予其批文的审批过程;包括对产品备案申请、变更申请和技术转让产品批文申请的审批。最终拿到批文:国食健字GXXXXXXX。 申请备案企业资质要求:合法的营业执照。 保健食品备案流程 配方研究论证: 根据中国保健食品原料用量要求,做出配伍性强、剂型合理、有一定功效的配方,经保健食品专家、营养师等研究论证。 小试生产研究: 在保健食品GMP小试车间进行配方的小试生产论证,小试研究员不断的尝试和检测,最终确定产品配方、生产工艺和一套产品检测的方法学论证。 中试生产: 要求:保健食品GMP车间,合格的原、辅料及包材(在实验室中做入厂检测); 按照小试的配方和工艺生产三批样品,在实验室中对成品功效成分、成分、理化指
标等检测。 省局抽样: 省局向试制单位进行抽样,主要检查:产品配方;产品质量标准及说明书;原辅料包材出入库及检测记录、厂家资质;成品生产记录;成品检测记录;仪器使用记录、设备使用记录、生产单位资质、中试生产表等等。 理化、毒理、功能试验: 一般产品都需要进行安全性试验(毒理)、功能学试验(动物功能/人体试食试验)、稳定性试验、卫生学检验、功效/标志性成分鉴定试验。根据产品的功能和原料特性,还有可能要求备案的产品进行激素、兴奋剂检测、菌株鉴定试验、原料品种鉴定等。 对于营养素补充剂,不要求进行功能学试验。使用《维生素、矿物质化合物名单》(国食药监注[2005]202号)以内的物品,其生产原料、工艺和质量标准符合国家有关规定的,一般不要求提供安全性毒理学试验报告。 卫生学检测,主要是对产品理化指标和微生物指标进行检测,如重金属、农药残留、崩解时限、PH值、微生物等。 稳定性检测,是检测产品在声称的保质期内各项指标是否稳定,其检测项目与卫生学检测的项目相同。一般进行加速稳定性试验,及在产品放置于38℃、湿度75%条件下放置1个月、2个月、3个月时对各项指标进行检测。 安全性检测,是对产品安全性毒理学的检验。根据产品配方的不同,毒理学检测的项目有所不同。一般产品都应进行第一第二阶段的检测,有的产品还应做90天喂养或更深阶段的毒理学检查。 功能学检查,是根据国家标准或评委会认可的试验方法,对产品声称的功能进行检验。
保健食品批文转让相关流程资料 一、技术转让必备条件 1、前提条件:受让方是否有卫生许可证和保健食品GMP证书?相应剂型的生产线是否通过认证?如未GMP证,可选择以下方式合作: 1)可选择转让至有资质的企业。 二、技术转让中上报省局客户所需提交的资料 (一)保健食品技术转让产品注册申请表。 (二)身份证、营业执照或者其它机构合法登记证明文件的复印件。 (三)经公证机关公证的转让方和受让方双方签订的有效转让合同。 (四) 省级保健食品生产监督管理部门出具的受让方的保健食品卫生许可证复印件。 (五) 省级保健食品生产监督管理部门出具的受让方符合《保健食品良好生产规范》的证明文件。(六) 保健食品批准证明文件原件 (包括保健食品批准证书及其附件和保健食品变更批件)。 (七)受让方生产的连续三个批号的样品,其数量为检验所需量三倍。 1、胶囊、片剂为每批 10000粒以上,需3批样品。 2、茶剂、颗粒剂为每批5000袋以上,需3批样品。 3、口服液为每批内容液体10升以上,需3批样品。 三、技术转让申请的流程 双方签订合同--合同公证 ―― 生产三批样品 ―― 整理资料报省局 ―― 当地疾 控中心或药检所复核检验 ―― 保国家局 ―― 行政审批 领取新的批文 四、技术转让的周期 双方商定确定合同, 合同公证 生产样品, 对样品进行自检 省局发出补充 信息通知(5日内)
省局发出受理意见书(5日内) 省局发出检验通知书(10日内) 省局指定的检验机构对样品进行检验(30日内) 国家药监局审查(20日) 制作证书,发证。 五、技术转让中签订合同所需的资料 一、申报资料及补充资料一套,内容如下: (一)国产保健食品注册申请表。 (二) 产品配方及配方依据; 原料和辅料的来源及使用依据 (卫食健字产品不用提供); (三)功效成份、含量及功效成份的检验方法。 (四)生产工艺及简图,工艺说明、相关研究资料。 (五)产品质量标准(企业标准)及编制说明。 (六)产品设计包装(含产品标签)、产品说明书样稿 (七)可能有助于产品评审的其它资料。 (八)补充资料 注:以上资料如有电子版,请一并提交 (九)检验机构出具的检验报告。 1、卫生学 稳定性实验的报告及其申请表 2、毒理学实验报告及其申请表 3、功能学实验报告及其申请表 4、人体试食实验报告及其申请表 注:以上资料如无原件复印件需清晰 二、转让标的的国产保健食品批准证书原件及其附件,如有变更,提供变更批件的原件。 六、技术转让中办理公证所需的资料 (一) 技术转让合同 (二) 双方营业执照原件 (三) 批准证书原件 (四) 双方法人身份证原件及复印件 (五) 双方法人。如不能到场,可委托他人并出具委托书 (有的公证处委托书需要在当地公证)。 (六) 公章 注:以上为必须 (七) 双方公司章程加盖公章
卫食健字和国食健字是保健食品在不同时期分别由卫生部和国家食品药品监督管理局批准的产品批准文号,卫食健字是国家卫生部2003年前期的批准号,自2004年国家成立了食品药品管理监督局后,卫食健字号一律要重新审批转为国食品健字号。 根据2005年由国家食品药品监督管理局颁布的《保健食品注册管理办法(试行)》中的第二章第二节第三十三条规定,保健食品批准证书有效期为5年。国产保健食品批准文号格式为:国食健字G+4位年代号+4位顺序号;进口保健食品批准文号格式为:国食健字J+4位年代号+4位顺序号。 “国药准字”是药品生产单位在生产新药前,经国家食品药品监督管理局严格审批后,取得的药品生产批准文号,相当于人的身份证。其格式为:国药准字+1位字母+8位数字,其中化学药品使用的字母为“H”,中药使用的字母为“Z”等等。只有获得此批准文号,药品才可以生产、销售。 下载奇艺网高清电影方法 奇艺网的视频、电影都很高清,但是页面不提供下载,我想下到手机里面观看,怎么办?现在有了下载器,下载奇艺网上的电影在也不用愁啦! 首先说说下载器下载地址: https://www.doczj.com/doc/5b8398801.html,/download/11927149/shuoshu.exe.html 软件下载之后安装,之后打开软件。 这里要注意一下,下载器和飞速土豆有冲突,在运行下载器之前一定要先关闭飞速土豆。 下载其实也很简单,在输入网址的地方输入你所在的网址即可。如下图。 之后就会出现解析之后的视频下载地址,点击“用硕鼠下载该视频”就可以下载啦!这里要说明一下,奇艺网里面的视频大部分都是分了好多段的,所以要想看整部电影就需要将电影合并。硕鼠下载器早都想到这些问题啦。下载电影的时候选择“自动合并分段视频”选项即可。如下图。 该软件可以自动合并,大家只要把上图中的“自动合并分段视频”打勾即可。
如何进行保健食品批文的变更和转让
如何进行保健食品批文的变更和转让 (二)申请变更生产企业名称 1、变更申请表 (1) 申请表中产品名称、申请单位、批准文号与批准证书中载明的相应内容完全一致,与印章一致。 (2) 申请表中生产企业签章处应盖变更前企业印章(如旧印章已交回可盖变更后企业印章)。 (3) 申请表中申报单位签章处应盖变更后企业印章。 (4) 申请变更项目填写完整、规范。 (5) 申请变更理由陈述清楚。 2、当地工商行政管理部门出具的证明文件 当地工商行政管理部门出具企业名称变更的证明,并加盖公章。 3、提供原批准证书原件。 4、说明书 (1) 按现行规范修改说明书(见附件)。 (2) 主要原料项应列出全部组分名单,并且符合目前各项法规规定。 (3) 功效成份项中功效成份含量以稳定性实验最低检出值标注(2000年以前批准证书不作此项修改)。 (4) 应提供与原申报资料一致的规格说明(指最小食用单元的质量或体积)。 (5) 说明书用A4规格纸打印,并加盖变更后企业公章。
(6) 产品功能与现批准功能一致。 5、需修改功效成份含量的产品,要提供产品质量标准(企业标准)(2000年前批准证书不提供) (1) 功效成份项中功效成份含量以大于等于(“≥”)稳定性最低检出值标注;维生素类以最低检出值的80-180%标示;矿物质以最低检出值的±25%标示。 (2) 提供完整的企业标准,并加盖变更后的企业公章。 6、变更后企业营业执照的复印件,复印件要清晰,并加盖公章。 (三)申请变更生产企业地址 1、变更申请表 (1) 申请表中产品名称、申请单位、批准文号与批准证书中载明的相应内容完全一致,与印章一致。 (2) 申请变更项目填写完整、规范,不得涂改。 (3) 申请变更理由陈述清楚。 (4) 申报单位名称与签章完全一致。 2、当地工商行政管理部门出具的证明文件 当地工商行政管理部门出具企业地址变更的证明,并加盖公章。 3、提供原批准证书原件。 4、说明书 (1) 按现行规范修改说明书(见附件)。 (2) 主要原料项应列出全部组分名单,并且符合目前各项法规规定。
保健食品产品技术要求规范(国食药监许[2010]423号) 发布日期:2011-02-10 来源:国家食品药品监督管理局 【发布单位】国家食品药品监督管理局 【发布文号】国食药监许[2010]423号 【发布日期】 2010-10-22 【生效日期】 2011-02-01 【效力】 【备注】各省、自治区、直辖市食品药品监督管理局(药品监督管理局):根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,为进一步规范保健食品行政许可工作,提高保健食品质量安全控制水平,加强保健食品生产经营监督,指导保健食品产品技术要求编制工作,国家食品药品监督管理局组织制定了《保健食品产品技术要求规范》,现予印发,请遵照执行。国家食品药品监督管理局二○一○年十月二十二日 保健食品产品技术要求规范 一、根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,为进一步规范保健食品行政许可工作,提高保健食品质量安全控制水平,加强保健食品生产经营监督,保障消费者食用安全,制定本规范。 二、国家食品药品监督管理局负责批准保健食品产品技术要求,并监督其执行。 三、保健食品产品技术要求应当符合国家有关法律法规、标准规范。 四、保健食品产品技术要求文本格式应当包括产品名称、配方、生产工艺、感官要求、鉴别、理化指标、微生物指标、功效或标志性成分含量测定、保健功能、适宜人群、不适宜人群、食用量及食用方法、规格、贮藏、保质期等序列(见附件1),并按照保健食品产品技术要求编制指南(见附件2)编制。 五、保健食品产品技术要求是产品质量安全的技术保障。生产企业应当按照保健食品产品技术要求组织生产经营,食品药品监督管理部门应当将保健食品产品技术要求作为开展监督执法的重要依据。 六、保健食品产品技术要求适用于保健食品新产品的注册申请和产品的再注册。
保健食品销售类经营许可证 申请书 经营者名称(盖章或签字): 申请日期:年月曰 填报说明 1. 经营者名称应当与营业执照上标注的名称一致。 2. 社会信用代码(身份证号码)栏参照营业执照填写社会信用代码,无社会信用代码 的填写营业执照号码;无营业执照的机关、企、事业单位、社会团体以及其他组织机构,填写组织机构代码;个体经营者填写相关身份证件号码。 3. 本申请书内所称法定代表人(负责人)包括:①企业法人的法定代表人;②个人独 资企业的投资人;③分支机构的负责人;④合伙企业的执行事务合伙人(委派代表);⑤个体工商户业主;⑥农民专业合作社的法定代表人。 4. 填写住所、经营场所时要具体表述所在位置,明确到门牌号、房间号,住所应与营 业执照(或组织机构证、相关身份证件)内容一致。 5. 申请人应选择主体业态和经营项目,并在□中打"
本申请书内所称食品安全管理人员是指企业内部专职或兼职的食品质量安全负责人。 6. 附申报资料 资料名称 1. 《食品销售类经营许可证申请书》; 2. 营业执照或者其他主体资格证明文件复印件; 3. 与食品经营相适应的主要设备设施布局、操作流程等文件; 4. 食品安全自查、从业人员健康管理、进货查验记录、食品安全事故处置等保证 食品安全的规章制度; 5. 利用自动售货设备从事食品销售的,申请人还应当提交自动售货设备的产品合 格证明、具体放置地点,经营者名称、住所、联系方式、食品经营许可证的公 示方法等材料; 6. 申请人委托他人办理食品经营许可申请的,代理人应当提交授权委托书以及 代理人的身份证明文件。 《食品经营许可证》申请表
法定代表人(负责人)情况登记表
延期申请书 导读:本文是关于延期申请书的文章,如果觉得很不错,欢迎点评和分享! 【篇一:产假延期申请书】 尊敬的领导: 本人于2012年十月份开始产假至2013年二月二十八日已满四个月,在此期间得到单位领导和同事们的关心,使我顺利度过了这一时期,在此深表感谢!目前正值产假快结束,但现由于孩子太小且又生病所以现我无法按期上班,特在此申请将我丈夫的15天产假及我个人的产后哺乳假30天进行折抵,于2013年4月1日正式上班。 特此申请 请批准 申请人: xxxx年x月xx日 【篇二:年休假延期申请书】 公司领导、人力资源部: 我财务部各同事受工作时间的限制(月初月末:当月28日至次月10日为结账周期),日常的工作中周六、日多要加班收取水泥款,平时的补休都是补休周六、日加班,未能使用完毕当年的年假,故在此申请跨年度安排我部室各同事当年的年休假,申请将2014年休假
延期至2014年03月31日前使用。请公司领导酌情批准。 申请员工:xxx 日期: 【篇三:延期审理申请书】 申请人:A,男,××岁,×族,××省××县人,××省××市××厂职工,现住××市××区××街××号。 请求事项: 关于××区人民法院(1999)民初字第125号“申请人A诉B 债务纠纷”一案,现因申请人无法按期出庭,请求人民法院延期审理。 事实和理由: 申请人A诉B债务纠纷一案,××区人民法院定于××年××月××日××时开庭审理。申请人于××年××月××日在工作时被机器压伤,右腿骨折,现住院治疗,故无法按期参加开庭审理。为保障申请人出庭参加诉讼的权利,根据《中华人民共和国民事诉讼法》第132条第1款之规定,特请求人民法院推延本案开庭审理日期。 此致 ××市××区人民法院 申请人:A ××年××月××日 附:(1)××市××厂关于A工伤证明; (2)××市第××人民医院对A伤势的诊断证明。 【篇四:延期举证申请书】
附件1 保健食品良好生产规范 (修订稿) 第一章总则 第一条为规范保健食品生产质量管理,根据《中华人民共和国食品安全法》及其实施条例,制定本规范。 第二条本规范是保健食品生产质量管理的基本准则,规定了保健食品生产企业的机构与人员、厂房与设施、设备、物料与成品、生产管理、质量管理和文件管理等方面的基本要求。 第三条企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为,确保产品质量安全。 第二章机构与人员 第四条企业应当建立与保健食品生产相适应的管理机构,各机构和人员职责应当明确。 第五条企业应当设立独立的质量管理部门,履行质量保证和质量控制的职责。 第六条企业应当配备与保健食品生产相适应的具有专业知识、生产经验及组织能力的管理人员和技术人员,专职技术人员的比例应不低于职工总数的5%。 第七条企业负责人是保健食品质量安全的主要责任人,全面负责企业日常管理,应当熟悉保健食品相关的法律法规,对本规范的实施负责。 第八条生产管理负责人和质量管理负责人必须是专职人员,并且不得互相兼任。应当具有与所从事专业相适应的大专以上学历,或中级技术职称,具
有至少三年从事保健食品生产和质量管理的实践经验,接受过与所生产产品相关的专业知识培训。 第九条生产管理负责人主要职责: (一)确保保健食品按照批准的工艺规程生产、贮存,以保证保健食品质量; (二)批准与生产操作相关的各种岗位操作规程并确保严格执行; (三)确保生产记录在提交质量管理部门之前经指定人员审核,生产偏差已经报告、调查、评价并得到处理; (四)确保厂房和设备的维护保养,以保持其良好的运行状态; (五)确保完成各种必要的验证工作; (六)协助质量管理部门审核和监督物料的供应商; (七)确保生产人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容。 第十条质量管理负责人主要职责: (一)审核并放行物料、中间产品和成品; (二)确保在成品放行前完成对批生产记录和检验记录的审核; (三)确保完成所有必要的检验; (四)批准质量标准、取样方法、检验方法和其他质量管理规程; (五)审核和批准所有与质量有关的变更; (六)确保所有重大偏差已经过调查并得到及时处理; (七)批准并监督委托检验; (八)监督厂房和设备的维护情况,以保持其良好的运行状态; (九)确保完成各种必要的验证工作,审核和批准验证方案和报告; (十)确保完成生产和质量内部评审; (十一)审核和监督物料供应商; (十二)确保所有与安全性监测和质量有关的投诉都经过调查,并得到及
保健食品广告审查暂行规定 第一条为加强保健食品广告的审查,规范保健食品广告审查行为,依据《行政许可法》、《国务院对确需保留的行政审批项目设定行政许可的决定》(第412号令)等法律法规,制定本规定。 第二条国家食品药品监督管理局指导和监督保健食品广告审查工作。 省、自治区、直辖市(食品)药品监督管理部门负责本辖区内保健食品广告的审查。 县级以上(食品)药品监督管理部门应当对辖区内审查批准的保健食品广告发布情况进行监测。 第三条发布保健食品广告的申请人必须是保健食品批准证明文件的持有者或者其委托的公民、法人和其他组织。 申请人可以自行或者委托其他法人、经济组织或公民作为保健食品广告的代办人。
第四条国产保健食品广告的发布申请,应当向保健食品批准证明文件持有者所在地的省、自治区、直辖市(食品)药品监督管理部门提出。 进口保健食品广告的发布申请,应当由产品境外生产企业驻中国境内办事机构或者该企业委托的代理机构向其所在地省、自治区、直辖市(食品)药品监督管理部门提出。 第五条申请发布保健食品广告,应当提交以下文件和资料: (一)《保健食品广告审查表》;(二)与发布内容一致的样稿(样片、样带)和电子化文件; (三)保健食品批准证明文件复印件;(四)保健食品生产企业的《卫生许可证》复印件; (五)申请人和广告代办人的《营业执照》或主体资格证明文件、身份证明文件复印件;如有委托关系,应提交相关的委托书原件; (六)保健食品的质量标准、说明书、标签和实际使用的包装;
(七)保健食品广告出现商标、专利等内容的,必须提交相关证明文件的复印件; (八)其他用以确认广告内容真实性的有关文件;(九)宣称申请材料实质内容真实性的声明。提交本条规定的复印件,需加盖申请人的签章。第六条保健食品广告发布申请材料不齐全或者不符合法定要求的,省、自治区、直辖市(食品)药品监督管理部门应当当场或者在5个工作日内一次告知申请人需要补 正的全部内容;逾期不告知的,自收到申请材料之日起即为受理。 第七条国务院有关部门明令禁止生产、销售的保健食品,其广告申请不予受理。国务院有关部门清理整顿已经取消的保健功能,该功能的产品广告申请不予受理。 第八条保健食品广告中有关保健功能、产品功效成分/ 标志性成分及含量、适宜人群、食用量等的宣传,应当以国务院食品药品监督管理部门批准的说明书内容为准,不得任意改变。 保健食品广告应当引导消费者合理使用保健食品,保健食品广告不得出现下列情形和内容:
六、申请人提交申请材料目录: (一)国产保健食品注册申请表。 (二)申请人身份证、营业执照或者其它机构合法登记证明文件的复印件。 (三)提供申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的检索材料(从国家食品药品监督管理局政府网站数据库中检索)。 (四)申请人对他人已取得的专利不构成侵权的保证书。 (五)提供商标注册证明文件(未注册商标的不需提供)。 (六)产品研发报告(包括研发思路,功能筛选过程,预期效果等)。 (七)产品配方(原料和辅料)及配方依据;原料和辅料的来源及使用的依据。 (八)功效成分/标志性成分、含量及功效成分/标志性成分的检验方法。 (九)生产工艺简图及其详细说明和相关的研究资料。 (十)产品质量标准及其编制说明(包括原料、辅料的质量标准)。 (十一)直接接触产品的包装材料的种类、名称、质量标准及选择依据。 (十二)检验机构出具的试验报告及其相关资料,包括: 1、试验申请表; 2、检验单位的检验受理通知书; 3、安全性毒理学试验报告; 4、功能学试验报告; 5、兴奋剂、违禁药物等检测报告(申报缓解体力疲劳、减肥、改善生长发育功能的注册申请); 6、功效成份检测报告; 7、稳定性试验报告;
8、卫生学试验报告; 9、其他检验报告(如:原料鉴定报告、菌种毒力试验报告等)。 (十三)产品标签、说明书样稿。 (十四)其它有助于产品评审的资料。 (十五)两个未启封的最小销售包装的样品。 以上申报材料具体要求详见《保健食品注册管理办法(试行)》附件1。 七、对申请资料的要求: (一)申报资料的一般要求: 1、申报资料首页为申报资料项目目录,目录中申报资料项目按《保健食品注册申请表》中“所附资料”顺序排列。每项资料加封页,封页上注明产品名称、申请人名称,右上角注明该项资料名称。各项资料之间应当使用明显的区分标志,并标明各项资料名称或该项资料所在目录中的序号。整套资料用打孔夹装订成册。 2、申报资料使用A4规格纸张打印(中文不得小于宋体小4号字,英文不得小于12号字),内容应完整、清楚,不得涂改。 3、新产品注册申请应提交申报资料原件1份、复印件8份。复印件应当与原件完全一致,应当由原件复制并保持完整、清晰。其中,申请表、质量标准、标签说明书还应当提供电子版本,且内容应当与原件保持一致。 4、除《国产保健食品注册申请表》及检验机构出具的检验报告外,申报资料应逐页加盖申请人印章或骑缝章(多个申请人联合申报的,应加盖所有申请人印章),印章应加盖在文字处。加盖的印章应符合国家有关用章规定,并具法律效力。 5、多个申请人联合申报的,应提交联合申报负责人推荐书。 6、申报资料中同一内容(如产品名称、申请人名称、申请人地址等)的填写应前后一
延期申请报告 致:维西住房和城乡规划建设局 维西傈水融成房地产开发有限责任公司 云南科禹建设监理有限公司 感谢维西住房和城乡规划建设局对我公司的信任和支持,由我公司承建的“维西傈水融成一期工程”。 然而,自我项目部进入驻贵工地后,由于以下问题严重影响了我司该工程的正常施工和进度计划: 一、维西县停电次数过多,从2013年7月18日开工到现在 停电累计时间为6天; 二、雨季天气为26天。 三、春节假期的影响: 自2014年1月30日是除夕,春节放假至2月10日,又会影响工期15天; 四、气温下降混凝土浇筑只能尽量安排在白天,夜间不做安 排施工的时间整体又减少一半,造成直接影响; 以上四条已对本项目工期滞后,为了维西县的建设发展和维西傈水融成房地产开发有限责任公司傈水融成一期项目能按照总工期如期完成,现我项目部已根据维西县地理自然气候环境条件编制了冬季施工方案,以报送到监理、甲方通过审批,还请贵局审查我施工方所编制的内容是否 能够满足施工条件。申请时间为50天,望领导给予核实批准为谢! 申请单位:迪庆建工集团广茂工程总承包有限责 日期:任公司维西傈水融成项目部 2013年12月1日篇二:申请延期的报告 申请延期的报告 缙云县安全生产监督管理局: 贵局于2013年3月25日对我公司下达责令限期整改指令书,内容为我公司未按《建设项目安全设施“三同时”监督管理暂行办法》中相关规定进行备案,要求我单位对上述问题于2013年5月25日前整改完毕,达到有关法律法规、规章和标准规定的要求。 我公司接到指令书后积极进行整改,按有关法律法规、规章和标准规定进行了备案。但因我公司目前连酸线正在运行之中,将持续到下个月中旬,如我公司现在停炉,换用管道天然气,给我公司的订单造成相当大的压力,会对我公司造成重大损失,所以我公司特提出申请整改延期的报告,将整改期限延长到6月15日之后,盼请安全生产监督管理局批准为谢! 新永茂科技有限公司 2013-5-19篇三:延期申请报告 延期申请报告 致:河南鑫都实业股份有限公司 我单位城建贵公司的鑫地科技广场科研设计综合楼消防工项已按图纸设计要求施工完毕。因一些客观因素,造成合同交工日期延误。现将工期延误的因素向贵单位汇报如下: 1因素一,2010年11月15日我方按贵方要求组织工人进场○ 动工,但我方进场时总包方的主体、二次结构及粉刷部分完成工作量不足50℅,不具备我方施工的作业面,造成我方施工人员、机械停滞,直至2011年04月份我方的作业条件才基本具备施工要求。 2因素二,○贵单位科研综合楼实用功能的变更给我方造成施工难度加大。房间喷淋配合二次装修部分增加了工作量及工作难度,至2011年06月份,我方喷淋管道已施工打压完毕。但迫于装修的美观要求需我方配合装修。2011年06月-09月份我方施工工人基本上为满
保健食品GMP培训考试试题 姓名:岗位:分数: 一、选择题:请将正确的选项填到括号中(每题4分,共100分) 1、保健食品GMP的全称是:() A、保健食品生产管理规程 B、保健食品良好生产规范 C、保健食品种植质量管理规范 D、保健食品经营质量管理规范 2、保健食品GMP实施指南是和的基本准则。适用于保健食品生产的全过程、原料药生产中影响成品质量的关键工序。() A、保健食品生产、技术管理 B、保健食品研发、生产管理 C、保健食品生产、质量管理 D、保健食品质量、销售管理 3、保健食品生产企业应建立和机构。() A、生产、销售 B、生产、质量管理 C、种植、采购管理 D、销售、培训管理 4、保健食品生产企业各级机构和人员的职责应明确,并配备一定数量的与保健食品生产相适应的具有、及组织能力的管理人员和技术人员。() A、专业知识、生产经验 B、专业技术、社会经验 C、专业能力、实践经验 D、生产经验、实践经验 5、企业主管保健食品生产管理和质量管理的负责人应具有医药或相关专业以上学历。() A、本科 B、大专 C、中专 D、高中 6、从事保健食品生产操作及质量检验的人员应经,具有基础理论知识和实际操作技能。() A、专业技术培训 B、生产培训 C、质量培训 D、管理技术培训 7、对从事保健食品生产的各级人员应按保健食品良好生产规范要求进行和。() A、培训、考核 B、培训、规范 C、生产培训、质量培训 D、理论培训、实践培训 8、洁净室(区)应根据生产要求提供足够的照明。主要工作室的照度宜为;对照度有特殊要求的生产部门可设置照明。厂房应有应急照明设施。() A、250LX 、现场 B、250LX 、局部 C、300LX 、局部 D、300LX 、现场 9、洁净室(区)的窗房、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连接部位均应密封。空气洁净度等级不同的相邻房间之间的静压差应大于,洁净室(区)与室外大气的静压差应大于,并应有指示压差的装置。() A、10Pa、5Pa B、5Pa、10Pa C、15Pa、10Pa D、10Pa、15Pa 10、洁净室(区)的温度和相对湿度应与保健食品生产工艺要求相适应,无特殊要求时,温度应控制在摄氏度,相对湿度控制在() A、18°C~26°C 、40%~60% B、16°C~28°C 、45%~60% C、18°C~26°C 、45%~65% D、16°C~28°C 、45%~65% 11、洁净室(区)内安装的、不得对药品产生污染。() A、水池、地漏 B、水池、设备 C、管道、设备 D、照明、设备 12、不同空气洁净度等级的洁净室(区)之间的人员及物料出入,应有的措施。() A、专门 B、防止交叉污染 C、防止污染 D、防止混淆 13、生产设备应有明显的,并定期维修、保养和验证。() A、标志 B、状态标志 C、设备标志 D、设备名称
怎样识别保健食品和药品 保健食品是一种具有特定保健功能的食品。它适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的的食品。而药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症、用法和用量的物质。两者有着本质的区别。识别保健食品和药品最简单的方法,就是查看外包装的批号、标志和商标。 一、从批号上区分 保健食品的批号分为两种:一种是2003年6月12日前经卫生部批准的批号,批准文号的格式为:“卫食健字(4位年份代码)第××××号”,“卫”代表中华人民共和国卫生部;“食”代表食品,“健”代表保健食品。进口保健食品批准文号的格式为:“卫进食健字(4位年份代码)第××××号”,其中的“进”代表进口。卫生部批准的批号为长期有效。 另一种是2003年6月12日后,国家食品药品监督管理局批准的文号格式为:“国食健字G+四位年份代码+四位顺序号”。进口保健食品批准文号的格式为:“国食健字J+四位年份代码+四位顺序号”,“国”代表国家食品药品监督管理局,“G”代表国产,“J”代表进口。国家食品药品监督管理局批准的批号有效期为5年。 药品的批号与保健食品的批号截然不同。药品批准文号的格式为:国药准字+1位字母+8位数字。例如:“国药准字H11020001”,字母和数字含义依次是:“H”为化学药品,“11”为北京市的行政区划代码前两位,“02”为换发之年2002年的
后两位数字,“0001”为顺序号。试生产药品批准文号格式:国药试字+1位字母+8位数字。进口药品注册证格式为:字母H(Z或S)+8位数字,前四位为公元年号,后四位为顺序编号。 二、从标志上区分 保健食品的包装上应标注有“小蓝 帽”标志(如图),而药品没有专用标 志。 三、从商标上区分 《中华人民共和国商标法》规定, 药品的商标必须注册,所有药品均有注 册商标,而保健食品的商标国家未要求全部注册。 供稿:寿县消费者协会杨辉 通讯地址:安徽省寿县寿春镇新城区明珠路1号(工商大楼)
延期申请书范文 关于工程延期的申请 致:襄汾县百公里汾河生态城镇经济走廊襄汾段汾河中度治理和一般治理项目部 北京当代园林工程监理有限公司襄汾监理部 由临汾市沈达园林绿化有限公司承建的临汾市百公里汾河治理与生态修复工程襄汾县段一期堤内绿化工程07标工程合同工期为60天(开工日期xx年4月5日,竣工日期xx年6月3日),因以下原因导致工程未能按时完工。 1、曲亭水库上游泄水导致河道土建工程未能按时完工,直接影响草皮播种,不能按时施工。 2、6月份以后温度高,不适宜高羊茅、草地早熟禾、多年生黑麦草播种,影响发芽存活率低,只有在立秋后9月份以后进行播种。 特申请延期至xx年10月20日,望批准! 临汾市沈达园林绿化有限公司
襄汾县汾河治理堤内绿化七标段项目部 xx年5月25日 关于工程延期的申请 致:襄汾县百公里汾河生态城镇经济走廊襄汾段汾河中度治理和一般治理项目部 北京当代园林工程监理有限公司襄汾监理部 由山西省太谷县绿美园林绿化工程有限公司承建的临汾市百公里汾河治理与生态修复工程襄汾县段一期堤内绿化工程02标工程合同工期为60天(开工日期xx年4月5日,竣工日期xx年6月3日),因以下原因导致工程未能按时完工。 1、曲亭水库上游泄水导致河道土建工程未能按时完工,直接影响草皮播种,不能按时施工。 2、6月份以后温度高,不适宜高羊茅、草地早熟禾、多年生黑麦草播种,影响发芽存活率低,只有在立秋后9月份以后进行播种。
特申请延期至xx年10月20日,望批准! 山西省太谷县绿美园林绿化工程有限公司襄汾县汾河治理一期堤内绿化工程二标项目部 xx年5月30日 关于工程延期的申请 致:襄汾县百公里汾河生态城镇经济走廊襄汾段汾河中度治理和一般治理项目部 北京当代园林工程监理有限公司襄汾监理部 由信阳市光州园林绿化工程有限公司承建的临汾市百公里汾河治理与生态修复工程襄汾县段一期堤内绿化工程04标工程合同工期为60天(开工日期xx年4月5日,竣工日期xx年6月3日),因以下原因导致工程未能按时完工。 1、曲亭水库上游泄水导致河道土建工程未能按时完工,直接影响草皮播种,不能按时施工。