
电解液知识介绍
一.电解质由溶剂和和溶质构成。
在电解液中常使用的溶剂有二甲基甲酰胺、γ-丁内酯、乙二醇、丙三醇、水等。二甲基甲酰胺是一种军用电容器的溶剂,它具有很广的工作温度范围。在亚洲,γ-丁内酯作为电解质的溶剂使用也很流行,主要用在低压小型电容器,使用这种溶剂
为主溶剂的电容器具有较低的ESR。乙二醇是使用最广泛的溶剂,低压电容器通常用的是乙二醇加部分水为溶剂的体系。
电解液中的溶质主要用的是硼酸、硼酸盐、羧酸盐及少量的其他无机盐和去极化消氢剂、缓蚀剂、水解抑制剂等。
对于低压电解液中一般人为添加部分水,改善电解液的导电性能;中高压电解液,通常使用的是无水乙二醇体系,即使含水也要求在3%以下。
二.电解液的发展历史
第一代:硼酸+乙二醇体系,已发明50多年了,水的含量较高,否则电导率太低。硼酸和乙二醇酯化以及硼酸变成偏硼酸都会产生水,水少量存在于电解液中有助于支持氧化物的形成,对于提高氧化膜的修复能力是有益处的,但大量的水会引起电极箔的腐蚀,产生氢气,并且在高温下的蒸汽压较高,容易致使电容器爆裂。所以这种体系的电容器无法用在105℃。
第二代:直链羧酸盐+硼酸+乙二醇体系,改进目标是如何降低并控制水的含量,这意味着必须使用硼酸替代物或其它溶剂,以便获得水含量稳定、低阻抗的电解质。目前国内仍有使用的改进体系为硼酸+直链羧酸铵盐(DCA)+乙二醇体系。该体系虽能一定程度地降低水含量并具有使用成本低的优点,但DCA 的强度随碳链的增长而降低。较弱的酸虽能用于较高的电压而不崩溃,但其盐的可溶性随分子量的增大而降低,从而阻抗增加。直链二元羧酸在低温下有结晶析出的趋势,电容器的工作温度范围受到制约,这些问题成为了制造中、高压、低阻抗、宽温度范围、长寿命电解电容器的大障碍。
第三代:直链羧酸盐+乙二醇体系,铝电解电容器在漏电流方面较第二代电解液有较显据改善,但羧酸盐由于分子量的增大闪火上升,但其溶解量下降。
第四代:支链羧盐+乙二醇体系,支链羧酸盐取代或部分取代直链羧盐,支链羧酸盐溶解量大,热稳定性较优,但造价一般较高。
近年来在电解液研究开发方面走在世界前列的国家是日本,他们采用支链二元羧酸盐取代或部分取代直链二元羧酸盐。由于一些支链二元羧酸盐在乙二醇溶液中的溶解度和热稳定性均优于直链羧酸盐,并且有化学自行修复能力,所以使用含有支链二元羧酸盐的乙二醇体系能制造出高耐压、低有效电阻、对纹波电流有高承受能力、高耐热、长寿命的电容器产品,而中国才刚刚起步生产支链羧酸盐系电解液。
三.电解液的种类
从电解液水含量来分为:水系和非水系,部分非水系为γ-丁内酯(GBL)体系从电压来分为:低压,中压,高压电解液
四.电解液材料介绍
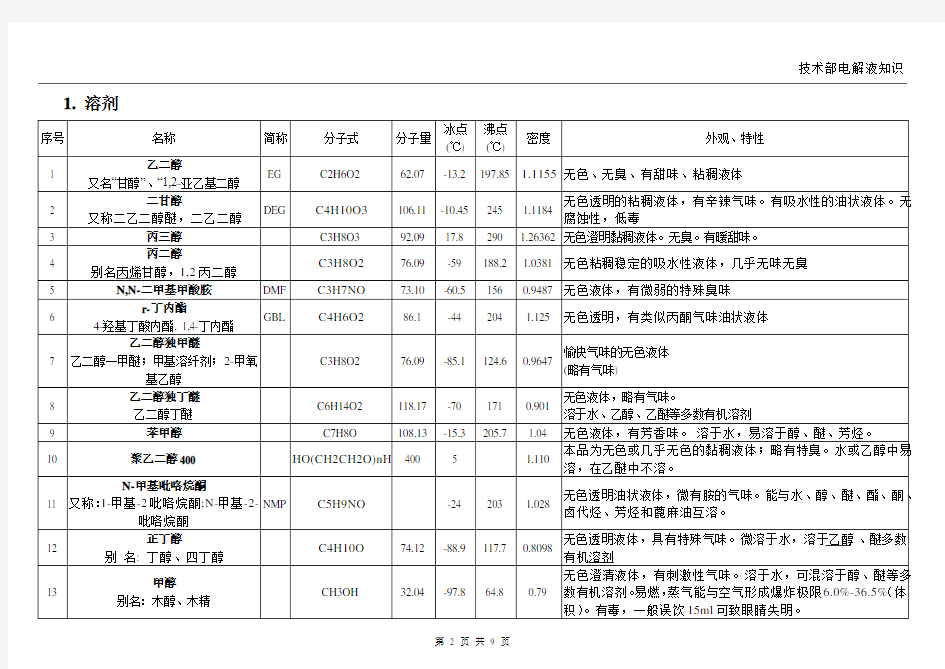
1.溶剂
2.溶质
五.电解液材料的选择
工作电解液是电容器的关键工艺之一。它作为电容器的实际阴极,有但要求具有优良的电化学特性,不断提供氧离子,修补受损的氧化膜;还必须具有极佳的稳定性,不与组成材料发生反应或发生腐蚀作用。
工作电解液按照组成成分为:溶剂、溶质和添加剂三部分。
1.溶剂的选择
溶剂决定电容器的使用范围,要求溶剂具有沸点高、凝固点低、蒸汽压和粘度小,对溶质有良好的溶解性,满足电容器在-40~+105℃范围内的电性能要求,部分要求为125℃甚至达到150℃以上(如节能灯铝电解电容),目前常用的主溶剂为乙二醇,沸点为196℃,凝固点为-12℃,其余辅助溶剂有:DMF、γ-丁内酯、二乙二醇、丙三醇等。DMF、γ-丁内酯有良好的低温特性,常常应用在超低温电解液,如-55℃等产品上。
2.溶质的选择
溶质是提供修补氧化膜,维持电容器正常工作的正、负离子或离子基团的主要成份。低压:甲酸铵、已二酸铵、马来酸铵等作溶质;中高压:壬二酸铵、葵二酸铵、已二酸铵、十二酸铵、苯甲酸铵、以及带支链的铵盐等作为其主溶质,保证高低温特性,提供氧化效率和高温稳定性。
3.添加剂的选择
添加剂是调节电解液粘度、电导率、提升闪火电压、钝化氧化膜和抑制氢气等作用的。电解液中添加磷酸及其盐类、硝基化合物、水解抑制剂等,可以显剧改善电解液的特性。
六.电解液中的反应
1.酯化反应:
A.硼酸或其盐与乙二醇或其它多元醇酯化
H3BO3+R1-OH R1-[(R1)i-O-B-(OH)-O]-H2+XH2O
B.
R1-COOH+HO-R2-OH R1-COO-R2-OH+H2O
2.酰胺化反应:
NH4OOC(CH2)n COONH4NH2OC(CH2)n CONH2+H2O
3.醚化反应:
R1-OH+R2-OH R1-O-R2+H2O
4.缩聚反应:2O
5.消氢反应: O2N++6e H2N OH+2H2O
七.电解液中水的来源
电解液中水的来源分为四个方面:
1.电解液中溶剂和各种溶质本身固有的水或结晶水
2.化学反应生成的水
A.酯化反应产生的水
B.电解液中有机化合物脱水、醚化、环化、热解等产生的水
3.芯子吸潮和溶剂溶质潮解从空气中吸收的水
4.人为加入的水分
特别指出,上述第三种水是需要特别防止的,因为空气中的水分或多或少含有微量的Cl-、灰分等有害物质,这是电解液中最忌讳的,它们可能导致铝箔的加快腐蚀,特别是珠海的海洋气候影响很大,还有在操作过程中的汗液挥发,所以制作的环境及工艺控制尤为重要。
八.铝电解电容器中的水合反应:
水合反应原理:
Al2O3+H2O Al(OH)3
九.电解液的检测:
电解液的检测主要有三项参数:电导率、酸碱度(PH值)、闪火电压等,必要时也要检验Cl-、SO42-、Fe3+、Cu2+、以及电解液的粘度等。
PH值: 一般分布在5.5-9.0,主要是由于铝及氧化铝的特性所决定,可用酸碱度仪测量.
电导率:一般分布在400μS/cm~80000μS/cm,可由电导率仪测出,电导率与产品的损耗以及等效串联电阻有很大的关系.
闪火电压:一般分布在100-600V,用铝箔氧化膜耐压测试仪测量,电解液的闪火电压是比较关键的一个参数,特别是高压电解液,闪火电压是制造技术的一个突破方向之一。测量闪火电压测量方法和材料因不同的公司各有不同:测量电流外部主要有10mA、20mA等,而我司一般用1mA,测量所用的材料有:高压化成箔(电压一般为590VF以上)、素箔、阳极导箔条等,所用的测量面积也各不相同。
测量温度,一般为常温,以30℃相对较准确,特别是电导率,受温度影响较大,所以电容在不同温度下损耗变化也相当明显,酸碱度和闪火电压也会随温度作微小变化。
外观检验:是否有杂质,污物,结晶,浑浊,颜色是否均勻,透明,有无异味。
一.电池常规知识 目录 1.什么是电池? 2.一次电池和二次电池有什么区别? 3、充电电池是怎样实现它的能量转换? 4、什么是Li-ion电池? 5、Li-ion电池的工作原理? 6、Li-ion电池的主要结构。 7、Li-ion电池的优缺点。 8、Li-ion电池安全特性是如何实现的? 9、什么是充电限制电压?额定容量?额定电压?终止电压? 10、Li-ion铝壳和钢壳电池比较它的区别有哪些? 11、目前常见的各种可充电电池之间有什么区别? 1、什么是电池? 电池是一种能源。当它正负极连接在用电器上时,因为正负极之间存在电势之差,电流从正极流向负极,储存在电池中的化学能直接转化成电能释放出来,一只电池必然由两种不同电化学活性的物质组成正负两极,正负极活性物质之间的电动势差形成电池的电压,根据其电化学系统的不同,各种类型的电池
电压各有不同。 2、一次电池和充电电池有什么区别? ?电池内部的电化学设计决定了该类型的电池是否可充。根据它 们的电化学成分和电极的结构可知,可充电电池的内部结构之 间所发生的反应是可逆的。 ?理论上,这种可逆性是不会受循环次数的影响,既然充放电会 在电极的体积和结构上引起可逆的变化,那么可充电电池的内 部设计就支持这种变化。而一次电池在给定的电池环境中两个 电极之间的电化学反应是不可逆的,因此,不可以将一次电池 拿来充电,这种做法很危险也很不经济。如果需要反复使用, 应选择真正的循环次数在1000次左右的充电电池,这种电池又 称为二次电池。 ?另一明显的区别就是它们具有较高的比能量和负载能力,以及 自放电率。一次电池能量密度远比一次电池高。然而他们的负 载能力相对要小。 ?二次电池具有相对较高的负载能力,可充电电池Li-ion,随着 近几年的发展,具有高能量容量。 ?不管何种一次电池的电化学系统属于哪种,所有的一次电池的 自放电率都很小。 3、充电电池是怎样实现它的能量转换? ?每种电池都具有电化学转换的能力,即将储存的化学能直接转 换成电能。就二次电池而言(另一术语也称可充电便携式电池),
小学生科普知识竞赛题目汇总 1为什么先看见闪电后听到雷声?(光波在空气中的传播速度比声速快) 2中国第一个奥运会冠军是谁?(许海峰) 3眼镜由谁发明的?(罗吉、培根) 4为什么自行车能动?(自行车的轮胎与地面相互摩擦) 5下面的称号各是谁?(诗仙—白、诗圣—杜甫、诗鬼—贺山水诗人——孟浩然、田园诗人——渊明)6月亮围绕什么东西转?转一周期多长?(地球)(24小时) 7我国三大平原是哪些?(东北平原、华北平原、长江中下游平原) 8地震在地球上每年多少次?(大约500万次) 9最小最冷的星星是什么?(冥王星) 10地球的厚被是什么?(大气圈) 11飞机上为什么要装黑匣子?(它是用来记载失事时飞机上的各种情况的,帮助人们了解事故的原因的)12春节有哪些风俗?(扫房、放爆、贴春联、吃年夜饭等) 13什么动物能预测地震?(牛、马、驴、兔、鸡、狗、蛇、鼠、狗、猫、燕子、鹰等) 14什么植物先开花,后长叶?(连翘、迎春花、腊梅、桃树、梨树) 15蜜蜂是怎样造蜂房的?(每一只工蜂的腰部都有一个蜡腺,能分泌出蜡,这种经过嘴巴的咀嚼后变得又软又韧,用它就可以建造蜂房了) 16药瓶为什么是浅色的?(因为浅色能反光,深色的受太一照,吸收光多,药品容易变质) 17谁发明蒸汽机?(瓦特) 18哪种恐龙最硬?(剑龙) 19地球的血是什么?(岩浆) 20地球的骨架是什么?(岩石) 21为什么不要看电焊火花?(含一种对眼睛有害的紫外线) 22为什么不能关灯看电视?(电视机的屏幕和图象都比较小,在黑暗中看,视力要高度集中和扩展,对电视机屏幕上的光线的强烈反映特别敏感,会使眼睛受到刺激,视力下降) 23中华人民国十大元帅是谁?(朱德、德怀、贺龙、毅、伯承、罗荣桓、徐向前、聂荣臻、林彪、叶剑英) 24按顺序写出我国古代都有什么朝?(夏、商、周、、汉、隋、唐、宋、元、明、清) 25为什么兔子不用喝水?(因为兔子的主食青菜里有大量水份,足够身体的需要了,如果肠里的水一多,就会患肠胃炎。但兔子体缺水时,也是可以喝水的) 26什么是流星?(指太空很小的固体或尘埃闯入地球大气层所产生的光迹) 27中国历史上杰出的天文学家是谁?(衡) 28电池的发明人是谁?(伏特) 29维威火山在哪里?(意大利) 30第1个到达月球的两个宇航员是谁?(阿姆斯特郎和奥尔德林) 31泰山在哪个省哪个市?(泰山市) 32亚马逊河在哪里?(巴西) 33伊洛瓦底江在哪里?(缅甸) 34界上最宝贵的五大宝石叫什么?(猫眼石、祖母绿、金刚宝石、蓝宝石、红宝石) 35鱼类的祖先叫什么?(鱼) 36世界上最毒的蜘蛛叫什么?(狼蜘) 37世界上会发光的动物叫什么?(电鳐和电鳗) 38巧克力是从哪里来的?(是从可可树上果实里的种子成的) 39为什么叶片里有“筋” (“筋”可以让叶收到,让根部吸收水分给叶)
1、一次电池和充电电池有什么区别? 电池内部的电化学性决定了该类型的电池是否可充,根据它们的电化学成分和电极的结构可知,真正的可充电电池的内部结构之间所发生反应是可逆的。 理论上,这种可逆性是不会受循环次数的影响,既然充放电会在电极体积和结构上引起可逆的变化,那么可充电电池的内部设计必须支持这种变化,既然,一次电池仅做一放电,它内结构简单得多且不需要支持这种变化,因此,不可以将一次电池拿来充电,这种做法很危险也很不经济,如果需要反复使用,应有尽有选择真正的循环次数在1000次左右的充电电池,这种电池也可称为一次电池或蓄电池。 2、一次电池和二次电池还有其他的区别吗? 另一明显的区别就是它们能量和负载能力,以及自放电率,二次电池能量远比一次电池高,然而他们的负载能力相对要小。 3、可充电便携式电池的优缺点是什么? 充电电池寿命较长,可循环1000次以上,虽然价格比干电池贵,但如果经常使用的话,是比较划算的。充电电池的容量比同规格的碱锰电池或锌碳电池低,比如,他们放电较快。 另一缺点是由于他们几近恒定的放电电压,很难预测放电何时结束。当放电结束时,电池电压会突然降低。假如在照相机上使用,突然电池放完了电,就不得不终止。 但另一方面可充电电池能提供的容量比太部分一次电池高。 但Li-ion电池却可被广泛地用照相器材中,因为它容量高,能量密度大,以及随放电深度的增加而逐渐降低的放电电压。 4、充电电池是怎样实现它的能量转换? 每种电池都具有电化学转换的能力,即将储存的化学能直接转换成电能,就二次电子(也叫蓄电池)而言(另一术语也称可充电使携式电池),在放电过程中,是将化学能转换成电能;而在充电过程中,又将电能重新转换成化学能。这样的过程根据电化学系统不同,一般可充放电500次以上,而我司产品li-ion可重复充放电1000次以上。Li-ion是一种新型的可充电便携式电池。它的额定电压为3.6V,它的放电电压会随放电的深度逐渐衰退,不象其他充电电池一样,在放电未,电压突然降低。 5、什么是Li-ion电池? Li-ion是锂电池发展而来。所以在介绍Li-ion之前,先介绍锂电池。举例来讲,以前照相机里用的扣式电池就属于锂电池。锂电池的正极材料是锂金属,负极是碳。当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。Li-ion就像一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅来回奔跑。所以Li-ion又叫摇椅式电池。 6、Li-ion电池有哪几部分组成? (1)电池上下盖(2)正极——活性物质为氧化锂 钴(3)隔膜——一种特殊的复合膜
三.电解池 1、定义:借助外加电流引起的氧化还原反应,把电能转化为化学能的装置。 装置原电池电解池 实例 原理 形成条件①电极:两种不同的导体相连; ②电解质溶液:能与电极反应。 ①电源; ②电极(惰性或活性电极); ③电解质(水溶液或熔化态)。 反应类型自发的氧化还原反应非自发的氧化还原反应 电极名称由电极本身性质决定: 正极:材料性质较不活泼的电极; 负极:材料性质较活泼的电极。 由外电源决定: 阳极:连电源的正极; 阴极:连电源的负极; 电极反应负极:Zn-2e-=Zn2+(氧化反应) 正极:2H++2e-=H2↑(还原反应) 阴极:Cu2+ +2e- = Cu (还原反应) 阳极:2Cl--2e-=Cl2↑ (氧化反应) 应用①抗金属的电化腐蚀; ②实用电池。 ①电解食盐水(氯碱工业);②电镀(镀 铜);③电冶(冶炼Na、Mg、Al);④精 炼(精铜)。 ⑴阴极A.阴极材料(金属或石墨)总是受到保护。 B.阳离子得电子顺序—金属活动顺序表的反表:K+ ①分析电解质溶液中存在的离子; ②看阳极电极材料,确定阳极参加反应的物质。若阳极材料为活性电极,则电极材料本身放电。若阳极材料为惰性电极,则阳极是溶液中的阴离子按照放电顺序进行放电③确定电极、写出电极反应式; ④写出电解方程式。 如:(阳极材料为惰性电极材料) ⑴电解NaCl溶液(放氢生碱型): 2NaCl+2H2O 电解 ====H2↑+Cl2↑+2NaOH,溶质、溶剂均发生电解反应,PH增大。 ⑵电解CuSO4溶液(放氧生酸型): 2CuSO4 + 2H2O 电解 ====2Cu + O2↑+ 2H2SO4溶质、溶剂均发生电解反应, PH减小。 ⑶电解CuCl2溶液(电解电解质本身): CuCl2电解 ==== Cu+Cl2↑ 电解盐酸: 2HCl 电解 ==== H2↑+Cl2↑溶剂不变,实际上是电解溶质,PH增大。 ⑷电解稀H2SO4、NaOH溶液、Na2SO4溶液(电解水型): 2H2O 电解 ==== 2H2↑ + O2↑,溶质不变,实际上是电解水,PH分别减小、增大、不变。酸、碱、盐的加入增加了溶液导电性,从而加快电解速率(不是起催化作用)。 ⑸电解熔融NaOH: 4NaOH 电解 ====4Na + O2↑ + H2O↑若阳极材料为活性电极如 用铜电极电解Na2SO4溶液: Cu +2H2O 电解 ==== Cu(OH)2 + H2↑ (注意:不是电解水。) 5、电镀(电解精炼铜) 1、定义:利用电解原理在某些金属表面镀上已薄层其他金属或合金的方法。其实质是一种特殊情况下的电解。 2、构成: 阴极:待镀金属制品阳极:镀层金属电镀液:含镀层金属离子的电解质溶液 如:在铁制品表面电镀铜: 阳极:Cu — 2e—== Cu2+ 阴极:Cu2+ + 2e—== Cu 小学生科普知识竞赛试题集锦 小学科普知识竞赛试题库 1、我国农历中有(24个)节气。 2、笛子发出声音是(空气的振动)产生的 3、产生海水潮汐的主要原因是:(月球引力) 4、我国法律规定,未满(18)周岁的公民称为未成年人? 5、企鹅是(南极)特有动物 6、地球上有四大洋,位于地球最北部的是(北冰洋) 7、清朝道光年间,在虎门销禁鸦片的民族英雄是(林则徐) 8、电脑的“大脑”是(中央处理器(CPU)) 9、端午节赛龙舟、吃粽子是为了纪念我国古代爱国诗人(屈原) 10、绿色植物吸收阳光能量、制造氧气的过程叫(光合作用) 11、成年人的骨头有(206块) 12、发明的(爱迪生)灯泡 13、在离地面20~25 公里的平流层内,有一层臭氧气体。臭氧层的作用是(阻挡太阳“紫外线辐射”)。 14、艾滋病的传播途径是(血液传播)、母婴传播。 15、胰岛素可以治疗(糖尿病)。 16、地震在地球上每年.大约500万次 17、创制世界上最早的浑天仪和测定地震的地动仪的我国古代科学家是(张衡)。 18、电池的发明人是(伏特)。 19、世界第一大河是(长江)。 20、(华佗)发明了麻醉术。 21、“杂交玉米之父”指的是(袁隆平)。 22、第一个登上月球的人是(美国的阿姆斯特朗). 23、世界上第一颗人造地球卫星是(前苏联)1957年发射成功的。 24、中国第一颗人造地球卫星是于(1970)年发射成功的。 25、中国第一颗原子弹在( 1964年)引爆,震惊了世界。 26、“行星之王”指的是(木星)。小学生科普知识竞赛试题集锦小学生科普知识竞赛试题集锦。 27、淡水资源占地球水资源的百分比是(3%)。 28、人类生产活动所排放大量的(二氧化碳)是造成气候变暖的主要原因。 29、地球表面有(70%)的地方被水覆盖。 30、表达祝福,用(发E—mail )方式更符合环保。 31、我国最大的沙漠是(塔克拉马干沙漠)。 32、甲午战争中牺牲的名族英雄是(邓世昌) 33、太阳是一颗离地球最近的(恒星)。 34、吃西餐时,我们应该(右手拿刀,左手拿叉)。 35、戏曲人物中画黑色脸谱的一般是(好人)。 36、我国第一大岛是(台湾岛)。 37、中国最大的淡水湖是(鄱阳湖)。 38、电视机的发明者是(贝尔德)。 39、计算机是使用(二进制)进行计算的。 原电池总复习知识点总结 一、定义: 将化学能直接转变成电能的装置。 二、构成原电池的条件: ①电解质溶液 ②两个导体做电极 ③形成闭合回路(或在溶液中接触) ④有能自发进行的氧化还原反应 三、原理 四、原电池电极的判断 (1)由组成原电池的两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。(2)根据外电路电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。 (3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。 (4)根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应。因此可以根据总化学方程式中化合价的升降来判断。 (5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。(但铅蓄电池放电时正负极质量都增大) (6)根据电极上产生的气体判断:原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。 (7)根据某电极附近pH的变化判断 析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。 五、电极反应式的书写 (1)准确判断原电池的正负极是书写电极反应的关键 如果原电池的正负极判断失误,电极反应式的书写一定错误。上述判断正负极的方法是一般方法,但不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:负极:Cu -2e-=Cu2+正极:NO3-+ 4H++ 2e-=2H2O + 2NO2↑ 再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为: 负极:2Al + 8OH--2×3e-=2AlO2-+ 2H2O正极:6H2O + 6e-=6OH-+ 3H2↑(2)要注意电解质溶液的酸碱性。在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH-,在碱溶液中,电极反应式中不能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以CO32-离子形式存在,而不是放出CO2气体。 (3)要考虑电子的转移数目 在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。防止由总反应方程式改写成电极反应式时所带来的失误,同时也可避免在有关计算中产生误差。 (4)要利用总的反应方程式 从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。 锂离子电池电解液 1 锂离子电解液概况 电解液是锂离子电池四大关键材料(正极、负极、隔膜、电解液)之一,号称锂离子电池的“血液”,在电池中正负极之间起到传导电子的作用,是锂离子电池获得高电压、高比能等优点的保证。电解液一般由高纯度的有机溶剂、电解质锂盐(六氟磷酸锂,LiFL6)、必要的添加剂等原料,在一定条件下,按一定比例配制而成的。 有机溶剂是电解液的主体部分,与电解液的性能密切相关,一般用高介电常数溶剂与低粘度溶剂混合使用;常用电解质锂盐有高氯酸锂、六氟磷酸锂、四氟硼酸锂等,但从成本、安全性等多方面考虑,六氟磷酸锂是商业化锂离子电池采用的主要电解质;添加剂的使用尚未商品化,但一直是有机电解液的研究热点之一。 自1991年锂离子电池电解液开发成功,锂离子电池很快进入了笔记本电脑、手机等电子信息产品市场,并且逐步占据主导地位。目前锂离子电池电解液产品技术也正处于进一步发展中。在锂离子电池电解液研究和生产方面,国际上从事锂离子电池专用电解液的研制与开发的公司主要集中在日本、德国、韩国、美国、加拿大等国,以日本的电解液发展最快,市场份额最大。 国内常用电解液体系有EC+DMC、EC+DEC、EC+DMC+EMC、EC+DMC+DEC等。不同的电解液的使用条件不同,与电池正负极的相容性不同,分解电压也不同。电解液组成为lmol/L LiPF6/EC+DMC+DEC+EMC,在性能上比普通电解液有更好的循环寿命、低温性能和安全性能,能有效减少气体产生,防止电池鼓胀。EC/DEC、EC/DMC电解液体系的分解电压分别是4.25V、5.10V。据Bellcore研究,LiPF6/EC+DMC与碳负极有良好的相容性,例如在Li x C6/LiMnO4电池中,以LiPF6/EC+DMC为电解液,室温下可稳定到4.9V,55℃可稳定到4.8V,其液相区为-20℃~130℃,突出优点是使用温度范围广,与碳负极的相容性好,安全指数高,有好的循环寿命与放电特性。 高中化学原电池和电解池 一原电池; 原电池的形成条件 原电池的工作原理原电池反应属于放热的氧化还原反应,实现化学能向电能的转化。 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。 原电池的构成条件有三个: (1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。 (2)两电极必须浸泡在电解质溶液中。 (3)两电极之间有导线连接,形成闭合回路。 只要具备以上三个条件就可构成原电池。而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。 形成前提:总反应为自发的氧化还原反应 GAGGAGAGGAFFFFAFAF 电极的构成: a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极; b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极; c.金属与化合物—铅蓄电池,铅板作负极,二氧化铅作正极; d.惰性电极—氢氧燃料电池,电极均为铂。 电解液的选择:电解液一般要能与负极材料发生自发的氧化还原反应。 原电池正负极判断: 负极发生氧化反应,失去电子;正极发生还原反应,得到电子。 电子由负极流向正极,电流由正极流向负极。溶液中,阳离子移向正极,阴离子移向负极 电极反应方程式的书写 负极:活泼金属失电子,看阳离子能否在电解液中大量存在。如果金属阳离子不能与电解液中的离子共存,则进行进一步的反应。例:甲烷燃料电池中,电解液为KOH,负极甲烷失8个电子生成CO2和H2O,但CO2不能与OH-共存,要进一步反应生成碳酸根。 正极:①当负极材料能与电解液直接反应时,溶液中 的阳离子得电子。例:锌铜原电池中,电解液为HCl,正 GAGGAGAGGAFFFFAFAF 科技节科普知识竞赛题(带答案} 三、选择题。 1、噪声对人体哪个系统有害: A、心血管系统 B、消化系统 C、呼吸系统 2、地球上的人观看晴朗的天空呈现蓝色,这是因为: A、大陆上的海水把天空映成蓝色 B、太阳光中的蓝色被物体反射成蓝色 C、太阳光中的蓝色光被天空中的微粒散射成蓝色 D、宇宙空间本身是蓝色 3、植物是很多动物的食物,植物自身则主要是利用光合作用制造养料。植物在进行光合作用的时候,除利用太阳能和自身的叶绿素外,还需要空气中的 A、二氧化碳 B、一氧化碳 C、氧气 D、一氧化氮 4、下列哪种喝水方式不宜采用: A、饭后大量喝水 B、渴了再喝水 C、根据膳食营养素构成等因素增减喝水量 5、哺乳动物是最高等的脊椎动物,靠母体的乳腺分泌乳汁哺育初生幼体。下面哪种是哺乳动物?A海豚B海马C海星D海龙 6、乒乓球瘪了用什么办法能使它鼓起来? A.放到冰柜里B.向里吹气C.泡在开水里 7、蝙蝠晚上捉蚊子不靠眼睛,靠什么呢? A.超声波B.电磁波C.脑电波 8、用冰块冷冻食物,最好把冰块放在食物: A、上方B.下方C、中间 9、狗为什么总伸着舌头喘气? A、散热B、跑得太快C、帮助呼吸 10、家庭照明电路的电压是多少伏? A、110伏B.220伏C、380伏 11、冬天用手摸室外的铁和木头? A、一样凉B、铁比木头凉C、木头比铁凉 12、为什么先看见闪光,后听见雷声? A、闪电和雷不是同时发生的 B、声音的传播速度比光的传播速度慢 C、声音的传播速度比光的传播速度快 13、向日葵为什么跟着太阳转是因为? A、因为地球自转 B、向光性 14、水是生命之源,人体各部位无一不含有水,水占人体重量的: A、50%以上 B、60%-70%%以上 15、人体最坚硬的部分是: A、指甲 B、牙齿 C. 颅骨 16、海马是马吗? A、不是 B、是 第四届科普知识竞赛活动总结 在运动会圆满结束之际,又迎来了数学与信息科学学院团总支科技实践部举办的科普知识竞赛。在科技实践部各成员的努力下,此次科普知识竞赛在一定程度上取得了圆满成功。对于此次活动,我部做了如下总结:1、在活动前期,由我们科技实践部的进行搜题,并做好了竞赛时要用的PPT。准备了活动的策划,通知的下发和参赛人员的确定,以及在参赛前准备好了参赛时所需的设备和发放给亲友团所需的奖品,会场的布置等等。可以说我们为这次竞赛做好了充分的准备,并且有信心把这次竞赛做好。 2、本次科普知识竞赛赛形式新颖独特,贴近生活,引发同学们的对科普知识的积极思考,锻炼了其团队合作精神。让全学院的同学在学习之余通过参加竞赛的形式了解更多的知识。 3、与之前的科普知识竞赛相比,此次活动整体气氛更加活跃,并且很多题目的答案都让同学们大开眼界,在一定程度上扩宽了他们的知识范围。 4、在亲友团抢答题环节中,由于我部对答对题的亲友赠上了小礼品,因此,极大地激发了同学们的积极性,也进一步的增强了活动氛围。 5、当然在活动过程中也存在一些不足:在抢答题环节,现场有些混乱,出现起哄现象,一些在边上的同学在此环节中不能被看见,我们没能 很准确的分清抢答过程中同学的先后顺序。也因此造成了比赛现场比 较混乱;在题目的准备过程中,题目的量还不够,虽然此次比赛并没有因此出现太大的问题,但在以后的工作中也是应该尽量注意的。5、据反馈表汇总,比赛题目安排不合理,存在某个方面的题过于集中,不分散,因此存在某个团队回答题目的时候只有关于那方面的知识,现场秩序在抢答题环节时有些混乱……这些都为我们以后工作的开展提供了最宝贵的建议。 总的来说,我们这次的活动举办得较为成功,这是我部第四次举办此类活动,不仅给我院广大学生提供了一个充分展示自我的平台,同时还加深了他们的科普知识的了解。希望我们能吸取经验教训,在以后的活动中能做的更好。 原电池与电解池 一、原电池 1. 构成原电池的条件: A.活泼性不同的两个电极 ①活动性不同的金属(或一种金属和一种非金属导体石墨),活泼金属为负极。 ②两惰性电极——石墨或Pt等(燃料电池电极)。; B.电解质溶液; C.形成闭合电路; D.自发氧化还原反应。 2. 原电池的反应原理 电子从负极流出,沿导线流回正极 ①活动性不同的金属(或一种金属和一种非金属导体石墨) 负极:较活泼金属,失电子,化合价升高,发生氧化反应 溶液中的阴离子向负极移动,电极质量减小。 正极:不活泼金属(或石墨等),得电子,化合价降低,发生还原反应。 ①当负极材料能与电解液直接反应时,溶液中的阳离子得电子。例:溶液中如果有阳离子,应由金属阳离子先得电子,变成金属单质,锌铜原电池中,电解液为HCl,正极H+得电子生成H2。 ②当负极材料不能与电解液反应时,溶解在电解液中的O2得电子。如果电解液呈酸性,O2+4e-+4H+==2H2O;如果电解液呈中性或碱性,O2+4e-+2H2O==4OH- 判断正负极的依据:金属活动顺序表 ②两惰性电极——石墨或Pt等(燃料电池电极) 负极:可燃烧的气体 正极:氧气 3. 各种电池 ①碱性干电池 Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH ②铅蓄电池 Pb+PbO2+2H2SO4=2PbSO4+2H2O, 请写出电极反应式。注意:PbSO4是难溶物。 ③燃料电池 二、电解池 1. 电解:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程,叫做电解。 2. 电解池的组成条件: ①直流电源 ②两个电极 ③电解质溶液或熔融电解质 ④形成闭合回路 ? 判断电解池两极的常用依据 ①看电源(与电池正极相连的是阳极,与负极相连的是阴极) ②看电子方向、两极产物(阳离子移向阴极,发生还原反应 阴离子移向阳极,发生氧化反应) 3. 电解反应方程式: 阴极:溶液中的阳离子向阴极移动,得电子,发生还原反应。阴极受保护。(电镀原理) 阳离子的放电顺序:金属活动顺序表的逆序 Zn 2+< Fe 2+ < Pb 2+ < H + < Cu 2+ < Fe 3+ < Hg 2+ < Ag + 注意: Ag + > Fe 3+ > Cu 2+ ; Fe 2+ > H 2O > Al 3+ 电镀时:H +浓度较小:H +< Zn 2+< Fe 2+< Pb 2+ < Cu 2+ 阳极:溶液中的阴离子向阴极移动,失电子,发生氧化反应。 放电顺序:① 活性电极(Ag 以前),电极失电子 A - ne-==A n+ ② 惰性电极(Pt 、Au 、石墨),阴离子放电 S 2->I ->Br ->Cl - >OH - ? 电解硫酸铜溶液的电极反应式和总反应式 阴极:2Cu 2+ + 4e- = 2Cu 阳极:4OH - - 4e- = 2H 2O + O 2↑ 4H2O==4H ++4OH- ? 写出以碳棒作电极电解饱和氯化钠溶液的电极反应式 阳极 (C): 2Cl -- 2e -=Cl2↑ 阴极 (C):2H+ +2e -= H2 ↑ ? 写出以铜棒作电极电解氯化铜溶液的电极反应式 阳极 (Cu): Cu - 2e -=Cu2+ 阴极 (Cu): Cu2+ +2e -= Cu 4. 电解原理的应用 a. 铜的电解精炼 ⑴粗铜含的杂质: Zn 、Fe 、Ni 、Ag 、Au 等 ⑵粗铜的精炼 粗铜做阳极,纯铜做阴极,CuSO 4溶液做电解液 (3)电极反应式 (4) 阳极上比铜不活泼的金属,沉积于阳极底部,成为阳极泥,可以提炼金、银 等贵重金属 通电 2Cu 2+ + 2H 2O 2Cu + 4H+ + O 2↑ 第四章电化学基础 一、原电池: 1、概念:化学能转化为电能的装置叫做原电池。 2、组成条件:①两个活泼性不同的电极②电解质溶液③电极用导线相连并插入电解液构成闭合回路 3、电子流向:外电路:负极——导线—— 正极 内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。 4、电极反应:以锌铜原电池为例: 负极:氧化反应: Zn-2e=Zn2+(较活泼金属) 正极:还原反应: 2H++2e=H2↑(较不活泼金属) 总反应式: Zn+2H+=Zn2++H2↑ 5、正、负极的判断: (1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。 (2)从电子的流动方向:负极流入正极 (3)从电流方向:正极流入负极 (4)根据电解质溶液内离子的移动方向:阳离子流向正极,阴离子流向负极 (5)根据实验现象:①溶解的一极为负极②增重或有气泡一极为正极 二、化学电池 1、电池的分类:化学电池、太阳能电池、原子能电池 2、化学电池:借助于化学能直接转变为电能的装置 3、化学电池的分类:一次电池、二次电池、燃料电池 (一)一次电池 1、常见一次电池:碱性锌锰电池、锌银电池、锂电池等 (二)二次电池 1、二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。 2、电极反应:铅蓄电池 放电:负极(铅): Pb-2e- =PbSO4↓ 正极(氧化铅): PbO2+4H++2e- =PbSO4↓+2H2O 充电:阴极: PbSO4+2H2O-2e- =PbO2+4H+ 阳极: PbSO4+2e- =Pb 两式可以写成一个可逆反应: PbO2+Pb+2H2SO4 ? 2PbSO4↓+2H2O 3、目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池 (三)燃料电池 1、燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池 2、电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。负极发生氧化反应,正极发生还原反应,不过要注意一般电解质溶液要参与电极反应。以氢氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中性。 ①当电解质溶液呈酸性时: 负极:2H2-4e- =4H+ 正极:O2+4e- +4H+ =2H2O 电解池 第1课时 电解原理 学习目标 1、理解电解原理,初步掌握一般电解反应两极反应物、产物的判断方法,能写出电极反应式和电解化学方程式。 知识归纳 1、电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。其实质是电解质溶液导电的过程。 电解池:把电能转化为化学能的装置,叫做电解池。 2、电极:(与电极材料无关)阳极:与电源的正极相连,发生氧化反应; 阴极:与电源的负极相连,发生还原反应。 3、构成条件:“三电一回路”①直流电源;②阴、阳电极;③电解质溶液或熔融电解质;④形成闭合回路。 4、(1)影响离子放电能力的因素:①离子得失电子的能力;②离子的浓度。 (2)离子的放电顺序:(物质在电解池的阴、阳两极发生反应的过程叫放电) 阴极:氧化性强的离子先得电子 Ag +>Hg 2+>Fe 3+>Cu 2+>H +(酸溶液)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +(水溶液)>Al 3+>Mg 2+>Na +>Ca 2+>K + 阳极:阳极金属或还原性强的离子先失电子 活性电极>S 2->I ->Br ->Cl ->OH ->N>S>F - 5、分析总结书写电解池电极反应的一般思路 ? 6、原电池和电解池的区别 负较活泼金属阳与电源正极相连正不活泼金属或非金属导体阴与电源负极相连三个①活动性不同的两个电极①两个电极原电池 电解池一个概念 将化学能转变为电能的装置将电能转变为化学能的装置两个电极 极—失电子—发生氧化反应极—失电子—发生氧化反应极—得电子—发生还原反应极—得电子—发生还原反应流向电子负极→外电路→正极阳极→外电路→阴极 电流正极→外电路→负极阴极→外电路→阳极 离子阳离子→正极,阴离子→负极阳离子→阴极,阴离子→阳极 四个条件 ②电解质溶液③闭合电路④自发进行的氧化还原反应②电解质溶液③闭合电路④外加直流电源相同点氧化还原反应 1、工笔是哪种绘画形式的技法(D) A. 水彩画 B.油画 C.水粉画 D.国画 2、人体含水量百分比最高的器官是(C) A. 肝 B.肾 C.眼球 3、人体最大的解毒器官是(C) A. 胃 B.肾脏 C.肝脏 D.脾 4、中国民间“送灶神”时要吃粘牙的甜食,这是为了(D) A.容易打发小孩子 B.是灶神喜欢的食品 C.甜为吉利 D.用糖粘住灶神的牙 5、下列哪种邮件如果丢失了,邮局不负赔偿责任(A) A.平信 B.挂号信 C.保价邮件 D.非保价邮包 E.特快专递邮 6、全世界最大的石佛像在(A) A.四川乐山 B.河南洛阳 C.四川屏山 D.四川江津 7、狗热时用什么散热(B) A. 皮肤 B.舌头 C.眼睛 D.耳朵 &现在美国国旗星条旗上有多少颗星:(C) A. 25 颗 B.30 颗 C.50 颗 D.60 颗 9、鱼、蛙、蛇等冷血动物的体温是(B) A.固定不变的 B.随外界的温度变化而变化 C.随体形的大小变化而变化 10、按照风俗习惯戒指带在中指上表示(B) A.正在寻找对象 B.正在恋爱之中 C.表示独身 D.表示离婚 E.表示结婚 11、智力的核心是(C) A.机械记忆能力 B.注意力 C.抽象思维能力 D.观察力 12、预防感冒要(ABCD) A锻炼身体增强抵抗力B经常开窗通风换气 C随气候变化增减衣服D不去病家串门,感冒流行时少去公共场所13、预防骨折要(ABCD) A注意遵守交通规则,防止交通事故B上下楼梯或高空作业要注意安全C要避免攀高取物,防止跌倒骨折D骨质疏松症者要避免剧烈运动14、中暑急救处理(ABCD) A轻度中暑时,应立即撤离高温环境到通风阴凉处休息 B 饮糖盐水及清凉饮料,也可内服人丹 C迅速为其进行物理降温 D严重中暑者要立即送医院抢救 15、心理健康是指(ABCD) A保持乐观情绪,适应社会环境B用健康的生活方式调整身心 C 创造良好的人际关系 D 家庭和睦 原电池和电解池知识点一.原电池和电解池的比较: 二.原电池正负极的判断: ⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。 ⑵根据电子或者电流的流动方向:电子流向:负极→正极。电流方向:正极→负极。 ⑶根据电极变化判断:氧化反应→负极;还原反应→正极。 ⑷根据现象判断:电极溶解→负极;电极重量增加或者有气泡生成→正极。 ⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。 三.电极反应式的书写: *注意点: 1.弱电解质、气体、难溶物不拆分,其余以离子符号表示; 2.注意电解质溶液对正负极的影响; 3.遵守电荷守恒、原子守恒,通过添加H+ 、OH- 、H 2 O 来配平 1.负极:⑴负极材料本身被氧化: ①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e-=M n+ 如:Zn-2 e-=Zn2+ ②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中: 如铅蓄电池,Pb+SO 4 2--2e-=PbSO 4 ⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式, 如燃料电池CH 4 -O 2 (C作电极)电解液为KOH:负极:CH 4 +10OH-8 e-=C0 3 2-+7H 2 O 2.正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应, H 2 SO 4 电解质,如2H++2e=H 2 CuSO 4 电解质: Cu2++2e= Cu ⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O 2 反正还原反应 ①当电解液为中性或者碱性时,H 2 O参加反应,且产物必为OH-, 如氢氧燃料电池(KOH电解质)O 2 +2H 2 O+4e=4OH- ②当电解液为酸性时,H+参加反应,产物为H 2 O 如氢氧燃料电池(KOH电解质) O 2 +4O 2 +4e=2H 2 O 四.常见的原电池 1.银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH ) 负极:Zn+2OH––2e-== Zn(OH)2 (氧化反应) 正极:Ag2O + H2O + 2e-== 2Ag + 2 OH-(还原反应) 化学方程式Zn + Ag2O + H2O== Zn(OH)2 + 2Ag 2.铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水) 负极:4Al-12e-==4Al3+ (氧化反应) 正极:3O2+6H2O+12e-==12OH-(还原反应) 总反应式为:4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面) ——海洋灯标电池 电解池 教育省科技馆 科学知识竞赛100题 学校:班级:: 学号:联系:邮编: 1.地球的寿命约为( B ) A.200~300亿年 B. 100~120亿年 C. 50~100亿年 D. 300~500亿年 2.通过英国格林尼治天文台的是( A ) A.0o经线 B. 0o纬线 C. 东经50o D. 西经50 o 3.人们将地幔与地核的分界面称为( D ) A.莫霍面 B.上地幔 C.下地幔 D.古登堡面 4.与西湖齐名,堪称“之肺”的是( C) A.雷峰塔 B.龙井 C.西溪湿地 D.梅家坞 5.提出“日心说”的科学家是(A ) A.哥白尼 B.伽利略 C.爱因斯坦 D.牛顿 6.海洋的面积约占地球表面积的( D) A.69% B.21% C. 31% D. 71% 7.世界上最古老的岩石大约有( D ) A.40亿岁 B.38亿岁 C.20亿岁 D.43亿岁 8.下列物品中,不是利用黏土制成的是(D ) A.唐三彩 B.“泥人”彩塑 C. 黑 D. 翡翠 9.世界上最坚硬的矿物是(D ) A.石英 B.花岗石 C. 石 D.金刚石 10. 琥珀是大自然的杰作,主要形成于( B ) A.三叠纪 B.白垩纪或第三纪 C. 第四纪 D.侏罗纪 11.下列不属于全球主要的地震带的是( D ) . . A.环太平洋地震带 B.地中海-喜马拉雅地震带 C.海岭地震带 D.大西洋地震带 12. 本世纪伤亡人数最多的一次海啸发生于( B ) A.1960年,智利 B.2004年,印度尼西亚 C.2011年,日本 D.1908年,意大利 13. 堪称“大自然的鬼斧神工之作”的恩戈罗恩戈罗火山口位于( D ) A.埃及 B.美国 C.日本 D.坦桑尼亚 14.当处于夏季时,澳大利亚处于( D ) A.春季 B.夏季 C. 秋季 D.冬季 15.闻名世界的“和下西洋”,发生于( A ) A.明朝 B.清朝 C.元朝 D.宋朝 16.如果傍晚出现火烧云,那么第二天的天气(A ) A.晴朗 B.阴雨 C. 下雪 D.落冰雹 17.人们真正发现科学的人工降雨方法,是在( D ) A.1945年 B.1946年 C.1947年 D.1948年 18.雪是一种结晶体,它的形状呈( D ) A.正五边形 B.正十二边形 C.八边形 D.正六角形 19.历史上最猛烈的闪电发生于( C ) A.坦桑尼亚 B. 埃及 C. 津巴布韦 D. 南非 20.发现彩虹形成原理的科学家是( D ) A.笛卡儿 B.伽利略 C.哥白尼 D.牛顿 21.世界上最大的沙漠是(B ) A. 塔克拉玛干沙漠 B.撒哈拉沙漠 C.辛普森沙漠 D.纳米布沙漠 22.被称为“圣女”的气候异常变化现象称为( B ) A.厄尔尼诺 B.拉尼娜 C.厄尔尼娜 D.拉尼诺 23.世界气象日为每年的( C ) A.4月12日 B.6月5日 C.3月23日 D.5月8日 . . 原电池和电解池 1.原电池和电解池的比较: 2原电池正负极的判断: ⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。 ⑵根据电子或者电流的流动方向:电子流向:负极→正极。电流方向:正极→负极. ⑶根据电极变化判断:氧化反应→负极; 还原反应→正极。 ⑷根据现象判断:电极溶解→负极; 电极重量增加或者有气泡生成→正极。 ⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。 3电极反应式的书写: 负极:⑴负极材料本身被氧化: ①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M —n e —=M n+ 如:Zn-2 e —=Zn 2+ ②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中: 如铅蓄电池,Pb+SO 42--2e -=PbSO 4 ⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式, 如燃料电池CH 4—O 2(C 作电极)电解液为KOH :负极:CH 4+10OH-8 e -=C032— +7H 2O 正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应, H2SO4电解质,如2H + +2e=H 2 CuSO 4电解质: Cu 2++2e= Cu ⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O 2反正还原反应 ① 当电解液为中性或者碱性时,H 2O 比参加反应,且产物必为OH — , 装置 原电池 电解池 实例 原理 使氧化还原反应中电子作定向移动,从而形成电流.这种把化学能转变为电能的装置叫做原电池. 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。这种把电能转变为化学能的装置叫做电解池. 形成条件 ①电极:两种不同的导体相连; ②电解质溶液:能与电极反应。 ③能自发的发生氧化还原反应 ④形成闭合回路 ①电源; ②电极(惰性或非惰性); ③电解质(水溶液或熔化态)。 反应类型 自发的氧化还原反应 非自发的氧化还原反应 电极名称 由电极本身性质决定: 正极:材料性质较不活泼的电极; 负极:材料性质较活泼的电极。 由外电源决定: 阳极:连电源的正极; 阴极:连电源的负极; 电极反应 负极:Zn —2e —=Zn 2+ (氧化反应) 正极:2H ++2e —=H 2↑(还原反应) 阴极:Cu 2+ +2e — = Cu (还原反应) 阳极:2Cl -—2e -=Cl 2↑ (氧化反应) 电子流向 负极→正极 电源负极→阴极;阳极→电源正极 电流方向 正极→负极 电源正极→阳极;阴极→电源负极 能量转化 化学能→电能 电能→化学能 应用 ①①抗金属的电化腐蚀; ②实用电池。 ①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na 、Mg 、Al );④精炼(精铜)。小学生科普知识竞赛试题集锦
原电池总复习知识点
锂电池电解液基础知识
高中化学原电池和电解池基础知识
科技节科普知识竞赛题(带答案}
科普知识竞赛总结
原电池与电解池 电化学知识点全复习
高中化学选修4电化学知识点总结(最新整理)
电解池知识点归纳
科普知识竞赛题库
原电池和电解池知识点归纳
科普知识竞赛100题题库
原电池和电解池知识点总结