
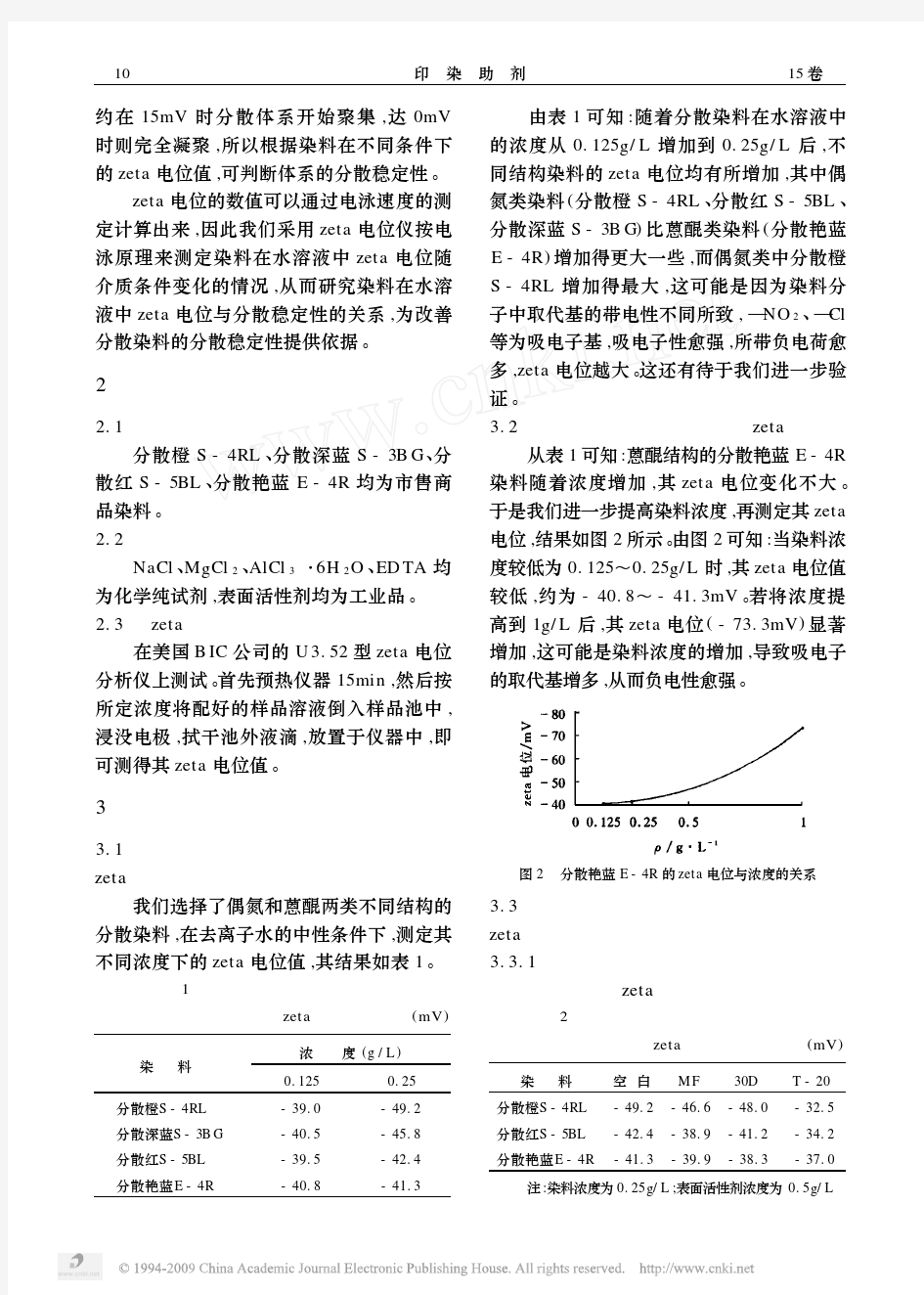
【专题】动态光散射基本原理及其在纳米科技中的应用——Zeta电位测量 -------------------------------------------------------------------------------- 作者: 骑着蜗牛追火箭收录日期: 2009-11-28 发布日期: 2009-11-28 动态光散射基本原理及其在纳米科技中的应用——Zeta电位测量 前言:Zeta电位是纳米材料的一种重要表征参数。现代仪器可以通过简便的手段快速准确地测得。大致原理为:通过电化学原理将Zeta电位的测量转化成带电粒子淌度的测量,而粒子淌度的测量测是通过动态光散射,运用波的多普勒效应测得。 1.Zeta电位与双电层(图1) 粒子表面存在的净电荷,影响粒子界面周围区域的离子分布,导致接近表面抗衡离子(与粒子电。荷相反的离子)浓度增加。于是,每个粒子周围均存在双电层。围绕粒子的液体层存在两部分:一是内层区,称为Stern层,其中离子与粒子紧紧地结合在一起;另一个是外层分散区,其中离子不那么紧密的与粒子相吸附。在分散层内,有一个抽象边界,在边界内的离子和粒子形成稳定实体。当粒子运动时(如由于重力),在此边界内的离子随着粒子运动,但此边界外的离子不随着粒子运动。这个边界称为流体力学剪切层或滑动面(slippingplane)。在这个边界上存在的电位即称为Zeta电位。 ZETA电位是一个表征分散体系稳定性的重要指标。由于带电微粒吸引分散系中带相反电荷的粒子,离颗粒表面近的离子被强烈束缚着,而那些距离较远的离子形成一个松散的电子云,电子云的内外电位差就叫Zeta电位。也称电动电位(只有当胶粒在介质中运动时才会表现出来),实际上就是扩散层内的电位差。ξ电位较高时,粒子能保持一定距离消弱和抵消了范德华引力从而提高了颗粒悬浮系统的稳定性。反之,当ξ电位较低时,粒子间的斥力减小并逐步靠近,进入范德华引力范围内,粒子就会互相吸引、团聚。ξ电位与液体递质内的粒子质量分数有关,改变液体的pH值、增加体系的盐含量都会引起双电层压缩,改变粒子的ξ电位,降低颗粒间的静电排斥作用,从而影响颗粒悬浮系统的稳定性。 2.Zeta电位与胶体的稳定性(DLVO理论) 在1940年代Derjaguin, Landau, Verway与Overbeek 提出了描述胶体稳定的理论,认为胶体体系的稳定性是当颗粒相互接近时它们之间的双电层互斥力与范德瓦尔互吸力的净结果。此理论提出当颗粒接近时颗粒之间的能量障碍来自于互斥力,当颗粒有足够的能量克服此障碍时,互吸力将使颗粒进一步接近并不可逆的粘在一起。(图2) Zeta电位可用来作为胶体体系稳定性的指示: 如果颗粒带有很多负的或正的电荷,也就是说很高的Zeta电位,它们会相互排斥,从而达到整个体系的稳定性;如果颗粒带有很少负的或正的电荷,也就是说它的Zeta电位很低,它们会相互吸引,从而达到整个体系的不稳定性。 一般来说, Zeta电位愈高,颗粒的分散体系愈稳定,水相中颗粒分散稳定性的分界线一般认为在+30mV或-30mV,如果所有颗粒都带有高于+30mV或低于-30mV的zeta电位,则该分散体系应该比较稳定 3.影响Zeta电位的因素 分散体系的Zeta电位可因下列因素而变化: A. pH 的变化 B. 溶液电导率的变化
Zeta电位仪测试简化过程 1、开启仪器(仪器的开关在设备的后面的右上部位), 将出现“嘟嘟”声,指示仪器已开启,开始初始化步骤;如果仪器完成例程,出现第二次“嘟嘟”声。将再次听到两次“嘟嘟”声,说明仪器已达到25°C的默认温度。因为本仪器为632.8激光光源,一般需稳定30分钟 2、点击图标,启动Zetasizer软件 3、点击软件中 File – New - Measurement file,创建此次测试文 件,一经创建,本次测试的结果均自动保存在此文件中,无需另行保存。 4、制备样品 5、将制备的样品注入样品池,粒径分布需1.0 ml—1.5 ml,Zeta点 位测量至少需要1.0 ml。 6、将样品池插入仪器中,等待温度平衡 7、点击Start (),即进行测量。 8、使用光盘拷取数据。 使用注意事项 测量粒径分布 1.测量粒径前,需查知样品分散剂的粘度、折光指数(Refractive Index) 2.用卷纸轻轻点拭样品池外侧水滴,切勿用力擦拭,以防将样品池划伤,如发现样品池 有划纹,需更换。 3.手尽量避免触摸样品池下端,否则会影响光路。 4.一定要去除样品池内的气泡 5.实验室提供的样品池为聚苯乙烯材质,不可用于测量有机分散体系 6.实验室提供的样品池,测量温度不可高于50摄氏度 7.如需测量有机分散体系或高于50摄氏度,请自带石英比色皿 8.使用滤纸过滤时,舍去过滤后的第一滴样品,以防滤纸上杂质进入样品池 测量时需自带:卷纸、多个注射器、多个离心管(用于稀释样品)
Zeta电位测量 1、测量粒径前,需查知样品分散剂的粘度、折光指数(Refractive Index)、介电常数 (Dielectric constant) 2、用卷纸轻轻点拭样品池外侧水滴,尤其是两个塞子外侧 3、一定要去除样品池内的气泡,尤其是电极上气泡 4、如发现电极变黑,需更换 5、实验室提供的样品池为聚苯乙烯材质,不可用于测量有机分散体系 6、实验室提供的样品池测量温度不可高于70度 7、使用滤纸过滤时,舍去过滤后的第一滴样品,以防滤纸上杂质进入样品池 测量时需自带:卷纸、多个注射器(5ml)、多个离心管(用于稀释样品) 制备样品—粒径 样品浓度 每个类型的样品材料,有最佳的样品浓度测量范围。 ?如果样品浓度太低,可能会没有足够的散射光进行测量。除极端情况外,对该仪器来说一般不会发生。 ?如果样品太浓,那么一个粒子散射光也会被其它粒离所散射(这称为多重散射)。 ?浓度的上限也要考虑到:在某一浓度以上,由于粒子间相互作用,粒子不再进行自由扩散。 小粒子需要考虑的事项 最小浓度 对小于10nm的粒子,决定最小浓度的主要因素是样品生成的散射光强。实用的角度,这种浓度应生成最低光强为10,000cp/s(10 kcps),这样才能超过分散剂的散射。作为一个指导,水的散射光强应超过10kcp的,甲苯的应超过100kcps。 最大浓度 对小粒径的样品,最大浓度实际上不存在(以进行动态光散射(DLS)测量的术语来说)。 但实际,样品的性质本身会决定此最大值。例如,样品可能有以下性质:
实验7 Zeta 电位法测蛋白质的等电点 实验目的 1. 掌握zeta 电位的测试原理方法以及zeta 电位仪的使用。 2. 掌握通过zeta 电位测量蛋白质等电点的方法。 实验原理 分散于液相介质中的固体颗粒,由于吸附、水解、离解等作用,其表面常常是带电荷的。Zeta 电位是描述胶粒表面电荷性质的一个物理量,它是距离胶粒表面一定距离处的电位。若胶粒表面带有某种电荷,其表面就会吸附相反符号的电荷,构成双电层[1]。在滑动面处产生的动电电位叫作Zeta 电位,这就是我们通常所测的胶粒表面的(动电)电位。 蛋白质是两性电解质。蛋白质分子中可以解离的基团除N ―端α―氨基与C ―端α―羧基外,还有肽链上某些氨基酸残基的侧链基团,如酚基、巯基、胍基、咪唑基等集团,它们都能解离为带电基团。因此,在蛋白质溶液中存在着下列平衡: C COOH H R NH 3+-C H R NH 3COO --+C COO -H NH 2R 阳离子 两性离子 阴离子 pH < pI pH = pI pH > pI 调节溶液的pH 使蛋白质分子的酸性解离与碱性解离相等,即所带正负电荷相等,净电荷为零,此时溶液的pH 值称为蛋白质的等电点。
图1. PH值对BSA的zeta电位的影响(0.1mol / L NaCl溶液)[2] 等电点是蛋白质的一个重要性质,本实验旨在通过测定不同pH下1mg/ml 的牛血清白蛋白(BSA)溶液的zeta电位,用zeta电位值对pH作图(如图1),对应于zeta电位为零的pH即为牛血清白蛋白(BSA)的等电点。 实验仪器及试剂: ZetaPALS型Zeta电位及纳米粒度分析仪,比色皿,钯电极,牛血清白蛋白(BSA),柠檬酸,柠檬酸钠,去离子水。 实验步骤: 1.配制pH值分别为3.0,4.2,5.4,6.6的0.1mol/L柠檬酸-柠檬酸钠缓冲溶液 溶液脱气后,再加入BSA充分溶解。 2.打开仪器后面的开关及显示器。 3.打开BIC Zeta potential Analyzer(水相体系)/BIC PALS Zeta potential Analyzer(有机相)程序,选择所要保存数据的文件夹(File-Database-Create Flod 新建文件夹,File-Database-双击所选文件夹-数据可自动保存在此文件夹),待机器稳定15-20min后使用。 4.待测溶液配制完成后需放置一段时间进行Zeta电位测试,将待测液加入比色 皿1/3高度处,赶走气泡,钯电极插入溶液中,拿稳钯电极上端和比色皿下端,不要让两者脱离,连上插头,关上仪器外盖,则开始实验。(AQ-961钯电极用于pH为2-12的水相体系,SR-482钯电极用于有机相和pH为1-13的水相体系,钯电极可在溶液中浸润一会儿)。
ZetaPALS型Zeta电位及粒度分析仪使用操作规程 —美国Brookhaven公司 粒度测定: 1 打开仪器后面的开关及显示器。 2 打开BIC Particle Sizing Software程序,选择所要保存数据的文件夹(File—Datebase—Create Fold新建文 件夹;File—Datebase—双击所选文件夹—数据可自动保存在此文件夹),待机器稳定15~20分钟左右后使用。 3 待测溶液经过离心或过滤处理后,将待测溶液加入比色皿(水相用塑料,有机相用玻璃)中,盖上比色 皿盖,插入样品槽,关上黑色盖子和仪器外盖。 4 点程序界面parameters,对测量的参数进行设置:Sample ID 输入样品名;Runs扫描遍数;Temp.设置温 度(5-70℃);Liquid选择溶剂(Unspecified是未知液,可输入Viscosity 和Ref.Index值,可以查文献,其中Ref.Index可由阿贝折射仪测得);Angle在90°不能改;Run Duration是扫描时间,一般2min,观察程序界面左上角Count Rate如小于20Kcps,则延长测量时间(5min或更长)。 5 Start开始测量。 6 数据分析:程序界面左上角Effective Diameter是直径,Polydispersity是多分散系数(<0.02是单分散体 系,0.02-0.08是窄分布体系,>0.08是宽分布体系),Avg. Count Rate是光强;右上角Lognomal可得到对数图,MSD是多分布宽度,Corr.Funct.是相关曲线图(非常重要,数据可信度参考相关曲线图,测量基线要回归到计算基线上);点击Zoom可选择Intensity、Volume、Surface Area和Number,一般是选择Intensity;点击Lognomal Summary—Copy for Spreadsheet可拷贝数据,点击Copy to Cliboard可将图拷贝到写字板。程序左下角的Copy to Cliboard也可将图拷贝到写字板,Turn Dust Filter Off是数据保有率。 7 关闭仪器和显示屏;靠数据找老师拿专用优盘 注意事项: 1. 一般来说,样品测量范围1nm~6μm,浓度体积比≤0.5%(最好0.1%,保证Count Rate不超过800Kcps), 体积1.5~3mL,测量时间1~2min/Run。 2. 样品放入样品池后需要在仪器中稳定5min左右。 3. 实验后及时清理样品仓,还原所使用附件。比色皿冲洗后可重复利用。 4. 在点击Datebase时不要误点到Rebuild Database File Index,如不小心点到,在弹出的对话框中点击cancel。 5. 不能判断浓度时,可点击Setup—Incident Power Settings—Maximize Incident Power Now,Avg. Count Rate
Zeta电位及其测定方法 Zeta电位(Zeta potential),又叫电动电位或电动电势(ζ电位或ζ电势),是指滑动面(Shear Plane)的电位。它是表征胶体分散系稳定性的重要指标。目前测量Zeta电位的方法主要有电泳法、电渗 1、Zeta电位及Stern模型 1.1胶体双电层理论、胶团结构: 胶体粒子间的静电排斥力减少相互碰撞的频率,使聚结的机会大大降低,从而增加了相对的稳定性。当固体与液体接触时,可以是固体
从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,在界面上形成了双电层的结构。 对于双电层的具体结构,最早于1879年Helmholz(亥姆霍兹)提出平板型模型;1910年Gouy和1913年Chapmar修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。 1.1.1亥姆霍兹平板型模型 亥姆霍兹认为固体的表面电荷与溶液中带相反电荷的(即反离子)构成平行的两层,如同一个平板电容器。整个双电层厚度为汉固体表面与液体内部的总的电位差即等于热力学电势仰,在双电层内,热力学电势呈直线下降。在电场作用下,带电质点和溶液中的反离子分别向相反方向运动。该模型过于简单,由于离子热运动,不可能形成平板电容器也不能解释带电质点的表面电势仰与质点运动时固液两相发生
相对移动时所产生的电势差—Zeta电势(电动电势)的区别,也不能解释电解质对Zeta电势的影响等。 1.1.2扩散双电层模型 Gouy(古依)和Chapman(查普曼)认为,由于正、负离子静电吸引和热运动两种效应的结果,溶液中的反离子只有一部分紧密地排在固体表面附近,相距约一、二个离子厚度称为紧密层;另一部分离子按一定的浓度梯度扩散到本体溶液中,离子的分布可用玻兹曼公式表示,称为扩散层。双电层由紧密层和扩散层构成。移动的切动面为AB面。Gouy一ChaPman理论虽然考虑到了静电吸引力和热运动力的平衡,但是它没有考虑到固体表面上的吸附作用,尤其是特殊的吸附作用。 1.1.3 Stern模型 1924年Stern(斯特恩)对扩散双电层模型作进一步修正。该模型认为溶液一侧的带电层应分为紧密层和扩散层两部分。他认为固体表面因静电引力和范德华引力而吸引一层反离子,紧贴固体表面形成一
Zeta电位及其测定方法 ±10 ±30 ±40 1、Zeta电位及Stern模型 1.1胶体双电层理论、胶团结构: 胶体粒子间的静电排斥力减少相互碰撞的频率,使聚结的机会大大降低,从而增加了相对的稳定性。当固体与液体接触时,可以是固体从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,在界面上形成了双电层的结构。
对于双电层的具体结构,最早于1879年Helmholz(亥姆霍兹)提出平板型模型;1910年Gouy和1913年Chapmar修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。 1.1.1亥姆霍兹平板型模型 亥姆霍兹认为固体的表面电荷与溶液中带相反电荷的(即反离子)构成平行的两层,如同一个平板电容器。整个双电层厚度为汉固体表面与液体内部的总的电位差即等于热力学电势仰,在双电层内,热力 学电势呈直线下降。在电场作用下,带电质点和溶液中的反离子分别向相反方向运动。该模型过于简单,由于离子热运动,不可能形成平板电容器也不能解释带电质点的表面电势仰与质点运动时固液两相发 生相对移动时所产生的电势差—Zeta电势(电动电势)的区别,也不能解释电解质对Zeta电势的影响等。 1.1.2扩散双电层模型 Gouy(古依)和Chapman(查普曼)认为,由于正、负离子静电吸引
和热运动两种效应的结果,溶液中的反离子只有一部分紧密地排在固体表面附近,相距约一、二个离子厚度称为紧密层;另一部分离子按一定的浓度梯度扩散到本体溶液中,离子的分布可用玻兹曼公式表示,称为扩散层。双电层由紧密层和扩散层构成。移动的切动面为AB面。Gouy一ChaPman理论虽然考虑到了静电吸引力和热运动力的平衡,但是它没有考虑到固体表面上的吸附作用,尤其是特殊的吸附作用。 1.1.3 Stern模型 1924年Stern(斯特恩)对扩散双电层模型作进一步修正。该模型认为溶液一侧的带电层应分为紧密层和扩散层两部分。他认为固体表面因静电引力和范德华引力而吸引一层反离子,紧贴固体表面形成一个固定的吸附层,这种吸附称为特性吸附,这一吸附层(固定层)称为Stern层(见上图)。Stern层由被吸附离子的大小决定。吸附反离子的中心构成的平面称为Stern面。滑动面是比Stern面厚的一个曲折曲面,滑动面由Stern层和部分扩散层构成。由Stern面到溶液
实验一电泳法测定分散体系中微粒的荷电性质与Zeta电位 一、实验目的 1.熟悉电泳仪的工作原理与使用方法 2.掌握钛酸钡胶体的荷电性质与ξ电位测定方法 3.掌握钛酸钡胶体等电点的测量方法 二、基本原理 在自然界中,固体与液体接触时,由于表面性质的差异,会使固体表面荷电,而固-液界面的液体带相反电荷,这种界面荷电影响界面周围介质中离子的分布,与固体表面荷电符号相反的介质中的离子被吸向界面,而同符号的离子被排离界面,同时,离子的热运动又促使它们均匀混合在一起,因此,在界面上形成一层扩散双电层。固体在溶液中荷电而构成双电层的原因,除外加电场外,大致有以下几种情况: 1.电离作用固体表面在溶液中产生电离或溶液中的电离成分依靠某种结合力与固体表面结合而使其荷电。例如,玻璃与水接触时,玻璃中的硅酸盐可电离出钾、钠、氢等离子,使玻璃带负电,而溶液带正电;蛋白质分子具有羧基(-COOH)和胺基(-NH2)官能团,但pH值较低时,溶液中电离的H+与胺基以氢键结合,形成(-NH3+)使蛋白质带正电,溶液一侧带负电,当pH 值升高后,蛋白质的羧基电离形成(-COO-)而使蛋白质带负电,在某一pH 值时,酸性基团和碱性基团的电离度相同,蛋白质分子上的静电荷为零,此时的pH值成为等电点(iso-electric point)。
2.离子交换作用由非等电荷离子发生交换而引起荷电。例如,但玻璃与CaCl2水溶液接触时,玻璃中的硅酸盐的钠离子被钙离子等摩尔量交换,使得玻璃带正电,而溶液侧带负电;又如粘土晶格表面的Si4+可被Al3+取代而带负电,或者其中的Ca2+被Al3+取代而带正电。 3.离子吸附作用微粒表面在溶液中能选择吸附某种离子而使表面带电,其荷电性质决定于微粒的组成与溶液中离子性质,如AgI溶胶微粒,当KI过量存在,吸附I-荷负电,当AgNO3过量时,吸附Ag+荷正电。从阴、阳离子水化强弱来分析,通常阳离子比阴离子更容易水化,留在溶液中倾向大,而不容易水化的阴离子则被表面吸附的倾向大,因此表面带负电荷较多。 4.电子取向作用固体金属中的电子云可以一定程度地伸展到与紧贴固体接界的溶液分子层中,从而引起溶液分子的偶极取向,此时离子也能依靠静电力和Van der waals力聚集在固体表面而是固体荷电。 5.摩擦荷电作用非导电固体在高速流动的流体中,由于两相接触摩擦而产生电荷,从一相转入另一相而使固体表面荷电。通常介电常数大的相带正电,介电常数小的相带负电。例如玻璃(ε=5~6)在水中(ε=81)带负电;在苯中(ε=2)则带正电。 固体在溶液中的荷电性质,影响着固体表面性质和界面区的电荷转移反应及其反应速度,因而引起科学家们的重视和研究。有关固-液界面荷电双电层的研究相继出现了Helmholtz平板电容式双电层、Gouy-Chapman扩散双电层、
动态光散射基本原理及其在纳米科技中的应用——Zeta电位测量 前言:Zeta电位是纳米材料的一种重要表征参数。现代仪器可以通过简便的手段快速准确地测得。大致原理为:通过电化学原理将Zeta电位的测量转化成带电粒子淌度的测量,而粒子淌度的测量测是通过动态光散射,运用波的多普勒效应测得。 1.Zeta电位与双电层(图1) 粒子表面存在的净电荷,影响粒子界面周围区域的离子分布,导致接近表面抗衡离子(与粒子电。荷相反的离子)浓度增加。于是,每个粒子周围均存在双电层。围绕粒子的液体层存在两部分:一是内层区,称为Stern层,其中离子与粒子紧紧地结合在一起;另一个是外层分散区,其中离子不那么紧密的与粒子相吸附。在分散层内,有一个抽象边界,在边界内的离子和粒子形成稳定实体。当粒子运动时(如由于重力),在此边界内的离子随着粒子运动,但此边界外的离子不随着粒子运动。这个边界称为流体力学剪切层或滑动面(slippingplane)。在这个边界上存在的电位即称为Zeta电位。 2.Zeta电位与胶体的稳定性(DLVO理论) 在1940年代Derjaguin, Landau, Verway与Overbeek 提出了描述胶体稳定的理论,认为胶体体系的稳定性是当颗粒相互接近时它们之间的双电层互斥力与范德瓦尔互吸力的净结果。此理论提出当颗粒接近时颗粒之间的能量障碍来自于互斥力,当颗粒有足够的能量克服此障碍时,互吸力将使颗粒进一步接近并不可逆的粘在一起。(图2) Zeta电位可用来作为胶体体系稳定性的指示: 如果颗粒带有很多负的或正的电荷,也就是说很高的Zeta电位,它们会相互排斥,从而达到整个体系的稳定性;如果颗粒带有很少负的或正的电荷,也就是说它的Zeta电位很低,它们会相互吸引,从而达到整个体系的不稳定性。 一般来说, Zeta电位愈高,颗粒的分散体系愈稳定,水相中颗粒分散稳定性的分界线一般认为在+30mV或-30mV,如果所有颗粒都带有高于+30mV或低于-30mV的zeta电位,则该分散体系应该比较稳定 3.影响Zeta电位的因素 分散体系的Zeta电位可因下列因素而变化: A. pH 的变化 B. 溶液电导率的变化 C. 某种特殊添加剂的浓度,如表面活性剂,高分子 测量一个颗粒的zeta势能作为上述变量的变化可了解产品的稳定性,反过来也可决定生成絮凝的最佳条件。 3.1 Zeta电位与pH(图3) 影响zeta电位最重要的因素是pH,当谈论zeta电位时,不指明pH根本一点意义都没有。 假定在悬浮液中有一个带负电的颗粒; 假如往这一悬浮液中加入碱性物质,颗粒会得到更多的负电; 假如往这一悬浮液中加入酸性物质,在一定程度时,颗粒的电荷将会被中和; 进一步加入酸,颗粒将会带更多的正电。