
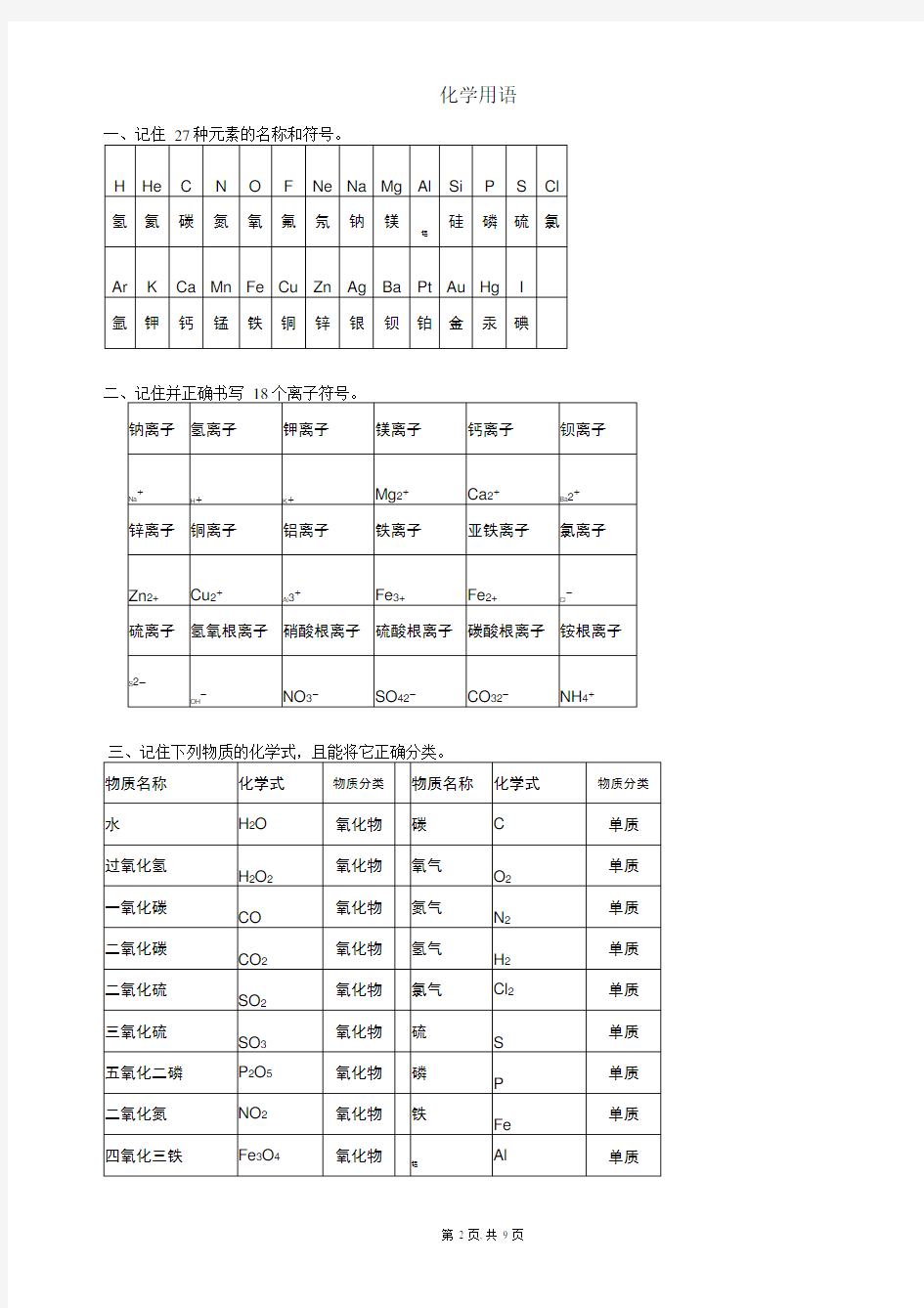
常见的元素符号:氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙。锰钡碘H He Li Be B , C N O F Ne , Na Mg Al Si P , S Cl Ar K Ca 。Mn Ba I 常见元素的化合价:金正,非负,单质零,氢+1,氧-2,正负总价和为零。
钾钠银氢+1价,钙镁钡锌+2 价;氟氯溴碘-1价,通常氧是-2价;铜+1,+2 铝+3;铁有+2,+3 硅+4; 2,
4,6 硫 2,4 碳;
氮磷-3,+5 最常见;2,4,6,7 锰变价;单质中元素零价要记清。化学式:单质:氢气H2 氧气O2 氮气N2 氯气Cl2 氖气Ne 碳 C 铜Cu 铁Fe 化合物:氧化物一氧化碳CO 二氧化碳CO2 五氧化二磷P2O5 二氧化硫SO2 二氧化锰MnO2 三氧化二铁Fe2O3 四氧化三铁Fe3O4 氧化亚铁FeO 氧化镁MgO 氧化钙CaO 三氧化二铝Al2O3 氧化汞HgO 氧化铜CuO 盐酸HCl 硫酸H2SO4 硝酸HNO3 碳酸H2CO3 磷酸H3PO4 氢氧化钠NaOH氢氧化钙Ca(OH)2氢氧化钡Ba(OH)2氢氧化钾KOH氢氧化铁Fe(OH)3氢氧化铜Cu(OH)2 氯化钠NaCl 氯化镁MgCl2 氯化铝AlCl3
氯化钾KCl 氯化铁FeCl3 氯化亚铁FeCl2 氯化锌ZnCl2
氯化钡BaCl2 氯化铜CuCl2 氯化银AgCl (盐酸盐)
碳酸钙CaCO3 碳酸钠Na2CO3 碳酸钾K2CO3 碳酸钡BaCO3
硫酸亚铁FeSO4 硫酸铁Fe2(SO4)3 硫酸钠Na2SO4 硫酸镁MgSO4
硫酸铝Al2(SO4)3 硫酸铜CuSO4 硫酸锌ZnSO4 硫酸钡BaSO4
硝酸银AgNO3 硝酸汞Hg(NO3)2 硝酸锌Zn(NO3)2 硝酸钡Ba(NO3)2 硝酸铝Al(NO3)3 硝酸铁Fe(NO3)3 硝酸铜Cu(NO3)2 硝酸钙Ca(NO3)2
硝酸根氢氧
根
碳酸
根
硫酸
根
磷酸
根
铵根
高锰酸
根锰酸根
符号NO3 OH CO3 SO4 PO4 NH4 MnO4 MnO4
离子符号NO3-
OH -
CO
3
2-
SO4
2-
PO4
3-NH4+MnO4-
MnO
4
2-
化合价-1 -1 -2 -2 -3 +1 -1 -2
表示法NO
3
OH CO3 SO4 PO4 NH4 MnO4 MnO4
-1
常见的离子:钾离子K+,钙离子Ca2+,钠离子Na+,镁离子 Mg2+
铝离子Al3+,锌离子Zn2+,铁离子Fe3+,氢离子H+
铜离子Cu2+,汞离子Hg2+,银离子Ag+,氧离子O2-
氟离子F-,硫离子S2-,氯离子Cl-,亚铁离子Fe2+
1-20 号元素的原子结构示意图:
质子:一个质子带一个单位的正电荷。原子核(带正电)
原子中子:不带电。核外电子:一个电子带一个单位的负电荷。原子中:核电荷数=质子数=核外电子数相对原子质量= 质子数+ 中子数
6、相对原子质量= 某一原子的实际质量
一种碳原子质量的1/12
无单位)
化学用语
记住下列反应的化学方程式。 木炭在空气中充分燃烧 点燃
C+O 2 点 燃 CO 2 硫在空气中燃烧 S+O 2 点 燃 SO 2
红磷在空气中燃烧 点燃
4P+5O 2
点 燃
2P 2O 5
铁在氧气中燃烧 3Fe +2O 2 点 燃 Fe 3O 4
镁带在空气中燃烧 点燃
2 Mg +O 2 点 燃
2MgO
铝在空气中被氧化
4Al +3O 2 =2Al 2O 3 铜在空气中加热(现象:红色固体变黑) 2Cu+O 2
2CuO
氢气在空气里燃烧
2H 2 +O 2 点 燃 2H 2O
碳在空气中不充分燃烧 2C+O 2 点 燃 2CO 一氧化碳燃烧 点燃
2CO+O 2
2CO 2
甲烷燃烧 CH 4 +2O 2 点 燃 CO 2 +2H 2O 乙醇燃烧
C 2H 5OH +3O 2 点 燃
2CO 2 +3H 2O 实验室用过氧化氢和二氧化锰的混合
物制氧气 2 H 2O 2 M n O 2 2H 2O +O 2 ↑ 实验室用加热氯酸钾和二氧化锰的混合物制氧气 2 KClO 3 M n O 2 2 KCl +3O 2 ↑
△
实验室用加热高锰酸钾的方法制氧气 2KMnO 4 K 2MnO 4 +MnO 2+O 2
↑
实验室用大理石(或石灰石)与稀盐酸反应制二氧化碳气体 CaCO 3 +2HCl =CaCl 2 +H 2O +CO 2 ↑ 实验室用锌粒与稀硫酸反应来制氢气 Zn +H 2SO 4 =ZnSO 4 +H 2 ↑
水通电分解
2H 2O 通 电 2H 2↑+O 2 ↑ 氢气还原氧化铜 H 2+CuO Cu +H 2O
四、
1. 2.
3. 4. 5. 6. 7.
8.
9.
10. 11.
12.
13.
14.
15.
16. 17.
18.
19.
碳还原氧化铜
C+2CuO 高 温 2 Cu +CO 2 ↑ 碳还原氧化铁
高温
3C+2Fe 2O 3 高 温 4Fe +3CO 2 ↑ 碳还原二氧化碳
C+CO 2 高 温 2CO 一氧化碳还原氧化铁(炼铁原理) 3CO +Fe 2O 3 高 温 2 Fe +3CO 2 一氧化碳还原氧化铜
CO +CuO Cu +CO 2
二氧化碳通入澄清的石灰水
CO 2 +Ca(OH)2 =CaCO 3 ↓+H 2O 二氧化碳与水反应CO 2 +H 2O =H 2CO 3 碳酸分解
H 2CO 3 =H 2O +CO 2 ↑ 碳酸钙高温分解
CaCO 3 高 温
CaO +CO 2 ↑
铁丝伸入硫酸铜溶液中 Fe +CuSO 4 = FeSO 4 +Cu 金属与盐酸(或稀硫酸)反应 Mg +2HCl =MgCl 2 +H 2 ↑ Zn +2HCl =ZnCl 2 +H 2 ↑ Fe +2HCl =FeCl 2 +H 2 ↑ 金属氧化物与盐酸(或稀硫酸) Fe 2O 3+6HCl=2FeCl 3+3H 2O CuO+2HCl=CuCl 2+H 2O 碱与酸发生中和反应 NaOH+HCl=NaCl+H 2O
Ca(OH)2+2HCl=CaCl 2+2H 2O 碳酸钠中加入稀盐酸
Na 2CO 3 +2HCl =2NaCl +H 2O + 非金
属氧化物与碱反应
Mg+H 2SO 4=MgSO 4 +H 2 ↑ Zn+H 2SO 4=ZnSO 4 +H 2 ↑ Fe +H 2SO 4 =FeSO 4 +H 2 ↑ 反应 Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O CuO+H 2SO 4=CuSO 4+H 2O
2NaOH+H 2SO 4=Na 2SO 4+2H 2O
CO 2 ↑ (CO 32―
的检验)
CO 2+2NaOH=Na 2CO 3+H 2O SO 2+2NaOH=Na 2SO 3+H 2O 盐与碱反应
Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOH
2NaOH +CuSO 4 =Cu(OH)2 ↓+Na 2SO 4 (氢氧化铜是蓝色沉淀) 3NaOH+FeCl 3=Fe(OH)3 ↓+3NaCl (氢氧化铁是红褐色沉淀) 盐与盐反应
20.
21. 22. 23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
AgNO 3+NaCl=AgCl↓+NaNO 3 (Cl ―
的检验)
Ba(NO 3)2+Na 2SO 4=BaSO 4↓+2NaNO 3 (SO 42―
的检验)
Ba(NO 3)2+Na 2CO 3=BaCO 3 ↓+2NaNO 3 (BaCO 3 溶于稀硝酸)
九年级应掌握的化学方程式、化学式、元素符号
一、化合反应:(14 个)
红磷或白磷燃烧/发令枪产生白烟:4P+5O 2 2P 2O 5 [重点]
5.
氢气作燃料:2H 2+O 2 2H 2O [重点]
6. 铁在氧气中燃烧:3Fe+2O 2 Fe 3O 4 7. 镁燃烧:2Mg+O 2 2MgO 8. 铝在氧气中燃烧:4Al+3O 2 2Al 2O 3 9. 铜在空气中受热:2Cu+O 2 2CuO 10. 一氧化碳(煤气主要成分)燃烧:2CO+O 2 2CO 2 [重点] 11.
二氧化碳通过炽热的碳:C+CO 2 2CO [了解] 12.
二氧化碳与水反应/碳酸饮料中反应(二氧化碳通入紫色石蕊试液):CO 2+H 2O=H 2CO 3 13. 氧化钙与水反应/用生石灰做干燥剂/用生石灰制取熟石灰或石灰水 CaO+H 2O=Ca(OH)2 [重点] 14.
酸雨的形成/二氧化硫与水反应生成亚硫酸:SO 2+H 2O=H 2SO 3[了解] 二、分解反应:(7个) 2.用高锰酸钾为原料制取氧气: 2KMnO 4 K 2MnO 4+MnO 2+O 2 ↑ 3.用氯酸钾与二氧化锰共热: 2KClO 3 2KCl+3O 2↑ [ 重点]
4.电解水: 2H 2O
2H 2↑ +O 2↑ [重点]
5.氧化汞受热分解: 2HgO
2Hg+O 2↑ [了解]
6.碳酸不稳定分解: H 2CO 3=CO 2↑ +H 2O [重点]
7.煅烧石灰石/工业上用石灰石制取生石灰: CaCO 3 CaO+CO 2 ↑ [重点]
1.
[重点] 实验室用过氧化氢和二氧化锰为原料制取氧气:2H 2O 2
2H 2O+O 2 ↑ [重点] 1.
碳燃烧:C+O 2 CO 2
2.
碳不充分燃烧:2C+O 2 2CO
3.
硫燃烧:S+O 2 SO 2
4.
三、置换反应:(4 类,13个)1.氢气还原氧化铜(氢气的还原性):H2+CuO Cu+H2O [了解]
2.木炭(碳)还原氧化铜(还原性):C+2CuO 2Cu+CO2↑[了解]
3.金属(主要Mg Al Zn Fe)与酸(稀盐酸或稀硫酸)反应
(活动性顺序中H前面的金属)Fe+2HCl=FeCl2+H2↑ 亚铁[重点]Fe+H2SO4=FeSO4+H2↑亚铁[重点]
2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑
Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑[重点]
Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑
4.金属与盐溶液反应(前面的金属置换后面金属)铁与硫酸铜反应/湿法炼铜/用铁检验或除去工业废水中铜离子Fe+CuSO4=Cu+FeSO4 [重点]
铜与硝酸银溶液反应:Cu+2AgNO3=2Ag+Cu(NO3)2
铝与硫酸铜反应:2Al+3CuSO4= 3Cu + Al2(SO4)3
四、复分解反应:(5类,20个)
1.酸与金属(碱性)氧化物反应:碱性氧化物 +酸 ------------ 盐 + 水
用稀盐酸或稀硫酸除铁锈
Fe2O3+6HCl=2FeCl3+3H2O [重点] Fe2O3+3H2SO4=Fe2(SO4)3+3H2O[重点]氧化铜与稀硫酸反应CuO+H2SO4=CuSO4+H2O [了解]2.酸与碱发生中和反应(生产生活中应用):酸 + 碱盐 + 水
氢氧化钠与盐酸肥应:NaOH+HCl=NaCl+H2O [重点]氢氧化钙与硫酸反应:Ca(OH)2+H2SO4=CaSO4+ 2H2O [重点]用氢氧化镁除胃酸Mg(OH)2+2HCl=MgCl2+2H2O[重点]3.酸与某些盐反应:(产生气体或沉淀)酸 + 盐另一种酸 + 另一种盐
碳酸钠(纯碱、苏打)与盐酸反应/检验碳酸根离子/检验氢氧化钠是否变质
Na2CO3+2HCl=2NaCl+H2O+CO2↑[重点]碳酸氢钠(小苏打)与盐酸反应(小苏打除胃酸)NaHCO3+HCl=NaCl+H2O+CO2↑[重点]
实验室制取二氧化碳/用大理石或石灰石与稀盐酸反应制取二氧化碳/用盐酸除水垢/用墨鱼骨粉除胃酸过多/用盐酸检验大理石、石灰石或贝壳中含有碳酸钙CaCO3+2HCl=CaCl2+H2O+CO2↑[重点]
硝酸银溶液与盐酸:HCl+AgNO3=AgCl↓+HNO3 [了解]
硫酸和氯化钡溶液反应:H2SO4+BaCl2=BaSO4↓+2HCl[了解]
4.碱溶液与某些盐溶液反应:(生成沉淀)碱 + 盐--------- 另一种碱 + 另一种盐
碳酸钠与石灰水反应/有石灰水检验碳酸钠/用熟石灰与碳酸钠为原料制取氢氧化钠氢氧化钙与碳酸钠:Ca(OH)=CaCO3↓+ 2NaOH[重点]
2+Na2CO3
氢氧化钠与硫酸铜:2NaOH + CuSO4=Cu(OH)2↓ + Na2SO4 [重点]
氢氧化钠与氯化铁:3NaOH + FeCl3=Fe(OH)3↓ + 3NaCl[了解]
氢氧化钠与氯化镁:2NaOH + MgCl2=Mg(OH)2↓ + 2NaCl[了解]
氢氧化钙与氯化铵:Ca(OH)2+2NH4Cl = CaCl2+2H2O+ 2NH3↑ 5.盐溶液与某些盐溶液反应:(生成沉淀)盐 + 盐两种新盐氯化钠溶液和硝酸银溶液:NaCl+AgNO3=AgCl↓+ NaNO3 硫酸钠溶液和氯化钡溶液:Na2SO4+BaCl2=BaSO4↓+2NaCl 碳酸钠溶液与硝酸钡溶液:Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3 碳酸钾溶液与氯化钙溶液:K2CO3+CaCl2=CaCO3↓+2KCl
五、其它反应:(3类,9个) 1.有机物燃烧:
天然气、沼气(主要成分甲烷CH4)用作燃料CH4+2O2 2H2O+CO2 [重点]
酒精(乙醇)燃烧C2H5OH+3O2 3H2O+2CO2 [了解]
2.碱溶液与非金属(酸性)氧化物反应:酸性氧化物+碱 --------- 盐+水
二氧化碳通入澄清石灰水中/二氧化碳与石灰水反应/用石灰水检验二氧化碳/石灰水在空气中变质/用石灰浆粉刷墙壁CO2 +Ca (OH)2 = CaCO3↓+ H2O [重点]
二氧化碳与氢氧化钠反应/氢氧化钠在空气中变质CO2+2NaOH=Na2CO3+ H2O [重点]
氢氧化钠溶液吸收污染气体SO2:SO2+2NaOH=Na2SO3+H2O [了解]
氢氧化钠溶液吸收气体SO3:SO3+2NaOH=Na2SO4+H2O [了解] 3.一氧化碳还原金属氧化物:一氧化碳还原氧化铜(一氧化碳具有还原性)CO+CuO Cu + CO2 [重点]
一氧化碳还原氧化铁(炼铁)Fe2O3+3CO 2Fe+3CO2 [重点]