福建中考化学知识点归纳一、基本概念与基本理论
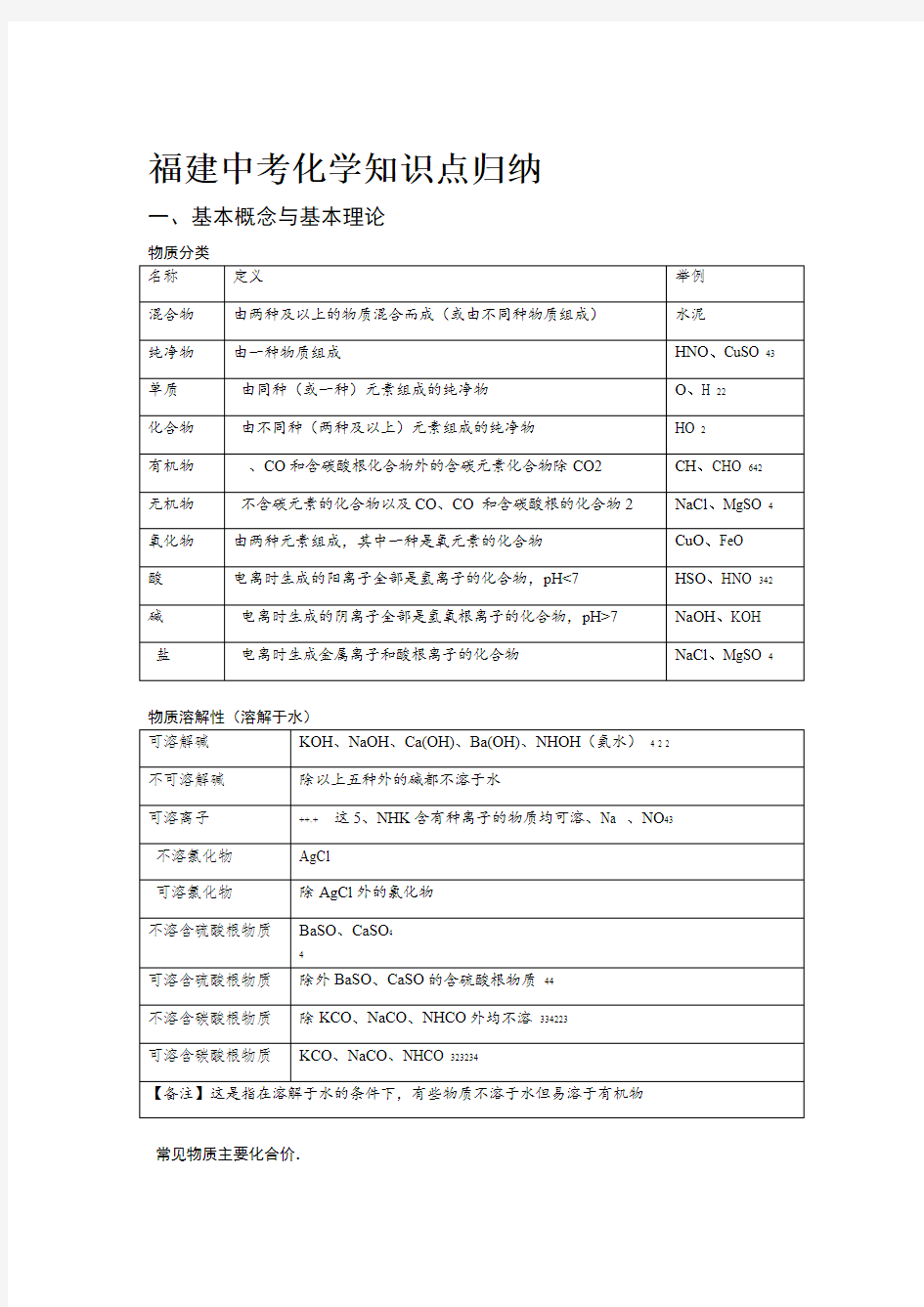
物质分类
物质溶解性(溶解于水)
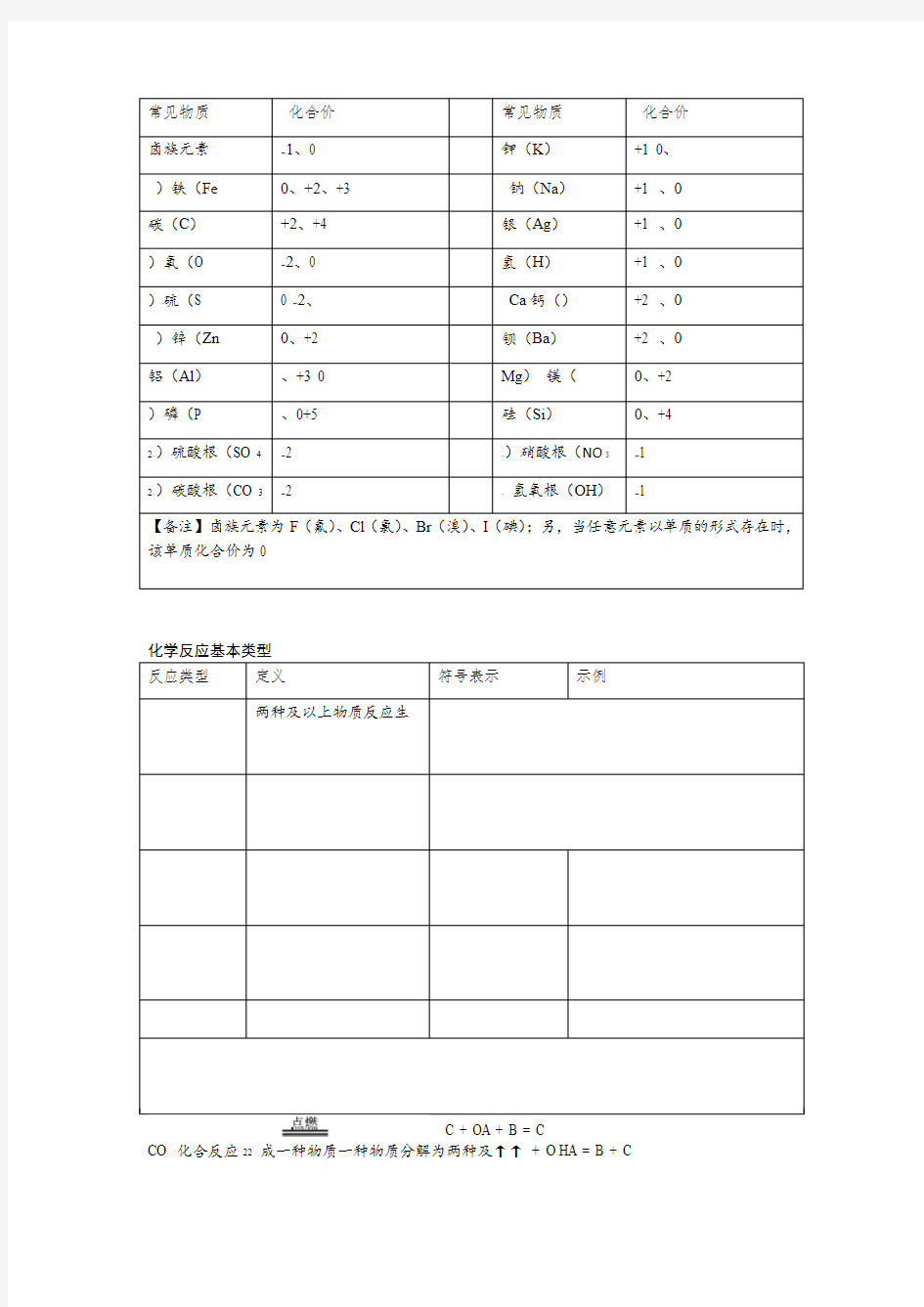
常见物质主要化合价.
化学反应基本类型
C + OA + B = C
CO 化合反应22成一种物质一种物质分解为两种及↑↑+ O HA = B + C
OH分解反应222以上物质单质和化合物反应生成
↑+ HAB + C = CB + A
2HCl + Zn = ZnCl 置换反应22 新的单质和新的化合物两种化合物交换成分生CuCl↓+ CaCl= CaSO+CuSOAB+CD=AC+BD
复分解反应244 2成两种新的化合物O
HCl + NaOH = NaCl + H 酸和碱反应生成盐和水中和反应水+盐=碱酸+2【备注】中和反应属于复分解反应;另,存在氧化反应,指物质和氧反应生成氧化物,如,铁暴露在空气中与氧气接触缓慢反应生成氧化铁等
常见沉淀颜色.
常见物质颜色
二、常见物质及其性质、用途、常见现象分析
(1)水(蒸馏水)
化学式:HO2性质:纯净物、化合物、氧化物.
密度:1.0 g/mL
水污染原因:
工业“三废”(废渣、废水、废气)和生活污水未经处理随意排放;农业生产化肥和农药随雨水注入河流。
备注:海水、矿泉水、河水、糖水、盐水属于混合物。
(2)空气
化学式:空气是混合物,主要成分为N、O、CO、稀有气体222—0.03%,稀有气体—0.94%CO78%气体体积分数:氮气—,氧气—21%, 2
空气污染原因:二氧化硫(SO)、二氧化氮(NO)、一氧化碳(CO)过度排放造成酸雨。22密度:1.293 g/L
(3)氧气
化学式:O 2物理性质:不易溶于水,密度比空气的略大;液氧、固态氧淡蓝色
化学性质:支持燃烧,有助燃性。可供呼吸用,是常用的氧化剂
用途:气焊、航天、潜水、登山、医疗、液氧、炸药、炼铁、炼钢等
与各物质反应:
①木炭(C)在氧气中燃烧(O可使带火星的木条复燃)2
CO化学方程式:C+O22反应现象:发出白光,放出热量,生成使澄清石灰水变浑浊的气体
)在氧气(空气)中燃烧S②硫
(
SO化学方程式:S+O22反应现象:硫在空气里燃烧发出微弱的淡蓝色火焰,产生有刺激性气味的气体,放出热量;在氧气里燃烧发出蓝紫色火焰,产生有刺激性气味的气体;放出热量
)在氧气(空气)中燃烧③磷(P
化学方程式:4P+5O2PO522反应现象:发出白光,产生大量的白烟,放出热量)在空气(氧气)
中燃烧Mg④镁
(.
2MgO
2Mg+O化学方程式:2反应现象:发出耀眼的白光,放出热量,生成白色固体
四氧化三铁Fe)在氧气中燃烧⑤铁丝
(
FeO化学方程式:3Fe+2O432反应现象:剧烈燃烧,火星四射,生成黑色固体,放出热量)在空气中燃烧(点燃爆鸣气)⑥氢气(H2
O
化学方程式:2H+O2H222反应现象:纯净氢气在空气里安静燃烧,淡蓝色火焰,放出热量(不纯氢气点燃会爆炸)
(4)氢气H化学式:2
物理性质:密度最小的气体,难溶于水化学性质:可燃性、还原性用途:充气球,冶炼金属,高能燃料,化工原料生成氢气的反应:↑+ HZn + H锌粒和稀硫酸反应SO = ZnSO 2442↑+ HFe + H铁和稀硫酸反应= FeSOSO 2424
↑镁和稀硫酸反应+ HMg + HSO = Mg SO 2424↑锌粒和盐酸反应Zn + 2HCl = ZnCl+ H
22↑Fe+2HCl = FeCl铁和盐酸反应+H22↑+HMg+2HCl = MgCl 镁和盐酸反应22↑+
2Al+6HCl = 2AlCl铝和盐酸反应3H 23
(5)铁Fe
化学式:物理性质:有银白色金属光泽的固体,有良好的延性和展性,质软,是导体化学性质:可跟氧气反应;可跟酸和排在铁后的金属的盐溶液发生置换反应(反应后溶液呈浅绿色);镀锌等金属或烤蓝防止铁生锈方法:在铁表面涂一层保护膜(如涂漆或油).
生铁和钢:都是铁的合金,区别是含碳量不同,生铁的含碳量高,钢含碳量低
(6)碳
化学式:C
化学性质:
CO)(燃烧不充分或氧气不足时生成CO而非木炭在氧气中燃烧C+0CO①可燃性:2 22
↑C+2CuO 2Cu+CO ②还原性:木炭高温下还原氧化铜2注意:金刚石和石墨是由碳元素组成的两种不同的单质,它们物理性质不同、化学性质相同。它们的物理性质差别大的原因是碳原子的排列不同
(7)二氧化碳化学式:CO2“干冰”物理性质:可溶于水,密度比空气的大,加压降温易变为固体化学性质:O = HCO + H CO①跟水反应:二氧化碳通入水中生成碳酸3222二氧化碳通入紫色石蕊试液,石蕊试液变红色;加热又变为紫色
+ H↓O )CO + Ca(OH) = CaCO②跟碱反应生成盐和水:(用澄清的石灰水鉴定CO22232O + H 跟氢氧化钠反应:CO + 2NaOH = NaCO2223不支持燃烧,也不能燃烧。③通常情况下,CO2用途:灭火,温室里作肥料,干冰用于致冷和人工降雨,化工原料
)碳酸钙(8 CaCO化学式:3物理性质:白色固体,难溶于水化学性质:①跟盐酸、硝酸反应(碳酸钙不溶于水,可溶于酸)↑O + CO + HCaCO + 2HCl = CaCl2232
↑O + CO + 2HNO + HCaCO = Ca(NO)233232
↑CaO + COCaCO②高温分解:23存在方式:碳酸钙主要以石灰石和大理石存在.
用途:大理石和石灰石做建筑材料
(9)有机物
化学式:有机物是统称,主要有CH(甲烷)、CHOH(甲醇)、CHOH(乙醇)等5324物理性质:
①甲烷难溶于水,密度比空气小,是沼气和天然气主要成分;
②甲醇是工业酒精;
③乙醇是无色液体,易挥发,溶于水,医用酒精有效成分。
化学性质:①甲烷有可燃性,点燃后火焰呈蓝色;
②甲醇有毒,不可饮用,饮用后使人双目失明,大量饮用致死。
③乙醇可燃,充分燃烧生成CO和HO。22相关化学式:
CH + 2O = CO + 2HO 2422↑+ 3HO
OH + O HC = 2CO22252
)氧化物(10
①有四种碱性氧化物跟水反应生成碱,其他的碱性氧化物不溶于水跟水不反应O = 2NaOH O + HNa22 CaO + HO = Ca(OH)22
O = 2KOH KO + H22O = Ba(OH)BaO + H2
2
②酸性氧化物:大部分非金属氧化物都是酸性氧化物,跟水化合生成同价的含氧酸。COCOO =
H + H3222 SOO = H + HSO3222
SO+ HSOO = H4223
(11)氢氧化钠
化学式:NaOH
俗称:烧碱、火碱、苛性钠
物理性质:白色固体,极易溶于水且放出大量热,有吸水性,易潮解
化学性质:(KOH的化学性质跟NaOH相同)
①与酸性气体反应(CO2、SO2)
CO+2NaOH=NaCO+HO
2232SO+2NaOH=NaSO+HO SO+2NaOH=NaSO+HO 22222234②与酸中和反应
NaOH + HCl = NaCl + H2O
NaOH + HNO3 = NaNO3 + H2O
③氢氧化钠跟盐反应
a.氢氧化钠溶液跟氯化铁、硫酸铁、硝酸铁溶液的现象和方程式:
↓+2Fe(OH)SO)有红褐色沉淀生成:6NaOH+Fe(SO=3Na342423b. 氢氧化钠溶液跟氯化铜、硫酸铜、硝酸铜溶液的现象和方程式:
↓+Cu(OH)=Na有蓝色沉淀生成:2NaOH+CuSOSO2442c. 氢氧化钠溶液跟氯化镁、硫酸镁、硫
酸铝溶液反应
↓+Mg(OH)=NaSO有白色沉淀生成:2NaOH+MgSO2442保存方法:因为易潮解、可吸水且可与空气中的CO反应,因此必须密封2用途:作中性或碱性气体的干燥剂;用于肥皂、石油、造纸等工业
(12)氢氧化钙
化学式:Ca(OH) 2俗称:消石灰、熟石灰
物理性质:白色固体,微溶于水,溶解度随温度升高而降低,可用CaO与H 反应制取O2.
用途:与CuSO4配制农药“波尔多”液;降低土壤酸性;建筑业配制三合土
三、物质的溶解度及其相关计算
概念:溶解度(S)是指在20℃时,某种物质在100g溶剂中达到饱和状态时溶解的质量。
溶解性表
概念溶解度范围(20℃,100g水,单位g)
≥10 易溶1-10 可溶
【注意】1()大多数物质溶解度随温度升高而增大(蔗糖、NaNO;等)3 NaCl等);2()少数物质的溶解度受温度影响不大(例如;)极少数物质溶解度随温度升高而减小(例如(3Ca(OH)、气体等)2(4)★气体溶解度在温度降低或气压增大时增大。
计算公式:
四、溶质的质量分数及其相关计算
概念:溶质的质量分数是指溶质的质量与溶液的质量之比。
计算公式:
溶液质量=溶剂质量+溶质质量
溶质质量=溶质的质量分数×溶液质量
溶质的质量分数/溶质质量=溶液质量
五、酸、碱、盐基本知识和反应
(一)基本概念
名称概念例子
HCl、HNO、酸H由氢离子和酸根离子构成的化合物SO 432NaOH、由氢氧根离子和金属离子构成的化合物KOH碱、Ca(OH) 2NaCl由金属离子和酸根离子构成的化合物盐、CaCO、FeSO 43