
一、目的:
指导实验人员准确完成酵母样真菌药敏试验(微量稀释法)。
二、适用范围:
怀疑酵母样真菌感染患者
三、检验原理:
ATB FUNGUS 3试条包括16对杯状凹cupules。第一对不含任何抗真菌剂。用作阳性生长对照。另外的15对包含不同稀释度的5种抗真菌剂。用于测定最小抑菌浓度(MIC)和(或)区分临床敏感性。
将准备好的待测酵母样真菌的悬浮液转移到培养基中,并接种到试条上。孵育后,我们可以通过肉眼判读,或者应用A TB仪器或miniAPI判读杯状凹中液体的生长情况。获得MIC(两性霉素B[AMB]),氟康唑[FCA],伊曲康唑[ITR],伏立康唑[VRC],5-氟胞嘧啶[5FC]),将菌株分为敏感、中介或耐药。
四、职责:生物梅里埃
实验人员准确完成酵母样真菌药敏试验(微量稀释法)
试剂厂家:
规格:25测试/盒
内含物:-25个独立包装的A TB FUNGUS 3 试条,包括干燥剂
-25个孵育盖
-25安瓿A TB F2培养基
-25张结果记录单
-一份说明书
五、储存条件及有效期:
在包装盒上指示的有效期前,试条和培养基应在2-8℃下存放。
有效期为12个月。
六、工作程序:
(一)试验的准备:
1、从包装中取出试条
2、在试条延长翼上记录下被测酵母菌株的编号
(二)接种物的准备:
1、打开一个API?0.85%氯化钠培养基安瓿(或API培养悬液)
2、采集不超过4天的菌落,制备成浊度相当于2 McFarland的悬浮液
3、用McFarland试剂盒的标准浊度管比较,或使用ATB比浊仪DENSIMAT
4、此菌悬液必须在准备后立即使用
5、使用一移液管转移20ul此悬浮液到一A TB F2培养基的安瓿中
(三)试验条的接种:
手工接种:
1、用ATB电子移液管混匀A TB F2培养基,避免产生气泡
2、使用ATB电子移液管在每个杯状凹中加入135ul的ATB F2 培养基(大约3*104酵母菌/毫升或4*103酵母菌/杯状凹)
自动接种:参考A TB接种器使用者手册
3、盖好试条盖子
4、把试条放入一个密封容器或是一个装有吸潮纸的GENbox型广口容器里
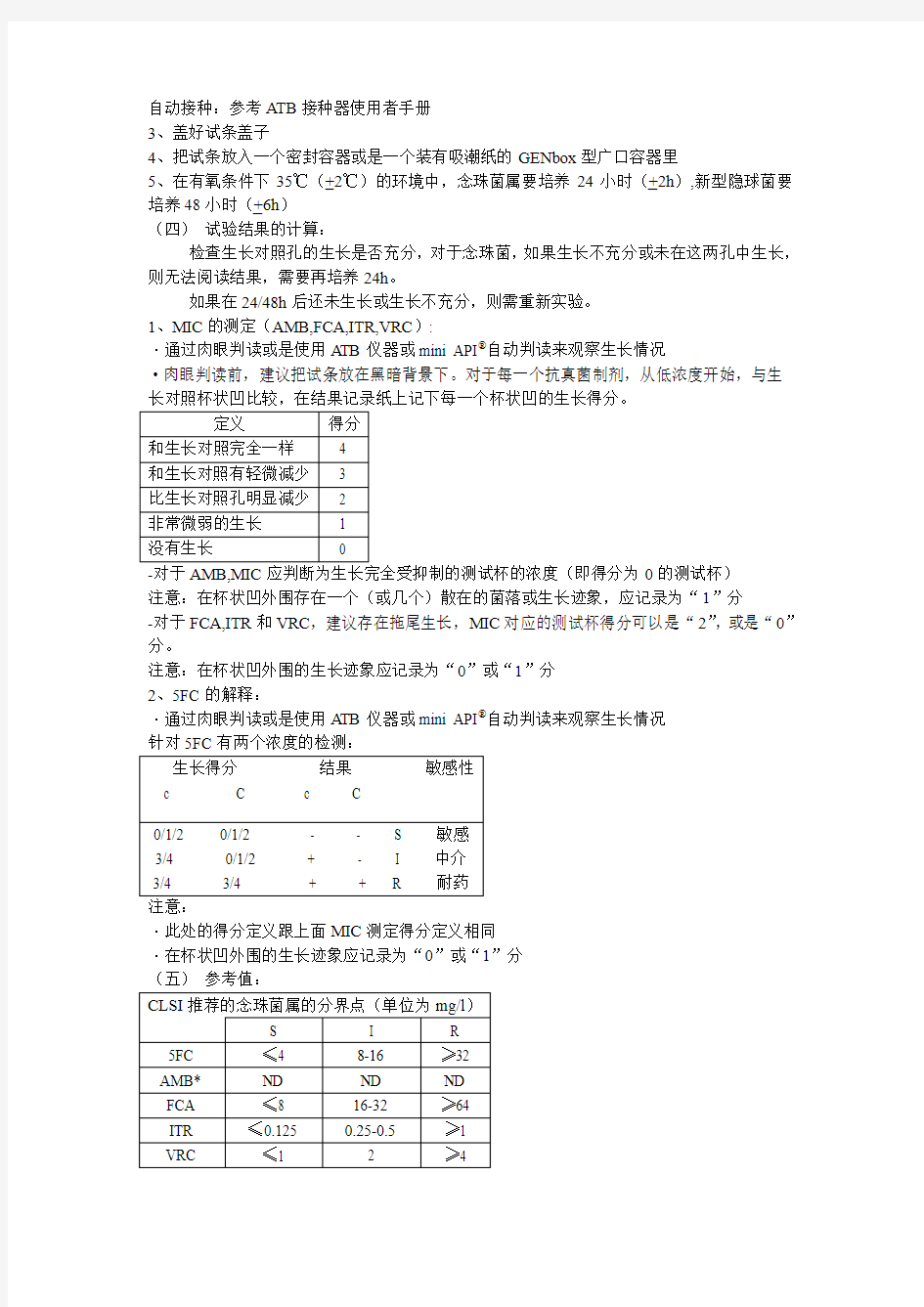
5、在有氧条件下35℃(+2℃)的环境中,念珠菌属要培养24小时(+2h),新型隐球菌要培养48小时(+6h)
(四)试验结果的计算:
检查生长对照孔的生长是否充分,对于念珠菌,如果生长不充分或未在这两孔中生长,则无法阅读结果,需要再培养24h。
如果在24/48h后还未生长或生长不充分,则需重新实验。
1、MIC的测定(AMB,FCA,ITR,VRC):
·通过肉眼判读或是使用ATB仪器或mini API?自动判读来观察生长情况
·肉眼判读前,建议把试条放在黑暗背景下。对于每一个抗真菌制剂,从低浓度开始,与生
0的测试杯)
注意:在杯状凹外围存在一个(或几个)散在的菌落或生长迹象,应记录为“1”分
-对于FCA,ITR和VRC,建议存在拖尾生长,MIC对应的测试杯得分可以是“2”,或是“0”分。
注意:在杯状凹外围的生长迹象应记录为“0”或“1”分
2、5FC的解释:
·通过肉眼判读或是使用ATB仪器或mini API?自动判读来观察生长情况
注意:
·此处的得分定义跟上面MIC测定得分定义相同
·在杯状凹外围的生长迹象应记录为“0”或“1”分
ND:CLSI没有定义
注意:
-由于克柔念珠菌对FCA天然耐药,试验结果应被系统的解释为R
*:对于AMB,MIC≥2mg/l,建议判断为低耐药
*:对于AMB,MIC≥2mg/l,建议判断为耐药(新型隐球菌通常的MIC为0.5和1mg/l)(六)检验结果的解释:
·在自动读取数据前,建议擦拭试条的中间部分,去除可能存在的小滴液体,以便仪器辨认试条代码
·一个或两个生长对照杯状凹中的生长缺失时,测试无效,必须重复进行
·在培养后,带有脱水的杯状凹的试条可能给予错误结果,必须重复测试
·对于AMB,在自动判读时,建议肉眼检查在杯状凹外围是否有个别菌落或生长
(得分为“1”)
·对于FCA、ITR和VRC,用于A TB FUNGUS 3所获得的“I”分类相当于CLSI定义的SDD(剂量依赖型敏感)
特殊细菌药敏试验的规范化操作 一、目前我国细菌药敏试验现状 20年以来,我国在卫生部和各地临床检验中心和检验学会的共同努力下引进CLSI药敏系列标准,使全国微生物实验室能在同一标准下进行质量控制活动。当前,微生物实验室对常见临床分离细菌的药物敏感试验的水平已有了显著的提高,但对特殊细菌的药敏试验的各个环节的规范操作还不能得到普及,对目前还无折点的细菌能否做药敏试验,以及如何判断细菌的药物敏感和耐药,仍然概念模糊,有待进一步规范和普及。 目前常见错误做法: (一)铜绿假单孢菌的药敏判断标准用于其他非发酵细菌;嗜血杆菌的标准用于卡他莫拉菌等的错误做法时有发生。 (二)借用同属细菌敏感标准 (三)借用同类抗生素的敏感标准 二、各菌属的药物敏感性报告及试验方法的CLSI药敏标准 (一)“嗜麦芽”菌属药敏报告标准 1.CLSI对“嗜麦芽”纸片药敏判断标准 药物名称纸片含量ug/片耐药 R 中介I 敏感S 米诺环素30 ≤1415-18 ≥19 左氧氟沙星 5 ≤1314-16 ≥17 复方新诺明 1.25/23.75 ≤1011-15 ≥16 2.CLSI对“嗜麦芽”稀释法判断标准 药物名称S I R 替卡西林/棒酸≤16/232/2-64/2 128/2 头孢他定≤816 ≥32 米诺环素≤48 ≥16 左氟沙星 2 4 ≥8 复方新诺明≤2/38- 4/76 氯霉素≤816 ≥32(二)无折点细菌的药物敏感试验报告 1. 其他药物的敏感性报告: CLSI推荐的药物可以报告MIC值和敏感度(S、I、R),临床需要的其他药物的药敏试验报告可以直接报告MIC值但不报告S、I、R。 2. 不要用认为相近细菌的折点代替报告S、I、R,这会误导医生用药。
抗菌素敏感试验 一、实验目的 1、掌握药敏试验(K-B纸片琼脂扩散法)方法、原理及结果判读 2、掌握抗酸染色方法及结果判定 二、实验原理 1、抗菌药物分类: (1)β-内酰胺类:青霉素类和头孢菌素类(硫酶素类、单内酰环类、β-内酰酶抑制剂、甲氧青霉素类) (2)氨基糖甙类:链霉素、庆大霉素、卡那霉素、妥布霉素、丁胺卡那霉素、新霉素、核糖霉素、小诺霉素、阿奇霉素 (3)大环内脂类:红霉素、白霉素、乙酰螺旋霉素、麦迪霉素、交沙霉素 (4)四环素类:四环素、土霉素、金霉素、强力霉素 (5)氯霉素类:氯霉素、甲砜霉素 (6)作用于G+细菌的其它抗生素:林可霉素、氯林可霉素、万古霉素、杆菌肽 (7)作用于G-菌的其它抗生素:多粘菌素、磷霉素、、环丝氨酸、利福平、抗真菌抗生素、灰黄霉素 (8)抗肿瘤抗生素:丝裂霉素、放线菌素D、博莱霉素、阿霉素 (9)具有免疫抑制作用的抗生素:环孢霉素 2、抗菌药物敏感试验(antimicrobial susceptibility testing in vitro ) 1)抑菌试验:体外测定抗菌药物抑制细菌生长能力的试验 (1)纸片扩散法(disc diffusion test) K-B纸片琼脂扩散法原理:将含有定量抗菌药物的纸片贴在已接种测试菌的琼脂平板上。纸片中所含的药物吸取琼脂中的水分溶解后不断地向纸片周围区域扩散形成递减的梯度浓度。在纸片周围抑菌浓度范围内测试菌的生长被抑制,从而形成透明的抑菌圈。抑菌圈的大小反映测试菌对测定药物的敏感程度,并与该药对测试菌的最低抑菌浓度(MIC)呈负相关。(2)稀释法(dilusion test) a.将被检菌株接种于一组含有不同稀释度抗菌药物的培养基内 b.37℃18-24小时后,抗菌药物能抑制被检菌肉眼可见生长的最低浓度(MIC)即该菌 对该抗菌药物的敏感度 c.MIC50 MIC90 d.根据MIC和常用剂量时该药所能达到的血药浓度来划定细菌对各种药物的敏感度或 耐药的界限(break point,折点) (3)E试验法(E test) 2)杀菌实验 3)联合药敏试验 4)检测细菌所产生的抗生素灭活酶试验 3、药物敏感性分级 1)敏感(S)
细菌分离培养方法及操作步骤无菌取血液或脏器、淋巴结划线接种于鲜血琼脂平板或血清琼脂平面培养基、普通肉汤培养基,37℃恒温培养24 h,观察其生长特性。目前细菌分离培养的常用方法有平板划线分离法、加热分离法与实验动物分离法。 平板划线接种法 这就是目前临床上最常用的分离接种方法。它可以从被检病料中通过划线可使细菌分离、分散生长而形成单个菌落(有利于从含有多种细菌的标本中分离出目的菌),以便挑选可疑菌落作纯培养加以鉴定。具体操作: 1、右手持接种环,在酒精灯上火焰灭菌; 图1 病料采集图2 接种环灭菌 2、待接种环冷却后,挑取被检料少许,左手持琼脂平板,以食指为
支点,用拇指与无名指将平皿揭开一空隙。大约20℃时,迅速地将接种环轻轻地涂布在培养基的边缘。 3、在涂布处来回移动作曲线形划线接种。(注意:划线时,以腕力使接种环在琼脂平板表面划动,尽量不要划破培养基,划的线条要密,但不能重复旧线,以免培养物形成菌 苔。) 图3 平板划线接种法 4、划线完毕,合上平皿盖,将琼脂平板倒置,放入37℃温箱内培养
18-24小时。 注意:分离培养用的平板培养基应表面干燥,可于临用前置37℃孵育箱内30分钟,这样表面即干燥有利于分离培养,又使培养基预温,对培养某些较娇弱的细菌有利。 细菌药敏试验方法操作步骤药敏试验就是抗菌药使用以前必不可少的一个基本环节,一个正确的药敏结果能够科学的指导养殖户用药,减少抗菌素使用的盲目性,从而减少养殖户损失。在临床实际生产中具备重要意义。 1、在“超净台”中,用经(酒精灯)火焰灭菌的接种环挑取适量细菌培养物,以划线方式将细菌涂布到平皿培养基上。具体方式; 用灭菌接种环取适量细菌分别在平皿边缘相对四点涂菌,以每点开始划线涂菌至平皿的1/2。然后,找到第二点划线至平皿的1/2,依次划线,直至细菌均匀密布于平皿。 图4 接种环划线
药敏试验程序及步骤 微生物标本的采集 通常有血液、脑脊液、尿液、伤口的脓液、胸水腹水、粪便、痰液及泌尿生殖系统的分泌物。1)采集的一般原则: a早期采集 b 无菌采集注意对局部及周围皮肤的消毒,渎道底部采集的标本(外通道)正常菌群 寄生部位采集的标本应明确目的菌,采用选择培养基。 C 不同菌不同采集方法 D 采集适量标本,量不应过少,注意采集不同时间不同部位标本,要全面有特征 E 安全采集 2)标本处理 2h送到检验处,部分菌应保温于一定环境中保存注意安全尤其对烈性传染病。有时可以直接用抽取标本的注射器 如尸检组织、支气管洗液、心包液、痰、尿等标本要保存于4℃环境中,脑脊液保存于25℃ 3)各部位标本的采集及注意事项 A 血液 皮肤消毒采血部位采血量采血次数采血时间不同动物有所不同血液应马上送检室温保存不可冷藏。 配置的培养基血液和肉汤比为1:5~1:10 血液中常见的病原体引起的疾病有葡萄球菌菌血症,肠球菌菌血症、革兰隐性杆菌、厌氧菌菌血症真菌血症。 B 脑脊液 采集脑脊液一般用腰椎穿刺术获得。采集后立即送检,一般不要超过1h,避免凝固和混入血液一般取3~5ml 35度保温送检不可至于冰箱保存做病毒检查时应放置冰块4度保存72h
常见细菌性脑膜炎如流行性脑脊髓膜炎肺炎球菌脑膜炎,链球菌脑膜炎等 真菌性脑膜炎常见隐球菌脑膜炎假丝酵母菌脑膜炎等特别是免疫功能低下和恶性疾病患者易并发。如AIDS 恶性肿瘤严重糖尿病等 流行性乙型脑炎是一种人兽共患病肠道病毒可见多种病毒引起脑膜炎和肺炎 c 脓液标本的采集 首先用无菌生理盐水清洗脓液及病灶的杂菌,在采集标本,用针和注射器抽吸采取,再移入无菌容器立即送检也可用拭子在伤口深部采集渗出物,对于皮肤或下表皮的散播性感染,应采集病灶出边缘而非中央处的感染组织送检。脓肿标本以无菌注射器抽取为好,也可用排液法取得,先用70的酒精擦拭病灶部位,袋干燥后用以无菌刀切开排脓,以无菌拭子采取,不能及时送检可放冰箱冷藏,厌氧菌培养的标本只能放于室温下。厌氧菌感染的脓液常有腐臭味,采集和运送要注意不要接触空气,可直接针筒送检或置于厌氧运送培养基送检。 外伤性创伤感染以葡萄球菌和链球菌多见,放线菌,结核分枝杆菌,大肠埃希菌,铜绿假单胞杆菌也常见。深部感染极易引起破伤风和气性坏死感染。 烧伤创面最常见革兰阴性杆菌感染和革兰阳性球菌感染 急性化脓性骨关节炎常由金黄色葡萄球菌感染溶血性链球菌肺炎链球菌感染所致慢性化脓性骨关节炎慢性骨髓炎常由结合分支杆菌感染所致。 放线菌感染可发生在免疫功能下降时或由于拔牙口腔粘膜损伤一起的感染。 d痰液标本的采集 自然咳痰法和支气管镜采集法对呼吸道感染诊断有重要意义,细菌性肺炎为下呼吸道感染最常见的类型。支原体肺炎常以不典型肺炎表现。真菌性肺炎和病毒性肺炎也常见。 E 粪便标本的采集 用药前自然排便采集脓血粘液部分2~3g,粪便表面采样,液体便取絮状物1~2ml置于无菌容器内送检。 细菌性痢疾细菌真菌病毒引起的胃肠炎细菌性食物中毒致病性大肠埃希菌的肠道感染幽门螺杆菌感染导致消化性溃疡,主要部位是十二指肠球部。 F 尿液标本采集 采集清洁中段尿最好早晨取样,先清洗尿道口。必要时导尿或膀胱穿刺留尿样本采集容器要求清洁无菌、密封、加盖、防渗透、广口、容积大于50ml。主要主要经尿道口上行感染,极少数血道感染,可反映肾脏,膀胱,尿道,前列腺等处的炎症变化。
表1A.美国临床微生物学实验室在非苛养菌常规试验和报告中应考虑的具有FDA临床适应证的抗菌药物建议分组总注释: A.对四环素敏感的菌株被认为对多西环素和米诺环素也敏感。然而,某些对四环素中介或耐药的 菌株可能对多西环素、米诺环素或二者敏感。 B.利福平不能单独用于抗菌治疗。 C.分离于泌尿道菌株不被常规报告。 D.头孢噻吩仅被用于预报口服药物结果,包括头孢氨苄、头孢泊肟、头孢氨苄和氯碳头孢。以前 关于头孢噻吩结果可预报其他头孢菌素敏感性建议仍然正确,但近年来还没有数据证实此建议。 E.当测试粪便中分离的沙门菌和志贺菌株时,只有氨苄西林、一种氟喹诺酮类和复方新诺明可用 于常规报告。另外,对肠道外感染沙门菌粉分离株,应测试并报告一种三代头孢菌素,假如需要,也可测试和报告氯霉素。分离于肠道内和肠道外伤寒样沙门菌(伤寒沙门菌和副伤寒沙门菌A-C)需进行药敏试验。分离于肠道内非伤寒样沙门菌不需进行常规药敏试验。 F.从CSF中分离菌株,试验和报告头孢噻肟和头孢曲松,以取代头孢唑林。 G.其他非肠杆菌科细菌包括假单胞菌和其他非苛养、非发酵葡萄球菌的革兰阴性杆菌,但不包括 铜绿假单胞菌、不动杆菌、洋葱伯克霍尔德菌和嗜麦芽窄食单胞菌,因为对这些菌种的建议试验和报告药物表格已分开。 鼻疽伯克霍尔德菌和假鼻疽伯克霍尔德菌试验和报告药物建议请参阅CLSIM45文件。 H.仅对金黄色葡萄球菌包括耐甲氧西林金黄色葡萄球菌(MRSA) I.青霉素敏感的葡萄球菌对葡萄球菌感染具有临床疗效的其他β-内酰胺类药物也敏感。青霉素耐 药葡萄球菌对青霉素酶不稳定青霉素类耐药。除具有抗-MRSA活性新的头孢菌素外,苯唑西林耐药葡萄球菌对当前所有使用的β-内酰胺类药物均耐药。因此,仅测试青霉素和头孢西丁或苯唑西林二者中任一种,则可推测对各种β-内酰胺类药物的敏感或耐药性。除具有抗-MRSA 活性药物外,不建议常规测试其他β-内酰胺类药物。 J.分离于呼吸道菌株不报告达托霉素结果。 K.头孢西丁纸片扩散法或MIC试验结果可用于预报金黄色葡萄球菌和路登葡萄球菌分离株是否存在mecA介导的苯唑西林耐药。对凝固酶阴性葡萄球菌(除路登葡萄球菌外),检测mecA介
抗菌药物敏感性试验的技术要求 1 范围 本标准规定了临床抗菌药物敏感性试验的技术要求,包括常规药敏试验的药物选择和报告、药敏试验方法、各种属细菌药敏试验、常见菌特殊耐药表型检测、药敏试验的质量控制、商品化药敏试验检测系统的性能验证。 本标准适用于开展临床微生物学检验的各级临床实验室。 2 术语和定义 下列术语和定义适用于本文件。 2.1 抗微生物药物敏感性试验Antimicrobial susceptibility testing 检测微生物(本文件特指细菌)对抗微生物药物(本文件特指抗菌药物)的体外敏感性,以指导临床合理选用药物的微生物学试验,简称药敏试验。 2.2 最低抑菌浓度Minimal inhibitory concentration;MIC 在琼脂或肉汤稀释法药物敏感性检测试验中能抑制肉眼可见的微生物生长的最低抗菌药物浓度。2.3 折点Breakpoint 能预测临床治疗效果,用以判断敏感、中介、剂量依赖型敏感、耐药、非敏感的最低抑菌浓度(MIC)或者抑菌圈直径(mm)的数值。 2.3.1 敏感Susceptible;S 当抗菌药物对分离株的MIC值或抑菌圈直径处于敏感范围时,使用推荐剂量进行治疗,该药在感染部位通常达到的浓度可抑制被测菌的生长,临床治疗可能有效。 2.3.2 中介Intermediate;I 当菌株的MIC值或抑菌圈直径处于中介时,该数值接近药物在血液和组织中达到的浓度,从而治疗反应率低于敏感菌群。该分类意味着采用高于常规剂量治疗时或在药物生理浓集的部位,临床治疗可能
有效。该分类同样可作为“缓冲域”,以防止由微小、不可控的技术因素导致的重大偏差,尤其是毒性范围较窄的药物。 2.3.3 剂量依赖型敏感Susceptible-dose dependent;SDD 细菌菌株对抗菌药物的敏感性依赖于抗菌药物的剂量。当某种药物对菌株的MIC或抑菌圈直径在SDD 范围时,临床可通过提高剂量和(或)增加给药频率等修正给药方案以达到临床疗效。 2.3.4 耐药Resistant;R 当抗菌药物对分离株的MIC值或抑菌圈直径处于该分类范围时,使用常规治疗方案,该药在感染部位所达到的药物浓度不能抑制细菌的生长,和(或)被测菌株获得特殊耐药机制,且治疗性研究显示该药临床疗效不确切。 2.3.5 非敏感Nonsusceptible;NS 对于那些因未现或罕现耐药,而仅具有敏感折点的抗菌药物,当该药对某分离株的MIC值高于或抑菌圈直径低于敏感折点时,此分类为非敏感。 2.4 流行病学界值Epidemiological cutoff value;ECV 将微生物群体区分为有或无获得性耐药的MIC值或抑菌圈直径,是群体敏感性的上限。根据ECV,可将菌株分为野生型和非野生型。 2.4.1 野生型 Wild-type;WT 根据ECV值,将抗菌药物(包括抗真菌药物)评估中未获得耐药机制或无敏感性下降的菌株定义为野生型。 2.4.2 非野生型Non-wild-type;NWT 根据ECV值,将抗菌药物(包括抗真菌药物)评估中获得了耐药机制或存在敏感性下降的菌株,定义为非野生型。 2.5 效价Potency 抗菌药物中具有抗菌活性的成分,通过同类标准物质测定得出。单位mg/g、IU/g或用百分比表示。
药敏试验: 用药敏实验进行药物敏感度的测定,以便准确有效的利用药物进行治疗。目前,临床微生物实验室进行药敏试验的方法主要有纸片扩散法,稀释法(包括琼脂和肉汤稀释法),抗生素浓度梯度法(E-test 法),和自动化仪器等。 简介: 体外抗菌药物敏感性试验简称药敏试验(AST),是指在体外测定药物抑菌或杀菌能力的试验。 根据美国国家临床实验室标准化委员会(NCCLS)近期推荐的标准,对非苛氧菌(肠杆菌科细菌、铜绿假单胞菌、和其他非肠科杆菌、葡萄球菌属细菌、肠球菌属细菌)和苛氧菌(嗜血杆菌属细菌、淋病奈瑟菌、肺炎链球菌和其他链球菌)选择常规药敏试验的首选药物(A 组抗生素)或临床使用的主要抗生素(B组抗生素)进行药敏试验。 抗菌药对细菌性传染病的控制起到了非常重要的作用,但由于养殖过程中不科学的、盲目的滥用抗菌药,很多致病性细菌产生了耐药性,使得抗菌药对细菌性疾病的控制效果越来越差,不但造成药物浪费,而且还延误病情,给养殖户造成了很大的经济损失。 随着新型致病菌的不断出现,抗菌药的防治效果越来越差。并且各种致病菌对不同的抗菌药物的敏感性不同,同一细菌的不同菌株对不同抗菌药物的敏感性也有差异。长期以来,各种致病菌耐药性的产生使各种常用抗菌药物往往失去药效,以及不能很好的掌握药物对细菌的敏感度,所以一个正确的结果,可供临床医师选用抗菌药物的参
考,并提高疗效。农业部动物检疫所青岛易邦生物工程有限公司动物疫病诊疗中心总结出几套适合基层进行药敏试验的操作方法,现简单介绍如下。 实验步骤: 实验材料 普通营养琼脂培养基:可去生化试剂店购买,做不同细菌的药敏试验可选择不同的培养基,如做大肠杆菌的药敏试验可选择普通营养琼脂或麦糠凯培养基。做沙门氏菌可选择血清培养基。 药敏试纸:购买或自制(详见实验准备) 细菌:待做药敏试验的细菌 仪器:接种环、酒精灯、打孔器、牛津杯、移液器、滴头 实验准备 2.1 药敏片的准备:购买或自制 2.1.1 制备方法:取新华1号定性滤纸,用打孔机打成6毫米直径的圆形小纸片。取圆纸片50片放入清洁干燥的青霉素空瓶中,瓶口以单层牛皮纸包扎。经15磅15-20分钟高压消毒后,放在37℃温箱或烘箱中数天,使完全干燥。 2.1.2 抗菌药纸片制作:在上述含有50片纸片的青霉素瓶内加入药液0.25毫升,并翻动纸片,使各纸片充分浸透药液,翻动纸片时不能将纸片捣烂。同时在瓶口上记录药物名称,放37℃温箱内过夜,干燥后即密盖,如有条件可真空干燥。切勿受潮,置阴暗干燥处存放,有效期3-6个月。
药敏试验方法: 默认分类 2009-05-06 22:37 阅读285 评论0 字号:大中小 K-B法: 1 从孵育了16-24小时的琼脂平板上(血平板),挑出单个菌落,直接用生理盐水制成0.5麦氏单 位。 2 在15分钟内,用无菌棉拭子蘸取调好的菌液,在液面上方管壁处旋转并用力挤压几次,以从中挤 出过多的菌液。 3 用棉拭子在无菌的M-H培养基表面化线接种,再重复操作两次,每次将平板转动60度,每次接 种都应保证接种物均匀分布,最后用棉拭子涂抹平板的边缘。 4 将确定好的药敏纸片分贴到平板表面。每个纸片都应压一下,以保证与平板表面完全接触。每个 纸片中心间距24mm。纸片一旦与平板接触,不应再移动。 5 贴完纸片后,应在15分钟内放入35度孵箱。嗜血杆菌属,链球菌属放入3%-5%的CO2烛缸。 6 孵育24小时以后,测量各药敏纸片抑菌圈直径,与NCCLS手册比较,作出结果判断。 说明:细菌药敏结果的判断以NCCLS为标准,所以药敏试验的每一步都应严格按照NCCLS操作,否则将失去意义。链球菌、奈瑟菌属、流感嗜血杆菌、除铜绿假单孢菌和不动杆菌外的假单孢菌属不用K- B法. 肺炎链球菌胶乳凝集测定法 1 在一干净玻片上分别滴两滴生理盐水。 2 从冰箱取出鉴定试剂(Slidex pneumo-kit)于室温。 ·3 在其中一滴生理盐水上滴加R1试剂,在另外一滴上滴加R2试剂,用搅拌棒混匀。 4 轻轻晃动玻片2分钟,观察结果。 5 2分钟内,如R1出现凝集为阳性;如R1和R2均未出现凝集为阴性。 注:R3为阳性对照。 药敏纸片的选择 1、革兰阴性杆菌(肠杆菌科)
头孢噻肟(CTX)头孢唑林(CZ)头孢他定(CAZ) 氨苄西林(AM)哌拉西林(PIP)阿米卡星(AN) 头孢噻吩(CF)环丙沙星(CIP)头孢呋辛(CXM) 庆大霉素(GM)头孢噻肟/棒酸(CTX/CA) 头孢他定/克拉维酸(CAZ/CA)羧苄青霉素(CB) 奥格门丁(AMX/CA)哌拉西林/三唑巴坦(PIP/TZ)亚安培南头孢匹肟(FEP)头孢克罗(CEC) 2、铜绿假单孢菌/不动杆菌 妥布霉素(TM)阿米卡星(AN)安曲南(AZT) 头孢哌酮(CFP)哌拉西林(PIP)头孢匹肟 头孢噻肟(CTX)环丙沙星(CIP)头孢他定(CAZ) 左旋氧氟沙星(OFL)亚安培南哌拉西林/三唑巴坦 3、金黄色葡萄球菌 苯唑西林(OX)青霉素G(P)头孢唑林(CZ)阿米卡星(AN)红霉素(E)头孢噻肟(CTX)环丙沙星(CIP) 万古霉素奥格门丁(AMX/CA)哌拉西林/三唑巴坦 头孢噻吩(CF) 4 、肠球菌 氨苄西林(AM)万古霉素环丙沙星(CIP) 庆大霉素(GM)红霉素(E)氧氟沙星(OFL) 5、除肺炎链球菌外链球菌 氨苄西林(AM)头孢噻肟(CTX)万古霉素 红霉素(E)氧氟沙星(OFL)克林霉素(CM) 肺炎克雷伯菌产酸克雷伯菌和大肠杆菌ESBLs的检测
细菌药物敏感试验实验报告 药物敏感性试验的基本原则 1药敏试验检测获得性耐药,不必测试天然耐药: 天然耐药是细菌菌种固有的特征,耐药基因一般位于染色体,可以长期稳定遗传,表现为对某类或某种药物的天然耐药。天然耐药信息一般由基础医学和临床文献提供。部分天然耐药,体外试验条件下可能无法检测出来,因而导致假敏感,如果报告将成为极重要错误,严重误导临床。常见菌种对各类药物的天然耐药见文献。实验室全体人员应熟知这些信息,可将其发给临床学习和参考。 2药敏试验测试的前提条件: 实验室应具备相应检测的人员能力、客观条件、结果解释依据。标本处理、菌株分离鉴定、药敏试验操作等环节规范、标准、结果可信;具备对结果的解释能力,能够提供临床会诊服务。临床常规工作,分离株(可能)有临床意义而非定植或污染时,才可进行药敏试验。 错误示例:来自痰标本的溶血葡萄球菌,未作标本质量评估和半定量培养,进行药敏试验;来自粪便标本肠球菌属进行药敏试验等。 3测试结果应准确: 实验室应遵照CLSI文件或相关规范建立本医院药敏试验的质量管理
体系。质控菌株、频率、质控范围符合相关要求;定期参加实验室室间比对项目。建议保留菌株,以便复核。 具体的专业要求 1标本类型 临床微生物学的一大特点是标本种类繁多,而不同药物在这些部位的分布不同。标本的规范采集、质量保证、立即运送和有效保藏有赖于临床、实验室以及相关各方的密切合作。在规范临床送检的前提下,实验室进行药敏试验和报告药敏结果时,应首先考虑标本的特殊性。实际工作中需重点考虑的标本如下。 1.脑脊髓液: 正常和疾病状态不能穿透血脑屏障的药物,常规不应报告。报告审核时,对于分离自脑脊髓液的菌,下列药物不能报告:仅有口服剂型的抗菌药物、一、二代头孢菌素(除外静脉用头孢呋辛)、头霉素类、克林霉素、大环内酯类、四环素类和喹诺酮类。
药敏试验方法: K-B法: 1 从孵育了16-24小时的琼脂平板上(血平板),挑出单个菌落,直接用生理盐水制成0.5麦氏单位。 2 在15分钟内,用无菌棉拭子蘸取调好的菌液,在液面上方管壁处旋转并用力挤压几次,以从中挤出过多的菌液。 3 用棉拭子在无菌的M-H培养基表面化线接种,再重复操作两次,每次将平板转动60度,每次接种都应保证接种物均匀分布,最后用棉拭子涂抹平板的边缘。 4 将确定好的药敏纸片分贴到平板表面。每个纸片都应压一下,以保证与平板表面完全接触。每个纸片中心间距24mm。纸片一旦与平板接触,不应再移动。 5 贴完纸片后,应在15分钟内放入35度孵箱。嗜血杆菌属,链球菌属放入3%-5%的CO2烛缸。 6 孵育24小时以后,测量各药敏纸片抑菌圈直径,与NCCLS手册比较,作出结果判断。 说明:细菌药敏结果的判断以NCCLS为标准,所以药敏试验的每一步都应严格按照NCCLS操作,否则将失去意义。链球菌、奈瑟菌属、流感嗜血杆菌、除铜绿假单孢菌和不动杆菌外的假单孢菌属不用K-B法. 肺炎链球菌胶乳凝集测定法 1 在一干净玻片上分别滴两滴生理盐水。 2 从冰箱取出鉴定试剂(Slidexpneumo-kit)于室温。 3 在其中一滴生理盐水上滴加R1试剂,在另外一滴上滴加R2试剂,用搅拌棒混匀。 4 轻轻晃动玻片2分钟,观察结果。 5 2分钟内,如R1出现凝集为阳性;如R1和R2均未出现凝集为阴性。 注:R3为阳性对照。 药敏纸片的选择 1、革兰阴性杆菌(肠杆菌科) 头孢噻肟(CTX)头孢唑林(CZ)头孢他定(CAZ) 氨苄西林(AM)哌拉西林(PIP)阿米卡星(AN) 头孢噻吩(CF)环丙沙星(CIP)头孢呋辛(CXM) 庆大霉素(GM)头孢噻肟/棒酸(CTX/CA) 头孢他定/克拉维酸(CAZ/CA)羧苄青霉素(CB) 奥格门丁(AMX/CA)哌拉西林/三唑巴坦(PIP/TZ) 亚安培南头孢匹肟(FEP)头孢克罗(CEC) 2、铜绿假单孢菌/不动杆菌 妥布霉素(TM)阿米卡星(AN)安曲南(AZT) 头孢哌酮(CFP)哌拉西林(PIP)头孢匹肟 头孢噻肟(CTX)环丙沙星(CIP)头孢他定(CAZ) 左旋氧氟沙星(OFL)亚安培南哌拉西林/三唑巴坦 3、金黄色葡萄球菌 苯唑西林(OX)青霉素G(P)头孢唑林(CZ)阿米卡星(AN) 红霉素(E)头孢噻肟(CTX)环丙沙星(CIP) 万古霉素奥格门丁(AMX/CA)哌拉西林/三唑巴坦 头孢噻吩(CF) 4 、肠球菌 氨苄西林(AM)万古霉素环丙沙星(CIP) 庆大霉素(GM)红霉素(E)氧氟沙星(OFL) 5、除肺炎链球菌外链球菌 氨苄西林(AM)头孢噻肟(CTX)万古霉素
常见细菌药物敏感性试验报告规范中国专家共识 微生物学检验为感染性疾病的诊断、治疗和控制提供了必不可少的证据。因此微生物学检验报告是临床和实验室等多方共同关注的焦点。国内临床微生物学检验发展较为薄弱,报告存在着种种不足。同时,临床与实验室的沟通存在一定不足,密切协作非常必要。基于实际存在的问题,为规范国内临床微生物学检验药物敏感性试验报告,加强临床与实验室合作,发挥检验医师作用,特制订本共识,以期指导相关报告的规范化,减少错误,增加专业信息,提高服务质量,为临床医学诊、治、控提供坚实的科学依据。本共识限于常见细菌的药物敏感性报告。 一、药物敏感性试验的意义和基本原则 (一)意义 药物敏感性试验可以检测细菌对于抗细菌药物的敏感性,为临床用药、新药研究、监测耐药变迁、发现耐药机制等提供客观证据[1]。对于经验治疗,依据一方面来自医生自身的经验,一方面是实验室长期不断提供的数据积累。临床需要考虑不同感染的病原谱和常见病原对不同药物的敏感性;对于靶向治疗,特定分离株的具体药敏试验结果可以用于判断经验治疗选药合理性、经验治疗效果分析、调整治疗选药依据等。 (二)基本原则 1.药敏试验检测获得性耐药,不必测试天然耐药: 天然耐药是细菌菌种固有的特征,耐药基因一般位于染色体,可以长期稳定遗传,表现为对某类或某种药物的天然耐药[2]。天然耐药信息一般由基础医学和临床文献提供。部分天然耐药,体外试验条件下可能无法检测出来,因而导致假敏感,如果报告将成为极重要错误,严重误导临床。常见菌种对各类药物的天然耐药见文献[3,4]。实验室全体人员应熟知这些信息,可将其发给临床学习和参考。 2.药敏试验测试的前提条件[5]: 实验室应具备相应检测的人员能力、客观条件、结果解释依据。标本处理、菌株分离鉴定、药敏试验操作等环节规范、标准、结果可信;具备对结果的解释能力,能够提供临床会诊服务。临床常规工作,分离株(可能)有临床意义而非定植或污染时,才可进行药敏试验。错误示例:来自痰标本的溶血葡萄球菌,未作标本质量评估和半定量培养,进行药敏试验;来自粪便标本肠球菌属进行药敏试验等。 3.测试结果应准确: 实验室应遵照C L S I文件或相关规范建立本医院药敏试验的质量管理体系。质控菌株、频率、质控范围符合相关要求;定期参加实验室室间比对项目。建议保留菌株,以便复核。 二、具体的专业要求 (一)标本类型 临床微生物学的一大特点是标本种类繁多,而不同药物在这些部位的分布不同。标本的规范采集、质量保证、立即运送和有效保藏有赖于临床、实验室以及相关各方的密切合作。
一、目的: 指导实验人员准确完成酵母样真菌药敏试验(微量稀释法)。 二、适用范围: 怀疑酵母样真菌感染患者 三、检验原理: ATB FUNGUS 3试条包括16对杯状凹cupules。第一对不含任何抗真菌剂。用作阳性生长对照。另外的15对包含不同稀释度的5种抗真菌剂。用于测定最小抑菌浓度(MIC)和(或)区分临床敏感性。 将准备好的待测酵母样真菌的悬浮液转移到培养基中,并接种到试条上。孵育后,我们可以通过肉眼判读,或者应用A TB仪器或miniAPI判读杯状凹中液体的生长情况。获得MIC(两性霉素B[AMB]),氟康唑[FCA],伊曲康唑[ITR],伏立康唑[VRC],5-氟胞嘧啶[5FC]),将菌株分为敏感、中介或耐药。 四、职责:生物梅里埃 实验人员准确完成酵母样真菌药敏试验(微量稀释法) 试剂厂家: 规格:25测试/盒 内含物:-25个独立包装的A TB FUNGUS 3 试条,包括干燥剂 -25个孵育盖 -25安瓿A TB F2培养基 -25张结果记录单 -一份说明书 五、储存条件及有效期: 在包装盒上指示的有效期前,试条和培养基应在2-8℃下存放。 有效期为12个月。 六、工作程序: (一)试验的准备: 1、从包装中取出试条 2、在试条延长翼上记录下被测酵母菌株的编号 (二)接种物的准备: 1、打开一个API?0.85%氯化钠培养基安瓿(或API培养悬液) 2、采集不超过4天的菌落,制备成浊度相当于2 McFarland的悬浮液 3、用McFarland试剂盒的标准浊度管比较,或使用ATB比浊仪DENSIMAT 4、此菌悬液必须在准备后立即使用 5、使用一移液管转移20ul此悬浮液到一A TB F2培养基的安瓿中 (三)试验条的接种: 手工接种: 1、用ATB电子移液管混匀A TB F2培养基,避免产生气泡 2、使用ATB电子移液管在每个杯状凹中加入135ul的ATB F2 培养基(大约3*104酵母菌/毫升或4*103酵母菌/杯状凹)
实训细菌的药物敏感性试验 教学目标 使学生掌握细菌药物敏感性试验的操作方法,能够利用本试验方法选择敏感药物治疗兽医临床常见的细菌性传染病。 材料准备 1.器材:温箱、天平、打孔机、滤纸、无菌试管及吸管、镊子、接种环、酒精灯等。 2.试剂:蒸馏水。 3.培养基:普通琼脂平板。 4.菌种:金黄色葡萄球菌及大肠杆菌的固体培养物。 5.药品:链霉素、金霉素、新霉素、红霉素等抗菌药物。 6.硫酸钡标准管:取1%~1.5%氯化钡0.5ml加1%硫酸溶液99.5ml,充分混匀即成,用前充分振荡。 方法步骤 将抗菌药物置于接种待检菌的固体培养基上,抗菌药物通过向培养基内的扩散,抑制敏感细菌的生长,从而出现抑菌环。由于药物扩散的距离越远,达到该距离的药物浓度越低,由此可根据抑菌环的大小,判定细菌对药物的敏感度。 (一)含药纸片的制备 1.滤纸片最好选用新华1号定性滤纸,用打孔机打成直径6mm的滤纸片,放在小瓶中或平皿中,在121.3℃灭菌15min,再置100℃干燥箱内烘干备用。 2.药液的配制用无菌蒸馏水将各药稀释成以下浓度:磺胺100mg/ml、青霉素100IU/ml、链霉素、金霉素、新霉素、红霉素、多粘菌素1000μg/ml。 3.含药纸片的制备将灭菌的滤纸片用无菌的镊子摊布于灭菌平皿中,按每张滤纸片饱和吸水量为0.01ml计算,50张滤纸片加入药液0.5ml。要不时翻动,使纸片充分吸收药液,浸泡1~2h后于37℃温箱中烘干备用。对青霉素、金霉素纸片的干燥宜采用低温真空干燥法,干燥后立即放入瓶中加塞,放干燥器内或置-20℃冰箱中保存。纸片的有效期一般为4~6个月。 (二)测验方法 1.钩取金黄色葡萄球菌和大肠杆菌菌落各4~5个,分别接种于肉汤培养基中,37℃培养4~6h。 2.用灭菌生理盐水稀释培养菌液,使其浊度相当于硫酸钡标准管。装有以上两种成分的试管须相同,硫酸钡应用前需充分振动。 3.用无菌棉拭子蘸取上述肉汤培养液,在试管壁上挤压除去多余的液体,在琼脂培养基表面均匀涂抹。每种细菌分别接种1~2个琼脂平板。
作者单位:100853北京,解放军总医院微生物科(刘梅系进修医师) 论著 酵母菌对氟康唑的敏感性及三种药敏试验方法的比较 沈定霞 谢灵 刘梅 周贵民 摘要 目的 了解酵母菌对氟康唑的敏感性,并对3种抗真菌药敏试验方法进行比较。方法 利用纸片扩散法,微量稀释法及浓度梯度法(Etest法)测定92株临床分离酵母菌对氟康唑的敏感性。结果 Etest法和微量稀释法所测酵母菌对氟康唑的总敏感率分别是73.9%和81.5%。纸片扩散法所测敏感菌,微量稀释法全部敏感,Etest法敏感率为91%;纸片扩散法所测耐药菌,其余两种方法检测多数仍为敏感。从不同菌种来看,白念珠菌、热带念珠菌、假热带念珠菌、葡萄牙念珠菌、白吉利丝孢酵母菌及酿酒酵母菌对氟康唑全部敏感;氟康唑对克柔念珠菌及光滑念珠菌的最小抑菌浓度(M IC)值均较高;近平滑念珠菌、季也蒙念珠菌、异常汉逊酵母菌及新型隐球菌中的部分菌株对氟康唑敏感,部分菌株为剂量依赖性敏感,未发现耐药菌株。结论 氟康唑对除克柔念珠菌及光滑念珠菌的M IC值较高外,其余酵母菌对氟康唑敏感性好。纸片扩散法虽简便,但仅可用于初筛敏感菌,对抑菌环直径 14mm者应进一步用微量稀释法或Etest法测定其M I C值。 关键词 酵母菌 氟康唑 微生物敏感性试验 C omparison of three methods for f luconazole antifungal susceptibility test Shen Dingx ia,X ie Ling, L iu M ei,et al.Dep ar tment of M icr obiology,Gener al H osp ital of PLA,Beij ing100853 Abstract Objectives T o study the susceptibility of yeasts to fluconazole and to compare three methods for antifung al susceptibility test.Methods 92clinical isolates of yeasts were examined for the sus-ceptibility to fluconazole by disk diffusion test,bro th microdilutio n method and E test.Results T he total susceptibility r ate of yeasts to fluconazole was73.9%and81.5%by E test and broth microdilution method r espectiv ely.Susceptible strains by disk diffusion test were all susceptible by broth microdilution method r ecommended by N CCLS and91%susceptible by the E test.T hose with inhibition zone diameters of 14mm w er e almost susceptible by anot her2methods.As concerned w ith t he species, C.albicans, C.trop-i calis, C.pseudotropicalis, C.lusitaniae,T r ichosporon beig elii and Saccaromyces cer ev isiae w er e all suscept-i ble to fluconazole,their M ICs 8 g/ml; C.krusei and T orulopsis glabrata possessed higher M I Cs of all 16 g/ml,even 256 g/ml.Some of Hansenula anomala, C.guillier mondii, C.parapsilosis and Crypto-coccus neofor mans w ere susceptible,and some were dose-dependent susceptible to fluconazole.C onclusions Almost all yeasts ex amined are susceptible to fluconazole except C.krusei and T orulopsis g labrata.T he disk diffusion test can only be used to screen sensitive strains althoug h it is easier to be done,the M I Cs must be tested by broth microdilut ion method or E test when the inhibition zone is 14mm. Key words Yeasts F luconazole M icrobial sensitivity tests 近年来,由于激素、免疫抑制剂及广谱抗生素的广泛应用,器官移植术的普遍开展,以及艾滋病病人的不断增加,原发及继发性免疫功能低下人群扩大,全身性真菌感染日益增多,抗真菌药物的使用,又使真菌的耐药现象出现[1]。因此,开展真菌的体外药敏试验,指导临床医生合理用药已受到越来越多的关注。 我们应用纸片扩散法、微量稀释法及浓度梯度法(Etest法)分别测定并比较了92株分离自临床标本的酵母菌对氟康唑(临床应用最多的抗真菌药物之一)的敏感性,现报告如下。 材料与方法 一、材料 1 试验菌:92株酵母菌分别来自临床送检的血 199 中华医学检验杂志1998年7月第21卷第4期
细菌分离培养方法及操作步骤 无菌取血液或脏器、淋巴结划线接种于鲜血琼脂平板或血清琼脂平面培养基、普通肉汤培养基,37℃恒温培养24 h,观察其生长特性。目前细菌分离培养的常用方法有平板划线分离法、加热分离法和实验动物分离法。 平板划线接种法 这是目前临床上最常用的分离接种方法。它可以从被检病料中通过划线可使细菌分离、分散生长而形成单个菌落(有利于从含有多种细菌的标本中分离出目的菌),以便挑选可疑菌落作纯培养加以鉴定。具体操作: 1、右手持接种环,在酒精灯上火焰灭菌; 图1 病料采集图2 接种环灭菌 2、待接种环冷却后,挑取被检料少许,左手持琼脂平板,以食指为支点,用拇指和无名指将平皿揭开一空隙。大约20℃时,迅速地将接种环轻轻地涂布在培养基的边缘。
3、在涂布处来回移动作曲线形划线接种。(注意:划线时,以腕力使接种环在琼脂平板表面划动,尽量不要划破培养基,划的线条要密,但不能重复旧线,以免培养物形成菌苔。) 图3 平板划线接种法 4、划线完毕,合上平皿盖,将琼脂平板倒置,放入37℃温箱内培养18-24小时。 注意:分离培养用的平板培养基应表面干燥,可于临用前置37℃孵育箱内30分钟,这样表面即干燥有利于分离培养,又使培养基预温,对培养某些较娇弱的细菌有利。
细菌药敏试验方法操作步骤 药敏试验是抗菌药使用以前必不可少的一个基本环节,一个正确的药敏结果能够科学的指导养殖户用药,减少抗菌素使用的盲目性,从而减少养殖户损失。在临床实际生产中具备重要意义。 1、在“超净台”中,用经(酒精灯)火焰灭菌的接种环挑取适量细菌培养物,以划线方式将细菌涂布到平皿培养基上。具体方式;用灭菌接种环取适量细菌分别在平皿边缘相对四点涂菌,以每点开始划线涂菌至平皿的1/2。然后,找到第二点划线至平皿的1/2,依次划线,直至细菌均匀密布于平皿。 图4 接种环划线 2、以无菌操作将灭菌的不锈钢小管(外径为4毫米、孔径与孔距均为3毫米,管的两端要光滑,也可用玻璃管、瓷管),放置在培养基上打孔,将孔中的培养基用针头挑出,并以火焰封底,使培养基能充分的与平皿融合(以防药液渗漏,影响结果)。
酵母菌MIC检测标准操作规程(微量液基稀释法) 编号:页数: 制订人:(签名)(日期) 审核人:(签名)(日期) 批准人:(签名)(日期) 颁发日期:生效日期
1.培养基配置: RPMI 1640 培养液:RPMI1640(Gibco BRL,Invitrogen)10g,NaHCO3 2.0g,吗啉基丙磺酸(morpholinepropanesulfonic acid, MOPS, Sigma)34.5 g(0.165 M),加三蒸水900 ml 溶解,1 M NaOH 调pH 至7.0(25℃),定容至1 000ml,过滤除菌,4℃保存。 沙堡葡萄糖琼脂培养基(sabouraud dextrose agar, SDA):蛋白胨10g,葡萄糖40g,琼脂18g,加三蒸水900 ml 溶解,加入2 mg/ml 氯霉素水溶液50 ml,调整pH 至7.0,定容至1 000 ml,115℃,高压灭菌,4℃保存。 2.抗真菌化合物的配制: (1)待筛选化合物统一用DMSO溶解,配成6.4mg/ml母液,-70℃保存; (2)药敏板制备前将50μl母液加入到450μl RPMI 1640 培养液中,充分振荡混匀,稀释为640μg/ml 中间浓度备用。 3.药敏板制备: (1)取无菌96 孔板,于每排1 号孔加RPMI 1640培养液200 μl 作空白对照; (2)96孔板每排3~12 号孔各加RPMI 1640培养液100 μl; (3) 2 号孔分别加RPMI 1640培养液180μl 和640μg/ml 抗真菌化合物溶液20 μl,充分混匀;每排为1个待筛选化合物;最后一排为质控氟康唑; (4)2~11 号孔10 级倍比稀释,使各孔的最终药物浓度分别为64、32、16、8、4、 2、1、0.5、0.25和0.125 μg/ml,各孔中DMSO 含量均低于1%;12 号孔不 含药物,作阳性对照; (5)药敏板配好之后如不立即接种真菌则必须用保险塑料袋封好,储存于-70℃。 4.阳性对照药浓度配置: (1)氟康唑和氟胞嘧啶为水溶性药物,其母液用无菌蒸馏水配置;两性霉素、咪康唑、伊曲康唑、伏立康唑、酮康唑、特比萘芬等为脂溶性药物,其母液用DMSO 溶解; (2)氟康唑、氟胞嘧啶母液配置浓度为1280μg/ml,两性霉素、酮康唑、咪康唑、特比萘芬、伊曲康唑母液配置浓度为1600μg/ml; (3)所有抗真菌药物母液-70℃保存; (4)氟康唑、氟胞嘧啶药敏板稀释浓度为:64-0.125μg/ml; (5)两性霉素、酮康唑、咪康唑、特比萘芬、伊曲康唑药敏板稀释浓度为:16-0.313μg/ml;
药敏试验结果解读及临床应用 一、药敏试验的目的 药敏试验是使用体外试验的方法检测细菌的耐药性,预测抗菌药物的临床治疗效果,在药物种类的选择上为临床医生提供帮助,以实施个体化治疗。 当前,“对症下药”已经变得难以奏效。首先,致病菌的种类发生了改变,一种疾病可以由多种病原菌所引起,包括致病菌和条件致病菌;其次,感染人群发生变化,从健康人群到老年人、长期使用激素、免疫抑制剂及放疗、化疗的人群,临床症状常常不典型;最后,早期不规使用抗生素,也会导致临床症状不典型。 与此同时,“对菌下药”又难以获得满意效果。耐药菌尤其是多重耐药菌的出现,使临床医师按照抗生素的作用机制选择1~2种抗菌药物不能覆盖常见的病原菌。因此,药敏试验成为临床工作的重要手段之一。 二、哪些细菌需要做药敏试验? 对任何分离的可疑病原菌,若不能从该菌的种属特征可靠地推知其对抗菌药物的敏感性,就需要进行药敏试验。以下情况不必进行药敏试验:正常定植菌与感染的关系不明确时;污染菌;已知细菌对某种抗生素天然耐药;已知细菌对某种抗生素全部敏感。检验地带网三、药敏试验中药物的选择 主要根据细菌种类和抗生素作用机制选药。选择试验的药物应具有确切的临床疗效,试验药物的体外试验结果可以接受,并且试验药物具有代表性。 目前我国临床实验室采用美国国家标准化委员会(NCCLS)/美国临床实验室标准化研究所(Clinical and Laboratory Standards Institute , CLSI)药敏试验执行标准选药。NCCLS抗生素选择分组为: A组:为首选药物,作常规试验和报告。 B组:为首选药物,可与A组药物平行作药敏试验,但只在以下情况下进行选择性报告:细菌对A组抗生素耐药,病人对A组抗生素过敏,严重感染或多部位、多种细菌混合感染,要获得耐药性监测资料。 C组:为备选药物,作为替代或补充,在下列情况下使用:对一个或多个首选药耐药的地区流行株感染,对不常见菌感染的治疗,控制传染病的流行,获得耐药性监测资料。 U组:为备选药物,仅用于尿路感染的治疗。 四、药敏试验所采用的方法 常用的试验方法包括纸片扩散法、稀释法、自动化仪器法、E-TEST(浓度梯度法)。 五、细菌的主要耐药机制 1、产生水解酶,如β-酰胺酶、钝化酶。 2、细菌上与抗生素的结合靶位改变,如青霉素结合蛋白2a。 3、细菌表面通道蛋白改变,可以使其渗透性发生改变。 4、细菌产生泵出机制。 5、其他机制,如病原菌产生生物被膜、休眠状态等。 六、临床常见病原菌的归属和分类 临床常见病原菌主要包括以下四大类: 1、革兰阳性球菌:如葡萄球菌属、肠球菌属。 2、革兰阴性杆菌:如肠杆菌科细菌(大肠埃希菌、肺炎克雷伯菌、肠杆菌属、枸橼酸杆菌属)和非发酵菌(铜绿假单孢菌、不动杆菌)。