
药品拒收报告单 The manuscript was revised on the evening of 2021
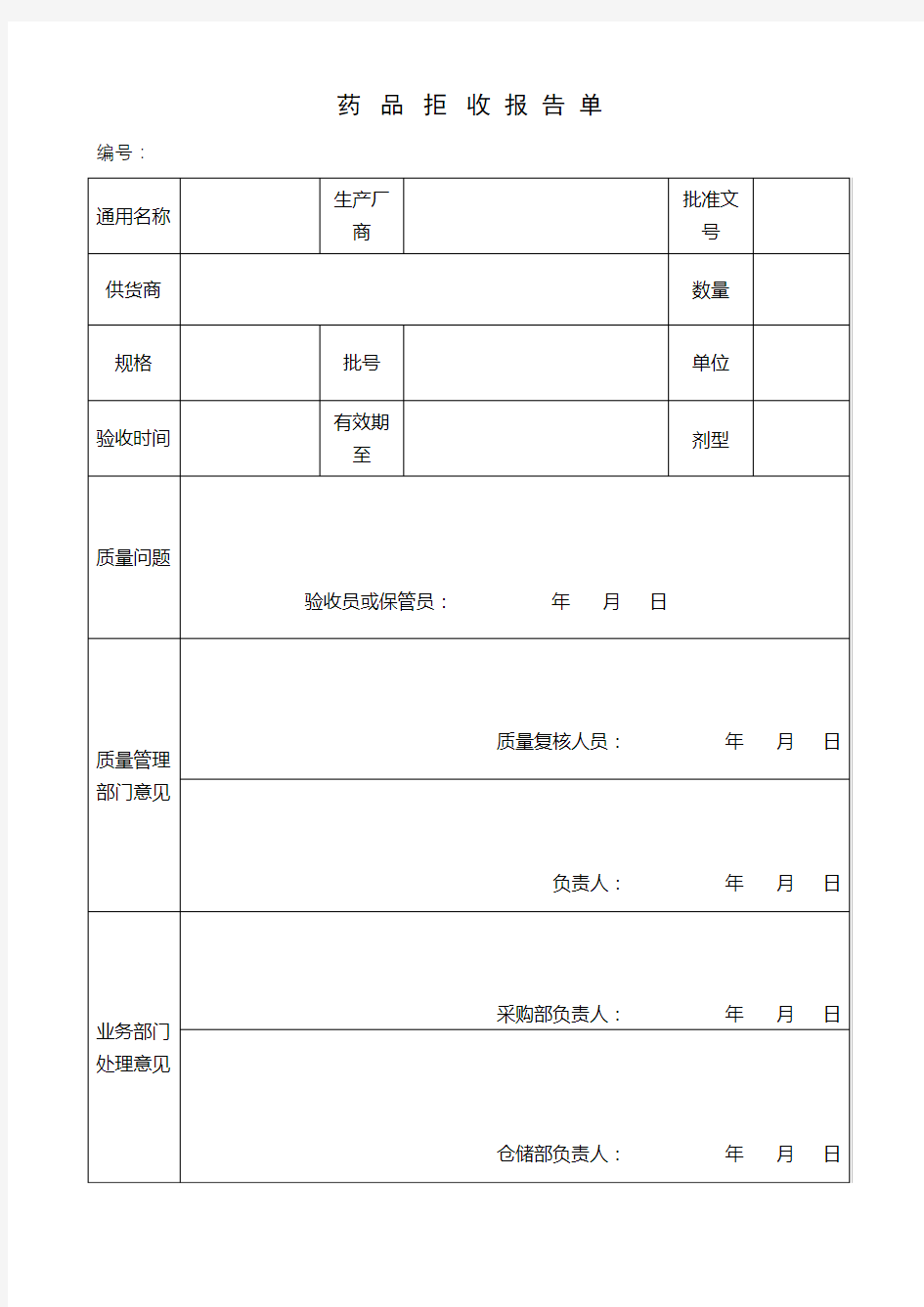
药品拒收报告单编号:
医药有限公司不合格药品管理制度 目的:保证药品质量、防止不合格药品注入市场,特制定本制度。 范围:储运部、质管部、采购部、销售部、财务部。 内容: 1、公司人员在验收、检验、保管、养护和销售过程中发现有药品不符合相关的质量标准及有关规定时,应立即停止进货,并按本制度采取措施。 2、验收员在验收过程中发现药品不符合验收要求及有关规定时,应先填写《药品拒收报告单》,上报质管部审核,质管部审核确认该批药品不合格后应立即封存,按不合格药品管理制度处理并上报上级药监部门。 3、保管、养护过程中发现在库药品有质量问题,保管人员应立即将该批药品移入待验区,停止发货,立即上报质管部与主管领导。并对临近批次药品进行严格审查,若发现问题也应予以标识。确认为不合格的药品应存放在不合格品库(区),按不合格药品管理制度处理。
4、质管部负责不合格药品的调查、监控与处理: 4.1质理管理部负责对造成不合格的原因进行调查,填写《不合格药品报损审批表》,详细说明药品品名、产品、批号、生产企业、不合格原因、标准规定及验收的结果,分析造成不合格拉三扯四在,提出对不合格药品的处理意见,经质管部负责人签字后送主管领导和总经理审批,经审核批准后对不合格药品进行处理; 4.2登记《不合格药品台账》,并作为该品种进货的审核依据; 4.3查出内在质量不合格的药品应上报药品监督管理部门; 4.4经质管部判定需要销毁的不合格药品,应填写《不合格药品销毁审批表》,质管部负责人与主管领导审核批准后,在质量管理人员监督下销毁或交药品监督管理部门处理,并填写《不合格药品销毁记录》,执行人和监督人分别在记录上签字,送质管部归档保存; 4.5业务部、仓储部对需要销毁的不合格药品,填写《不合格药品报损审批表》经总经理批准后交财务部进行处理; 4.6对由于保管、运输等本公司管理原因而造成药品不合格,及时处理并制定应采取的措施,分清质量责任。纠正措施确定后,各有关部门负责纠正措施的落实,质管部负责实施的监督。
《异常改善报告单》 智 得 電 子 制 品 有 限 公 司 異常改善報告單(□品質 □RoHS □環境安全 □其它) 異常發生日:*年*月*日 異常類別: □不良單 □抱怨單 □退貨單 □反饋單
NO._______ 1.異常現象(發出單位填寫,盡可能數據化): 客戶 材質 料號 派工單號(訂單號): 本批量 抽樣數 不良率 核準: 審核: 承辦: 2H完成信息傳達 4H作出應急方案 單據10個工作日內結案 並附異常專題檢討記錄表 2.調查處理 (品保部填寫): 核準: 審核: 承辦: 改善單位/
責任比 9糾 9預 9糾 9預 9糾 9預 是否需裁定: 9 是 9 否 簽名: 處理單位 3.生管(控)確認: 處理期限_______(工作H) 9不補需求9另補需求 9是9否____________(單位)開制程不良委托作業單委托 ___________(單位)作業(注:若開出此單則以下流程6、7不必執行;屬制程開出不良選別或重工后,數量須返回制程,見>,該單需要時提出). 部門主管:
4.1原因分析(改善單位填寫,分析入手:5M1E) 細部內容如有請另附 4.2糾正預防(改善單位填寫,改善入手:5W2H) 核準 審核 承辦 5.品質改善委員會(環境安全類:管理代表)批示: 處理部門 6.處理記錄(處理單位填寫): 部門主管: 項目 數量 費用 擔 當 7.處置狀況: 部門主管: 生管(控)填寫 報廢 重工 全檢 返電
8.結案追蹤 確認 流程(填寫不適用處劃“/”):不良單 抱怨單 退貨單(品保部完成2~8傳遞) :1→2→3→4→5→6→7→8(品保部結案存檔匯總); 反饋單: 1→4→5→8(反饋單位開立→品保部登錄立案→反饋單位跟進結案→復印品保部存檔匯總) 表單編號:420602 第 1 版 記錄保存:3年 智 得 電 子 制 品 有 限
不合格药品管理规定 This model paper was revised by the Standardization Office on December 10, 2020
不合格药品管理制度 1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符, 包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的.(3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销
售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问题药品、属假劣药品范围的不合格药品应报废,并在药品监督管理部门的监督下进行销毁处理。 10、不合格药品的确认、报告、报损、销毁应有完善的手续和记录。
( 安全管理 ) 单位:_________________________ 姓名:_________________________ 日期:_________________________ 精品文档 / Word文档 / 文字可改 不合格药品管理制度(新编版) Safety management is an important part of production management. Safety and production are in the implementation process
不合格药品管理制度(新编版) 1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符,包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的. (3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录.
4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问题药品、属假劣药品范围的不合格药品应报废,并在
XX课程诊改报告 一、课程设立的必要性 本课程是专业核心课程。其任务是:。按照人才培养方案的要求,通过学习本课程可以达到以下目标:(一)知识目标 1. 2. 3. (二)能力目标 1. 2. 3. (三)职业情感目标 1. 2. 3.
二、教学内容的选取 通过行业企业调研,重点分析制冷工的主要工作岗位,总结出职业岗位的典型工作任务,并将其职业能力结合岗位所对应的国家职业技能标准要求,序化出主要教学知识点。 三、教学方法与教学手段 根据本课程的特点,在教学中采用讲授法、小组讨论法、直观演示法、任务驱动法等多种学习方法,并且结合先进的信息化教学手段,有效解决教学重点,突破教学难点,提高课堂效率及教学质量。 (一)多种教学方法的运用 1.任务驱动法 该方法的具体实施过程为:按照基于工作过程的步骤来组织教学,即了解资讯——方案设计——方案确定——实施工作过程——过程检查——工作评价,由此培养学生整体工作过程概念和工作组织方法等。 2.直观演示法 使用多媒体设备和软件,充分利用多媒体、网络等数字资源进行各类操作、工艺过程的演示。 3.小组讨论法 为了达到教学目标,结合课程内容特点,教师将不同层次的学生进行编组,学生以小组为单位开展自主性学习活动。通过分组学习能够充分调动学生的主观
能动性,并且有利于培养学生的团队合作能力与协调沟通能力。 (二)现代教学手段的应用 信息技术的高速发展其在教育领域的广泛应用,极大改善了课堂教学条件。通过在教学过程中大量使用信息化教学手段,如PPT教学课件、教学视频、微课短片、仿真软件、云班课等,解决学生课前预习、课后复习、自主学习等问题,加强教学互动及教、学过程的监管与评价,从而达到提高教学效率、增强教学效果的目的。 四、课程考核 为全面考核学生的知识与技能掌握情况,本课程采用形成性考核与终结性考核相结合的考核方式。 五、课程建设的主要问题 1.该课程虽然经过几年多年的摸索实验,取得了一定的教学成果,但在教学经验和学术积累上仍存在不足,需要进一步总结、完善。教学实训室由于经费、场地等因素,制约了实训教学发展。此外,在实训室配备和图书资料收集上还有待进一步加强。 2.教学资源没有得到及时的优化、提升和更新。现代的信息化教学日益盛行,学生也乐于接受。目前的教学资源已经不能适应当下的教学要求,首先将现有的教学资源进行整合和提升,使其转变为同学们乐于接受的现代化信息教学模式;并将其在网络教学平台上呈现,实现教学线上线下相融合的学习模式。 六、课程建设改进措施 1.根据学校总体发展规划,以精品课程建设为龙头,以高素质技能型人才培
1 目的:通过产品首检及工序确认,在无品质异常的情况下投入生产,防止批量不良的发生。 2 适用范围:本规程适用于公司所有产品的生产过程。 3 概念区分 3.1 产品首检:批量生产开始时,对最先按产品规定要求加工完成的一定数量的完成品进行外观、尺寸、电性能、可靠性等方面的检验和试验活动。 3.2工序确认:每天上午、下午、晚上工作开始时及生产过程中其它必要情况下,按规定数量对各工序最初加工好的在制品进行确认,确保无品质异常。 4 职责:工程内质检员负责产品首检及工序确认工作,并填写相关的记录表;组长负责记录表的确认,根据情况决定投入生产或采取纠正措施,并及时向科长汇报;科长负责督导和必要的指导工作,出现问题时及时向制造主管汇报以便必要时调整生产安排。 5 控制规程 5.1产品首检 5.1.1产品按订单数量投入批量生产时,取最先加工完成的5件,由工程内质检员进行外观、尺寸、电性能等方面的检查和测试,然后填写《产品首检报告》,并根据产品规定要求做出符合性判定。 5.1.2凡产品按规定要求要进行可靠性例行实验的,质检员送例行实验室,由实验室专门人员进行实验及填写实验结果做符合性判定。 5.1.3规定的检查、测试、例行实验项目完成后,质检员把填写好的《产品首检报告》交组长确认。 5.1.4组长对《产品首检报告》进行审核,确认符合性判定是否无误 (必要时要对首检品进行验证)。 5.1.5首检品各项指针均符合产品规定要求时,组长可通知生产班组进行生产,若有不符合项目时应马上报告科长,由相关人员进行原因分析及采取纠正、预防措施。 5.1.6工单数量没有一次性完成,即间断后再生产时或换班组生产时,要按上述规定再次进行产品首检。
药品质量问题处理报告单 药品质量问题处理报告单 ?vbnert | 2009-09-10 16:00:34 ?有0人认为这个回答不错 | 有0人认为这个回答没有帮助 ?不合格药品管理程序 广州市东山区百济抗肿瘤药房 文件名称:不合格药品管理程序 编号:CX-BG-8-1 起草人: 审核人: 批准人: 颁发人: 起草日期:20050216 审核日期:20050218 批准日期:20050222 执行日期:20050224 分发人员:质量管理部门、购进部门、仓储部门、销售部门 1、目的:建立不合格药品控制性管理程序,规范不合格药品的管理工作。 2、依据:《药品经营质量管理规范》。 3、适用范围:本程序规定了企业不合格药品控制性管理的内容、方法和要求,明确了相关部门或 人员的职责,适用于药品验收、在库养护、和销售过程中发现的不合格药品的处理。 4、职责:质量管理部门、购进部门、仓储部门、销售部门对本程序的实施负责。 5、内容: 5.1 不合格药品的发现: 5.1.1 购进验收时不合格药品的发现:药品验收人员根据药品法定标准和购进合同规定的质量条款对购进药品进行验收,遇以下药品质量问题,需填写《药品拒收报告单》,报质量管理人员确认。 5.1.1.1 破损、污染、短少。 5.1.1.2 包装、标签、说明书不符合规定 5.1.1.3 批号、有效期不符合规定。 5.1.1.4 进口药品通关单不符合规定。 5.1.1.5 假药、劣药。 5.1.2 在库养护不合格药品的发现:在库发现以下质量可疑药品,需填写《药品质量复核单》,
报质量管理部门确认。 5.1.2.1 保管人员发现的质量可疑药品。 5.1.2.2 养护人员对在库药品养护检查中发现质量有疑问的药品。 5.1.2.3 超过有效期的药品。 5.1.3 售后不合格药品的发现:销售部门对售后药品发现质量问题或疑问应填写《药品质量复核单》,报质量管理部门确认。 5.1.3.1 购货单位发现质量不合格或有疑问而以口头、电话、书面函件等形式向销售人员或销售部门反映的药品。 5.1.4 供货单位发现留样有质量问题而通知购货单位回收的药品。 5.1.5 药品监督管理部门发文要求停止使用或回收的药品。 5.2 不合格药品的报告: 5.2.1 验收人员填写《药品拒收报告单》后,向质量管理人员报告。 5.2.2 养护人员、出库复核人员填写《药品质量复核单》后,向质量管理部门报告。 5.2.3 销售人员填写《药品质量复核单》后,向质量管理部门报告。 5.2.4 验收人员、销售人员在发生以下情况时,应立即向质量管理部门报告: 5.2.4.1 在药品经营过程中发现假劣药品。 5.2.4.2 销售人员被购货单位口头、电话或书面告之所销售药品发生新的或严重的不良反应以及发生临床事故。 5.2.5 质量管理部门接到购货单位口头、电话或书面通知有关5.2.4所述情况时,应立即向当地药品监督管理部门报告并做好记录。 5.3 不合格药品的确认: 5.3.1 验收过程中不合格药品的确认:质量管理人员根据《药品拒收报告单》所反映的情况,依据国家有关法规及企业内部有关规定,对验收过程中质量有疑问的药品进行复核,确认为不合格药品的予以签名,并通知保管人员将该药品移至不合格药品库(区)。 5.3.2 在库养护不合格药品的确认: 5.3.2.1 质量管理部门根据有关的法规和企业内部的规定对有质量疑问的药品进行质量复核,确认为不合格药品的予以签名,并通知保管人员将该药品移入不合格品(区)。 5.3.2.2 抽样检验为不合格药品的,即通知保管人员移入不合格库(区)。 5.3.2.3 质量管理部门对在库有效期还有10天的药品作停售处理,通知保管人员将这类药品移入不合格品库(区)。 5.3.3 售后不合格药品的确认: 5.3.3.1 销售部门接到购货单位口头或电话、书面等形式反映药品质量有问题后,应立即填写《药品质量复核单》,并向质量管理部门报告;质量管理部门立即与购货单位联系核实,必要时,抽样送法定检验机构确认。 5.4 不合格药品的处理:不合格药品由质量管理部门负责处理,并做好不合格药品处理记录。5.4.1 移库与存放: 5.4.1.1 质量管理部门进行现场复核,确认为不合格药品后,填写“移库单”,通知保管人员将药品移入不合格药品库(区)存放。 5.4.1.2 质量管理部门现场复核后不能确认的,应开具“抽样单”抽样送法定的药品检验机构检验(在购货单位抽样时,应征求购货单位同意),裁定为不合格药品的,填写“移库单”通知保管人员将其移入不合格品库(区)存放。在检验期间,库存药品应存放在待验库(区),并放置明显标志。 5.4.1.3 质量管理部门接到销售人员的《药品质量复核单》后,应首先暂停在库同批号药品的销售,并与购货单位联系核实(必要时,抽样送法定检验机构检验);确认为不合格药品时,填
一、目的:通过制定实施不合格药品质量管理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。二、职责:质量管理部、业务部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。 三、范围:适用于不合格药品处理的全过程。 四、主要内容: 1.不合格药品的定义: 凡不符合国家有关法律、法规,不符合药品质量标准,包装不符合规定以及药监部门明文规定禁止销售的药品均属不合格药品。有以下情形的,按不合格品处理: 1.1《药品管理法》规定的假药、劣药。 1.2质量证明文件不合格的药品。 1.3包装、标签、说明书内容不符合规定的药品。 1.4包装破损、被污染,影响销售和使用的药品。 1.5批号、有效期不符合规定的药品。 1.6各级药品监督管理部门公告的抽检不合格的。 1.7各级药品监督管理部门发文通知禁止销售的。 1.8质量管理部抽样送检确认不合格的。 2.不合格药品的处理: 2.1购进验收时发现不合格药品的:
2.1.1验收员进行验收时,填写《药品采购入库质量验收记录单》后,根据拒收数量自动生成《药品拒收报告单》报质量管理部。质量管理人员依据《药品拒收报告单》所反映的情况,依据国家有关法规及企业内部有关规定,对验收过程中质量有疑问的药品进行复核,确认为不合格药品的予以审核,通知采购员填写《到货拒收单》,及时通知供货方,并按购销合同或质量保证协议的有关规定进行处理,并通知保管员将货物放到退货区,同时若确认为不合格品的药品应存放于不合格品库(区); 2.1.2验收员进行验收时,填写《药品采购入库质量验收记录单》后,如填写了不合格品数量,则通知质量管理人员进行处理判定,质量管理员根据实际情况,并依据判定标准,做出相应的处理意见,在系统内参照生成《不合格品处理审批单》,并经过质管部负责人、质量负责人二级审批后,将确认为不合格品的药品存放于不合格品库(区),做好标识,等待处理,处理意见一般分为三种,直接报损,入库报损,先暂存后退货。 2.1.3处理意见为直接报损:质管员填制《不合格品记录单》,之后保管员填制《不合格品报损审批表》,经业务部经理、质量管理部经理、财务部经理、质量负责人签署审批通过后,质量管理部出具《不合格药品报废销毁审批表》,指导相关人员按法律法规要求将不合格药品进行处理,并及时在系统中维护《不合格药品报废销毁记录》,登记《药品销毁记录》,系统自动生成《不合格药品台账》。 2.1.4处理意见为入库报损:业务部根据《不合格品处理审批单》的结果,办理入库业务,后按照2.1.3的处理规程执行 2.1.5处理意见为先暂存后退货:业务部根据《不合格品处理审批单》的结果,办理入库业务,后按照《销售退回操作规程》执行。 2.1.6在销后退回验收时有发现可疑或不合格药品的,应按照2.1所规定的处理规程处理。 2.2在库内检查、养护过程、出库复核时发现不合格药品的: 2.2.1保管员、养护员或复核员在工作发现药品质量可疑或不合格药
不合格药品管理制度 1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符, 包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的.(3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单” 进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问 题药品、属假劣药品范围的不合格药品应报废,并在药品监督管理部门的 监督下进行销毁处理。 10、不合格药品的确认、报告、报损、销毁应有完善的手续和记录。
首件检验报告的主要容:Content: 1. 首件检验的原因 reason for FAI 2. 零部件的基本数据 date of the items 3. 检验结果 result 4. 文件检查情况 documentation check 5. 零部件检查情况 check of the components 6. 改进的措施清单及建议list of measures, recommendation 7. 附件 appendices 8. 参加人员 participants
放行产品的详细情况: 满足第6点的规定义务 results, release given conditions acc. to Yes 1): Release with stipulation. The production release is to accept under reserve of conditions mentioned at chapter 6. 是1):按约定放行。在第6章提到的约定条件下接受产品放行。 signature 2) release by the leader of the FAI or his deputy 签字2):由首件检验组长或其代表放行。
o.k. = fulfilled满足 n.o.k. = failed不满足 SPQ3) -> supplier product qualification (specifically MOR requirement)供方产品资质(特别是铁道部要求)
备注:o.k. = fulfilled满足 n.o.k. = failed不满足 6. list of measures,recommendations 改进措施清单及建议6.1 list of measures措施清单
个人工作改善报告书范文3篇 事务改善是指间接部门的改善活动,目的主要是消除各类管理损耗、减少间接人员、改进管理系统、提高办事或事务效率,更好地为生产活动服务。*是为大家整理的工作改善报告范文,仅供参考。 工作改善报告范文篇一 我于12月1日正式成为东方CJ顾客中心商谈7组组员,成为正式员工已有3个月左右的日子,在最近的1个多月里,我的情况不敬如人意,已经犯下了多次商谈错误,并且被领导谈话教育。在此,辜负了领导及同事对于我的信任,深表歉意。在这段时间里,我进行了深刻的反思,归根结底主要问题出在以下2点: 1.对工作态度的散漫 由于在起初的2个月里没有犯下致命错误,并且成为正式员工已有一段时间,造成了自满的情绪,忽略了自己的不足点,所以在工作中,缺少主动性,对我组老员工提出的建议也是听过算数,没有认真思考并加以改善。随着工作态度的下降,业务看的少了,对工作的关心程度,参与度也少了,在商谈中抱着侥幸的心理去应对。导致了QA成绩下降,犯下商谈员错误等一系列问题。
2.对工作失去热情 在工作了一段时间后,渐渐发觉每天的工作就是重复接听电话,也没有空余的时间来调节自己,与同事之间缺乏沟通交流。每天上班变的枯燥乏味起来,对商谈产生了抗拒的心理。 改进目标 通过总结以上两点问题,改变自己对工作态度上的散漫,提高自己对工作的职业操守。争取在以后的工作中提高自己的QA 成绩,重新得到领导和同事的信任。 改善措施 针对以上两点问题,首先严格要求自己,有空余时间就看KMS和共享等,以加强我司业务流程及应对方法,提高自己的工作效率和商谈技巧,有不懂的地方多寻求领导或老员工的帮助,同时对出现的问题及自己的薄弱环节加以思考并改进。在商谈过程中做到思想集中,对客户情切,耐心等基本QA要求,用心应对。提高自己的商谈水平。其次,对工作多一点参与和关心,多与我组的优秀员工进行交流取经,以此来提高自己的工作经验。领着这份薪水就应该对得起它,提高自己的职业素养和个人修养,认真完成每一份工作,吸取各位每一份建议。 在此,我下决心努力工作,希望在将来的工作中通过自己的努力能使自己提高,取得进步,请大家督促。谢谢
检验科标本拒收规则及标准 为防止不合格标本的检验结果用于患者的诊疗过程,遇以下情况将按SOP文件要求拒收标本: 1. 申请单无检验项目或检验项目不清楚的标本,非本实验室检验项目的标本。 2. 姓名明显变更,或出现多个姓名,无法确认标本正确归属的。 3. 申请单和标本已经分离,标本容器上又无明确患者标识。 4. 空管,标本量不符合规定要求的(见《检验科项目组合及标本保存运输表》)。 以下为详细说明: 1) 三全或两全组合,总血量少于3ml,离心后血清或血浆量少于1.5ml 2) 生化少于15项的组合,总血量少于2ml,离心后血清或血浆量少于1ml 3) 生化少于5项组合或单项,总血量少于1ml,离心后血清或血浆量少于500μl 4) 尿生化标本少于1ml 5) 血氨检测未抽满一管 6) 出凝血标本过多或过少,超出允许范围±15% 7) 血液常规标本采血量少于1ml 8) 血沉标本血量不符合1.6ml 9) 尿液常规标本少于4ml 10) 尿液沉渣标本量少于10ml
11) 大便标本量极少(少于1粒黄豆量) 5. 收集容器不正确,如血清标本用了抗凝管,血浆标本错用普通管,用普通大便 盒留取培养标本等。 6. 检验标本类别不符,如申请单注明血,但送检标本为胸水。 7. 标本外部有严重的遗洒、渗漏,怀疑标本可能交叉污染的。 8. 经询问确认标本采集部位不正确的或患者状态不适合做相应检查的,如正在 9. 输入脂肪乳的患者检测血脂,正在输入葡萄糖的患者抽血测定血糖。 10. 经询问,确认标本超过标本允许送达时间的,如尿液沉渣标本送检时已超过2 小时,或非晨起第1次或第2次尿标本,如检测项目中包含K、Glu、P、TCO2、LA、HCY、胆红素,则超过2小时拒收,如检测项目中包含Amon的标本血气标本超过30分钟拒收。允许送达时间见《检验科项目组合及标本保存运输表》。 11. 经询问确认标本保存、运输方式不正确的,具体保存方式见《检验科项目组合 及标本保存运输表》。 12. 出凝血项目标本、血常规标本出现凝块。 13. 标本离心后出现溶血(除外新生儿、烧伤及血管内溶血患者);对于新生儿、 烧伤患者溶血标本,以下项目由于影响较大不进行检测:K、Cr、LD、AST、CK、
不合格药品管理制度示范 文本 In The Actual Work Production Management, In Order To Ensure The Smooth Progress Of The Process, And Consider The Relationship Between Each Link, The Specific Requirements Of Each Link To Achieve Risk Control And Planning 某某管理中心 XX年XX月
不合格药品管理制度示范文本 使用指引:此管理制度资料应用在实际工作生产管理中为了保障过程顺利推进,同时考虑各个环节之间的关系,每个环节实现的具体要求而进行的风险控制与规划,并将危害降低到最小,文档经过下载可进行自定义修改,请根据实际需求进行调整与使用。 1、不合格药品是指:药品的包装不合格、外观质量不 合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知 或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、 包装、标识不符,包装污染、破碎及超过有效期的药品, 并报质量管理员确认为不合格的. (3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药
品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理
改善报告范文精选 改善报告是针对于存在的问题或关系进行改善和调整,一起达到最佳的效果,一般是针对自身存在的问题进行改善,以下是小编整理的改善报告,欢迎大家参阅。 第1篇:改善报告 广州总厂储运课: 我司201x年3月份与4月份从广州发至石家庄、苏州和昆明的货物因混装现象严重导致拒收货物颇多,针对此事,特此报告,分析造成原因并提出改善措施。 从屡次拒收事件,我司了解,造成拒收的原因主要有以下三点: 1、司机接了货急着装,将货送到目的地市,直接转到零担站,请零担站重新装车送至分公司。 2、司机将货送到送达方,但送达方无法尽快给司机卸货,司机将货转到零担站,请零担站重新装车送至分公司。
3、市场上的车主找货时,没有寻到整车,在我司不知情的情况下,先装我司的货,然后出去配其他货,导致混装和破损的情况比较严重。 对此,我司经过协商与讨论,制定以下针对措施: 1、我司将派专门跟踪车辆的工作人员,及时了解司机送货情况,保证货物直接送达分公司。 2、及时了解司机卸货情况,为司机解决卸货问题,或者与司机沟通延迟卸货。 3、派车前与司机签署整车运输合同,不允许司机外出配货。 我司因混装严重给贵司带来的不便之处深感抱歉,在后期的合作中,我司一定着重不断改善此类事件,按质按量承运贵司货物。特此报告。 顺致商祺! 顺鸿实业有限公司 二0一x年五月十一日 第2篇:不良品改善报告怎么写 首先,你要明白一个道理,让你写改善报告并不是追究你的责任,而是让你这样的第一当事人想出不让这样的事再发生的办
法,以杜绝同样的事或带有普遍性类似相同点的事再发生,正所谓“没有解决不了的问题,只有发现不了的方法!”明白了这个道理后再写这报告就不会有什么心理负担了,写起来就简单了。 (1)写出不良产生的原因,是什么原因就写什么原因。要写清是什么时间在哪里发生的是怎么发生的,是谁发现的发现后采取了什么临时措施就是所谓的对策。一共发现不良品多少台,是否全数追回等等。 (2)写出你能想出的最简单、最有效的杜绝此类事件再发生的方法也就是所谓的改善。这样的改善最好对事不对人,改善结果应适用于此类事件不再发生,不能只针对你一个人,或一小群人而是适用于每一个人,要不然,就没有意义了。 第3篇:改善医患关系的调研报告 医患关系是医务人员与患者在医疗过程中产生的一种特殊关系。近年来,我院医疗纠纷和医闹事件时有发生,医患关系矛盾突出,给正常的医疗秩序带来了严重的影响。在行业评议中也处在末尾,为了缓解紧张的医患关系,构建和谐医院,我院开展了关于改善医患关系的调研,通过与患者及医护人员的交流,现将调研有关情况报告如下: 一、我院产生医患关系紧张的原因:
CB36 报告单 (中水十一局[2018]首报001号) 合同名称:引江济淮工程(安徽段)江水北送段施工标(二标段)西淝河朱集站~龙德站段河道工程合同编号:YJJH-JSBS-GC-20180126034 注:1、本表一式份,由承包人填写。监理机构、签署意见后,发包人份、监理机构份、承包人份。
中国水利水电第十一工程局 引江济淮江水北送段施工二标河道工程T梁预制首件施工总结 编制: 审核: 批准: 中国水利水电第十一局有限公司 引江济淮江水北送段施工二标项目部 2018年12月
目录 一、工程概况 (1) 二、开展首件施工目的 (1) 三、首件施工设备及人员配置情况 (1) 四、施工工艺流程及工序施工要求 (2) 五、首件制工程质量评价 (3) 六、施工中针对质量通病采取的措施 (3) 七、整改要求 (4) 附件:施工明白卡
T梁预制首件工程施工总结 一、工程概况 本标段范围为西淝河上段朱集站~龙德站河段(桩号112+715~155+519)全长 42.80km。本标段梁板预制主要为桥梁工程中的梁板,梁主要为T梁,T梁跨度分为 25m、30m两种。其中龙德~坟台公路桥全部采用跨度为30m的预应力混凝土简支T梁,梁高2.0m,全桥共计15片T梁。古梅桥采用25m+30m+25m预应力混凝土简支T梁,全桥工12片T梁,其中30mT梁4片,25mT梁8片。两边跨采用25mT梁,梁高1.7m,梁肋宽48cm。翼缘厚16cm;中跨采用30mT梁,梁高2.0m,梁肋宽50cm。翼缘厚16cm; 25mT梁与30mT梁边梁和中梁均等宽,全桥T梁宽度均为1.7m。 二、开展首件施工目的 通过对T梁预制首件工程的实施,熟悉了设计规范及技术要求,根据T梁预制施工特点,确定质量验收标准及特殊要求;通过T梁预制首件工程的实施,完善了施工方案,施工工艺、操作规程,且充分显现出材料、人员、设备、工艺、环保对工程质量的影响程度,便于总结经验,加强管理,避免施工后期造成返工,为规范化施工创造条件。 三、首件施工设备及人员配置情况 机械设备配置表 施工人员配置表
检验科检验报告单书写制度 1、检验报告单是疾病诊断及治疗的重要参考依据,也是病人知情权的一种体现,因此,对检验单内容、格式、报告及发放有必要作详细的规定,指导检验人员正确书写检验报告,为患者提供完整、正确、规范、及时的检验报告。 2、检验结果审核人员和检验人员对检验报告的正确性、及时性及规范性负责,实行双签字制度。科主任对检验报告发放流程及监督负责。 3、临床医生(具有职业医师的资格)申请检验项目(化验单申请)必须规范填写(包括病人姓名、性别、年龄、住院号、床号、临床诊断、科别、标本种类、送检日期、送检医生),对申请内容含糊不清或缺项的,本科人员应退回修改,并在标本拒收记录本上登记。 4、检验报告内容应包括检验项目中文名称、报告单位、标本类型、参考范围、异常值提示、唯一编码、标本采集和接收日
期时间、报告日期时间、备注、检验者和报告者的双签名。报告单书写必须规范,严禁涂改,严禁使用热敏打印或打印不清楚的报告。 5、检验报告经审核后,门诊病人自取,病区的检验报告单由病房值班护士来取送到病区。在报告单发放过程中,要注意保护好病人的隐私,不得随意泄漏病人检验结果,病区办公室只限于医务人员进入电脑(或病历)查看病人检验报告。 6、即时检验(POCT)检验报告:由检验科负责质量监督,报告单书写要求有专用POCT报告格式,检验科定期检查POCT检验报告书写质量,对书写不规范、采用热敏纸打印,单位用错,缺项等报告单,及时纠正。 7、发送报告单时严格执行查对制度,避免报告单的丢失、遗落。报告单如有丢失,实验室负责查找、补发报告。 8、检验报告单应严格执行生物安全相关规定,污染的报告单必须经消毒后再发放。 9、检验报告单发放时间的规定:急诊优先原则。 10、临床医生和护士收到报告单应妥善保管,粘贴在病历上应整齐,严禁在检验报单上任意的涂改、划线、做记号或列公式等不规范的行为。