
1 绪论 1.1在银催化剂上进行甲醇氧化为甲醛的反应: 3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+ 进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算 (1)反应的选择性; (2)反应器出口气体的组成。 解:(1)由(1.7)式得反应的选择性为: 0.629Y S 0.961196.11% X 0.720==== (2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为 2由甲醇的转化率达72%2y x +=72%; 4 .27x =69.2% 解得x=18.96; y=0.77 所以,反应器出口气体组成为: CH 3OH: %1002 21004.27?+ +--y x y x =6.983%
空气: %1002 210023279.54?+ +-- y x y x =40.19% 水: %10022100281.17?+ +++y x y x =34.87% HCHO: %10022100?+ +y x x =17.26% CO 2: %1002 2100?+ +y x y =0.6983% 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下: 23CO 2H CH OH +? 23222CO 4H (CH )O H O +?+ 242CO 3H CH H O +?+ 24924CO 8H C H OH 3H O +?+ 222CO H O CO H +?+ 由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。下图是生产流程示意图 放空气体 Akmol/h 原料气和冷凝分离后的气体组成如下: 组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82
化学反应工程知识点 —郭锴主编 1、化学反应工程学不仅研究化学反应速率与反应条件之间的关系,即化学反应动力学,而且着重研究传递过程对宏观化学反应速率的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。 2、任何化工生产,从原料到产品都可以概括为原料的预处理、化学反应过程和产物的后处理这三个部分,而化学反应过程是整个化工生产的核心。 3.化学反应工程的基本研究方法是数学模型法。数学模型法是对复杂的、难以用数学全面描述的客观实体,人为地做某些假定,设想出一个简化模型,并通过对简化模型的数学求解,达到利用简单数学方程描述复杂物理过程的目的。模型必须具有等效性,而且要与被描述的实体的那一方面的特性相似;模型必须进行合理简化,简化模型既要反映客观实体,又有便于数学求解和使用。 4.反应器按型式来分类可以分为管式反应器、槽式反应器(釜式反应器)和塔式反应器。 5反应器按传热条件分类,分为等温反应器、绝热反应器和非等温非绝热反应器。 第一章 均相单一反应动力学和理想反应器 1、目前普遍使用关键组分A 的转化率来描述一个化学反应进行的程度,其定义为:0 0A A A A A A n n n x -==组分的起始量组分量转化了的 2、化学反应速率定义(严格定义)为单位反应体系内反应程度随时
间的变化率。其数学表达式为dt d V r ξ1=。 3、对于反应D C B A 432+=+,反应物A 的消耗速率表达式为dt dn V r A A 1-=-;反应产物C 的生成速率表达式为:dt dn V r C C 1= 4.反应动力学方程:定量描述反应速率与影响反应速率之间的关系式称为反应动力学方程。大量的实验表明,均相反应的速率是反应物系的组成、温度和压力的函数。 5.阿累尼乌斯关系式为RT E C C e k k -=0,其中活化能反应了反应速率对温 度变化的敏感程度。 6、半衰期:是指转化率从0变为50%所需时间为该反应的半衰期。 7、反应器的开发大致有下述三个任务:①根据化学反应动力学特性来选择合适的反应器型式;②结合动力学和反应器两方面特性来确定操作方式和优化操条件;③根据给定的产量对反应装置进行设计计算,确定反应器的几何尺寸并进行评价。 8.在停留时间相同的物料之间的均匀化过程,称之为简单混合。而停留时间不同的物料之间的均匀化过程,称之为返混。 9.根据返混情况不同反应器被分为以下类型:间歇反应器、理想置换反应器(又称平推流反应器或活塞流反应器)、全混流反应器(又称为连续操作的充分搅拌槽式反应器)。 10.反应器设计计算所涉及的基础方程式就是动力学方程式、物料衡算方程式和热量衡算方程式,其中物料衡算所针对的具体体系称为体积元。 11、停留时间又称接触时间,用于连续流动反应器,指流体微元从反
4-1 在定态操作反应器的进口物料中脉冲注入示踪物料。出口处示踪物浓度随时间变化的情况如下。假设在该过程中物料的密度不发生变化,试求物料的平均停留时间与时间t/s 0 120 240 360 480 600 720 840 960 1080 示踪物浓度 / )/(3cm g 0 0 0 t/min 2 4 6 8 10 12 14 16 18 3/cm g c i 0 0 0 min /1)(i t E 0 0 0 i i t E t )( 0 0 0 min )(2i i t E t 0 2 5 0 0 ])(2)(4[3109753864210c c c c c c c c c c t dt c i +++++++++?=?∞ ]0)5.20.1025.1(2)0.10.55.125.6(40[3 2++++++++= =100 min)/1(100) ()(0 ti i c dt c t c t E ==? ∞
} )(])()()()([2])()()()([4)({3 10109977553 38866442211_ t E t t E t t E t t E t t E t t E t t E t t E t t E t t E t t t +++++++++?= ]0)03.08.05.0(2)14.05.075.013.0(40[3 2 +++++++++=min 187.6= ?∞ =-=-=0 22 2 2971.8187.625.47)(t dt t E t t σmin 2 4-2 无量纲方差表达式的推导 (1)推导无量纲方差2 22 /t t σσθ=; (2)推导CSTR 的2 2t t =σ。 1. τ θt = 2. τ τ t e t E - =1 )( 证明: 20 22)(i i i i t t t t E t -?=∑∞σ ? ∞ --= 2 21 t dt e t t τ τ 2 2)()()()(ττθθττθ--=?∞ - d t E ()]1)1([0 22 --=?∞ θθθτd E 22θστ= 222/τσσθt =∴ 220 2 2 2)(1 )(- - ∞ -=-=??t dt e t t dt t E t t t ττ σ
第一章习题 1 化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系? 答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。 2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么? 何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。基元反应符合质量作用定律。基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。基元反应的反应级数是该反应的反应分子数。一切不符合质量作用定律的反应都是非基元反应。非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。 3 若将反应速率写成t c r d d A A - =-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。 4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。 5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。 (1)A+2B →C (2)A+2B →C (3)2A+2B →C A+C →D B+C →D A+C →D C+D →E 解
(1) D 4C A 3D D 4C A 3C 22 B A 1C C 22B A 1B D 4C A 3C 22 B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-= (2) E 6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22 B A 1C D 4C B 3C 22B A 1B C 22 B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-= (3) D 4C A 3D D 4C A 3C 22 B 2A 1C C 22B 2A 1B D 4C A 3C 22 B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-= 6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65× 104m 6kmol -2s -1。现以气相分压来表示速率方程,即(?r A )=k P p A p B 2 ,求k P =?(假定气体为理想气体) 解 ()3 -1-363111 2643c P 2 B A p A 2 B A c 2 B A c A 1264c kPa s m kmol 10655.1K 303K kmol kJ 314.8s kmol m 1065.2)(s kmol m 1065.2K 30330273--------??=???= ==-? ? ? ??==-= ?==+=RT k k p p k r RT p RT p k c c k r RT p c k T
4管式反应器 4.1在常压及800r 等温下在活塞流反应器中进行下列气相均相反应: C 6H 5CH 3 H 2 C 6H 6 CH 4 在反应条件下该反应的速率方程为: r 1.5C T c H .5,mol /l .s 式中G 及G 分别为甲苯及氢的浓度,mol/l ,原料处理量为2kmol/h ,其中甲苯 与氢的摩尔比等于1。若反应器的直径为 50mm 试计算甲苯最终转化率为 95% 时的反应器长度。 解:根据题意可知甲苯加氢反应为恒容过程, 原料甲苯与氢的摩尔比等于1, 即: C T0 C H 0,则有: C T C H C T0(1 示中下标T 和H 分别代表甲苯与氢,其中: P T0 0.5 1.013 105 RT 8.314 Q °C T 0 2/ 2 所以,所需反应器体积为: X T V r Q 0C T0 0 X T ) C T0 103 1073 5.68 1kmol /h 0.278 10 3kmol / m 3 10 3kmol /s 3 0.278 10 dX T 1.5C T C H .5 0.95 Q 0 C T0 dX T X T dX T 0 1.5C T .5 c 3 15 15 0.4329 0 1.5(5.68 10 3 ) (1 X T ) 3.006 d 2 1531.1m 所以,反应器的长度为:0.05 3.14/4 (1 T 1 3.006m 3 1.5 1 4.2根据习题3.2所规定的条件和给定数据,改用活塞流反应器生产乙二醇, 试计算所需的反应体积,并与间歇釜式反应器进行比较。 解:题给条件说明该反应为液相反应,可视为恒容过程,在习题 3.2中已 算出: Q 0 27 5.8l /h 所以,所需反应器体积: X A C A0 1.231mol / I V r Q 0C A0 0 dX A kC A0(1 X A )(C B0 C A 0X A ) 275?8 O.95 818.6l X kC A0 1 X A 5.2 1.231 1 0.95 由计算结果可知,活塞流反应器的反应体积小,间歇釜式反应器的反应体积大, 这是由于间歇式反应器有辅助时间造成的。 Q 0 X A 4.3 1.013 x 105Pa 及20C 下在反应体积为0.5m 3的活塞流反应器进行一氧 化氮氧 化反应:
1 绪 论 1.1在银催化剂上进行甲醇氧化为甲醛的反应: 进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应 后甲醇的转化率达72%,甲醛的收率为69.2%。试计算 (1) (1) 反应的选择性; (2) (2) 反应器出口气体的组成。 解:(1)由(1.7)式得反应的选择性为: (2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比), A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为: n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 mol n C =n A0(X A -Y P )=0.7672 mol 结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为: n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol 1. 1. 2其主副反应如 下: 由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩 原料气 Bkg/h 粗甲醇 Akmol/h
100kmol 放空气 体 原料气和冷凝分离后的气体组成如下:(mol) 组分原料气冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29 粗甲醇的组成为CH 3OH 89.15%,(CH 3 ) 2 O 3.55%,C 3 H 9 OH 1.10%,H 2 O 6.20%,均为 重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO 2 9.82g,CO 9.38g,H 2 1.76g,CH 4 2.14g,N 2 5.38g。若循环气与原料气之比为7.2(摩尔比), 试计算: (1)(1)一氧化碳的单程转换率和全程转化率; (2)(2)甲醇的单程收率和全程收率。 解:(1)设新鲜原料气进料流量为100kmol/h,则根据已知条件,计算进料原料 i i i i i m i i 。 M’ m =∑y i M i =9.554 又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N 2 作衡算 得: 5.38B/28×1000+0.1029A=2.92 (A) 对整个系统就所有物料作衡算得: 100×10.42=B+9.554A (B) 联立(A)、(B)两个方程,解之得 A=26.91kmol/h B=785.2kg/h 反应后产物中CO摩尔流量为
华东版-- 4-1 解:由反应可知膨胀率为:2111 A ε-== 反应速率可写成:()1111A A A A A A x x p p r k k RT x RT x ε??---== ?++?? 00A p F v RT = 反应器容积可写成: 00001111Af Af x x A A A A A A A F v x x RT V dx dx k p x k x ++==--?? ()00003 210.8/36000.8/36000.52ln 0.50.4/36000.4/36001.77Af Af x x A A A v v V dx dx k k x V m -=- --=-?-?=?? 4-2 由反应可知膨胀率为:320.52 A ε-== 反应速率可写成:()11110.5A A A A A A x x p p r k k RT x RT x ε??---== ?++?? 反应器容积可写成: []000000003 10.51111 1.5210.40.0082049730.50.8 1.5ln 0.20.970.160 32.92 2.01 1.1Af Af Af Af x x A A A A A A A x x A A A A A F v x x RT V dx dx k p x k x F F RT RT V dx dx k p k p x V m ++==---=- --??=-?-??=?=?? ?? 4-3 解:
()() ()0311ln 110.980.19.92105ln 0.9812473A A A A A M x c k M M x x x s τττ-+-=+--??=--= 4-4 解:0.900A A A dx c kp τ=? A A p c RT = 膨胀率为:320.52 A ε-== () 0110.5A A A A c x c x -=+ 所以: ()()()0.9000.9010.511 1.5ln 10.513.2A A A A A A x c dx kRT x x x kRT s τ+=-=---∣??? ?=? 4-5 解: () ()00630030011ln 10.294100.312.88.314828 1211ln ln 18.210.2712.810.95 R A A A A A A R A A V F kc x p c mol m RT F V m kc x -=-??===??===-?- 4-6 解:假设反应为二级反应,则011A A k c c τ-= 把数据代入,可得: 1124;10.041 k k -== 114;10.21 k k -== 11;10.51 k k -==
第四章非理想流动 1. 停留时间分布的密度函数在t < 0时,E (t) = 。 2. 停留时间分布的密度函数在t > 0时,E (t) _ _ 。 3. 当t=0时,停留时间分布函数F (t) =_ 。 4. 当t= a时,停留时间分布函数 F (t ) = ______ 。 5?停留时间分布的密度函数E ( 9 ) = _______ E (t ) _ 2 _ 2 6. 表示停留时间分布的分散程度的量▽日= ______ 坊七。 7. 反应器物料的停留时间的分布曲线是通过物理示踪法来测定的,根据示踪剂的输入方式不同分为 。 8. 平推流管式反应器t 时,E (t ) = ______________ 。 9. 平推流管式反应器t式£时,E (t ) = ___________ 。 10. 平推流管式反应器t At时,F (t) = ___________ 。 11. 平推流管式反应器t V t时,F (t) = ___________ 。 2 12. 平推流管式反应器其E ( 9 )曲线的方差▽日= ____________ 。 _ 2 13. 平推流管式反应器其E (t )曲线的方差▽t = _____________ 。 14. 全混流反应器t=0时E (t ) = ________ 。 _ 2 _ 15. 全混流反应器其E ( 9 )曲线的方差日二_____________ 。 _ 2 _ 16. 全混流反应器其E (t )曲线的方差=_________________ 。 _ 2 17. 偏离全混流、平推流这两种理想流动的非理想流动, E ( 9 )曲线的方差日为____________ 。 C A 18. 脉冲示踪法测定停留时间分布C0对应曲线为___________ 。 C A 19. 阶跃示踪法测定停留时间分布C0对应曲线为__ _ 。 20. 非理想流动不一定是由__= _______ 造成的。 21. 非理想流动不一定是由返混造成的,但返混造成了______________ 。 22. 为了模拟返混所导致流体偏离平推流效果,可借助这种轴向返混与扩散过程的相似性,在__ _____ 的基础上 叠加上轴向返混扩散相来加以修正,并认为的假定该轴向返混过程可以用费克定律加以定量描述,所以,该模型称 为_ _ _ 。 23. 在轴向分散模型中,模型的唯一参数彼克莱准数P e = __。 24. 在轴向分散模型中,模型的唯一参数彼克莱准数愈大轴向返混程度就________ 。 25. 轴向分散模型的偏微分方程的初始条件和边界条件取决于采用示踪剂的__________ 、 __________ 、_______ 的 情况。 26. 轴向分散模型的四种边界条件为___ ________ 、 _____________ 、 ____________ 、_ 。 27. 若流体是分子尺度作为独立运动单元来进行混合,这种流体称为_ —。
第二章 均相反应动力学 1、有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后, 转化掉90%,求表达此反应的动力学方程式。 2 A A min 18A0min 8A0A A A0d d 2 19.019.0181)(21 8.018.081)(11kc t c kc kc x x c kt =- = -?== -?=-?= 为假设正确,动力学方程 3、 在间歇反应器中有一级液相可逆反应P A ?,初始反应时C A0=0.5mol/L ,C P0=0反应8min 后,A 的转化率为1/3,而平衡转化率是2/3,求此反应的动力学方程式。 解:p A A C k C k dt dC 21-=- 210021 22) 1(k k x C x C C C K k k Ae A Ae A Ae Pe ==-===即 根据一级可逆反应积分式 1212121min 08664.08 2ln 3 132ln 18ln 1 -==+∴+=-+= k k k k x x x k k t A Ae Ae 121 1m in 02888.0m in 05776.0--==∴k k P A p A A C C C k C k dt dC 02888.005776.021-=-=- 5、恒温恒容的气相反应A →3P ,其动力学方程为V n k dt dn V r A A A =- =-1)(,在反应过程 中系统总压p t 及组分A 的分压均为变量,试推导 )(A t p f dt dp =的表达式。
解:A t A A A t A A A A A A A A t A A t A A A t kp dt dp RT p k kc V n k dt dp RT dt dp RT dt dp RT dt dc r V n k dt dn v r dt dp dt dp p p p p p p p 221211(1)(22)(3)0 0======-=-=-=-=--=--=-+=得即 8、纯气相组分A 在一等温等容间歇反应器中按计量式P A 5.2?进行反应,实验测得如下 数据, 时间/min 0 2 4 6 8 10 12 14 ∝ 分压p A /MPa 0.1 0.08 0.0625 0.051 0.042 0.036 0.032 0.028 0.020 用积分法求此反应的动力学方程式。 解:由于当∞→t 时,02.0=A p 常数,因此假设为一级可逆反应。 )即,即,达到平衡时,020220 20220212 121210215 1 (5.125.25.125.25.210)(5.2101002 .02.02.0)02.01.0(5.2)(5.25.2A A A A A A A A A A A Ae pe pe Ae A A p p A A p p k p k p k p k p k p k p p k p k dt dp k k p p k k RT p k RT p k MPa p p p c k c k dt dc p A e - =-=-+-=-?-=- ====∴ ==-=-=-=-→∞
第四章维生素解释题 1 .维生素 2 .抗维生素 3 .维生素缺乏症 4. 维生素中毒症5 .脂溶性维生素 6 .水溶性维生素 7 .维生素原 8 .内源因子 填空题 1 .维生素A 是带β- 白芷酮环的不饱和一元醇,可被氧化成_____ ,它作为_____的组分在暗视觉中起作用。 2. 维生素D 是_____类化合物,它在人体内具有生物活性的分子形式为_____。 3 .维生素B 1 是由_____和_____借助甲烯基连接成的水溶性维生素。 4 .维生素B 1 的衍生物Tpp 是催化_____反应的一种辅酶,又称_____ 酶。 5 .维生素B 2 是由和6,7 一二甲基异咯嗪缩合成的橘黄色针状结晶,故维生素B 2 又称_____ 。 6. FMN 、FAD 在有关酶的催化反应中起作用,这是由于维生素B 2 分子中_____环上的1 位和10 位氮原子具有活泼双键能可逆地加氢脱氢的缘故。 7 .维生素PP 的化学本质是_____ ,缺乏它会引起_____病。 8 .生物素是_____的辅酶,在有关催化反应中起_____作用。 9 .叶酸是由_____、_____和L- 谷氨酸构成的。 10 .四氢叶酸(THFA )是由二氢叶酸在二氢叶酸还原酶和_____存在下还原成的,它在代谢中起_____作用。 11 .四氢叶酸分子中_____和_____原子参与一碳单位的转移。 12. 维生素B 12 在体内的辅酶形式有5- 脱氧腺苷钴胺素、氰钴胺素、羟钴胺素、甲钴胺素,其中_____是维生素B 12 在体内的主要存在形式,作为_____的辅酶在代谢中起作用。 13. 维生素C 是_____的辅酶,它参与胶原分子中的羟基化反应。 14. 维生素K 促进_____的合成。 一酮酸氧化脱羧反应需要的辅因子,除了硫辛酸、CoA-SH, FAD, NAD + 外,还有_____ 。 16 .缺乏维生素B1 可使神经组织中_____堆积,引起_____ 病。 17 .在嘌呤核苷酸从无到有的生物合成途径中,所需要的维生素为_____ 和_____ 。 18 .参与琥珀酸脱氢生成延胡羧酸反应的辅酶是_____ 。 19. 人类长期不摄人蔬菜、水果,将可能导致_____和_____这两种维生素的缺乏。 20. 由乙酰CoA 生成丙二酰CoA 需要_____作为酶的辅因子。 21 .脂溶性维生素包括_____ 、_____ 、_____ 、_____ 和_____ 。 22 .水溶性维生素包括维生素B 族和。维生素B 族有_____、_____ 、_____ 、_____ 、_____、_____和_____。 23 .维生素D 3 必须在_____、_____ 进行羟化反应生成_____,才有生物活性。 24 .谷氨酸脱羧生成_____,其脱氢酶的辅酶是_____。 25 .维生素C 参与体内_____、_____、_____ 等合成过程中的羟化作用。 26 .维生素B 1 构成的辅酶是_____ ,如果缺乏,糖代谢发生障碍,_____和_____在神经组织堆积,引起脚气病。 27. 维生素B 2 又名,它是由和缩合而成,其构成的辅基主要生化功能是_____ 。 28. 维生素PP 是_____衍生物,包括_____和_____,其构成的辅酶生化功能是_____。 29. 维生素B 6 包括_____ 、_____ 和_____ 。其中_____ 和_____ 经磷酸化成为辅酶,起_____ 作用。 30. 维生素C 是含6 个碳原子的_____ 化合物,其分子中C 2 及C 3 上的两个相邻的烯 醇式羟基,既可_____而呈酸性,又可_____生成氧化型维生素 C 。 31 .维生素A 主要以视黄醇的形式存在,它的结构是一种含有_____环的,在体内可以氧化生成_____及_____ 。 32. _____、_____、_____ 、_____ 在体内可以转化成为维生素A ,故称维生素A 原,但它们的转化效能并不相同,其中以_____ 转化率最高。
第一章 绪论 1. 化学反应工程是一门研究______________的科学。(化学反应的工程问题) 2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。(化学反应、工程问题) 3. _______是化学反应工程的基础。( 三传一反) 4. 化学反应过程按操作方法分为_______、_______、_______操作。(分批式操作、连续式操作、半分批式) 5. 化学反应工程中的“三传一反”中的三传是指_______、_______、_______。(传质、传热、动量传递) 6. 不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______。(数学模型) 7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。(累积量=输入量-输出量) 8.“三传一反”是化学反应工程的基础,其中所谓的一反是指_______。(D ) A .化学反应 B. 反应工程 C. 反应热力学 D. 反应动力学 9.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。(A ) A. 能量传递 B. 质量传递 C. 热量传递 D. 动量传递 第二章 均相反应动力学 1. aA + bB pP + sS 对于反应,则=P r _______)(A r -。( a p ) 2.着眼反应组分K 的转化率的定义式为_______。( 00K K K K n n n -= χ) 3. 化学反应速率式为β αB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =_______P K 。() ()(βα+RT ) 4. 活化能的大小直接反映了______________对温度的敏感程度。(反应速率) 5. 一个可逆的均相化学反应,如果正、逆两向反应级数为未知时,采用______________法来求反应级数。(初始速率法) 6. 平行反应A P(主) S(副)均为一级不可逆反应,若主E >副E ,选择性S p 与_______无关,仅是_______的函数。(浓度、温度) 7. 如果平行反应 A P(主) S(副)均为一级不可逆反应,若主E >副E ,提高选择性P S 应 _______。(提高温度) 8. 一级连串反应A S K 1 K 2 P 在平推流反应器中,为提高目的产物P 的收率,应 ______12/k k 。(降低) 9.化学反应O H CH H CO 2423+?+,其中化学反应计量系数为-1的是哪种物质______。(A ) A. CO B. 2H C. 4CH D. O H 2 10.对于一非恒容均相化学反应αA A αB B ,反应组分A 的化学反应速率 =-A r _______。(A ) A. Vdt dn r A A -=- B. Vdt dn r B A -=- C. dt dC r A A -=- D. dt dC r B A -=-
检测方法及方法确认作业指导书 天津大学:《反应工程》(第二版) 习题答案 1 绪论 1.1 在银催化剂上进行甲醇氧化为甲醛的反应: 进入反应器的原料气中,甲醇︰空气︰水蒸气=2︰4︰1.3(摩尔比),反 应后甲醇的转化率(X)达72%,甲醛的收率(Y)为69.2%。试计算:(1 )反应的选择性(S);(2)反应器出口气体的组成(摩尔分率%)。 解:(1)由(1.7)式得反应的选择性为: (2)进入反应器的原料气中,甲醇︰空气︰水蒸气=2︰4︰1.3(摩尔比), 设甲醇的转化率为X A ,甲醛的收率为Y P ,根据(1.3)和(1.5)式可得反 应器出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为: n A=n A0(1-X A)=7.672 mol,n P=n A0Y P=18.96 mol,n C=n A0(X A-Y P)=0.7672 mol 结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别 为: n W=n W0+n P+2n C=38.30 mol n O=n O0-1/2n P-3/2n C=0.8788 mol n N=n N0=43.28 mol 组分摩尔数(mol)摩尔分率% CH 3 OH 7.672 6.983 HCHO 18.96 17.26 H 2 O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.39 组分摩尔分率y i0 摩尔数n i0 (mol) CH 3 OH 2/(2+4+1.3)=0.2740 27.40 空气4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0
《化学反应工程原理》复习思考题 第一章绪论 1、了解化学反应工程的研究内容和研究方法。 2、几个常用指标的定义及计算:转化率、选择性、收率。 第二章化学反应动力学 1、化学反应速率的工程表示,气固相催化反应及气液相非均相反应反应区的取法。 2、反应速率常数的单位及其换算。 3、复杂反应的反应速率表达式(可逆、平行、连串、自催化)。 4、气固相催化反应的步骤及基本特征。 5、物理吸附与化学吸附的特点。 6、理想吸附等温方程的导出及应用(单组分吸附、解离吸附、混合吸附)。 7、气固相催化反应动力学方程的推导步骤。 8、不同控制步骤的理想吸附模型的动力学方程的推导。 9、由已知的动力学方程推测反应机理。 第三章理想间歇反应器与典型化学反应的基本特征 1、反应器设计的基本方程式。 2、理想间歇反应器的特点。 3、理想间歇反应器等温、等容一级、二级反应反应时间的计算及反应器体积的计算。 4、自催化反应的特点及最佳工艺条件的确定及最佳反应器形式的选择。 5、理想间歇反应器最优反应时间的计算. 7、可逆反应的反应速率,分析其浓度效应及温度效应。 8、平行反应选择率的浓度效应及温度效应分析。 9、平行反应反应器形式和操作方式的选择。 10、串连反应反应物及产物的浓度分布,t opt C p.max的计算。 11、串连反应的温度效应及浓度效应分析。 第四章理想管式反应器
1、理想管式反应器的特点。 2、理想管式反应器内进行一级、二级等容、变容反应的计算。 3、空时、空速、停留时间的概念及计算。 4、膨胀率、膨胀因子的定义,变分子数反应过程反应器的计算。 第五章理想连续流动釜式反应器 1、全混流反应器的特点。 2、全混流反应器的基础方程及应用。 3、全混釜中进行零级、一级、二级等温、等容反应时的解析法计算。 4、全混釜的图解计算原理及图解示意。 5、全混流反应器中的浓度分布与返混,返混对反应的影响。 6、返混产生的原因及限制返混的措施。 7、多釜串联反应器进行一级、二级不可逆反应的解析法计算。 8、多釜串联反应器的图解法计算原理。 第七章化学反应过程的优化 1、简单反应过程平推流反应器与全混流反应器的比较及反应器形式的选择。 2、多釜串连反应器串连段数的选择分析。 3、自催化反应反应器的选型分析。 4、可逆放热反应速率随温度的变化规律,平衡温度和最优温度的概念。 5、平行反应选择率的温度效应及浓度效应分析,反应器的选型,操作方式的确定。 6、串连反应影响选择率和收率的因素分析,反应器的选型及操作方式的确定。 7、平推流与全混釜的组合方式及其计算。 第八章气固相催化反应过程的传递现象 1、气固相催化反应的全过程及特点。 2、等温条件下催化剂颗粒的外部效率因子的定义。 3、外扩散、内扩散对平行反应、连串反应选择性的影响分析。 4、气体流速对外扩散的影响分析。 5、等温条件下催化剂颗粒的内部效率因子的定义。
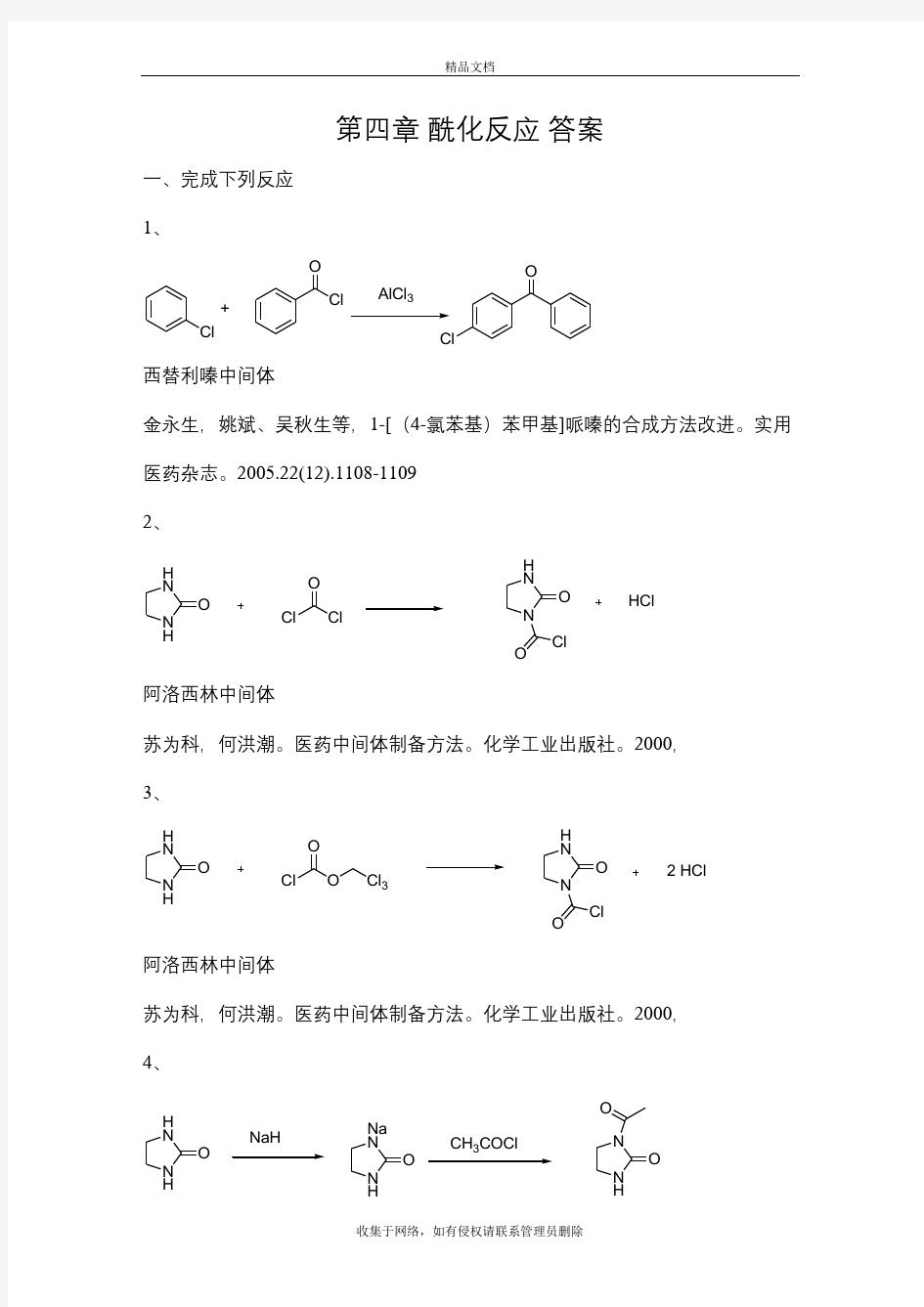
第四章 酰化反应 答案 一、完成下列反应 1、 Cl Cl Cl O O +AlCl 3 西替利嗪中间体 金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。实用医药杂志。2005.22(12).1108-1109 2、 N H H N O Cl O Cl N H N O Cl O HCl 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 3、 N H H N O Cl O O N H N O Cl O 2 HCl Cl 3 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 4、 N H H N O NaH N H Na N O CH COCl N H N O O 青霉素。 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 5、 H H N O SO 2Cl N H N O O 2 HCl 半合成β-内酰胺类抗生素 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000
6、 O O 3 C O CH 2CH 2COOH 芬不芬 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,1340 7 N H S O O O N S COCH 3 乙酰丙嗪 8 NH 2COOH NHCOCH 3COOH 安眠酮 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,13 9 N N S H 2N SH O 3 O N N S HN SH 3 乙酰唑胺 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,14 10 NH 2 OH O O O NHCOCH 3 OH 嘧啶苯芥 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,15 11 NH 2 3NHCOCH 3 磺胺类药物 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,17 12
第一章 1. 化学反应工程是一门研究 (化学反应个工程问题)的科学。 2. 所谓数学模型是指 (用数学方法表达各变量间的关系)。 3. 化学反应器的数学模型包括 (动力学方程式、 物料横算式子、 热量衡算式、 动量衡算式 和 参数计算式) 4. 所谓控制体积是指 (能把反应速率视作定值的最大空间范围)。 5. 模型参数随空间而变化的数学模型称为 ( 分布参数模型)。 6. 模型参数随时间而变化的数学模型称为 (非定态模型)。 7. 建立物料、热量和动量衡算方程的一般式为 (累积量=输入量-输出量)。 第二章 1. 均相反应是指 (在均一的液相或气相中进行的反应)。 2. 对于反应aA + bB → pP + sS ,则r P =( p/a )r A 。 3.着眼反应物A 的转化率的定义式为(转化率Xa=转化了的物料A 的量/反应开始的物料A 的量)。 4. 产物P 的收率ΦP 与得率ХP 和转化率x A 间的关系为( Xp/Xa )。 5. 化学反应速率式为r A =k C C A αC B β,用浓度表示的速率常数为k C ,假定符合理想气体状态方 程,如用压力表示的速率常数k P ,则k C =[ (RT)的a+B 次方]k P 。 6.对反应aA + bB → pP + sS 的膨胀因子的定义式为 (P+S )-(A+B))/A 。 7.膨胀率的物理意义为 (反应物A 全部转化后系统的体积变化率)。 8. 活化能的大小直接反映了 (反应速率) 对温度变化的敏感程度。 9. 反应级数的大小直接反映了(反应速率) 对浓度变化的敏感程度。 10.对复合反应,生成主产物的反应称为 (主反应),其它的均为(副反应)。 11. 平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,选择性S p 与 (A 的浓度) 无关,仅是 (A 的浓度) 的函数。 12. 如果平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,提高选择性S P 应(提到 温度)。 13. 一级连串反应A → P → S 在平推流反应器中,为提高目的产物P 的收率,应(降 低)k 2/k 1。 14. 产物P 的收率的定义式为 (生成的全部P 的物质的量/反应掉的全部A 的物质的量) 15. 产物P 的瞬时收率φP 的定义式为(生成的物质的量/反应的A 的物质的量) 16. 产物P 的选择性S P 的定义式为(单位时间内产物P 的物质的量/单位时间内生成产物S 的物质的量) 17. 由A 和B 进行均相二级不可逆反应αA A+αB B = αS S ,速率方程为: r A =-dC A /dt=kC A C b 。 求: (1)当C A0/C B0=αA /αB 时的积分式 (2)当C A0/C B0=λ≠αA /αB 时的积分式 18. 反应A → B 为n 级不可逆反应。已知在300K 时要使A 的转化率达到20%需,而在340K 时达到同样的转化率仅需,求该反应的活化能E 。 第三章 1. 理想反应器是指(理想混合反应器 平推流反应器)。 2. 全混流反应器的空时τ是 (反应器容积) 与(进料的体积流量)之比。 3. 全混流反应器的放热速率Q G ={ 00()A A Hr Ft y x ? }。 4. 全混流反应器的移热速率Q r ={ 012()pm Ft C T T - } 5. 全混流反应器的定常态操作点的判据为{ G r Q Q = }。 6. 全混流反应器处于热稳定的定常态操作点的判据为{ G r Q Q = G r dQ dQ dT dT > }。
过程三:原料药合成控制 酰化技术基本理论知识习题及答案 1.解释下列名词或术语 DCC,:二环己基碳二亚胺 DMSO:二甲基亚砜 DEPC,:焦碳酸乙二脂 Hoesch 反应:酚或酚醚在氯化氢和氯化锌等Lewis酸的存在下,与腈作用,随后进行水解,得到酰基酚或酰基酚醚: Vilsmeier反应:以氮取代的甲酰胺为甲酰化剂,再三氯氧磷的作用下,在放缓及防杂环上引入甲酰基的反应。 Claisen反应:一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮: Reisen-Tiemann反应:酚与氯仿及碱液反应生成芳醛的反应。 2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点? 作为酰化剂的羧酸衍生物酰化能力强弱顺序: RCO·H al >(RCO) O > RCOO Rˊ> RCOOH > RCONH Rˊ 2 3.羧酸和醇的酯化反应有何特点?加速反应和提高收率都有哪些方法?总结酯化反应的其他方法,并用实例加以说明。 反应物结构 对于羧酸(RCOOH),其羰基碳原子的 亲电性越强、位阻越小,反应越容易; 配料比及操作特点 酯化反应是一可逆平衡反应,要想提高产物的收率,较多采用将水蒸馏除去的方法。
除去水可用以下几种方法: (1)加脱水剂 加入如浓硫酸、无水氯化钙、无水硫酸酮、无水硫酸铝等。 (2)蒸馏除水 (3)共沸脱水 某些溶剂能与水形成具有较低共沸点的二元或三元共沸混合物,可以在较低温度水蒸馏除去。 4.羧酸法酯化反应常用的催化剂有哪些?要酰化酚类应用哪些方法? 常用的催化剂有以下几种。 (1)质子酸 质子酸催化剂主要有浓硫酸、高氯酸、四氟硼酸、氯化氢气体等无机酸及苯磺酸、对甲苯磺酸等有机酸。如: HOOCCH 2CH 2NH 2 424 25~60 ROOCCH 2CH 2NH 2 (34~94%) (2)Lewis 酸 常用的Lewis 酸催化剂有BF 3、AlCl 3、ZnCl 2及硅胶等。如: (94%) CH CHCOOCH 3 CH 3OH CH CHCOOH C 2H 5COOH n BuOH AlCl 3 2H 5COOBu n (97%) (3)强酸型离子交换树脂 如醋酸甲酯的制备,反应仅10分钟,收率即可达94%。 CH 3COOH CH 3OH R 34 10min CH 3COOCH 3 (94%) 5.胺类化合物的酰化活性一般有什么规律? N-酰化是制备酰胺类化合物的重要方法。被酰化的可以是脂肪胺,也可以是芳香胺;可以是伯胺,也可以是仲胺。 一般活性规律是;伯胺>仲胺,位阻小的胺>位阻大的胺,脂肪胺>芳香胺。