
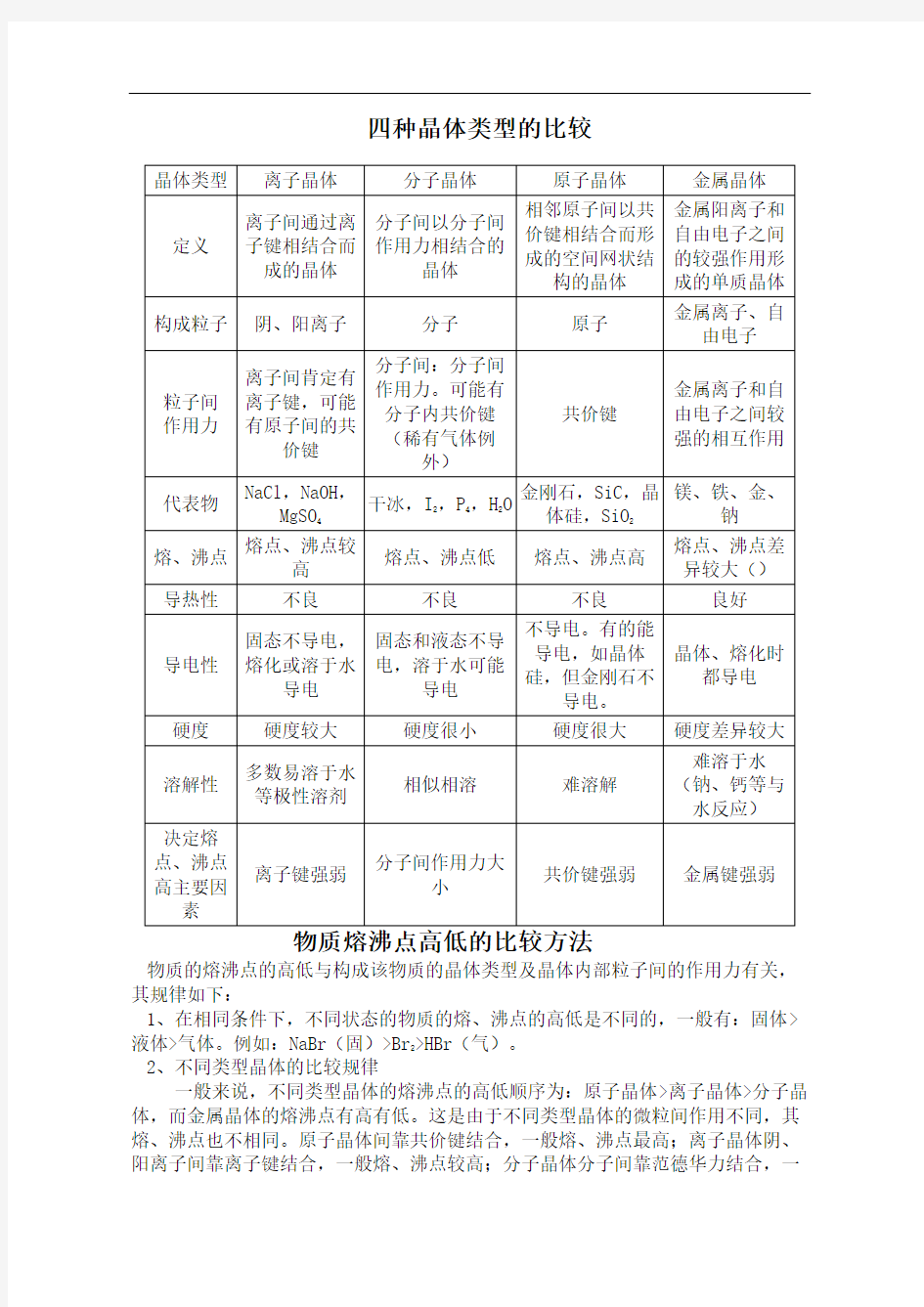
四种晶体类型的比较 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
四种晶体类型的比较
物质熔沸点高低的比较方法
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:
1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>
>HBr(气)。
液体>气体。例如:NaBr(固)>Br
2
2、不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一
般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰
3、同种类型晶体的比较规律
A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。KF>KCl>KBr>KI,CaO>KCl。
C、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na<Mg <Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。
D、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高)
如:H
2O>H
2
Te>H
2
Se>H
2
S,C
2
H
5
OH>CH
3
—O—CH
3
。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越
强,物质的熔沸点越高。如:CH
4<SiH
4
<GeH
4
<SnH
4
。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,
其熔沸点就越高。如熔沸点 CO>N
2,CH
3
OH>CH
3
—CH
3
。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C
17H
35
COOH>C
17
H
33
COOH;硬脂酸>油酸
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增
加,熔沸点升高,如C
2H
6
>CH
4
, C
2
H
5
Cl>CH
3
Cl,CH
3
COOH>
HCOOH。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降
低。如:CH
3(CH
2
)
3
CH
3
(正)>CH
3
CH
2
CH(CH
3
)
2
(异)>(CH
3
)
4
C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低)
针对性训练
一、选择题
1.下列性质中,可以证明某化合物内一定存在离子键的是()
(A)溶于水(B)有较高的熔点(C)水溶液能导电(D)熔融状态能导电
2.下列物质中,含有极性键的离子化合是()
(A)CaCl
2(B)Na
2
O
2
(C)NaOH (D)K
2
S
3.Cs是IA族元素,F是VIIA族元素,估计Cs和F形成的化合物可能
是( )
(A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体
4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( )
(A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3
6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( )
(A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体 7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( )
(A )38a N m A ?g·cm -3 (B )A N Ma 83g·cm -3
(C )3a N M A ?g·cm -3 (D )A
N Ma 3g·cm -3
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
B 、离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。 例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。 C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高) 如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。 (2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。 (3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。 如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸 (4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸 点升高,如C 2H 6>CH 4, C 2H 5Cl >CH 3Cl ,CH 3COOH >HCOOH 。 (5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如: CH 3(CH 2)3CH 3 (正)>CH 3CH 2CH(CH 3)2(异)>(CH 3)4C(新)。 芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低) 针对性训练 一、选择题 1.下列性质中,可以证明某化合物内一定存在离子键的是( ) (A )溶于水 (B )有较高的熔点 (C )水溶液能导电 (D )熔融状态能导电 2.下列物质中,含有极性键的离子化合是( ) (A )CaCl 2 (B )Na 2O 2 (C )NaOH (D )K 2S 3.Cs 是IA 族元素,F 是VIIA 族元素,估计Cs 和F 形成的化合物可能是( ) (A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体 4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( ) (A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3 6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( ) (A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体 7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( ) (A )3 8a N m A ?g·cm -3 (B )A N Ma 83 g·cm -3 (C )3 a N M A ?g·cm -3 (D )A N Ma 3 g·cm -3
四种晶体类型的比较 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价
键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C —C
四种晶体类型的比较
物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr (固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,原子半径越小,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
四种晶体类型的比较 GE GROUP system office room 【GEIHUA16H-GEIHUA GEIHUA8Q8-
四种晶体类型的比较
物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体> >HBr(气)。 液体>气体。例如:NaBr(固)>Br 2 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。 C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高) 如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。 (2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。 (3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。 如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸
四种晶体性质比较 1.晶体 ⑴晶体与非晶体 ⑵得到晶体的途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接___________________ 。 ③溶质从溶液中析出。 ⑶晶胞 ①概念 描述晶体结构的基本单元。 ②晶体中晶胞的排列一一无隙并置 a. _______________________________ 无隙:相邻晶胞之间没有。 b?并置:所有晶胞________ 卡列、取向相同。 ⑷晶格能 ①定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位: __________________ 。 ②影响因素 a.离子所带电荷数:离子所带电荷数越多,晶格能越大。一 b. ____________________________ 离子的半径:离子的半径晶格能越大。 ③与离子晶体性质的关系
晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度_________________ 。
2.四种晶体类型的比较 3?晶体熔沸点的比较 ⑴不同类型晶体熔、沸点的比较 ①不同类型晶体的熔、沸点高低的一般规律:______________________________ >离子晶体〉_____________________________________ 0 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 ⑵同种晶体类型熔、沸点的比较 ①原子晶体:
原子半径越小」—>1键长越短②离子晶体: a?—般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强, 其离子晶体的熔、沸点就越高,如熔点:MgO ____ MgCI 2 ______ N aCl _____ CsCI。 b.衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。 ③分子晶体: a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。女口H20> H2Te> H2Se> H2S。 b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,女口Sn H4> GeH4 > SiH4> CH4。 c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点 ___________ 如 C0>N2,CH3OH>CH3CH3。 d.同分异构体,支链越多,熔、沸点越低。 ④金属晶体: 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na v Mg v Al。 2 .在下列物质中:NaCl、NaOH、Na2S、H2O2、Na2S2、(NH4)2S、CO2、CCI4、 C2H2、SiO2、SiC、晶体硅、金刚石。 ⑴其中只含有离子键的离子晶体是___________ ; (2)其中既含有离子键又含有极性共价键的离子晶体是_____________ ; (3)其中既含有离子键,又含有极性共价键和配位键的离子晶体是______________ ; ⑷其中既含有离子键又含有非极性共价键的离子晶体是______________ ; (5)其中含有极性共价键的非极性分子是____________ ; (6)其中含有极性共价键和非极性共价键的非极性分子是_____________ ; (7)其中含有极性共价键和非极性共价键的极性分子是 (8)其中含有极性共价键的原子晶体是 _______ 。
四种晶体比较表 注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。 晶体熔沸点的比较 一、看常态:1、常态:固>液>气。
2、一般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。 3、原子晶体:共价键(取决于原子半径)。 4、离子晶体:离子键(取决于离子半径和离子电荷) 5、金属晶体:金属键(取决于金属原子半径和价电子数) 6、分子晶体:①结构相似,分子量越大,熔沸点越高。 ②分子量相等,正>异>新。③氢键反常 二、看类型 三、分类比较 18.请完成下列各题: (1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。 (2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于晶体。 (3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。 19.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式。 (2)根据等电子原理,写出CO分子结构式。 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。 ①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子 中碳原子轨道的杂化类型为。 ②甲醛分子的空间构型是;1mol甲醛分子中σ键的数 目为。 ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。
2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话::: 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞) 中,处于不同位置的微粒在该单元中所占的份额也有 所不同,一般的规律是:顶点上的微粒属于该单元中 所占的份额为18 ,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12 ,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个C l -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的 Cl -围成的空间构型为正八面体。每个N a +周围与其最近且距离相等的Na + 有12个。见图1。 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4 因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。 2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与 一个Cs +距离最近且相等的Cs +有6个。晶胞中平均Cs +个数:1;晶胞中平 均Cl -个数:8×18 = 1。 因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4 个C 原子紧邻,因而整个晶体中无单个分子存在。由共价键构成的最小 环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环 共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6× 112 = 12 ,平均C —C 键数为6×16 = 1。 C 原子数: C —C 键键数 = 1:2; C 原子数: 六元环数 = 1:2。 2.二氧化硅晶体结构与金刚石相似,C 被Si 代替,C 与C 之间插氧,即为SiO 2晶体,则SiO 2晶体中最小环为12环(6个Si ,6个O ), 最小环的平均Si 原子个数:6×112 = 12;平均O 原子个数:6×16 = 1。 即Si : O = 1 : 2,用SiO 2表示。 在SiO 2晶体中每个Si 原子周围有4个氧原子,同时每个氧原子结合2个硅原子。一个Si 原子可形 图 1 图 2 NaCl 晶体 图3 CsCl 晶体 图4 金刚石晶体
四种晶体比较 This model paper was revised by the Standardization Office on December 10, 2020
四种晶体比较表 注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。 晶体熔沸点的比较 一、看常态:1、常态:固 >液 >气。
2、一般情况下,原子晶体>离子晶体 (金属晶体)>分子晶体。 3、原子晶体:共价键 (取决于原子半径)。 4、离子晶体:离子键 (取决于离子半径和离子电荷) 5、金属晶体:金属键 (取决于金属原子半径和价电子数) 6、分子晶体:①结构相似,分子量越大,熔沸点越高。 ②分子量相等,正>异>新。③氢键反常 二、看类型 三、分类比较 18.请完成下列各题: (1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。 (2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。 在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于 晶体。 (3)在极性分子NCl 3 中,N原子的化合物为―3,Cl原子的化合价为+1,请 推测NCl 3 水解的主要产物是(填化学式)。 19.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO 2、H 2 等)与H 2 混合,催化合成甲醇是生物质能利用的方法之一。 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式。 (2)根据等电子原理,写出CO分子结构式。 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH) 2的碱性溶液反应生成Cu 2 O 沉淀。 ①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。 ②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
四种晶体类型的比较 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
四种晶体类型的比较 物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体> >HBr(气)。 液体>气体。例如:NaBr(固)>Br 2 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一
般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
晶体类型的判断与比较,晶体结构的计算,怎样比较熔点的高低, 8晶体类型的判断与比较 1、判断晶体类型的方法 (1)依据物质的分类判断 金属氧化物(如K2O、Na2O2等),强碱(如NaCl、KOH等)和绝大多数的盐类是离子晶体。大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体单质有金刚石、石墨、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金都是金属晶体。 (2)依据物质的性质判断 离子晶体的熔点较高,常在数百至1000余度;原子晶体熔点高,常在100 0度至几千度;分子晶体熔点低,常在数百度以下至很低温度;金属晶体多数熔点高,但也有相当低的。 离子晶体水溶液及熔化时能导电,晶体不导电;原子晶体一般为非导体,但石墨等导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子也能导电,但熔化不导电,金属晶体是良导体。 2、晶体中的几个不一定 (1)离子晶体除含离子键外不一定不含其他化学键。如氨盐中除含离子键,还含极性键和配位键;Na2O2中除含离子键还含非极性键。
(2)离子晶体不一定肯定含金属阳离子,如NH4Cl中含的阳离子是NH4+(凡是氨盐、肯定同时含离子键、极性键和配位键)。 (3)离子晶体的熔点不一定肯定低于原子晶体,如MgO的熔点高于SiO2。(4)含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。 (5)金属和非金属形成的晶体不一定都是离子晶体,如AlCl3就是含共价键的分子晶体 (6)具有金属光泽且能导电的单质不一定就是金属,如石墨具有金属光泽且能导电,却是非金属。 3、四类晶体的比较:
四种晶体性质比较1.晶体 (1)晶体与非晶体 (2)得到晶体的途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接_______________。 ③溶质从溶液中析出。 (3)晶胞 ①概念 描述晶体结构的基本单元。
②晶体中晶胞的排列——无隙并置 a.无隙:相邻晶胞之间没有____________。 b.并置:所有晶胞______排列、取向相同。 (4)晶格能 ①定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位:_________________。 ②影响因素 a.离子所带电荷数:离子所带电荷数越多,晶格能越大。 b.离子的半径:离子的半径________,晶格能越大。 ③与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度___________。2.四种晶体类型的比较
3.晶体熔沸点的比较 (1)不同类型晶体熔、沸点的比较 ①不同类型晶体的熔、沸点高低的一般规律:________________>离子晶体>____________。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 (2)同种晶体类型熔、沸点的比较
①原子晶体: 原子半径越小―→键长越短―→键能越大―→ ②离子晶体: a .一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO____MgCl 2______NaCl______CsCl 。 b .衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。 ③分子晶体: a .分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。如H 2O >H 2Te >H 2Se >H 2S 。 b .组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH 4>GeH 4>SiH 4>CH 4。 c .组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点____________,如CO >N 2,CH 3OH >CH 3CH 3。 d .同分异构体,支链越多,熔、沸点越低。 ④金属晶体: 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na <Mg <Al 。 2.在下列物质中:NaCl 、NaOH 、Na 2S 、H 2O 2、Na 2S 2、(NH 4)2S 、CO 2、CCl 4、C 2H 2、SiO 2、SiC 、晶体硅、金刚石。 (1)其中只含有离子键的离子晶体是________;
市场的四种类型 定义形成条件评价 完全 竞 争又称纯粹竞争,是指一 种竞争完全不受任何阻碍和干扰的市场结构 市场上有生产者与消费 者,且规模小无法决定市场价 格 市场上的产品是同质的, 即不存在产品差别 资源完全自由流动 市场信息是畅通的 1、供求平衡,资源 得到最优配置 2、成本低生产要素 效率得到充分发挥 3、价格最低,对消 费者有利 4、各厂商的平均最 低并不一定是社会成 本最低 5、产品无差别,消 费者的多种需求无法 得到满足 6规模小,不利于 技术发展 7、现实中很少 完全 垄 断又称垄断,是指整个行 业的市场完全处于一家厂商所控制的状态,即一家厂商控制了某种产品的市场 1、政府借助政权 对某一行业进行完全垄 断 2、政府特许的私 人完全垄断 3、某些产品市场 需求很小只有一家厂商 即可满足全部需求 4、某些厂商控制 了某些自然资源或矿藏, 从而对使用这些资源生 产的产品进行垄断 5、对生产某些产 品的特殊技术的控制 有害1、资源无法得 到充分利用造成浪费 2、厂商控制价格引 起消费者剩余的减少 和这回经济福利的损 失 3、厂商剥削,收入 分配不平等 4、可能阻碍科技进 步(也可能是促进) 5、政府垄断需具体 分析 垄断 竞 争指一种既有垄断又有竞 争,既不是完全垄断又不是完全竞争的市场结构 引起这种垄断竞争的基 本条件是产品差别的存在 1、垄断竞 争有利于鼓励进行 创新 2、垄断竞 争之下会使销售成 本,主要是广告成 本增加 寡头 垄指少数几家厂商垄断了 某一行业的市场,控制了这一行业的供给 优点:1、可以实现规模经济 3、有利于
断促进科技进步 缺点:寡头间勾结 抬高价格损害消费者 利益和社会经济福利
老虎型、猫头鹰型、鸽子、孔雀型四种客户类型类型特点方法克星 老虎强势,想控制,主导, 看中目标,不想浪费时 间。决策果断,对权威, 声望,地位感兴趣 同理,PMP,利益,蓝图,专 业。 猫头鹰,会建立信任感的 猫头鹰,要有勇气。 猫头鹰冷漠,理智,思考,犹 豫不做错的决定。 专业,(恰到好处的PMP), 数据,稀缺,限制,细致。 高敏感度的孔雀+老虎 鸽子话不多,说话慢,脾气 好,喜欢倾听,讲话稳, 下决定慢 给痛苦,帮客户下决定,注 意细节(数据),默认成交。 老虎+猫头鹰 孔雀爱表现,热情,说话快, 看重关系,人情压力。 倾听,PMP,给信心,描蓝图鸽子(充分的倾听,然后 给信心) 客户类型同行服务方案思维模式 老虎HC怎么帮我 做? 效果怎么 样? 都有谁在做? (老虎)1.HC的买家给我带 来的价值? 2.HC是怎么帮找买 家的? 1.建议一个最适合的方案, 满足我需求的? 2.价格有什么优惠,上促销 让我知道你是怎么帮我做的, 给我带来什么好处?我要付出什么? 少量PMP 孔雀HC怎么帮我 的同行做 的?1.什么样的买家,适 不适合我? 2.大买家有多少? 1.报价后上促销,优惠多少 钱? 2.让他知道占了多大便宜.. 让我知道HC,知道同行,有成功案例, PMP.描绘蓝图式的说服务; 让客户幻想一定能做大;
总结:孔雀需要一通电话打好,尤其的慧聪品牌和同行;猫头鹰要在合理性上做好,每通电话都要把道理讲通,关系建立到位;老虎需要FAB 的B 讲到位;鸽子要把同行渲染到位;(老虎和猫头鹰对销售人员的专业性要求比较高!)大部分决策层的人都是老虎和猫头鹰的多。 猫头鹰客户分析和对策 一、猫头鹰客户的声音表现:声音不大,语速不快,可能面无表情,不太爱互动,不表示友好。不管你说什么,可能经常会“嗯,嗯”,让你显得无从下手。 1、表现:嗯,我是,请讲; 嗯,你说; 可以啊,你说,你们怎么做的? 2、开场白:您好,请问下石磊石先生吧? 您好,我是慧聪公司北京总部打过来的,我姓张叫张明,很高兴和您通话;您这会说话方便吗?是这样的石先生,之前呢我们同事也应该都跟您联系过,我今天打电话过来主要是做个简单的了解,以便更好的帮到您?呵呵 我的同行具体是怎么做的? 还有哪些同行都这么做?(孔雀) 客户通过HC 直接找我采购 3.都有谁成交了,真 实的例子… 未来我有机会联系 大买家… 猫头鹰 为什么要这么做? 都有谁这么做? 他们做的怎么样? 他们具体是怎么做的? 你们是怎么 帮他们做 的?(猫头 鹰) 1.都有什么服务? 2.为什么会有这些 服务? 3.这些服务给我带 来的价值是什么? 4.我为什么要购买 这些服务? 1.你们都有什么方案? 2.哪个最适合我? 3.为什么? 4.上促销稀缺限制. 让我知道价值,利益,数据,PMP , 让我心里感受好,被得到认可; 鸽子 别人是怎么做的? 他们具体是怎么做的? 你们是怎么帮他做的? 如果是我应 该怎么做? 如果是我怎 么超过他。。。 (鸽子) 1.谁从HC 展会,买家,大买家上面进行宣传推广? 2.如果是我也来操 作,我将得到的价值 是什么? 1.同行都做的什么方案? 2.结合你的情况,建议你做××会员,二选一… 让他知道同行,同行的服务,同行的方 案,帮客户很快下决定;
比较说明各种市场结构的优缺点市场的最基本的含义是指商品交换的场所。对市场而言,重要的不是市场本身,甚至有无场所,而是在场所上所发生的活动。就此而言,将市场定义为:市场是商品交换的总和,或者说市场是买者和卖者相互作用共同决定商品或劳务的价格和交易数量的机制。 市场结构指的是:构成市场的买方之间、卖方之间、买卖双方之间以及市场上已有的和潜在的买方和卖方之间等诸关系的因素及其特征。 根据市场结构的影响因素或市场竞争程度的强弱,可以把市场结构分为完全竞争市场、完全垄断市场、垄断竞争市场和寡头垄断市场等四种类型。 一、完全竞争市场 (一)概念:完全竞争市场又称纯粹竞争市场,是指竞争充分而不受任何阻碍和干扰的一种市场结构。较为接近的市场就是一些农产品市场。 (二)完全竞争市场至少应同时具备以下四个条件: 1、市场上有大量的买者和卖者。 “大量”之意是指多到多一个不多,少一个不少这种境况。 那么,在此处判断“多”或“少”的标准是什么呢?是从厂商之间的相互影响来说的,“多一个不多”是指多一个厂商进入市场,对市场中别的厂商毫无影响;“少一个不 少”也是此意,即一个厂商离开此市场,也未给留在市场中的企业有减少市场竞争,扩大市场销售的好处。 那么,上面说到的“毫无影响”的“影响”在此又是所指何意呢?这是指企业的进出入市场对市场产品供给量的
影响进而对其它厂商产品销售价格、销售数量和销售收益的影响。“毫无影响”当然是指在这些方面毫无影响。 上述叙述的一个比方不过是说,完全竞争市场向一个大海,多一滴水或少一滴水并不影响大海(市场)的性质, 也不影响海中的每一滴水。 2、市场上所有厂商提供的产品都是同质的。这种同质性具体表现在: (1)各厂商提供的产品自身从里到外都是完全一样的,毫无区别。具体来说,就是所有的产品的质量、功能和外包装等方面都是完全一样的,没有任何可以进行区别的标 志 (2)为销售产品所提供的产前、产中、产后的服务都是完全一样的,没有任何不同,哪怕连售货员小姐都是一样的漂亮或一样的丑陋。 (3)在市场中的所有产品销售没有任何时空方面优势 或劣势,也都是完全一样的。 由于产品都一样,所以,没有一个厂商能对其产品按高一点的价格来卖,因为价高就不会买;同时,任何一个厂商也没有必要让其产品价格低于别的厂商来卖,因为任 何一个厂商产品产量相对于整个市场而言都是微不足道 的,不愁卖不掉,出于厂商利润最大化目的,厂商没有必要降价。所以,完全竞争市场的产品价格不受单个厂商的 影响。