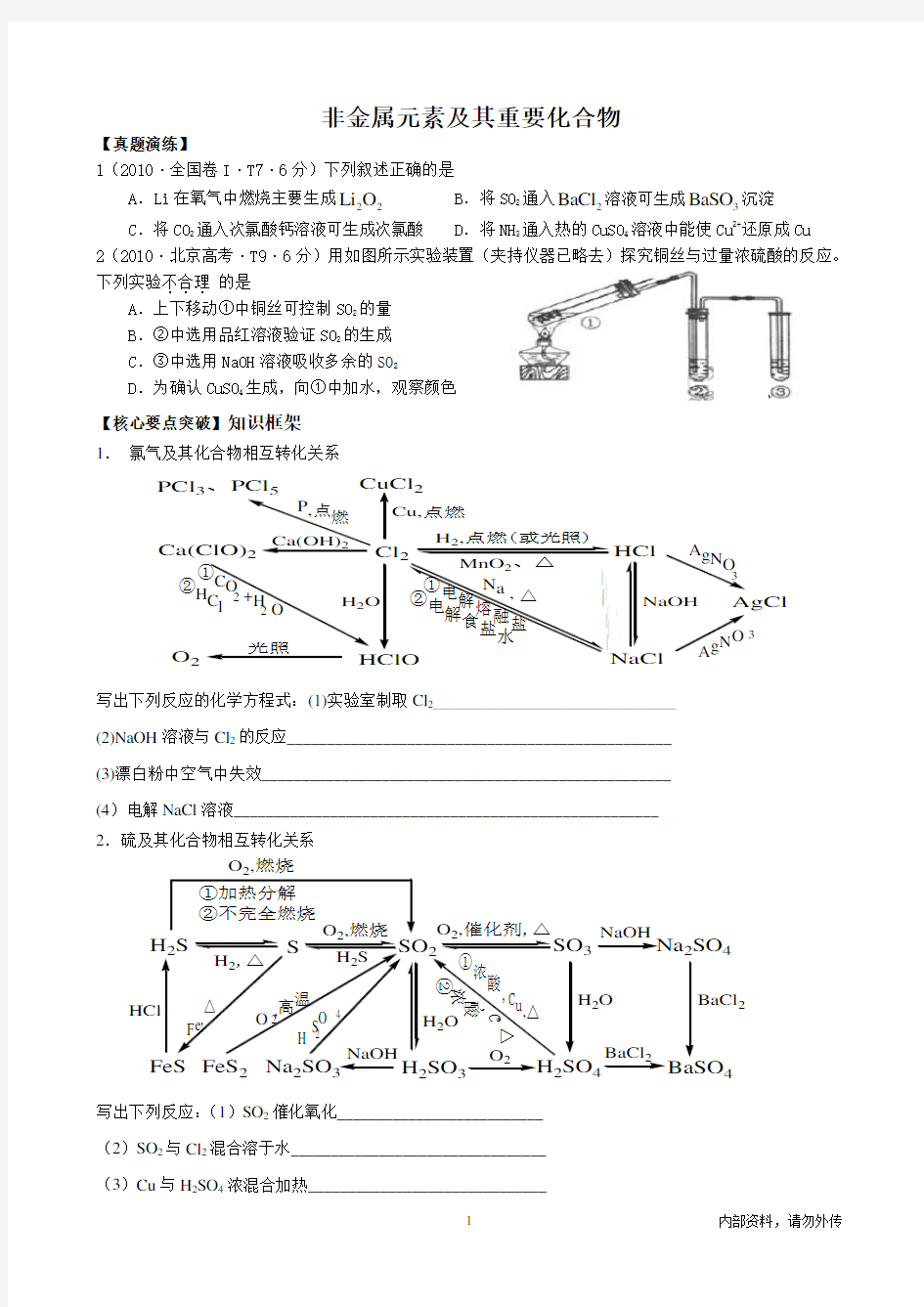

2
CuCl 2PCl 3、PCl HClO
O 2Ca(ClO)2①C O 2+H 2O ②C l P ,点燃
2点燃
NaCl
AgCl
NaOH H 2S O 4(浓)△
MnO 2、△
N a , △①电解熔融
盐②电解食盐水H 2O 光照
A g N O
3
A
g N O 3Ca(OH)2
2S S SO 23Na SO 4223H 22SO 44
HCl H 2,△O 2,燃烧H 2S O ,燃烧①加热分解②不完全燃烧
2NaOH O 22H 2O 2①
浓酸,C u ,△②
浓
酸
,C
, △
H 2O
H
2S O 4
O 2,
高温F e ,△
非金属元素及其重要化合物
【真题演练】
1(2010·全国卷I ·T7·6分)下列叙述正确的是
A .Li 在氧气中燃烧主要生成22
Li O
B .将SO 2通入2BaCl 溶液可生成3BaSO 沉淀
C .将CO 2通入次氯酸钙溶液可生成次氯酸
D .将NH 3通入热的CuSO 4溶液中能使Cu 2+
还原成Cu 2(2010·北京高考·T9·6分)用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理...
的是 A .上下移动①中铜丝可控制SO 2的量
B .②中选用品红溶液验证SO 2的生成
C .③中选用NaOH 溶液吸收多余的SO 2
D .为确认CuSO 4生成,向①中加水,观察颜色 【核心要点突破】知识框架
1. 氯气及其化合物相互转化关系
写出下列反应的化学方程式:(1)实验室制取Cl 2_____________________________________________ (2)NaOH 溶液与Cl 2的反应________________________________________________ (3)漂白粉中空气中失效___________________________________________________ (4)电解NaCl 溶液_____________________________________________________
2.硫及其化合物相互转化关系
写出下列反应:(1)SO 2催化氧化__________________________ (2)SO 2与Cl 2混合溶于水________________________________ (3)Cu 与H 2SO 4浓混合加热______________________________
NH 4Cl NH 3N
2NO
NO 2
HNO 3
NaNO 3
N 2O 4
Mg 3N 2NH 3·H 2O NH 4+ OH -+
Ca(OH)2,△HCl H 2,催化剂
高温 高压
O 2 , 放电O 2
H 2O NaOH O 2
浓H 2SO 4
△
①浓酸,Cu ②见光或△③C
Mg , 点燃H 2O
△△
23.氮及其化合物相互转化关系
写出下列反应:(1)实验室制取NH 3的反应__________________________ (2)Mg 3N 2 与H 2O 反应________________________________ (3)工业上合成氨的反应______________________________ 4.硅及其化合物之间的相互转化关系
写出下列反应:(1)碳高温还原SiO 2__________________________ (2)往Na 2SiO 3溶液中通入少量CO 2________________________________ (3)Si 与NaOH 溶液的反应______________________________
【核心要点突破】
一、非金属单质及其氧化物的共性和特性
1.常见非金属单质:Cl 2、Br 2、I 2、O 2、S 、N 2、P 4、H 2、C 、Si
(1)非金属元素在周期表中的位置和原子结构特点:
①位置:已知元素中,非金属共22种(包括6种稀有气体元素),除氢元素位于ⅠA 族外,其余都集中在元素周期表阶梯线(硼、硅、砷、碲、砹斜线)的右上方。
②原子结构特点及化合价:
Ⅰ.最外层电子均大于、等于3(除H 以外),与其主族序数相同。 Ⅱ.最高正价分别为:+4 +5 +6 +7(与族序数相等) 对应最低负价:-4 -3 -2 -1(等于族序数减8)
Ⅲ.非金属元素一般都有变价:除呈现上述最高价及最低价以外,有的非金属还呈现其它价态。如:S :+4价;N :+1 +2 +3 +4价; Cl :+1 +3 +5价。
(2)非金属单质的物理性质
①色态:多数常温下为气态,而Br 2为___态,I 2、S 、C 、Si 为___态;Cl 2为_____色,Br 2为____色,I 2为_____色。毒性:Cl 2、Br 2、I 2、有一定的毒性
2.非金属氧化物的性质
(1)常见的氧化物:SO2、 SO3、NO 、NO2、CO 、CO2、SiO2
(2)物理性质:①SO2、NO2有刺激性气味②NO2是_______气体
③除CO2、SiO2外均有毒④SO2易液化、SiO2是坚硬、难溶的固体
(3)化学性质
①与水反应:SO2、 SO3、NO2 、CO2 能与水反应
②与碱反应 SO2、 SO3、SiO2 、CO2 与OH- 反应生产酸式盐或正盐,
③氧化性
4、还原性
5 、特性
二、常见无机酸的重要规律和重要特性
1.最高价氧化物对应的酸的组成和酸性
(1)最高价氧化物对应的酸的组成
2.重要特性
(1)H2SiO3(或H2SiO4)为_____酸,浓盐酸、浓硝酸为_____酸。
(2)硝酸、浓H2SO4、次氯酸具有强氧化性,属于氧化性酸,其中硝酸、HClO见光受热易分解。
(3)浓HNO3和Cu(足量)、浓H2SO4和Cu(足量)、浓盐酸和(足量)在反应时,随着反应的进行,产物会发生变化或反应停止。
(4)浓H2SO4具有______、_______和______性。
(5)常温下,___,______遇浓H2SO4、浓HNO3发生钝化。
【课堂练兵】
1.(2010·山东高考·T13·4分)下列推断正确的是
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
2. (2010·天津高考·T3·6分)下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和A g+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和C H3CH2CH2CHO
【延伸拓展】
3.(2010·新课标全国卷·T27·15分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是____________________,其中发生反应的化学方程式为
__________________________________________________________。
(2)实验过程中,装置B、C中发生的现象分别是_______________、_______________,这些现象分别
说明SO2具有的性质是__________和_______________;装置B中发生反应的离子方程式为
_____________________________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:__________
______________________________________________________________________;
(4)尾气可采用____________________溶液吸收。
【类题拓展】常见漂白剂概括
(1)漂白剂的漂白作用是指使有机色质褪色的过程。常见有漂白作用的物质有SO2、HClO、H2O2。
(2)SO2的漂白过程是SO2和有机色质发生化合反应生成了不稳定的无色化合物,这种化合物在受热的时
候又会分解生成了原来的有色物质和SO2,因此SO2的漂白作用是可逆的。
(3)HClO、H2O2具有漂白性是因为他们具有强氧化性,能氧化有机色质而使其褪色,故它们的漂白过程是
不可逆的,是永久性的。
4.某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)利用B装置可制取的气体有___________(写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。若在丙中加入石蕊试液,实验过程中溶液发生的颜色变化为:
请在方框内填写出导致该阶段颜色变化的粒子符号。
(3)B、D、E装置相连后在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行实验。
①B中发生反应的化学方程式为____________ _______。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹____,再打开止水夹____,使烧杯中的水进入试管丁的操作是___ ___ _____。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是_______(气体按标准状况计算)。
5.已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,
E为液体,下图中箭头上的反应物和反应条件均已略去
(1)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是
气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有(填字母)。D 溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为(写成化合物、复合物或氧化物形式均可)。试描述气体C的物理性质_____________。
(2)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。通过上述
描述可知:A的化学式为,E的化学式为。当小心加热A与E化合时的生成物F 时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成的G+H的化学方程式。