
Quartus ii 10.0教程
说明
本文的部分章节,来源于本人翻译的Terasic DE2-115的英文入门文档。
平台
硬件:艾米电子EP2C8-2010增强版套件
软件:Quartus II 10.0 + ModelSim-Altera 6.5e (Quartus II 10.0) Starter Edition
内容
?典型的CAD流程
?开始
?新建工程
?录入Verilog设计
?编译设计
?引脚分配
?仿真设计电路
?编程及配置到FPGA器件
?测试设计电路
典型的CAD流程
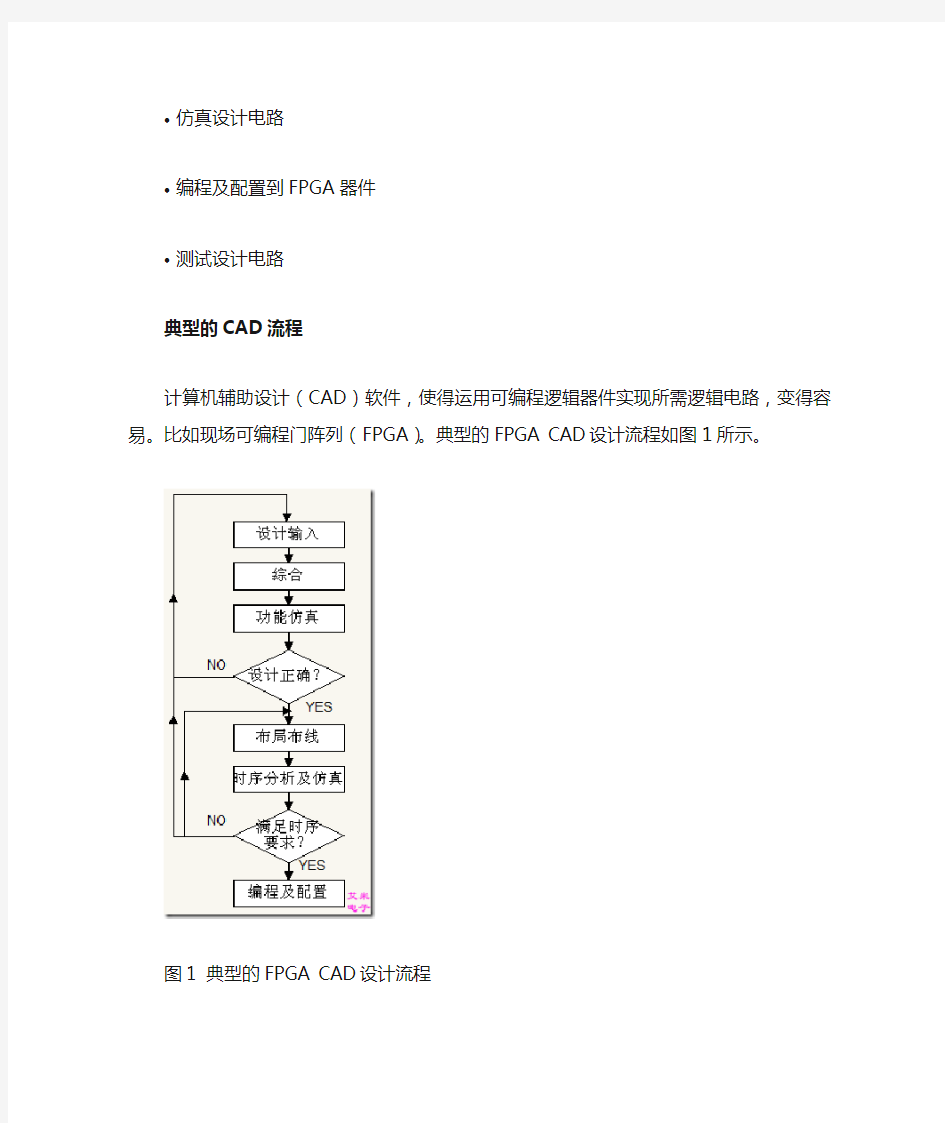
计算机辅助设计(CAD)软件,使得运用可编程逻辑器件实现所需逻辑电路,变得容易。比如现场可编程门阵列(FPGA)。典型的FPGA CAD设计流程如图1所示。
图1 典型的FPGA CAD设计流程
CAD流程包含以下步骤:
?设计输入——所需电路可通过原理图方式或硬件描述语言方式(如Verilog或VHDL)进行设计。
?综合——输入的设计被综合进入由逻辑元素(LEs,FPGA芯片提供)组成的电路中。
?功能仿真——综合电路被测试以验证其功能是否正确,次仿真不考虑时序因素。
?布局布线——CAD Fitter工具决定网表中定义的LEs如何布置成FPGA芯片中的实际LEs。
?时序分析——分析已布局布线电路中的不同路径的传播延迟,用以指示所需电路的性能。
?时序仿真——测试已布局布线电路,验证其是否在功能和时序上都正确。
?编程及配置——设计的电路,通过编程配置开关,被实现到一个物理的FPGA芯片。
配置开关用于配置LEs和建立所需线路连接。
本指南介绍Quartus II软件的基本特征。展示如何使用Verilog硬件描述语言来设计和实现电路。使用GUI来实现Quartus II指令。通过本份指南,读者将学习到:
?新建工程
?使用Verilog代码录入设计
?将综合的电路布局到Altera FPGA
?分配电路的输入输出到FPGA上的指定引脚
?仿真设计电路
?编程配置艾米电子EP2C8核心板上的FPGA芯片
1. 开始
在Quartus II中设计的每个逻辑电路或子电路,叫做一个工程。软件每次运行一个工程,并将所有信息保存在单一文件夹中。欲开始一个新的逻辑电路设计,第一步就是新建一个文件夹来保存文件。为了保存本指南的设计文件,在D盘新建introtutorial文件夹。指南者运行的范例为一个简单的双路灯控电路。
打开Quartus II软件,将看到类似于图2的画面。该显示画面包括若干窗口,用户可使用鼠标选择,以访问Quartus II软件的相关功能。Quartus II提供的大多数命令都可用菜单形式来访问。例如,在图2中,在File标签下点击左键,可打开如图3所示的菜单。用左键单击Exit可退出Quartus II软件。
图2 Quartus II主体显示
图3 File菜单一例
对于有些命令,需要连续访问两个或以上的菜单才可以使用。
1.1 Quartus II在线帮助
Quartus II软件提供了容易理解的在线文档,可解答许多在使用软件时遇到的问题。用户可通过选择Help>Search来快速访问帮助话题,在打开的对话框中,可以输入关键字。另外一个方法是,内容感应帮助,以快速查找指定话题的文档。在大多数的应用中,按住键盘上的F1键将打开一个显示该应用的可用命令的帮助窗口。
2 新建工程
按如下步骤新建工程:
1. 选择File>New Project Wizard,以打开图4所示窗口,可通过Don't show me this introduction again跳过此窗口步骤。单击Next,出现图5所示窗口。
图4 引导的任务显示
图5 创建新的工程
2. 选择工作文件夹introtutorial,也可以使用您自己设定的文件夹。工程必须有一个名字,通常情况下,与顶层设计实体的名字相同。如图5所示,选择light作为工程名和顶层实体名。单击Next。因为还没有创建introtutorial文件夹,Quartus II弹出一个对话框,询问是否新建所需文件夹,如图6所示。单击Yes,将会引出图7所示的窗口。
图6 创建新的工程文件夹与否?
图7 添加用户指定设计文件
3. 如果没有已存在的设计文件,单击Next,将会打开如图8所示的画面。
图8 选择器件家族和指定的器件
4. 艾米电子EP2C8核心板采用的器件为Cyclone II EP2C8Q208C8。此处选择Cyclone II器件家族,器件为PQFP封装,有208个引脚,速度等级为8。单击Next,出现图9所示画面。
图9 指定第三方EDA工具
5. 用户可指定一些第三方EDA工具。持续Simulation选用ModelSim-Altera,格式为Verilog HDL。单击Next,出现图10所示窗口。
6. 设置一览如图10所示。单击Finish,返回Quartus II主体窗口。标题栏将显示light工程,如图11所示。
图10 工程设置一览
图11 Quartus II显示已建工程
3 使用Verilog代码设计输入
作为一个设计范例,我们将采用双路的灯控电路,如图12所示。此灯可由两个按键中的任一按键来控制,x1和x2,按键的闭合相应的逻辑值为1。真值表也同时在图中给出。注意输入x1和x2是异或的关系,但是我们仍然用门来显示。
图12 灯控电路
所需电路,如图13所示,使用Verilog代码来描述。注意,Verilog模块叫做light,这个图5所示的名称是一致的。此代码的编辑可以使用任何可存储ASCII码的文本编辑器,或者使用Quartus II自带的编辑器。当然,文件的名称可以任意取;而和顶层Verilog模块的名称一致,是一个设计惯例。文件名称必须带.v扩展名,用以指示此文件为Verilog文件。所有,我们使用light.v这个名称。
图13 图12所示电路的Verilog代码
3.1 使用Quartus II 文本编辑器
本节将展示如何使用Quartus II文本编辑器。如果你喜欢使用其他文本编辑器来创建Verilog 源文件,可以逃过此节。选择File>New打开图14所示窗口,选择Verilog HDL File,并单击OK。这将打开文本编辑器窗口。第一步是指定所创建的文件的名称。选择File>Save As,打开图15所示的对话框。选择存储类型为Verilog HDL File,填写名称为light.v。单击Save,打开图16所示窗口。输入图13所示的代码。使用Ctrl+s保存该文件。
图14 选择新建的文件类型
图15 命名文件
图16 文本编辑器窗口
3.1.1 使用Verilog模板
对于设计者来说,Verilog的语法有时很难被记住。为了解决问题,文本编辑器提供了Verilog 模板集。这些模板提供了不同类型的Verilog表达的范例,譬如module声明、always块和设置语句的陈述。可以通过Edit>Insert Template>Verilog HDL来浏览这些模板,以熟悉这些资源,这是相当值得的。
3.3 添加设计文件到工程中
正如图7所讨论的那样,我们可以告诉Quartus II软件,哪些文件是当前工程的一部分。要查看当前的light工程中已包含的文件列表,选择Assignment>Setting>File,这将打开图17所示画面。另外一个可用的方法是选择标签Project>Add/Remove Files in Project。
使用Quartus II文本编辑器创建文件时,勾上Add file to current project选项,所创建文件即自动加入到工程文件列表。如果使用的不是Quartus II自带的文本编辑器,那么图17,列表中就没有所创建的文件,此时必须手动添加文件到工程文件列表中。欲添加文件到工程文件列表中,单击图17中的File Name:的按钮,弹出图18所示对话框,选择light.v,单击Open。再次查看图17画面,此时所添加的文件就已经在文件列表了。需要注意的是,在大多数案例中,Quartus II软件可根据各个实体自动找到正确的文件,即使某些文件没有被认真地添加到工程中。
然而,对于包含许多文件的复杂工程,按照上述方法,添加指定所需文件到工程中,是一个很好的设计惯例。
图17 设置窗口
图18 选择文件
4 编译设计电路
在light.v中Verilog代码,要经过几个Quartus II工具的处理:分析代码、综合电路以及生成目标芯片的实现内容。这些应用程序被聚集在一起,且被称作编译器。
选择Processing>Start Compilation运行编译器,或者单击按钮运行。在编译过程中,Quartus II的左边会显示不同阶段的进度。编译成功(或不成功)后,会弹出一个对话框。
单击OK确认。Qartus II会显示图19所示画面的编译报告。当编译成功后,也可以通过按钮手动打开编译报告。
图19 编译报告
在此窗口的左面,列出了许多信息的列表。如图19所示,本工程使用了1个LE和3个引脚。
4.1 错误
在编译期间,Quartus II在消息窗口,会显示生成的消息。如果此Verilog设计正确,其中一条消息就会显示编译成功及无错误。
如果编译不是零错误,那么在Verilog代码中,至少有一个错误。在这种情况下,与错误对应的消息就会在消息窗口显示。双击某条错误信息,该信息将会滚动显示完整;并且打开Quartus II自带文本编译器,Verilog代码中的某行将被高亮显示。类似的,编译器也会显示许多警告消息。同样的方法也适用于查看完整的警告消息。针对于某条错误或警告消息,想得到更多信息,可选住此条消息,然后按住F1功能键,即可查看。
我们将light.v的最后一行改成endmodules,重新编译。Quartus II弹出对话框,报告编译错误;单击OK,以确认。编译报告如图20所示。在消息窗口,单击Error标签,显示图21所示消息。双击第一条错误信息,Quartus II文本编辑器打开light.v,最后一行被高亮,如图22所示。修正代码,重新编译,直至成功为止。
图20 编译报告
图21 错误信息
图22 指示错误代码的位置
5 引脚分配
在艾米电子EP2C8-2010增强版套件中,我们使用LED[1]代表f,SW[1]和SW[2]分别代表x1和x2,所需引脚映射如图23所示。使用文本编辑器,新建一文件,命名为pins’ list.txt。录入图24所示内容。选择Assignments>Import Assignments,打开图25所示窗口。选择pins’
list.txt路径,单击OK导入引脚配置。选择Assignments>Pin Planner(或单击按钮),打开图26所示窗口,查看引脚是否分配正确。
图23 所需引脚映射
图24 引脚分配文件——pins’ list.txt
图25 导入设置
图26 查看引脚分配
5.1 配置未用引脚
未用引脚需要一定得约束,倘若没有这些约束,就有可能出现一些莫名其妙的问题。选择Assignments>Device>Device and Pin Options>Unused Pins,打开图27所示窗口。一般情况下,按照图28所示配置。
图27 配置未用引脚
图28 配置未用引脚为三态输入
6 仿真所设计的电路
在艾米电子EP2C8-2010增强版套件实现所需电路之前,审慎的做法是,先仿真以确定所设计电路是否正确。下面将介绍如何使用ModelSim-Altera仿真:
6.1 新建testbench文件
使用文本编辑器新建testbench文件,文件类型与图9一致,命名为light_tb.v;不要勾Add file to current project选项,即不可加入到Quartus工程文件夹列表。录入图29所示代码。
图29 light_tb.v
6.2 设置ModelSim-Altera路径
第一次使用需要先设置ModelSim-Altera路径。选择Tools>Options>General>EDA Tool Options,打开EDA工具选择,如图30所示,设置路径。单击OK,返回Quartus II主题界面。
图30 设置ModelSim-Altera路径
6.3 添加仿真所需测试文件
选择Assignments>Setting>EDA Tool Setting>Simulation,打开图31所示窗口。在NativeLink setting下,选择Compile test bench:标签,单击Test Benches按钮,打开图32所示窗口。单击New,弹出设置窗口,命名Test bench name:为light_tb(与前面编写light_tb.v一致);在File name:处,点击…按钮,添加light_tb文件路径;单击Add,完成后如图33所示。连续三次单击OK,返回Quartus II主题窗口。
图31 仿真选项设置
图32 指定Test Benches
图33 添加Test Benches
6.4 开始仿真
选择Tools>Run EDA Simulation Tool>EDA RTL Simulation,进行RTL仿真;或者选择Tools>Run EDA Simulation Tool>EDA Gate Level Simulation,进行门级仿真。此处以RTL仿真为示范。选择选择Tools>Run EDA Simulation Tool>EDA RTL Simulation,弹出图34所示仿真画面。稍等片刻,波形就会显现。
图34 ModelSim-Altera仿真画面
在Wave窗口右上角,单击,最大化Wave窗口,方便查看波形,如图35所示。将鼠
标放在想要查看的波形上面,按住Ctrl键,滚动鼠标滚轴,可以很方便地放大缩小波形。
图35 查看波形
7 编程及配置FPGA器件
7.1 安装下载电缆驱动
USB-Blaster用户,请参考https://www.doczj.com/doc/4f6287332.html,/literature/ug/ug_usb_blstr.pdf
?ByteBlaster II用户,请参考https://www.doczj.com/doc/4f6287332.html,/literature/ug/ug_bbii.pdf
?EthernetBlaster用户,请参考https://www.doczj.com/doc/4f6287332.html,/literature/ug/ug_ebcc.pdf
7.2 JTAG编程
将USB-Blaster与FPGA开发板连接在一起,打开FPGA开发板电源,回到Quartus II主题窗
口。选择Tools>Progrmmer或单击按钮,打开图35所示窗口。选择Mode为JTAG。缺省情况下,USB-Blaster没有被选中,单击Hardware Setup按钮,在弹出的窗口选择USB-Blaster,如图36所示,单击Close退出。
图36 编程器窗口
Abaqus操作技巧总结 打开abaqus,然后点击file——set work directory,然后选择指定文件夹,开始建模,建模完成后及时保存,在进行运算以前对已经完成的工作保存,然后点击job,修改inp文件的名称进行运算。切记切 记!!!!!! 1、如何显示梁截面(如何显示三维梁模型) 显示梁截面:view->assembly display option->render beam profiles,自己调节系数。 2、建立几何模型草绘sketch的时候,发现画布尺寸太小了 1)这个在create part的时候就有approximate size,你可以定义合适的(比你的定性尺寸大一倍); 2)如果你已经在sketch了,可以在edit菜单--sketch option ——general--grid更改 3、如何更改草图精度 可以在edit菜单--sketch option ——dimensions--display——decimal更改 如果想调整草图网格的疏密,可以在edit菜单--sketch option ——general——grid spacing中可以修改。 4、想输出几何模型 part步,file,outport--part 5、想导入几何模型? part步,file,import--part 6、如何定义局部坐标系 Tool-Create Datum-CSYS--建立坐标系方式--选择直角坐标系or柱坐标系or球坐标 7、如何在局部坐标系定义载荷
laod--Edit load--CSYS-Edit(在BC中同理)选用你定义的局部坐标系 8、怎么知道模型单元数目(一共有多少个单元) 在mesh步,mesh verify可以查到单元类型,数目以及单元质量一目了然,可以在下面的命令行中查看单元数。 Query---element 也可以查询的。 9、想隐藏一些part以便更清楚的看见其他part,edge等 view-Assembly Display Options——instance,打勾 10、想打印或者保存图片 File——print——file——TIFF——OK 11、如何更改CAE界面默认颜色 view->Grahphic options->viewport Background->Solid->choose the wite colour! 然后在file->save options. 12、如何施加静水压力hydrostatic load --> Pressure, 把默认的uniform 改为hydrostatic。这个仅用于standard,显式分析不支持。 13、如何检查壳单元法向 Property module/Assign/normal 14、如何输出单元体积 set步---whole model ----volume/Tickness/Corrdinate-----EVOL 15、如何显示最大、最小应力 在Visualization>Options>contour >Limits中选中Min/Max:Show Location,同样的方法可以知道具体指定值的位置。 16、如何在Visualization中显示边界条件 View——ODB display option——entity display——show boundary conditions 17、后处理有些字符(图例啊,版本号啊,坐标系啊)不想显示, viewport-viewport annotation option ,选择打勾。同样可以修改这些字体大小、位置等等。
生物化学简明教程 (第四版) 习题及答案 目录 1 绪论.............................................. 32蛋白质化学5? 3 核酸.............................................. 9 4 糖类的结构与功能 ................................ 15 5 脂类化合物和生物膜2?0 6 酶 (27) 7 维生素37? 8新陈代谢总论与生物氧化 .......................... 42 9 糖代谢4?7 10 脂质的代谢 (51) 11 蛋白质分解和氨基酸代谢5?4 12 核苷酸代谢 ....................... 错误!未定义书签。13DNA的生物合成?62 14 RNA的生物合成67? 15 蛋白质的生物合成?74 16 物质代谢的调节控制?77
? 1 绪论 1.生物化学研究的对象和内容是什么? 解答:生物化学主要研究: (1)生物机体的化学组成、生物分子的结构、性质及功能; (2)生物分子分解与合成及反应过程中的能量变化; (3)生物遗传信息的储存、传递和表达; (4)生物体新陈代谢的调节与控制。 2.你已经学过的课程中哪些内容与生物化学有关。 提示:生物化学是生命科学的基础学科,注意从不同的角度,去理解并运用生物化学的知识。 3.说明生物分子的元素组成和分子组成有哪些相似的规侓。 解答:生物大分子在元素组成上有相似的规侓性。碳、氢、氧、氮、磷、硫等6种是蛋白质、核酸、糖和脂的主要组成元素。碳原子具有特殊的成键性质,即碳原子最外层的4个电子可使碳与自身形成共价单键、共价双键和共价三键,碳还可与氮、氧和氢原子形成共价键。碳与被键合原子形成4个共价键的性质,使得碳骨架可形成线性、分支以及环状的多种多性的化合物。特殊的成键性质适应了生物大分子多样性的需要。氮、氧、硫、磷元素构成了生物分子碳骨架上的氨基(—NH 2)、羟基(—O H)、羰基(C O )、羧基(—C OOH)、巯基(—SH)、磷酸基(—PO 4 )等功能基团。这些功能基团因氮、硫和磷有着可变的氧化数及氮和氧有着较强的电负性而与生命物质的许多关键作用密切相关。 生物大分子在结构上也有着共同的规律性。生物大分子均由相同 类型的构件通过一定的共价键聚合成链状,其主链骨架呈现周期性重复。构成蛋白质的构件是20种基本氨基酸。氨基酸之间通过肽键相连。肽链具有方向性(N 端→C 端),蛋白质主链骨架呈“肽单位”重复;核酸的构件是核苷酸,核苷酸通过3′, 5′-磷酸二酯键相连,核酸链也具有方向
1 绪论 1.生物化学研究的对象和内容是什么? 解答:生物化学主要研究: (1)生物机体的化学组成、生物分子的结构、性质及功能; (2)生物分子分解与合成及反应过程中的能量变化; (3)生物遗传信息的储存、传递和表达; (4)生物体新陈代谢的调节与控制。 2.你已经学过的课程中哪些内容与生物化学有关。 提示:生物化学是生命科学的基础学科,注意从不同的角度,去理解并运用生物化学的知识。 3.说明生物分子的元素组成和分子组成有哪些相似的规侓。 解答:生物大分子在元素组成上有相似的规侓性。碳、氢、氧、氮、磷、硫等6种是蛋白质、核酸、糖和脂的主要组成元素。碳原子具有特殊的成键性质,即碳原子最外层的4个电子可使碳与自身形成共价单键、共价双键和共价三键,碳还可与氮、氧和氢原子形成共价键。碳与被键合原子形成4个共价键的性质,使得碳骨架可形成线性、分支以及环状的多种多性的化合物。特殊的成键性质适应了生物大分子多样性的需要。氮、氧、硫、磷元素构成了生物分子碳骨架上的氨基(—NH 2)、羟基(— OH )、羰基(C O )、羧基(—COOH )、巯基(—SH )、磷酸基(—PO 4 )等功能基团。这些功能基团因氮、硫和磷有着可变的氧化数及氮和氧有着较强的电负性而与生命物质的许多关键作用密切相关。生物大分子在结构上也有着共同的规律性。生物大分子均由相同类型的构件通过一定的共价键聚合成链状,其主链骨架呈现周期性重复。构成蛋白质的构件是20种基本氨基酸。氨基酸之间通过肽键相连。肽链具有方向性(N 端→C 端),蛋白质主链骨架呈“肽单位”重复;核酸的构件是核苷酸,核苷酸通过3′, 5′-磷酸二酯键相连,核酸链也具有方向性(5′、→3′ ),核酸的主链骨架呈“磷酸-核糖(或脱氧核糖)”重复;构成脂质的构件是甘油、脂肪酸和胆碱,其非极性烃长链也是一种重复结构;构成多糖的构件是单糖,单糖间通过糖苷键相连,淀粉、纤维素、糖原的糖链骨架均呈葡萄糖基的重复。2 蛋白质化学 1.用于测定蛋白质多肽链N 端、C 端的常用方法有哪些?基本原理是什么? 解答:(1) N-末端测定法:常采用2,4―二硝基氟苯法、Edman 降解法、丹磺酰氯法。 ①2,4―二硝基氟苯(DNFB 或FDNB)法:多肽或蛋白质的游离末端氨基与2,4―二硝基氟苯(2,4―DNFB )反应(Sanger 反应),生成DNP ―多肽或DNP ―蛋白质。由于DNFB 与氨基形成的键对酸水解远比肽键稳定,因此DNP ―多肽经酸水解后,只有N ―末端氨基酸为黄色DNP ―氨基酸衍生物,其余的都是游离氨基酸。② 丹磺酰氯(DNS)法:多肽或蛋白质的游离末端氨基与与丹磺酰氯(DNS ―Cl )反应生成DNS ―多肽或DNS ―蛋白质。由于DNS 与氨基形成的键对酸水解远比肽键稳定,因此DNS ―多肽经酸水解后,只有N ―末端氨基酸为强烈的荧光物质DNS ―氨基酸,其余的都是游离氨基酸。③ 苯异硫氰酸脂(PITC 或Edman 降解)法:多肽或蛋白质的游离末端氨基与异硫氰酸苯酯(PITC )反应(Edman 反应),生成苯氨基硫甲酰多肽或蛋白质。在酸性有机溶剂中加热时,N ―末端的PTC ―氨基酸发生环化,生成苯乙内酰硫脲的衍生物并从肽链上掉下来,除去N ―末端氨基酸后剩下的肽链仍然是完整的。④ 氨肽酶法:氨肽酶是一类肽链外切酶或叫外肽酶,能从多肽链的N 端逐个地向里切。根据不同的反应时间测出酶水解释放的氨基酸种类和数量,按反应时间和残基释放量作动力学曲线,就能知道该蛋白质的N 端残基序列。(2)C ―末端测定法:常采用肼解法、还原法、羧肽酶法。 肼解法:蛋白质或多肽与无水肼加热发生肼解,反应中除C 端氨基酸以游离形式存 在外,其他氨基酸都转变为相应的氨基酸酰肼化物。 ② 还原法:肽链C 端氨基酸可用硼氢化锂还原成相应的α―氨基醇。肽链完全水解后,代表原来C ―末端氨基酸的α―氨基醇,可用层析法加以鉴别。③ 羧肽酶法:是一类肽链外切酶,专一的从肽链的C ―末端开始逐个降解,释放出游离的氨基酸。被释放的氨基酸数目与种类随反应时间的而变化。根据释放的氨基酸量(摩尔数)与反应时间的关系,便可以知道该肽链的C ―末端氨基酸序列。2.测得一种血红蛋白含铁0.426%,计算其最低相对分子质量。一种纯酶按质量计算含亮氨酸1.65%和异亮氨酸2.48%,问其最低相对分子质量是多少?解答: (1)血红蛋白: 55.8100100131000.426??=铁的相对原子质量最低相对分子质量==铁的百分含量 (2)酶: 因为亮氨酸和异亮氨酸的相对分子质量相等,所以亮氨酸和异亮氨酸的残基数之比为:1.65%:2.48%=2:3,因此,该酶分子中至少含有2个亮氨酸,3个异亮氨酸。()r 2131.11100159001.65M ??=≈最低 ()r 3131.11100159002.48M ??=≈最低 3.指出下面pH 条件下,各蛋白质在电场中向哪个方向移动,即正极,负极,还是保持原点? (1)胃蛋白酶(pI 1.0),在pH 5.0; (2)血清清蛋白(pI 4.9),在pH 6.0; (3)α-脂蛋白(pI 5.8),在pH 5.0和pH 9.0; 解答:(1)胃蛋白酶pI 1.0<环境pH 5.0,带负电荷,向正极移动; (2)血清清蛋白pI 4.9<环境pH 6.0,带负电荷,向正极移动; (3)α-脂蛋白pI 5.8>环境pH 5.0,带正电荷,向负极移动; α-脂蛋白pI 5.8<环境pH 9.0,带负电荷,向正极移动。 4.何谓蛋白质的变性与沉淀?二者在本质上有何区别? 解答:蛋白质变性的概念:天然蛋白质受物理或化学因素的影响后,使其失去原有的生物活性,并伴随着物理化学性质的改变,这种作用称为蛋白质的变性。变性的本质:分子中各种次级键断裂,使其空间构象从紧密有序的状态变成松散无序的状态,一级结构不破坏。
22 后处理 22.1 显示局部坐标系上的结果 问:我前处理用的是直角坐标系,但是我想在后处理中输出关于柱坐标的位移分量 是不是要设计局部的坐标系?怎样设计? 答:后处理时点菜单tools / coordinates system / create, 创建柱坐标系(例如使用默认的名称csys-1). 菜单result / options, 点tranformation, 点user-specified, 选中csys-1, 点OK. 窗口左上角显示的变量如果原来是U, U1,现在就变为U,U1(CSYS-1). 22.1 显示局部坐标系上的结果 问:我前处理用的是直角坐标系,但是我想在后处理中输出关于柱坐标的位移分量 是不是要设计局部的坐标系?怎样设计? 答:后处理时点菜单tools / coordinates system / create, 创建柱坐标系(例如使用默认的名称csys-1). 菜单result / options, 点tranformation, 点user-specified, 选中csys-1, 点OK. 窗口左上角显示的变量如果原来是U, U1,现在就变为U,U1(CSYS-1). 22.2 绘制曲线(X–Y data) 问:例如我想用odb文件建立这样一个曲线: x y(自行指定) currentmax("my-xy01") 1.0 currentmax("my-xy02") 3.3 ……………… 搜索了半天也找不到,在此向用过的前辈请教,或者有第三方软件也请指点。(虽然我手工 excel也能做,但是那个时间就……-_-b) 答: 后处理菜单 tools / XY Data / Create, 先创建你的"my-xy01",再选择Operate on XY Data,
《生物化学简明教程》附带的习题答案 (一)用于测定蛋白质多肽链N端、C端的常用方法有哪些? 解答:(1)N-末端测定法:常采用2,4―二硝基氟苯法、Edman降解法、丹磺酰氯法。 (2)C―末端测定法:常采用肼解法、还原法、羧肽酶法。 (二)何谓蛋白质的变性与沉淀?二者在本质上有何区别? 解答:蛋白质的变性:天然蛋白质受物理或化学因素的影响后,使其失去原有的生物活性,并伴随着物理化学性质的改变的作用。 变性的本质:分子中各种次级键断裂,使其空间构象从紧密有序的状态变成松散无序的状态,一级结构不破坏。 蛋白质变性后的表现:①生物学活性消失②理化性质改变:溶解度下降,黏度增加,紫外吸收增加,侧链反应增强,对酶的作用敏感,易被水解。 蛋白质由于带有电荷和水膜,因此在水溶液中形成稳定的胶体。如果在蛋白质溶液中加入适当的试剂,破坏了蛋白质的水膜或中和了蛋白质的电荷,则蛋白质胶体溶液就不稳定而出现沉淀现象。沉淀机理:破坏蛋白质的水化膜,中和表面的净电荷。 蛋白质的沉淀可以分为两类: (1)可逆的沉淀:蛋白质的结构未发生显著的变化,除去引起沉淀的因素,蛋白质仍能溶于原来的溶剂中,并保持天然性质。。 (2)不可逆沉淀:蛋白质分子内部结构发生重大改变,蛋白质变性而沉淀,不再能溶于原溶剂。 蛋白质变性后,有时由于维持溶液稳定的条件仍然存在,并不析出。因此变性蛋白质并不一定都表现为沉淀,而沉淀的蛋白质也未必都已经变性。 (三)一个α螺旋片段含有180个氨基酸残基,该片段中有多少圈螺旋?计算该α-螺旋片段的轴长。 解答:180/3.6=50圈,50×0.54=27nm,该片段中含有50圈螺旋,其轴长为27nm。 (五)如果人体有1014个细胞,每个体细胞的DNA含量为6.4 × 109个碱基对。试计算人体DNA 的总长度是多少?是太阳―地球之间距离(2.2 × 109 km)的多少倍?已知双链DNA每1000个核苷酸重1 ×10-18g,求人体DNA的总质量。 解答:每个体细胞的DNA的总长度为:6.4 × 109 × 0.34nm = 2.176 × 109 nm = 2.176m,人体内所有体细胞的DNA的总长度为:2.176m×1014 = 2.176×1011km,这个长度与太阳―地球之间距离(2.2×109 km)相比为:2.176 × 1011/2.2 × 109 = 99倍,每个核苷酸重1 × 10-18g/1000 = 10-21g,所以,总DNA 6.4 × 1023 × 10-21 = 6.4 × 102 = 640g。 (六)如何看待RNA功能的多样性?它的核心作用是什么? 解答:RNA的功能主要有: ①控制蛋白质合成 ②作用于RNA转录后加工与修饰 ③参与细胞功能的调节 ④生物催化与其他细胞持家功能 ⑤遗传信息的加工 ⑥可能是生物进化时比蛋白质和DNA更早出现的生物大分子。 其核心作用是既可以作为信息分子又可以作为功能分子发挥作用。 (七)什么是DNA变性?DNA变性后理化性质有何变化? 解答:DNA双链转化成单链的过程称变性。 DNA变性后的理化性质变化主要有:
1、氨基酸:是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上 2、等电点:使氨基酸分子处于兼性离子状态,即分子的所带静电荷为零,在电场中不发生迁移的pH值。等电聚胶电泳(IFE):利用一种特殊的缓冲液(两性电解质)在聚丙烯酰氨凝胶制造一个pH梯度,电泳时,每种蛋白质迁移到它的等电点(pI)处,即梯度足的某一pH时,就不再带有净的正或负电荷了 3、肽键:一个氨基酸的羧基与另一个的氨基的氨基缩合,除去一分子水形成的酰氨键。肽:两个或两个以上氨基通过肽键共价连接形成的聚合物 4、构形:有机分子中各个原子特有的固定的空间排列。这种排列不经过共价键的断裂和重新形成是不会改变的。构形的改变往往使分子的光学活性发生变化。 5 6 7 8 9 10 11 12 13 14 15 16 ( 17 应 18 19 21 22 23 24 25,辅基:是与酶蛋白质共价结合的金属离子或一类有机化合物,用透析法不能除去。辅基在整个酶促反应过程中始终与酶的特定部位结合 26、变旋现象:葡萄糖在水溶液中出现旋光度变化的现象。 27、糖苷键:单糖的半缩醛上羟基与非糖物质的羟基形成的缩醛结构称为糖苷,形成的化学键称为糖苷键 29、生物氧化:生物体内有机物质氧化而产生大量能量的过程称为生物氧化。 30、呼吸链:代谢物上的氢原子被脱氢酶激活脱落后,经过一系列的传递体,最后传递给激活的氧分子,而生成水的全部体系称为呼吸链。
31、氧化磷酸化:在底物脱氢被氧化时,电子或氢原子在呼吸链上的传递过程中伴随ADP 磷酸化生成ATP 的作用,称为氧化磷酸化。 32、磷氧比:电子经过呼吸链的传递作用最终与氧结合生成水,在此过程中所释放的能量用于ADP 磷酸化生成ATP。经此过程消耗一个原子的氧所要消耗的无机磷酸的分子数(也是生成ATP 的分子数)称为磷氧比值(P/O)。如NADH 的磷氧比值是3,FADH2 的磷氧比值是2。 33、底物水平磷酸化:在底物被氧化的过程中,底物分子内部能量重新分布产生高能磷酸键的中间产物,通过酶的作用使ADP生成ATP的过程,称为底物水平磷酸化。 电子传递磷酸化:当电子从NADP或FADH2经过电子传递体系(呼吸链),传递给氧形成水时,同时伴有ADP磷酸化为ATP,这一全过程称为电子传递磷酸化。 34、变构调节:变构调节是指某些调节物能与酶的调节部位结合使酶分子的构象发生改变,从而改变酶的活性,称酶的变构调节 35、糖异生:非糖物质(如丙酮酸乳酸甘油生糖氨基酸等)转变为葡萄糖的过程。 36、糖酵解:葡萄糖在人体组织中,经无氧分解生成乳酸的过程,和酵母菌使葡萄糖生醇发酵的过程基本相同。称为糖酵解 37糖可分为:(1)单糖:不能被水解成更小分子的糖。(2)寡糖:2-6个单糖分子脱水缩合而成,以双糖最为普遍,意义也较大。(3)多糖:均一性多糖:淀粉、糖原、纤维素、半纤维素、几丁质 1、什么是蛋白质的变性作用和复性作用?蛋白质变性后哪些性质会发生改变? 答:蛋白质变性作用是指在某些因素的影响下,蛋白质分子的空间构象被破坏,并导致其性质和生物活性改变的现象。蛋白质变性后会发生以下几方面的变化: (1)生物活性丧失;(2)理化性质的改变,包括:溶解度降低,因为疏水侧链基团暴露;结晶能力丧失;分子形状改变,由球状分子变成松散结构,分子不对称性加大;粘度增加;光学性质发生改变,如旋光性、紫外吸收光谱等均有所改变。(3)生物化学性质的改变,分子结构伸展松散,易被蛋白酶分解 2、蛋白质有哪些重要功能 答:蛋白质的重要作用主要有以下几方面:(1)生物催化作用酶是蛋白质,具有催化能力,新陈代谢的所有化学反应几乎都是在酶的催化下进行的。(2)结构蛋白有些蛋白质的功能是参与细胞和组织的建成。(3)运输功能如血红蛋白具有运输氧的功能。(4)收缩运动收缩蛋白(如肌动蛋白和肌球蛋白)与肌肉收缩和细胞运动密切相关。(5)激素功能动物体内的激素许多是蛋白质或多肽,是调节新陈代谢的生理活性物质。(6)免疫保护功能抗体是蛋白质,能与特异抗原结合以清除抗原的作用,具有免疫功能。(7)贮藏蛋白有些蛋白质具有贮藏功能,如植物种子的谷蛋白可供种子萌发时利用。(8)接受和传递信息生物体中的受体蛋白能专一地接受和传递外界的信息。(9)控制生长与分化有些蛋白参与细胞生长与分化的调控。(10)毒蛋白能引起机体中毒症状和死亡的异体蛋白,如细菌毒素、蛇毒、蝎毒、蓖麻毒素等。 3、DNA 分子二级结构有哪些特点? 按Watson-Crick 模型,DNA 的结构特点有:两条反相平行的多核苷酸链围绕同一中心轴互绕;碱基位于结构的内侧,而亲水的糖磷酸主链位于螺旋的外侧,通过磷酸二酯键相连,形成核酸的骨架;碱基平面与轴垂直,糖环平面则与轴平行。两条链皆为右手螺旋;双螺旋的直径为2nm,碱基堆积距离为0.34nm,两核酸之间的夹角是36°,每对螺旋由10 对碱基组成;碱基按A=T,G=C 配对互补,彼此以氢键相连系。维持DNA 结构稳定的力量主要是碱基堆积力;双螺旋结构表面有两条螺形凹沟,一大一小。 4、在稳定的DNA 因素: 答:在稳定的DNA 双螺旋中,碱基堆积力和碱基配对氢键在维系分子立体结构方面起主要作用。还有疏水核心和环境中的正离子。 5、简述酶作为生物催化剂与一般化学催化剂的共性及其个性? 答:(1)共性:用量少而催化效率高;仅能改变化学反应的速度,不改变化学反应的平衡点,酶本身在化学反应前后也不改变;可降低化学反应的活化能。(2)个性:酶作为生物催化剂的特点是催化效率更高,具有高度的专
ABAQUS中的壳单元S33代表的是壳单元法线方向应力,S11 S22 代表壳单元面内的应力。因为壳单元的使用范围是“沿厚度方向应力为0”,也即沿着法相方向应力为0,且满足几何条件才能使用壳单元,所以所有壳单元的仿真结果应力查看到的S33应力均为0。 S11 S22 S33 实体单元是代表X Y Z三个方向应力,但壳单元不是,另外壳单元只有S12,没有S13,S23。 LE----真应变(或对数应变) LEij---真应变 ... 应变分量; PE---塑性应变分量; PEEQ---等效塑性应变 ABAQUS Field Output Stresses S stress components and invariants 应力分量和变量 SVAVG volume-averaged stress components and invariants (Eulerian only) MISESMAX 最大 Mises 应力 TSHR transverse shear stress(for thick shells)横向剪切应力 CTSHR transverse shear stress in stacked continuum shells 连续堆垛壳横向剪切应力 TRIAX stress triaxiality 应力三轴度 VS stress in the elastic-viscous network 弹粘性网格应力PS stress in the plastic-viscous network 塑粘性网格应力 SFABRIC stress components in fabric constitutive measure 纤维本构应力分量 SSAVG average shell section stress 平均壳节点应力 Strain E total strain components 总应变分量 VE viscous strain in the elastic-viscous network 黏性应变弹黏性网格PE plastic strain components 塑性应变分量 PEVAVG volume-averaged plastic strain components (Eulerian only) VEEQ equivalent viscous
15 蛋白质的生物合成 1.一个编码蛋白质的基因,由于插入一段4个核苷酸序列而被破坏的功能,是否可被一个核苷酸的缺失所恢复解释原因。 解答:一个编码蛋白质的基因,如果插入4个核苷酸序列,就会发生移码突变,即从插入处开始此蛋白质的氨基酸顺序都发生了变化,导致此蛋白质功能的丧失。但如果在此插入段相邻处缺失一个核苷酸,此蛋白质仅在插入处的几个氨基酸发生了改变,如果此变异不是蛋白质发挥功能必需的部位,那么此蛋白质可能恢复其功能。 2.一个双螺旋DNA片段的模板链含有顺序: 5'GTTAACACCCCTGACTTCGCGCCGTCG 3' (a)写出从这条链转录产生的mRNA的碱基顺序; (b)从(a)中的mRNA的5-末端开始翻译产生的肽链的氨基酸顺序是什么(参考密码表) (c)合成此多肽需消耗多少ATP 解答:(a)转录产生mRNA的碱基顺序为: 5-CGACGGCGCGAAGUCAGGGGUGUUAAC-3 (b) Arg-Arg-Arg-Glu-Val-Arg-Gly-Val-Lys(不考虑起始密码和终止密码) (c) 在蛋白质合成过程中,每个氨基酸活化消耗2个高能键(ATP→AMP),进位和转肽各需要1个GTP,每往肽链中加入1个氨基酸要消耗4个ATP,所以以上肽链合成需要9×4=36个ATP (不考虑起始和终止)。 3.原核生物是如何区分AUG是起始密码还是多肽链内部Met的密码的 解答:原核生物在起始密码上游约10个核苷酸处(即-10区)通常有一段富含嘌呤的序列,称为SD序列(Shine-Dalgain sequence)。SD序列可以与小亚基16S rRNA 3′-末端的序列互补,使mRNA与小亚基结合,使得核糖体能够识别正确的起始密码AUG。而多肽链内部Met的密码前没有SD序列。 4.原核生物蛋白质合成体系由哪些物质组成各起什么作用 解答:原核生物蛋白质合成体系的物质组成和作用。详见。 5.简述蛋白质合成的起始、延长和终止过程。 解答:详见15.2.3,,。 6.试比较原核生物与真核生物在蛋白质合成上的差异。 解答:(1)原核生物转录和翻译同步进行,真核生物转录产物要加工后才进行翻译。 (2)原核生物核糖体为70S,由50S与30S两个亚基组成;真核生物核糖体为80S,由60S与40S两个亚基组成。 (3)原核生物的蛋白质合成起始于甲酰甲硫氨酸,需起始因子IF-1、IF-2、 IF-3及GTP、Mg2+参加。真核生物的蛋白质合成起始于甲硫氨酸,起始因子为 eIF-1、eIF-2、eIF-3、
a b a q u s后处理中各应力 解释个人收集修订版 IBMT standardization office【IBMT5AB-IBMT08-IBMT2C-ZZT18】
ABAQUS中的壳单元S33代表的是壳单元法线方向应力,S11 S22 代表壳单元面内的应力。因为壳单元的使用范围是“沿厚度方向应力为0”,也即沿着法相方向应力为0,且满足几何条件才能使用壳单元,所以所有壳单元的仿真结果应力查看到的S33应力均为0。 S11 S22 S33 实体单元是代表X Y Z三个方向应力,但壳单元不是,另外壳单元只有S12,没有S13,S23。 LE----真应变(或对数应变) LEij---真应变 ... 应变分量; PE---塑性应变分量; PEEQ---等效塑性应变 ABAQUS Field Output Stresses S stress components and invariants 应力分量和变量 SVAVG volume-averaged stress components and invariants (Eulerian only) MISESMAX 最大 Mises 应力 TSHR transverse shear stress(for thick shells)横向剪切应力 CTSHR transverse shear stress in stacked continuum shells 连续堆垛壳横向剪切应力 TRIAX stress triaxiality 应力三轴度 VS stress in the elastic-viscous network 弹粘性网格应力 PS stress in the plastic-viscous
生物化学简明教程(第四版)课后习题
————————————————————————————————作者: ————————————————————————————————日期:
2蛋白质化学 1.用于测定蛋白质多肽链N端、C端的常用方法有哪些?基本原理是什么? 解答:(1) N-末端测定法:常采用2,4―二硝基氟苯法、Edman降解法、丹磺酰氯法。 ①2,4―二硝基氟苯(DNFB或FDNB)法:多肽或蛋白质的游离末端氨基与2,4―二硝基氟苯(2,4―DNFB)反应(Sanger反应),生成DNP―多肽或DNP―蛋白质。由于DNFB与氨基形成的键对酸水解远比肽键稳定,因此DNP―多肽经酸水解后,只有N―末端氨基酸为黄色DNP―氨基酸衍生物,其余的都是游离氨基酸。 ②丹磺酰氯(DNS)法:多肽或蛋白质的游离末端氨基与与丹磺酰氯(DNS―Cl)反应生成DNS―多肽或DNS―蛋白质。由于DNS与氨基形成的键对酸水解远比肽键稳定,因此DNS―多肽经酸水解后,只有N―末端氨基酸为强烈的荧光物质DNS―氨基酸,其余的都是游离氨基酸。 ③苯异硫氰酸脂(PITC或Edman降解)法:多肽或蛋白质的游离末端氨基与异硫氰酸苯酯(PITC)反应(Edman反应),生成苯氨基硫甲酰多肽或蛋白质。在酸性有机溶剂中加热时,N―末端的PTC―氨基酸发生环化,生成苯乙内酰硫脲的衍生物并从肽链上掉下来,除去N―末端氨基酸后剩下的肽链仍然是完整的。 ④氨肽酶法:氨肽酶是一类肽链外切酶或叫外肽酶,能从多肽链的N端逐个地向里切。根据不同的反应时间测出酶水解释放的氨基酸种类和数量,按反应时间和残基释放量作动力学曲线,就能知道该蛋白质的N端残基序列。 (2)C―末端测定法:常采用肼解法、还原法、羧肽酶法。 肼解法:蛋白质或多肽与无水肼加热发生肼解,反应中除C端氨基酸以游离形式存在外,其他氨基酸都转变为相应的氨基酸酰肼化物。 ②还原法:肽链C端氨基酸可用硼氢化锂还原成相应的α―氨基醇。肽链完全水解后,代表原来C―末端氨基酸的α―氨基醇,可用层析法加以鉴别。 ③羧肽酶法:是一类肽链外切酶,专一的从肽链的C―末端开始逐个降解,释放出游离的氨基酸。被释放的氨基酸数目与种类随反应时间的而变化。根据释放的氨基酸量(摩尔数)与反应时间的关系,便可以知道该肽链的C―末端氨基酸序列。 2.测得一种血红蛋白含铁0.426%,计算其最低相对分子质量。一种纯酶按质量计算含亮氨酸1.65%和异亮氨酸2.48%,问其最低相对分子质量是多少? 解答: (1)血红蛋白:
生物化学简明教程最精简重点 一、名词解释 增色效应:核酸水解为核苷酸,紫外吸收值增加30%~40%的现象。 减色效应:复性后,核酸的紫外吸收降低 一碳单位:指具有一个碳原子的基团。 生物化学:研究生物体组成及变化规律的基础学科 Tm值:即溶解温度,即紫外线吸收的增加量达到最大增量的一半时的温度 酶活性部位:在整个酶分子中,参与对底物的结合与催化作用的一小部分区域的氨基酸残基 ] 氧化磷酸化:伴随放能的氧化作用而进行的磷酸化作用 呼吸链:代谢物上的氢原子被脱氢酶激活脱落后,经过一系列的传递体,最后传递给被激活的氧化分子,并与之结合生成水的全部体系 糖酵解:1mol葡萄糖变成2mol丙酮酸并伴随ATP生成的过程 底物磷酸化:直接利用代谢中间物氧化释放的能量产生ATP的磷酸化类型 脂类:是一类低溶于水而高溶于非极性溶剂的生物有机分子 β-氧化:脂肪酸氧化是发生在β原子上的,逐步将碳原子成对地从脂肪酸键上切下,即β-氧化 氨基酸代谢库:体内氨基酸的总量 从头合成途径:不经过碱基,核苷的中间阶段的途径 / 补救途径:利用体内游离的碱基或核苷直接合成核苷酸 半保留复制:DNA的两条链彼此分开各自作为模板,按碱基配对规则合成互补链,由此产生的子代DNA的一条链来自亲代,另一条链则是以这条亲代为模板合成的新链 不对称转录:一、指双链DNA只有一股单链用作模板;二,指同一单链上可以交错出现模板链和编码链 前导链:复制时,DNA中按与复制叉移动的方向一致的方向,沿5’至3”方向连续合成的一条链 后随链:在已经形成一段单链区后,先按与复制叉移动方向相反的方向,沿5’至3”方向合成冈崎片段连在一起构成完整的链的一条链 密码子:mRNA上所含A,,C决定一个氨基酸的相邻的三个碱基 反密码子:指tRNA上的一端的三个碱基排列顺序 起始密码子:特定起始点的密码子(AUG) ] 终止密码子:mRNA中终止蛋白质合成的密码子(UAG,UAA,UGA) 二,蛋白质 1,两性离子:指在同一个氨基酸分子上带有能放出质子的-NH3+正离子和能接受质子的-COO-负离子, 2,等电点(PI):调节氨基酸溶液的PH,使氨基酸分子上的-NH3+,-COO-解离度完全相等,此时溶液的PH。 PI>PH时,氨基酸向阴极移动;反之,向阴极移动 3,氨基酸与水合茚三酮反应特征:脯氨酸和羟脯氨酸与茚三酮反应产生黄色物质,其余的α-氨基酸与茚三酮反应均产生蓝紫色物质 4,与2,4-二硝基氟苯(DNFB)反应:生成的2,4-二硝基苯氨基酸呈黄色。通过提取后进一步鉴定,可鉴定多肽或蛋白质的末端氨基酸,此法称为Sanger法 5,与异硫氰酸苯酯反应(Edman反应):此反应可测定出多肽链N端的氨基酸排列顺序 6,蛋白质结构:一级结构:多肽链中的氨基酸序列。二级结构:多肽链有一定周期性的,由氢键维持的局
1绪论 1.生物化学研究的对象和内容是什么? 解答:生物化学主要研究: (1)生物机体的化学组成、生物分子的结构、性质及功能; (2)生物分子分解与合成及反应过程中的能量变化; (3)生物遗传信息的储存、传递和表达; (4)生物体新陈代谢的调节与控制。 2.你已经学过的课程中哪些内容与生物化学有关。 提示:生物化学是生命科学的基础学科,注意从不同的角度,去理解并运用生物化学的知识。 3.说明生物分子的元素组成和分子组成有哪些相似的规侓。 解答:生物大分子在元素组成上有相似的规侓性。碳、氢、氧、氮、磷、硫等6种是蛋白质、核酸、糖和脂的主要组成元素。碳原子具有特殊的成键性质,即碳原子最外层的4个电子可使碳与自身形成共价单键、共价双键和共价三键,碳还可与氮、氧和氢原子形成共价键。碳与被键合原子形成4个共价键的性质,使得碳骨架可形成线性、分支以及环状的多种多性的化合物。特殊的成键性质适应了生物大分子多样性的需要。氮、氧、硫、磷元素构成了生物分子碳骨架上的氨基(—NH 2)、羟基(— OH )、羰基(C O )、羧基(—COOH )、巯基(—SH )、磷酸基(—PO 4)等功能基团。这些功能基团因氮、硫和磷有着可变的氧化数及氮和氧有着较强的电负性而与生命物质的许多关键作用密切相关。 生物大分子在结构上也有着共同的规律性。生物大分子均由相同类型的构件通过一定的共价键聚合成链状,其主链骨架呈现周期性重复。构成蛋白质的构件是20种基本氨基酸。氨基酸之间通过肽键相连。肽链具有方向性(N 端→C 端),蛋白质主链骨架呈“肽单位”重复;核酸的构件是核苷酸,核苷酸通过3′,5′-磷酸二酯键相连,核酸链也具有方向性(5′、→3′),核酸的主链骨架呈“磷酸-核糖(或脱氧核糖)”重复;构成脂质的构件是甘油、脂肪酸和胆碱,其非极性烃长链也是一种重复结构;构成多糖的构件是单糖,单糖间通过糖苷键相连,淀粉、纤维素、糖原的糖链骨架均呈葡萄糖基的重复。 2蛋白质化学 1.用于测定蛋白质多肽链N 端、C 端的常用方法有哪些?基本原理是什么? 解答:(1)N-末端测定法:常采用2,4―二硝基氟苯法、Edman 降解法、丹磺酰氯法。 ①2,4―二硝基氟苯(DNFB 或FDNB)法:多肽或蛋白质的游离末端氨基与2,4―二硝基氟苯(2,4―DNFB )反应(Sanger 反应),生成DNP ―多肽或DNP ―蛋白质。由于DNFB 与氨基形成的键对酸水解远比肽键稳定,因此DNP ―多肽经酸水解后,只有N ―末端氨基酸为黄色DNP ―氨基酸衍生物,其余的都是游离氨基酸。 ②丹磺酰氯(DNS)法:多肽或蛋白质的游离末端氨基与与丹磺酰氯(DNS ―Cl )反应生成DNS ―多肽或DNS ―蛋白质。由于DNS 与氨基形成的键对酸水解远比肽键稳定,因此DNS ―多肽经酸水解后,只有N ―末端氨基酸为强烈的荧光物质DNS ―氨基酸,其余的都是游离氨基酸。 ③苯异硫氰酸脂(PITC 或Edman 降解)法:多肽或蛋白质的游离末端氨基与异硫氰酸苯酯(PITC )反应(Edman 反应),生成苯氨基硫甲酰多肽或蛋白质。在酸性有机溶剂中加热时,N ―末端的PTC ―氨基酸发生环化,生成苯乙内酰硫脲的衍生物并从肽链上掉下来,除去N ―末端氨基酸后剩下的肽链仍然是完整的。 ④氨肽酶法:氨肽酶是一类肽链外切酶或叫外肽酶,能从多肽链的N 端逐个地向里切。根据不同的反应时间测出酶水解释放的氨基酸种类和数量,按反应时间和残基释放量作动力学曲线,就能知道该蛋白质的N 端残基序列。 (2)C ―末端测定法:常采用肼解法、还原法、羧肽酶法。 肼解法:蛋白质或多肽与无水肼加热发生肼解,反应中除C 端氨基酸以游离形式存 在外,其他氨基酸都转变为相应的氨基酸酰肼化物。 ②还原法:肽链C 端氨基酸可用硼氢化锂还原成相应的α―氨基醇。肽链完全水解后,代表原来C ―末端氨基酸的α―氨基醇,可用层析法加以鉴别。 ③羧肽酶法:是一类肽链外切酶,专一的从肽链的C ―末端开始逐个降解,释放出游离的氨基酸。被释放的氨基酸数目与种类随反应时间的而变化。根据释放的氨基酸量(摩尔数)与反应时间的关系,便可以知道该肽链的C ―末端氨基酸序列。 2.测得一种血红蛋白含铁0.426%,计算其最低相对分子质量。一种纯酶按质量计算含亮氨酸1.65%和异亮氨酸2.48%,问其最低相对分子质量是多少? 解答: (1)血红蛋白: 55.8100100131000.426??=铁的相对原子质量最低相对分子质量==铁的百分含量 (2)酶: 因为亮氨酸和异亮氨酸的相对分子质量相等,所以亮氨酸和异亮氨酸的残基数之比为:1.65%:2.48%=2:3,因此,该酶分子中至少含有2个亮氨酸,3个异亮氨酸。 ()r 2131.11100159001.65M ??=≈最低 ()r 3131.11100159002.48M ??=≈最低 3.指出下面pH 条件下,各蛋白质在电场中向哪个方向移动,即正极,负极,还是保持原点? (1)胃蛋白酶(pI1.0),在pH5.0; (2)血清清蛋白(pI4.9),在pH6.0; (3)α-脂蛋白(pI5.8),在pH5.0和pH9.0; 解答:(1)胃蛋白酶pI1.0<环境pH5.0,带负电荷,向正极移动; (2)血清清蛋白pI4.9<环境pH6.0,带负电荷,向正极移动; (3)α-脂蛋白pI5.8>环境pH5.0,带正电荷,向负极移动; α-脂蛋白pI5.8<环境pH9.0,带负电荷,向正极移动。 4.何谓蛋白质的变性与沉淀?二者在本质上有何区别? 解答:蛋白质变性的概念:天然蛋白质受物理或化学因素的影响后,使其失去原有的生物活性,并伴随着物理化学性质的改变,这种作用称为蛋白质的变性。 变性的本质:分子中各种次级键断裂,使其空间构象从紧密有序的状态变成松散无序的状态,一级结构不破坏。 蛋白质变性后的表现:①?生物学活性消失;②?理化性质改变:溶解度下降,黏度增加,紫外吸收增加,侧链反应增强,对酶的作用敏感,易被水解。
生物化学简明教程第四版课后答案-张丽萍
1 绪论 1.生物化学研究的对象和内容是什么? 解答:生物化学主要研究: (1)生物机体的化学组成、生物分子的结构、性质及功能; (2)生物分子分解与合成及反应过程中的能量变化; (3)生物遗传信息的储存、传递和表达; (4)生物体新陈代谢的调节与控制。 2.你已经学过的课程中哪些内容与生物化学有关。 提示:生物化学是生命科学的基础学科,注意从不同的角度,去理解并运用生物化学的知识。 3.说明生物分子的元素组成和分子组成有哪些相似的规侓。 解答:生物大分子在元素组成上有相似的规侓性。碳、氢、氧、氮、磷、硫等6种是蛋白质、核酸、糖和脂的主要组成元素。碳原子具有特殊的成键性质,即碳原子最外层的4个电子可使碳与自身形成共价单键、共价双键和共价三键,碳还可与氮、氧和氢原子形成共价键。碳与被键合原子形成4个共价键的性质,使得碳骨架可形成线性、分支以及环状的多种多性的化合物。特殊的成键性质适应了生物大分子多样性的需要。氮、氧、硫、磷元素构成了生物分子碳骨架上的 氨基(—NH 2)、羟基(—OH)、羰基(C O )、羧基 (—COOH)、巯基(—SH)、磷酸基(—PO 4 )等 功能基团。这些功能基团因氮、硫和磷有着可变的氧化数及氮和氧有着较强的电负性而与生命物质的许多关键作用密切相关。 生物大分子在结构上也有着共同的规律性。生物大分子均由相同类型的构件通过一定的共价
(PITC)反应(Edman反应),生成苯氨基硫甲酰多肽或蛋白质。在酸性有机溶剂中加热时,N―末端的PTC―氨基酸发生环化,生成苯乙内酰硫脲的衍生物并从肽链上掉下来,除去 N―末端氨基酸后剩下的肽链仍然是完整的。 ④氨肽酶法:氨肽酶是一类肽链外切酶或叫外肽酶,能从多肽链的N端逐个地向里切。根据不同的反应时间测出酶水解释放的氨基酸种类和数量,按反应时间和残基释放量作动力学曲线,就能知道该蛋白质的N端残基序列。 (2)C―末端测定法:常采用肼解法、还原法、羧肽酶法。 肼解法:蛋白质或多肽与无水肼加热发生肼解,反应中除C端氨基酸以游离形式存在外,其他氨基酸都转变为相应的氨基酸酰肼化物。 ②还原法:肽链C端氨基酸可用硼氢化锂还原成相应的α―氨基醇。肽链完全水解后,代表原来C―末端氨基酸的α―氨基醇,可用层析法加以鉴别。 ③羧肽酶法:是一类肽链外切酶,专一的从肽链的C―末端开始逐个降解,释放出游离的氨基酸。被释放的氨基酸数目与种类随反应时间的而变化。根据释放的氨基酸量(摩尔数)与反应时间的关系,便可以知道该肽链的C―末端氨基酸序列。 2.测得一种血红蛋白含铁0.426%,计算其最低相对分子质量。一种纯酶按质量计算含亮氨酸1.65%和异亮氨酸2.48%,问其最低相对分子质量是多少?