
5.1环烷烃的定义和命名
分子中具有碳环结构的烷烃称为环烷烃,单环烷烃的通式为C n H 2n ,与单烯烃互为同分异构体。
环烷烃可按分子中碳环的数目大致分为单环烷烃和多环烷烃两大类型。 1.单环烷烃
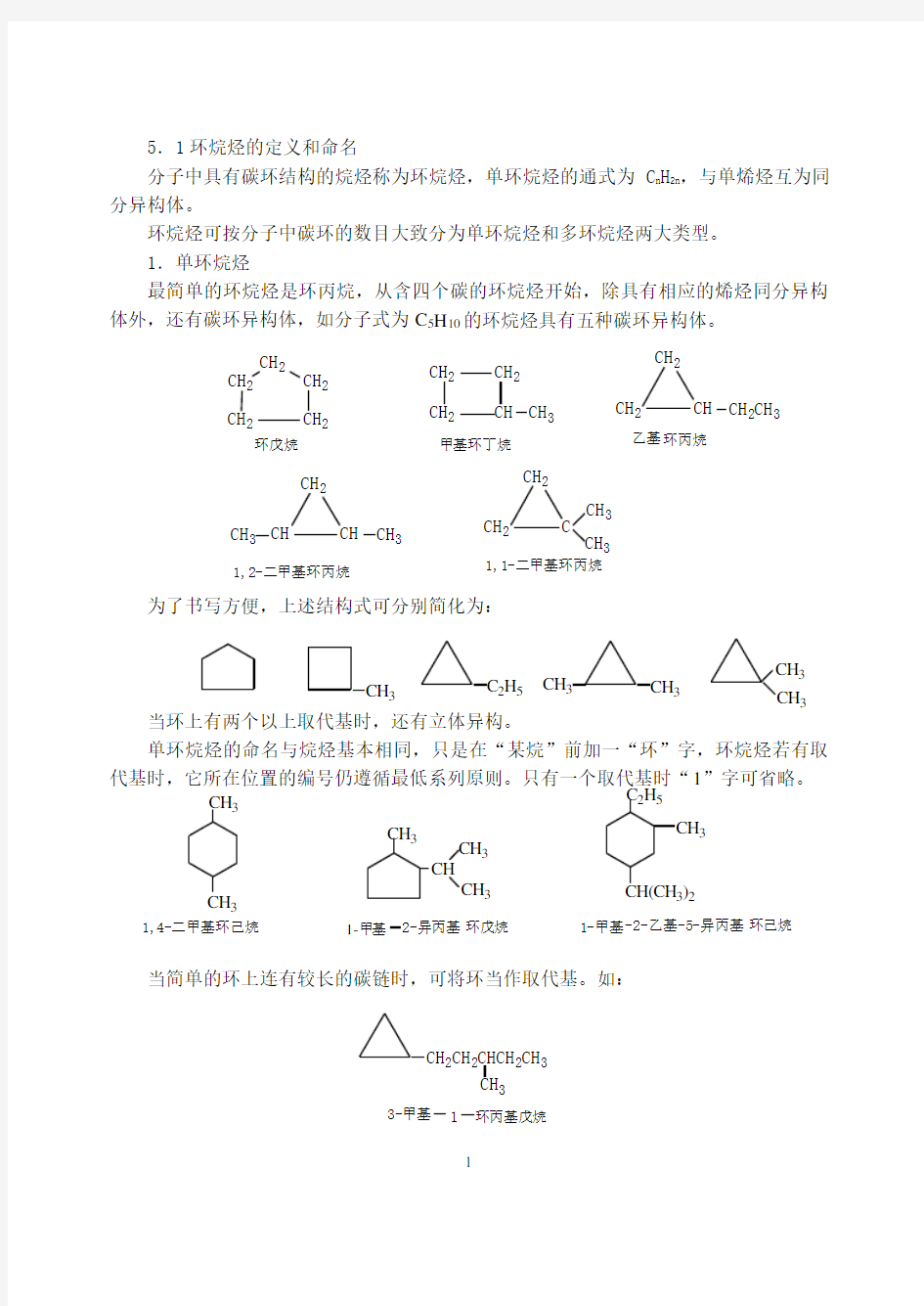
最简单的环烷烃是环丙烷,从含四个碳的环烷烃开始,除具有相应的烯烃同分异构体外,还有碳环异构体,如分子式为C 5H 10的环烷烃具有五种碳环异构体。
为了书写方便,上述结构式可分别简化为:
当环上有两个以上取代基时,还有立体异构。
单环烷烃的命名与烷烃基本相同,只是在“某烷”前加一“环”字,环烷烃若有取代基时,它所在位置的编号仍遵循最低系列原则。只有一个取代基时“1”字可省略。
当简单的环上连有较长的碳链时,可将环当作取代基。如:
CH 3
CH 3
CH 3
C 2H 5
CH 3
CH 3CH 2CH 3
CH 3
环丙烷
CH 2CH 2
CH 甲基环丁烷
CH 2CH 2
CH CH 2环戊烷CH 2CH 2
CH 2
CH 2CH 2
乙基3-甲基
CH 3
CH 2CH 2CHCH 2CH 3
环丙基戊烷
1
1,1-二甲基环丙烷
1,2-二甲基环丙烷
CH 3
CH 2
CH
CH
CH 3CH 2
CH 2
C CH 3CH 3
CH
CH 3
CH 3
3
CH 3CH 3
CH 3
C 2H 5
1,4-二甲基环己烷
1-甲基
2-异丙基环戊烷
CH(CH 3)2
1-甲基-2-乙基-5-异丙基环己烷
2.多环烷烃
含有两个或多个碳环的环烷烃属于多环烷烃。多环烷烃又按环的结构、位置分为桥环、螺环等。
(1)桥环 两个或两个以上碳环共用两个以上碳原子的称为桥环烃,两个或两个以上环共用的叔碳原子称为“桥头碳原子”,从一个桥头到另一个桥头的碳链称为“桥”。桥环化合物命名时,从一个桥头开始,沿最长的桥编到另一个桥头,再沿次长的桥编回到起始桥头,最短的桥最后编号。命名时以二环、三环作词头,然后根据母体烃中碳原子总数称为某烷。在词头“环”字后面的方括号中,由多到少写出各桥所含碳原子数(桥头碳原子不计入),同时各数字间用下角圆点隔开,有取代基时,应使取代基编号较小。例如:
1,2,7-三甲基-双环[2.2.1]庚烷 双环[4.4.0]癸烷 双环[2.2.1]庚烷
(2)螺环 脂环烃分子中两个碳环共用一个碳原子的称为螺环烃,共用的碳原子为螺原子。命名时根据成环的碳原子总数称为螺某烷,编号从小环开始,经过螺原子编至大环,在“螺”字之后的方括号中,注明各螺环所含的碳原子数(螺原子除外),先小环再大环,数字间用下角圆点隔开。有取代基的要使其编号较小。例如:
5-甲基螺[3.4]辛烷 1,6-二甲基螺[3.5]壬烷
5.2环烷烃的性质
在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为液体。
环烷烃不溶于水,易溶于有机溶剂,比水轻。环烷烃的沸点、熔点、相对密度都比同碳数的烷烃高,
环烷烃的化学性质与烷烃类似,可发生取代和氧化反应,但由于碳环的存在还具有一些与烷烃不同的特性。如三元和四元环烷烃由于分子中存在张力,所以表现在化学性质上比较活泼,它们与烯烃相似,可以发生开环加成反应生成链状化合物。
1.开环反应
环烷烃中环丙烷和环丁烷能与氢气、溴、卤化氢等试剂发生开环反应,而环戊烷和
7
6
5
544
3
3
22
1
1
CH
2C
CH 2
CH 3
CH
C 2H 5
CH CH CH 3CH 2
CH 3
CH 3
CH 2
CH 2
CH 3CH
CH 2
C
CH 2
CH 2CH 2
环己烷却不易发生或不能发生类似的开环反应。
(1)催化加氢 小环烷烃的性质与烯烃类似,在催化剂存在下能发生加氢反应,生成烷烃。
环戊烷需要用活性高的铂为催化剂在300℃以上才能加成。环己烷、环庚烷在此条件下不发生加氢反应。
(2)加溴 环丙烷在室温下与溴发生加成反应生成1,3-二溴丙烷。
在加热条件下环丁烷与溴发生加成反应,生成1,4-二溴丁烷。
(3)加卤化氢 环丙烷、环丁烷与卤化氢发生加成反应生成卤代烷。环戊烷、环己烷不易发生反应。
2.取代反应
环戊烷、环己烷等在光或热的作用下可发生取代反应。
CH 3CH 2CH 2CH 3
CH 3CH 2CH 3。c
。c Ni
H
2
++
80H 2Ni
+H 2
Pt
CH 3CH 2
CH 2CH 2CH 3
300。c
+CH 2CH 2CH 2
Br 2
CCl
4
Br Br
+
CH 2CH 2CH 2CH 2Br 2Br
Br
2CH 2CH 2CH 2
Br
CH 3CH
2CH 2Br ++HBr HBr
Br
。c 或300(
)
Br 2
紫外光
Br
Br ++
环丙烷与溴在光照下反应,除生成少量取代产物外,主要得到的却是加成产物。
3.氧化反应
常温下环烷烃与一般氧化剂不起作用,即使环丙烷也不起反应,因此可用高锰酸钾鉴别环烷烃和烯烃。当加热或在催化剂作用下,用空气中的氧气或硝酸等强氧化剂氧化环己烷等,则发生环的破裂生成二元酸。
己二酸是合成尼龙的单体。
5.4环烷烃的分子结构
从环烷烃的化学性质可以看出,环的稳定性与组成环的碳原子数密切相关,环的稳定性的大小反映了分子内能的不同,内能越大,环越不稳定。
据测定,环丙烷分子中C-C-C 键角为105.5°,H-C-H 键角为114°。可见,相邻碳原子的sp 3
杂化轨道为形成环丙烷必须将正常键角压缩成105.5°,这就使分子本身产生一种恢复正常键角的角张力。角张力的存在是环丙烷不稳定的重要原因。此外,轨道重叠程度越大,形成的键越牢固。显然在形成105.5°键角时,其轨道重叠不及正常的 109.5°大,实际上呈弯曲状,所以人们常把这种键称为弯曲键或香蕉键。
环丁烷与环丙烷类似,分子内也存在角张力,但比环丙烷小些。为降低扭转张力(由于C-C 间处于重叠式构象引起的张力),环丁烷通常呈折叠状构象,这种非平面结构可减少C-H 键的重叠,其稳定性比环丙烷大一些。
( 主要)
Br
+CH 2CH 2CH 2Br 2
Br
Br
+
CH 2CH 2
COOH CH
2CH 2COOH
。
C 醋酸个大气压10100O 2+己二酸
环戊烷、环己烷分子中的碳原子不在一个平面上,碳碳σ键的夹角接近或保持 109.5°,分子中既无角张力,又无扭转张力,所以都比较稳定。 5.4.1环的张力 拜尔张力学说
由上面化学性质可看出,环的稳定性与环的大小有关。小环不稳定,大环较稳 定。为了解释这一事实拜尔在1885年提出了张力学说。 要点是:环烷烃中碳原子(饱和,SP 3杂化),与其他原子结合时,任何两键
角都是109028,
。但环丙烷是三角形,其夹角是60,环丁烷是四方形,夹角是900,
这样环中的C-与-C 键角不能是109028,
,必须压缩到600,900以适应环的几何形状。 这种由于与正常键角的偏差,引起分子的张力,称角张力。这样的环称张力环。 张力环为减小张力,有生成更稳定的开链化合物的倾向。与正常键角偏差越大, 环张力越大,越易起开环反应。书中给出了几种环烷烃键角偏转大小,正值表示键 角向内压缩,负值表示键角向外扩张。根据张力学说,环己烷以上因键角向外扩张 而存在张力,且环越大,键角扩张越大,环越不稳定,而事实上,它的都是稳定的。 拜尔张力学说对小环的结论是正确的,但无法解释负环以上大环的稳定性,其 原因是成环碳原子都处于同平面这个假设是错误的,它们实际上不是共平面! 环烷烃的燃烧热
上章我们学过,利用燃烧热可以判断异构体的稳定性,在化学上,我们说某化 合物不稳定,意思是说分子的内能较高,易起化学反应。小环烷烃不稳定,内能较 高,可以从其燃烧热数据得到证实。
开链烷烃,不论含碳较少,每个CH 2的燃烧热都接近658.6KJ/MOL ,而环烷烃每 个CH 2的燃烧热则因环的大小而不同,大多数都大于开链烷烃的658.6KJ/MOL 。这高 出的能量叫张力能。例如:环丙烷:CH 2燃烧热697.1KJ/MOL CH 2张力能697.1-658.6=38.5KJ/MOL 分子总张力能3*38.5=115.5KJ/MOL
P50 表中给出了多种环烷烃的有关数据。
可见张力越大,环越不稳定,张力越小,环越稳定,环己烷,及大环烷烃几乎
为无张力环,都很稳定。 若被氧化,
Csp 3Csp 2角很大,能量升高。
张力能
在有机化合物中,有四种因素不产生张力能。 1.非键作用
分子中两非键合原子或基因由于几何原因互相靠近,当其间距小于两者范德华 半径之和时,这两个原子或基团就强烈的排斥,引起体系能量升高,且升高的数值
环丁烷
环戊烷
最大。E nb 2.键长变化
分子中由于几何原因,必须使某一个键伸长或缩短(象弹簧),体系能量随之 升高,EL ,升高数值越大,但〈E nb 3.键角变化
分子中由于几何原因要使键角的大小发生变化,就引起的体系的能量升高,E 其升高数值越大,但〈E l 4.扭转角变化
分子中由于几何原因,使扭转角发生变化就引起能量升高,E ,其数值高升最 小。比如:一个分子由于几何原因使两非键合原子或基团靠的太近时,因相互排 斥,体系能量升高,为降低能量,扭转角发生变化,以使它们彼此分开。如果扭 转角变化还不是以使两个原子或基团分开,这时某些键角,键长就会发生必要的 变化,使其分开并能够容纳在有限的空间内,而范德华半径很少变化。 近代结构理论的解释
从近代价键理论观点来看,两个原子轨道重迭越多则键越稳定。烷烃碳为SP 3杂
化,键角为109028,
,而在环丙烷分子中,键角为600,故SP 3杂化轨道很难头对头 重叠,即重叠角较少,形成的键也较不稳定,易开环。根据量子化学计算,认为环 丙烷分子中C-C 键是弯曲的,键角为1050,形如香蕉,又称香蕉键,不仅重叠程度 较少,且电子云分布4在C-C 键连线外侧,易受试剂进攻而起开环反应。
1.环烷烃的顺反异构
环烷烃中由于环的存在限制了C-C σ键的自由旋转,如果有两个或两个以上的环碳原子连有不同取代基时,就会得到不同构型,产生顺反异构。例如1,2-二甲基环丙烷就有两种异构体。取代基在环平面同侧的称为顺式,在异侧的称为反式。
顺-1,2-二 甲基环丙烷 反-1,2-二甲基环丙烷
2.环己烷及其衍生物构象
(1)船式构象和椅式构象 在环己烷分子中碳原子以sp 3
杂化,六个碳原子不在同一个
CH 3CH 3CH 33H
比较环己烷的船式构象和椅式构象:船式构象中两个船头碳原子C 1和C 4上的氢原子相距很近,只间隔0.183nm,比它们的范德华半径之和0.25nm 小得多,因此相互之间斥力较大;而在椅式构象中相邻的两个碳原子上的氢都处于邻位交叉式;船式构象中,C 2-C 3和C 5-C 6上的C-H 是全重叠式,因而具有扭转张力。所以船式构象不如椅式构象稳定,环己烷及其衍生物在一般情况下都以椅式构象存在,椅式构象为环己烷的优势构象。
环己烷的船式构象和椅式构象之间能相互转换,通常的环己烷就处于这两种构象的转换平衡中。由于船式构象远没有椅式构象稳定,环己烷几乎都是以椅式构象存在,因此在讨论环己烷结构时通常只考虑椅式构象。
(2)平伏键和直立键 环己烷椅式构象中的十二个C-H 键可分为两类:与分子对称轴平行的六个C-H 键称为直立键或a 键(axial 的简写),其中三个朝上三个朝下;另外六个键与对称轴成109.5°的角度称为平伏键或e 键(equatorial 的简写)。
(3)椅式构象环的翻转 椅式构象也有两种构象,由于分子的热运动,在常温下,通过C-C 键的不断扭动,环己烷的一种椅式构象可以转变到另一种椅式构象,而且这种翻转进行得非常快。翻转以后原来的e 键变为a 键,a 键变为e 键。
(4)取代环己烷的构象
一元取代环己烷中,取代基处于e 键上的构象较稳定。
对于多元取代环己烷,一般说来最稳定的构象应是取代基在e 键上最多的椅式构象,尤其是大的取代基处于e 键上更为稳定。
椅式构象
船式构象655
44
3321162C H H H H H H H C H H H H C H H H H C H 对称轴
3
( 不稳定 )( ee )
反式3
( ae )
顺式反式( aa )