
二氧化硫转化率最优化
题目:SO 2+1/2O 2=SO 3,四段绝热反应器,级间间接换热。
1.基础数据:
混合物恒压热容C p =0.2549[kcal/kg ·K] -ΔH =23135[kcal/kmol] 床层空隙率ρy =554[kg/m 3]
进口SO 2浓度8.0%,O 2浓度9.0%,其余为氮气。 处理量131[kmolSO 2/hr],要求最终转化率98%。 2.动力学方程:
式中:
3.基本要求:
(1)在T -X 图上,做出平衡线,至少4条等速率线;
(2)以一维拟均相平推流模型为基础,在催化剂用量最少的前提下,总的及各段的催化剂装量;进出口温度、转化率;并在T-X 图上标出折线; 4.讨论:
(1)要求的最终转化率从97%变化到99%对催化剂用量的影响;
(2)如果有关系:YO 2+YSO 2=21%,SO 2进口浓度在7-9%之间变化,对催化剂装量的影响。
计算过程:
(1)由于反应速率的表达式是温度和转化率的函数,所以在入口浓度一定的条件下,当反应速率等于零的时候,不同的温度对应不同的转化率。根据这些
()
()(
)
[]
sec ./112
2
3
2323222gcat mol P P K P P B B P P K P k R SO SO SO SO SO SO O eff SO +-+-=ξ-()
()
987
.13.11295exp 1026203.227200exp 103.25.7355exp 4814860047535992exp 105128.147542076062exp 106915.7521
87182
23
=?
?
? ???=?
?
? ?
?=?
?
?
???=?
??
??-=-?
??
??-?=-?
??
??-?=--R T K P P K P RT K T B C RT k C RT k P O SO P SO o
eff o
eff ξ
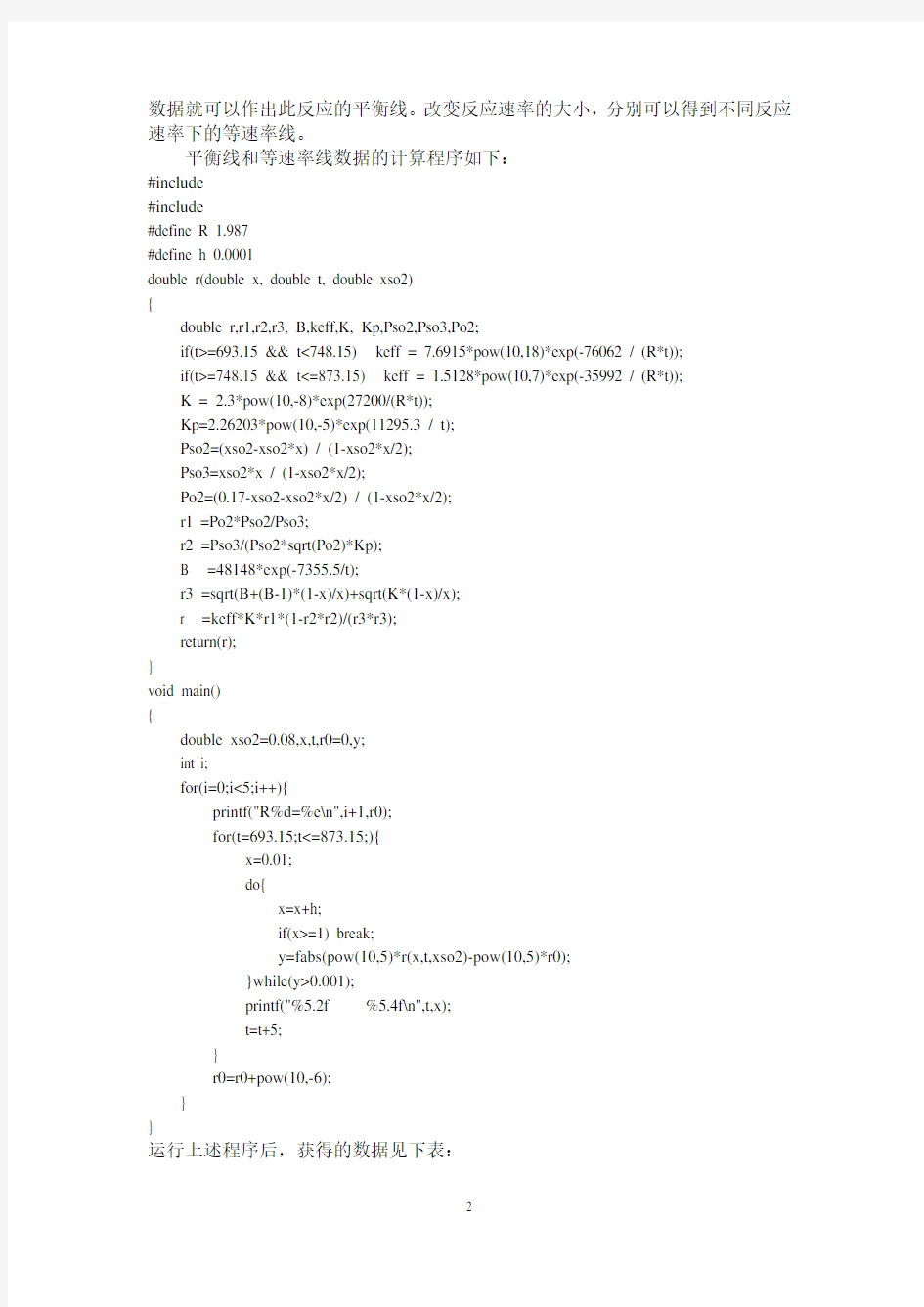
数据就可以作出此反应的平衡线。改变反应速率的大小,分别可以得到不同反应速率下的等速率线。
平衡线和等速率线数据的计算程序如下:
#include
#include
#define R 1.987
#define h 0.0001
double r(double x, double t, double xso2)
{
double r,r1,r2,r3, B,keff,K, Kp,Pso2,Pso3,Po2;
if(t>=693.15 && t<748.15) keff = 7.6915*pow(10,18)*exp(-76062 / (R*t));
if(t>=748.15 && t<=873.15) keff = 1.5128*pow(10,7)*exp(-35992 / (R*t));
K = 2.3*pow(10,-8)*exp(27200/(R*t));
Kp=2.26203*pow(10,-5)*exp(11295.3 / t);
Pso2=(xso2-xso2*x) / (1-xso2*x/2);
Pso3=xso2*x / (1-xso2*x/2);
Po2=(0.17-xso2-xso2*x/2) / (1-xso2*x/2);
r1 =Po2*Pso2/Pso3;
r2 =Pso3/(Pso2*sqrt(Po2)*Kp);
B =48148*exp(-7355.5/t);
r3 =sqrt(B+(B-1)*(1-x)/x)+sqrt(K*(1-x)/x);
r =keff*K*r1*(1-r2*r2)/(r3*r3);
return(r);
}
void main()
{
double xso2=0.08,x,t,r0=0,y;
int i;
for(i=0;i<5;i++){
printf("R%d=%e\n",i+1,r0);
for(t=693.15;t<=873.15;){
x=0.01;
do{
x=x+h;
if(x>=1) break;
y=fabs(pow(10,5)*r(x,t,xso2)-pow(10,5)*r0);
}while(y>0.001);
printf("%5.2f %5.4f\n",t,x);
t=t+5;
}
r0=r0+pow(10,-6);
}
}
运行上述程序后,获得的数据见下表:
反应速率=r×106
温度T/k
0.0 1.0 2.0 3.0 4.0
693.150.9809
698.150.9797
703.150.9782 0.0117
708.150.9762 0.2719
713.150.9740 0.4750
718.150.9715 0.6205 0.1844
723.150.9686 0.7214 0.3863 0.0784
728.150.9655 0.7901 0.5373 0.2903 0.0638 733.150.9620 0.8365 0.6473 0.4536 0.2689 738.150.9582 0.8674 0.7265 0.5761 0.4285 743.150.9541 0.8873 0.7828 0.6669 0.5500 748.150.9496 0.8995 0.8224 0.7336 0.6416 753.150.9447 0.8964 0.8237 0.7398 0.6529 758.150.9394 0.8927 0.8239 0.7444 0.6617 763.150.9338 0.8885 0.8231 0.7474 0.6685 768.150.9278 0.8837 0.8214 0.7491 0.6736 773.150.9213 0.8784 0.8188 0.7497 0.6772 778.150.9144 0.8725 0.8154 0.7492 0.6794 783.150.9071 0.8662 0.8113 0.7477 0.6804 788.150.8994 0.8593 0.8065 0.7453 0.6803 793.150.8912 0.8519 0.8010 0.7421 0.6792 798.150.8826 0.8440 0.7948 0.7380 0.6772 803.150.8735 0.8357 0.7881 0.7332 0.6743 808.150.8640 0.8268 0.7807 0.7277 0.6706 813.150.8540 0.8175 0.7727 0.7215 0.6661 818.150.8436 0.8077 0.7643 0.7146 0.6609 823.150.8327 0.7975 0.7552 0.7071 0.6550 828.150.8215 0.7868 0.7457 0.6990 0.6484 833.150.8097 0.7757 0.7357 0.6904 0.6412 838.150.7976 0.7642 0.7252 0.6812 0.6335 843.150.7851 0.7523 0.7142 0.6716 0.6252 848.150.7722 0.7400 0.7029 0.6614 0.6163 853.150.7590 0.7273 0.6912 0.6508 0.6070 858.150.7454 0.7143 0.6791 0.6398 0.5972 863.150.7315 0.7010 0.6666 0.6285 0.5870 868.150.7174 0.6874 0.6539 0.6167 0.5764 873.150.7030 0.6736 0.6408 0.6047 0.5654 根据上述数据制图:
700
720
740
760
780
800
820
840
860
880
0.0
0.10.20.30.40.50.6
0.70.80.91.0
X
T
R=0 R=1e-6 R=2e-6 R=3e-6 R=4e-6
上图以温度为横坐标,转化率为纵坐标。最上面一条为平衡线,平衡线下的四条曲线为反应速率分别为1e-6、2e-6、3e-6、4e-6(mol/gcat.sec)时的等速率线。
(2)根据入口组成,设定入口温度,根据反应对入口温度所求偏导数在这一段内对组成的积分为零,可以求得此段出口转化率,即下一段的入口组成。由
于段内操作线的斜率为1/λ(dT
dx λ=),因此根据入口温度、入口组成和出口组
成计算可得出口温度。要使催化剂用量最少,应使,,11,1,(,)(,)i i out i out i i in i in r X T r X T +++=,
根据0
(,)
out
in
X cat
A X W dx
F r x T =?
计算每段的最小催化剂用量。循环计算四段后可得最后
的出口转化率,若不能满足要求(x =98%),则重新设定第一段入口温度,再进行计算直至满足条件。
上述计算过程的C 语言程序如下:
#include
double r(double x, double t, double xso2) { double r,r1,r2,r3,keff,K,B,Kp,Pso2,Pso3,Po2; if(t>=693.15 && t<748.15) keff = 7.6915*pow(10,18)*exp(-76062 / (R*t)); if(t>=748.15 && t<=873.15)
keff = 1.5128*pow(10,7)*exp(-35992 / (R*t));
K = 2.3*pow(10,-8)*exp(27200/(R*t));
Kp=2.26203*pow(10,-5)*exp(11295.3 / t);
Pso2=(xso2-xso2*x) / (1-xso2*x/2);
Pso3=xso2*x / (1-xso2*x/2);
Po2=(0.17-xso2-xso2*x/2) / (1-xso2*x/2);
r1 =Po2*Pso2/Pso3;
r2 =Pso3/(Pso2*sqrt(Po2)*Kp);
B =48148*exp(-7355.5/t);
r3 =sqrt(B+(B-1)*(1-x)/x)+sqrt(K*(1-x)/x);
r =keff*K*r1*(1-r2*r2)/(r3*r3);
return(r);
}
double dr(double x, double t, double xso2)
{
double y;
y=(r(x,t+h,xso2)-r(x,t-h,xso2))/(2*h);
return(y);
}
double t(double t0, double x0, double x)
{
double y,lamda,H=-23135,Cp=254.9,rou=0.500,c=1.282;
lamda=-H*c/(rou*Cp);
y=t0+lamda*(x-x0);
return(y);
}
double fun1(double x, double t, double xso2)
{
double y;
y=-dr(x,t,xso2)/(r(x,t,xso2)*r(x,t,xso2));
return(y);
}
double jifen(double x0, double t0, double xso2)
{
double sum=0.0,x1=x0,x2,t1,t2=693.15,xout;
do{
t1=t(t0,x0,x1);
x2=x1+h/10;
t2=t(t0,x0,x2);
if(t2>873.15){
xout = x1;
goto end;
}
sum=sum+h*(fun1(x1,t1,xso2)+fun1(x2,t2,xso2))/20;
x1=x2;
}while(sum<0);
xout=x1-h/10;
end: return(xout);
}
double wjifen(double xin, double xou, double tin, double xso2)
{
double y,x1=xin,x2,t1,t2,sum=0.0,wcat;
do{
t1=t(tin,xin,x1);
x2=x1+h;
t2=t(tin,xin,x2);
if(t2>=873.15) goto end ;
sum=sum+(1/r(x1,t1,xso2)+1/r(x2,t2,xso2))*h/1000;
x1=x2;
}while(x2<=xou);
end: wcat=sum*131*1000/3600;
return(wcat);
}
void main()
{
double xso2=0.08,xout,tout,x0=0.0001,t0,t00=719,t1,wcat,wsum;
int i,j;
loop1: wsum=0.0;
x0=0.0001;
t0=t00;
printf("1 tin=%f xin=%e\n",t00,x0);
for(i=0;i<=3;i++){
xout=jifen(x0,t0,xso2);
tout=t(t0,x0,xout);
printf("%d tout=%f ",i+1,tout);
printf("xout=%f \n",xout);
wcat=wjifen(x0,xout,t0,xso2);
printf("Wcat=%f ",wcat);
wsum=wsum+wcat;
t1= 693.15;
do{
t1=t1+0.01;
}while(fabs(pow(10,5)*r(xout,t1,xso2)-pow(10,5)*r(xout,tout,xso2))>h);
x0=xout;
t0=t1;
printf("%d tin= %f xin= %f\n",i+2,t0,xout);
}
printf("Wsum=%f \n",wsum);
t00=t00-0.1;
printf("\n\n");
if(x0<=0.98) goto loop1;
}
运行上述程序的结果见下表:
X Tin/K Xin Tout/K Xout Wcat/KG Wsum/KG
0.98 1 717.80 0.00010 873.148833 0.66766 8349.6671140
91891.935289
2 723.60 0.66766 778.519894 0.90366 11605.588273
3 715.92 0.90366 729.505692 0.9620
4 21557.219801
4 693.19 0.96204 697.388114 0.98008 50379.460102
0.97 1 719.00 0.00010 873.148042 0.66250 8010.6611480
81141.232231
2 725.87 0.66250 780.764296 0.89839 10705.246828
3 718.65 0.89839 732.84772
4 0.95940 18921.891195
4 696.1
5 0.95940 700.611078 0.97858 43503.433060
本程序计算在一定SO2进口含量(须满足条件XSO2+XO2 = 0.21)的情况下使得出口转化率达到0.98时所需要的催化计量。
#include"math.h"
#include"stdio.h"
#define R 1.987
#define h 0.0001
double r(x,t,xso2)
double x,t,xso2;
{
double r,r1,r2,r3,keff,K,B,Kp,Pso2,Pso3,Po2;
if(t>=693.15 && t<748.15)
keff = 7.6915*pow(10,18)*exp(-76062 / (R*t));
if(t>=748.15 && t<=873.15)
keff = 1.5128*pow(10,7)*exp(-35992 / (R*t));
K = 2.3*pow(10,-8)*exp("7200/(R*t));
Kp=2.26203*pow(10,-5)*exp(11295.3 / t);
Pso2=(xso2-xso2*x) / (1-xso2*x/2);
Pso3=xso2*x / (1-xso2*x/2);
Po2=(0.21-xso2-xso2*x/2) / (1-xso2*x/2);
r1 =Po2*Pso2/Pso3;
r2 =Pso3/(Pso2*sqrt(Po2)*Kp);
B =48148*exp(-7355.5/t);
r3 =sqrt(B+(B-1)*(1-x)/x)+sqrt(K*(1-x)/x);
r =keff*K*r1*(1-r2*r2)/(r3*r3);
return(r);
}
double dr(x,t,xso2)
double x,t,xso2;
{
double y;
y=(r(x,t+h,xso2)-r(x,t-h,xso2))/(2*h);
return(y);
}
double t(t0,x0,x)
double t0,x0,x;
{
double y,lamda,H=-23135,Cp=254.9,rou=0.500,c=1.282;
lamda=-H*c/(rou*Cp);
y=t0+lamda*(x-x0);
return(y);
}
double fun1(x,t,xso2)
double x,t,xso2;
{
double y;
y=-dr(x,t,xso2)/(r(x,t,xso2)*r(x,t,xso2));
return(y);
}
double jifen(x0,t0,xso2)
double x0,t0,xso2;
{
double sum=0.0,x1=x0,x2,t1,t2=693.15,xout;
do{
t1=t(t0,x0,x1);
x2=x1+h/10;
t2=t(t0,x0,x2);
if(t2>873.15){
xout = x1;
goto end;
}
sum=sum+h*(fun1(x1,t1,xso2)+fun1(x2,t2,xso2))/20;
x1=x2;
}while(sum<0);
xout=x1-h/10;
end: return(xout);
}
double wjifen(xin,xou,tin,xso2)
double xin,xou,tin,xso2;
{
double y,x1=xin,x2,t1,t2,sum=0.0,wcat;
do{
t1=t(tin,xin,x1);
x2=x1+h;
t2=t(tin,xin,x2);
if(t2>=873.15) goto end ;
sum=sum+(1/r(x1,t1,xso2)+1/r(x2,t2,xso2))*h/1000;
x1=x2;
}while(x2<=xou);
end: wcat=sum*131*1000/3600;
return(wcat);
}
main()
{
double xso2=0.08,xout,tout,x0=0.0001,t0,t00=717,t1,wsum=0.0,wcat;
double xou[5],tou[5],tin[5],xin[5];
int i,j;
loop1: x0=0.0001;
t0=t00;
i=0;
xin[i]=x0;
tin[i]=t00;
loop2: xout=jifen(x0,t0,xso2);
tout=t(t0,x0,xout);
xou[i]=xout;
tou[i]=tout;
t1= 693.15;
do{
t1=t1+0.01;
}while(fabs(pow(10,5)*r(xout,t1,xso2)-pow(10,5)*r(xout,tout,xso2))>h);
x0=xout;
t0=t1;
i++;
xin[i]=xout;
tin[i]=t0;
if(i<=3) goto loop2;
t00=t00-0.1;
if(x0<=0.98) goto loop1;
printf("i tin xin tout xout wcat\n");
for(j=0;j<=3;j++){
wcat=wjifen(xin[j],xou[j],tin[j],xso2);
printf("%d %5.5f %5.5f %5.5f %5.5f %5.5f\n",j+1,tin[j],xin[j],tou[j],xou[j], wcat);
wsum=wsum+wcat;
}
printf("wsum= %f (KG) %f (Ton)\n",wsum,wsum/1000);
}
X SO2Tin/K Xin Tout/K Xout Wcat/KG Wsum/KG
0.070 1717.000.00010873.149360.671104648.31851
26480.6702 2738.420.67110790.777740.896094167.40302
3732.770.89609747.912530.961165352.48512
4708.450.96116712.883840.9801712312.46358
0.075 1716.500.00010873.149690.673254962.02189
29195.76953 2737.200.67325789.466980.897854568.28686
3761.310.89785746.056920.961226040.78522
4707.280.96122711.652650.9800113624.67556
0.080 1715.900.00010873.147760.675825334.82368
33107.7256 2735.660.67582787.852520.900105079.87849
3729.480.90010743.773140.961526999.83292
4705.640.96152709.942830.9800115693.19406
0.085 1715.400.00010873.148090.677975743.45684
38125.31007 2733.870.67797786.071820.902295720.00498
3727.380.90299741.249600.961898184.48414
4703.790.96189708.016040.9700518477.66410
0.090 1715.200.00010873.148220.678836161.25781
44461.52035 2731.990.67883784.338430.903786478.89742
3725.230.90378738.801730.962109792.95111
4701.810.96210705.991820.9800722028.41402
二氧化硫性质实验创新设计 摘要:为达到绿色环保、现象明显、操作简便和有效调控的目的,文章设计了新的二氧化硫性质实验装置。 关键词:二氧化硫的性质;实验改进;创新设计 文章编号:1008-0546(2012)08-0094-01 中图分类号:g633.8 文献标识码:b doi:10.3969/j.issn.1008-0546.2012.08.046 二氧化硫气体的性质实验是课本上的必做实验[1],但由于二氧化硫是有毒气体,广大化学教学同仁从环保、安全和易操作的角度出发对该实验进行了很多有益的探索和改进,如对实验进行微型化改进和集约化设计,在教学中取得了一定的成效,但从使用的情况来看,仍存在美中不足,如装置复杂、药品的用量大,可视效果差、器材准备繁琐等,为使该实验的操作更进一步完善,笔者设计了新的实验装置,现介绍如下。 一、实验仪器 125ml蒸馏烧瓶1个,配单孔橡皮塞1个,250ml广口瓶一个,配双孔橡胶塞(注:其中一孔为斜孔,用来插入蒸馏燃烧的支管)1个,直形玻璃管1支,乳胶管,止水夹,直角玻璃管1支,滤纸,药匙,滴管、镊子,纸槽。 二、实验药品 70%的硫酸溶液,无水亚硫酸钠固体,2%的酸性高锰酸钾溶液,石
蕊试液,溴水,品红试液,氢氧化钠溶液。 三、实验装置(见图1) 四、实验操作过程和现象 1.搭建图1(1)所示装置,经检查装置的气密性完好后,按图1(1)所示在各仪器的相应位置加入药品,其中在与烧瓶配套的单孔胶塞的直形玻璃管上等距离粘附有滤纸,用滴管把溴水、品红溶液、紫色石蕊试液、酸性高锰酸钾溶液分别滴在对应的滤纸上。 2.关闭止水夹,用手小心地扶住装置使其朝右倾斜,让无水亚硫酸钠固体滑落至硫酸溶液后,立即让装置竖立,如图1(2)所示,观察现象。现象:可以看得到亚硫酸钠与硫酸混合后,立即反应产生白雾,玻璃管上各对应滤纸的酸性高锰酸钾溶液紫色褪去,石蕊试液紫色变红,溴水橙色褪去,品红试液红色逐渐褪去。 3.待反应停止后,打开止水夹,用洗耳球从乳胶管口向装置内吹入空气,以排尽烧瓶中的so2尾气让广口瓶中的naoh溶液吸收,此后可拆卸装置,洗涤仪器。 五、新设计实验的优点 1.装置简单,操作方便,所使用的仪器均为实验室常备仪器,仪器之间容易组装,且不需要用铁架台来夹持,可减轻教师准备实验的负担。 2.新设计的装置能在同一仪器内完成二氧化硫气体的制备及演示二氧化硫的系列性质(二氧化硫作为酸性氧化物的性质,能使紫色石蕊变红;二氧化硫的还原性,能使酸性高锰酸钾和溴水褪色;二
(此处可用于收集,或继续组装其他性质实验装置:如 组装与H2S反应装置。还可以通过通水方法排进气体) (热水) (品红溶液)(石蕊试液)(溴水)(酸性KMnO4)(蘸有NaOH的棉花)微型化学实验应用——二氧化硫性质检验实验改进 (河北省张家口市宣化一中化学教研组李彤075100) 一.改进实验目的 二氧化硫是一种具有刺激性气味的有毒气体,性质多样,具有酸性、漂白性、还原性等, 能使品红、溴水、氯化铁溶液、酸性高锰酸钾溶液褪色。整个实验装置包括制备装置、性 质实验装置和尾气处理装置,故在班级做演示实验时仪器较多,同时易造成S02扩散,污染 教室环境,严重威胁师生的健康,。为此,我们对该实验进行改进,使操作更加简便、实验时 间短、药品用量少、效果明显,而且方便展台演示、便于学生观察,有效的防止了S02的逸 散,有助于学生环保意识的养成。 二.实验仪器及试剂: 仪器:具支试管(带双孔塞)、导管、橡胶管(若干)、分液漏斗、干燥管、烧杯(带热水)、铁架台(带铁夹) 药品:70%浓硫酸、Na2SO3固体、FeCl3溶液、品红溶液、石蕊试液、溴水、酸性KMnO4、蘸有NaOH的棉花。 三.实验仪器装置图及仪器的组装说明 向具支试管中加入少量亚硫酸钠粉末,分液漏斗中注入少量浓硫酸,用注射器从橡胶管 处向输液管处注入药品。关闭上面的止水夹,打开下面的止水夹,旋转分液漏斗的玻璃旋塞, 是浓硫酸滴下与亚硫酸钠反应,观察四个输液管中的现象;关闭下面的止水夹,打开上面的 止水夹,继续做其他实验。(实验完毕后,还可从此导管处通水,将装置中的残余S02全部排 出。) 实验完毕后,从分液漏斗中注入一定量的浓氢氧化钠片刻后,再拆仪器。 五.装置改进的意义
2S 反应装置。还可以通过通水方法排进气体)(品红溶液) 微型化学实验应用——二氧化硫性质检验实验改进 (河北省张家口市宣化一中 化学教研组 李彤 075100) 一.改进实验目的 二氧化硫是一种具有刺激性气味的有毒气体,性质多样,具有酸性、漂白性、还原性等,能使品红、溴水、氯化铁溶液、酸性高锰酸钾溶液褪色。整个实验装置包括制备装置、性质实验装置和尾气处理装置,故在班级做演示实验时仪器较多,同时易造成S02扩散,污染教室环境,严重威胁师生的健康,。为此,我们对该实验进行改进,使操作更加简便、实验时间短、药品用量少、效果明显,而且方便展台演示、便于学生观察,有效的防止了S02的逸散,有助于学生环保意识的养成。 二.实验仪器及试剂: 仪器:具支试管(带双孔塞)、导管、橡胶管(若干)、分液漏斗、干燥管、烧杯(带热水)、 铁架台(带铁夹) 药品:70%浓硫酸、Na 2SO 3固体、FeCl 3溶液、品红溶液、石蕊试液、溴水、酸性KMnO 4、蘸 有NaOH 的棉花。 三.实验仪器装置图及仪器的组装说明 向具支试管中加入少量亚硫酸钠粉末,分液漏斗中注入少量浓硫酸,用注射器从橡胶管处向输液管处注入药品。关闭上面的止水夹,打开下面的止水夹,旋转分液漏斗的玻璃旋塞,是浓硫酸滴下与亚硫酸钠反应,观察四个输液管中的现象;关闭下面的止水夹,打开上面的止水夹,继续做其他实验。(实验完毕后,还可从此导管处通水,将装置中的残余S02全部排出。) 实验完毕后,从分液漏斗中注入一定量的浓氢氧化钠片刻后,再拆仪器。 五.装置改进的意义
此实验由于是变色反应,反应现象明显,且反应速度快,大大减少污染,节省药品而且缩短了实验时间,操作更为方便。同时,通过借助多媒体设备进行投影,可以使学生观察方便。 此装置是对教材中SO2的制备以及性质检验进行的系统化改进。与课本实验相比,该实验具备以下几个有点:首先,能在短时间内做完二氧化硫的多个化学性质,给老师上课赢得了时间;其二,实验装置主要用废旧输液管,所需材料简单,有利于学生课内外开展实验;其三,此实验改进,可以直观的完成二氧化硫的系列性质实验。其四,受装置的启发,利用同样装置,还可以完成乙烯等气体性质实验。此实验改进利用微型实验,做到废旧物品的利用、节省了药品的同时,能大幅度的减少废气排放。特别是对毒性大,气体排放量大的实验,可减轻环境的污染。对于易燃易爆的实验可以提高其安全系数,不至于危害生命。 微型实验易激发学生兴趣,可使每个学生都亲自动手;培养了学生观察和实验的能力,提高学生即动脑,又动手,以及理论联系实际的能力;对于办学条件较差,缺少仪器药品和实验设备的学校,学生可以利用废旧的物品(如:青霉素药瓶、墨水瓶等等),自制简单便携的微型化学仪器,培养了学生的创新精神。
二氧化硫的性质实验探究 一、实验教学目标 知识目标: (一)通过简单介绍二氧化硫的实验室制法,使学生掌握好实验室制取二氧化硫的反应原理,实验装置,并利用设计的装置制取二氧化硫,用于动手实验,提高学生分析和解决实际问题的能力。 (二)通过分组实验探究,归纳出二氧化硫的性质。 能力目标: 让学生通过动手、观察、比较、思考提高归纳、总结、应用等各方面的能力。 情感目标: (一)培养学生良好的学习习惯,善于探索的思维方法,把课堂主动权交给学生。 (二)通过实验探究,培养学生求实、创新、合作的科学品质。 (三)通过师生、生生合作学习,研究性学习,体验探究成功的乐趣,激发学生探究欲。 (四)通过探究二氧化硫的性质实验,使学生掌握科学的试验方法,培养学生的逻辑思维能力和动手能力。 (五)了解二氧化硫的物理性质;掌握二氧化硫的特殊性、漂白性和还原性。 (六)通过改进实验培养实验设计能力、观察能力、分析能力、探究能力和合作学习能力, 二、实验内容设计 实验探究1:用干燥的矿泉水瓶收集一瓶二氧化硫,然后向矿泉水瓶中注入蒸馏水,请仔细观察实验现象,为什么注射蒸馏水而不是自来水? 实验探究2:向变瘪的矿泉水瓶中注入石蕊溶液,观察实验现象,这说明什么? 实验探究3:用干燥的试管收集二氧化硫,用橡胶塞塞住,然后用注射器吸10mL的品红溶液向试管注入品红溶液,观察实验现象,这说明什么? 实验探究4:用干燥的试管收集二氧化硫,用橡胶塞塞住,然后用注射器吸10mL的酸性高锰酸钾溶液向试管注入酸性高锰酸钾溶液,观察实验现象,这说明什么? 实验探究5:给实验探究3和实验探究4的试管加热,对比实验,认真观察实验现象;然后向其滴加酸性氯化钡溶液,观察实验现象,这又说明什么? 三、实验方法设计 教学目标的达成,需要适当的教学方法。本节课是实验教学课,所以以实验为主,通过分组实验、活动探究、演示实验、对比探究、合作交流、讨论归纳相结合的教学方法。给学生自己动手实验,让学生积极的思考,最后由学生自己来归纳总结。让学生在体会实验探究快乐的同时,也顺利的完成教学目标。 四、教学过程设计
二氧化硫的制备及其性质实验的改进 衡南二中苏秋中邓礼军 一:设计意图 在人教版《化学》(必修一)教材的P90实验4-7中,演示了SO2的水溶性和漂白性,在教学过程中,我们发现,在实验时存在一些不足,比如SO2容易排放到空气中,污染环境,危害师生健康,在实验过程中,实验药品的用量较大,造成了药品的浪费,不符合绿色化学的理念,操作较为复杂,现象不太明显,而且实验不能完全演示二氧化硫的性质,为此,在借鉴前辈们的创新成果的基础上,我设计了以下实验方案,能有效解决上述问题。 二:改进后所需的仪器及药品 1:仪器 青霉素瓶(6支),5ml的干燥的注射器(2支),20ml的干燥的注射器(2支),烧杯(3个),点滴板,酒精灯,火柴,大试管,双孔橡皮塞,气球,药匙,试管架,试管夹 2:药品 Na2SO3,4mol/L的H2SO4,充满硫化氢的青霉素瓶1瓶,酸性高锰酸钾,溴水,pH试纸,品红溶液,NaOH溶液 3:装置图 三:操作 一:二氧化硫的制备 步骤: 1:检查装置气密性 2:在大试管中加1药匙Na2SO3,用20ml的注射器吸取约10ml的H2SO4,关闭止水夹 3:将注射器中硫酸滴加到大试管中,发现气球膨胀 4:打开止水夹,用向上排空气法收集4瓶气体备用
5:关闭止水夹,多余的气体储存在气球内 二:二氧化硫的性质 1:二氧化硫的溶解性及其水溶液的酸性 步骤: a.用注射器吸取约3mL水,先注入1mL水到充满SO2的青霉素瓶中,握住注射器活塞,振荡青霉素瓶,松手,观察现象。 2:二氧化硫的漂白性 步骤: a.用注射器吸取约2mL品红溶液,慢慢注入充满SO2的青霉素瓶,振荡,观察现象。 3:二氧化硫的还原性 步骤: a.用注射器吸取约1mL左右的高锰酸钾溶液,慢慢注入充满SO2的青霉素瓶,振荡,观察现象。 的青霉素瓶,振荡,观察现象。 4:二氧化硫的氧化性 步骤: 用干燥的注射器吸取约5mLSO,慢慢注入到充满H 四:改进后的优点 (1)青霉素瓶等取材方便,又是二次利用,环保,低碳,节约,实验成本低 (2)装置简单,能快速制取SO2并把SO2的性质全部演示出来,提高了课堂教学效率(3)操作方便、药品用量少、现象明显,成功率高 (4)实验在密闭体系中进行,基本上没有排放有毒气体排放,最大程度的避免了空气污染(5)实验产生的废物,可以及时的处理,安全、基本无污染 (6)体现了绿色化学的理念,有助于学生从小树立绿色化学观念
空气中二氧化硫的测定实验报告
实验十三空气中二氧化硫含量的测定 (甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法) 一、概述 )又名亚硫酸酐,分子量为二氧化硫(SO 2 64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度 2.26。极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。也溶于乙醇和乙醚。二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。 二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。 二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。它主要来源于以煤或石油为燃料的工厂企
业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。 测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。 二、实验目的 1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。 2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。 三、实验原理 1.二氧化硫的基本性质 二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为
-10℃,熔点为-76.6℃,对空气的相对密度为2.26。极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。 2.盐酸副玫瑰苯酚分光光度法 测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。为避免汞的污染,近年来用甲醛溶液代替汞盐作吸收液。 SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,与盐酸副玫瑰苯胺作用,生成紫红色化合物,用风光光度计在570mm处进行测定。 测定范围为10mL样本溶液中含0.3—20μg SO2。若采样体积为20L,则可测浓度范围为0.015—1.000mg/m3。 3.方法特点
改进二氧化硫的性质实验 二氧化硫的性质是人教版必修一教材的重点,但是按照书上的教材内容制备二氧化硫气体装置非常复杂,且在制备及检验性质的过程中容易产生严重的污染。为了解决实验步骤繁琐、仪器繁多、浪费药品、不便于学生操作等问题,笔者尝试改进,不仅绿色环保,而且操作起来更为简便快捷。 一、明确教学内容二氧化硫的性质实验充分体现了以学生为主体的教学思想,激发了学生的求知欲,培养了学生实事求是的态度和科学的价值观。其教学内容包括:第一,学生自行完成二氧化硫的性质检验,培养了学生的环保意识; 第二,学生分组实验,根据实验现象得出结论。如:酸性氧化物的性质检验方法有:①S02与水(滴加 紫色石蕊溶液)的反应,现象是紫色石蕊溶液变红;②S02与NaOH 溶液(滴加酚酞溶液)的反应,现象是NaOH容液红色退色;③S02 与BaCl2 溶液的反应,现象是没有白色沉淀产生。 此外,漂白性的检验方法有:S02与品红溶液的反应,现象是品红溶液退色;还原性的检验方法有:S02与KMnO溶液的反应,现象是KMn0溶液紫色退色;氧化性的检验方法有:S02与Na2S溶液的反应,现象是产生淡黄色沉淀。 二、实验准备 二氧化硫的性质实验仪器包括酒精灯、圆底烧瓶、分液漏斗、铁架台、导管、橡胶塞、小试管、止水夹、气球、医用一次性带针头的注射器
(每组6 支)、透明的矿泉水瓶(每组6 个)、pH 试纸;药品包括浓硫酸、亚硫酸钠粉末、紫色石蕊溶液、酚酞、氢氧化钠溶液、品红溶液、高锰酸钾溶液、硫化钠溶液、氯化钡溶液。 三、实验改进步骤及优势 传统二氧化硫的性质实验的制备和检验步骤是在通风橱中完成,用 固液制取装置制取二氧化硫。这样的实验对环境、仪器以及安全性提出了很高的要求,而且受课时的限制,学生无法在一节课中完成实验。 改进后的实验操作步骤是在实验室的通风橱中制取及收集二氧化 硫,按照传统制取氯气的装置进行制备。改进方案包括:第一,气体的收集方式。气体收集到矿泉水瓶中,每组课前收集好六瓶,一次性收集完; 第二,把导气管通入到装有水(滴加紫色石蕊溶液)的试管中,使其变红一段时间后,立即套好气球,以备检验二氧化硫与水是否发生反应; 第三,把导气管通入到装有少量品红溶液的试管中,使其溶液退色后,立即套上气球,以备证明二氧化硫漂白的可逆性。改进后的实验不仅方便操作、选材简单,而且绿色环保、节约药品。 传统二氧化硫的性质实验的检验内容包括酸性氧化物的性质、漂白性、氧化性、还原性。其改进方案包括:第一,用带针头的注射器分别抽取水(滴加紫色石蕊溶液)、氢氧化钠溶液(滴加酚酞溶液)、氯化 钡溶液、品红溶液、高锰酸钾溶液、硫化钠溶液,然后依次扎入收集好二氧化硫的矿泉水瓶中。注入完毕后,注意用透明胶带粘好针孔处,以防外溢; 第二,把事先准备好的,已经褪色的品红溶液的试管放到酒精灯上加热,溶液变红及气球鼓起即可。
实验六大气中二氧化硫的测定 环境工程李婷婷2110921109 一、实验目的 1、练习使用大气采样器,掌握其操作过程; 2、掌握二氧化硫测定的实验原理。 二、实验原理 二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,形成紫红色络合物,根据颜色深浅,比色定量。 四氯汞钾:HgCl2+2KCl=K2[HgCl4] 吸收SO2:[HgCl4]2-+SO2+H2O=[HgCl2SO3]2-+2H++2Cl- 二氯亚硫酸盐络合物 加盐酸和甲醛: [HgCl2SO3]2-+HCHO+2H+=HgCl2+HOCH2SO3H 羟基甲基磺酸 加副品红,显色:
三、实验步骤 1、样品采集: 用内装5mL四氯汞钾吸收液的多孔玻板吸收管,以0.5L/ min流量采气10-20L,在采样、样品运输及存放过程中应避免日光直接照射。 2、标准曲线的绘制: 取8支具塞比色管,按表配制标准色列: 各管中加入0.50mL氨基磺酸胺溶液,摇匀。再加入0.50mL甲醛溶液及1.50mL盐酸副玫瑰苯胺溶液,摇匀。当室温为15~20℃,显色30min;室温为20~25℃,显色20min;室温为25~30℃,显色15min。用10mm比色皿,在波长575nm处,测定吸光度。 3、样品测定: 将吸收管中的样品溶液全部移入比色管中,用少量水洗涤吸收管,并入比色管中,使总体积为5mL。以下步骤同标准曲线的绘制。 四、实验结果与分析 大气中二氧化硫的浓度X SO2(mg SO2/m3): X SO2 = (A-A。)B S/V0
式中:A——样品溶液吸光度; A0——试剂空白液吸光度; B S———核准因子,μg/吸光度单位; V0——换算为标准状态下(0℃,101325Pa)的采样体积,L B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n 式中:W N为SO2的含量(μg) n为标液份数 V0= Vt*273/(273+t)*P/101.3 式中:Vt为采样温度为t,压力为P的采样体积,L P:现场采样压力,K Pa 经实验测得,二氧化硫的标准曲线如下: 代入公式B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n,得: B S=12.40361。0.04 实验采样时P=102.8Kpa,T=280K,采样流量为0.5L/ min,时间为30min,所以采样体积为Vt=15L,代入公V0=Vt*273/(273+t)*P/101.3得:V0=14.84156L。 实验测得样品吸光度为A=0.111,A0=0.063,由以上计算可知B S=12.404,V0=14.842L,代入公式X SO2 =(A-A。)B S/V0,可得:X SO2=0.04 mg SO2/m3。
附件2 第五届全国中小学实验教学说课活动申 报表
1
二、装置的基本构造及安装方法: 1、输液管中取用70%硫酸(取用方式:关闭输液管开关,捏住软囊部位,把输液管的针头部位插入硫酸中,松开软囊,硫酸自然进入输液管中) 2、小广口试剂瓶中加入亚硫酸钠粉末,然后加入带有检验气体性质纸帶的圆柱桶(圆柱桶制作方法:可以选取多孔卷发器或打孔的小圆柱桶,在圆柱体的四个方位上粘贴四条滤纸条,要有一定的距离,然后在滤纸上分别滴少量的“硫化钠溶液、氯化钡溶液、滴有酚酞的氢氧化钠溶液、高锰酸钾溶液”,注意浸润即可,不要流下) 3、把带有三通装置和输液管的双孔塞塞好,保证气密性。 4、在三通管的两个导管处分别接两个小许愿瓶(许愿瓶的制作方法:在许愿瓶中分别加入少量品红试液、紫色石蕊试液,盖上胶塞。双孔胶塞一个插入导气管,一个插上导气管,并连接气球) 三、实验基本操作方法: 1、检查好气密性后,按上述要求安装好仪器,装好药品后准备实验。 2、打开连在输液管上的三通一端,打开输液管开关,使大气流通,待有液体流下且未进入试剂瓶之前,关闭三通一端,用输液管开关控制流速,保证实验的在密闭系统中顺利畅通。 3、观察圆柱桶表面各滤纸的颜色变化,效果明显(高锰酸钾褪色、硫化钠出现淡黄色、氢氧化钠的酚酞溶液褪色、氯化钡溶液无明显变化) 4、观察许愿瓶中品红颜色微微褪去时,关闭输液管开关(严格控制反应物用量,用瓶内剩余的药品即可使品红完全褪色,紫色石蕊试液变为红色)。 5、实验结束后,用止水夹夹住许愿瓶的进器口,把许愿瓶放入到50度左右的温水浴中,加热一段时间后,两个气球迅速鼓起,过一会冷却后,气球又变瘪,充分证明二氧化硫了漂白的可逆性和溶于水的可逆性。 6、最终实验结束后,用针筒吸取氢氧化钠溶液注入到试剂瓶中,做好尾气处理。
苏教版化学1第4专题第一单元 《二氧化硫的性质和作用》教学设计 王海英 (江苏省新海高级中学江苏连云港222006) 一、教学设计 本节课的设计以新课程理念为指导,改变以往对元素化合物知识的学习模式:结构→性质→用途,而是从现实实际和观察到的现象出发,让学生通过观察分析→推测性质→实验验证→得出结论,体现探究式学习方式。本节课以“酸雨”为背景,课前循环播放的优美风景图片与一组环境污染图片的对比,视觉冲击深深触动学生的心灵,接着课堂创设“模拟酸雨”的情境,引发学生的探究欲,并由此引出相关问题,设计展开四个探究活动:①二氧化硫可溶于水且溶液显酸性。 ②探究SO 的还原性。③探究二氧化硫的氧化产物。④探究二氧化硫的漂白性。这 2 些场景的创设,有效地激发了学生的学习热情;将知识问题化,通过化学实验、分析化学原理、类比迁移等化学方法使问题得以解决;遵循学生的认知规律,由浅入深,由现象到本质,使教学目标得以达成。 二、教材分析 本课时是苏教版《化学1》专题4第一单元的第一课时。二氧化硫是高中化学学习的重要氧化物之一,是一种既具有氧化性又具有还原性的酸性氧化物,是工业生产硫酸环节中的一种重要的物质,也是学生初步认识环境污染中大气污染的一种主要物质。通过实验手段探究其性质,提高学生学习化学的兴趣、培养学生的探究精神;通过了解二氧化硫对环境的危害,加强学生的环保意识;通过对二氧化硫用途的学习,有助于学生辩证看待事物。 三、教学目标 知识与技能: (1)了解二氧化硫的作用,了解可逆反应的概念; (2)掌握二氧化硫的化学性质; (3)培养学生用新概念重新理解旧知识的能力(可逆反应的概念);培养学生设计实验、动手实验、观察现象,并根据实验现象得出可能的规律的能力。 过程与方法 通过二氧化硫的组成及价态,分析其可能的性质,并设计实验探究,激发学生学习化学的兴趣、探索新知识的欲望,且在实验研究中培养求实,进取的优良品质。 情感态度价值观 通过图片展示环境污染的情景,对学生进行防止环境污染、保护环境的教育,使其意识到自己的义务和责任。 教学重点:二氧化硫的性质教学难点:实验方案的设计 四、教学过程 1.引入新课 【教师投影】一组美丽的画面 【教师引入】清山秀水惹人醉,如画美景不胜收。美丽的风景需要我们珍惜和保护,否则我们将会看到另一番景象。 【教师投影】一组被酸雨污染的画面
3二氧化硫的测定 3.1 方法与原理 环境空气甲醛吸收-副玫瑰苯胺分光光度法:二氧化硫被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,在样品溶液中加入氢氧化钠使加成化合物分解,释放出的二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物,用分光光度计在波长577 nm 处测量吸光度。 3.2 试剂和材料 (1)碘酸钾(KIO 3),优级纯,经110℃干燥2 h 。 (2)氢氧化钠溶液,c (NaOH )=1.5 mol/L :称取6.0 g NaOH ,溶于100 ml 水中。 (3)环己二胺四乙酸二钠溶液,c (CDTA-2Na)=0.05 mol/L :称取1.82 g 反式1,2-环己二胺四乙酸[简称CDTA],加入氢氧化钠溶液6.5 ml ,用水稀释至100 ml 。 (4)甲醛缓冲吸收贮备液:吸取36%~38%的甲醛溶液5.5 ml ,CDTA-2Na 溶液20.00 ml ;称取2.04 g 邻苯二甲酸氢钾,溶于少量水中;将三种溶液合并,再用水稀释至100 ml ,贮于冰箱可保存1年。 (5)甲醛缓冲吸收液;用水将甲醛缓冲吸收贮备液稀释100倍。临用时现配。 (6)氨磺酸钠溶液,ρ (NaH2NSO3)=6.0 g/L :称取0.60 g 氨磺酸[H2NSO3H]置于100 ml 烧杯中,加入4.0 ml 氢氧化钠(4.2),用水搅拌至完全溶解后稀释至100 ml ,摇匀。此溶液密封可保存10 d 。 (7)碘贮备液,c (1/2I2)=0.10 mol/L :称取12.7 g 碘(I2)于烧杯中,加入40 g 碘化钾和25 ml 水,搅拌至完全溶解,用水稀释至1 000 ml ,贮存于棕色细口瓶中。 (8)碘溶液,c (1/2I2)=0.010 mol/L :量取碘贮备液50 ml ,用水稀释至500 ml ,贮于棕色细口瓶中。 (9)淀粉溶液,ρ(淀粉)=5.0 g/L :称取0.5 g 可溶性淀粉于150 ml 烧杯中,用少量水调成糊状,慢慢倒入100 ml 沸水,继续煮沸至溶液澄清,冷却后贮于试剂瓶中。 (10)碘酸钾基准溶液,c (1/6KIO3)=0.100 0 mol/L :准确称取3.566 7 g 碘酸钾溶于水,移入1 000 ml 容量瓶中,用水稀至标线,摇匀。 (11)盐酸溶液,c (HCl)=1.2 mol/L :量取100 ml 浓盐酸,加到900 ml 水中。 (12)硫代硫酸钠标准贮备液,c (Na 2S 2O 3)=0.10 mol/L :称取25.0 g 硫代硫酸钠,溶于1 000 ml ,新煮沸但已冷却的水中,加入0.2 g 无水碳酸钠,贮于棕色细口瓶中,放置一周后备用。如溶液呈现混浊,必须过滤。 标定方法:吸取三份20.00 ml 碘酸钾基准溶液分别置于250 ml 碘量瓶中,加70 ml 新煮沸但已冷却的水,加1g 碘化钾,振摇至完全溶解后,加10 ml 盐酸溶液,立即盖好瓶塞,摇匀。于暗处放置5 min 后,用硫代硫酸钠标准溶液滴定溶液至浅黄色,加2 ml 淀粉溶液,继续滴定至蓝色刚好褪去为终点。硫代硫酸钠标准溶液的浓度按式(1)计算: (1) 式中:c 1——硫代硫酸钠标准溶液的浓度,mol/L ; 1020.00mol /C L V ?= ()
< 二氧化硫的性质>教学反思 一、精心创设求知情景,激发学习兴趣 以全球瞩目的全球三大环境问题之一“酸雨”为切入口,播放一段有关酸雨的录像,使学生感到亲切又渴望,亲切的是日常生活所能碰到的问题,渴望了解酸雨是如何形成的。这时我再顺水推舟引出课题:形成酸雨的主要原因之一是二氧化硫,欲知酸雨如何形成,得先了解二氧化硫的性质。好的开始是成功的一半,上课时就能吸引学生、激发起学生的学习兴趣尤其重要。我做到了这一点。 二、内容重组,过渡自然 秉着新课程理念“用教材教而不是教教材”,于是我对硫和氮的氧化物的内容做了重新的安排:硫单质及其燃烧后的产物已在初中时接触过,我不再作为上课时的讲解内容,主要讲解二氧化硫的性质。考虑到学生的基础及知识的完整性、系统性,我将其进行补充改进:首先介绍二氧化硫的漂白性,教材上是往二氧化硫的水溶液中滴加品红溶液来说明二氧化硫漂白作用,这样的说服力不强,学生会认为会不会是二氧化硫与水反应后得到的亚硫酸具有漂白作用而不是二氧化硫。在教研室陈主任的帮助下我把其改成了往二氧化硫气体中伸入品红试纸来验证二氧化硫具有漂白作用。这样既避免想到亚硫酸的影响,又在加热时不会有过多的二氧化硫从溶液中分解出来。实验简单易行,又能避免学生在认知上的歧义。我认为这是本节课的一处亮点。接着从组成上分析二氧化硫具有酸性氧化物的通性,最后从化合价分析二氧化硫的氧化还原性。这样既过渡自然又环环紧扣。 三、问题驱动,激发兴趣与动力 二氧化硫性质学习整个过程中,我都以问题驱动学生积极参与学习与探究。如在学习其物理性质时,我设计了几个问题:1、了解一种物质的物理性质,主要从哪几点考虑?2、如何知道一种气体物质的水溶性?方案设计?几个问题把学生带入了实验探究。在学习二氧化硫的漂白作用时,我不是直接引入漂白实验而是,而是先创设情景:古时利用燃烧硫的方法漂白布料,你能说说其可能原理吗?引入可能的性质漂白作用,再进行实验探究验证。在学习二氧化硫的其它两化学性质酸性氧化物的通性及氧化还原性时也都是精心的设置问题,解决问题的方式呈现,我认为这样可以避免教师直接填鸭式的告知方式的枯燥无味,激起学生想解决问题的欲望及兴趣,上课时同学们的积极参与就很好的说明了这一点。 四、创设认知“冲突”,激活学生思维 在验证二氧化硫能不能与氢氧化钠溶液反应的实验探究,提出方案通过颜色变化观察(往滴有酚酞的氢氧化钠溶液中通入二氧化硫)后,质疑能否说明就是二氧化硫与氢氧化钠
二氧化硫性质实验的改进 实验目的: 1、通过探究二氧化硫的性质实验,使学生掌握科学的试验方法,培养学生的逻辑思维能力和动手能力。 2、了解二氧化硫的物理性质;掌握二氧化硫的特殊性、氧化性和还原性。 3、通过改进实验培养实验设计能力、观察能力、分析能力、探究能力和合作学习能力。 实验原理: SO2的制备原理:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O H2S的制备原理:Na 2S+H 2 SO 4 (浓)=H 2 S↑+Na 2 SO 4 2H2S+SO2 == 3S↓+2H2O SO2+I2+2H2O == 2HI+H2SO4 2KMnO4+5SO2+2H2O==K2SO4+2MnSO4+2H2SO4 尾气处理:SO2+2NaOH == Na2SO3+H2O SO 2 +H2O H2SO32H++SO32- SO2可以使品红溶液褪色,加热后颜色还原,因为SO2的漂白原理是SO2与被漂白物反应生成无色的不稳定的化合物,加热时,该化合物分解,恢复原来颜色。 实验仪器与试剂: 三颈烧瓶、注射器、试管、玻璃棒、酒精灯、烧杯、铁架台、三脚架、石棉网、药匙、导管、胶管、带孔胶塞、pH试纸、石蕊试纸、淀粉KI试纸、滤纸、胶纸 NaOH溶液、品红试剂、浓硫酸、Na2SO3固体、酸性高锰酸钾溶液、Na2S 固体 实验步骤与现象: ①仪器安装好,检验其气密性 ②向三颈烧瓶加入过量Na2SO3固体,再用注射器吸取一管浓硫酸,插在右颈上,用烧杯装取一定量品红溶液,用导管与三颈烧瓶连接 ③取一根玻璃棒,在上面按图A-D顺序贴上pH试纸、蓝色石蕊试纸、酸性高锰酸钾试纸和淀粉KI试纸(酸性高锰酸钾试纸:取一小片滤纸,浸入酸 性高锰酸钾溶液中,晾干后即得;淀粉 KI试纸应先被数滴高锰酸钾溶液滴过, 带有蓝紫色出现,晾干即可),插入中间 颈口。以上试纸反应前均湿润。 ④挤入浓硫酸反应立即开始,可以观察到 酸性高锰酸钾试纸紫红色褪去,这是因为 SO2与高锰酸钾发生反应,而被高锰酸钾 氧化的淀粉KI试纸的紫蓝色也褪去,即 I2与SO2反应了,证明了SO2的还原性; 而蓝色石蕊试纸变红,说明SO2溶于水显 酸性;而pH试纸则变为红色,对比比色实验装置图 (请以实验报告纸质版为准)
S02性质实验综合 1?图中是实验室制备 S02并验证S02某些性质的装置图。试回答: (1) 如果用浓硫酸和铜来制取 S02,发生装置还需选用的仪器是 (2) __________________ ⑤的作用是 __________________ ,反应的离子方程式为 (3) 选用图乙收集 S02气体,气体从 ___________ 口进。 装置 实验现象 体现S02的性质 ① ② ③ ④ 2高一化学资料 11 5「談豔 &魚水 图 甲 图乙 ________ ,化学方程式为
根据要求同答下列问题 (1)装置A中反应的化学方程式为_____________ 。 (2)利用装置C可以证明SO2具有漂白性,C中盛放的溶液是___________ ;若要证明其漂白作用是可逆的, 还需要的操作是______________ 。 (3)通过观察D中现象,即可证明 SO2具有氧化性,D中盛放的溶液可以是 _____________ 。 a.NaCI 溶液 b.酸性 KMnO 4 c.FeCb d.Na z S 溶液 (4)研究小组发现 B中有白色沉淀生成,若往 B中加入过量稀盐酸,沉淀不溶解。沉淀物的化学式是 (5)为进一步验证 B中产生沉淀的原因,研究小组进行如下两次实验: 实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊。 实验ii:用如上图2的F装置代替上述实验中的 A装置(其他装置不变),连接后往装置F中通入气体X 时间,再加入70%H2SO4溶液,结果B中没有出现浑浊。 ①实验i”中煮沸BaCl2溶液的目的是_____________ 。 ②气体X可以是 ________ (填序号)。 a.CO2 b.Cl2 c.N2 d.NO2 ③B中形成沉淀的原因是(用化学方程式表示): ______________________ 。 3.1 ?某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
扬州大学 环境科学与工程学院 环 境 工 程 实 验 设 计 目录 吸收实验结果绘制的曲线,你可以得到那些结论? (3) 一、根据SO 2 (一)脱硫效率随塔内高度的变化 (3) (二)气体流量与吸收效率的关系 (4)
(三)入口SO 浓度与吸收效率的关系 (4) 2 (四)pH值与脱硫效率关系 (5) (五)钙硫比与脱硫效率的关系 (6) (六)液气比与脱硫效率关系 (6) 二、影响吸收效率的主要因素有哪些? (6) (一)吸收塔高度与脱硫效率的关系 (6) (二)入口二氧化硫浓度与脱硫效率的关系 (7) (三)液气比与脱硫效率的关系 (7) (四)浆液喷淋密度与脱硫效率的关系 (8) (五)风速与脱硫效率的关系 (8) (六)浆液粒径与脱硫效率的关系 (8) (七)浆液PH与脱硫效率的关系 (8) (八)吸收剂质量与脱硫效率的关系 (9) (九)氧化空气量与脱硫效率的关系 (9) (十)烟气温度与脱硫效率的关系 (10) (十一)钙硫比与脱硫效率的关系 (10)
三、如实验室无SO 吸收实验设备,请设计一套简易的实验装置 (11) 2 (一)石灰石研磨以及制浆设备 (11) (二)吸收塔 (11) (三)除雾器和再热器 (12) (四)设备注意事项 (12) (五)实验方法及步骤? (12) 吸收设备的设计参数 (13) 四、简述如何通过试验得出实际工程中SO 2 (一)设备腐蚀 (13) (二)结垢和堵塞 (14) (三)除雾器堵塞 (14) (四)脱硫剂的利用率 (14) (五)脱硫产物及综合利用 (14) 五、参考文献 (14) 一、根据SO 吸收实验结果绘制的曲线,你可以得到那些结论? 2 (一)脱硫效率随塔内高度的变化 实验值表明:脱硫效率的上升速率沿脱硫塔高度方向下降,说明单位长度时间内所吸
第二节二氧化硫的制备和性质 教学设计 【教学目标】 (一)《普通高中化学标准》对于本课的要求 认识二氧化硫的主要性质与作用,实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气的污染,知道硫酸型酸雨的形成原因和防治方法,培养良好的环境保护意识。 (二)三位教学目标 1. 知识与技能: ①认识二氧化硫的主要性质和作用; ②了解二氧化硫对空气的污染知道硫酸型酸雨的形成原因和防治二氧化硫所导致的空气污染的方法; ③会书写简单的化学方程式。 2. 过程与方法: ①通过对二氧化硫性质的实验探究,进一步学习基本的化学实验技能,并且理解硫酸型酸雨的形成过程; ②借助于生产实际和环境保护等社会热点内容,创设了促进学生改变学习方法的情景,在活动中获取知识,提高学生学以致用的意识和解决问题的能力。 3. 情感态度与价值观: ①认识科学探究的意义,体会实验探究的过程和乐趣; ②通过问题讨论和实验探究,激发勇于探索的精神,培养严谨的科学态度和合作意识;【教学重点、难点】 教学重点:二氧化硫的性质与作用,建立环境保护意识。 教学难点:设计实验探究二氧化硫的性质。 【课堂导入】【实物展台】 化学表演:龚喻《想当电工的粗铜》 【问题设计】龚喻同学把铜冶炼出来了,这个铜和我们今天要学习的二氧化硫的制备有没有什么联系呢?在实验室中制备二氧化硫的方法有哪些? 【PPT展示】一、实验室制备二氧化硫 【合作学习】男同学和女同学PK赛,看谁写得多,谁写得好。 【自主学习】问题1:三种制备二氧化硫的方法哪一个更好?说说你的理由?
问题2:制备二氧化硫,选择20%、70%、98%的硫酸,哪一种更好? 【学生回答】 【小结】实验室制备气体考虑的原则①原料尽量采用非气体②反应条件加热或不加热③方便收集,所以我们采用固液不加热的方法制备气体,选用的硫酸浓度为70%左右。 【实验探究】分别把SO2通入下列溶液 会有怎样的实验现象呢? 【自主学习】实物展台展示学生讨论的结果 【问题讨论】把SO2通入石蕊中,石蕊会先变红,然后会怎么样?会不会褪色? 把SO2通入NaOH和酚酞的混合溶液中,红色褪去,是不是漂白? 把SO2通入酸性高锰酸钾溶液中,红色褪去,是不是漂白? 把SO2通入溴水中,橙色褪去,是不是漂白? 【阅读教材】必修一P90,二氧化硫具有漂白性,它能漂白某些有色物质,二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。这种物质容易分解而使有色物质恢复原来的颜色。 【小结】SO2的漂白性在溶液中只针对品红溶液。 【问题讨论】把SO2通入足量的澄清石灰中,对应的方程式应该如何书写? 【课堂训练】1.酸性氧化物的通性 (1)与水反应 (2)与足量的氢氧化钠溶液 (3)与足量的石灰水 (4)与足量的氢氧化钡溶液 (5)(16江苏)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 【PPT展示】正确的化学方程式的书写 【问题讨论】二氧化硫中硫的价态是正四价,而硫的家族梦想是正六价,也就是说二氧化硫是还原性是比较强的。大家
(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法) 一、概述 二氧化硫(SO2)又名亚硫酸酐,分子量为,为无色有很强刺激性气体,沸点-10℃;熔点-℃;对空气的相对密度。极易溶于水,在0℃时,1L水可溶解,20℃溶解。也溶于乙醇和乙醚。二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。 二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在m3或大于此浓度就能被大多数人嗅觉到。吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。 二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。 测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。 二、实验目的 1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。 2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。 三、实验原理 1.二氧化硫的基本性质 二氧化硫(SO2)又名亚硫酸酐,分子量为,为无色有很强刺激性的气体,沸点为-10℃,熔点为℃,对空气的相对密度为。极易溶于水,在0℃时,1L水可溶解 SO2,20℃溶解 SO2,也溶于乙醇和乙醚。SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。 2.盐酸副玫瑰苯酚分光光度法 测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。为避免汞的污染,近年来用甲醛溶液代替汞盐作吸收液。 SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,与盐酸副玫瑰苯胺作用,生成紫红色化合物,用风光光度计在570mm处进行测定。 测定范围为10mL样本溶液中含—20μg SO2。若采样体积为20L,则可测浓度范围为—
二氧化硫的性质实验改进说课 令狐采学 新疆石河子第二中学王珊珊 一、使用教材 人教版高中化学必修一第四章第三节硫氮氧化物。 二、使用器材集气瓶及瓶塞。两个注射器,一根前端弯成螺旋状的铜丝, 若干滤纸条。药品:亚硫酸钠固体、浓硫酸、2mol/L氢氧化钠溶液、高锰酸钾溶液、石蕊试剂、品红溶液、硫化钠溶液、PH试纸。 三、实验创新要求/改进要点 集气瓶上方插入两根注射器。一个注射器用于注入浓硫酸反应制气,一个注射器吸取氢氧化钠用于吸收二氧化硫进行尾气处理。铜丝上悬挂的有各种试剂的滤纸条用于检验二氧化硫
的性质。将二氧化硫气体的制备、性质验证、尾气处理为一体,微型化。 1、上下拉动的铜丝可以让滴有各种试剂的滤纸与二氧化硫第一时间充分反应,节约药品,节省时间。 2、将注射器的针帽下端扎上许多小孔再嵌入瓶塞中,当推入氢氧化钠溶液时可以以喷洒式的方式进入,充分吸收二氧化硫。 四、实验原理/实验设计思路 以往二氧化硫的演示实验装置连接复杂,浪费药品,耗时长,不利于课堂演示。并且二氧化硫的密闭性差,吸收不充分,影响师生健康。特别是课堂上对装置的介绍、组装占用了很多的时间,使得教师对二氧化硫性质的分析不充分不透彻,无法真正达到实验探究的效果。我改进的装置微型一体化,操作简单,现象明显,尾气吸收充分,非常适合课堂实验演示。通过二氧化硫与滤纸上各试剂的反应现象,引导学生分析得出二氧化硫的性质:酸性(使紫色石蕊变红)、漂白性(使品红
溶液褪色,但不能使PH试纸和变红的石蕊溶液褪色,区别过氧化钠的漂白性)、还原性(使高锰酸钾溶液紫红色消失)氧化性(和硫化钠溶液反应生成黄色的硫单质)。 五、实验教学目标 1、知识目标:了解二氧化硫的性质和用途,掌握二氧化硫的性质。 2、能力目标:让学生学会通过对实验的探究分析得出物质的性质。从而培养学生的观察能力,分析解决问题的能力,提升学科素养。 3、核心目标:通过实验的改进,激发学生对实验的探索和创新精神,让学生全面发展。 [实验教学内容]:以二氧化硫的实验演示为主,引导学生观察现象,从而分析原因得出二氧化硫复杂的化学性质。 [实验教学过程]: 1、介绍二氧化硫的影响。 2、利用改进的装置进行演示实验来探究二氧化硫的性质。