
医疗器械安全风险分析报告
名称:****仪
1、目的
本报告用于判定---****仪,可能出现的危害,估计和评价风险,并控制这些风险。
2、适用范围
本报告适用于---****仪的设计开发与改进、生产控制和产品备案阶段。
3、参考资料
3.1 标准
YY/T 0316-2008 《医疗器械风险管理对医疗器械的应用》
GB9706.1-2007医用电气设备第一部分:安全通用要求
3.2 产品规范及工艺文件、质量标准等。
见相关工艺文件。
4、风险管理的对象
4.1 概况
仪器在操作中采用样本转移系统根据人体不同类型细胞其比重不同的特点,尤其是病变细胞比重大、沉降速度快,与特殊处理后的载玻片相互吸引,从而最大程度地捕获病变细胞和具诊断价值的成分,自动湿染片,最终制成背景清晰、诊断线索明确已染色的单层细胞薄片。
4.2 功能
模仿人工染色过程,在染色舱内通过染色头把染液滴落在玻片上染色舱内的样品上,并全部覆盖样品,在规定时间内让染液渗入并发生反应,随后用水冲去残留染液,再用染色头吸去玻片上的废弃液体,最后染色完成。
4.3 预期用途
用于病理分析前对人体细胞或细菌样本进行制片及染色。
4.4 适用环境
****仪正常工作环境:220V,50Hz、电源电压波动不超过额定电压的±10%;工作环境温度: 5℃~40℃;室内相对湿度:<90%;大气压力:70.0kPa~106.0kPa;环境周围无易燃易爆气体和腐蚀性气体。
5、风险管理过程的实施
5.1医疗器械预期用途
用于病理分析前对人体细胞或细菌样本进行制片及染色。
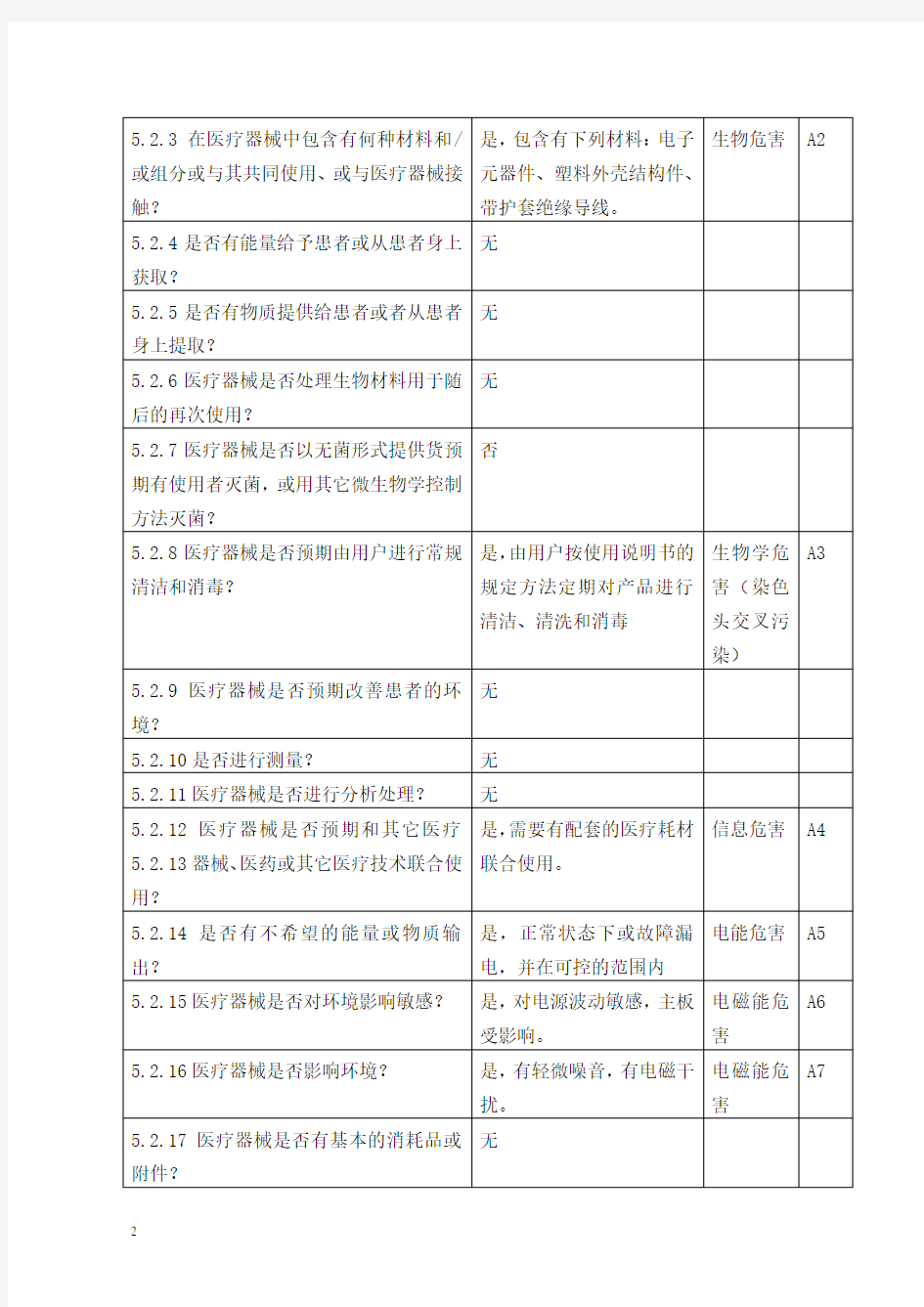
5.2与安全性有关的特征
5.3危害的判定
依据与之有关的安全性特征,正常和故障状态下已知和可预见的危害事件序列进行了分类,同时对可能发生的损害和初步控制措施进行了分析,如下表:
5.4风险评价
5.4.1评价准则
5.4.1.1 严重度分级:按可能造成伤害的严重程度分
5.4.2 发生概率分级:按事件发生的概率(次/台)
5.4.3 风险可接受准则:
5.4.4风险评价表
6、风险控制
通过以上的评价可以看出产品的风险可接受的程度,对处于可广泛接受区的风险无需再采取控制措施,对处于合理可行区的风险必须采取进一步的措施进行控制。
7、剩余风险评价
采取降低风险的措施后,危害的风险已降到广泛可接受的程度.采取降低风险的措施后,没有引入新的风险。
8、风险管理分析小组成员及职务
安全风险分析报告 产品名称:粪便保存液 产品描述 本粪便保存液 Tris-HCl、NaCL成分可以保持环境渗透压平衡和维持相对PH 稳定,EDTA可以螯合粪便中钙离子等金属离子从而抑制核酸酶活性防止 DNA 被降解。 1.医疗器械预期用途 本粪便保存液 Tris-HCl、NaCL成分可以保持环境渗透压平衡和维持相对PH 稳定,EDTA可以螯合粪便中钙离子等金属离子从而抑制核酸酶活性 防止 DNA 被降解。主要用于对人类粪便的保存和 DNA 提取样本的前处理。 2.可能的使用错误 2.1.本产品属于专用试剂不可用来做除人类粪便保存以外的用处。 2.2.使用量不宜太少,该保存液体积和粪便的质量比约为 3: 1- 5: 1 之间较为合适。 2.3. 该保存液应该和其他液体试剂分开避免交叉污染。 3.医疗器械预期用途与安全性有关的特征 表 1 医疗器械预期用途和与安全性有关特征的判断 问题内容特征判定可能的危害 本粪便保存液 Tris-HCl、NaCL 成分 可以保持环境渗透压平衡和维持相对PH C.2.1 医疗器械的预期用途是什么和怎样使用医疗稳定,EDTA可以螯合粪便中钙离子等金属 离子从而抑制核酸酶活性防止DNA 被降无 器械? 解。主要用于对人类粪便的保存和DNA 提取样本的前处理。使用方法请遵循说明 书。 C.2.2 医疗器械是否预期植入?否无C.2.3 医疗器械是否预期和患者或其他人员接触?无任何接触无C.2.4 在医疗器械中利用何种材料或组分,或与医 无无疗器械共同使用或与其接触? C.2.5 是否有能量给予患者或从患者身上获取?否无 本粪便保存液,所处理的样本为患者的粪 C.2.6 是否有物质提供给患者或从患者身上提取?便样本,不直接与患者发生直接的接触, 无因此不涉及给予患者物质或从患者身上 获取物质。 C.2.7 医疗器械是否处理生物材料用于随后的再次否无
安全风险分析报告要求 医疗器械应按照YY 0316《医疗器械风险管理对医疗器械的应用》的有关要求编制,主要包括医疗器械预期用途和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险;对每个已判定的危害处境,评价和决定是否需要降低风险;风险控制措施的实施和验证结果,必要时应引用检测和评价性报告;任何一个或多个剩余风险的可接受性评定等,形成风险管理报告。 体外诊断试剂应对产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知和可预见的危害等方面的判定及对患者风险的估计进行风险分析、风险评价及相应的风险控制的基础上,形成风险管理报告。 医疗器械产品安全风险分析报告格式见附件一。 体外诊断试剂产品安全风险分析报告格式见附件二。
附件一 安全风险分析报告(医疗器械) 产品名称(宋体四号,加粗) 1.医疗器械预期用途(宋体小四号,加粗) ……(宋体小四号) 2. 与安全性有关的特征(宋体小四号,加粗) ……(宋体小四号) 3. 危害的判定(宋体小四号,加粗) ……(宋体小四号) 4.估计每个危害处境的风险(宋体小四号,加粗) ……(宋体小四号) 5.对每个已判定的危害处境,评价和决定是否需要降低风险(宋体小四号,加粗) ……(宋体小四号) 6. 风险控制措施的实施和验证结果,必要时应引用检测和评价性报告(宋体小四号,加粗) ……(宋体小四号) 7. 任何一个或多个剩余风险的可接受性评定(宋体小四号,加粗) ……(宋体小四号) 8.其他(宋体小四号,加粗)(如适用) ……(宋体小四号) 本公司承诺:按如下要求编写了(产品名称)的安全风险分析报告。 1、国家食品药品监督管理总局《关于第一类医疗器械备案有关事项的公告》(2014年第26号公告)中,关于“安全风险分析报告”的相关要求。 2、YY 0316《医疗器械风险管理对医疗器械的应用》的相关要求。(宋体小四号,加粗)
XX股份有限公司 安全生产风险分析报告 20XX年XX月
目录 第一章总则 (1) 1.1 编制目的 (1) 1.2 编制原则 (1) 1.2 编制依据 (1) 1.2.1法律、法规 (1) 1.2.2部门规章、地方法规 (1) 1.2.3规范、标准 (2) 1.3 适用范围 (3) 1.4 评估程序 (3) 1.5 风险评估报告的修订 (3) 第二章企业信息和事故风险分析 (4) 2.1 基本信息 (4) 2.1.1地理位置 (4) 2.2 生产工艺 (4) 2.3主要设备设施及未使用危化品情况说明 (8) 2.3.1主要生产设备设施 (8) 2.3.2使用危化品情况说明 (9) 2.4总平面布置及主要建、构物情况 (11) 2.4.1总平面布置 (11) 2.4.2主要建、构物情况 (12) 2.5风险分析 (12) 2.5.1主要风险分析 (12) 2.5.2重大危险源辨识情况 (10) 2.6风险及应急处置措施 (14) 附XX股份有限公司安全风险分级管控表 (15)
第一章总则 1.1 编制目的 通过系统性的分析和评估,识别场区安全生产事故风险物质,事故风险装置,确定场区事故风险源,评估其可能导致的事故及影响后果,评估场区现有防控能力和水平,并提出切实可行的降低事故风险的措施和工作思路。 1.2 编制原则 (1)事故风险评估编制应体现科学性、规范性、客观性和真实性的原则。(2)事故风险评估过程中应贯彻执行我国安全生产相关的法律法规、标准、政策,分析场区自身事故风险状况,明确事故风险防控措施。 (3)认真排查场区的事故风险,确保全面辨识,科学分析,查找重点风险; (4)事故风险评估报告是应急预案编制重要部分。 1.2 编制依据 1.2.1法律、法规 《中华人民共和国安全生产法》国家主席令笫13号 《中华人民共和国突发事件应对法》国家主席令第69号 《中华人民共和国职业病防治法》国家主席令第52号(2017年第三次修正) 《中华人民共和国环境保护法》国家主席令第22号(2014年修订)《中华人民共和国消防法》国家主席令第6号 《中华人民共和国特种设备安全法》国家主席令第4号 《生产安全事故报告和调查处理条例》国务院令第493号 1.2.2部门规章、地方法规 《突发事件应急预案管理办法》国办发〔2013〕101号
产品风险分析报告 XXXXX医疗器械有限公司 XXXX年XX月
一、产品预期用途/预期目的和与安全性有关的特征的判定 按照《YY/T0316-2003 医疗器械风险管理对医疗器械的应用》第4.2条的要求及附录A中有关医疗器械定性和定量特征的判定的提示清单,列出“XXXXXX”产品的所有可能影响其安全性的定性和定量特征的问题,并判定如下: 1.1.1 什么是预期用途/预期目的和怎样使用医疗器械? ——预期用途: ——怎样使用:。 1.1.2 医疗器械是否预期和患者或其他人员接触? ——。 1.1.3 在医疗器械中包含有何种材料和/或组分或与其共同使用、或与医疗器械接触? —— 1.1.4 是否有能量给予患者或从患者身上获取? ——。 1.1.5 是否有物质提供给患者或从患者身上提取? ——。 1.1.6 是否由医疗器械处理生物材料然后再次使用? ——。 1.1.7 医疗器械是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌?—否。 1.1.8 医疗器械是否预期由用户进行常规清洁和消毒? ——是。由用户按使用说明书的规定方法定期对产品进行清洁、清洗和消毒。 1.1.9 医疗器械是否预期改善患者的环境?——否。 1.1.10 医疗器械是否进行测量?——否。 1.1.11 医疗器械是否进行分析处理?——否。 1.1.12 医疗器械是否预期和医药或其它医疗技术联合使用?——否。 1.1.13 是否有不希望的能量或物质输出?——无。 1.1.14 医疗器械是否对环境影响敏感?——否。 1.1.15 医疗器械是否影响环境?——否。 1.1.16 医疗器械是否有基本消耗品或附件?——无。 1.1.17 是否需要维护和校准?
无线心电和体温监测仪产品风险分析报告 中科康馨电子技术(北京)有限公司 2011 年11 月
、产品预期用途/预期目的和与安全性有关的特征的判定 按照《YY/T0316-2003 医疗器械风险管理对医疗器械的应用》第4.2 条的要求及附录A 中有关医疗器械定性和定量特征的判定的提示清单,列出“无线心电和体温监测仪” 产品的所有可能影响其安全性的 定性和定量特征的问题,并判定如下: A.2.1 什么是预期用途/ 预期目的和怎样使用医疗器械?——预期用途:主要用于人体心脏和体温的监测。 ——怎样使用:由患者按照产品使用说明书在日常环境下自行使用。皮肤感觉差或行动不便的,使用时必须有医护人员或正常人员监护。 A.2.2 医疗器械是否预期和患者或其他人员接触?——是。监测时心电导联线和体温探头与受监护者皮肤接触,建议洗澡后 使用。 A.2.3 在医疗器械中包含有何种材料和/ 或组分或与其共同使用、或与医疗器械接触?——包含有下列材料:电子元器件、铁芯、漆包电磁线、铁氧体永磁块、带护套绝缘导线、工程塑料外壳结构件。 A.2.4 是否有能量给予患者或从患者身上获取?——有。由产品的应用部分即理疗带将人造恒磁场、交变磁场、热量和机械震动所产生的强度及时间可控的能量传递给予患者病患部位。 A.2.5 是否有物质提供给患者或从患者身上提取?——无。 A.2.6 是否由医疗器械处理生物材料然后再次使用?——否。 A.2.7 医疗器械是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌?—否。A.2.8 医疗器械是否预期由用户进行常规清洁和消毒? ——是。由用户按使用说明书的规定方法定期对产品进行清洁、清洗和消毒。 A.2.9 医疗器械是否预期改善患者的环境?——否。 A.2.10 医疗器械是否进行测量?——否。 A.2.11 医疗器械是否进行分析处理?——否。 A.2.12 医疗器械是否预期和医药或其它医疗技术联合使用?——否。 A.2.13 是否有不希望的能量或物质输出?——无。 A.2.14 医疗器械是否对环境影响敏感?——否。 A.2.15 医疗器械是否影响环境?——否。 A.2.16 医疗器械是否有基本消耗品或附件?——无。 A.2.17 是否需要维护和校准? ——需要维护。用户在使用中应经常检查电源线、理疗带电缆、插头及其他连接部分的磨损、 接触不良或其他损坏情况。如检查发现上述情况,应及时与制造厂商联系维修。 A.2.18 医疗器械是否有软件?——无。
文件编号:SF/WI-XX-XX 版本:A/0 安全风险分析报告 产品名称:(生理性海水鼻腔喷雾器) 编写: 日期: 年月日 批准: 日期: 年月日 XX医疗科技有限公司发布
更改履历
目录 第1章编制依据 (4) 1.1 相关标准 (4) 1.2 产品的有关资料 (4) 第2章目的和适用范围 (4) 第3章产品描述 (4) 第4章产品的预期用途以及与安全有关的特征的判定 (5) 第5章风险接受性准则 (6) 5.1 风险的严重度分级 (7) 5.2 风险的概率分级 (7) 5.3 风险的可接受性准则 (7) 第6章风险评价、风险控制和初始风险控制措施验证 (7) 第7章控制 (9) 第8章剩余风险评价 (9) 第9章上市后生产信息评审 (11) 第10章结论 (11)
1.编制依据 1.1相关标准 1. YY/T 0316:2008 《医疗器械——风险管理对医疗器械的应用》 2. YY/T 0287:2003 IDT ISO 13485:2003《医疗器械质量管理体系用于法规的要求》 3. GB/T14233.1-2008 《医用输液、输血、注射器具检验方法第1部分:化学分析方法》 4. GB/T14233.2-2005 《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》 5. GB/T1688 6.10-2005《医疗器械生物学评价第10部分:刺激与致敏试验》 6. GB/T16886.5-2003 《医疗器械生物学评价第5部分:细胞毒性试验,体外法》 7. GB/T16886-2001 《医疗器械生物学评价》 8. YY/T 0466.1-2009 《医疗器械用于医疗器械标签、标记和提供信息的符号》 1.2产品的有关资料 1)使用说明书 2.目的和适用范围 本文是对生理性海水鼻腔喷雾器进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低风险的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于生理性海水鼻腔喷雾器成品产品,该产品处于成熟生产阶段。 3.产品描述 本风险管理的对象是生理性海水鼻腔喷雾器。
安全风险分析报告 产品名称:(YH定制式义齿) 风险评价人员及背景:(项目组长、医学角度的大夫、技术角度的设计人员、应用角度的、市场角度的,并提供人员资格证明,如受过的培训资格、职称等级) 编制:日期: 批准:日期:
1.编制依据 1.1相关标准 1)GB/T6387——1986 齿科材料名词术语 2)YY0466——2003 医疗器械用于医疗器械标签、标记和提供信息的符号 3)YY牙科学合成树脂牙陶瓷牙 1.2产品的有关资料 1)使用说明书 2)医院使用情况、维修记录、顾客投诉、意外事故记录等以 3)专业文献中的文章和其他信息 2.目的和适用范围 本文是对义齿进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于YH定制产品,该产品处于设计和开发阶段(或处于小批生产阶段)。3.产品描述 本风险管理的对象是义齿,产品概述、机理、用途 适应症:适用于牙体缺损和牙列缺损、缺失适宜修复的患者 禁忌症: 设备由以下部分组成:(文字描述或示意图) 4.产品预期用途以及与安全有关的特征的判定 (依序回答附录A用于判定医疗器械可能影响安全性的特征的问题) 4.1产品的预期用途、预期目的是什么?如何使用? 应考虑的因素:预期使用者及其精神、体能、技能水平、文化背景和培训等情况 人机工程学问题、医疗器械的使用环境和由谁安装 患者是否能够控制和影响医疗器械的使用 医疗器械是否用于生命维持或生命支持 在医疗器械失效的情况下是否需要特殊的干预 是否有接口设计方面的特殊问题可以导致不经心的使用错误(见4.27) 设备起诊断、预防、治疗、缓解或创伤补偿、解剖矫正、妊娠控制的哪个作用 4.2医疗器械是否预期和患者或其他人员接触、如何接触、接触时间长短? 应考虑的因素:预期接触的性质:表面接触、有创接触和(或)植入 每种接触的时间长短
**产品 安全风险分析报告 **公司 编制:日期:审核:日期:批准:日期:
目录 1. 编制依据 (2) 1.1. 相关标准 (2) 1.2. 产品的有关资料 (2) 2. 目的和适用范围 (3) 3. 产品描述 (3) 4. 产品风险识别 (3) 4.1. 产品预期用途 (3) 4.2. 产品风险分析 (3) 4.3. 产品风险清单 (9) 5. 风险评价和风险控制 (15) 5.1. 风险评价准则 (15) 5.2. 风险水平综合表 (15) 5.3. 风险控制表 (16) 5.4. 剩余风险评价 (19) a) 产生的其他危害 (19) b) 风险评价的完整性 (19) c) 全部剩余风险的评价 (19) 6. 结论 (19)
产品名称 **产品风险分析主要人员及职责
1.编制依据 1.1.相关标准 涵盖该产品到目标市场上市需遵循的所有国内或国际标准。 1) YY/T 0316-2008 医疗器械风险管理对医疗器械的应用 2) ********* 1.2.产品的有关资料 1)使用说明书 2)技术文档 2.目的和适用范围 此风险分析是针对**公司的**产品进行的,目的在于识别和控制该产品在设计研发阶段可遇见的风险。报告列出了该款产品所有已识别的危害和每个危害产生的原因,并对每种危害可能产生损害的严重度和危害的发生概率进行了估计,报告还列出了在研发过程中对各个风险采取的控制措施和验证方法,并对采取降低风险措施后的剩余风险重新进行了评价。 本报告适用于**公司的**产品。 3.产品描述 **公司的**产品*******等组成。
4.产品风险识别 4.1.产品预期用途 该产品适用于***症 **产品的预期操作者为有临床经验的医生,而且在操作仪器前,需经过培训。需由**公司指定的客服人员完成。 **产品的使用环境**科等。 4.2.产品风险分析 根据产品的预期用途,对ISO14971附录C问题进行回答;并根据问题结果,按照附录E列出初始已认知的和可预见的危害清单,并给出设计和开发中所采用的对策。 附录C:
*****产品 风险分析报告 **公司 编制:日期:审核:日期:批准:日期:
目录 1. 编制依据 (2) 1.1. 相关标准 (2) 1.2. 产品的有关资料 (2) 2. 目的和适用范围 (3) 3. 产品描述 (3) 4. 产品风险识别 (3) 4.1. 产品预期用途 (3) 4.2. 产品风险分析 (3) 4.3. 产品风险清单 (9) 5. 风险评价和风险控制 (15) 5.1. 风险评价准则 (15) 5.2. 风险水平综合表 (15) 5.3. 风险控制表 (16) 5.4. 剩余风险评价 (19) a) 产生的其他危害 (19) b) 风险评价的完整性 (19) c) 全部剩余风险的评价 (19) 6. 结论 (19)
产品名称 **产品风险分析主要人员及职责
1.编制依据 1.1.相关标准 涵盖该产品到目标市场上市需遵循的所有国内或国际标准。 1) YY/T 0316-2008 医疗器械风险管理对医疗器械的应用 2) ********* 1.2.产品的有关资料 1)使用说明书 2)技术文档 2.目的和适用范围 此风险分析是针对**公司的**产品进行的,目的在于识别和控制该产品在设计研发阶段可遇见的风险。报告列出了该款产品所有已识别的危害和每个危害产生的原因,并对每种危害可能产生损害的严重度和危害的发生概率进行了估计,报告还列出了在研发过程中对各个风险采取的控制措施和验证方法,并对采取降低风险措施后的剩余风险重新进行了评价。 本报告适用于**公司的**产品。 3.产品描述 **公司的**产品*******等组成。
4.产品风险识别 4.1.产品预期用途 该产品适用于***症 **产品的预期操作者为有临床经验的医生,而且在操作仪器前,需经过培训。需由**公司指定的客服人员完成。 **产品的使用环境**科等。 4.2.产品风险分析 根据产品的预期用途,对ISO14971附录C问题进行回答;并根据问题结果,按照附录E列出初始已认知的和可预见的危害清单,并给出设计和开发中所采用的对策。 附录C:
安全风险分析报告 产品名称:(注册标准上的名称) 风险评价人员及背景:(项目组长、医学角度的大夫、技术角度的设计人员、应用角度的、市场角度的,并提供人员资格证明,如受过的培训资格、职称等级) 编制:日期: 批准:日期:
1.编制依据 1.1相关标准 1)YY0316-2003医疗器械——风险管理对医疗器械的应用 2)GB9706.1-1995医用电气设备第一部分:通用安全要求; 3)IEC60601-1-4:1996医用电器设备——第一部分:通用安全要求——4:并行标准:医 用可编程电气系统 4)产品标准及其他 1.2产品的有关资料 1)使用说明书 2)医院使用情况、维修记录、顾客投诉、意外事故记录等 3)专业文献中的文章和其他信息 2.目的和适用范围 本文是对XXXX进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于……产品,该产品处于设计和开发阶段(或处于小批生产阶段)。 3.产品描述 本风险管理的对象是……(如能加入照片或图片最好),产品概述、机理、用途 适应症: 禁忌症: 设备由以下部分组成:(文字描述或示意图) 4.产品预期用途以及与安全有关的特征的判定 (依序回答附录A用于判定医疗器械可能影响安全性的特征的问题) 4.1产品的预期用途、预期目的是什么?如何使用? 应考虑的因素:预期使用者及其精神、体能、技能水平、文化背景和培训等情况 人机工程学问题、医疗器械的使用环境和由谁安装 患者是否能够控制和影响医疗器械的使用 医疗器械是否用于生命维持或生命支持 在医疗器械失效的情况下是否需要特殊的干预 是否有接口设计方面的特殊问题可以导致不经心的使用错误(见4.27) 设备起诊断、预防、治疗、缓解或创伤补偿、解剖矫正、妊娠控制的哪个作用 4.2医疗器械是否预期和患者或其他人员接触、如何接触、接触时间长短?
医疗器械安全风险分析报告 名称:****仪 1、目的 本报告用于判定---****仪,可能出现的危害,估计和评价风险,并控制这些风险。 2、适用围 本报告适用于---****仪的设计开发与改进、生产控制和产品备案阶段。 3、参考资料 3.1 标准 YY/T 0316-2008 《医疗器械风险管理对医疗器械的应用》 GB9706.1-2007医用电气设备第一部分:安全通用要求 3.2 产品规及工艺文件、质量标准等。 见相关工艺文件。 4、风险管理的对象 4.1 概况 仪器在操作中采用样本转移系统根据人体不同类型细胞其比重不同的特点,尤其是病变细胞比重大、沉降速度快,与特殊处理后的载玻片相互吸引,从而最大程度地捕获病变细胞和具诊断价值的成分,自动湿染片,最终制成背景清晰、诊断线索明确已染色的单层细胞薄片。 4.2 功能 模仿人工染色过程,在染色舱通过染色头把染液滴落在玻片上染色舱的样品上,并全部覆盖样品,在规定时间让染液渗入并发生反应,随后用水冲去残留染液,再用染色头吸去玻片上的废弃液体,最后染色完成。 4.3 预期用途 用于病理分析前对人体细胞或细菌样本进行制片及染色。 4.4 适用环境 ****仪正常工作环境:220V,50Hz、电源电压波动不超过额定电压的±10%;工作环境温度: 5℃~40℃;室相对湿度:<90%;大气压力:70.0kPa~106.0kPa;环境周围无易燃易爆气体和腐蚀性气体。 5、风险管理过程的实施 5.1医疗器械预期用途 用于病理分析前对人体细胞或细菌样本进行制片及染色。 5.2与安全性有关的特征
5.3危害的判定 依据与之有关的安全性特征,正常和故障状态下已知和可预见的危害事件序列进行了分类,同时对可能发生的损害和初步控制措施进行了分析,如下表:
安全生产状况分析报告 根据XXX对在建项目安全日常检查和专项检查情况,现将在建公路水运项目安全生产状况分析如下: 一、全县在建重点公路水运项目生产安全总体情况(一)生产安全事故总体情况 xx年,全县在建公路水运项目共9个,其中,县道项目1个,乡道项目3个,渡口改桥梁项目4个,新建桥梁1个。 全年,全县在建公路水运项目未发生生产安全事故(零事故)。(二)检查发现隐患总体情况 xx年局质监办根据安全日常检查和专项检查情况,共检查14次,涉及9个项目,检查共发现安全隐患22处。按照隐患类别统计,安全基础管理类隐患10处,占48%,施工现场安全管理类隐患12处,占52%。 二、安全隐患统计分析 (一)按隐患类型分析 1.安全基础管理方面。安全生产费用管理、安全生产管理制度、安全生产条件、安管人员持证、安全体系建立、风险评估、应急管理、隐患排查记录等是安全基础管理方面数量最多、存在项目最广的安全隐患。这类隐患共10处,主要集中在新开工项目安全生产条件的检查工作开展不到位、记录不全等方面。
表1 xx年安全基础管理方面不同隐患类型统计分析表 2.施工现场安全管理方面。安全防护类、警示标志类、高处作业类是施工现场安全管理方面数量最多、涉及项目最广的安全隐患。这类隐患共11处,分别在近半数的项目上都有所体现。这反映出大部分项目在临边防护,警示提醒、高空作业安全防护及人员上下通道等方面安全管理不到位。 表2 xx年施工现场安全管理方面不同隐患类型统计分析表 三、突出安全隐患分析 (一)安全基础管理方面 1.安全生产费用使用管理不到位。主要表现为: (1)施工单位未按要求编制本项目的安全生产费用计划,未按要求建立安全生产费用使用台账; (2)现场的安全防护用具偏少,安全生产经费投入不足。 2.安全生产管理制度执行不到位。主要表现为: 安全保证体系责任未落实到人,安全检查记录、台账不完善;汛期安全生产工作开展不到位,汛期安全专项方案粗糙,汛期隐患排查资料不全等。
产品风险分析报告 广州市枫阳医疗器械有限公司 2014年6月
一、产品预期用途/预期目的和与安全性有关的特征的判定 按照《YY/T0316-2003 医疗器械风险管理对医疗器械的应用》第4.2条的要求及附录A中有关医疗器械定性和定量特征的判定的提示清单,列出“一次性冲吸式无菌吸痰组合管”产品的所有可能影响其安全性的定性和定量特征的问题,并判定如下: A.2.1 什么是预期用途/预期目的和怎样使用医疗器械? ——预期用途:该产品适用于医疗单位对临床病人口腔内痰液清理吸取和口腔清洁护理一次性用。 ——怎样使用:由患者按照产品使用说明书在正常室内环境下由医护人员对患者使用。口腔过敏或行动不便的,医护人员使用时应进行相关培训。 A.2.2 医疗器械是否预期和患者或其他人员接触? ——是。治疗时理疗带与患者的病患区口腔粘膜接触。 A.2.3 在医疗器械中包含有何种材料和/或组分或与其共同使用、或与医疗器械接触? ——包含有下列材料:硅橡胶和PP材料以及ABS材料 A.2.4 是否有能量给予患者或从患者身上获取? ——无。 A.2.5 是否有物质提供给患者或从患者身上提取?——无。 A.2.6 是否由医疗器械处理生物材料然后再次使用?——否。 A.2.7 医疗器械是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌?—否。 A.2.8 医疗器械是否预期由用户进行常规清洁和消毒? ——是。由用户按使用说明书的规定方法定期对产品进行清洁、清洗和消毒。 A.2.9 医疗器械是否预期改善患者的环境?——否。 A.2.10 医疗器械是否进行测量?——否。 A.2.11 医疗器械是否进行分析处理?——否。 A.2.12 医疗器械是否预期和医药或其它医疗技术联合使用?——否。 A.2.13 是否有不希望的能量或物质输出?——无。 A.2.14 医疗器械是否对环境影响敏感?——否。 A.2.15 医疗器械是否影响环境?——否。 A.2.16 医疗器械是否有基本消耗品或附件?——无。 A.2.17 是否需要维护和校准?
产品安全风险分析报告 产品:一次性医用无纺布制品和一次性使用手术包腹部手术包、人流包、产包、介入手术包、胸部手术包、肢体手术包、头部手术包、脊柱手术包。 一、影响安全性,产生安全风险的因素及可能导致的后果 1、原材料和外购件 本公司生产的产品原材料及外购件主要有:非织造布、医用脱脂纱布、医用脱脂棉、医用手套、脐带圈等。如材料采购不符合要求,将影响到加工后的产品质量不合格,可能导致产品使用中出现渗液、易破、不吸水等现象,起不到防护的作用。 2、工人生产质量 生产过程中,由于加工者人为的因素可能造成跳针、漏缝等现象,可能导致产品使用中出现不结实、易发线等影响防护效果。 3、外包装 外包装过薄可能出现易破损、难密封的现象,导致成品在灭菌后进入空气受到污染。被污染后的产品将不再是无菌产品,可能导致患者感染。 4、重复使用使用 使用者在使用过产品后,再次使用将导致细菌、病毒的传播造成严重后果。 5、灭菌后产品微生物指标 产品在包装密封后经灭菌后,如微生物指标不能达到要求,可能导致患者感染及疾病的传播。 二、降低安全风险的措施
针对以上造成安全风险的因素,我公司采取了以下降低风险的措施,并严格执行。 1、原材料和外购件 对于公司所采购的原材料及外购件,其取得材料的供方是具备生产资格及条件且经公司考察、评审合格的企业。每到一批材料公司都会经几道检验程序验收,确保使用的原材料都是合格品,保证产品质量,降低风险。 2、工人生产质量 公司制定了严格的生产检验程序,生产的整个过程都有质检员严格监控,并保证一件产品有多道检验过程,最大限度降低不合格品的产生。 3、外包装 本公司产品的外包装是采用的达到包装三类医疗器械一次性输液器、注射器要求的高压膜包装袋,无论是厚度、韧度、强度等都有保障。并在包装上标有“包装破损严禁使用”的警示语,以确保产品的安全使用。 4、重复使用 在所有的包装上都标有“一次性使用”的警示符号和文字,并要求用户使用后进行销毁,以避免重复使用。 5、灭菌后产品微生物指标 产品委托具有国家资质的Co60辐照中心进行专业严格的辐照消毒灭菌,在外包装上贴有是否灭菌标示,并进行灭菌前后的菌检,以保证灭菌后的产品符合要求。 从上述报告中可看出本公司产品在生产、使用过程中存在不利影响,但因事前加强的防范措施,通过严格的检验、生产、灭菌及包装警示将最大限度的避免这些风险的出现。因此从整体上分析,本公司产品是安全可靠的,可以放
安全风险分析报告范文篇一: 产品名称:(注册标准上的名称) 风险评价人员及背景:(项目组长、医学角度的大夫、技术角度的设计人员、应用角度的、市场角度的,并提供人员资格证明,如受过的培训资格、职称等级) 编制:日期: 批准:日期: 1. 编制依据 1.1 相关标准 1) YY0316-2003医疗器械——风险管理对医疗器械的应用 2) GB9706.1-1995医用电气设备第一部分:通用安全要求; 3) IEC60601-1-4:1996医用电器设备——第一部分:通用安全要求——4:并行标准:医用可编程电气系统 4) 产品标准及其他 1.2 产品的有关资料 1) 使用说明书 2) 医院使用情况、维修记录、顾客投诉、意外事故记录等 3) 专业文献中的文章和其他信息 2. 目的和适用范围 本文是对XXXX进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于……产品,该产品处于设计和开发阶段(或处于小批生产阶段)。 3. 产品描述 本风险管理的对象是……(如能加入照片或图片最好),产品概述、机理、用途适应症: 禁忌症: 设备由以下部分组成:(文字描述或示意图)
4. 产品预期用途以及与安全有关的特征的判定 (依序回答附录A用于判定医疗器械可能影响安全性的特征的问题) 4.1 产品的预期用途、预期目的是什么?如何使用? 应考虑的因素:预期使用者及其精神、体能、技能水平、文化背景和培训等情况 人机工程学问题、医疗器械的使用环境和由谁安装 患者是否能够控制和影响医疗器械的使用 医疗器械是否用于生命维持或生命支持 在医疗器械失效的情况下是否需要特殊的干预 是否有接口设计方面的特殊问题可以导致不经心的使用错误(见4.27) 设备起诊断、预防、治疗、缓解或创伤补偿、解剖矫正、妊娠控制的 哪个作用 4.2 医疗器械是否预期和患者或其他人员接触、如何接触、接触时间长短? 应考虑的因素:预期接触的性质:表面接触、有创接触和(或)植入 每种接触的时间长短 每种接触的频次 4.3 在医疗器械中包含有何种材料和(或)组分或与其共同使用、或与医疗器械接触? 应考虑的因素:与安全性有关的特性是否已知 4.4 是否有能量给予患者或从患者身上获取? 应考虑的因素:传递能量的形式及其控制、质量、数量和持续时间 4.5 是否有物质提供给患者或从患者身上提取? 应考虑的因素:物质是供给还是提取 单一物质还是几种物质 最大和最小传递率及其控制 4.6 是否由医疗器械处理生物材料然后再次使用? 应考虑的因素:处理的方式和被处理物质的类型(如自动输血、透析) 4.7 医疗器械是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌? 应考虑的因素:医疗器械是否预期一次使用或重复使用
医疗器械安全风险分析 报告 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
安全风险分析报告 产品名称:(注册标准上的名称) 风险评价人员及背景:(项目组长、医学角度的大夫、技术角度的设计人员、应用角度的、市场角度的,并提供人员资格证明,如受过的培训资格、职称等级) 编制:日期: 批准:日期:
1.编制依据 1.1相关标准 1)YY0316-2003医疗器械——风险管理对医疗器械的应用 2)GB9706.1-1995医用电气设备第一部分:通用安全要求; 3)IEC60601-1-4:1996医用电器设备——第一部分:通用安全要求—— 4:并行标准:医用可编程电气系统 4)产品标准及其他 1.2产品的有关资料 1)使用说明书 2)医院使用情况、维修记录、顾客投诉、意外事故记录等 3)专业文献中的文章和其他信息 2.目的和适用范围 本文是对XXXX进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于……产品,该产品处于设计和开发阶段(或处于小批生产阶段)。 3.产品描述 本风险管理的对象是……(如能加入照片或图片最好),产品概述、机理、用途 适应症: 禁忌症: 设备由以下部分组成:(文字描述或示意图) 4.产品预期用途以及与安全有关的特征的判定 (依序回答附录A用于判定医疗器械可能影响安全性的特征的问题) 4.1产品的预期用途、预期目的是什么?如何使用? 应考虑的因素:预期使用者及其精神、体能、技能水平、文化背景和培训等情况 人机工程学问题、医疗器械的使用环境和由谁安装 患者是否能够控制和影响医疗器械的使用 医疗器械是否用于生命维持或生命支持 在医疗器械失效的情况下是否需要特殊的干预
安全风险评估报告范文篇一: 叙利亚修井项目安全风险评估报告 1 项目基本情况 1.1项目甲乙方、相关方情况 项目甲方中石化国际勘探开发公司叙利亚公司。 项目乙方为河南油田分公司井下作业处。 1.2项目来源及主要施工区域 该项目是中石化国际勘探开发公司承包的叙利亚Oudeh和Tishrine油田,两油田相距约120km ,Oudeh油田位于叙北部农业区,地势平坦,自然环境较好,距土耳其边境2km。海拔350-400m,夏季较热,冬季最低可到-5℃。工区道路交通情况良好,国家高速公路从油田穿过,Tishrine油田位于伊拉克沙漠延伸的过渡带上,距伊拉克边界30km,地势稍有起伏,植被很少,工区道路交通情况良好。 1.3施工队伍基本情况 中方人员24人,其中项目组4人,现场中方雇员20人,当地雇员46人,分白班和夜班,2个小修作业队。 需投入设备主要有60吨修井机二台,120吨修井机一台,500泥浆泵二台,发电机五台,吊车一台,叉车一台,自吊车一台,资产原值约3100万元。 2 项目总体安全形势分析 2.1 项目所在国安全风险分析 2.1.1阿拉伯叙利亚面积18.5万平方公里(含戈兰高地)。位于亚洲大陆西部,地中海东岸。北与土耳其接壤,东同伊拉克交界,南与约旦毗连,西南与黎巴嫩和巴勒斯坦为邻,西与塞浦路斯隔地中海相望,人口1839.2万,阿拉伯人占80%以上,其他还有库尔德人、亚美尼亚人、土库曼人和彻尔克斯人等。阿拉伯语为国语,通用英语和法语。 2.1.2叙利亚地处中东热点地区,紧邻伊拉克、黎巴嫩和巴勒斯坦,并与以色列长期处于敌对状态,安全形势较为严峻,但叙政府掌控治安能力较强,社会治安状况较好。 2.1.3叙利亚存在的主要风险:
医疗器械风险管理报告 XXXXX(器械名称) 批准: 批准日期: Xxxxx医疗器械
目录 第一章综述-------------------------------------------------------------- -----------1 第二章风险管理评审输入-------------------------------------------------------2 第三章风险管理评审-------------------------------------------------------------3 第四章风险管理评审结论-------------------------------------------------------4 第五章附录1------------------------------------------------------------- ----------5 附录2-------------------------------------------------------------------------6 附录3-------------------------------------------------------------------------7 附录4-------------------------------------------------------------------------8
第一章综述 1.产品简介 XXXXX什么样的产品。组成、作用。 2.风险管理计划及实施情况简述 XXXXX是XXXXX与有关技术专家合作项目,于xxx年开始策划立项,立项同时,我们就针对该产品进行了风险管理活动的计划。 该风险管理计划确定了XXXXX的风险可接受准则,对产品设计开发阶段﹙包括试生产阶段﹚的风险管理活动以及生产后信息的获得方法的评审要求进行了安排。 3.此次风险管理评审目的 本次风险管理的目的是为了对XXXXX调整仪在贯彻国标GB/T 9706.1-2007及国标GB 7247.1-2001标准,对产品安全性部分按国标的要求进行了修订后的所进行的风险管理,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受评价,证实对产品的风险进行了管理,并且控制在可接受围。 4.风险管理评审小组成员及职责
安全风险分析报告(依据YY0316-2003医疗器械——风险管理对医疗器械的应用) 单位名称:******医疗器械有限公司 产品名称:医用纱棉块 申报日期:2008年6月9日
风险分析报告
1.编制依据 相关标准 1)YY0316-2003医疗器械——风险管理对医疗器械的应用 2)产品标准及其他 产品的有关资料 1)使用说明书 2.目的和适用范围 本文是对医用纱棉块产品进行风险管理的报告,报告中对所有的可能危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。在某一风险水平不可接受时,采取了降低见的控制措施,同时,对采取风险措施后的剩余风险进行了评价。最后,使所有的剩余风险的水平达到可以接受。 本报告适用于医用纱棉块产品。 3.产品描述 本风险管理的对象是医用纱棉块。 产品概述、机理、用途: 我公司所生产的医用纱棉块是采用YZB/赣-2007《医用纱棉块》注册标准进行生产,原材料采用医用脱脂棉和脱脂棉纱布,产品的规格为:详见附页。 主要供医疗机构使用。
4.产品预期用途以及与安全有关的特征的判定 产品的预期用途: 主要供医疗机构使用。 产品是否预期和患者或其他人员接触 表面接触、有创接触 产品中包含有何种材料和(或)组分 医用脱脂棉和脱脂棉纱布 是否有能量给予患者或从患者身上获取 否 是否有物质提供给患者或从患者身上提取 否 是否由医疗器械处理生物材料然后再次使用 否 是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌有以无菌形式提供和由使用者使用前高温灭菌 是否预期由用户进行常规清洁和消毒? 是 是否预期改善患者的环境? 否 是否进行测量? 否 是否进行分析处理? 否 医疗器械是否预期和医药或其他医疗技术联合使用? 否 是否有不希望的能量或物质输出? 否 是否对环境敏感? 否 医疗器械是否影响环境? 否 是否有基本消耗品 否 是否需要维护和校准? 否 是否有软件? 否 是否有储存寿命限制? 防火、防压、防潮 是否有延迟和(或)长期使用效应? 否 承受何种机械力?
XX公司 安全风险评估报告 单位名称: 编制单位: 编制日期:年月 目录 一、本企业基本情况 (2) 二、危险源与事故风险描述 (2) 三、风险及隐患治理、报告与应急处置措施 (6) 四、结论 (12) 安全风险评估报告 按照《中华人民共和国安全生产法》等有关法律、法规和企业的有关规定,为进一步强化本企业安全生产基础,提高安全生产管理水平,xx分公司 (以下简称公司”组织了对公司安全生产危险因素、风险因素、作业环境等进行了风险评估,以强化责任落实为重点,推动安全生产责任落实,建立健全隐患排查治理及重大危险源监控的长效机制,编制预案及现场处置方案,强化安全生产基础,提高安全生产管理水平,有效防范,以此减少或杜绝各类安全生产事故的发生。 一、本企业基本情况 xx分公司,位于XXXX,东临XXXX,西临XXXX,其中北侧办公楼x层,占地面积xxx平方米,建筑面积xxxx平方米,消防出口3处(东、南、北);南侧移动大楼XX层,占地面积XXXX平方来,建筑面积XXXX平方米,消防出口4 处;员工人数XXX人。生产楼一处位于XXXX号,共用XX机楼二处:、xxxx物资仓库。 二、危险源与事故风险描述 公司各单位应对危险性大、易发事故、事故危害大的生产经营系统、部位、装置设备进行危险源辨识和风险评价。根据发生生产安全事故的可能性及一旦发生生产安全事故可能造成的危害
后果来确定危险目标、等级及影响范围。在进行危险源辨识时,要全面、有序进行,防止出现漏项。 根据公司经营特点,在对公司危险源进行调查与分析基础上,确定了公司主要危险源及关键生产装置、重点经营部位和可能发生的事故类型如下: ㈠高压配电室火灾危险性分析 高压配电室的一些装置(变压器等)都含有大量易燃、易爆液体(变压器油),在高温和电弧作用下或遭遇雷击,都可能发生燃烧、爆炸等事故,根据《企业职工伤亡事故分类标准》可能出现的事故类别为:其它爆炸、火灾、触电等; ①设计、安装时选型不正确; ②设备或导线随意装接,增加负荷,超载运行; ③检修、维护不及时,设备或导线处于带病运行; ④短路、电弧和火花短路的主要原因是载流部分绝缘破坏,如:绝缘老化,耐压与机械强度下降,过电压使绝缘击穿,错误操作或将电源投向故障线路,恶劣天气,如大风暴雨造成线路金属连接。短路点、与导线连接松动的电气接头会产生电弧或火花。 接触不良:实际上是接触电阻过大,形成局部过热,也会出现电弧、电火花,造成潜在的点火源。 烘烤:电热器具、照明灯具,长时间通电,形成高温火源,可能使附近的可燃物质受高温烘烤而起火。 摩擦:发电机或电动机等旋转性电气设备,转子与定子相碰或轴承出现润滑不良、干枯产生干磨发热,引发火灾。 ㈡雷电、静电接地危险性分析 雷电瞬间放电产生电孤、电火花使建筑物破坏,输电线路或电气设备损坏。 静电是由于不同物体之间相互摩擦、接触、分离、喷溅、静电感应、人体点位等原因,逐渐累积静电荷形成岛电位,在一定条件下,将周围空气介质击穿,对金属放电并产生足够能量的火花放电。火花放电产生的热能引燃或引爆可燃物或爆炸性混合物。