
方法验证报告方法名称:
方法来源:
分析项目:
验证实验室:
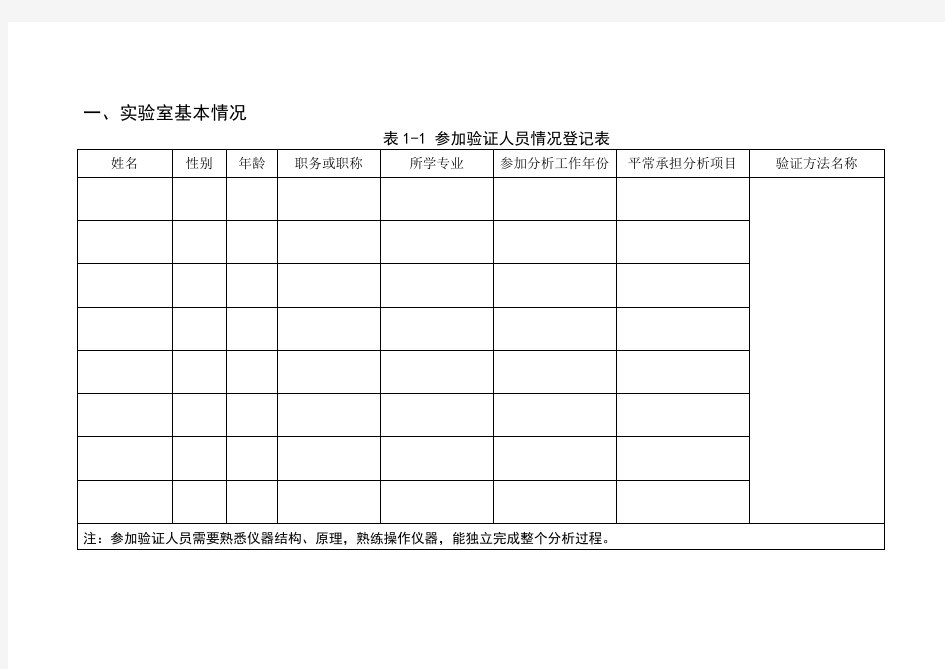
一、实验室基本情况
二、全程序空白实验
三、标准样品实验、方法线性范围
四、方法检出限、测定下限测试
五、方法精密度测试
六、方法准确度测试
七、质量控制自查情况
表7 质量控制情况
注;采样器皿准备、样品保存条件、样品保存期限、替代物回收范围、空白加标回收率范围、样品加标回收率范围、加标分析频次、实验室空白分析频次、仪器连续校准分析频次、检出限确定方法请直接填写表7中。
八、方法验证结论
(1)各测试水平的检出限、测定下限、精密度、准确度的测试结果汇总(见表8方法验证汇总表);
(2)验证过程中异常值的解释、更正或提出的情况及理由;
(3)方法各特性指标是否达到预期要求;
(4)根据实验室分析情况,评价方法,考虑是否需要对方法进行改进及理由。
九、附录
(2)标准样品测试谱图
(3)仪器生成的标准曲线报告(金属需要提供)
(4)方法验证产生的所有原始数据文件
注:该表中的所有数据文件,需要提交原始数据或仪器自动生成的报告文件,所有文件有据可查。
分发部门:
目录 一、概述 二、验证前准备 三、验证记录与结果 四、漏项与偏差处理 五、评价与建议 六、验证结论 七、附件:相关记录
一、概述 为更好实现产品过程控制,我中控实验室依据《分析方法确认与验证管理规程》(文件编码:F0004-00)与《中华人民共和国药典》2010版附录中相关规定和相应指导原则的要求,制定出一系列检验方法验证实验来考察本产品中间产品检验方法的适用性,从而确保该方法能够可靠有效地用于控制药品的内在质量。 本中间产品检验标准操作规程中所列检验项目有:含量测定,溶出度,干燥失重。其方法验证参见相应成品检验方法验证,现主要对酒石酸美托洛尔含量测定检验项目进行方法验证。 验证实施时间:自年月日开始至年月日完成。 二、验证前准备 1、培训确认 2、所用仪器设备,包括电子分析天平、检验方法中规定的仪器设备已经校验,且在有效期内。 3、试验所用的玻璃计量器具需清洁,并经检定后符合要求。 4、相关对照品、试剂试药均符合《中国药典》要求。 三、验证结果 1、含量测定方法各项验证实验结果 含量——专属性验证结果 试验人/日期复核人/日期
含量——重复性验证结果 试验人/日期复核人/日期 含量——准确度验证结果 是否符合要求: 试验人/日期复核人/日期 含量——线性验证结果 试验人/日期复核人/日期2、含量测定方法验证小结 小结人:日期:
四、漏项与偏差处理 无 五、评价与建议 小结人:日期:六、验证结论 总结人:日期:七、附件 相应验证记录与图谱。
酒石酸美托洛尔片中间产品检验方法验证记录 1 检验依据:《中国药典》2005版。 2 检验方法:取相当于本品20片的颗粒,精密称定,研细,精密称取适量(约相当于酒石酸美托洛尔0.12g),置100ml量瓶中,加2%氯化钠溶液适量,振摇使酒石酸美托洛尔溶解并稀释至刻度,摇匀,滤过,滤过,精密量取续滤液5ml,置50ml量瓶中,加水稀释至刻度,摇匀。照紫外-可见分光光度法(中国药典2005年版二部附录IV A),在274nm的波长处测定吸收度。另精密称取酒石酸美托洛尔对照品适量,加水制成每1ml中含0.12mg的溶液,同法测定,计算,即得。 3 验证记录: 3.1相关物料 3.2 仪器用具 3.3 验证步骤 3.3.1 专属性:分别取空白辅料混合物、空白溶剂,按照“2”项下所述方法配制空白溶液,在200~600nm处进行紫外扫描。 实验结果: 3.3.2 准确度:按处方比例配制3个不同浓度(80%、100%、120%)的试样,每个浓度的样品按照“2”
报告的格式范文 【公文写作】报告格式、范文 报告是向上级机关汇报工作、反映情况、提出意见或者建议,答复上级机关的询问时使用的公文。 一、报告的使用范围 报告使用范围很广。按照上级部署或工作计划,每完成一项任务,一般都要向上级写报告,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想等,以取得上级领导部门的指导。 报告,在已发布的党、人大、政府、军队的公文处理规范中,都规定了这个文种。其适用范围,大体上是一致的,但也有些区别。请看这四个大机关对报告下的定义: 《中国共产党机关公文处理条例》(以下简称党的《条例》)中规定:报告,“用于向上级机关汇报工作、反映情况、提出建议,答复上级机关的询问”。 《人大机关公文处理办法(试行)》(以下简称人大《办法》)中规定:报告,“适用于报告工作、反映情况、提出建议或答复询问等”。
《国家行政机关公文处理办法》(以下简称《办法》)中规定:报告,“适用于向上级机关汇报工作,反映情况,答复上级机关的询问”。 《中国人民解放军公文处理条例》(以下简称军队《条例》)中规定:“向上级机关汇报工作、反映情况和意见建议,询问用“报告”。 从以上定义可以发现,四大机关的报告,均是上行文。其中,党、人大、军队三家的报告,都规定了四项用途,包括汇报工作、反映情况、提出建议、答复上级机关询问等。惟独政府的报告,只有三项用途,即汇报工作、反映情况、答复上级机关询问,而没有“提出建议”这个功能。实际上,在2000年发布的行政《办法》之前,也曾有“提出建议”的功能,只是在新的行政《办法》中取消了。承担这一功能新增加了文种:意见。因此,“意见”这个文种多了一个上行文的用途。(节选自《应用写作》2005年第11期《浅谈报告的适用范围和写作要求》) 二、报告的特点 1.内容的汇报性:一切报告都是下级向上级机关或业务主管部门汇报工作,让上级机关掌握基本情况并及时对自己的工作进行指导,所以,汇报性是“报告”的一个大特点。 2.语言的陈述性:因为报告具有汇报性,是向上级讲述做了什么工作,或工作是怎样做的,有什么情况、经验、体会,存在什么问题,今后有什么打算,对领导有什么意见、建议,所以行文上一般都使用叙
文件编号:73021微生物限度检查方法及其验证报告
目录1 样品相关信息 1.1 基本信息 2 主要仪器设备和试验耗材信息 2.1 主要使用的仪器设备 2.2 试验用培养基 2.3 试验用试剂 2.4 试验用菌种 3 试验环境 3.1 无菌室 3.2 洁净工作台 3.3 生物安全柜 4 试验方案 4.1 验证试验目的 4.2 微生物限度检查方法草案 5 方法验证试验 5.1 菌液制备 5.2 计数培养基适用性检查 5.3 控制菌检查用培养基使用性检查 5.4 供试液制备 5.5 方法验证 5.5.1 菌落计数方法验证试验 5.5.2 控制菌检查方法的验证 5.6 方法验证结论 6 供试品微生物限度检查结果
1 样品相关信息 1.1 基本信息(三批) 2 主要仪器设备和试验耗材信息2.1 主要使用的仪器设备 2.2 试验用培养基 2.2.1 对照培养基
2.2.2 试验用培养基 2.3 试验用试剂 2.4 试验用菌种
3 试验环境 《中国药典》2015版规定,微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域进行。 本公司微生物限度室、阳性对照室、生物安全柜及超净工作台洁净度检测无特殊情况下每季度进行一次。 3.1 无菌室 无菌室按《医药工业洁净厂房设计规》GB 50457-2008监测,静态洁净度检测结果符合GB50457-2008对10000级洁净度要求。 3.2 超净工作台 超净工作台按《医药工业洁净厂房设计规》GB50457-2008监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。 超净工作台沉降菌检测记录 2015.11.15 3.3生物安全柜 生物安全柜按《生物安全实验室建筑技术规》GB50346-2011监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。 生物安全柜沉降菌监测记录 2015.11.15 4 试验方案 按《中国药典》2015年版第四部:(通则1105)非无菌产品微生物限度检查:微生物计数法、(通则1106)非无菌产品微生物限度检查:控制菌检查法、(通则1107)非无菌药品微生物限度标准及(通则1121)抑菌效力检查法规定,本品微生物限度标准为:1g供试品中,需氧菌总数不得过1000cfu,霉菌和酵母菌总数不得过100cfu,大肠埃希菌不得检出。
设备确认再确认 工艺验证清洁验证 再验证回顾验证 同步验证检验方法验证 分析仪器确认其他
XX安装和运行确认验证方案目录 1.0验证目的和范围 (3) 2.0设备说明 (3) 3.0验证小组人员和职责 (3) 4.0突出的问题 (4) 5.0审批后开始工作 (4) 6.0安装确认的项目、接受标准和结果 (4) 7.0运行确认的项目、接受标准和结果 (10) 8.0安装和运行确认结论 (12) 9.0建议 (12) 10.0附录表 (13) 11.0偏差 (13) 12.0方案变更历史 (13) 附录1 (13) 整理为word格式
1.0验证目的和范围 1.1确认该设备符合供应商的安装要求和相关要求; 1.2确认该设备有足够的信息证明可以安全、有效、连续的运行并得以维护; 1.3确认该设备在空载和预期的范围内,运行正确可靠,各项参数的限度符合说明书 的规定及已获批准的变更控制; 1.4确保在执行运行确认之前已经辨别出需要校正的仪器; 1.5确保在执行运行确认之前已有草拟的设备操作SOP、维修SOP、清洁SOP等文件; 1.6确保相关人员已经过培训,可以正确使用、清洁和维护设备; 1.7确保设备操作SOP、维修SOP、清洁SOP等文件草案已经过相应的补充与修改, 并被批准为正式文件; 1.8确认该设备的状态是否可以执行后续性能确认; 1.9确保以上确认过程经过文件化的记录; 1.10本次验证的范围为:本次确认主要验证XX安装和运行是否符合生产要求。 2.0设备说明 2.1设备的工作原理 反应釜的工作原理是在内层放入反应溶媒可做搅拌反应,夹层可通上不同的冷热源(冷冻液,热水或热油)做循环加热或冷却反应。 2.2设备的组成、安装位置 主要由由带夹套的釜何釜体,原动机和减速机,密封装置组成。 2.3设备的主要参数 容积:材质设备结构:主轴转速: 3.0验证小组人员和职责 4 确认工作依据
---------------------------------------------------------------范文最新推荐------------------------------------------------------ 情况报告格式范本 (一)情况报告的基本含义 情况报告,也叫工作报告、工作汇报,其内容主要反映本机关的某一段的工作进展情况,发生的重大问题,对于政策法令和有关部门指示的贯彻执行情况,以及对于上级交办的事项的完成情况等。 (二)情况报告的写作要点 通常来说,情况报告要包括以下主要内容: 1 .撰写情况报告要注意把情况写得清楚,对有关部门事实和数据必须核对清楚,坚持实事求是; 2 .反映情况的报告,可以附带简要总结工作经验、分析问题产生的原因,或提出某些建议或意见等; 3 .业务主管机关有时针对工作中发现的问题,要及时提出具休要求、措施与意见等,报告领导机关,请求予以审核和批转给各有关部门贯彻执行。 关于中央移民建镇资金审计情况的报告 报告格式:(情况报告) 关于××××××的报告 根据××××××××&ti mes;×××××××× 1 / 15
;××××××××&t imes;×××××××&time s;××××××××& times;×××××××现将主要情况报告如下: ××××××××&ti mes;×××××××× ;××××××××&t imes;×××××× 针对××××××,提出以下建议: 一、××××××××&ti mes;×××××××× ;××。 二、××××××××&ti mes;×××××××× ;××。 XXXX医院××处 ××××年×月×日
验证文件 XXXXXX有限公司2013年XX月
6.验证报告起草、审核与批准6.1验证报告起草 6.2 再验证报告审核 6.3 再验证报告批准
目录 1. 验证概述 2. 验证目的 3. 验证范围 4. 再验证依据标准 5. 机构与职责 5.1 验证机构 5.2 验证职责 6. 验证方式 7. 验证准备 7.1 设备设施准备 7.2 仪器试剂准备 7.3 原辅物料准备 7.4 文件与培训 8. 验证时间与计划 9. 验证实施 9.1 产品的工艺流程图 9.2产品的工艺验证: 9.2.1称量备料 9.2.1.1目的 9.2.1.2文件 9.2.1.3检查项目及结果9.2.2 配制 9.2.2.1 目的 9.2.2.2 文件 9.2.2.3 评估项目 9.2.2.4 评估方法 9.2.2.5 取样方法 9.2.2.6配制试验数据 9.2.3 灌装封尾 9.2.3.1 目的 9.2.3.2文件 9.2.3.3评估项目 9.2.3.4评估方法 9.2.3.5灌装封尾检查数据9.2.4 成品抽样检验 9.2.4.1 目的 9.2.4.2 文件
9.2.4.3 评估项目 9.2.4.4 评估方法 9.2.4.5产品检验报告复印件 10. 偏差与处理. 11. 结果与分析 11.1 验证数据汇总 11.2 存在问题与措施 11.3 风险与预防 12. 验证结论 12.1 验证结论 12.2 验证评价与建议 13. 验证周期 14. 附件 15.参考或引用文件 1.概述: 复方醋酸地塞米松乳膏为我司生产多年的乳膏剂品种,自2009GMP再认证以来,乳膏剂生产线生产所用关键设备、生产工艺及工艺参数没有改变,为了验证在正常的生产条件和GMP文件管理体系下能生产出符合预定的规格及质量标准的产品,根据验证管理文件的要求,我们对复方醋酸地塞米松乳膏的生产工艺进行再验证。 2.目的: 在现行的GMP文件管理体系下,生产三批复方醋酸地塞米松乳膏进行工艺再验证: (1)确认关键工序质量监控点是否符合质量要求; (2)确认该产品质量是否符合预定成品的标准。 3.验证范围: 本次验证对复方醋酸地塞米松乳膏,依据工艺规程的各项参数设定指标,并认真按方案组织了实施,仅验证该品种工艺参数设定的科学性符合性。 4.再验证的依据与标准: 《药品生产质量管理规范》(2010版)、《复方醋酸地塞米松乳膏生产工艺规程》、《复方醋酸地塞米松乳膏中间产品内控质量标准》、《复方醋酸地塞米松乳膏成品内控质量标准》。
目的:检验方法验证的目的是证明采用的方法适合于相应检测要求。 适用范围:在制定药品质量标准时所采用的检验方法应验证,药物生产方法变更、制剂组分变更、原检验方法进行修订时,检验方法应进行再验证。 责任者:化验室、研究开发实验室 内容: 1.验证项目药品检验方法包括化学检验、生物测定和仪器分析三种。验证项目应包括: 鉴别试验; 杂质定量或限度检查; 制剂中其他成分(如降解产物、防腐剂等)测定; 有效成分含量测定; 溶出度释放度检查中溶出量的测试方法。 2.一般步骤 2.1方案的起草及审批 通常由研究开发实验室提出,检验实验室会签,根据产品工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料提出规格标准,确定检查项目,规定杂质限度和操作步骤,并经有关领导审批方可实施。 2.2仪器的确认验证过程中所用的仪器设备均应校验,对于新的大型
精密仪器应进行确认,确保测试数据的准确可靠。大型精密仪器应制定确认方案,经安装确认、运行确认符合要求,有关领导批准确认报告后方可投入使用。 2.3适用性试验适用性试验内容包括:准确度试验、精密度测定、线性范围试验、选择性试验、检测限等。 2.3.1准确度试验准确度是指测量值与真值接近的程度,测量值与真值愈接近,测量值的误差愈小,测量就愈准确。在准确度试验中可用对照试验、回收试验和空白试验三种方法。准确度通常用回收率表示。 原料含量测定方法的准确度一般用已知含量的对照品或标准品作样品,以所用的方法对它进行定量测定,从分析结果与标准样品或纯净物的含量差值就可知道误差。 制剂含量测定方法的准确度一般用已知含量的原料和处方中相应的辅料按比例模拟配制成制剂进行测定。 杂质定量测定方法的准确度一般用加入已知量杂质进行测定,应能明确证明单一杂质或杂质总量相当于主成分的重量百分比。 在规定范围内,至少用9次测定结果进行评价,如制备3个不同浓度的样品,各测定3次,或把被测物浓度当作100%,用至少测定6次的结果进行评价。 2.3.2精密度测定精密度系指在规定的测试条件下,用同一方法对某一成份进行多次测定,所测得值彼此符合的程度,所以也称重现性,测定值彼此愈接近,测量值的偏差愈小,测量就愈精密。 精密度通常用相对标准偏差表示。 在规定的范围内至少用9次测定结果进行评价。 2.3.3线性范围试验在检验过程中取样量或样品浓度是允许在一定范围内变化的,测定的结果也应随取样量或样品浓度成正比的变化,这样的检验方法才能达到准确度和精密度的要求。取样量在一定范围内变化时,测得含量的结果也成正比的变化,这样的取样范围称之为线性范围。 线性范围的测试通常精密配制一系列供试样品(至少5份)进行测定,以测得的响应信号作为被测物浓度的函数,用最小二乘法进行线性回归。
2009年**月**报告 各类报告格式模板 一、纸张格式 页眉:采用固定格式,部门logo+报告名称(如上所示) 页边距:使用a4纸标准格式,左、右页边距31.7mm,上、 下页边距25.4mm。(必要时可略作调整,但边距不 应小于20mm) 页脚:第x页共 y页,居中 二、正文 标题:宋体、小二号、加粗。 行距:1.5倍。 三、表格具体格式 表格内字体及行距:仿宋、小四、单倍行距。 表格内第一行项目标题加粗、居中。 四、层次结构 第一层:一、二、三… 第二层:(一),(二),(三)… 第三层:1,2,3… 第四层:(1),(2),(3)… 五、落款 总行运营管理总部集中作业中心 六、成文日期 用汉字将年、月、日标全;“零”写成“○”; 例如:二○○九年十一月九日 第 1 页共 1 页篇二:报告格式模板 软件学院学生报告 实习题目: (三号黑体,居中, 不得超过30个汉字) (论文题目可分两行 书写) 学生姓名:学软件指导教师:软件通 专业班级:软件工程2004级(x)班 所在学院: 目录(三号黑体居中) 以下目录内容是自动产生的,可以点击鼠标右键并选择“更新域”进行自动更新,自动 更新之后将小节标题再缩进两格对齐; 其中关于字体大小的说明是原文带下来的,不必理会。 1.1 1.1.1 1.2 1.2.1 2.1 2.1.1 2.2 2.2.1 3.1
3.1.1 3.1.2 3.2 3.2.1 第一章实习基本情况(三号黑体居中) ............................. 1 节标题(四号黑体左起顶格打印,上面空两行) ...................... 1 小节标题(小 四号黑体左起顶格打印).............................. 1 节标题.......................................................... 1 小节标 题 ........................................................ 1 节标题(四号黑体左 起顶格打印,上面空两行) ...................... 2 小节标题(小四号黑体左起顶格打印).............................. 2 节标题(四号黑体左起顶格打 印) .................................. 3 小节标题(小四号黑体左起顶格打 印) .............................. 3 节标题(四号黑体左起顶格打印,上面空两行)...................... 4 小节标题(小四号黑体左起顶格打印).............................. 4 小节标题........................................................ 4 节标题.......................................................... 4 小节标 题 ........................................................ 4 第二章图表(三号黑 体居中) ..................................... 2 第三章报告主体(三号黑体居 中) (4) (要求学生对实习的主要内容、本人学习与工作的表现、收获与体会、以及存在的问题 等方面进行全面总结。) 第一章实习基本情况(三号黑体居中) 1.1 节标题(四号黑体左起顶格打印,上面空两行) 1.1.1 小节标题(小四号黑体左起顶格打印) 实习报告正文主体,一般由标题、正文、图、表格和公式等内容构成。写作内容可因实 习项目的不同而变化 报告正文采用小四号宋体打印,英文正文采用小四号times new roman. 1.2 节标题 1.2.1 小节标题 可以根据需要,分多个小节。 正文:采用小四号宋体打印,英文正文采用小四号times new roman. 第二章图表(三号黑体居中) 2.1 节标题(四号黑体左起顶格打印,上面空两行) 2.1.1 小节标题(小四号黑体左起顶格打印) 图:图中标注,图题可用中、英任一种文字,亦可采用中英文对照,其英文字体为五号 times new roman,中文字体为五号宋体。引用他人的图时,应在图题右上角标出此图的来源 文献。 图号按章顺序号,如图3.2为第三章第二图。如果图中含有几个不同部分,应标注分图 号,并在图题下列出各部分内容。 绘图必须工整、清晰、规范。程序流程图按规定的要求绘制;示意图应能清楚反映图示 内容;屏幕拷贝应该清晰;实验结果曲线图应制成方框图。 表格:表格按章顺序编号,如表5.4为第五章第四表。表应有标题,表内必须按规定的 符号标注单位。 图及图题例:
报告编号:YT-FS-1277-35 职报告格式模板(完整版) After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
职报告格式模板(完整版) 备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。文档可根据实际情况进行修改和使用。 写辞职报告也需要一个好的辞职报告格式,下面来看一篇辞职报告格式范文,希望此内容对大家有帮助。 辞职报告格式 (一)标题 在辞职报告第一行正中写上报告的名称。一般辞职报告由事由和文种名共同构成,即以“辞职报告”为标题。标题要醒目,字体稍大。 (二)称呼 要求在标题下一行顶格处写出接受辞职报告的单位组织或领导人的名称或姓名称呼,并在称呼后加冒号。 (三)正文
正文是报告的主要部分,正文内容一般包括三部分。 首先要提出报告请辞的内容,开门见山让人一看便知。 其次申述提出报告的具体理由。该项内容要求将自己有关辞职的详细情况一一列举出来,但要注意内容的单一性和完整性,条分缕析使人一看便知。 最后要提出自己提出辞职报告的决心和个人的具体要求,希望领导解决的问题等。 (四)结尾 结尾要求写上表示敬意的话。 (五)落款 辞职报告的落款要求写上辞职人的姓名及提出辞职申请的具体日期。 辞职报告范文 尊敬的公司领导: 您好! 首先想对您说声谢谢,在工作上您多年来给予的
IQ/OQ/PQ验证方案模版 使用说明:针对此模版使用者 此模版应用于系统/设备确认验证方案的起草,规定了方案格式和通用内容。因此系统/设备确认验证方案的产生形成过程必须以此模版给出的格式为指南并且要严格符合验证组织和实施sop(xxxxx)的要求。 此模版作为一个指导,由一些必须在实际操作中执行章节组成. 这些章节/ 内容项目以青色标明。在完成这些青色标注的项目后必须用黑色字体的文字部分来代替,删除或覆盖掉。而与本次验证不相关的部分/项目以黑字内容可直接从模版中删除。
方案批准: 批准意味着该确认方案已经被审核并且是完整和可接收的。
目录 (列出本文件的主要标题及相应的页码) 1.验证小组签名 (3) 2. 缩写和定义 (3) 3. 参考文件 (3)
1.验证小组签名 在本验证中涉及的所有人员必须完成下表,作为在该文件中所有签名/首字母签名的识别(可增加表格行数)。 2. 缩写和定义 此文件中可能使用的首字母缩写如下(可适当增减),通用的首字母缩写不用在此定义例如FDA, DQ, IQ, OQ, SOP, cGMP CIP 在线清洁 CoC 变更控制 CSV 计算机控制系统验证 DAM 文件审批矩阵 HMI 人机互动过程 RA 影响评估通常也叫风险分析 PID 工艺,管道系统图表 PLC 可编程序逻辑控制器 PQP 工程确认计划 QSR 验证总结报告 EHS 环境,健康和安全 SRS 系统要求标准 URS 用户需求标准 3. 参考文件 以下是在此文件可能引用参照的资源 3.1 GMP规程 3.1.1 欧盟GMP及其附录x 3.1.2中国GMP及药品生产验证指南 3.1.3 美国GMP 3.1.4 中国药典X版
报告编号:LX-FS-A43992 报告的基本格式标准范本 The Stage T asks Completed According T o The Plan Reflect The Basic Situation In The Work And The Lessons Learned In The Work, So As T o Obtain Further Guidance From The Superior. 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
报告的基本格式标准范本 使用说明:本报告资料适用于按计划完成的阶段任务而进行的,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想的汇报,以取得上级的进一步指导作用。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 基本格式 标题,包括事由和公文名称。 主送机关,发文单位的直属上级领导机关。 正文,结构与一般公文相同。从内容方面看,报情况的,应有情况、说明、结论三部分,其中情况不能省略;报意见的,应有依据、说明、设想三部分,其中意见设想不能省去。从形式上看,复杂一点的要分开头、主体、结尾。开头使用多的是导语式、提问式给个总概念或引起注意。主体可分部分家二级标题或分条加序码。 结尾,可展望、预测,亦可省略,但结语不能
省。 打报告要注意做到: 情况确凿,观点鲜明,想法明确,口吻得体,不要夹带请示事项。 注意结语: 呈转报告的要写上“以上报告如无不妥,请批转各地参照执行。”最后写明发文机关、日期。 易错的地方 1.结尾处应有结束性语言,如“特此报告”一类结语,词语既无实际意义,也无结构作用,可以去除,保留亦可。但如果写成“以上报告当否,请指示”,就为严重错误,因为如上述,报告是无须上级回复处理的文种,所以,即使写上这句话也是白搭,上级不会答复你。 2.同理,报告后面加附注标明“联系人”和“联
检验检测报告 报告编号: 委托单位:沧县顺发再生胶厂 检测项目:再生胶改扩建项目 竣工环境保护验收检测分析 河北鼎泰检测技术服务有限公司 二〇一七年三月十六日 精品
检测报告说明 、本报告无本公司章、检验检测专用章及骑缝章无效。、本报告无编制人、审核人、批准人签字无效。 、本报告涂改无效。 、本报告仅对本次检测结果负责。由委托方自行采样送检样品仅对送检样品检测结果负责,不对样品来源负责。 、委托方如对本报告有异议,须于接收报告之日起十五日内向本公司提出查询,逾期不查询的,视为认可本报告。、未经本公司书面授权同意,复制或部分复制本报告,视为无效报告。 、未经本公司同意,本报告不得用于广告宣传等其他用途。 河北鼎泰检测技术服务有限公司 地址:沧州渤海新区中捷产业园二队西、黄赵公路北 电话: 传真: 邮箱: 邮编:
报告编写:日期:年月日报告审核:日期:年月日报告签发:日期:年月日采样人员:冯红达、刘学文、沈建帮 分析人员:付振宇、刘永帅
一、概况 委托单位:沧县顺发再生胶厂 项目名称:再生胶改扩建项目竣工环境保护验收检测分析项目地址:沧县仵龙堂乡前堂庄村村北处 检测日期:年月日~月日 二、检测项目及分析方法 、废气 表废气检测分析方法
、厂界噪声 表分析方法、分析仪器及检出限
三、采样时间及样品信息 、无组织废气 监测点位:在无组织排放源下风向厂界外范围内布设个监控点 : (◎~◎)为监控点 图 无组织废气监测点位 .厂界噪声 检测点位:厂界外布设个检测点位。 ▲~为检测点位 风向 单 位 周 界 ◎ ◎ ◎ ▲ 厂区 ▲ ▲ ▲ 北
1 基本格式 (1)标题:包括事由和公文名称。 (2)上款:收文机关或主管领导人。 (3)正文:结构与一般公文相同。从内容方面看,报情况的,应有情况、说明、结论三部分,其中情况不能省略;报意见的,应有依据、说明、设想三部分,其中以建设想不能省去。从形式上看,复杂一点的要分开头、主体、结尾。开头使用多的是导语式、提问式给个总概念或引起注意。主体可分部分家二级标题或分条加序码。 (4)结尾:可展望、预测,亦可省略,但结语不能省。 (5)打报告要注意做到:情况确凿,观点鲜明,想法明确,口吻得体,不要夹带请示事项。 (6)注意结语:呈转报告的要写上“以上报告如无不妥,请批转各地参照执行。”最后写明发文机关,日期。 2 写作特点
(1)内容的汇报性:一切报告都是下级向上级机关或业务主管部门汇报工作,让上级机关掌握基本情况并及时对自己的工作进行指导,所以,汇报性是“报告”的一个大特点。 (2)语言的陈述性:因为报告具有汇报性,是向上级讲述做了什么工作,或工作是怎样做的,有什么情况、经验、体会,存在什么问题,今后有什么打算,对领导有什么意见、建议,所以行文上一般都使用叙述方法,即陈述其事,而不是像请示那样采用祈使、请求等法。 (3)行文的单向性:报告是下级机关向上级机关行文,是为上级机关进行宏观领导提供依据,一般不需要受文机关的批复,属于单项行文。 (4)成文的事后性:多数报告都是在事情做完或发生后,向上级机关作出汇报,是事后或事中行文。 (5)双向的沟通性:报告虽不需批复,却是下级机关以此取得上级机关的支持指导的桥梁;同时上级机关也能通过报告获得信息,了解下情,报告成为上级机关决策指导和协调工作的依据。 3 专题报告 专题报告是指向上级反映本机关的某项工作、某个问题或某一方面的情况,要求上级对此有所了解的报告。所写的报告要迅速、及时,一事一报。呈报、呈转要分清写明。专题报告与调查报告有一些类似,都是主要针对某个事实或论点而展开论述,不过专题报告没有调查报告要求的扩展面更加广泛,论述的深度和广度要求较低。 4 调查报告
验证报告Validation Report
目录CONTENTS 报告总结Summary Report 1、目的Purpose 2、验证范围Scope 3、验证依据Validation Basis 4、责任者Person Responsibility 5、接受标准Acceptance Criterion 6、有机挥发性物质的测定Determination of Organic Volatile Impurities 6.1有机挥发性物质的限度Limit of Organic Volatile Impurities 6.2溶液配制Preparation 6.3色谱系统Chromatographic System 6.4系统适应性试验System Suitability Test 6.5测定Procedure 6.6结果计算Calculate 6.7样品测定Sample Determination 7、仪器和试药Instruments and Reagents 7.1仪器Instruments 7.2试药Reagents 8、验证内容Validation Contents 8.1专属性(定位)Specificity 8.2检测限Limit of Detection 8.3精密度Precision 8.4线性范围Linearity and Range 8.5准确度/回收率Accuracy/Recovery 9、变更和偏差调查Change and Deviation Investigation 10、结果分析、结论和评价Comprehensive, Conclusion and Assessment 11、附录A ppendix
文件编号:产品包装材料验证报告 拟制日期年月日 审核日期年月日 批准日期年月日 版号生效日期年月日 有限公司
产品包装材料验证报告 一、总则 1 包装材料的要求 依据:YY/T0681.1、YY/T0313 、YZB/国《体》产品注册标准。 用作制造XXXX的包装材料原料是原始材料,应有原料的来源,明确其历史和可追溯性,并受到控制,以确保成品始终能满足要求。 2 包装材料的设计必须在满足原定用途的条件下,既能够确保内包装材料的符合性,又把对使用者或患者的安全造成危害的可能性降低到最小程度。 2.1 包装材料与XXXX的相容性(即包装与医疗器材相互无不良影响):主要考虑的有:包装材料的安全性毒性的要求,拟包装的医疗器械的大小和形状,对物理和其它防护的要求,医疗器械对特殊危险例如辐射、湿气、机械性撞击,静电放射的敏感性。 2.2 包装材料与标识方式的相容性:标识方法必须对包装材料与采用的灭菌过程的相容性无不良影响,印刷或书写所采用的油墨不会转移到XXXX产品上,也不会和包装材料起反应而影响包装材料的效用,也不会变色而使标识变的模糊不清,对固定在包装材料表面的标识,其附着方式必须能耐受灭菌过程的使用及制造厂规定的贮存和运输条件。 3 包装材料能够提供对物理、化学和微生物的防护。 3.1包装材料在使用场所与使用者撕开包装取出使用时的要求相容性(例如无菌的开封)。
3.2 在使用条件下,在灭菌前、中、后,包装材料不可释放已知是有毒的,其数量足以对健康危害的物质。 3.3无菌状态的保持:(即从其产品灭菌后,成为无菌之时起,直至规定的失效日期或使用时止),包装完整性及包装材料的微生物阻隔特性。 3.4 材料的毒性检测。
RPT VL-FX901001-01清洁验证中残留物头孢克肟分析方法确认报告 宁波大红鹰药业股份有限公司 NINGBO DAHONGYING PHARMACEUTICAL CO., LTD.
本《清洁验证中残留物头孢克肟分析方法验证报告》(RPTVL-FX901001-01)系根据《清洁验证中残留物头孢克肟分析方法验证方案》(STP VL-FX901001-01),对分析方法进行验证。验证委员会认为,本验证工作确认该分析方法能有效检测出设备清洁残留活性成分头孢克肟。验证委员会批准本验证报告,并颁发《验证证书》(编号FX901001-01). 宁波大红鹰药业股份有限公司验证委员会 主任委员: 副主任委员会: 委员:
目录 1概述 (4) 2 验证小组 (4) 3验证时间 (4) 4验证过程 (4) 5验证结论及最终评价 (8) 6验证建议 7附件
1概述 通过对设备清洁活性残留成分头孢克肟的的检出限,专属性,线性,回收率试验,证明该分析方法确实有效。 2 验证小组 本验证小组由下列人员组成: 3验证时间 验证小组完全按照经批准的验证方案中所规定的要求,对头孢克肟清洁残留物分析方法进行验证。具体验证进行时间如下: 年月日至年月日 4验证过程 4.1 验证的准备工作 4.1.1 验证所需要的文件资料 文件所需要文件资料见下表 表1 验证所需要资料及存放处 4.1.2仪器、工具使用的清单
所有与验证有关的设备、仪器进行了验证,仪表、计量器具经校正合格。设备、仪器等均有相关的操作程序、维护保养程序 表2 验证所需设备清单 方法研究 4.2.1专属性试验 称取脱脂棉约0.35g,加流动相10ml,振摇5分钟,记录色谱图,连续3次,结果见表3,脱脂棉在头孢克肟相对保留时间处无吸收峰存在,证明脱脂棉对该检验方法无干扰。 表3 棉花的专属性试验 结论: 评价人:日期: 4.2.2线性和范围 精密称取头孢克肟对照品适量,用流动相溶解并定量稀释制成不同浓度的溶液,精密量取10ul,注入液相色谱仪,记录色谱图。
报告的基本格式及模板 ###报告频道为大家整理的报告的基本格式及模板,供大家参考。更多阅读请查看本站频道。 1 基本格式 (1)标题:包括事由和公文名称。 (2)上款:收文机关或主管领导人。 (3)正文:结构与一般公文相同。从内容方面看,报情况的,应有 情况、说明、结论三部分,其中情况不能省略;报意见的,应有依据、 说明、设想三部分,其中以建设想不能省去。从形式上看,复杂一点 的要分开头、主体、结尾。开头使用多的是导语式、提问式给个总概 念或引起注意。主体可分部分家二级标题或分条加序码。 (4)结尾:可展望、预测,亦可省略,但结语不能省。 (5)打报告要注意做到:情况确凿,观点鲜明,想法明确,口吻得体,不要夹带请示事项。 (6)注意结语:呈转报告的要写上“以上报告如无不妥,请批转各 地参照执行。”最后写明发文机关,日期 2 写作特点 (1)内容的汇报性:一切报告都是下级向上级机关或业务主管部门 汇报工作,让上级机关掌握基本情况并即时对自己的工作实行指导, 所以,汇报性是“报告”的一个大特点。 (2)语言的陈述性:因为报告具有汇报性,是向上级讲述做了什么 工作,或工作是怎样做的,有什么情况、经验、体会,存有什么问题,今后有什么打算,对领导有什么意见、建议,所以行文上一般都使用 叙述方法,即陈述其事,而不是像请示那样采用祈使、请求等法。
(3)行文的单向性:报告是下级机关向上级机关行文,是为上级机 关实行宏观领导提供依据,一般不需要受文机关的批复,属于单项行文。 (4)成文的事后性:多数报告都是在事情做完或发生后,向上级机 关作出汇报,是事后或事中行文。 (5)双向的沟通性:报告虽不需批复,却是下级机关以此取得上级 机关的支持指导的桥梁;同时上级机关也能通过报告获得信息,了解 下情,报告成为上级机关决策指导和协调工作的依据。3 专题报告 专题报告是指向上级反映本机关的某项工作、某个问题或某一方 面的情况,要求上级对此有所了解的报告。所写的报告要迅速、即时,一事一报。呈报、呈转要分清写明。专题报告与调查报告有一些类似,都是主要针对某个事实或论点而展开论述,不过专题报告没有调查报 告要求的扩展面更加广泛,论述的深度和广度要求较低。 4 调查报告 调查报告是对某项工作、某个事件、某个问题,经过深入细致的 调查后,将调查中收集到的材料加以系统整理,分析研究,以书面形 式向组织和领导汇报调查情况的一种文书;主要分为介绍典型经验类、 揭露问题类、反映新生事物类和社会情况类的调查报告。 5 例行报告 主要指日报、周报、月报、季报和年报等,常见于工作生活中, 用于工作直属下级对上级汇报制定时间段的工作安排,报告内容除了 要反应这段时间的工作完成进度和结果之外,还要说明工作中所发生 的情况、经验、体会、存有的问题和问题解决的办法,写作的方法一 般采用记叙的方式,要求要全面来说简意赅。。
工艺验证报告 文件编码: 起草人:姓名: 部门: 日期: 审核人:姓名: 部门: 日期: 批准人:姓名: 部门: 日期:
目录 1.介绍 (2) 2.验证目的 (2) 3.验证范围 (2) 4.验证类型 (2) 5.验证日期与相关批号 (2) 6.验证小组成员及职责 (2) 7.简单工艺描述(略) (2) 8.胺化工艺验证 (3) 8.1.工艺参数 (3) 8.2.验证人员及日期 (3) 8.3.验证标准、分析方法 (3) 8.4.验证数据 (3) 8.5.验证结果分析、评价及建议 (4) 9.纯化工艺验证 (4) 9.1.工艺参数 (4) 9.2.验证人员及日期 (5) 9.3.验证标准、分析方法 (5) 9.4.验证数据 (5) 9.5.验证结果分析、评价及建议 (6) 10.成盐工艺验证 (7) 10.1.工艺参数 (7) 10.2.验证人员及日期 (8) 10.3.验证标准 (8) 10.4.分析方法 (8) 10.5.验证数据 (8) 10.6.验证结果分析、评价及建议 (9) 11.验证结果批准、会签及日期 (10)
1.介绍 在验证生产过程中发生偏差与异常情况,我们按“偏差处理程序--SOP-ZL-9004-02”进行了处理。 2.验证目的 证明本工艺路线在预定的工艺参数范围内运行能持续有效地生产出高质量的合格的硫酸羟基氯喹。 3.验证范围 4.验证类型 前瞻性验证 5.验证日期与相关批号 验证日期:2007 年03 月20 日至2007 年04 月20 日验证批号:070402、070403、070404 6.验证小组成员及职责 7.简单工艺描述(略) 详见工艺验证方案SMP-ZL-7244-00。