
项目3 反应速率的测定与分析 实验1 反应级数和速率常数的测定
一、实验目的
1.了解浓度对化学反应速率的影响。
2.测定(NH 4)2S 2O 8与KI 反应的速率、反应级数和速率常数。
二、实验原理
(NH 4)2S 2O 8和KI 在水溶液中发生如下反应:
S 2O 82-(aq)+ 3I -(aq) = 2SO 42- (aq)+ I 3-(aq) (1)
这个反应的平均反应速率为:
r = - 228(S O )/c t - = 228(S O )(I )kc c αβ-- 式中:r ── 反应的平均反应速率;
228(S O )c - ── t 时间内228S O -的浓度变化;
228(S O )c -,(I )c - ── 228S O -,I -的起始浓度; k ── 该反应的速率常数;
,αβ ──反应物228S O -,I -的反应级数,()αβ+为该反应的总级数。
为了测出在一定时间(t )内S 2O 82-的浓度变化,在混合(NH 4)2S 2O 8和KI 溶液的同时,加入一定体积的已知浓度的Na 2S 2O 3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S 2O 32- (aq) + I 3-(aq) ══ S 4O 62-(aq) + 3I -(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I 3-会立即与S 2O 32-反应生成无色的S 4O 62-和I -。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na 2S 2O 3一旦耗尽,由反应(1)生成的微量I 3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S 2O 82- 就要消耗2 mol 的S 2O 32-,即
c (S 2O 82-)= 12
c (S 2O 32-)
由于在t 时间内,S 2O 32-已全部耗尽,所以c (S 2O 32-)实际上就是反应开始时Na 2S 2O 3的浓度,即
-c (S 2O 32-)= 0c (S 2O 32-)
这里的0c (S 2O 32-)为Na 2S 2O 3的起始浓度。在本实验中,由于每份混合液中Na 2S 2O 3的起始浓度都相同,因而c (S 2O 32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(t ),就可以算出一定温度下该反应的平均反应速率:
r =228()c S O t
-
- =()2232c S O t -- =
()02232c S O t - 按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由()()
228/[]k r c S O c I αβ--= 求出反应的速率常数k 。
三、仪器、药品及材料
1.仪器:
每组:
(1)150mL 锥形瓶1个[用作反应容器]。 (2)25mL 烧杯1个[(NH 4)2S 2O 8专用]。 每3组:
(1)10mL 移液管4个[分别贴上(NH 4)2S 2O 8、KI 、KNO 3、NH 4)2SO 4]、5mL 移液管1个[贴上Na 2S 2O 3]、2mL 移液管1个[贴上淀粉]。
(2)250mL 烧杯6个[分别贴上NH 4)2S 2O 8、KI 、Na 2S 2O 3、淀粉、KNO 3、(NH 4)2SO 4]。 (3)移液管架1个。 实验室:
(1)试剂6个[分别贴上(NH 4)2S 2O 8、KI 、Na 2S 2O 3、淀粉、KNO 3、(NH 4)2SO 4]。 2.药品:
(NH 4)2S 2O 8(0.2mol ·L -1),KI (0.2mol ·L -1),Na 2S 2O 3(0.05mol ·L -1), KNO 3(0.2mol ·L -1), (NH 4)2SO 4(0.2mol ·L -1),淀粉溶液(0.2%),Cu(NO 3)2(0.02mol ·L -1)。
四、实验步骤
(一)第1次实验:
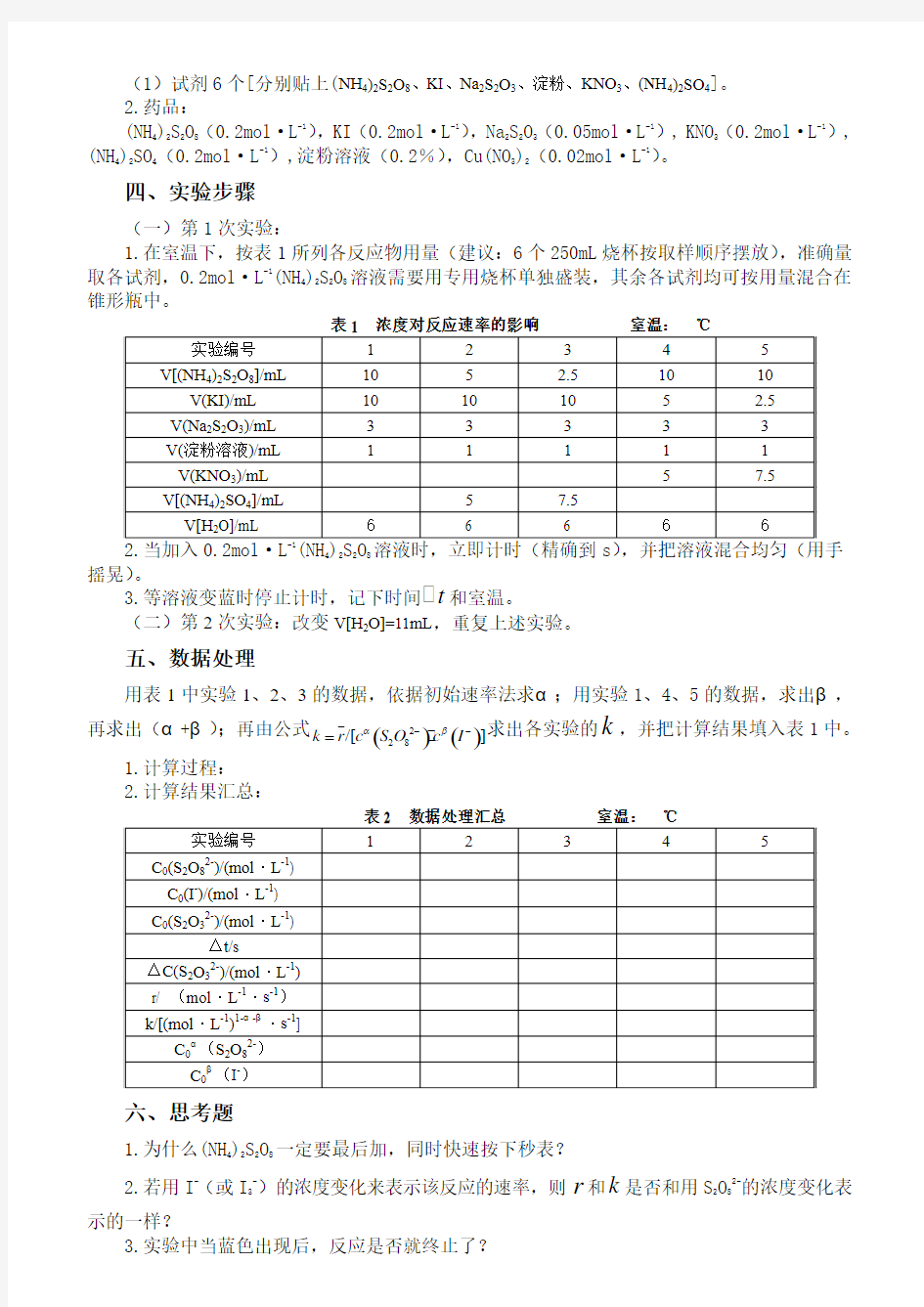
1.在室温下,按表1所列各反应物用量(建议:6个250mL 烧杯按取样顺序摆放),准确量取各试剂,0.2mol ·L -1(NH 4)2S 2O 8溶液需要用专用烧杯单独盛装,其余各试剂均可按用量混合在锥形瓶中。
表1 浓度对反应速率的影响 室温: ℃
4228摇晃)。
3.等溶液变蓝时停止计时,记下时间t 和室温。
(二)第2次实验:改变V[H 2O]=11mL ,重复上述实验。
五、数据处理
用表1中实验1、2、3的数据,依据初始速率法求α;用实验1、4、5的数据,求出β,再求出(α+β);再由公式()()22
8
/[]k r c S O c I αβ--= 求出各实验的k ,并把计算结果填入表1中。
1.计算过程:
2.计算结果汇总:
六、思考题
1.为什么(NH 4)2S 2O 8一定要最后加,同时快速按下秒表?
2.若用I -(或I 3-)的浓度变化来表示该反应的速率,则r 和k 是否和用S 2O 82-的浓度变化表示的一样?
3.实验中当蓝色出现后,反应是否就终止了?
项目3 反应速率的测定与分析
实验2 活化能的测定
一、实验目的
1.了解温度及催化剂对化学反应速率的影响。
2.测定(NH 4)2S 2O 8与KI 反应的活化能。
二、实验原理
(NH 4)2S 2O 8和KI 在水溶液中发生如下反应:
S 2O 82-(aq)+ 3I -(aq) = 2SO 42- (aq)+ I 3-(aq) (1)
速率测定方法同实验1。 由Arrhenius 方程得
ln ln a E
k A RT
=-
式中:a E ── 反应的活化能;
R ── 摩尔气体常数,R = 8.314 J ·mol -1
·K -1
; T ── 热力学温度
求出不同温度时的k 值后,以ln k 对1T 作图,可得一直线,由直线的斜率a E
R ??- ???
可求得
反应的活化能a E 。
Cu 2+可以加快(NH 4)2S 2O 8与KI 反应的速率,Cu 2+的加入量不同,加快的反应速率也不同。
三、仪器、药品及材料
1.仪器:
(1)150mL 锥形瓶1个[用作反应容器]。
(2)25mL 烧杯1个[贴上(NH 4)2S 2O 8,专用],25mL 烧杯1个[用于转移其他溶液]。 (3)玻璃棒1个。
(4)恒温水浴1台,温度计1个。 2.药品:
(NH 4)2S 2O 8(0.2mol ·L -1),KI (0.2mol ·L -1),Na 2S 2O 3(0.05mol ·L -1), KNO 3(0.2mol ·L -1), (NH 4)2SO 4(0.2mol ·L -1),淀粉溶液(0.2%),Cu(NO 3)2(0.02mol ·L -1)。
四、实验步骤
(一)第1次实验:
1.温度对反应速率的影响,求活化能
按实验1中编号1的试剂用量分别在高于室温5℃、10℃、15℃和20℃的温度下进行实验。这样就可测得这5个温度下的反应时间(反应前样品预热至恒温再混合),并计算5个温度下的反应速率及速率系数,把数据和实验结果填入本实验表1中。
表1 温度对反应速率的影响
利用表1中各次实验的k 和T ,作ln k -1T 图(实验报告要求附图),求出直线的斜率,
进而求出反应(1)的活化能a E 。
2.催化剂对反应速率的影响 在室温下,按实验1中编号1的试剂用量,再分别加入1滴、5滴、10滴0.02mol ·L -1Cu(NO 3)2
溶液[不足10滴的用0.2mol ·L -1(NH 4)2SO 4溶液补充]。
(二)第2次实验:
按实验1中编号5的试剂用量重复上述实验。
五、思考题
1.实验中取试剂的移液管(量筒)没有分开专用对实验结果有何影响?
2.加(NH 4)2SO 4的作用是什么?
3.Na 2S 2O 3的用量过多或过少,对本实验结果有何影响?
专题8.1 化学反应速率 (测试时间60分钟,满分100分) 姓名:班级:得分: 一、选择题(本题包括10小题,每小题5分,共50分) 1.【百强校·2016届哈尔滨6中期中】下列说法正确的是() A.增大压强,活化分子百分数增加,化学反应速率一定增大 B.升高温度,单位体积内分子总数不变,但活化分子数增加了 C.分子间所有的碰撞为有效碰撞 D.加入反应物,使活化分子百分数增加,化学反应速率增大 【答案】B 考点:本题主要是考查影响速率的因素判断 2.【2017届河北沧州市第一中学高三上第一次月考】对反应A+B=AB来说,常温下按以下情况进行反应: ①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol ③0.1mol?L-1的A、B溶液各10mL ④0.5mol?L-1的A、B溶液各50mL 四者反应速率的大小关系是() A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④ 【答案】A
考点:考查了化学反应速率的影响因素的相关知识。 3.【2017届湖北省恩施一中高三上学期开学考试】下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是() ①改变气体物质的浓度②改变气体的压强 ③加入催化剂④改变气体的温度 A.只有①② B.只有③④ C.只有①③④ D.①②③④ 【答案】B 【解析】 试题分析:在影响反应速率的外界条件中,只有温度和催化剂才是通过改变活化分子百分数来实现的。浓度和压强改变的是单位体积内的活化分子个数,而不是活化分子的百分数,故B正确。 考点:本题考查影响反应速率的因素。 4.【2017届内蒙古赤峰二中高三上第一次月考】影响化学反应速率的因素有:浓度、压强、温 度、催化剂等。下列有关说法不正确 ...的是() A.改变压强不一定能改变有气体参与反应的速率 B.增大浓度能加快化学反应速率,原因是增大浓度增加了反应体系中活化分子的百分数C.温度升高使化学反应速率加快的主要原因是增加了单位体积内活化分子总数 D.催化剂能加快化学反应速率主要原因是降低反应所需的能量 【答案】B 【解析】 试题分析:A.压强改变有气体参加的反应的反应速率,增大压强,反应速率加快,故A不选; B.增大浓度,增加了反应体系中活化分子数目增大,则反应速率加快,故B选;C.温度升高,增加了反应体系中活化分子百分数增大,反应速率加快,故C不选;D.催化剂降低反应的活化能,则反应速率加快,故D不选;故选B。 考点:考查了化学反应速率的影响因素的相关知识。
蔗糖水解反应速率常数的测定实验报告记录
————————————————————————————————作者:————————————————————————————————日期:
序号: 6 物理化学实验报告 姓名:××× 院系:化学化工学院 班级:××× 学号:××××××× 指导老师:××× 同组者:×××××××××××
实验项目名称:蔗糖水解反应速率常数的测定 一、实验目的 (1)根据物质的旋光性质研究蔗糖水解反应,测定其反应的速率常数和半衰期; (2)了解旋光仪的基本原理,掌握其使用方法。 二、实验原理 蔗糖在水中转化成葡萄糖与果糖,其反应方程式为 C 12H 22O 11 + H 2O === C 6H 12O 6 + C 6H 12O 6 为使水解反应加速,反应常常以H+为催化剂,故在酸性介质中进行。由于在较稀的蔗糖溶液中,水是大量的,反应达到终点时,虽有部分水分子参加反应,但可认为其没有改变。因此,在一定的酸度下,反应速度只与蔗糖的浓度有关,所有本反应可视为一级反应。该反应的速度方程为: -dt dc =KC 积分后: ln C C O =Kt 或 ㏑C=-k t+㏑C 。 式中,C 。为反应开始时蔗糖的浓度;C 为时间t 时的蔗糖浓度,K 为水解反应的速率常数。 从上式中可以看出,在不同的时间测定反应物的浓度,并以㏑C t 对t 作图,可得一条直线,由直线斜率即可求出反应速率常数K 。然而反应是不断进行的,要快速分析出某一时刻反应物的浓度比较困
难。但根据反应物蔗糖及生成物都具有旋光性,且他们的旋光性不同,可利用体系在反应过程中旋光度的改变来量度反应的进程。 旋光度与浓度呈正比,且溶液的旋光度为各组分的旋光度之和(加和性)。若以α0,αt,α∞分别为时间0,t,∞时溶液的旋光度,则可导出: C0∝(α0-α∞),C t∝(αt-α∞) 所以可以得出: ㏑(α0-α∞)/(αt-α∞)=k t 即:㏑(αt-α∞)=-k t﹢㏑(α0-α∞) 上式中㏑(αt-α∞)对t作图,从所得直线的斜率即可求得反应速度常数K。 一级反应的半衰期则用下式求取: t=㏑2/k=0.693/k 2/1 三、仪器和试剂 仪器:自动指示旋光仪一台;移液管(25 mL)2支;超级恒温槽1台;烧杯(150 mL)2个;恒温水浴锅1台;吸耳球1个;秒表1块;容量瓶(50mL)1个;锥形瓶(100 mL)2个; 试剂:蔗糖(AR);2 mol/L的盐酸溶液。 四、实验操作 1、温度设定与准备
专题十一化学反应速率及化学平衡 要点一、化学反应速率的概念及有关计算 1、概念: 2、计算公式: 3、单位: 4、注意点: (1)固体或纯液体(不是溶液)的浓度可视为不变的常数,故一般不用固体或纯液体表示化学反应速率,同一化学反应的速率可以用不同物质的浓度变化来表示,其数值不一定相同,但表示的意义相同。 其速率数值之比等于方程式中化学计量数之比。 (2)化学反应速率均用正值表示。 (3)所研究的反应速率一般指平均速率,不是瞬时速率。 【典例1】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法: ①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②2s时物质B的浓度为0.7 mol·L-1③用物质 B表示的反应的平均速率为0.6 mol·L-1·s-1 ④2s时物质A的转化率为70%,其中正确的是()A.①② B.①④C.②③ D.③④ 【典例2】反应A(气)+3B(气) 2C(气)+2D(气)在四种不同情况下的反应速率分别如下,其中反应速率最大的是 ( ) A.V A=0.15mol·L-1·min-1B.V B=0.6mol·L-1·min-1 C.V C=0.4mol·L-1·min-1D.V D=0.01mol·L-1·s-1 要点二、影响化学反应速率的因素 决定因素:参加化学反应的物质的性质 影响因素:当其它条件不变时 (1)浓度的影响:(2)压强的影响: (3)温度的影响:(4)催化剂: (5)此外:光、电磁波、超声波、反应物颗粒的大小溶剂的性质等也会对化学反应速率产生影响。[探讨]压强对气体反应体系的影响 例如:N2 + 3H22NH3反应在密闭容器中进行 1. 容器若为恒定容器,在容器内充入惰性气体,则化学反应速率_____(加快、不变、减慢),原因是_________ 2. 容器若为恒压容器,在容器内充入惰性气体,则反应速率(加快,不变,减慢)_________________, 原因是________ ____________________________________ 。 【典例3】(2009广东卷)2SO 2(g)+O2(g)V2O5 △ 2SO3(g)是制备硫酸的重要反应。
实验名称:化学反应速度与活化能的测定 一、实验目的 1、测定Na2SO3与KIO3反应的速率、反应级数,速率系数和反应的 活化能; 2、了解浓度、温度、催化剂对化学反应速率的影响。 二、实验原理 (NH4)2S2O8+3KI=(NH4)2SO4+K2SO4+KI3 S2O3^2-+3I^-=2SO4^2-+I3^- 五、数据结果 1、表3-1 2、表3-2 浓度对化学反应速率的影响 实验编号 1 2 3 4 5 试液的体积V/mL 0.2mol/L(NH4)2S2O8 20 10 5 20 20 0.2mol/LKI 20 20 20 10 5 0.01mol/LNa2S203 8 8 8 8 8 0.2%淀粉 4 4 4 4 4 0.2mol/LKNO3 0 0 0 10 15 0.2mol/L(NH4)2SO4 0 10 15 0 0 反应物的起始浓度c/mol/L (NH4)2S2O8 0.2 0.2 0.2 0.2 0.2 KI 0.2 0.2 0.2 0.2 0.2 Na2S2O3 0.01 0.01 0.01 0.01 0.01 反应开始至溶液显蓝色时所需时间 △t/s 76 172 324 178 300 反应的平均速率v/mol/L*S 0.000066 0.000029 0.000015 0.000028 0.000017 反应的速率常数k k=10140 反应级数 m=1 n=1 m+n=2 温度对化学反应速率的影 响 实验编号 反应温度T/℃ 反应时间△t/s 反应速率v/mol/L*S 反应速率常数 k Lgk 1/T 4 18.9 178 0.000028 10140 4.01 0.05 6 29 74 0.000068 22984 4.36 0.03
高考化学专题题库∶化学反应速率与化学平衡的综合题及答案 一、化学反应速率与化学平衡 1.硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2 实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示: (1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%?80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______ (2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条) (3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______ 实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。 资料:Fe3++3S2O32-?Fe(S2O3)33-(紫黑色) 装置试剂X实验现象 Fe2(SO4)3溶液混合后溶液先变成紫黑色,30s 后几乎变为无色 (4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象: _______ 实验Ⅲ:标定Na2S2O3溶液的浓度 (5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g?mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72- +14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______mol?L-1
实验 化学反应速率与活化能 一、实验目的 1.了解浓度、温度和催化剂对反应速率的影响。 2.测定过二硫酸铵与碘化钾反应的速率,并计算反应级数、反应速率常数和反应的活化能。 二、实验原理: 在水溶液中过二硫酸铵与碘化钾反应为: (NH 4)2S 2O 8 + 3KI === (NH 4)2SO 4 + K 2SO 4 + KI 3 其离子反应为: S 2O 82- + 3I - === SO 42- + I 3- (1) 反应速率方程为: n I m O S c kc r - - ?=28 2 式中r 是瞬时速率。若-28 2O S c 、- I c 是起始浓度,则r 表示初速率(v 0)。在实验中 只能测定出在一段时间内反应的平均速率。 t c r O S ??-= - 28 2 在此实验中近似地用平均速率代替初速率: t c c kc r O S n I m O S ??-= =- - -28 2 28 20 为了能测出反应在△t 时间内S 2O 82-浓度的改变量,需要在混合(NH 4)2S 2O 8 和KI 溶液的同时,加入一定体积已知浓度的Na 2S 2O 3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应: 2S 2O 32- + I 3- === S 4O 62- + 3I - (2) 此反应几乎是瞬间完成,(1)反应比(2)反应慢得多。因此,反应(1)生成的I 3-立即与S 2O 32-反应,生成无色S 4O 62-和I -,而观察不到碘与淀粉呈现的特征蓝
色。当S 2O 32-消耗尽,(2)反应不进行,(1)反应还在进行,则生成的I 3- 遇淀粉呈蓝色。 从反应开始到溶液出现蓝色这一段时间△t 里,S 2O 32- 浓度的改变值为: )O S )O S )O S O S c c c c 始始终(((23 223 223 223 2][----=--=? 再从(1)和(2)反应对比,则得: 2 (23 2 28 2 ) O S O S c c 始--= ? 通过改变S 2O 82- 和I -的初始浓度,测定消耗等量的S 2O 82- 的物质的量浓度- ?28 2O S c 所需的不同时间间隔,即计算出反应物不同初始浓度的初速率,确定出速率方程和反应速率常数。 三、实验步骤 1.浓度对化学反应速率的影响 在室温条件下进行编号Ⅰ的实验。用量筒分别量取 L KI 溶液, LNa2S2O3溶液和 %淀粉溶液,全部注入烧杯中,混合均匀。 然后用另一量筒取 L(NH4)2S2O8溶液,迅速倒入上述混合溶液中,同时开动秒表,并不断搅拌,仔细观察。 当溶液刚出现兰色时,立即按停秒表,记录反应时间和室温。 按下表各溶液用量进行实验。 室温 ℃
2.4 测试反应快慢 知识目标: 1、翻拍手游戏中,我们会用到皮肤、眼镜等感觉器官。 2、抓尺子游戏中,我们需要用眼镜看对面同学的手势,尺子的位置,大脑判断后,命令手去抓等。 3、大多数情况下,感官都是协同作战的。 能力目标: 1、、通过“测定反应快慢”这个完整的探究活动,进一步熟练探究实验的一般 过程,提高学生的探究能力;设计实验,设计记录表格,培养学生的创新能力。 3、汇报探究方案,培养学生的语言表达能力,通过对实验结果的分析,培养学 生的综合思维能力。 情感态度价值观目标: 1、在活动过程中,发展学生合作意识,体验人与人之间的交往。培养学生的良好科学素 养。 【教学重难点】 教学重点:完成整个探究活动。 教学难点:设计记录在不同条件下的多组重复实验数据的表格及对数据的处理和 统计分 【课前准备】 1、实验用具:8支30cm长的塑料尺 2、学生准备:每人一把15cm长的塑料尺。前一节课结束时布置学生围绕“测定 【教学流程设计及分析】 一、创设情境,导入新课 1、创设游戏情境 比一比谁的反应速度快,做同学们熟知的翻拍手的游戏。 设计思想:好玩,好动是孩子的天性,通过本环节,可以使教师从学生熟悉 的事物入手,激发学生的学习兴趣,把学生的情绪、注意力和思维调节到最佳状 态。 2、创设问题情境 在刚才的游戏中,,我们的反应速度有没有快慢之分呢?反应速度的快慢又和什么因素有关呢?我们可以通过测定反应速度这个探究活动来获取答案。
设计思想:提出问题,及时把学生的注意力从游戏中收回。回到课堂学习 当中来。 二、探究实验 1、做一个“反应速度尺”玩抓尺子的游戏 2、探究过程: 1.提出问题 根据自己的兴趣提出想探究的问题。 设计思想:由于不同的学生观察问题的角度不同,提出问题的水平也不同, 教师可从中抽出一些问题做进一步的探究。 最终确定探究以下四个问题: ①抓尺子的游戏需要用到那些感觉器官? ②左右手的反应速度一样吗? ③反应速度与性别有关吗? ④反应速度与反复训练有关吗? 1.作出假设 根据自己的生活经验作出假设。 根据教师的提示结合日常生活经验学生作出如下假设: ①抓尺子游戏中,我们需要用眼镜看对面同学的手势,尺子的位置,大脑判断后,命令手去抓等。。 ②左右手的反应速度不一样。 ③反应速度与性别有关。 ④反应速度与反复训练有关,训练次数越多,反应速度越快。 (3)制定计划 让学生根据课本上的推荐的具体方法,设计完整的实验方案。并讨论以下内容: 1、材料用具(思考如何使用) 2、抓住尺子时,应怎样读取尺子上的刻度值?每次测量时,读取数值的方 法应当一样吗? 3、每个人的测量次数应该是几次? 4、人员分工(分工明确,合作愉快,提高效率) 5、记录结果是否需要设计表格?怎样设计表格? (4)实施计划
2014高考必备专题——化学反应速率和化学平衡 【考纲解读】 一、化学反应速率 1.定义:单位时间内反应物或生成物的物质的量的变化(以单位时间内反应物浓度的减少或生成物浓度的增加来表示),用来衡量化学反应进行快慢的物理量。 2.表达方式 t A c v A ??= ) (,式中Δc(A)表示物质A 的物质的量浓度的变化,单位为mol/L ,Δt 表示时间,单位为s (秒)、min (分)、h (时)。v(A)表示物质A 的化学反应速率。单位是mol/(L ·s)或mol/(L ·min)或mol/(L ·h)。 3.化学反应速率的规律 同一化学反应,用不同物质的量浓度变化变化表示的化学反应速率之比等于化学方程式中相应物质的计量数之比。这是有关化学反应速率的计算或换算的依据。如:对于化学反应:a A(g) + b B(b) = c C(g) + d D(g),则存在v(A):v(B):v(C):v(D) = a :b :c :d 。 注意:⑴化学反应速率均为正值; ⑵化学反应速率通常是指某种物质在某一段时间内化学反应的平均速率,而不是指某一时刻的瞬时速率; ⑶由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯固体和纯液体参加的反应,一般不用纯固体或纯液体来表示化学反应速率 ⑷对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其速率的值可能不同,但这些不同的数值表示的是同一个化学反应在同一段时间内的反应,所以为相同的速率。所以比较速率时不能只看速率的数值,还要说明是用那种物质表示的速率。 (5)化学反应速率大小的比较 由于同一化学反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。 ①看单位是否统一,若不统一,换算成相同的单位。 ②换算成同一物质表示的速率,再比较数值的大小。 ③比较化学反应速率与化学计量数的比值,即对于一般反应a A +b B===c C +d D ,比较v (A)a 与v (B)b ,若 v (A)a > v (B) b ,则A 表示的反应速率比B 大。 二、影响化学反应速率的因素 主要因素为内因:参加化学反应的物质的性质是决定化学反应速率的主要原因。反应的类型不同,物质的结构不同,都会导致反应速率的不同。
化学反应速率及其测定 一.化学反应速率、 1.表示方法:通常用反应物浓度的或生成物浓度的来表示 2.计算式: 3.单位:一般为或或 4.注意 ①化学反应速率只能用单位时间内的变化来表示 ②化学反应速率指的是一段时间内的,无值 ③同一个化学反应,用不同物质表示化学反应速率时,数值可能不同,但其意义相同。如aA+bB=cC+dD,有如下关系 ④比较同一反应在不同反应条件下的反应速率的大小,要 ⑤不能用或表示化学反应速率,但可以换算 【例】将化合物A的蒸气2mol充入0.5L容器中加热,发生分解反应2A(g)==B(g)+nC(g),反应到3min时,将化合物A的蒸气2mol充入0.5L容器中加热,发生分解反应2A(g)==B(g)+nC(g),反应到3min时容器中S的浓度为1.6mol/L,并测得这段时间内用C的浓度变化表示的平均反应速率为v(C)=1.2mol/(L.min). (1)求化学方程式中的计量数n的值 (2)以B的浓度变化表示该反应的平均速率 二.测量化学反应速率的常见实验方法 1.气体法 见教材P18第二段 2.颜色法 已知YYYY 现利用该反应设计实验,探究“浓度对化学反应速率的影响” #实验操作# ①取两支试管,各加入4mL0.01mol/L的高锰酸钾溶液 ②向其中一支试管加入2mL0.1mol/L的草酸溶液,记录溶液褪色的时间 ③向另外一支试管加入2mL0.2mol/L的草酸溶液,记录溶液褪色的时间 3.沉淀法 #实验操作# ①向两支试管各加入5mL0.1mol/L硫代硫酸钠溶液 ②另取两支试管,各加入5mL0.1mol/L硫酸溶液 ③将四支试管分为两组(各有一支硫酸溶液和硫代硫酸钠溶液),将其中一组试管加入冷水中,另一组试管加入热水中 ④一段时间后,分别混合搅拌。记录出现浑浊时间
生物实验报告单 姓名时间班级实验内容测定反应速度 实验目的测定自己的反应速度,比较不同学生间的反应实验用材学生用的直尺 实验过程1.同学4人一组 2.一同学手握直尺刻度最大的一端,受测者拇指和食指对准 尺子刻度为0的一端,但不要接触尺子 3.测试者一旦松开手,被受测者尽快用拇指和食指夹住尺 子,记下夹住尺子的刻度,刻度越小说明反应速度越快。 4.小组4人轮流测试 实验结果刻度为cm 分析讨论 结果和重复的次数有一定关系;结果和人的某种状态也有一定关系。
赠送资料 青花鱼(北京)健康产业科技有限公司 2018年财务分析报告 1 .主要会计数据摘要 2 . 基本财务情况分析 2-1 资产状况 截至2011年3月31日,公司总资产20.82亿元。 2-1-1 资产构成 公司总资产的构成为:流动资产10.63亿元,长期投资3.57亿元,固定资产净值5.16亿元,无形资产及其他资产1.46亿元。主要构成内容如下: (1)流动资产:货币资金7.01亿元,其他货币资金6140万元,短期投资净值1.64亿元,应收票据2220万元,应收账款3425万元,工程施工6617万元,其他应收款1135万元。 (2)长期投资:XXXXX2亿元,XXXXX1.08亿元,XXXX3496万元。 (3)固定资产净值:XXXX净值4.8亿元,XXXXX等房屋净值2932万元。 (4)无形资产:XXXXXX摊余净值8134万元,XXXXX摊余净值5062万元。 (5)长期待摊费用:XXXXX摊余净值635万元,XXXXX摊余净值837万元。 2-1-2 资产质量
(1) 货币性资产:由货币资金、其他货币资金、短期投资、应收票据构成,共计9.48亿元,具备良好的付现能力和偿还债务能力。 (2) 长期性经营资产:由XXXXX构成,共计5.61亿元,能提供长期的稳定的现金流。 (3) 短期性经营资产:由工程施工构成,共计6617万元,能在短期内转化为货币性资产并获得一定利润。 (4) 保值增值性好的长期投资:由XXXX与XXXX的股权投资构成,共计3.08亿元,不仅有较好的投资回报,而且XXXX的股权对公司的发展具有重要作用。 以上四类资产总计18.83亿元,占总资产的90%,说明公司现有的资产具有良好的质量。2-2 负债状况 截至2011年3月31日,公司负债总额10.36亿元,主要构成为:短期借款(含本年到期的长期借款)9.6亿元,长期借款5500万元,应付账款707万元,应交税费51万元。 目前贷款规模为10.15亿元,短期借款占负债总额的93%,说明短期内公司有较大的偿债压力。结合公司现有7.62亿元的货币资金量来看,财务风险不大。 目前公司资产负债率为49.8%,自有资金与举债资金基本平衡。 2-3 经营状况及变动原因 扣除XXXX影响后,2011年1-3月(以下简称本期)公司净利润605万元,与2010年同期比较(以下简称同比)减少了1050万元,下降幅度为63%。变动原因按利润构成的主要项目分析如下: 2-3-1 主营业务收入 本期主营业务收入3938万元,同比减少922万元,下降幅度为19%。其主要原因为:(1)XXXX收入3662万元,同比增加144万元,增长幅度为4.1%,系XXXXXXXXXXX 增加所致。
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告 1.概述 化学反应速率用符号J或ξ表示,其定义为: J=dξ/dt(3-1) ξ为反应进度,单位是mol,t为时间,单位是s。所以单位时间的反应进度即为反应速率。 dξ=v-1B dn B(3-2) 将式(3-2)代入式(3-1)得: J=v-1B dn B/dt 式中n B为物质B的物质的量,dn B/dt是物质B的物质的量对时间的变化率,v B为物质B的化学计量数(对反应物v B取负值,产物v B取正值)。反应速率J总为正值。J的单位是mol·s-1。 根据质量作用定律,若A与B按下式反应: aA+bB→cC+dD 其反应速率方程为: J=kc a(A)c b(B) k为反应速率常数。 a+b=n n为反应级数。n=1称为一级反应,n=2为二级反应,三级反应较少。反应级数有时不能从方程式判定,如: 2HI→I2+H2 看起来是二级反应。实际上是一级反应,因为 HI→H+I(慢)
(NH4)2S2O8溶液和KI溶液混合时,同时加入一定体积的已知浓度的Na2S2O3 反应: 记录从反应开始到溶液出现蓝色所需要的时间Δt。由于在Δt时间内 式中,{k}代表量k的数值。
可求得反应速率常数k。 根据阿伦尼乌斯公式: 率等于-E a/2.303R,通过计算求出活化能E a。 2.实验目的 (1)掌握浓度、温度及催化剂对化学反应速率的影响。 (2)测定过二硫酸铵与碘化钾反应的反应速率,并计算反应级数、反应速率常数及反应的活化能。 (3)初步练习用计算机进行数据处理。 3.实验内容 (1)实验浓度对化学反应速率的影响 在室温下,取3个量筒分别量取20ml 0.20mol·L-1 KI溶液、8.0ml 0.010 mol· L-1 Na2S2O3溶液和 4.0mL 0.2%淀粉溶液,均加到150mL 烧杯中,混合均匀。再用另一个量筒取20mL0.20mol· L-1(NH4)2S2O8溶液,快速加到烧杯中,同时开动秒表,并不断搅拌。当溶液刚出现蓝色时,立即停秒表,记下时间及室温。 用同样的方法按照表3-1中的用量进行另外4次实验。为了使每次实验中的溶液的离子强度和总体积保持不变,不足的量分别用 0.20mol·L-1 KNO3溶液和0.20mol·L-1(NH4)2SO4溶液补足。
高考总复习化学反应速率 【考纲要求】 1.了解化学反应速率的概念、反应速率的定量表示方法,会进行简单计算。 2.重点理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响规律。 【考点梳理】 要点一、化学反应速率 1.定义: 化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。 要点诠释: (1).表达式为:υ = ?c/?t。 式中:v—化学反应速率,单位mol/(L?min)、mol/(L?s)、mol/(L?h) Δc—浓度变化,单位mol/L Δt—时间,单位s、min、h (2).意义:衡量化学反应进行的快慢。 (3).不用纯固体、纯液体表示反应速率。 (4).化学反应速率为某时间段内的平均速率,不指某时刻的瞬时速率。 (5).化学反应速率须标明物质:同一反应,同样快慢。不同物质浓度变化可能不同,速率数值也就不同,但表示的意义相同。 2.化学反应速率与方程式中各物质化学计量数的关系: 同一反应中,用不同物质(气体或溶液)表示的化学反应速率比=化学计量数之比。 如:化学反应mA(g) + nB(g) = pC(g) + qD(g) v (A)∶v(B) ∶v(C) ∶v(D) = m∶n∶p∶q。 3.化学反应速率的计算格式: 依据化学方程式计算化学反应速率时可按以下格式(“三段式”)求解: (1)写出有关反应的化学方程式; (2)找出各物质的起始量、转化量、某时刻量; (3)根据已知条件列方程式计算。 例如:反应mA + nB pC 起始浓度(mol·L―1) a b c 转化浓度(mol·L―1)x nx m px m 某时刻浓度(mol / L)a-x nx b m - px c m + 4.比较反应的快慢的方法: 同一化学反应的反应速率用不同物质的浓度变化表示时,数值可能不同,比较化学反应速率的大小不能只看数值大小,而要进行一定的转化。 (1)换算成同一物质、同一单位表示,再比较数值大小。 (2)比较化学反应速率与化学计量数的比值。如aA+bB cC,即比较 (A) v a 与 (B) v b ,若 (A)(B) v v a b >,则用A表示时的反应速率比用B表示时大。 要点二、影响化学反应速率的因素 (一).内因:反应物自身的结构和性质,内因对反应速率大小起决定性作用。如金属与水
化学反应速率与活化能的测定实验报告 姓名 班级 试验时间 第 室 号位 指导教师 实验目的 1. 了解浓度、温度及催化剂对化学反应速率的影响。 2. 测定(NH 4)2S 2O 8与KI 反应的速率、反应级数、速率系数和反应的活化能。 实验原理 (NH 4)2S 2O 8和KI 在水溶液中发生如下反应: S 2O 82-(aq)+ 3I -(aq) = 2SO 42- (aq)+ I 3-(aq) (1) 这个反应的平均反应速率为 v = - 228(S O ) c t - = 228(S O )(I )kc c αβ-- 式中:v ── 反应的平均反应速率; 228(S O )c - ── t 时间内228S O -的浓度变化; 228(S O )c -,(I )c - ── 228S O -,I -的起始浓度; k ── 该反应的速率系数; ,αβ ──反应物228S O -,I -的反应级数,()αβ+为该反应的总级数。 为了测出在一定时间(t )内S 2O 82-的浓度变化,在混合(NH 4)2S 2O 8和KI 溶液的同时,加入一定体积的已知浓度的Na 2S 2O 3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生: 2S 2O 32- (aq) + I 3-(aq) ══ S 4O 62-(aq) + 3I -(aq) (2) 由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I 3-会立即与S 2O 32-反应生成无色的S 4O 62-和I -。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na 2S 2O 3一旦耗尽,由反应(1)生成的微量I 3-就会立即与淀粉作用,使溶液呈蓝色。 由反应(1)和(2)的关系可以看出,每消耗1mol S 2O 82- 就要消耗2 mol 的S 2O 32-,即 c (S 2O 82-)= 12 c (S 2O 32-) 由于在t 时间内,S 2O 32-已全部耗尽,所以c (S 2O 32-)实际上就是反应开始时Na 2S 2O 3的浓度,即 -c (S 2O 32-)= 0c (S 2O 32-) 这里的0c (S 2O 32-)为Na 2S 2O 3的起始浓度。在本实验中,由于每份混合液中Na 2S 2O 3的起始浓度都相同,因而c (S 2O 32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(t ),就可以算出一定温度下该反应的平均反应速率: v =228() c S O t - - =()2232c S O t -- = ()02232c S O t - 按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得
五、实验记录和处理 1、将实验数据记录于下表一中。 室温:24℃ 大气压:100.42KPa k0(25℃)=2.510 k∞(25℃)=0.896 k0 2、以k t对(k0-k t)/t作图,根据直线斜率求速率常数值。拟合直线见图一、图二。
k t (k 0-k t )/t 图一25℃下k t ~(k 0-k t )/t 拟合直线 注:拟合度R 2=0.99089,说明直线拟合的很好,可以用于计算。 k t (k 0-k t )/t 图二35℃下k t ~(k 0-k t )/t 拟合直线
注:拟合度R 2=0.9694,说明直线拟合地较好,可以用于计算。 (1)由图一知,直线斜率为15.70158 NaOH (分析纯):0.0832g 定容体积:100mL NaOH 浓度:0.0208mol/L 稀释后NaOH 浓度:0.0104mol/L ,即a=0.0104mol/L 。 根据推导公式: k t = ∞+-?k t k k t 0ak 1 所以,25℃时反应速率常数k=6.1238L/(mol ·min) 查阅书籍:25℃时的反应速率常数标准值为:6.4254L/(mol ·min) 因此实验测量的相对误差为:4.69% (2)由图二知,直线斜率为8.23511, a=0.0104mol/L 。 根据推导, k t = ∞+-?k t k k t 0ak 1 所以,35℃时反应速率常数k=11.6761L/(mol ·min) 查阅书籍,35℃时的反应速率常数标准值为:11.9411L/(mol ·min) 因此实验测量的相对误差为:2.2% 3、计算反应活化能。 根据Arrhenius 公式: lnk 2/k 1=E(T 2-T 1)/(RT 1T 2) 所需物理量的相关数值见表二: 表二求活化能所需物理量的相关数值 将数值代入公式,求得:E=49.29kJ/mol 将反应速率常数标准值代入公式,求得反应活化能的标准值:E=47.34kJ/mol 因此实验测量的相对误差为:4.12%
2020年高考化学试题分类汇编——化学反应速率和化 学平衡 化学反应速率和化学平稳 〔2018天津卷〕6.以下各表述与示意图一致的是 A .图①表示25℃时,用0.1 mol·L -1盐酸滴定20 mL 0.1 mol·L -1 NaOH 溶液,溶液的pH 随加入酸体积的变化 B .图②中曲线表示反应2S O 2(g) + O 2(g) 2S O 3(g);ΔH < 0 正、逆反应 的平稳常数K 随温度的变化 C .图③表示10 mL 0.01 mol·L -1 KM n O 4 酸性溶液与过量的0.1 mol·L -1 H 2C 2O 4溶液混合时,n(Mn 2+) 随时刻的变化 D .图④中a 、b 曲线分不表示反应CH 2=CH 2 (g) + H 2(g)??→C H 3C H 3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 解析:酸碱中和在接近终点时,pH 会发生突变,曲线的斜率会专门大,故A 错;正逆反应的平稳常数互为倒数关系,故B 正确;反应是放热反应,且反应生成的Mn 2+对该反应有催化作用,故反应速率越来越快,C 错;反应是放热反应,但图像描述是吸热反应,故D 错。 答案:B 命题立意:综合考查了有关图像咨询题,有酸碱中和滴定图像、正逆反应的平稳常数图像,反应速率图像和能量变化图像。 〔2018重庆卷〕10.()()()22COCl g CO g +Cl g ;0.H ??→?←??> 当反应达到平稳时,以下措施:①升温 ②恒容通入惰性气体 ③增加CO 的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl 2转化率的是 A .①②④ B .①④⑥ C .②③⑥ D .③⑤⑥ 10. 答案B
一、 化学反应速率 1.表示方法 通常用单位时间内反应物浓度的________或生成物浓度的________来表示。 2.数学表达式及单位 v =__________,单位为mol ·L -1·min -1或mol ·L -1·s -1。 3.规律 同一反应在同一时间内,用不同物质来表示的反应速率可能________,但反应速率的数值之比等于这些物质在化学方程式中的________________之比。 归纳:(1)固体或纯液体的浓度视为定值,因此不用固体或纯液体表示反应速率。 (2)计算反应速率时,若给出的是物质的量的变化值,不要忘记转化为物质的量浓度的变化值。 (3)化学反应速率大小的比较 由于同一化学反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。 ①看单位是否统一,若不统一,换算成相同的单位。 ②换算成同一物质表示的速率,再比较数值的大小。 ③比较化学反应速率与化学计量数的比值,即对于一般反应a A +b B===c C +d D ,比较 v (A)a 与v (B)b ,若v (A) a >v (B) b ,则A 表示的反应速率比B 大。 巩固练习 1.反应2SO 2(g)+O 2(g)催化剂 △2SO 3(g)经一段时间后,SO 3的浓度增加了0.4 mol ·L -1 ,在这段时间内用O 2 表示的反应速率为0.04 mol ·L -1 ·s -1 ,则这段时间为__________。 2.对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是 ( ) A .v (A)=0.5 mol ·L -1·min -1 B .v (B)=1.2 mol ·L -1·s -1 C .v (D)=0.4 mol ·L -1 ·min -1 D .v (C)=0.1 mol ·L -1 ·s -1 3.已知反应4NH 3+5O 2 4NO +6H 2O ,若反应速率分别用v (NH 3)、v (O 2)、v (NO)、v (H 2O)表示,则下列正确的关系是 ( ) A.4 5v (NH 3)=v (O 2) B.56v (O 2)=v (H 2O) C.2 3 v (NH 3)=v (H 2O) D.4 5 v (O 2)=v (NO) 二、 影响化学反应速率的因素 1.内因(主要因素):反应物本身的__________。 2.外因(其他条件不变,只改变一个条件)
高考化学化学反应速率与化学平衡综合题含答案(1) 一、化学反应速率与化学平衡 1.某小组同学对FeCl3与KI的反应进行探究。 (初步探究)室温下进行下表所列实验。 (1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。 (2)写出实验Ⅰ反应的离子方程式:_____________________________________。 (3)上述实验现象可以证明Fe3+与I?发生可逆反应,实验Ⅰ在用量上的用意是__________ (4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释) _________________________________________________________。 (深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。 (5)已知在酸性较强的条件下,I?可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I?氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验: ____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。 噲?2Fe2++I2使KI过量,再检验是否有Fe3+,以证明该反【答案】铁氰化钾 2Fe3++2I?垐? 应为可逆反应下层呈紫色,上层呈浅绿色用CCl4萃取碘以后,使平衡右移,Fe3+浓度更小,与SCN-的反应不明显向试管中加入5ml 0.1mol/L的KI溶液和1-2滴淀粉溶液,加酸调pH=5,钟后观察现象碘离子浓度过小,氢离子浓度过小(合理即可) 【解析】 【分析】 (1) 在含有Fe2+ 的溶液中滴加铁氰化钾溶液有蓝色沉淀生成; (2) Fe3+与I-发生氧化还原反应生成碘单质; (3) 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1mol?L-1KSCN溶液溶液呈红色,实验Ⅰ滴入几滴反应后仍含铁离子; (4)I2易溶于CCl4;减小生成物的浓度,平衡会向正反应方向移动。 (5) 已知在酸性较强的条件下,I-可被空气氧化为I2,设计实验可以在酸性弱的条件下观察反应现象分析判断,导致溶液不变蓝的因素可逆是碘离子浓度和氢离子浓度低的原因。【详解】 (1) 取实验Ⅰ反应后溶液适量,向溶液中滴加铁氰化钾溶液有蓝色沉淀生成,说明所得溶液
《测定反应速度》探究实验教学设计 知识目标: 1、说出探究的一般过程。 2、理解复杂反射的建立过程。 能力目标: 1、提出有关反应速度的问题,制定并实施探究计划。 2、通过“测定反应速度”这个完整的探究活动,进一步熟练探究实验的一般 过程,提高学生的探究能力;设计实验,设计记录表格,培养学生的创新能力。 3、汇报探究方案,培养学生的语言表达能力,通过对实验结果的分析,培养学生的综合思维能力。 情感态度价值观目标: 1、在活动过程中,发展学生合作意识,体验人与人之间的交往。培养学生的良好科学素养。 2、通过实验结果:反应速度随实验次数增加的现象,认同“勤能补拙”的道理。从而养成良好地生活习惯和学习习惯。 【教学重难点】 教学重点:完成整个探究活动。 教学难点:设计记录在不同条件下的多组重复实验数据的表格及对数据的处理和统计分 【课前准备】 1、实验用具:8支30cm长的塑料尺 2、学生准备:每人一把15cm长的塑料尺。前一节课结束时布置学生围绕“测定 反应速度”作探究设计。要求按探究实验的全过程完成设计方案。 【教学流程设计及分析】 一、创设情境,导入新课 1、创设游戏情境 比一比谁的反应速度快,做同学们熟知的相反动作的游戏:“摸左耳”、“举 右手”、“左手摸右耳”等。 设计思想:好玩,好动是孩子的天性,通过本环节,可以使教师从学生熟悉 的事物入手,激发学生的学习兴趣,把学生的情绪、注意力和思维调节到最佳状
态。 2、创设问题情境 在刚才的游戏中,当我喊出口令时,不管你做的对与否,大家都很快做出了 反应,那么,我们的反应速度有没有快慢之分呢?反应速度的快慢又和什么因素有关呢?我们可以通过测定反应速度这个探究活动来获取答案。 设计思想:提出问题,及时把学生的注意力从游戏中收回。回到课堂学习 当中来。 二、探究实验 1、让学生回顾七年级上册学过的探究的基本过程:提出问题→作出假设→ 订计划(讨论并完善计划)→实施计划→得出结论→表达和交流。 设计思想:引导学生回顾旧知,利用旧知解决新问题。 2、探究过程: 1.提出问题 根据自己的兴趣提出想探究的问题。 设计思想:由于不同的学生观察问题的角度不同,提出问题的水平也不同, 教师可从中抽出一些问题做进一步的探究。 最终确定探究以下四个问题: ①反应速度与尺子的长短有关吗? ②左右手的反应速度一样吗? ③反应速度与性别有关吗? ④反应速度与反复训练有关吗? 1.作出假设 根据自己的生活经验作出假设。 根据教师的提示结合日常生活经验学生作出如下假设: ①反应速度与尺子的长短有关。 ②左右手的反应速度不一样。 ③反应速度与性别有关。 ④反应速度与反复训练有关,训练次数越多,反应速度越快。 (3)制定计划 让学生根据课本上的推荐的具体方法,设计完整的实验方案。并讨论以下内容:1、材料用具(思考如何使用)