
无机化学习题参考答案(II)
第一章
1.4.解:
(1)H 2O 2?
2C
? (2)S 2O 32-
3v C
(3)N 2O ?(N -N-O 方式)?v C ∞? (4)Hg 2Cl 2?
h D ∞
(5)H 2C=C=CH 2 2d D
(6)UOF4?? C 5v (7)B F4-??
d T ?
(8)SClF 5
?
4v C
(9)反-P t(NH 3)2Cl 2?2h D ? ? (10)PtCl 3(C 2H4)- 2v C
1.B(CH 3)3和BCl 3相比,哪一个的Lew is 酸性强,为什么?
一般来说,C H3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH3)3不溶于水,在空气中易燃)
2.BH 3和BF3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
P
F
F
H 3CH 3
P
F F H 3CH 3
B B
H 3F 3
(该题可参考史启桢等翻译的"无机化学",作者Shri ve r等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)
3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?
配位饱和(6配位),失去L ewis 酸性
4. 吸水后失效 的A lCl 3有什么方法可以脱水?
因为A l3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HC l,NH 4C l,SO Cl 2等气氛下加热脱水。(只能加强热生成 Al 2O3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
第二章
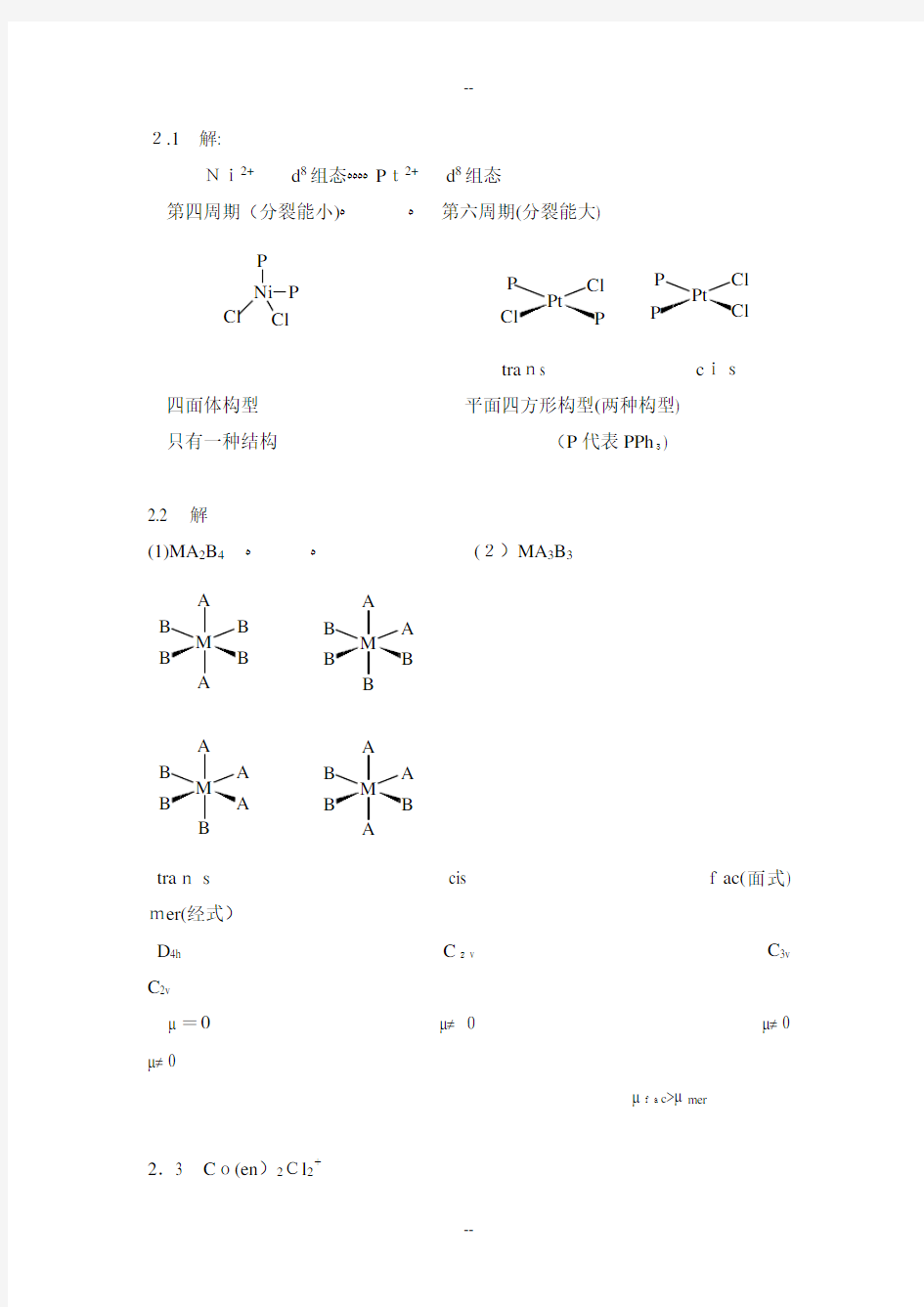
2.1 解:
Ni2+ d 8组态???? P t2+ d 8组态 第四周期(分裂能小)?
? 第六周期(分裂能大)
P Ni Cl
P Cl
Pt
Cl
Cl P P
tra ns c is
四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)
2.2 解 (1)MA 2B 4 ?
? (2)MA 3B 3
M A B
B M A A B
M A B
A
B M A A
A B
tra ns cis fac(面式) mer(经式) D 4h
C 2v
C 3v
C 2v
μ=0 μ≠0 μ≠0 μ≠0
μfac >μmer
2.3 C o(en )2Cl 2+
D2h???C2光活异构体?C2
Co(en)2(NH3)Cl2+
3
3
H
trans cis
Co(en)(NH3)2Cl2+
3
Cl
3
3
3
NH
NH3
3
trans(1) trans(2)
cis
2.4Co(en)33+??Ru(bipy)32+??手性分子
D3??D3
PtCl(dien)+
dien
HN
CH2
CH2CH2NH
2
NH2
CH2
基本上为平面分子,无手性
2.5(1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
(2)等物质量的异构体中分别加入过量AgNO3,产生少量沉淀(1molAgCl↓)的为前者(摩尔比为2:1),产生大量沉淀(2molAgCl↓)的为后者。
或用电导方法测量,前者和后者的电导比为2:3
(3)[Co(H2O)4Cl2]+
顺式C2v、反式D4h,对称性不同,偶极矩不同,可以用物理方法鉴别,例如红外或Raman光谱不同。
2.68个CN -基团在化合物中的化学环境是完全等同的,可能的结构是四方反棱柱和四方棱柱构型,不可能是12面体(D2d点群),实验证明是四方反棱柱。2.7根据HSAB的协同作用(symbiotic)原理,软配体可使中心金属变软,反之亦然,CN是软配体,NH3是硬配体。桥连配体NCS中S比N软,因此分子结构为:
(H3N)5Co-NCS-Co(CN)5
2.8同上题,桥连配体NC中C比N软,因此,分子结构为:
Co(NH3)5-NC-Co(CN)5
2.9 AgO晶体中的Ag(Ⅱ)实际上是Ag(Ⅰ)和Ag(Ⅲ)混合而成,
d10的Ag(I)为sp杂化,直线型
d8的Ag(Ⅲ)倾向dsp2杂化,以获得更多的晶体场稳定化能,因此为平面四方。
COLICSDCollection Code 202055
DATE Recorded Dec19, 1988; updated Aug 1, 1989
NAME Silver(I,III) oxide - tetragonal
FORMAg O
= Ag O
TITLStructure and magneticproperties of tetragonal Silver(I,III)
oxide Ag O
REF Journal of Solid State Chemistry
JSSCB 65 (1986) 225-230
REFJournal of Solid State Chemistry
JSSCB 68 (1987)380
AUTYvon K, BezingeA, Tissot P, FischerP
CELL a=6.883(3) b=6.883(3) c=9.122(4)?90.0 ?90.0 ?90.0 V=432.2 Z=16
SGR I 41/a Z (88)- tetragonal
CLAS 4/m (Hermann-Mauguin) -C4h (Schoenflies)
PRS tI32
ANX ABX2
PARMAtom__No OxStat Wyck -----X----- -----Y----- -----Z
----- -SOF-
Ag 1 3.000 8c0.0. 0.
Ag 2 1.000 8d 0. 0. 1/2 O 1 -2.000 16f 0.0798(3) 0.0130(5) 0.2128(3) WYCK f d c
ITF Ag 1 U=0.0168(8)
ITFAg 2 U=0.0058(6)
ITF O 1 U=0.0066(4)
REM NDP (neutron diffraction from a powder)
RVAL 0.066
2.10 Mn(CO)5(NO)
(1)C4v
(2)Co(PPh2Me)2(NO)Cl2
C2vC2v C1C1 (对映体的点群不变,未给出)
(3)[Fe(CO)
4
(CN)]-
C2vC3v
(4)Ni(PPhMe
2
)2Br3
C2vCsD3h (5)Ru(PPh3)3Cl
2
D
3h
C s C2v (6)VOCl4
2-
C3v C2v
?第三章习题
3.1 3-
6
Fe(CN)??3+
26
Fe(H O)
3+
Fe为d5,CN--强场配体?H2O为弱场配体
∴3-
6
Fe(CN)为LS???3+
26
Fe(H O)为HS
有一个未成对电子有五个未成对电子
d8Ni(CN)42-NiCl42-
?CN--强场LS Cl--弱场HS
??平面四方??四面体
3.2Ni2+为d8组态第四周期
Pt2+为d8组态,第六周期
按照g f ?=???g 为金属离子的性属,周期数越高,g 因子越大
∴Pt 2+的g 因子大于N i2+的g 因子。
?( PtC l42-) > ? (NiCl 42-)
分裂能?大,容易形成平面四方构型,?小,则为四面体构型 3.5
(1)2p 1
L =1, 1
2
S =
, 基谱项 2P (2)2p 2? L =1, S=1, 基谱项 3P
(3)2d 1??L =2, 1
2
S =
, 基谱项 2D (4)2d3 ?L=3, 3
2S =, 基谱项 4F
(5)3d 5??L=0, 5
2
S =, 基谱项 6S
(6)3d 9? 与3d 1类似 L =2, 1
2S =, 基谱项 2D
3.6 CoF 63-中,Co 3+的电子组态为d 6,高自旋(弱场配体)
∴在T-S 图中,允许在跃迁是5T 2g →5E g ,只有一个吸收带。 3.7 1017600cm -?=? ?1918cm B -= Cr(H 2O)63+中Cr 3+为d3组态 从T-S 图上得到:
可能的两个允许跃迁为4A2→4T 2 4A 214T →
0/17600/91819.2B ?==
在横轴上找到19.2的点,作垂线与4T 2和4T 1分别相交于E/B=28.5和E/B=19.5两点。
∴E 1/B=28.5 ?E 1=28.5×918=26200(cm -1) E 2/B=19.5? E 2=19.5×918=17901(c m-1) 3.8 (1)L S?Rh(NH 3)63+??
d 6组态 强场
1
A 1g
(2)Ti (H 2O)63+??d 1
2
T 2g
(3)Fe(H 2O)63+
d 5??HS,弱场
6
A1g
3.9 CrL 6??d 3
?
LMCT 光谱
(a )4A 2g →4T 2g (4F)(低能量峰)
4
A 2g→4T 1g (4F)(高能量峰)
(b ) e n?ox 2- F-
??????→ 配位场强度减弱
F -的配位场强度最弱,在T-S图中偏左,∴有可能得4A 2g →4T1g (4P)的跃迁 3.10 Mn 2+为d 5,H 2O为弱场配体
d 5弱扬,基谱项为六重态的6A 1,而高能级谱项中没有相应的六重态谱项,∴没有自旋允许的跃迁。
Cr(aq )3+为d 3,弱场
允许的电子跃迁有4A 2→4T 1,4A 2→T 1,吸收光谱在能量较低的可见光区,∴有色。
3.11 d 2组态的金属含氧酸根离子
+4 +5 +6 +6 CrO 44-, M nO 43-,FeO 42-和RuO 42-, 四周期 四周期 四周期 五周期 氧化态和所在周期的位置对下列性质有影响 (1)RuO 42-的t ?最大,Cr O44-的t ?最小。
(2)Fe O42-有最短的M-0键,∵Fe(Ⅵ)离子半径最小
r Fe(Ⅵ)< r Mn(Ⅴ)< r C r(Ⅳ) (3)是LMCT
?第四章习题
4.1 进入基团y 不同而反应速率相同,说明反应与y无关,速控步为离去基团的解离,因此反应属于S N 1反应,即离解机理,或D机理。 4.2
Cl
Cl
Cl
Pt
2
Cl NH3
NO
2
H3
Cl
Cl
Pt
Cl
Pt
Cl
cis
trans
-
-
∵反位效应的顺序为:NO2->Cl->NH3
4.3
(1)
PR3
PR3
PR3PR
3
PR
3
Cl
Cl
-Cl-PR3
PR
Cl
cis
2++
cis- PtCl2(PR3)2反位效应PR3>Cl-
(2) .trans-PtCl2(PR
3)2反位效应PR3>
Cl-
Cl
Cl Cl PR
3
Cl PR3
PR3PR
3
trans
2--
反位效应PR3>Cl-
(3)
py
Cl-
3
3
NH3
Cl
Pt
NH3
Cl
Pt
+
∵反位效应Cl->NH3≥py
4.5速率=k1[Au(dien)Cl2+]+k2[Au(dien)Cl2+][Cl*-]
取代反应中存在两种机理①前一项表示S
N
1反应,即单分子反应的离解机理,②后一项表示双分子取代的缔合机理。
注:k1通常溶剂合作用的过程,表现为离解机理
(1)
Cl
N
Cl
N
+2
* S Cl*
-S
-Cl-
+2(2)
Cl
N
Cl
N
+2*
Cl*-Cl
-+2
4.62+2+3+3+3+
2626363636
Mn(H O) > Ni(H O) > Ir(NH) > Rh(NH) > Co(NH)活性逐渐减小
d5(HS) ? d8?d6(LS) d6(LS) ?d6(LS)