
选修①《化学与生活》第二章 班级姓名_____________ 一.选择题。 1.下列关于水的说法正确的是 A、我们平时应多饮用很纯净的水,防止有毒物质进入体内 B、所有天然水都不能饮用 C、人体内含有约2/3体重的水,故人每天不用喝水也可 D、人类可利用的水只占自然界的水极少量,我们应节约用水 2.关于食物的酸碱性说法错误的是 A、蛋白质在体内经消化后生成碳酸.硫酸.尿酸等,故它属于酸性食物 B、葡萄吃起来是酸的,故它属于酸性食物 C、食物的酸碱性与化学上所指溶液的酸碱性不同的 D、正常人的人体内体液PH总保持恒定. 3.下列物质既可以做防腐剂,又可以做调味剂的是 A、食盐 B、苯甲酸钠 C、柠檬黄 D、味精 4.下列做法正确的是 A、为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 B、为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 C、食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 D、为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果. 5.阿司匹林又名乙酰水杨酸,推断它不应具有的性质 A、与NaOH溶液反应 B、与金属钠反应 C、与乙酸发生酯化反应 D、与乙醇发生酯化反应 6.下列物质不可作防腐剂的是 A、食盐 B、醋 C、二氧化硫 D、花生油 7.下列关于食品添加剂的说法不正确的是 A、亚硝酸钠可以致癌 B、我们应该禁止使用防腐剂
C、苯甲酸钠可以作雪碧饮料的防腐剂 D、绝大多数食品添加剂在过量使用时对人体有害的 8.下列关于药物的使用说法正确的是 A、虽然药物能治病,但大部份药物有毒副作用 B、使用青霉素时,不用进行试验直接静脉注射 C、长期大量使用阿司匹林可预防疾病,没有副作用 D、我们生病了都可以到药店自己买药吃,不用到医院 9.下列物质既能与酸反应,又能与碱反应的是 A、Mg(OH)2 B、CaCO3 C、Na2CO3 D、Al(OH)3 10.下列说法正确的是 A、绿色食品就是指颜色为绿色的食品 B、白色污染是指白色的废弃物的污染 C、有机食品是指含有有机物的食品 D、食盐加碘实质是在食盐中加入KIO3 11.长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是 A.冰毒、黄连素 B.海洛因、黄连素 C.大麻、摇头丸 D.黄曲霉素、尼古丁 12.青霉素是下面哪位科学家发现的 A、钱恩 B、弗莱明 C、诺贝尔 D、柯尔贝 13.某同学胃酸过多,他应该用下列哪种药品治疗 A、阿司匹林 B、青霉素 C、麻黄素 D、胃舒平 14.下列同学饮食习惯科学的是 A、多吃肉,少吃蔬菜水果 B、合理摄入糖类.油脂等,注意膳食平衡 C、为防止变胖,炒菜时不放油 D、多饮用纯净水,少饮用矿泉水 15.碘酒是一种常用的外用消毒药,关于它的消毒原理说法正确的是 A.溶解细菌B、氧化细菌,使蛋白质变性 C、使细菌缺氧而死 D、使细菌缺水而死
选三第一章练习题 1.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( ) A.半导体材料砷化镓 B.吸氢材料镧镍合金 C.透明陶瓷材料硒化锌 D.超导材K3C60 2、某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为() A. 24 B. 18 C. 19 D. 29 3.有关核外电子运动规律的描述错误的是() A.核外电子质量很小,在原子核外作高速运动 B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动 D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多 4、下列说法中正确的是() A. 因为p轨道是“8”字形的,所以p的电子走“8”字形 B. K能级有3S,3P,3d,3f四个轨道 C. 氢原子只有一个电子,故氢原子只有一个轨道 D. 以上说法均不正确 5、同主族两种元素原子的核外电子数的差值可能是() A. 6 B. 12 C. 26 D. 30 6、已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是() A. n=m+1 B. n=m+10 C. n=m+11 D. n=m+25 7、X、Y、Z三种元素的原子,其最外层电子排布分别为nS1、3S23P1和2S22P4,由这三种元素组成的化合物的化学式可能为() A. XYZ2 B. X2YZ3 C. X2YZ2 D. XYZ3 8.气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( ) A.1s22s22p63s23p2→1s22s22p63s23p1 B.1s22s22p63s23p3→1s22s22p63s23p2 C.1s22s22p63s23p4→1s22s22p63s23p3 D.1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1 9.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为() ①a-4②a-5③a+3 ④a+4 A.①④B.②③C.①③D.②④ 10.下列电子排布图中能正确表示某元素原子的最低能量状态的是(D) 11.下列各组表述中,两个微粒不属于同种元素原子的是() A.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子 B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子 C.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
化学选修三第二章二节习题(附答案) 1、下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( ) A、NH4Cl=NH3↑+ HCl↑ B、NH3+CO2+H2O=NH4HCO3 C、2NaOH+Cl2=NaCl+NaClO+H2O D、2Na2O2+2 CO2=2Na2CO3+O2 2.下列分子或离子中,含有孤对电子的是()A.H2O B.CH4C.SiH4D.NH4+ 3、σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p 轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s 轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是() A.H2 4.有关乙炔分子中的化学键描述不正确的是() A.两个碳原子采用sp杂化方式B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子形成两个π键5.在乙烯分子中有5个σ键、一个π键,它们分别是() A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键 D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 6、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为() A、直线形式上 B、平面正方形 C、正四面体形 D、正八面体形 7.有关苯分子中的化学键描述正确的是() A.每个碳原子的sp2杂化轨道中的其中一个形成大π键 B.每个碳原子的未参加杂化的2p轨道形成大π键 C.碳原子的三个sp2杂化轨道与其它形成三个σ键 D.碳原子的未参加杂化的2p轨道与其它形成σ键 8.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是()A.PCl3分子中三个共价键的键长,键角都相等B.PCl3分子中的P-Cl键属于极性共价键C.PCl3分子中三个共价键键能,键角均相等D.PCl3中磷原子是sp2 D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展 9.下列说法正确的是() A.π键是由两个p电子“头碰头”重叠形成的 B.σ键是镜像对称,而π键是轴对称 C.乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键 分子中含σ键,而Cl2分子中还含有π键 10、.在BrCH=CHBr分子中,C—Br键采用的成键轨道是() —p —s —p —p 11.下列物质的杂化方式不是sp3杂化的是() 12.下列说法正确的是() A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数 B.离子化合物中只有离子键,共价化合物中只有共价键 C.铵根离子呈正四面体结构 D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键
新人教版选修(4)全册教案 绪言 一学习目标:1学习化学原理的目的 2:化学反应原理所研究的范围 3:有效碰撞、活化分子、活化能、催化剂二学习过程 1:学习化学反应原理的目的 1)化学研究的核心问题是:化学反应2)化学中最具有创造性的工作是:设计和创造新的分子3)如何实现这个过程? 通常是利用已发现的原理来进行设计并实现这个过程,所以我们必须对什么要清楚才能做到,对化学反应的原理的理解要清楚,我们才能知道化学反应是怎样发生的,为什么 有的反应快、有的反应慢,它遵循怎样的规律,如何控制化学反应才能为人所用!这就是 学习化学反应原理的目的。 2:化学反应原理所研究的范围是1)化学反应与能量的问题2)化学反应的速率、方向及限度的问题3)水溶液中的离子反应的问题4)电化学的基础知识3:基本概念 1)什么是有效碰撞?引起分子间的化学反应的碰撞是有效碰撞,分子间的碰撞是发生化学反应的必要条件,有效碰撞是发生化学反应的充分条件,某一化学反应的速率大小与,单位时间内有效碰撞的次数有关2)什么是活化分子?具有较高能量,能 够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。3)什么是活化能?活化分子高出反应物分子平均能量的部分是活化能,如图 活化分子的多少与该反应的活化能的大小有关,活化能的大小是由反应物分子的性质决定,(内因)活化能越小则一般分子成为活化分子越容易,则活化分子越多,则单位时间内有效碰撞越多,
则反应速率越快。4)什么是催化剂?催化剂是能改变化学反应的速率,但反应前后本身性质和质量都不改变的物质,催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率.反应速率大幅提高. 5)归纳总结:一个反应要发生一般要经历哪些过程? 1、为什么可燃物有 氧气参与,还必须达到着 火点才能燃烧?2、催化剂在我们技术改造和生产中,起关键作用,它主要作用是提高化学反应速率,试想一下为什么催化剂能提高反应速率? 第一节化学反应与能量的变化(第一课时) 一学习目标:反应热,焓变 二学习过程 1:引言:我们知道:一个化学反应过程中,除了生成了新物质外,还有 思考 1、你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗? 活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应 反应物具有的总能量> 生成物具有的总能量 2、你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗?
第二章检测题 (时间:50分钟分值:100分) 一、单选题(本题包括40个小题,每小题2分,共80分,每小题只有一个选项符合题意) 1.下列物质不能作为食品添加剂的是( ) A.甲醇 B.食盐 C.柠檬酸D.苯甲酸钠 解析:甲醇有毒,不能作为食品添加剂。 答案:A 2.下列有关食谱的说法错误的是( ) A.营养学家编制的食谱对每个人都适用 B.每一种食物含有多种营养素,每种营养素又存在于多种食物中,因此对营养素的摄取应综合考虑 C.靠不吃或少吃食物来减肥有害健康 D.编制好的食谱不可以永久使用 解析:不同的人有不同的情况,不同的人不能使用同一份食谱,故A错误;B正确;靠不吃或少吃食物来减肥有害健康,因为摄入的营养素无法达到人体生理活动的需要,故C 正确;由于年龄、体重、活动量的不同,不同时期需要的营养素是不同的,所以一份食谱不能永远使用,要进行适当的调节,故D正确。 答案:A 3.商品类“纯净水”“太空水”“蒸馏水”等作为日常饮用水,因缺少某些成分而不利于儿童身体健康。你认为制备上述商品类饮用水时还需要添加的化学物质是( ) A.钙、镁的碳酸氢盐B.含碘酸钾的食盐 C.漂白粉D.小苏打 解析:人体必需元素钙的来源之一就是饮用水,当身体缺钙时会出现抽搐等症状,长期饮用纯净水会缺少某些无机盐离子,对身体无益。 答案:A 4.从毒韭菜到炸鸡翅、从速溶茶到儿童奶粉,关于食品质量的报道中不断有①“致癌农药”,②“苏丹红”,③“碘元素”,④“亚硝酸盐”等化学名词出现。上述化学名词所提到的物质中,在某食品添加剂中允许含有且符合限量时不会引起中毒的是( ) A.②③④B.②③ C.③④D.只有③
第三节分子的性质 知识梳理 1.键的极性和分子的极性: (1)键的极性是指共用电子对所处位置与成键原子连线的中点是否重合:一般情况下同种原子之间形成,不同种原子之间形成。 (2)分子的极性是指;可以通过正负电荷中心是否重合来判断:极性分子是指,非极性分子是指。 对于AB n型分子:可以根据A元素化合价的绝对值与族序数是否相等来判断,相等的是非极性分子, (3)键的极性和分子的极性的关系:只含非极性键的分子是非极性分子(O3除外),只含极性键的分子是极性分子,极性分子中含有极性键。 2.范德华力及其对物质性质的影响: 范德华力是指,其强度比化学键。 一般来讲,具有组成和结构相似的分子,相对分子质量越大,范德华力越大,越高。 3.氢键及其对物质性质的影响: (1)氢键是。(2)氢键通常用表示。 (3)氢键可以存在于,也可存在于;形成能使某些物质的熔、沸点升高。 4.物质的溶解性及其影响因素: (1)分子极性:相似相溶原理 (2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。例如,乙醇与 水能互溶;戊醇与水不能互溶,但与己烷能互溶。 (3)氢键:溶质与溶剂分子之间若能形成分子间氢键,则会增大溶解度。 (4)反应性:溶质若能与溶剂发生反应,则会增大溶解度。 5.手性: 判断方法是:。 6.无机含氧酸分子的酸性: (1)一般地,无机含氧酸分子中能够电离成H+的H原子都是与O原子直接相连的(即羟基氢),不与O原子
相连的H原子一般不能电离。 (2)大多数无机含氧酸的通式可以写成(HO)m RO n的形式,非羟基氧的个数n越大,酸性越强。 ①同一元素的不同价态含氧酸,R的价态越高,酸性越强。 ②成酸元素R不同时,非羟基氧数n越大,酸性越强;n相同,酸性相近。 思维导航 【例1】Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题: (1)请在以下空格内画出这两种固体分子的几何构型图: 淡黄色固体:,黄绿色固体: (2)淡黄色固体物质是由组成,黄绿色固体物质是由 组成(填“极性分子”或“非极性分子”) (3)黄绿色固体在水中溶解度比淡黄色固体大,原因是。 【解析】可以类比确定甲烷的空间结构的方法来处理。Pt(NH3)2Cl2如果是平面正方形,就有两种不同结构,如果是正四面体,就只有一种结构。 答案:(1) (2)非极性分子;极性分子 (3)水分子是极性分子,而黄绿色固体的分子也是极性分子,根据相似相溶原理可知黄绿色固体在水中的溶解度应比淡黄色固体大 【例2】利用相关结构理论,画出平面型分子C2N2和N2F2的空间构型,并确定其极性。 分析:先根据C、N、F原子的最外层单电子数画出它们的电子式: 再确定C和N的杂化形式: C2N2分子中的C采用的是sp杂化,分子是线型结构 正负电荷中心重合,是非极性分子。 N2F2分子中的N采用的是sp2杂化,分子是平面三角型结构,有如下图A、B两种结构。若为A,正负电荷中心重合是非极性分子,若为B,正负电荷中心不重合是极性分子。 【例3】含氧酸可表示为:(HO)m RO n,酸的强度与酸中的非羟基氧原子数n有关,n越大其酸性越强。一般情况下 3333 (1)写出两种酸的结构式:、。 (2)亚磷酸是元酸,写出它和过量的NaOH反应的方程式. (3)次磷酸是一种一元酸,化学式为H3PO2,它的结构为:。 【解析】根据酸的相对强弱规律确定分子中非羟基氧的个数,根据成酸元素的价键确定其结构,根据—OH
课题:第一章认识有机化合物 第一节有机化合物的分类 教学目的 知识 技能 1、了解有机化合物常见的分类方法 2、了解有机物的主要类别及官能团 过程 方法 根据生活中常见的分类方法,认识有机化合物分类的必要性。利用投影、动画、多媒体等教学手段,演示有机化合物的结构简式和分子模型,掌握有机化合物结构的相似性。价值观体会物质之间的普遍联系与特殊性,体会分类思想在科学研究中的重要意义 重点了解有机物常见的分类方法;难点了解有机物的主要类别及官能团 板书设计第一章认识有机化合物 第一节有机化合物的分类 一、按碳的骨架分类 二、按官能团分类 教学过程 [引入]我们知道有机物就是有机化合物的简称,最初有机物是指有生机的物质,如油脂、糖类和蛋白质等,它们是从动、植物体中得到的,直到1828年,德国科学家维勒发现由无机化合物通过加热可以变为尿素的实验事实。我们先来了解有机物的分类。 [板书]第一章认识有机化合物 第一节有机化合物的分类 [讲]高一时我们学习过两种基本的分类方法—交叉分类法和树状分类法,那么今天我们利用树状分类法对有机物进行分类。今天我们利用有机物结构上的差异做分类标准对有机物进行分类,从结构上有两种分类方法:一是按照构成有机物分子的碳的骨架来分类;二是按反映有机物特性的特定原子团来分类。[板书]一、按碳的骨架分类 链状化合物(如CH 3-CH 2 -CH 2 -CH 2 -CH 3 ) (碳原子相互连接成链) 有机化合物 脂环化合物(如)不含苯环 环状化合物 芳香化合物(如)含苯环 [讲]在这里我们需要注意的是,链状化合物和脂环化合物统称为脂肪族化合物。而芳香族化合物是指包含苯环的化合物,其又可根据所含元素种类分为芳香烃和芳香烃的衍生物。而芳香烃指的是含有苯环的烃,其中的一个特例是苯及苯的同系物,苯的同系物是指有一个苯环,环上侧链全为烷烃基的芳香烃。除此之外,我们常见的芳香烃还有一类是通过两个或多个苯环的合并而形成的芳香烃叫做稠环芳香烃。 [过]烃分子里的氢原子可以被其他原子或原子团所取代生成新的化合物,这种决定化合物特殊性质的原子或原子团叫官能团,下面让我们先来认识一下主要的官能团。
(人教版)高中化学选修四(全册)最全考点汇总(打印版) 考点1 用盖斯定律进行有关反应热的计算 【考点定位】本考点考查用盖斯定律进行有关反应热的计算, 巩固对盖斯定律的理解, 提升应用盖斯定律解决问题的能力, 重点是灵活应用盖斯定律. 【精确解读】 1.内容:化学反应不管是一步完成还是分几步完成, 其反应热是相同的;即化学反应热只与其反应的始态和终态有关, 而与具体反应进行的途径无关; 2.应用: a.利用总反应和一个反应确定另一个反应的热效应; b.热化学方程式之间可以进行代数变换等数学处理; 3.反应热与键能关系 ①键能:气态的基态原子形成1mol化学键释放的最低能量.键能既是形成1mol化学键所释 放的能量, 也是断裂1mol化学键所需要吸收的能量. ②由键能求反应热:反应热等于断裂反应物中的化学键所吸收的能量(为“+”)和形成生成 物中的化学键所放出的能量(为“-”)的代数和.即△H=反应物键能总和-生成物键能总和=∑E反-∑E生 ③常见物质结构中所含化学键类别和数目:1mol P4中含有6mol P-P键;1mol晶体硅中含 有2mol Si-Si键;1mol金刚石中含有2molC-C键;1mol二氧化硅晶体中含有4mol Si-O 键. 【精细剖析】 1.盖斯定律的使用方法:
①写出目标方程式; ②确定“过渡物质”(要消去的物质); ③用消元法逐一消去“过渡物质”. 例如: ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1 ②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2 ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3 求反应FeO(s)+CO(g)=Fe(s)+CO2(g)△H4的焓变 三个反应中, FeO、CO、Fe、CO2是要保留的, 而与这四种物质无关的Fe2O3、Fe3O4要通过方程式的叠加处理予以消去, 先②+③×2-①×3先消除Fe3O4, 再消除Fe2O3, 得到④6Fe(s)+6CO2(g)=6FeO(s)+6CO(g)△H5, ④逆过来得到 ⑤6FeO(s)+6CO(g)=6Fe(s)+6CO2(g)-△H5, 再进行⑤÷6, 得到△H4=-; 2.计算过程中的注意事项: ①热化学方程式可以进行方向改变, 方向改变时, 反应热数值不变, 符号相 反; ②热化学方程式中物质的化学计量数和反应热可以同时改变倍数; ③热化学方程式可以叠加, 叠加时, 物质和反应热同时叠加; ④当对反应进行逆向时, 反应热数值不变, 符号相反. 【典例剖析】己知:Mn(s)+O2(g)═MnO2(s)△H l S(s)+O2(g)═SO2(g)△H2 Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3 则下列表述正确的是( ) A.△H2>0 B.△H3>△H1 C.Mn+SO2═MnO2+S△H=△H2-△H1 D.MnO2(s)+SO2(g)═MnSO4(s)△H═△H3-△H2-△H1 【答案】D
人教版高中化学选修3第一章《原子结构和性质》检测题(有答案) 1 / 7 《原子结构与性质》检测题 一、单选题 1.现有四种元素的基态原子的电子排布式如下: ①1s 22s 22p 63s 23p 2;②1s 22s 22p 63s 23p 3;③1s 22s 22p 4;④1s 22s 22p 3。 则下列有关比较中正确的是 A .原子半径:③>④>②>① B .第一电离能:④>③>②>① C .最高正化合价:③>④=②>① D .电负性:④>③>②>① 2.下列关于价电子构型为4s 24p 4的原子的描述正确的是( ) A .其电子排布式为1s 22s 22p 63s 23p 64s 23d 104p 4 B .其价电子排布图为 C .其4p 轨道电子排布图为 D .其电子排布式可以简化为[Ar]3d 104s 24p 4 3.下列关于元素第一电离能的说法不正确的是 A .钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B .因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C .最外层电子排布为ns 2np 6(当只有K 层时为1s 2)的原子,第一电离能较大 D .对于同一元素而言,原子的电离能I 1Na +>Mg 2+ D .原子的未成对电子数:Mn>Si>Cl 6.下列有关碳原子排布图中,正确的是 A . B . C . D .
第二章《分子结构与性质》单元测试题一、单选题(每小题只有一个正确答案) 1.下列叙述正确的是() 32- 中硫原子的杂化方式为sp 2 B 2 2 分子中含有 3个σ键和 2 个π键 A. SO.C H C. H2O分子中氧原子的杂化方式为sp2D. BF3分子空间构型呈三角锥形 2.氯的含氧酸根离子有ClO ---- 等,关于它们的说法不正确的是、 ClO 2、 ClO 3、 ClO 4 () A. ClO4-是 sp3 杂化B. ClO3-的空间构型为三角锥形 C. ClO2-的空间构型为直线形D. ClO-中 Cl 显 +1价 3.下列描述中正确的是() 2 V 形的极性分子 A. CS 为空间构型为 B.双原子或多原子形成的气体单质中,一定有σ 键,可能有π 键 C.氢原子电子云的一个小黑点表示一个电子 2﹣3 杂化 D. HCN、SiF 4和 SO3的中心原子均为 sp 4.水是生命之源,下列关于水的说法正确的是() A.水是弱电解质B.可燃冰是可以燃烧的水 C.氢氧两种元素只能组成水D.0℃时冰的密度比液态水的密度大 5.电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是()A. CO和 CO2B. NO和 CO C . CH4和 NH3D. OH-和 S2- 6.下列分子或离子中, VSEPR模型为四面体且空间构型为V 形的是 A. H2S B . SO2 2-C . CO2 D . SO4 7.下列分子中只存在σ键的是 () A. CO2B.CH4C.C2H4D.C2H2 8. HBr 气体的热分解温度比HI 热分解温度高的原因是() A. HBr 分子中的键长比HI 分子中的键长短,键能大 B. HBr 分子中的键长比HI 分子中的键长长,键能小 C. HBr 的相对分子质量比HI 的相对分子质量小 D. HBr 分子间作用力比HI 分子间作用力大 9.表述 1 正确,且能用表述 2 加以正确解释的选项是() 表述1表述2 A在水中,NaCl 的溶解度比I 2的溶解度大NaCl晶体中Cl ﹣与Na+间的作用力
化学选修2《化学与技术》全册精编教案 专题一多样化的水处理技术 〔课程标准要求〕 1、知道化学在水处理中的应用 2、了解海水的综合利用,认识化学科学发展对自然资源利用的作用 〔教学内容增减建议〕增加污水处理中电化学处理、从海水中提取镁,掌握明矾净水的原理、水的消毒原理,富营养化的化学原理,大量内容阅读了解 [课时安排] 第一单元2课时,第二单元3课时,复习1课时,习题1课时,共7课时 第一单元水的净化与污水处理(第一课时) 〔知识回顾〕 2.写出FeCl3 AlCl3的水解方程式,思考如何得到氢氧化铝和氢氧化铁胶体。 3.写出制备漂白粉的化学方程式,思考漂白粉消毒的原理是什么? 知识学习: 2.阅读表1-1找出你认为有毒、应当除去的微粒。你能利用所学的知识对这些有害物 质进行处理吗? 3.明矾净水主要处理的水中哪些微粒?原理是什么? 4.澄清的水是干净的水吗?九寨沟的水折射出漂亮的蓝色?是良好的饮用水吗? 你认为需要怎样的处理?氯水的消毒原理是什么? 5.结合图1-3完成课后P8的习题3,体会自来水厂净化天然水的设计意图,写出相关的方 程式。 6.自来水能直接饮用吗?理由是什么? 习题巩固: 2.在净水过程中用到混凝剂,其中可以作为混凝剂使用的是 A、偏铝酸钠 B、氧化铝 C、氯化铝 D、明矾 3.下列广告用语在科学上没有错误的是 A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任 何离子 C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命 4.下列过程中,不涉及化学变化的是 A.甘油加水作护肤剂 B.用明矾净水 C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 D.烧菜用过的铁锅,经放置常出现红棕色斑迹 5.长时间烧沸的天然水不宜喝的主要原因是
鲁科版高中化学选修1全册教案 1.1 关注空气质量 教学目标: 1. 知道空气污染指数(API)、光化学烟雾的概念。 2.了解影响空气质量的因素、室内空气污染的来源。 3.二氧化碳、二氧化氮和可吸入颗粒物的含量对大气质量的影响。 4.酸雨形成过程中所涉及及反应的化学方程式。 情感目标: 通过空气质量报告反映的内容,认识空气质量对人类生存的影响,增强学生的环保意识。教学重点难点:空气污染指数(API)的确定。 教学方法:讨论总结法 教学过程: 【引入】从1997年5月起,我国有十几座城市先后开始发布城市空气质量周报,为大众提供空气质量信息济南市也在其中,在此基础上,很多城市又发布了空气质量日报。表1-1-1 是某城市某日空气质量报告,你了解各项内容的含义吗? 【阅读】表1-1-1 某城市某日空气质量报告 【板书】一从空气质量报告谈起 1 解读空气质量报告 【讲解】要了解该表中各项内容的含义,我们首先从什么时空气污染指数(Air Pollution Index,简称API)开始。目前,空气质量报告中涉及的污染物主要是二氧化硫、二氧化碳 和可吸入颗粒物(PM10)。污染指数是将某种污染物浓度进行简化处理而得出的简单数值形式。每天分别测定各种污染物的浓度,计算出它们的污染指数,其中污染指数最大的污染物就是当日的首要污染物,并将其污染指数作为当日的空气污染指数(Air Pollution Index,简称API)。API作为衡量空气质量好坏的指标,其数值越小,空气质量越好。API在空气污染指数分级标准中所对应的级别就是当日的空气质量级别。下面请同学们阅读表1-1-2,了解下我国空气污染指数分级标准,及各个级别对人群健康的影响。 【讲解】空气质量受多种复杂因素的影响,其中主要因素有两个:一个是污染物的排放量,另一个是气象条件。
第一章原子结构与性质 第一节原子结构:(1小节) 一、原子结构理论发展 从古代希腊哲学家留基伯和德谟克利特的一般原子说到现代量子力学模型,人类思想中的原子结构模型经过多次演变,给我们多方面的启迪。 现代大爆炸宇宙学理论认为,我们所在的宇宙诞生于一次大爆炸。大爆炸后约两小时,诞生了大量的氢、少量的氦以及极少量的锂。其后,经过或长或短的发展过程,氢、氦等发生原子核的熔合反应,分期分批地合成其他元素。 复习:必修2中学习的原子核外电子排布规律: 1.核外电子排布的一般规律 (1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次 排布在能量逐步升高的电子层(能量最低原理)。 (2)原子核外各电子层最多容纳2乘以n平方个电子。 (3)原子最外层电子数目不能超过8个(K层为最外层时不能超过2个电子 (4)次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒 数第三层电子数目不能超过32个。 说明:以上规律是互相联系的,不能孤立地理解。例如;当M层是最外层 时,最多可排8个电子;当M层不是最外层时,最多可排18个电子 2、能层与能级 由必修2的知识,我们已经知道多电子原子的核外电子的能量是不同的,由内而外可以分为: 第一、二、三、四、五、六、七……能层 符号表示 K、 L、 M、 N、 O、 P、 Q…… 能量由低到高 例如:钠原子有11个电子,分布在三个不同的能层上,第一层2个电子,第二层8个电子,第三层1个电子。由于原子中的电子是处在原子核的引力场中,电子总是尽可能先从内层排起,当一层充满后再填充下一层。理论研究证明,原子核外每一层所能容纳的最多电子数如下: 能层一二三四五六七…… 符号 K L M N O P Q…… 最多电子数 2 8 18 32 50…… 即每层所容纳的最多电子数是:2n2(n:能层的序数) 但是同一个能层的电子,能量也可能不同,还可以把它们分成能级(S、P、d、F),就好比能层是楼层,能级是楼梯的阶级。各能层上的能级是不一样的。 能级的符号和所能容纳的最多电子数如下: 能层 K L M N O ……
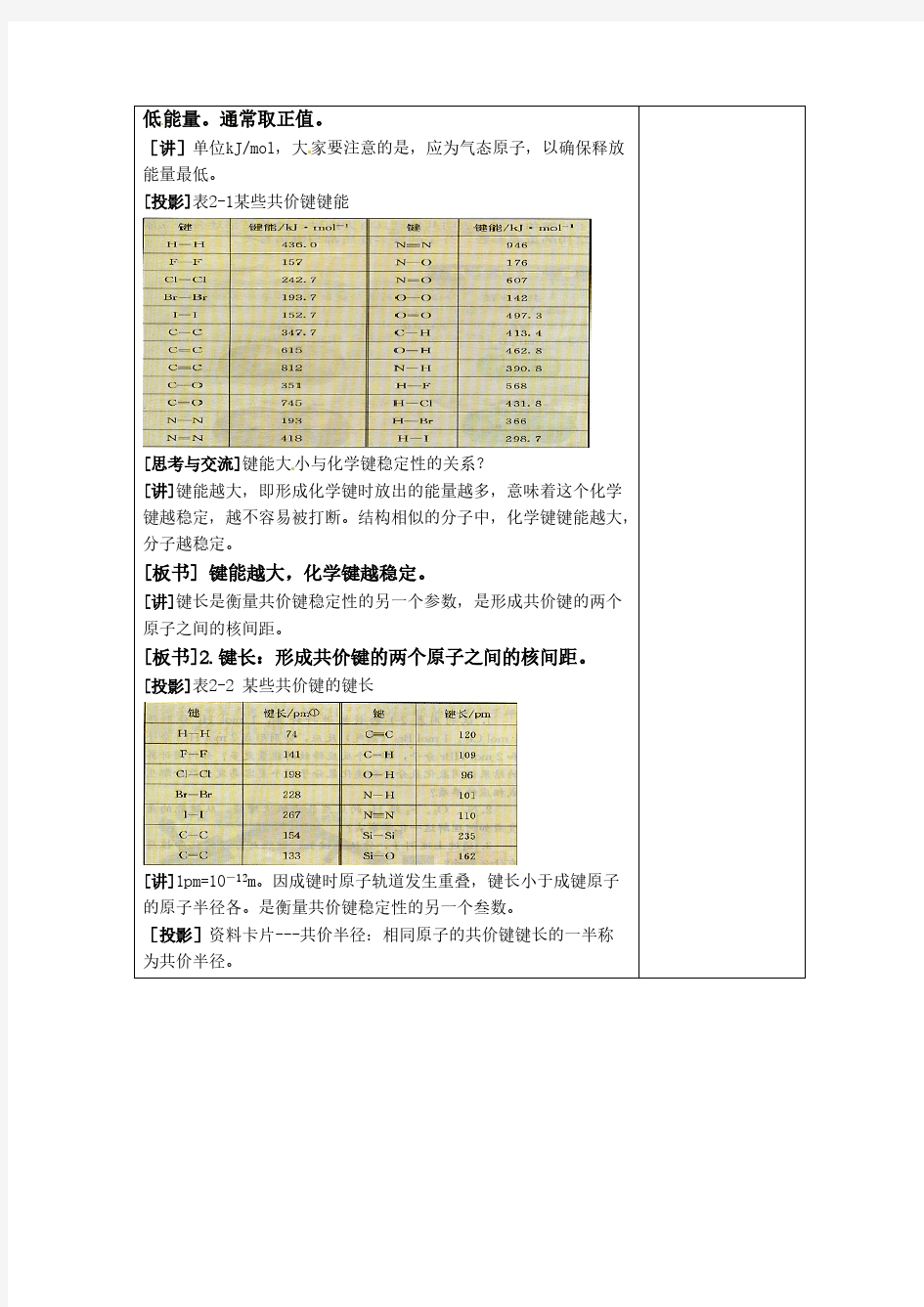
第一节共价键 [核心素养发展目标] 1.宏观辨识与微观探析:能从微观角度分析形成共价键的微粒、类型,能辨识物质中含有的共价键的类型及成键方式,了解键能、键长及键角对物质性质的影响。 2.证据推理与模型认知:理解共价键中σ键和π键的区别,建立判断σ键和π键的思维模型,熟练判断分子中σ键和π键的存在及个数。 一、共价键的形成与特征 1.共价键的形成 (1)概念:原子间通过共用电子对所形成的相互作用,叫做共价键。 (2)成键的粒子:一般为非金属原子(相同或不相同)或金属原子与非金属原子。 (3)本质:原子间通过共用电子对(即电子云重叠)产生的强烈作用。
(4)形成条件:非金属元素的原子之间形成共价键,大多数电负性之差小于1.7的金属与非金属原子之间形成共价键。 2.共价键的特征 (1)饱和性 按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。 (2)方向性 除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的愈多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。 共价键的特征及应用 (1)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。 (2)共价键的方向性决定了分子的立体构型,并不是所有共价键都具有方向性,如两个s电子形成共价键时就没有方向性。 例
1(2018·南昌高二月考)共价键具有饱和性和方向性。下列有关叙述不正确的是() A.共价键的饱和性是由成键原子的未成对电子数决定的 B.共价键的方向性是由成键原子轨道的方向性决定的 C.共价键的饱和性决定了分子内部原子的数量关系 D.共价键的饱和性与原子轨道的重叠程度有关 答案 D 解析一般地,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数目决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A、C正确;形成共价键时,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,则共价键的方向性是由成键原子轨道的方向性决定的,故B正确;共价键的饱和性与原子轨道的重叠程度无关,与原子的未成对电子数有关,故D错误。 二、共价键的类型 1.σ键 (1)概念:未成对电子的原子轨道采取“头碰头”的方式重叠形成的共价键叫σ键。 (2)类型:根据成键电子原子轨道的不同,σ键可分为s-s σ键、s-p σ键、p-p σ键。 ①s-s σ键:两个成键原子均提供s轨道形成的共价键。 ②s-p σ键:两个成键原子分别提供s轨道和p轨道形成的共价键。 ③p-p σ键:两个成键原子均提供p轨道形成的共价键。 (3)特征 ①以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称
…………………………………………………………最新精品资料推荐…………………………………………………… 选修5《有机化学基础》教案 第一章认识有机化合物 【课时安排】共13课时 第一节:1课时 第二节:3课时 第三节:2课时 第四节:4课时 复习:1课时 测验:1课时 讲评:1课时 第一节有机化合物的分类 【教学重点】 了解有机化合物的分类方法,认识一些重要的官能团。 【教学难点】 分类思想在科学研究中的重要意义。 【教学过程设计】 【思考与交流】 1.什么叫有机化合物? 2.怎样区分的机物和无机物? 有机物的定义:含碳化合物。CO、CO2、H2CO3及其盐、氢氰酸(HCN)及其盐、硫氰酸(HSCN)、氰酸(HCNO)及其盐、金属碳化物等除外。 有机物的特性:容易燃烧;容易碳化;受热易分解;化学反应慢、复杂;一般难溶于水。 从化学的角度来看又怎样区分的机物和无机物呢? 组成元素:C 、H、O N、P、S、卤素等 有机物种类繁多。(2000多万种) 一、按碳的骨架分类: 有机化合物链状化合物脂肪 环状化合物脂环化合物化合物 芳香化合物 1.链状化合物这类化合物分子中的碳原子相互连接成链状。(因其最初是在脂肪中发现的,所以又叫脂肪族化合物。)如: CH3CH2CH2CH3CH3CH2CH2CH2OH 正丁烷正丁醇 2.环状化合物这类化合物分子中含有由碳原子组成的环状结构。它又可分为两类: (1)脂环化合物:是一类性质和脂肪族化合物相似的碳环化合物。如: OH
环戊烷环己醇 (2)芳香化合物:是分子中含有苯环的化合物。如: 苯萘 二、按官能团分类: 什么叫官能团?什么叫烃的衍生物? 官能团:是指决定化合物化学特性的原子或原子团. 常见的官能团有:P.5表1-1 烃的衍生物:是指烃分子里的氢原子被其他原子或原子团取代所生成的一系列新的有机化合物。 可以分为以下12种类型: 练习: 1.下列有机物中属于芳香化合物的是() 2.〖归纳〗芳香族化合物、芳香烃、苯的同系物三者之间的关系: 〖变形练习〗下列有机物中(1)属于芳香化合物的是_______________,(2)属于芳香烃的是________, ?芳香化合物是分子中含有苯环的有机化合物,芳香烃是分子中含有苯环的烃,苯的同系物是分子中含有苯环并与苯相差若干个CH2的有机物。苯及苯的同系物属于芳香烃,芳香烃属于芳香族化合物。烃是化学家发明的字,就是用“碳”的声母加上“氢”的韵母合成一个字,用“碳”和“氢”两个字的内部结构组成字型,烃类是所有有机化合物的母体,可以说所有有机化合物都不过是用其他原子取代烃中某些原子的结果。 (3)属于苯的同系物的是______________。 NO2CH3CH 2 —CH3 OH CH = CH2 CH3 CH3 CH3
第二章 促进身心健康 第一节 合理选择饮食 《中国居民膳食指南》基本原则共有十条:①食物多样,谷类为主,粗细搭配;②多吃蔬菜、水果和薯类;③每天吃奶类、大豆或其制品;④吃适量鱼、禽、蛋、瘦肉;⑤减少烹调油;⑥食不过量,天天运动,保持健康体重;⑦三餐分配要合理,零食要适当;⑧每天足量饮水,合 理选择饮料;⑨如饮酒应限量;⑩吃新鲜卫生的食物。 你认为这些原则科学吗?为了我们的身心健康, 应怎样进行合理的饮食搭配呢? 水平测试 1.下列物质属于食品添加剂的是( ) A.NaOH B.胡萝卜素 促进身心健康 化学选修1(人教版)
C.甲水溶液 D.工业NaCl 答案:B 2.市场上很多食品标签上注明有“苯甲酸钠”字样,该物质属于() A.食品所含营养成分之一 B.食品鲜味剂 C.食品防腐剂 D.人工合成甜味剂 【试题解析】:苯甲酸钠是常用的防腐剂。 答案:C 3.下列关于食品添加剂应用不正确的是() A.苋菜红、柠檬黄可用作着色剂 B.氯化钠可用作净水剂 C.味精可用作食品的调味剂 D.醋可用作食品调味剂,也可用作防腐剂 【试题解析】:氯化钠可用作调味剂和防腐剂,不可用作净水剂。 答案:B 4.食品添加剂改善了人们的生活,但应该区别合法食品添加剂与违法食品添加剂。做馒头的过程中禁止添加的是() A.食盐 B.蔗糖 C.小苏打 D.增白剂 【试题解析】:食盐无毒,有咸味,可作调味品,做馒头的过程中能够添加;蔗糖无毒,且是甜味剂和营养素,做馒头的过程中能够添加;小苏打无毒且能与面粉发酵时产生的酸反应生成二氧化碳气体,使馒头松软,故做馒头的过程中能够添加;增白剂含有有毒有害成分,做馒头的过程中禁止添加。 答案:D 5.下列物质属于酸性食物的是() A.柠檬酸 B.胡萝卜
高中化学选修3第一章测试 (满分:100分考试时间:100分钟) 一、选择题。(在每小题给出的选项中,只有一项符合题目要求的,每题2分,共50分) 1、下列微粒:①质子②中子③电子,在所有原子中不一定含有的微粒是() A.①②③ B. 仅有② C.①和③ D.①和② 2、某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为() A. 24 B. 18 C. 19 D. 29 3、下列四个能级中,能量最高,电子最后填充的是() A. 3s B. 3p C. 3d D. 4s 4、下列说法中正确的是() A. 因为p轨道是“8”字形的,所以p的电子走“8”字形 B. K能级有3S,3P,3d,3f四个轨道 C. 氢原子只有一个电子,故氢原子只有一个轨道 D. 以上说法均不正确 5、下列原子中未成对电子最多的是() A. C B. O C. N D. Cl 6、下面是某些元素的最外层电子排布,各组指定的元素,不能形成AB2型化合物的是() A. 2S22P2和2S22P4 B. 3S23P4和2S22P4 C. 3s2和2s22p5 D.3s1和3s23p4 7、同主族两种元素原子的核外电子数的差值可能是() A. 6 B. 12 C. 26 D. 30 8、已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是() A. n=m+1 B. n=m+10 C. n=m+11 D. n=m+25 9、下列化合物中阳离子半径与阴离子半径比值最小的是()
A. NaF B. LiI C. MgCl2 D. KBr 10、已知A n+,B(n+1)+,C n-,D(n+1)-具有相同的电子层结构,则原子半径由大到小的顺序为() A. C>D>B>A B. A>B>C>D C. D>C>A>B D. A>B>D>C 11、在前三周期的元素中,原子最外层A. 6种 B. 5种 C. 4种 D. 3种 12、A、B属于短周期中不同主族的元素,A、B原子最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数为() A. a-8 B. a-5 C. a+6 D. a+4 13、按照原子核外电子排布规律,各电子层最多容纳的电子数为2n2(n为电子层数,其中,最外层电子数不超过8个,次外层不超过18个),1999年已发现了核电荷数为118的元素,其原子核外电子层排布是() A. 2,8,18,32,32,18,8 B. 2,8,18,32,50,8 C. 2,8,18,32,18,8 D. 2,8,18,32,50,18,8 14、碘跟氧可形成多种化合物。其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是() A. I2O3 B. I2O4 C. I4O7 D. I4O9 15、已知短周期元素的离子aA2+,bB+,cC3-,dD-都具有相同的电子层结构,下列叙述正确的是() A. 原子半径A>B>C>D B. 原子序数d>c>b>a C. 离子半径C3->D->B+>A2+ D. 单质还原性A>B>D>C 16、下列叙述中,A金属的活泼性肯定比B金属强的是() A. A原子的最外层电子数比B原子的最外层电子数少 B. A的氢氧化物为两性化合物,B的氢氧化物为弱碱 C. 1molA从酸中置换出H+生成的H2比1molB从酸中置换出H+生成的H2多 D. A元素的电负性比B元素的电负性小 根据下列5种元素的电离能数据(单位:kJ.mol-1)回答17和18题