
第二章
晶体结构
2.1
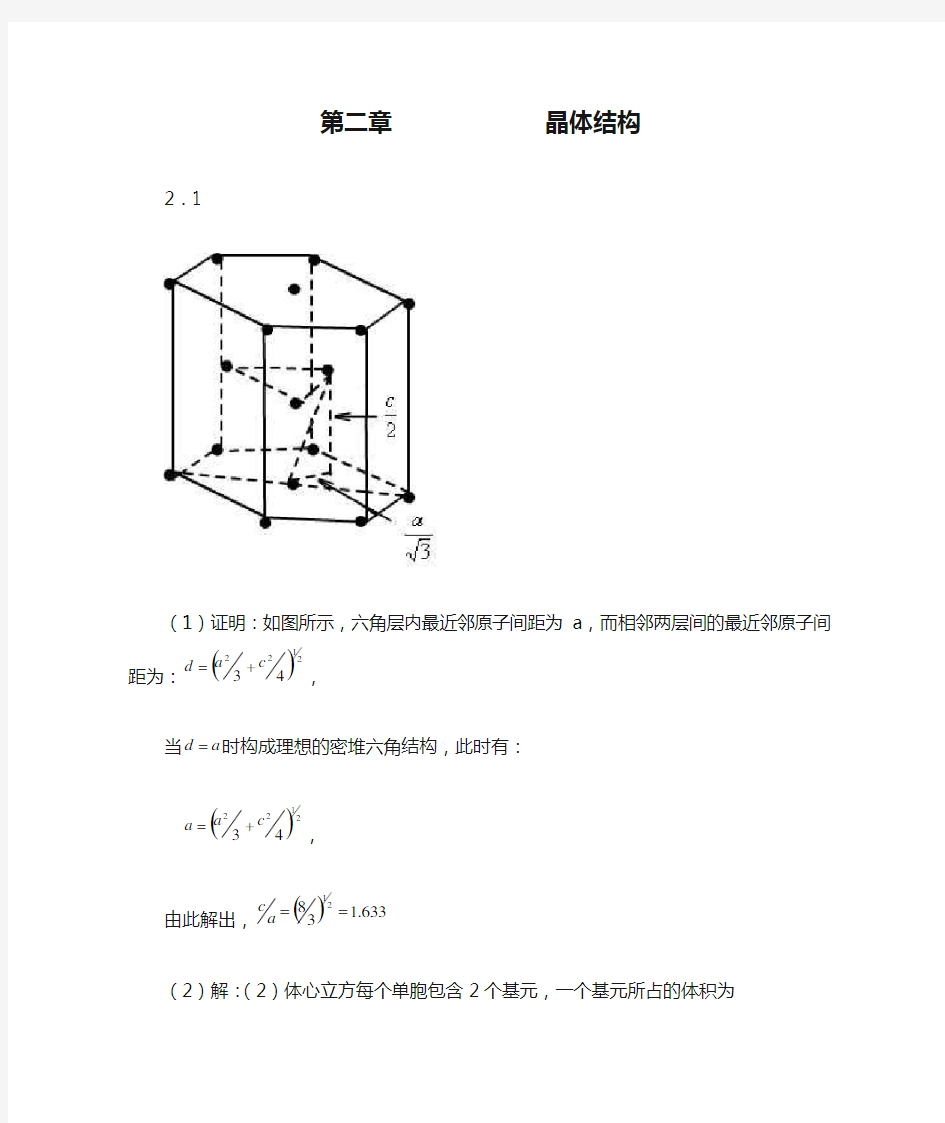
(1)证明:如图所示,六角层内最近邻原子间距为a ,而相邻两层间的最近邻原子间距为:
(
)2
1
2
2
4
3
c
a
d +=,
当a d =时构成理想的密堆六角结构,此时有: (
)2
1
2
2
4
3
c
a
a +=,
由此解出,()
633.138
2
1==a
c
(2)解:(2)体心立方每个单胞包含2个基元,一个基元所占的体积为
23
c
c a V =
, 单位体积内的格点数为.
1
Vc
六角密堆积每个单胞包含6个基元,一个基元所占的体积为 3
2
1
222
23843436/323a
a a c a c a a V s =
?
?? ???==????
? ????=
因为密度不变,所以 s
c
V V 11=,即:3
3
2
22/a
a c =
nm
a a c s 377.02
/6
1== nm
a c s 615.0633.1==
2.2证明: 设简单六角布拉菲格子基矢如图示 :
∧
∧∧
∧
=+
=
=z c a y a x a a x a a 321,
2
32
,
则其倒格子的三个基矢为
()(
)(
)
∧
∧
∧∧=
==
?=????
??-=?=z
c
b y a a a b y x a a a b ππ
ππ
ππ
223322233223
2133
211323
211
另知21,b b 的夹角为120度,且
a
34π=
=,2313,b b b b ⊥⊥
故简单六角布拉菲格子的倒格子仍为简单六角,倒格子的晶格常数分别为
a
c
34,
2ππ,倒格
子相对于正格子绕c 轴旋转30度,(如图中标出321,,b b b 更清晰)
2.3 体心立方
(111)面心立方:
2.4:解:
(111)面与(110)面的交线晶向:[]101 或 []011。 (111)面与(100)面的交线晶向:[]101 或 []110。 2..5 证明:
解:(1)体心立方的基矢为: ()
()()???
???
???-+=+-=++-=z
y x a a z y x a a z y x a a ???2???2???232
1
()()()()()()[]z l l l y l l l x
l l l a z y
x
a l z y
x
a l z y
x
a l a l a l a l R l ???2???2???2???2321321321321332211-+++-+++-=-+++-+++-=++=
其中l 1,l 2,l 3为整数,以直角坐标系
x a i ?2= ,y a j ?2= ,z a
k ?2= 。 ()()()???
??
?
???
-+=+-=++-=32133212
3211222l l l a n l l l a n l l l a n
如果n 1为偶数则,n 2=n 1+2(l 1- l 2)必
n 3=n 1+2(l 1- l 3) 必为偶数。 如果n 1为奇数则n 2=n 1+2(l 1- l 2)必为
n 3=n 1+2(l 1- l 3) 必为奇数。 所以n 1,n 2,n 3的奇偶性相同,全部为奇数或偶数。
(2)面心立方的基矢为: ()()()???
?
??
???+=+=+
=y
x
a a z x a a z y a a ??2??2??2321
()()()()()()[]z l l y l l x
l l a y x a
l z x a
l z y
a l a l a l a l R l ???2??2
??2
??2
213132321332211+++++=+++++=++=
其中l 1,l 2,l 3为整数,以直角坐标系
x a i ?2= ,y a j ?2= ,z a
k ?2= 。 ()
()()
???
??+=+=+=213
312321l l n l l n l l n
()
3213212l l l n n n ++=++为偶数。
2.6解:
每个晶胞所含有的八面体间隙数为:44
1121=?
+个,与晶胞原子数相同且八面体间
隙的中心位置位于体心位置和每个棱边的中点。
每个晶胞中有8个四面体间隙数,四面体间隙中心的坐标为:
??
?
?????????41,41,41及其等效位置。
2.7解:
设最近邻的二蜂房点的距离为a ,则原胞的基矢为:
∧
∧
∧
+
=
=y a x a a x a a 2
32
3,321
求原胞的倒格矢:设 ∧
∧
∧
∧
+=+=y b x b b y b x b b y x y x 222111
由 020*********=?=?=?=?a b a b a b a b ππ
可得
∧∧
∧∧
∧
??? ??-+=
???
?
?
???=
-=
y a h a h x h a G y
a
b y
a
x a b h 32343234323212121ππππππ 原胞基元含有两个同种原子,位置分别为:
∧
∧
+
=
=y a x a d d 2
12
30
21
3
23
2122h h d G h ππ+
=
?
从而 ()???
?
????????+-+=2132e x p 1h h i f S
h
G π
2.8 解:
设晶面族的面间距为d ,离原点最近的晶面在晶胞基矢上的截距为
l
a k a h a 3
21,, 有
d l
a d k
a d h
a ===γβαc o s ,
c o s ,
c o s 321
d
a l d
a k d
a h γβαcos ,cos ,cos 321=
=
=
所以晶面的密勒指数()l k h ,,可以写成 ??
?
?
?d a d
a d
a γβ
α
cos ,
cos ,
cos 321
2.9 解:
对于晶体,晶体中的电位移和电场的关系为:()1E D ε=
其中介电常数矩阵 ???
?
????
??=33
32
31
232221
131211εεεεεεεεεε 坐标旋转后,各物理量在新旧坐标系中的关系矢
E A E D A D E D =='=',
',
''
ε
若旋转后在新坐标系中的晶格分布与未旋转前的一样,是对称操作,则有''E D ε=将上
式中后两式代入此式,得到 E A A E A A D t
εε==-1
将上式与(1)式比较,得到 ()2A
A t εε=
对六角晶系绕x(即a)轴旋转?180和绕z(即c)轴旋转?120都是对称操作,坐标变换矩阵分别为:
????????
?????????
?
--
-=????
?
?????--=10
021*********
010
001z x A A 则由x t x A A εε=得 ????
?
???
??----=?????
???
??3332312322
211312
11333231
232221
131211
εεεεεεεεεεεεεεεεεε
可见:
即:
????
????
??=====333223
22
11312113120
00
00
εεεεεεεεεε
将上式代入z t
z A A εε=得
???
????
?
?
??????
?
?
?-
-
-+
+
-
-+
-
+
=??
????????33
32
3223221122112322
1122
1133322322112
32
32
1
4
34
14
343
234
3434
3410
000εεεεεεεεεεεεεεεεεε???
??===?2211
322300εεεε
于是得到六角晶系的介电常数
????
?
???
??=3311
1100
0000εεεε
2.10对一个三主轴方向周期分别为a ,b 和c 的正交简单晶格,当入射X 射线方向与[100]方向(其重复周期为a )一致时,试确定在哪些方向上会出现衍射极大?什么样的X 射线波长才能观察到极大? 解: ?
??
???
???===?
?????===z c b y b b x a
b z
c a y b a x
a a ?2?2?2???32
1
321πππ
倒格矢
??? ??++=++=z c h y b h x a h
b h b h b h G h ???2321332211π
x
k k ?=
(100方向) h
h G G k 2
21=? (参考-书2.5.9式劳厄条件)
??????????? ??+???
??+???
??=?
???
????????
??+??? ??+??? ??=232
2211232
2
212122c h b h a h h a k c h b h a h k a
h πππ
z c h y b h x a h c h b h h a z c h y b h x a h
c h b h a h h a
z c h y b h x a h x
k G k k h ?2?2??2?2?2???2?32
12322132
12322211321πππππππππ--???
? ?
?-??????????? ??+???
??=--???
? ??-???
???????? ??+???
??+??? ??=??? ??++-=-=' (劳厄条件)
综上,方向沿z c h y b h x a h
c h b h h a ?2?2?32
1
23221
ππππ--???? ?
?-???
???????? ??+???
??会出现衍射极大值。
X 射线的波长????
??????? ??+???
??+??? ??=
2322
2112c h b h a h a
h λ才能观察到极大值。
解法2:
2.10 解:
取简单正交格子的三个晶轴方向为坐标轴,则该晶体的倒格矢可写成:
()1222321∧
∧
∧
+
+
=
z
c
h y b
h x a
h G h πππ
这里321,,h h h 为互质的整数
入射的x 射线的波矢0k 可表示成: ()220∧
=x k λ
π
据劳厄方程有: ()30h G n k k =-
把衍射x 射线的波矢k
写成下面形式:
()42?
?
? ??++=∧
∧∧z k y k x k k z y x λπ
因为x 射线在衍射前后,波长保持不变,所以要求 12
2
2
=++z y x k k k
()()()421一起代入()3:
()??
??
??++=???
??++-∧∧∧∧
∧∧z c nh y b nh x a nh z k y k x k z y x 321212πλπ ()()()
???
?
?
?
???
==+=?765132
1nh c k nh b k nh a
k x
y x
λλλ
把()()()765代入()4有:
112
32221=??
? ??+?
?? ??+??? ??+nh c nh b nh a λλλ 即:
()822
32
22
11??
?
??+???
??+??? ????
? ??-=
c nh b nh a nh a nh λ
故对应于各种不同321,,nh nh nh 值的衍射极大方向,其入射光的波长λ必须满足()8,如不满足则其对应的衍射极仍不能观察到。
2.11 解: (1)如图示:
设原子是等间距的,衍射光束与原子链的夹角为θ,当入射x 光垂直于原子链时,A 原子或
B 原子散射波的光程差为θcos a ,当λθn a =c
o s 时,各A ()B 原子的散射波的相位差为0,
散射波相互加强形成很强的衍射光
(2)一个原胞的基元包含B A ,两个原子,位置分别为
∧
=
=x a d d 2
21,
另知一维等距离格子的倒格矢
,2∧
=x a
h G h πh 为整数
()
()πih f f d G i f f S
B A h B A G h
-+=?-+=exp exp 2
若 ()2c o s h
πB A G G f f S S I h
h
+=?∝*
故h 为奇数时,衍射束的强度正比于2
B
A f f -
故h 为偶数时,衍射束的强度正比于2
B A f f +
(3)若f f f B A ==,当h 为奇数时衍射光的强度为零,这时A 原子与B 原子的散射波的相位差为π,相位相反,互相抵消,即对应消光现象。 当h 为偶数时,衍射光的强度最强2
4f I ∝。
第二章金属的晶体结构与结晶 教学目的及要求 通过本章的学习,使学生掌握常用纯金属的结构特点和性能特点,建立金属材料结构与性能之间的关系。 主要内容 1.材料的结合方式 2.金属的晶体结构与结晶 学时安排 讲课2学时。 教学重点 1.金属的三种典型的晶体结构 2.晶体缺陷及其对性能的影响 3.纯金属的结晶过程 教学难点 1.金属材料的晶体结构 2.各类缺陷对结构及性能的影响 第一节纯金属的晶体结构 一、晶体结构的基本概念 晶体结构:指在晶体内部,原子、离子或原子集团规则排列的方式。晶体结构不同,其性能往往相差很大。 晶格:为了便于分析研究,通常把将晶体中实际存在的原子、离子或原子集团等物质质点,抽象为空间中纯粹的几何点,而完全忽略它的物质性,这些抽象的几何点称为阵点。用假想的直线把这些阵点连接起来,得到周期性规则排列的三维空间格子称为晶格。 晶胞:组成晶格的能反映其特征和规律的最基本几何单元,称为晶胞。晶格可以看作是由许多大小和形状完全相同的晶胞紧密地堆垛在一起而成的。 晶格常数:晶胞各棱边的长度用a、b、c表示,称为晶格常数或点阵常数,其大小通常以埃为计量单位。晶胞各边之间的相互夹角分别以α、β、γ表示。a、b、c、α、β、γ称为晶胞的六个参数。 在研究晶体结构时,通常以晶胞作为代表来考查。
配位数和致密度:表示晶格中原子排列的紧密程度。 配位数:指晶格中与任一原子处于相距最近并距离相等的原子数目; 致密度(K):指晶胞中原子排列的致密程度,即晶胞中原子所占的体积与晶胞体积(V)的比值,比值K越大,致密度越大。 二、金属中常见的晶体结构类型 三种典型晶体结构特征: 晶体结构与材料性能:(一般规律)面心立方的金属塑性最好,体心立方次之,密排六方的金属较差。 第二节实际金属中的晶体缺陷 一、常见晶体缺陷及分类 晶体缺陷:实际晶体中排列不规则的区域称为晶体缺陷。 分类:按空间尺寸分为三种。 1.点缺陷。不规则区域在空间三个方向上的尺寸都很小,主要是空位、置换原子、间隙原子。 2.线缺陷。不规则区域在一个方向的尺寸很大,在另外两个方向的尺寸都很小,主要是位错。 3.面缺陷:不规则区域在两个方向的尺寸很大,在另外一个方向的尺寸很小,主要是晶界和亚晶界。 二、晶体缺陷对晶体性能的影响 1.点缺陷周围晶格发生畸变,材料的屈服强度提高,塑性韧性下降,电阻增加。
第 2 章结晶结构 一、名词解释 1.晶体:晶体是内部质点在三维空间内周期性重复排列,具有格子构造的固体 2.空间点阵与晶胞: 空间点阵是几何点在三维空间内周期性的重复排列 晶胞:反应晶体周期性和对称性的最小单元 3.配位数与配位多面体: 化合物中中心原子周围的配位原子个数 成配位关系的原子或离子连线所构成的几何多面体 4.离子极化: 在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象5.同质多晶与类质同晶: 同一物质在不同的热力学条件下具有不同的晶体结构 化学成分相类似物质的在相同的热力学条件下具有相同的晶体结构 6.正尖晶石与反尖晶石: 正尖晶石是指2价阳离子全部填充于四面体空隙中,3价阳离子全部填充于八面体空隙中。 反尖晶石是指2价阳离子全部填充于八面体空隙中,3价阳离子一半填充于八面体空隙中,一半填充于四面体空隙。 二、填空与选择 1.晶体的基本性质有五种:对称性,异相性,均一性,自限性和稳定性(最小内能性)。 2.空间点阵是由 C 在空间作有规律的重复排列。( A 原子 B离子 C几何点 D分子)3.在等大球体的最紧密堆积中有面心立方密堆积和六方密堆积二种排列方式,前者的堆积方式是以(111)面进行堆积,后者的堆积方式是以(001)面进行堆积。 4.如晶体按立方紧密堆积,单位晶胞中原子的个数为 4 ,八面体空隙数为 4 ,四面体空隙数为 8 ;如按六方紧密堆积,单位晶胞中原子的个数为 6 ,八面体空隙数为 6 ,四面体空隙数为 12 ;如按体心立方近似密堆积,单位晶胞中原子的个数为 2 , 八面体空隙数为 12 ,四面体空隙数为 6 。 5.等径球体最紧密堆积的空隙有两种:四面体空隙和八面体空隙。一个球的周围有 8个四面体空隙、 6 个八面体空隙;n个等径球体做最紧密堆积时可形成 2n 个四面体空隙、 n 个八面体空隙。不等径球体进行堆积时,大球做最紧密堆积或近似密堆积,小球填充于空隙中。
第二章纯金属的结晶 2-1 a)试证明均匀形核时,形成临界晶粒的△Gk与其体积V之间关系式为△Gk=V△Gv/2 b)当非均匀形核形成球冠状晶核时,其△Gk与V之间的关系如何? 答: 2-2 如果临界晶核是边长为a的正方体,试求出△Gk和a之间的关系。为什么形成立方体晶核的△Gk比球形晶核要大。 答:
2-3 为什么金属结晶时一定要由过冷度?影响过冷度的因素是什么?固态金属熔化时是否会出现过热?为什么? 答: 金属结晶时需过冷的原因: 如图所示,液态金属和固态金属的吉布斯自由能随温度的增高而降低,由于液态金属原子排列混乱程度比固态高,也就是熵值比固态高,所以液相自由能下降的比固态快。当两线相交于Tm温度时,即Gs=Gl,表示固相和液相具有相同的稳定性,可以同时存在。所以如果液态金属要结晶,必须在Tm温度以下某一温度Tn,才能使G s<Gl,也就是在过冷的情况下才可自发地发生结晶。把Tm-Tn的差值称为液态金属的过冷度 影响过冷度的因素: 金属材质不同,过冷度大小不同;金属纯度越高,则过冷度越大;当材质和纯度一定时,冷却速度越大,则过冷度越大,实际结晶温度越低。 固态金属熔化时是否会出现过热及原因: 会。原因:与液态金属结晶需要过冷的原因相似,只有在过热的情况下,Gl<G s,固态金属才会发生自发地熔化。 2-4 试比较均匀形核和非均匀形核的异同点。 答: 相同点: 1、形核驱动力都是体积自由能的下降,形核阻力都是表面能的增加。
2、具有相同的临界形核半径。 3、所需形核功都等于所增加表面能的1/3。 不同点: 1、非均匀形核的△Gk小于等于均匀形核的△Gk,随晶核与基体的润湿角的变 化而变化。 2、非均匀形核所需要的临界过冷度小于等于均匀形核的临界过冷度。 3、两者对形核率的影响因素不同。非均匀形核的形核率除了受过冷度和温度的 影响,还受固态杂质结构、数量、形貌及其他一些物理因素的影响。 2-5 说明晶体生长形状与温度梯度的关系。 答: 液相中的温度梯度分为: 正温度梯度:指液相中的温度随至固液界面距离的增加而提高的温度分布情况。负温度梯度:指液相中的温度随至固液界面距离的增加而降低的温度分布情况。固液界面的微观结构分为: 光滑界面:从原子尺度看,界面是光滑的,液固两相被截然分开。在金相显微镜下,由曲折的若干小平面组成。 粗糙界面:从原子尺度看,界面高低不平,并存在着几个原子间距厚度的过渡层,在过渡层中,液固两相原子相互交错分布。在金相显微镜下,这类界 面是平直的。 晶体生长形状与温度梯度关系: 1、在正温度梯度下:结晶潜热只能通过已结晶的固相和型壁散失。 光滑界面的晶体,其显微界面-晶体学小平面与熔点等温面成一定角度,这种情况有利于形成规则几何形状的晶体,固液界面通常呈锯齿状。 粗糙界面的晶体,其显微界面平行于熔点等温面,与散热方向垂直,所以晶体长大只能随着液体冷却而均匀一致地向液相推移,呈平面长大方式,固液界面始终保持近似地平面。 2、在负温度梯度下: 具有光滑界面的晶体:如果杰克逊因子不太大,晶体则可能呈树枝状生长;当杰克逊因子很大时,即时在较大的负温度梯度下,仍可能形成规则几何形状的晶体。具有粗糙界面的晶体呈树枝状生长。 树枝晶生长过程:固液界面前沿过冷度较大,如果界面的某一局部生长较快偶有突出,此时则更加有利于此突出尖端向液体中的生长。在尖端的前方,结晶潜热散失要比横向容易,因而此尖端向前生长的速度要比横向长大的速度大,很块就长成一个细长的晶体,称为主干。这些主干即为一次晶轴或一次晶枝。在主干形成的同时,主干与周围过冷液体的界面也是不稳的的,主干上同样会出现很多凸出尖端,它们会长大成为新的枝晶,称为称为二次晶轴或二次晶枝。二次晶枝发展到一定程度,又会在它上面长出三次晶枝,如此不断地枝上生枝的方式称为树枝状生长,所形成的具有树枝状骨架的晶体称为树枝晶,简称枝晶。 2-6 简述三晶区形成的原因及每个晶区的特点。 答: 三晶区的形成原因及各晶区特点: 一、表层细晶区
2-1 (a )MgO 具有NaCl 结构。根据O 2-半径为0.140nm 和Mg 2+半径为0.072nm ,计算球状离子所占有的空间分数(堆积系数)。 (b )计算MgO 的密度。 解:(a )MgO 具有NaCl 型结构,即属面心立方,每个晶胞中含有4个Mg 2+和4个O 2-,故Mg 所占有体积为: 2233MgO Mg O 334 4()34 4(0.0720.140) 3 0.0522nm V R R ππ+- ?+?+=== 因为Mg 2+和O 2-离子在面心立方的棱边上接触: 22Mg O 2()20.0720.1400.424nm a R R +-++==()=() 堆积系数=%=)(=5.68424.00522 .033 MgO a V (b ) 37233 )10424.0(1002.6) 0.163.24(4·0MgO -???+?= = a N M n D =3.51g/cm 3 2-2 Si 和Al 原子的相对质量非常接近(分别为28.09和26.98),但SiO 2和Al 2O 3的密度相差很大(分别为2.65g/cm 3和3.96g/cm 3)。试计算SiO 2和Al 2O 3的堆积密度,并用晶体结构及鲍林规则说明密度相差大的原因。 解: 首先计算SiO 2堆积系数。每cm 3中含SiO 2分子数为: 3223 22343223 2322223 2.65SiO /cm 2.6410/cm (28.0932.0)/(6.0310) Si /cm 2.6410/cm O /cm 2.64102 5.2810/cm +-?+?????= =个=个==个 每cm 3 中Si 4+ 和O 2- 所占体积为: 2-32273 Si432273 O 4 /cm 2.6410(0.02610)3 0.001954 /cm 5.2810(0.13810)3 0.5809V V ππ-+-????????==== Si 2O 3晶体中离子堆积系数=000195+0.5809=0.5829或58.29% Al 2O 3堆积系数计算如下:
第二章材料中的晶体结构 基本要求:理解离子晶体结构、共价晶体结构。掌握金属的晶体结构和金属的相结构,熟练掌握晶体的空间点阵和晶向指数和晶面指数表达方法。 重点:空间点阵及有关概念,晶向、晶面指数的标定,典型金属的晶体结构。难点:六方晶系布拉菲指数标定,原子的堆垛方式。 §2.1 晶体与非晶体 1.晶体的定义:物质的质点(分子、原子或离子)在三维空间作有规律的周期性重复排列所形成的物质叫晶体。 2. 非晶体:非晶体在整体上是无序的;近程有序。 3. 晶体的特征 周期性 有固定的凝固点和熔点 各向异性 4.晶体与非晶体的区别 a.根本区别:质点是否在三维空间作有规则的周期性重复排列 b.晶体熔化时具有固定的熔点,而非晶体无明显熔点,只存在一个软化温度范围 c.晶体具有各向异性,非晶体呈各向同性(多晶体也呈各向同性,称“伪各向同性”) 5.晶体与非晶体的相互转化 思考题: 常见的金属基本上都是晶体,但为什么不显示各向同性? §2.2 晶体学基础 §2.2.1 空间点阵和晶胞 1.基本概念 阵点、空间点阵 晶格 晶胞:能保持点阵特征的最基本单元
2.晶胞的选取原则: (1)晶胞几何形状能够充分反映空间点阵的对称性; (2)平行六面体内相等的棱和角的数目最多; (3)当棱间呈直角时,直角数目应最多; (4)满足上述条件,晶胞体积应最小。 3. 描述晶胞的六参数 §2.2.2 晶系和布拉菲点阵 1.晶系 2. 十四种布拉菲点阵 晶体结构和空间点阵的区别 §2.2.3 晶面指数和晶向指数 晶向:空间点阵中各阵点列的方向。 晶面:通过空间点阵中任意一组阵点的平面。 国际上通用米勒指数标定晶向和晶面。 1.晶向指数的标定 (1)建立以晶轴a,b,c为坐标轴的坐标系,各轴上的坐标长度单位分别是晶胞边
第二章晶体结构缺陷 1.(错)位错属于线缺陷,因为它的晶格畸变区是一条几何线。 2.(错)螺型位错的柏氏失量与其位错线垂直,刃型位错的柏氏失量与其位错线是平行。 3. (错)肖特基缺陷是由于外来原子进入晶体而产生的缺陷。 4.(错)弗伦克尔缺陷是由于外来原子进入晶体而产生的缺陷。 二选择题 1.非化学剂量化合物Zn1+x O中存在 A 。 A. 填隙阳离子 B. 阳离子空位 C. 填隙阴离子 D. 阴离子空位 2. 非化学计量化合物UO2+x中存在 C 。 A. 填隙阳离子 B. 阳离子空位 C. 填隙阴离子 D. 阴离子空位 3.非化学剂量化合物TiO2-x中存在 D 。 A. 填隙阳离子 B. 阳离子空位 C. 填隙阴离子 D. 阴离子空位 4.螺型位错的位错线是 A 。 A. 曲线 B. 直线 C. 折线 D. 环形线 5.非化学剂量化合物ZnO1-x中存在 D 。 A. 填隙阳离子 B. 阳离子空位 C. 填隙阴离子 D. 阴离子空位 6. 非化学计量化合物UO2+x中存在 C 。 A. 填隙阳离子 B. 阳离子空位 C. 填隙阴离子 D. 阴离子空位 三、名词解释 1. 弗仑克尔缺陷 原子离开其平衡位置二进入附近的间隙位置,在原来位置上留下空位所形成的缺陷,特点是填隙原子与空位总是成对出现。 2.固溶体: 物种数:凡在固体条件下,一种组分(溶剂)内“溶解”了其它组分(溶质)而形成的单一、均匀的晶态固体称为固溶体。
四、解答题 1.完成下列缺陷方程式,并且写出相应的化学式 (1)NaCl 溶入CaCl 2中形成空位型固溶体; (2)CaCl 2溶人NaC1中形成空位型固溶体; 解:(1)NaCl Na Ca ’+ Cl Cl + V Cl · Ca 1-x Na x Cl 2-x (2)CaCl 2 Ca Na · + 2Cl Cl + V Na ’ Na 1-2x Ca X Cl 2完成下列缺陷方程式,并且写出相应的化学式(6分) (1)M gCl 2固溶在LiCl 晶体中形成填隙型 Li 1-x Mg x Cl 1+x (2) SrO 固溶在Li 2O 晶体中形成空位型 Li 2-2x Sr x O 3.写出下列缺陷反应式 ①.NaCl 形成肖脱基缺陷。 ②.AgI 形成弗伦克尔缺陷(Ag +进入间隙)。 ③KCl 溶入CaCl 2中形成空位型固溶体。 解:1、O→VNa ′+VCl˙ 2、Ag Ag+Vi →A g i ˙+V Ag′ ③ KCl K Ca ’+ Cl Cl + V Cl · Ca 1-x K x Cl 2-x 4 对于MgO 、Al 2O 3和Cr 2O 3,其正、负离子半径比分别为0.47,0.36和0.40。Al 2O 3和Cr 2O 3形成连续固溶体。(4分) (a )这个结果可能吗?为什么? (b )试预计,在MgO -Cr 2O 3系统中的固溶度是有限还是很大的?为什么? 答(a )可能,Al 2O 3和Cr 2O 3的正离子半径之比小于15%。晶体结构又相同。 所以可能 O Li Li O Li O V Sr S SrO +'+??→??. 2)(Cl i Li LiCl Cl Cl Mg S MgCl ++?? →??')(.2
第二章晶体结构与晶体中的缺陷 内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构, 用以掌握与本专业有关的各种晶体结构类型。介绍了实际晶体中点缺陷分 类;缺陷符号和反应平衡。固熔体分类和各类固熔体、非化学计量化学化 合物的形成条件。简述了刃位错和螺位错。 硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。硅离子是高点价低配位的阳离子。因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。表2-1列出硅酸盐晶体结构类型及实例。 表2-1 Array硅酸 盐晶 体的 结构 类型
真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。 点缺陷根据产生缺陷的原因分类,可分为下列三类: (1)热缺陷(又称本征缺陷) 热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。 弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。 肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。 (2)杂质缺陷(非本征缺陷) (3)非化学计量化学化合物 为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。 表2-2 Kroger-Vink缺陷符号(以M2+X2-为例)
小结 第二章晶体与晶体结构 内容: 金属的晶体结构: 合金的晶体结构 实际金属的晶体结构 第一节金属的晶体结构 晶体与非晶体 1. 晶体:指原子呈规则、周期性排列的固体。常态下金属主要以晶体形式存在。晶体具有各向异性。 非晶体:原子呈无规则堆积,和液体相似,亦称为“过冷液体”或“无定形体”。在一定条件下晶体和非晶体可互相转化。 2. 区别 (a)是否具有周期性、对称性 (b)是否长程有序 (c)是否有确定的熔点 (d)是否各向异性 3金属的晶体结构 晶体结构描述了晶体中原子(离子、分子)的排列方式。 1)理想晶体——实际晶体的理想化 ·三维空间无限延续,无边界 ·严格按周期性规划排列,是完整的、无缺陷。 ·原子在其平衡位置静止不动 2)理想晶体的晶体学抽象 (晶体)空间规则排列的原子→刚球模型→晶格(刚球抽象为晶格结点,构成空间格架)→晶胞(具有周期性最小组成单元)。 晶体学参数:a,b,c,α,β,γ
晶格常数:a,b,c 晶系:根据晶胞参数不同,将晶体分为七种晶系。 90%以上的金属具有立方晶系和六方晶系。 立方晶系:a=b=c,α=β=γ=90? 六方晶系:a1=a2=a3≠ c, α=β=90?, γ=120? 原子半径:晶胞中原子密度最大方向上相邻原子间距的一半。 晶胞原子数:一个晶胞内所包含的原子数目。 配位数:晶格中与任一原子距离最近且相等的原子数目。 致密度:晶胞中原子本身所占的体积百分数。 二.常见的金属晶格 晶胞晶体学参数原子半径晶胞原子数配位数致密度 2 8 68% BCC a=b=c,α=β =γ=90o FCC a=b=c, α= 4 12 74% β=γ=900 HCP a=b c, a/2 6 12 74% c/a=1.633, α =β=90o, γ =120o 第二节实际金属的晶体结构 理想晶体+晶体缺陷——实际晶体 实际晶体——单晶体和多晶体 单晶体:内部晶格位向完全一致,各向同性。 多晶体:由许多位向各不相同的单晶体块组成,各向异性。
第二章晶体结构缺陷 1、(错)位错属于线缺陷,因为它得晶格畸变区就是一条几何线。2.(错)螺型位错得柏氏失量与其位错线垂直,刃型位错得柏氏失量与其位错线就是平行。 3、(错)肖特基缺陷就是由于外来原子进入晶体而产生得缺陷。 4、(错)弗伦克尔缺陷就是由于外来原子进入晶体而产生得缺陷。 二选择题 1.非化学剂量化合物Zn1+x O中存在 A 。 A、填隙阳离子 B、阳离子空位 C、填隙阴离子 D、阴离子空位 2、非化学计量化合物UO2+x中存在 C 。 A、填隙阳离子 B、阳离子空位 C、填隙阴离子 D、阴离子空位 3.非化学剂量化合物TiO2-x中存在 D 。 A、填隙阳离子 B、阳离子空位 C、填隙阴离子 D、阴离子空位 4、螺型位错得位错线就是 A 。 A、曲线 B、直线 C、折线 D、环形线 5.非化学剂量化合物ZnO1-x中存在 D 。 A、填隙阳离子 B、阳离子空位 C、填隙阴离子 D、阴离子空位 6、非化学计量化合物UO2+x中存在 C 。 A、填隙阳离子 B、阳离子空位 C、填隙阴离子 D、阴离子空位 三、名词解释 1、弗仑克尔缺陷 原子离开其平衡位置二进入附近得间隙位置,在原来位置上留下空位所形成得缺陷,特点就是填隙原子与空位总就是成对出现。 2.固溶体: 物种数:凡在固体条件下,一种组分(溶剂)内“溶解”了其它组分(溶质)而形成得单一、均匀得晶态固体称为固溶体。 四、解答题 1.完成下列缺陷方程式,并且写出相应得化学式 (1)NaCl溶入CaCl2中形成空位型固溶体;
(2)CaCl 2溶人NaC1中形成空位型固溶体; 解:(1)NaCl Na Ca ’+ Cl Cl + V Cl · Ca 1-x Na x Cl 2-x (2)CaCl 2 Ca Na · + 2Cl Cl + V Na ’ Na 1-2x Ca X Cl 2完成下列缺陷方程式,并且写出相应得化学式(6分) (1)M gCl 2固溶在LiCl 晶体中形成填隙型 Li 1-x Mg x Cl 1+x (2) SrO 固溶在Li 2O 晶体中形成空位型 Li 2-2x Sr x O 3.写出下列缺陷反应式 ①、NaCl 形成肖脱基缺陷。 ②、AgI 形成弗伦克尔缺陷(Ag +进入间隙)。 ③KCl 溶入CaCl 2中形成空位型固溶体。 解:1、O→VNa ′+VCl˙ 2、Ag Ag+Vi →A g i ˙+V Ag′ ③ KCl K Ca ’+ Cl Cl + V Cl · Ca 1-x K x Cl 2-x 4 对于MgO 、Al 2O 3与Cr 2O 3,其正、负离子半径比分别为0、47,0、36与0、40。Al 2O 3与Cr 2O 3形成连续固溶体。(4分) (a )这个结果可能吗?为什么? (b )试预计,在MgO -Cr 2O 3系统中得固溶度就是有限还就是很大得?为什 么? 答(a )可能,Al 2O 3与Cr 2O 3得正离子半径之比小于15%。晶体结构又相同。 所以可能 (b )MgO -Cr 2O 3系统中得固溶度就是有限得,由于得晶体结构不同。 O Li Li O Li O V Sr S SrO +'+??→??. 2)(Cl i Li LiCl Cl Cl Mg S MgCl ++?? →??')(.2
第二章金属及合金的晶体结构 金属材料是指以金属键来表征其特性的材料,它包括金属及其合金。金属材料在固态下通常都是晶体状态,所以要研究金属及合金的结构就必须首先研究晶体结构。 一、晶体的基本概念 晶体结构指晶体内部原子规则排列的方式。晶体结构不同,其性能往往相差很大。为了便于分析研究各种晶体中原子或分子的排列情况,通常把原子抽象为几何点,并用许多假想的直线连接起来,这样得到的三维空间几何格架称为晶格,如图2-3(b)所示;晶格中各连线的交点称为结点;组成晶格的最小几何单元称为晶胞,晶胞各边的尺寸a、b、c称为晶格常数,其大小通常以为计量单位(A),晶胞各边之间的相互夹角分别以α、β、γ表示。图2-3(c)所示的晶胞为简单立方晶胞,其晶格常数a=b=c,而α=β=γ=90o。由于晶体中原子重复排列的规律性,因此晶胞可以表示晶格中原子排列的特征。在研究晶体结构时,通常以晶胞作为代表来考查。 为了描述晶格中原子排列的紧密程度,通常采用配位数和致密度(K)来表示。配位数是指晶格中与任一原子处于相等距离并相距最近的原子数目;致密度是指晶胞中原子本身所占的体积百分数,即晶胞中所包含的原子体积与晶胞体积(V)的比值。 图2-3 简单立方晶体 (a)晶体结构(b)晶格(c)晶胞 二、常见纯金属的晶格类型 在金属元素中,除少数具有复杂的晶体结构外,大多数具有简单的晶体结构,常见的晶格类型有以下三种:1.体心立方晶格 体心立方晶格的晶胞如图2-4所示。它的形状是一个立方体,其晶格常数a=b=c,所以只要一个常数a即可表示;其α=β=γ=90o。在体心立方晶胞中,原子位于立方体的八个顶角和中心。属于这类晶格的金属有α-Fe、Cr、V、W、Mo、Nb等。
晶体结构分类方法
(B) 2.1 符号中的第一个大写字母表示结构的类型,后面的数字为第个大写字母表示结构的类型后面的数字为顺序号,不同的顺序号表示不同的结构,例如A1是铜型结 结构等。 构,B2是CsCl型结构等,C3是FeS 2
Pearson符号 它所属的布喇菲点阵类型(例如P、I、F、C等),第三个数 等) 字表示单胞中的原子数。 2.2 金属单质的晶体结构 在元素周期表中,共有70多种金属元素。
由于金属键不具有饱和性和方向性,使金属的晶体结构倾向配位数(
将用原子刚性球模型讨论每个单胞所含的原子数以及这些构中的间隙等。 2.2.1 面心立方结构 结构符号是A1,Pearson 符号是c F4。 原子坐标为0 0 0,0 1/2 1/2,1/2 0 1/2和1/2 1/2 0 每个晶胞含4个原子 最紧密排列面是{111},密排方向 是<110>。原子直径是a/2<110>的 长度,即 面心立方结构的晶胞体积为a 3, 晶胞内含4个原子,所以它的致密 度η为4 2a r =423443443 3 33? ??? ????×=×=ππηa r 每个原子有个最近邻原子,它的 配位数(CN )是12。 74 .062 ==πa a
面心立方结构的最密 排面是{111},面心立 方结构是以{111}最密 排面按一定的次序堆 垛起来的。 第一层{111}面上有两个 可堆放的位置:▲和▼位 可堆放的位置▲和▼位 置,在第二层只能放在一 种位置,在面上每个球和 下层3个球相切,也和上 层3个球相切。 第一层为A,第 二放在B 位置, 第三层放在C 位 置,第四层在 置第四层在 放回A位置。 {111}面 按…abcabc… 顺序排列,这 就形成面心立 方结构。
第二章 晶体结构 2.1 (1)证明:如图所示,六角层内最近邻原子间距为a ,而相邻两层间的最近邻原子间距为: ( )2 1 2 2 4 3 c a d +=, 当a d =时构成理想的密堆六角结构,此时有: ( )2 1 2 2 4 3 c a a +=, 由此解出,() 633.138 2 1==a c (2)解:(2)体心立方每个单胞包含2个基元,一个基元所占的体积为 23 c c a V = , 单位体积内的格点数为. 1 Vc 六角密堆积每个单胞包含6个基元,一个基元所占的体积为 3 2 1 222 23843436/323a a a c a c a a V s = ? ?? ???==???? ? ????= 因为密度不变,所以 s c V V 11=,即:3 3 2 22/a a c = nm a a c s 377.02 /6 1== nm a c s 615.0633.1== 2.2证明: 设简单六角布拉菲格子基矢如图示 :
∧ ∧∧ ∧ =+ = =z c a y a x a a x a a 321, 2 32 , 则其倒格子的三个基矢为 ()( )( ) ∧ ∧ ∧∧= == ?=???? ??-=?=z c b y a a a b y x a a a b ππ ππ ππ 223322233223 2133 211323 211 另知21,b b 的夹角为120度,且 a 34π= =,2313,b b b b ⊥⊥ 故简单六角布拉菲格子的倒格子仍为简单六角,倒格子的晶格常数分别为 a c 34, 2ππ,倒格 子相对于正格子绕c 轴旋转30度,(如图中标出321,,b b b 更清晰) 2.3 体心立方
第二章 晶体结构 2.1 晶体结构 1 晶格和基元 理想晶体中原子排列是十分规则的,主要体现是原子排列具有周期性,或者称为是长程有序的。非晶体则不具有长程有序的性质,但是在非晶体中原子排列也不是杂乱无章、完全无序的,仍然保留有原子排列的短程序。1984年在实验中发现了一类和晶体、非晶体都不相同的固体,在这类固体中发现了已经证明在晶体中不可能存在的五重对称轴,使人们想到介于晶体和非晶体之间的固体,称为准晶体。在这一章我们首先讨论有关晶体的问题。 所有晶体的结构用晶格来描述,晶格是一种数学上的抽象,它是由数学上的几何点在空间有规律地作周期性的无限重复分布构成的。这种晶格的每一个格点上附有一群完全相同的原子,这样一个完全相同的原子群称为基元。当原子基元以相同的方式安置在每一个格点上,就构成了晶体结构。简单地说晶格加基元就形成晶体结构。由无数的小单晶体无规则地结合成的大晶体叫多晶体。 2 原胞和基矢 所有晶格的共同特点是具有周期性,通常用原胞和基矢来描述晶格的周期性,晶格的原胞 (Primitive cell) 是指一个晶格最小的周期性单元,对三维晶格来说是可以一个平行六面体,对二维晶格可以是一个平行四边形。原胞的选取是不唯一的。原则上讲只要是最小周期性单元都可以。判断最小周期性单元的标准只要考察这个重复单元中是否只包含一个格点。但是实际上各种晶格结构已经有习惯的原胞选取方式。晶格基矢是指原胞的边矢量,一般用a 1, a 2, a 3表示。原胞的体积为: Ω=a 1 ? a 2 ? a 3 (2.1.1) 简单立方晶格的立方单元就是最小的周期性单元,通常就选取它作为原胞。它的三个基矢为: ??? ??===k a j a i a a a a 3 21 (2.1.2) 体心立方晶格和面心立方晶格的立方单元都不是最小的周期性单元。在体心立方晶格中,通常由一个立方顶点到最近的三个体心得到三个晶格基矢: ()()()??? ? ? ???? -+=-+=-+=j i k a i k j a k j i a 222 3 21a a a (2.1.3) 以这三个晶格基矢为边的平行六面体就是相应的体心立方的原胞。 在面心立方晶格中,通常由一个立方顶点到三个相邻的面心的矢量作为晶格基矢: () ()() ??? ? ? ???? += += +=i k a k j a j i a 2 22 321a a a (2.1.4) 以这三个晶格基矢为边的平行六面体就是相应的面心立方的原胞。 图2.1.1 体心立方和面心立方晶格的单胞和原胞 作由晶格原点出发的所有晶格矢量的垂直平分面,这些垂直平分面所封闭的包含晶格原点的最小空间,称为Wigner -Seitz 原胞。体心立方和面心立方晶格的Wigner -Seitz 原胞如图1.1.2所示。
Chapter Outline ?金属的晶体结构 ?密排面堆积方式 ?晶体结构间隙 ?固溶体 ?中间相结构
常见金属的晶体结构 面心立方结构(A1)face-centred cubic lattice 体心立方结构(A2) body-centred cubic lat tice 密排立方结构(A3)hexagonal close-packed lattice A B A ?金属键无饱和性和方向性,使其晶 体结构倾向于最紧密堆垛。 ?将原子看作刚性球,构成相互接触 圆球模型,更确切表示原子排列。 ?面心原子shared by 2 cells: 6 x 1/2 = 3?顶角原子shared by 8 cells: 8 x 1/8 = 1 面心立方结构金属:γ-Fe, Al, Cu, Ni, Au, Ag 和Pt 等。 面心立方结构 ?结构符号A1,Pearson 符号c F4。 ?每个晶胞含4个原子。(0,1/2,1/2)● (0,0,0) ●(1/2,1/2,0)●●(1/2,0,1/2)
配位数与致密度 面心立方结构的致密度η为?致密度η是衡量原子堆垛紧密程度的,为晶胞中原子所占体积(V a )与晶胞体积(V )的比值:η=V a / V ?面心立方晶胞面对角线为原子半径的4倍,即()r 24/=a ?配位数(Coordination Number——CN )是晶体结构中每个原子的最近邻原子数目。a/2 2密排面{111}密排方向 <110> ?面心立方结构的配位数为12,最近 原子间距离为?结构符号A2,Pearson 符号c I2?每个晶胞含2个原子 体心立方结构 ?体心立方结构的金属包括:α-Fe, Cr, W, Mo, V 和Nb 等。 ?体心立方结构配位数为8,原子间距a/23?还有6个次近邻原子,间距为a ,相差15.5%。?体心配位数也表示为CN=8+6。 体心立方结构的致密度η为 体心立方晶胞体对角线为原子半径的4倍,即()r 34/=a 体心原子shared by 0 cells: 1 x 1 = 1 顶角原子shared by 8 cells: 8 x 1/8 = 1 (1/2 1/2 1/2)●(000)●密排面{110} 密排方向<111>
内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构, 用以掌握与本专业有关的各种晶体结构类型。介绍了实际晶体中点缺陷分 类;缺陷符号和反应平衡。固熔体分类和各类固熔体、非化学计量化学化 合物的形成条件。简述了刃位错和螺位错。 硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。硅离子是高点价低配位的阳离子。因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。表2-1列出硅酸盐晶体结构类型及实例。 表2-1 Array硅酸 盐晶 体的 结构 类型
真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。 点缺陷根据产生缺陷的原因分类,可分为下列三类: (1)热缺陷(又称本征缺陷) 热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。 弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。 肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。 (2)杂质缺陷(非本征缺陷) (3)非化学计量化学化合物 为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。 表2-2 Kroger-Vink缺陷符号(以M2+X2-为例)
习题集部分参考答案 2金属的晶体结构 思考题 1.晶体和非晶体的主要区别是什么? 答:晶体和非晶体的区别在于内部原子的排列方式。晶体内部的原子(或分子)在三维空间按一定规律作周期性排列,而非晶体内部的原子(或分子)则是杂乱分布的,至多有些局部的短程规律排列。因为排列方式的不同,性能上也有所差异。晶体有固定的熔点,非晶体没有,晶体具有各向异性,而非晶体则是各向同性。 2.何为各向异性? 答:各向异性是指晶体的某些物理性能和力学性能在不同方向上具有不同的数值。 3.为什么单晶体呈各向异性,而多晶体通常呈各向同性? 答:单晶体是原子排列方位完全一致的一个晶粒,由于在不同晶向上原子密度不同,原子间的结合力不同,因而导致在单晶体中的各个方向上性能差异。 对于多晶体中的任意一个晶粒来看,基本满足单晶体的特征,呈现各向异性,但是在多晶体系统中,单一晶粒的各向异性已经被周围其他位向的晶粒所“干扰”或“抵消”,整个多晶系统呈现其各向同性。 4.什么叫晶体缺陷?晶体中可能有哪些晶体缺陷?他们的存在有何实际意义? 答:晶体缺陷是指金属晶体中原子排列的不完整性。常见的晶体缺陷有点缺陷、线缺陷和面缺陷三类,它们都会造成材料的晶格畸变。 点缺陷是指呈点状分布的缺陷,包含有空位、间隙原子和置换原子等,它对材料中的原子扩散、固态相变,以及材料的物理性能(电阻、体积、密度)等都会产生重大影响。过饱和的点缺陷还可以提高材料的强度。 线缺陷是各种类型的位错。对材料的变形、扩散以及相变起着非常大的作用。特别它很好地解释了塑性变形的微观机理,使我们了解到滑移是借助于位错的运动来实现的。当位错密度不高的情况下,位错支持了滑移,材料的塑性很好,但是当位错密度达到了较高的水平时,位错间的相互作用会造成位错的彼此“纠缠”,使滑移运动受阻,这时表现出材料的塑性变形的抗力提高,材料的强度提高。 金属晶体中面缺陷主要有晶界、亚晶界、孪晶界和相界等。比如:晶界处原子的平均能量比晶内高,在高温时,晶粒容易长大。晶界和亚晶界均可提高金属的强度。单位体积中的晶粒数目越多,晶界面积越大,晶格畸变越严重,材料的强度越高,同时材料的塑性也较好(同样的变形量可以分散到更多的晶粒中去进行,说明材料可以承受更大的变形量)。
第二章晶体结构及常见晶体结构类型 1、名词解释 (a)晶体与晶体常数(b)类质同晶和同质多晶(c)二八面体型与三八面体型(d)同晶取代与阳离子交换(e)尖晶石与反尖晶石(f)晶胞与晶胞参数(g)配位数与配位体(h)同质多晶与多晶转变(i)位移性转变与重建性转变(j)晶体场理论与配位场理论 解:(a)晶体是内部质点在三维空间成周期性重复排列的固体。或晶体是具格子构造的固体。晶体常数:晶轴轴率或轴单位,轴角。 (b)类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。 同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。(c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体型结构。 三八面体型:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三八面体型结构。 (d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构类型的现象。 阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层时,一些电价低、半径大的阳离子(如K+、Na+等)将进入晶体 结构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下可以被其它阳离子交换。 (e)正尖晶石:在AB2O4尖晶石型晶体结构中,若A2+分布在四面体空隙、而B3+分布于八面体空隙,称为正尖晶石; 反尖晶石:若A2+分布在八面体空隙、而B3+一半分布于四面体空隙另一半分布于八面体空隙,通式为B(AB)O4,称为反尖晶石。 (f)任何晶体都对应一种布拉菲格子,因此任何晶体都可划分出与此种布拉菲格子平行六面体相对应的部分,这一部分晶体就称为晶胞。晶胞是能够反映晶体
第二章 晶体的结构习题 1.晶面指数为(123)的晶面ABC 是离原点O 最近的晶面,0A ,0B 和0C 分别与基矢1a ,2a 和3a 重合,除0点外,0A ,0B ,和0C 上是否有格点若ABC 面的指数为(234),情况又如何 (答案: 只有A 点是格点; A 、B 、和C 都不是格点) 2.在结晶学中,晶胞是按晶体的什么特性选取的 3. 在晶体衍射中,为什么不能用可见光 4.温度升高时,衍射角如何变化X 光波长变化时,衍射角如何变化 (答案: 衍射角变小; 衍射角变大) 5.以刚性原子球堆积模型,计算以下各结构的致密度(一个晶胞中刚性原子球占据的体积与晶胞体积的比值称为结构的致密度)分别为: (1)简立方,6π ; (2)体心立方,π83 ;(3)面心立方,π62 ; (4)金刚石结构,π16 3 。 6. 在立方晶胞中,画出(101),(021)晶面。 | 7. 六角晶胞的基矢 j a ai a 223+=, j a ai b 2 23+-=,ck c =。求其倒格基矢。 (答案: )33(2*j i a a +=π, )33(2*j i a b +-=π,k c c π2*=) 8. 证明以下结构晶面族的面间距: (1) 立方晶系:2/1222][-++=l k h a d hkl ; (2) (2)正交晶系:2/1222])()()[(-++=c l b k a h d hkl ; (3)六角晶系:2/12222])()(34[-+++=c l a hk k h d hkl 。 9.求晶格常数为a 的面心立方和体心立方晶体晶面族)(321h h h 的面间距。 (答案:2 /1232123212321])()()[(h h h h h h h h h a -+++-+++-; 2/1221213232])()()[(h h h h h h a +++++)。