
1. 小芳设计了如下气体制取与性质验证的组合装置。打开分液漏斗活塞放出一定量过氧化氢溶液后,
关上活塞,A中出现大量气泡,
B中白磷燃烧,C中液面下降,
稀盐酸逐渐进入D中。请看图回
答问题:
(1)A中发生反应的化学方程
式为。
(2)B中白磷能够在水下燃烧的原因是。
(3)E中的实验现象是。
(4)用F装置收集气体的依据是。
2. 水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】 a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有。B中变化的化学方程式为。
(2)装置C中的药品为。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是; E中的变化说明氧化铜具有性。
【实验结论】猜想正确。
【实验反思】
经过讨论,同学们将上图中装置C~H进行了简化,只用右图所示装置并自
选必要试剂就能完成探究。其中,干燥管中碱石灰的作用
为,烧杯上能观察到的现象
是。最后一步的实验操作及现象
是。
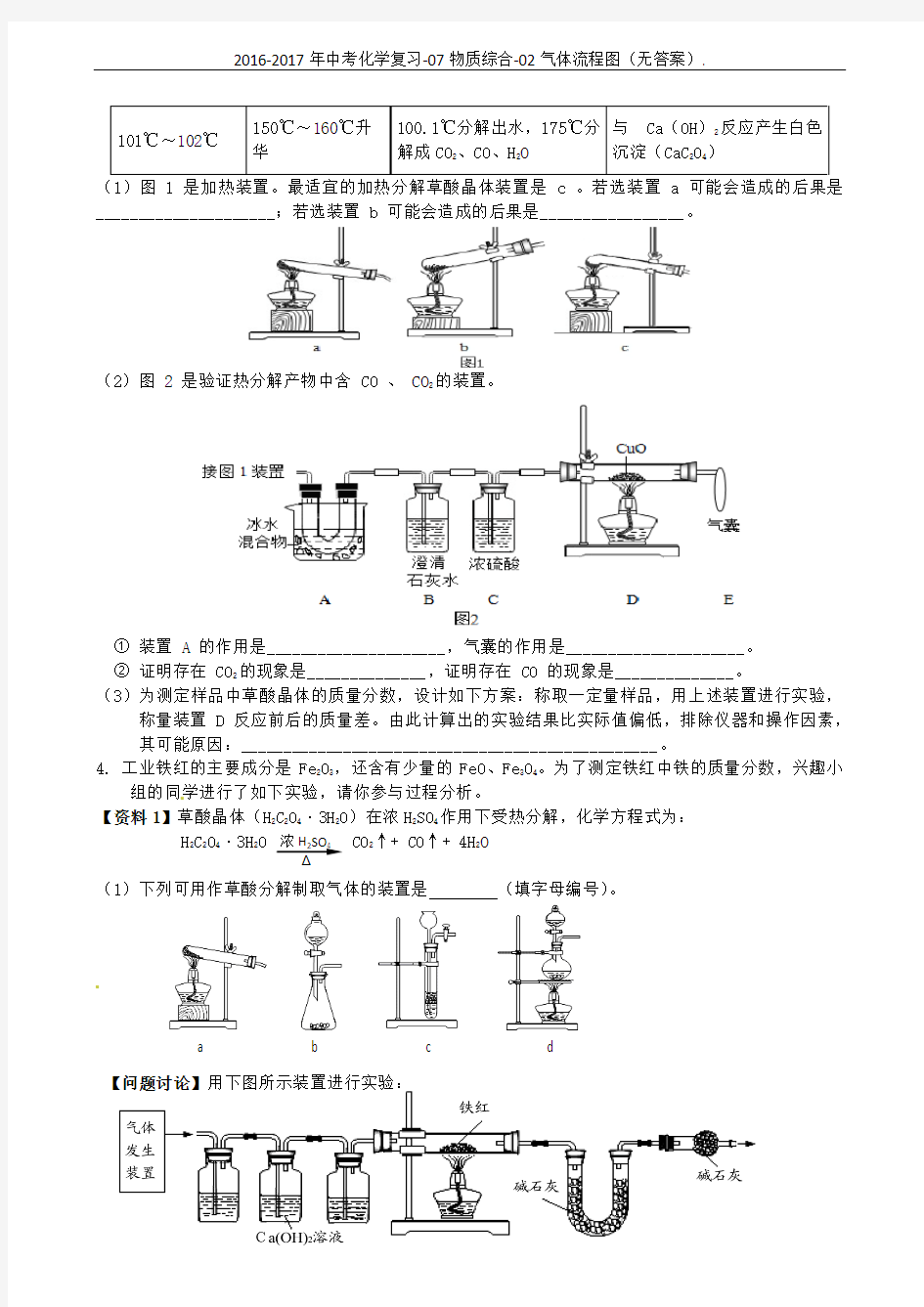
3. 某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量
分数(假设杂质不参与反应)。已知:浓硫酸可作为干燥剂;草酸晶体
2242
a b c d _____________________;若选装置 b 可能会造成的后果是_________________。
(2)图 2 是验证热分解产物中含 CO 、 CO 2的装置。
① 装置 A 的作用是_____________________,气囊的作用是_____________________。
② 证明存在 CO 2的现象是______________,证明存在 CO 的现象是______________。
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,
称量装置 D 反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:_________________________________________________。
4. 工业铁红的主要成分是Fe 2O 3,还含有少量的FeO 、Fe 3O 4。为了测定铁红中铁的质量分数,兴趣小
组的同学进行了如下实验,请你参与过程分析。
【资料1】草酸晶体(H 2C 2O 4·3H 2O )在浓H 2SO 4作用下受热分解,化学方程式为:
H 2C 2O 4·3H 2O CO 2↑+ CO ↑+ 4H 2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。
【问题讨论】用下图所示装置进行实验:
浓H 2SO 4 Δ
A B C D E
F
(2)实验前应先 。
(3)进入D 中的气体是纯净、干燥的CO ,则A 、C 中的试剂依次是 、 (填字母编号)。
a .浓硫酸
b .澄清的石灰水
c .氢氧化钠溶液
(4)B 装置的作用是 。
(5)对D 装置加热前和停止加热后,都要通入过量的CO ,其作用分别是:
①加热前 。 ②停止加热后 。
(6)写出D 装置中所发生反应的一个化学方程式 。
【数据分析与计算】【资料2】铁的常见氧化物中铁的质量分数:
(7)称取铁红样品10.0 g ,用上述装置进行实验,测定铁红中铁的质量分数。
① D 中充分反应后得到Fe 粉的质量为m g ,则 < m < 。
② 实验前后称得E 装置增重6.6g ,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C 装置(不考虑其它因素),则测得样品中铁的质量分数 会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。
5.某化学兴趣小组对某品牌牙膏中摩擦剂的成分及含量进行如下探究:
查阅资料:获得如下信息:
(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其余成分遇盐酸无气体生成。
(2)氢氧化铝性质:白色固体、难溶于水也难溶于氨水,存在如下反应:Al(OH)3+NaOH=NaAlO 2+2H 2O ; NaAlO 2溶液与过量二氧化碳发生如下反应:NaAlO 2 + CO 2 + 2H 2O = NaHCO 3 + Al(OH)3↓
探究Ⅰ:验证该品牌牙膏摩擦剂中含有氢氧化铝
部分实验过程如下:
(1)步骤②中,加入的试剂A 是 ,目的是 。
(2)步骤③中,往滤液Ⅱ先通入过量二氧化碳,再加入过量稀盐酸,先后观察到的现象
为 。
探究Ⅱ:测定该品牌牙膏摩擦剂中碳酸钙的含量
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C 中生成的沉淀质量,以确定样品中碳酸钙的质量分数。
(3)A 装置的目的
是 ;
写出该反应的化学方程
式: 。
(4)B 装置中加入酸碱指示剂的目的
是 ;写出该装置中发生反应的其中一个化学方程
式:。
(5)实验结束前仍继续通入空气一段时间,目的是。
(6)实验中准确称取16.00 g样品三份,分别进行三次测定,测得C中沉淀的平均质量为4.00 g。
则样品中碳酸钙的质量分数为_ _。
(7)有人认为不必测定C中生成沉淀质量,根据质量守恒定律,只要测定装置C在吸收气体前后的质量差,同样可以测定碳酸钙的质量分数。你认为该观点是否正确?;理由是:。
6. 一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研究性学习小组的
同学在老师的指导下对该产品开展了以下探究活动。
【查阅资料】
“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为122),它是一种白色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物质,是当前使用最为广泛的洗涤助剂之一。
【实验探究一】过碳酸钠的化学组成
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定该样品中过碳酸钠的含量,同学们经讨论设计了如下图所示的实验装置。图中装置B盛装氢氧化钠溶液、C盛装澄清石灰水、D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气)。
A B C D E F
(1)首先关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置B的作用是;
(2)依次关闭活塞K1、K3、K4,打开活塞K2、K,此时锥形瓶中反应生成的气体是,E中装入碱石灰的作用是,反应完全后关闭活塞K,再次打开活塞K1通入氮气的作用是;
(3)同学们根据E装置在测定前后的质量差计算出了样品中过碳酸钠的含量。装置F的作用是,如不连接装置F,测定的过碳酸钠含量会(填“偏高”或“偏低”)。