
避光药品分级表
关于避光药品目录的文献说明
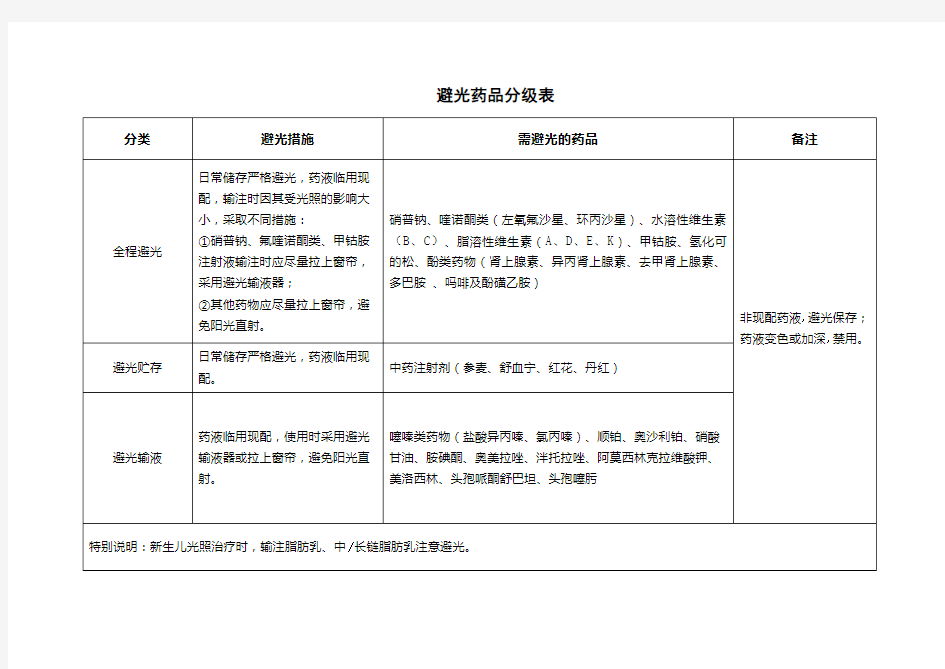
硝普钠的光解过程十分复杂, 且光解产物与照射光源有关。在不避光的条件下, 其pH 值和含量在5 min 左右就会发生较大的改变。且其溶液不稳定, 见光降解生成氰化物, 输入体内增加对人体的毒性, 故在临床上需临用前配制, 更应注意全程避光 [1]。
中国药品生物制品研究所的杨亚莉等 [2]比较了司帕沙星、环丙沙星、左氧氟沙星、洛美沙星水溶液在 UVA 光照下紫外光谱的变化, 并根据 HPLC法测定光照过程的含量, 求出光解动力学参数T1/2 , 溶液中光稳定性顺序为司帕沙星>环丙沙星>左氧氟沙星> 洛美沙星,其中左氧氟沙星半衰期减少到35.4min,环丙沙星半衰期减少到51.0min[2],因氟喹诺酮类药物会诱发患者的光毒性反应,即患者皮肤第一次接触光敏性物质后, 在无害的光线照射强度下诱发产生的异常的皮肤反应(如红斑、水泡等),提示应用氟喹诺酮类药物时既要注意药品的全程避光,更要注意病室的光照管理。
噻嗪类药物(盐酸异丙嗪、氯丙嗪)在光、金属离子、氧的作用下,极易发生氧化变色,有研究表明盐酸氯丙嗪溶于5%葡萄糖氯化钠溶液后,在避光下保持24 h,液体澄明,无变化;随后将该袋输液直接放在光照下照射1h左右即出现少量蓝色絮状团块样物质[3],因此要求噻嗪类药物在输注时应现配现用,并严格避光,以保证用药的安全性和有效性。
研究发现水溶性维生素(B、C)在日光照射下降解极快,如10ug/ml的维生素C溶液在日照5min
在高压汞灯下含量变化迅速,原料的半后的保存率仅为 6.4%[4],而饶桂香等做的研究也表明维生素B
2
衰期仅为68h[5],因此水溶性维生素仍应全程避光。
由于顺铂溶解后在光线较强的情况下(如太阳光直射),发生光水合反应和光氧化还原反应,终析出金属铂,是很多铂族金属配合物(包括奥沙利铂)的特性[6]。因此,照药品说明书的要求,药使用时建议使用避光输液器给药。
脂溶性维生素(A、D、E、K)在与水溶液配伍4h后各维生素成分均出现了迅速分解,与对照组(避光)均出现了统计学差异,尤其是维生素A与维生素K,为显著性差异[7],由于我院的脂溶性维生素剂型多为注射液,要求脂溶性维生素应全程避光。
甲钴胺注射液说明书(厂家:卫材药业有限公司)描述为“给药时:见光易分解,封后立即使用的同时,注意避光。从遮光保护袋中取出后应立即使用”。由于甲钴胺结构中β位的烷基具有强烈的斥电子作用,得Co-CH3键能减弱,光照射易发生断裂。该药稀释后,钴胺分子被溶剂分子分散、透光性增加,上氧化作用、光解大大增强,钴胺有效成分即较快降解[8]。
林涛等[9]采用自然光照射实验预测氢化可的松注射液在自然光照射下的贮存期,发现氢化可的松降解呈零级反应,降解周期仅为36天,因此氢化可的松仍应全程避光,减少不必要含量消耗。
硝酸甘油注射液、胺碘酮注射液及部分注射用质子泵抑制剂以及β-内酰胺类抗菌药物等或其经溶剂稀释后,置在光线较强环境中一定时间后成分均可能会发生变化[10-12]。因此上述这些药品在临床使用时,现用现配,免在光线较强的环境中(如阳光直射下)注射,采取关闭室内日光灯、拉上窗帘等避光措施[13]。
酚类药物(含酚羟基的药物如肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡及酚磺乙胺等)在氧、金属离子、光线、温度等的影响下, 易氧化变质,提示贮存、使用时宜避光[14]。
中药注射剂(参麦、舒血宁、红花、丹红、丹参)因其成分复杂,未能进行稳定性实验,但为避免不良反应,应按说明书采取日常避光措施。
【参考文献】
[1]刘高峰 , 刘蕊 , 刘军.注射用硝普钠溶液稳定性的考察[J] .中国药师, 2009,12(3):343-345.
[2]杨亚莉 , 胡昌勤 , 金少鸿.4 种氟喹诺酮类抗生素水溶液的光稳定性研究 [J] .药物分析杂志 , 2004, 24 (1):71.
[3]曹跃利 .复方氯丙嗪静滴时应注意避光 [J] .辽宁药物与临床 , 2001,4(2):90.
[4]丁健桦,饶火瑜,王兴祥 . HPLC法初步研究维生素C的稳定性 [J] .食品工业, 2004,1:44-45.
[5]饶桂香,达明,何静 .维生素B2对光的稳定性研究[J] .华西药学杂志, 1994,9(3):172-175.
[6]张翠莲,王彪,佟勐. 临床输注条件下顺铂的光稳定性研究[J] .中国药学杂志,2009,44(20):1578-1581.
[7]周远华,方海顺,苏广海. 注射用脂溶性维生素(Ⅰ) 与两种常用输液的配伍稳定性考察[J] .中国药师,2013,16(4):573-576.
[8] 吴李菊,刘军旗.甲钴胺注射液的光稳定研究及其对临床用药的指导意义[J].黑龙江医药,2006,
9(2):127.
[9]林涛,李开兰,李成蓉. 氢化可的松注射液在光作用下的稳定性研究[J].华西医大学报,2001,
32(2): 315- 316.
[10] 王广进,张福仁.药物诱发的光敏反应[J].中国中西医结合皮肤性病学杂志,2009,(2):131.
[11] 黄佳,杨莉,赵志刚,等.药源性光敏反应的致敏药物及防治[J].药品评价,2014,1(2):17.
[12] 马媛,刘治军.临床常见对光照和温度有特殊要求的药品汇总分析[J].齐鲁药事,2011,0(6):340.
[13] 杨吉德,刘金荣.光敏性药物及其危害[J].内蒙古中医药,2012,1(22):38.
[14] 廖伟雄 .酚磺乙胺在输液中的稳定性考察[J] .西北药学杂志 ,2000,15 (4):168.
附件2:化学药品注册分类及申报资料要求 一、注册分类 1. 未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2. 改变给药途径且尚未在国内外上市销售的制剂。 3. 已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4. 改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原 料药及其制剂。 5. 改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6. 已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1. 药品名称。 2. 证明性文件。 3. 立题目的与依据。 4. 对主要研究结果的总结及评价。 5. 药品说明书、起草说明及相关参考文献。 6. 包装、标签设计样稿。 (二)药学研究资料 7. 药学研究资料综述。 8. 原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9. 确证化学结构或者组份的试验资料及文献资料。 10. 质量研究工作的试验资料及文献资料。 11. 药品标准及起草说明,并提供标准品或者对照品。 12. 样品的检验报告书。 13. 原料药、辅料的来源及质量标准、检验报告书。 14. 药物稳定性研究的试验资料及文献资料。 15. 直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16. 药理毒理研究资料综述。 17. 主要药效学试验资料及文献资料。
需要避光使用的药物 主讲人:赵志强 课件日期:2017.1.13 主持人:范小娟 避光药物稳定性差,遇光易发生氧化、分解、变色等反应,尤其是一些化疗药物,溶解后可发生裂环、重排、水解、聚合、氧化、异构化等复杂的反应,光照条件下可催化上述反应的进程。因此避光药物要注意避光。 药物的避光包括贮藏过程中的避光及使用过程中的避光两种。避光药物在贮藏过程中均需要遮光保存。但具体在药物使用的过程中,是否也同样需要避光呢?这要看具体药物的种类,有些是要求严格避光的,这在药品说明书一般均有明确要求,如下所列药物均要求使用过程中需要避光。 1.硝普钠:本品对光敏感,溶液稳定性较差,滴注溶液应新鲜配制并迅速将输液瓶用黑纸或铝箔包裹避光。新配溶液为淡棕色,如变为暗棕色、橙色或蓝色,应弃去。溶液的保存与应用不应超过24小时。溶液内不宜加入其他药品。 2.尼莫地平:尼奠地平输液的活性成份有轻微的光敏感性。应避免在太阳光直射下使用。如果输液过程中不可避免暴露于太阳光下,应采用黑色、棕色或红色的玻璃注射器及输液管或用不透光材料将输液泵及输液管包裹或遵医嘱。但如果在散射性日光或人工光源下,使用本品10小时内不必采取特殊的保护措施。 3.甲钴铵注射液:见光易分解,开封后应立即使用,应注意避光。 4.依诺沙星和氟罗沙星:依诺沙星每0.2g加入到5%葡萄糖注射液100ml内溶解后,避光静脉滴注。氟罗沙星,避光缓慢静脉滴注,一次0.2~0.4g,一日1次,稀释于250-500ml5%葡萄糖注射液中。 5. 两性霉素B:静脉滴注或鞘内给药时,均先以灭菌注射用水10ml配制本品50mg,或5ml配制25mg,然后用5%葡萄糖注射液稀释(不可用氯化钠注射液,
许可事项化学药品注册分类 一、化学药品注册分类 1、未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。 2、改变给药途径且尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的原料药及其制剂; (2)已在国外上市销售的复方制剂; (3)改变给药途径并已在国外上市销售的制剂。 4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6、已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1、药品名称。 2、证明性文件。 3、立题目的与依据。 4、对主要研究结果的总结及评价。 5、药品说明书样稿、起草说明及最新参考文献。 6、包装、标签设计样稿。
(二)药学研究资料 7、药学研究资料综述。 8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9、确证化学结构或者组份的试验资料及文献资料。 10、质量研究工作的试验资料及文献资料。 11、药品标准草案及起草说明,并提供标准品或者对照品。 12、样品的检验报告书。 13、辅料的来源及质量标准。 14、药物稳定性研究的试验资料及文献资料。 15、直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16、药理毒理研究资料综述。 17、主要药效学试验资料及文献资料。 18、一般药理研究的试验资料及文献资料。 19、急性毒性试验资料及文献资料。 20、长期毒性试验资料及文献资料。 21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等主要与局部、全身给药相关的特殊安全性试验研究和文献资料。 22、复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。 23、致突变试验资料及文献资料。 24、生殖毒性试验资料及文献资料。 25、致癌试验资料及文献资料。
书山有路勤为径,学海无涯苦作舟 常用危险化学品分类明细表-爆炸品 爆炸品类具有整体爆炸危险的物质和物品。表A1 序号品名别名分 子式(或结构式)主(次)危险性类别危险特性标志 1 2,4,6-三硝基甲苯(干 的或含水小于30)trinitrotoluene 梯恩梯茶色炸药CH3C6H2(NO2)3 爆炸性(有毒)5.13,5.17,5.37,5.57,5.110,5.1201(26)2 2,4,6-三硝基苯甲硝胺2,4,6- trinitrophenylmethyl nitramine 特屈儿(NO2)3C6H2N(NO2)CH2 5.13,5.31,5.38,5.57,5.95,5.1103 2,4,7-三硝基芴酮2,4,7-trinitrofluorenone C6H3(NO2)COC6H(NO2)2 5.9,5.57,5.85,5.1104 2,4,6-三硝基苯胺2,4,6- trinitroaniline 苦基胺NH2C6H2(NO2)3 爆炸性 5.13,5.57,5.1101 5 1,3,5-三硝基苯(干的或含水小于30)1,3,5-trinitrobenzene 均三硝基苯C6H3(NO2)3 5.13,5.57 6 2,4,6-三硝基苯甲酸(干的或含水小于30%)2,4,6-trinitrobenzoic acid 三硝基安息 香酸C6H2(NO2)3COOH 5.13,5.57 7 三硝基苯甲醚trinitroanisole 三硝基茴香醚 苦味酸甲酯C6H2(OCH3)(NO2)3 5.13,5.23,5.57,5.1108 2,4,6-三硝基苯酚(干的或含水小于30%)2,4,6-trinitrophenol 苦味酸(NO2)3C6H2OH 爆炸性(有毒)5.13,5.57,5.94,5.1101(26)9 2,4,6-三硝基苯酚铵(干的或含水小于10%)2,4,6- ammonium trinitrophenol 苦味酸铵C6H2(NO2)3ONH4 爆炸性5.13,5.32,5.36,5.57,5.711 10 2,4,6-三硝基氯苯2,4,6-trinitrochlorobenzene 苦酰氯苦基氯C6H2Cl(NO2)3 5.13,5.57 11 三硝基萘trinitronaphthalene (NO2)C10H5 5.13,5.57,5.9012 六硝基二苯胺(含水<75%)hexanitrodiphenyl-amine 二苦基胺、六硝炸药(NO2)3C6H2NHC6H2(NO2)3 爆炸性(有毒) 5.13,5.18,5.32,5.57,5.94,5.105,5.1121(26)[next]13 2,3,4,6-四硝基苯胺2,3,4,6- tetranitroaniline C6H(NO2)4NH2 爆炸性5.13,5.57,5.1101 14 环三次甲基三硝胺(含水≥15%或含钝感剂)cyclotrimethylene-trinitramine 黑索金、旋风炸药
常用避光药物 特级避光药品:硝普钠。本品对光敏感,溶液稳定性较差,滴注溶液应新鲜 配制 并注意避光,如变为暗棕色,橙色或蓝色,禁用。静滴时,输液器要用 铝箔或 不透光材料包裹使其避光。 一级避光药品:盐酸左氧氟沙星、两性霉素B 、阿霉素。盐酸左氧氟沙星 可引 起 少见的光毒性反应(发生率v 0.1%),在接受本品治疗时应避免过度阳光暴晒和人 工紫外线,如出现 光敏反应或皮肤损伤应停用本品,故在输液过程中应注意避光; 两性霉素B 滴注时必须临时配制,避光滴注;阿霉素滴注时必须临时配制,避光滴 注。 二级避光药品:尼莫地平、盐酸异丙嗪、盐酸氯丙嗪、水溶性维生素、肾上 腺 素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡、卡铂、顺铂、奥沙利铂、环 磷酰胺、阿糖胞苷、甲氨蝶呤、氟尿嘧啶。 由于尼莫地平输液的活性成分有光 敏感性,输液过程中采用黑色,棕色或红色的玻璃注射器或输液管,或用不透光材 料将输液泵及输液管包裹或遵医嘱。盐酸异丙嗪和盐酸氯丙嗪在光、金属离子、氧 的作用下,极易氧化变色。静滴时须注意避光。一次配药不宜使用时间过长,以保 证用药的有效性和安全性。 水溶性维生素加入葡萄糖注射液中进行输液时,应注意 避光。 肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡在氧、金属离 子、光线、温度等的影响下,易氧化变质,提示临床使用时宜避光。 卡铂、顺铂、 奥沙利铂、环磷酰胺在光照下,顺铂注射液会发生光水合反应和光氧化还原反应, 直至金属铂析出。滴注时应避光。 阿糖胞苷、甲氨蝶呤、氟尿嘧啶等使用溶解稀释 后,水溶液不稳定,光照加速反应。在临床滴注过程中应避光 三级避光药品:脂溶性维生素、甲钻胺、 平、盐酸普鲁卡因、泮托拉唑钠、依托泊苷、 肪乳、中/长链脂肪乳。 脂溶性维生素为对光敏感的药物,滴注时应注意避光。维生素K 需避光。甲钻胺 见光易分解,开封后立即使用的同时,应注意避光。 氢化可的松、强的松、呋塞咪、 利血平、盐酸普鲁卡因均为对光敏感的药物,应注意避光。 泮托拉唑钠避光情况有 争议,建议最好避光输注。 依托泊苷、多西他赛、昂丹司琼等在光线照射下,对药物稳定性有一定的 影 响,在滴注的过程中应尽量避光。 硝酸甘油,静脉使用本品时须采用避光措施。 脂肪乳、中/长链脂肪乳等资料显示在 光照疗法中,同时输入脂肪乳,由光引起的脂 质过氧化物不能被完全消除。因此作为预防措施,建议对新生儿进行光照疗法期间, 输入脂肪乳应避光。对二、三级避光药品,若非现配药液,要避光保存;药液变色 或加深,应禁用 只供学习与交流 氢化可的松、强的松、呋塞咪、利血 多西他赛、昂丹司琼、硝酸甘油、脂
化学药注册分类大变动,CFDA发布《化学药品注册分类改革工作方案》和《化学仿制药生物等效性试验备案管理规定》征求意见稿为贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》政策要求,根据全国人大常委会《关于授权国务院在部分地区开展药品上市许可持有人制度试点和有关问题的决定》,昨日(11月6日),国家食药监总局官网发布了《化学药品注册分类改革工作方案(征求意见稿)》和《化学仿制药生物等效性试验备案管理规定(征求意见稿)》,面向社会公开征求意见。 《化学药品注册分类改革工作方案(征求意见稿)》 为贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》政策要求,根据全国人大常委会《关于授权国务院在部分地区开展药品上市许可持有人制度试点和有关问题的决定》,制定本工作方案。 一、工作原则 按照分类科学、标准严格、质量提高的原则,在原有化学药品注册分类的基础上,结合国务院改革意见中有关药品分类的调整原则,对原有化学药品注册分类进行调整和完善。首先,根据药品的安全风险程度,将药品分为新药和仿制药两大类;其次,根据药品原创性和新颖性的不同,将新药进一步分为创新药和改良型新药;第三,在仿制药中,根据被仿制药上市情况不同,进一步细分为对境外上市、境内未上市药品的仿制,对境内上市药品的仿制以及境外上市药品申请境内上市三类。 二、化学药品新注册分类及说明
新药是指未在中国境内外上市销售的药品,将境外上市境内未上市药品纳入仿制药。调整后,化学药品新注册分类共分为1-5类(表1),具体如下: (一)根据物质基础的原创性和新颖性不同,将新药分为创新药(注册分类1)和改良型新药(注册分类2)两类。其中,创新药是指含有新的结构明确的具有生理或药理作用的分子或离子,且具有临床价值的原料药及其制剂,包括用拆分或者合成等方法制得的已知活性成份的光学异构体及其制剂,但不包括对已知活性成份成酯、成盐(包括含有氢键或配位键的盐),或形成其他非共价键衍生物(如络合物、螯合物或包合物),或其结晶水、结晶溶剂、晶型的改变等。 改良型新药是在已知活性成份的基础上,对其结构、剂型、给药途径、适应症、用法用量、规格等进行优化,且具有明显临床优势的药品。结构优化是指对已知活性成份成酯、成盐(包括含有氢键或配位键的盐),或形成其他非共价键衍生物(如络合物、螯合物或包合物),或其结晶水、结晶溶剂、晶型的改变等。 (二)被仿制的参比制剂来源不同,其上市情况存在差异,研制者和监管部门对其上市基础的认识也随之不同,为便于申报,将仿制药分为3-5类。其中,注册分类3是指仿境外上市、境内未上市药品;注册分类4是指仿制境内上市药品;注册分类5是指境外上市的药品申请在境内上市。 仿制药的基本要求是与参比制剂质量和疗效一致,参比制剂须为原研或国际公认的药品。原研药品指境外或境内首先批准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。国际公认的药品是指与原研药品质量和疗效一致的药品。 表1化学药品新注册分类、说明及包含的情形
附件2: 化学药品注册分类及申报资料要求 一、注册分类 1.未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2.改变给药途径且尚未在国内外上市销售的制剂。 3.已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6.已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1.药品名称。 2.证明性文件。 3.立题目的与依据。 4.对主要研究结果的总结及评价。 5.药品说明书、起草说明及相关参考文献。 6.包装、标签设计样稿。 (二)药学研究资料 7.药学研究资料综述。 8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9.确证化学结构或者组份的试验资料及文献资料。 10.质量研究工作的试验资料及文献资料。 11.药品标准及起草说明,并提供标准品或者对照品。 12.样品的检验报告书。 13.原料药、辅料的来源及质量标准、检验报告书。 14.药物稳定性研究的试验资料及文献资料。 15.直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16.药理毒理研究资料综述。
化学药品注册分类对比(仅供参考) 2016年3月4日,食品药品监管总局发布了《化学药品注册分类改革工作方案》。现将《化学药品注册分类改革工作方案》与《药品注册管理办法》(2007版)相比,有以下这些不同之处:
相较于2015年11月6日《化学药品注册分类改革工作方案(征求意见稿)》中提到的2.5含有已知活性成分的新用法用量和新规格的制剂,在此方案中并未体现,可能只能走补充申请了。 相关注册管理要求 (一)对新药的审评审批,在物质基础原创性和新颖性基础上,强调临床价值的要求,其中改良型新药要求比改良前具有明显的临床优势。对仿制药的审评审批,强调与原研药品质量和疗效的一致。
(二)新注册分类1、2类别药品,按照《药品注册管理办法》中新药的程序申报;新注册分类3、4类别药品,按照《药品注册管理办法》中仿制药的程序申报;新注册分类5类别药品,按照《药品注册管理办法》中进口药品的程序申报。 新注册分类2类别的药品,同时符合多个情形要求的,须在申请表中一并予以列明。 (三)监测期有变动; (四)可以继续按照原规定进行审评审批,也可以申请按照新注册分类进行审评审批。如申请按照新注册分类进行审评审批,补交相关费用后,不再补交技术资料,国家食品药品监督管理总局药品审评中心要设立绿色通道,加快审评审批。符合要求的,批准上市;不符合要求的,不再要求补充资料,直接不予批准。 (五)新注册分类的注册申请所核发的药品批准文号(进口药品注册证/医药产品注册证)效力与原注册分类的注册申请核发的药品批准文号(进口药品注册证/医药产品注册证)效力等同。 (六)国家食品药品监督管理总局组织相关部门细化工作要求,做好受理、核查检查、技术审评及制定、修订相关国家药品标准等工作。 (七)《药品注册管理办法》与本方案不一致的,按照本方案要求执行。
常用避光药物 特级避光药品:硝普钠。本品对光敏感,溶液稳定性较差,滴注溶液应新鲜配制并注意避光,如变为暗棕色,橙色或蓝色,禁用。静滴时,输液器要用铝箔或不透光材料包裹使其避光。 一级避光药品:盐酸左氧氟沙星、两性霉素B、阿霉素。盐酸左氧氟沙星可引起少见的光毒性反应(发生率<0.1%),在接受本品治疗时应避免过度阳光暴晒和人工紫外线,如出现光敏反应或皮肤损伤应停用本品,故在输液过程中应注意避光;两性霉素B滴注时必须临时配制,避光滴注;阿霉素滴注时必须临时配制,避光滴注。 二级避光药品:尼莫地平、盐酸异丙嗪、盐酸氯丙嗪、水溶性维生素、肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡、卡铂、顺铂、奥沙利铂、环磷酰胺、阿糖胞苷、甲氨蝶呤、氟尿嘧啶。由于尼莫地平输液的活性成分有光敏感性,输液过程中采用黑色,棕色或红色的玻璃注射器或输液管,或用不透光材料将输液泵及输液管包裹或遵医嘱。盐酸异丙嗪和盐酸氯丙嗪在光、金属离子、氧的作用下,极易氧化变色。静滴时须注意避光。一次配药不宜使用时间过长,以保证用药的有效性和安全性。水溶性维生素加入葡萄糖注射液中进行输液时,应注意避光。肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡在氧、金属离子、光线、温度等的影响下,易氧化变质,提示临床使用时宜避光。卡铂、顺铂、奥沙利铂、环磷酰胺在光照下,顺铂注射液会发生光水合反应和光氧化还原反应,直至金属铂析出。滴注时应避光。阿糖胞苷、甲氨蝶呤、氟尿嘧啶等使用溶解稀释后,水溶液不稳定,光照加速反应。在临床滴注过程中应避光。 三级避光药品:脂溶性维生素、甲钴胺、氢化可的松、强的松、呋塞咪、利血平、盐酸普鲁卡因、泮托拉唑钠、依托泊苷、多西他赛、昂丹司琼、硝酸甘油、脂肪乳、中/长链脂肪乳。 脂溶性维生素为对光敏感的药物,滴注时应注意避光。维生素K需避光。甲钴胺见光易分解,开封后立即使用的同时,应注意避光。氢化可的松、强的松、呋塞咪、利血平、盐酸普鲁卡因均为对光敏感的药物,应注意避光。泮托拉唑钠避光情况有争议,建议最好避光输注。 依托泊苷、多西他赛、昂丹司琼等在光线照射下,对药物稳定性有一定的影响,在滴注的过程中应尽量避光。硝酸甘油,静脉使用本品时须采用避光措施。脂肪乳、中/长链脂肪乳等资料显示在光照疗法中,同时输入脂肪乳,由光引起的脂质过氧化物不能被完全消除。因此作为预防措施,建议对新生儿进行光照疗法期间,输入脂肪乳应避光。对二、三级避光药品,若非现配药液,要避光保存;药液变色或加深,应禁用。
一、注册分类 1、未在国内外上市销售的药品: (1 )通过合成或者半合成的方法制得的原料药及其制剂; (2 )天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3 )用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; ( 4 )由已上市销售的多组份药物制备为较少组份的药物;( 5 )新的复方制剂。 2、改变给药途径且尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药品: (1 )已在国外上市销售的原料药及其制剂; (2 )已在国外上市销售的复方制剂; (3 )改变给药途径并已在国外上市销售的制剂。 4 、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6、已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1、药品名称。 2、证明性文件。 3、立题目的与依据。 4、对主要研究结果的总结及评价。 5、药品说明书样稿、起草说明及最新参考文献。 6、包装、标签设计样稿。
(二)药学研究资料 7、药学研究资料综述。 8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9、确证化学结构或者组份的试验资料及文献资料。 10、质量研究工作的试验资料及文献资料。 11、药品标准草案及起草说明,并提供标准品或者对照品。 12、样品的检验报告书。 13、辅料的来源及质量标准。 14、药物稳定性研究的试验资料及文献资料。 15 、直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16、药理毒理研究资料综述。 17、主要药效学试验资料及文献资料。 18、一般药理研究的试验资料及文献资料。 19、急性毒性试验资料及文献资料。 20、长期毒性试验资料及文献资料。 21 、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等主要与局部、全身给药相关的特殊安全性试验研究和文献资料。 22、复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。 23、致突变试验资料及文献资料。 24、生殖毒性试验资料及文献资料。 25、致癌试验资料及文献资料。 26、依赖性试验资料及文献资料。 27、动物药代动力学试验资料及文献资料。
中国药品注册的分类说明: 化学药品新注册分类共分为5个类别,具体如下: 1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。 2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。 3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。 4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。 5类:境外上市的药品申请在境内上市。 涉及到本次双方的合作项目的进口注册类型为5.2类别:境外上市的非原研药品(包括原料药及其制剂)申请在境内上市。 The classification instruction of drug registration in China There are 5 categories of chemical drug new registrations. They are as follows. Category 1: Innovative drugs that are not marketed both domestically and abroad. These drugs contain new compounds with clear structures and pharmacological effects and they have clinical value. Category 2: Modified new drugs that are not marketed both domestically or abroad. With known active components, the drug’s structure, phase, prescription manufacturing process, administration route and indication are optimized and it has obvious clinical advantage. Category 3: The drugs that are imitated by domestic applicants to original drugs that have been marketed abroad but not domestically.This kind of drugs are supposed to have the same quality and effects with original drugs.Original drugs are the foremost drugs that are approved to be marketed domestically and /or abroad with complete and full safety and validity data as marketing evidence. Category 4: The drugs that are imitated by domestic applicants to original drugs that have been marketed domestically. This kind of drugs are supposed to have the same quality and effects with original drugs. Category 5: The drugs that have been marketed abroad are applied to be marketed domestically. The category of the imported registration involved in our collaboration program is category 5.2: non-original drugs( including API and its preparation) that have been marketed abroad are applied to be marketed domestically.
避光药品分级表
关于避光药品目录的文献说明 硝普钠的光解过程十分复杂, 且光解产物与照射光源有关。在不避光的条件下, 其pH 值和含量在5 min 左右就会发生较大的改变。且其溶液不稳定, 见光降解生成氰化物, 输入体内增加对人体的毒性, 故在临床上需临用前配制, 更应注意全程避光 [1]。 中国药品生物制品研究所的杨亚莉等 [2]比较了司帕沙星、环丙沙星、左氧氟沙星、洛美沙星水溶液在 UVA 光照下紫外光谱的变化, 并根据 HPLC法测定光照过程的含量, 求出光解动力学参数T1/2 , 溶液中光稳定性顺序为司帕沙星>环丙沙星>左氧氟沙星> 洛美沙星,其中左氧氟沙星半衰期减少到35.4min,环丙沙星半衰期减少到51.0min[2],因氟喹诺酮类药物会诱发患者的光毒性反应,即患者皮肤第一次接触光敏性物质后, 在无害的光线照射强度下诱发产生的异常的皮肤反应(如红斑、水泡等),提示应用氟喹诺酮类药物时既要注意药品的全程避光,更要注意病室的光照管理。 噻嗪类药物(盐酸异丙嗪、氯丙嗪)在光、金属离子、氧的作用下,极易发生氧化变色,有研究表明盐酸氯丙嗪溶于5%葡萄糖氯化钠溶液后,在避光下保持24 h,液体澄明,无变化;随后将该袋输液直接放在光照下照射1h左右即出现少量蓝色絮状团块样物质[3],因此要求噻嗪类药物在输注时应现配现用,并严格避光,以保证用药的安全性和有效性。 研究发现水溶性维生素(B、C)在日光照射下降解极快,如10ug/ml的维生素C溶液在日照5min 在高压汞灯下含量变化迅速,原料的半后的保存率仅为 6.4%[4],而饶桂香等做的研究也表明维生素B 2 衰期仅为68h[5],因此水溶性维生素仍应全程避光。 由于顺铂溶解后在光线较强的情况下(如太阳光直射),发生光水合反应和光氧化还原反应,终析出金属铂,是很多铂族金属配合物(包括奥沙利铂)的特性[6]。因此,照药品说明书的要求,药使用时建议使用避光输液器给药。 脂溶性维生素(A、D、E、K)在与水溶液配伍4h后各维生素成分均出现了迅速分解,与对照组(避光)均出现了统计学差异,尤其是维生素A与维生素K,为显著性差异[7],由于我院的脂溶性维生素剂型多为注射液,要求脂溶性维生素应全程避光。 甲钴胺注射液说明书(厂家:卫材药业有限公司)描述为“给药时:见光易分解,封后立即使用的同时,注意避光。从遮光保护袋中取出后应立即使用”。由于甲钴胺结构中β位的烷基具有强烈的斥电子作用,得Co-CH3键能减弱,光照射易发生断裂。该药稀释后,钴胺分子被溶剂分子分散、透光性增加,上氧化作用、光解大大增强,钴胺有效成分即较快降解[8]。 林涛等[9]采用自然光照射实验预测氢化可的松注射液在自然光照射下的贮存期,发现氢化可的松降解呈零级反应,降解周期仅为36天,因此氢化可的松仍应全程避光,减少不必要含量消耗。
化学药品注册分类新旧版对比 新版(红色字体):NMPA于2020年06月30日发布的《国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号)》 旧版(蓝色字体):CFDA于2016年03月09日发布的《总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)》新旧两版均将化药注册分类分为5个类别,具体差异如下: 1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。 1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的原料药及其制剂。 2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。 2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。 2.1含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金
属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的药品。 2.1含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的原料药及其制剂。 2.2含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的药品。 2.2含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的制剂。 2.3含有已知活性成份的新复方制剂,且具有明显临床优势。 2.3含有已知活性成份的新复方制剂,且具有明显临床优势。 2.4含有已知活性成份的新适应症的药品。 2.4含有已知活性成份的新适应症的制剂。 3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与参比制剂的质量和疗效一致。 3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。 具有与参比制剂相同的活性成份、剂型、规格、适应症、给药途径和用法用量,并证明质量和疗效与参比制剂一致。
临床需避光药物 1. 注射用硝普钠:周围血管扩张药 2. 葡萄糖酸伊诺沙星注射液(左氧氟沙星、培氟沙星、司帕沙星、加替沙星、氟罗沙星):抗生素 3. 尼莫地平注射液:降血压药物 4. 甲钴胺注射液:缺乏VB12引起的巨幼细胞性贫血治疗、周围神经病变 5. 亚叶酸钙注射液(商品名:法益宁):抗贫血药 6. 注射用对氨基水杨酸钠:抗微生物药物/抗结核病药物 7. 注射用两性霉素B:抗真菌药物 8. 重酒石酸去甲肾上腺素注射液:循环系统药物 9. 核黄素磷酸钠注射液(VB2):维生素类药物 10. 盐酸氯丙嗪注射液:抗精神病药 11. 氨茶碱注射液:呼吸系统药物 12. 注射用顺铂:抗肿瘤药物 13. 注射用达卡巴嗪:用于治疗恶性黑色素瘤 14. 二氮嗪注射液:用于高血压危象、急性型高血压或高血压脑病 15. 呋塞米注射液:用于水肿性疾病。 16. 盐酸多柔比星注射液:抗有丝分裂和细胞毒性药物多柔比星能成功地诱导多种恶性肿瘤的缓解包括急性白血病淋巴瘤软组织和骨肉瘤儿童恶性肿瘤及成人实体瘤尤其用于乳腺癌和肺癌 17. 硫辛酸注射液:糖尿病周围神经病变引起的感觉异常 18. 枸橼酸舒芬太尼注射液(商品名:舒芬尼):用于气管内插管、使用人工呼吸的全身麻醉。 19. 注射用硫喷妥钠: 脂溶性高,静脉注射后迅速通过血-脑屏障,用于全麻诱导,复合全麻及小儿基础麻醉。 20. 他克莫司注射液(普乐可复):预防肝脏或肾脏移植术后的移植物排斥反应。 21. 替尼泊苷注射液(商品名:卫萌):常与其它抗癌药物联合使用治疗。 22. 硝酸甘油注射液:主要药理作用是松弛血管平滑肌。 23. 烟酸注射液:用于维生素PP缺乏症;扩张小血管;缺血性心脏病。 24. 烟酰胺注射液:与烟酸相似。 25. 维生素C注射液:治疗坏血病、慢性铁中毒、特发性高铁血红蛋白。 滴注过程中应注意避光的药品
附件 化学药品新注册分类申报资料要求(试行) 第一部分 注册分类1、2、3、5.1类申报资料要求(试行) 一、申报资料项目 (一)概要 1.药品名称。 2.证明性文件。 2.1注册分类1、2、3类证明性文件 2.2注册分类5.1类证明性文件 3.立题目的与依据。 4.自评估报告。 5.上市许可人信息。 6.原研药品信息。 7.药品说明书、起草说明及相关参考文献。 8. 包装、标签设计样稿。 (二)主要研究信息汇总表
9. 药学研究信息汇总表。 10. 非临床研究信息汇总表。 11. 临床研究信息汇总表。 (三)药学研究资料 12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。 12.1(3.2.S.1)基本信息 12.2(3.2.S.2 )生产信息 12.3(3.2.S.3 )特性鉴定 12.4(3.2.S.4)原料药的质量控制 12.5(3.2.S.5)对照品 12.6(3.2.S.6)包装材料和容器 12.7(3.2.S.7)稳定性 13. (3.2.P)制剂。 13.1(3.2.P.1)剂型及产品组成 13.2(3.2.P.2)产品开发 13.3(3.2.P.3)生产 13.4(3.2.P.4)原辅料的控制 13.5(3.2.P.5)制剂的质量控制 13.6(3.2.P.6)对照品 13.7(3.2.P.7)稳定性 (四)非临床研究资料 14.非临床研究资料综述。
15.主要药效学试验资料及文献资料。 16.安全药理学的试验资料及文献资料。 17.单次给药毒性试验资料及文献资料。 18.重复给药毒性试验资料及文献资料。 19.遗传毒性试验资料及文献资料。 20.生殖毒性试验资料及文献资料。 21.致癌试验资料及文献资料。 22.依赖性试验资料及文献资料。 23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。 24.其他安全性试验资料及文献资料。 25.非临床药代动力学试验资料及文献资料。 26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。 (五)临床试验资料 27.临床试验综述资料。 28.临床试验计划及研究方案。 29. 数据管理计划、统计分析计划。 30.临床研究者手册。 31.知情同意书样稿、伦理委员会批准件;科学委员会审查报告。 32.临床试验报告。 33.临床试验数据库电子文件(原始数据库、衍生的分析数据库及
. '. 常用避光药物 特级避光药品:硝普钠。本品对光敏感,溶液稳定性较差,滴注溶液应新鲜 配制并注意避光,如变为暗棕色,橙色或蓝色,禁用。静滴时,输液器要用铝箔或不透光材料包裹使其避光。 一级避光药品:盐酸左氧氟沙星、两性霉素B、阿霉素。盐酸左氧氟沙星可引起少见的光毒性反应(发生率<0.1%),在接受本品治疗时应避免过度阳光暴晒和人工紫外线,如出现光敏反应或皮肤损伤应停用本品,故在输液过程中应注意避光;两性霉素B滴注时必须临时配制,避光滴注;阿霉素滴注时必须临时配制,避光滴注。 二级避光药品:尼莫地平、盐酸异丙嗪、盐酸氯丙嗪、水溶性维生素、肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡、卡铂、顺铂、奥沙利铂、环磷酰胺、阿糖胞苷、甲氨蝶呤、氟尿嘧啶。由于尼莫地平输液的活性成分有光敏感性,输液过程中采用黑色,棕色或红色的玻璃注射器或输液管,或用不透光材料将输液泵及输液管包裹或遵医嘱。盐酸异丙嗪和盐酸氯丙嗪在光、金属离子、氧的作用下,极易氧化变色。静滴时须注意避光。一次配药不宜使用时间过长,以保证用药的有效性和安全性。水溶性维生素加入葡萄糖注射液中进行输液时,应注意避光。肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡在氧、金属离子、光线、温度等的影响下,易氧化变质,提示临床使用时宜避光。卡铂、顺铂、奥沙利铂、环磷酰胺在光照下,顺铂注射液会发生光水合反应和光氧化还原反应,直至金属铂析出。滴注时应避光。阿糖胞苷、甲氨蝶呤、氟尿嘧啶等使用溶解稀释后,水溶液不稳定,光照加速反应。在临床滴注过程中应避光。 三级避光药品:脂溶性维生素、甲钴胺、氢化可的松、强的松、呋塞咪、利血平、盐酸普鲁卡因、泮托拉唑钠、依托泊苷、多西他赛、昂丹司琼、硝酸甘油、脂肪乳、中/长链脂肪乳。 脂溶性维生素为对光敏感的药物,滴注时应注意避光。维生素K需避光。甲钴胺见光易分解,开封后立即使用的同时,应注意避光。氢化可的松、强的松、呋塞咪、利血平、盐酸普鲁卡因均为对光敏感的药物,应注意避光。泮托拉唑钠避光情况有争议,建议最好避光输注。 依托泊苷、多西他赛、昂丹司琼等在光线照射下,对药物稳定性有一定的影响,在滴注的过程中应尽量避光。硝酸甘油,静脉使用本品时须采用避光措施。脂肪乳、中/长链脂肪乳等资料显示在光照疗法中,同时输入脂肪乳,由光引起的脂质过氧化物不能被完全消除。因此作为预防措施,建议对新生儿进行光照疗法期间,输入脂肪乳应避光。对二、三级避光药品,若非现配药液,要避光保存;药液变色或加深,应禁用。
需避光输液药品目录 一些药物的稳定性差,溶解后遇光易发生氧化、分解、变色等反应 一些化疗药物溶解后可发生裂环、重排、水解、聚合、氧化、异构化等较复杂的反应,光照可催化上述反应的进程 一、易发生光化降解的药物 1.硝普钠遇光转为激发态,多步化学反应生成有毒物质 2.吡啶类药物含有二氢吡啶环,对光不稳定,如硝苯地平、尼莫地平、异烟肼和尼可刹米 3.维生素类见光易分解,尤其是水溶性类,如维生素B12、亚叶酸钙注射液 4.喹诺酮类药物光解反应使抗菌活性下降,如氟罗沙星、环丙沙星、左氧氟沙星和美罗沙星 5.噻嗪类药物在光、金属离子、氧的作用下极易氧化变色,如氯丙嗪和异丙嗪 6.酚类药物分子结构中含有酚羟基,如肾上腺素、异丙肾上腺素、去甲肾上腺素、多巴胺、吗啡等 7.芳胺药物对氨基水杨酸钠易发生脱羧反应生成褐色的间氨基酚,引起不良反应 8.含有不饱和碳键的药物多烯类抗真菌药两性霉素B具有易氧化的不饱和碳键 二、抗肿瘤药物 含铂化疗药(顺铂、卡铂、澳沙利铂)光照下发生水合反应析出铂 达卡巴嗪对光极不稳定,放置后溶液变浅红色,需临时配制,溶解后立即注射 长春新碱注入静脉时要避免日光直接照射 环磷酰胺水溶液不稳定,现配现用 三、避光等级 1.特级避光药品:硝普钠 对光极敏感,输液器用铝箔或不透光材料包裹,限时使用12h,变色后禁用。 2.一级避光药品:盐酸左氧氟沙星、含铂化疗药(顺铂)、水溶性维生素、达卡巴嗪、两性霉素B、阿霉素等。 严格避光保存,输注之前才打开铝箔包装抽液、配液,输注时避光,变色禁用。 3.二级避光药品:尼莫地平、噻嗪类药物、肾上腺素类、环磷酰胺、甲氨蝶呤等 4.三级避光药品:脂溶性维生素、呋塞咪、利血平、硝酸甘油、中/长链脂肪乳 对二三级避光药物应:避光保存,现配药液,药液变色或加深,应禁用。 四、避光药物的使用原则 避光保存 现配现用 限时使用 避光输注 五、药物避光方法 1、保持原包装 2、遵循四原则 避光保存、现配现用、限时使用、避光输注 3、避光措施 遮光袋配以一次性带过滤器的避光输液器 黑色塑料薄膜将输液器缠裹。
护士须知 | 静脉输液时需要避光的药物本文并未覆盖所有对光不稳定的药物,尤其是复方制剂,同时由于 不同厂家的制剂工艺不同,使用说明可能会有差异,具体操作方法应以 药物的说明书为准。 光照会加速药物的氧化,一些化学性质不稳定的药物见光后易分解,不仅降低了药物的活性,而且增加了药物的毒性,严重影响药物的疗效。尤其是水溶液,药物分子被分散,对光的通透性增加,以及水中氧的氧化作用,加大了光解作用。除了影响治疗效果之外,还常常引起以下不良反应,严重的甚至危及生命;因此在药品生产、运输、贮存,特别是在药品使用过程中应注意避光。 一、临床输注时需要避光的药物 通用名称避光原因 氧氟沙星、氟罗沙星、乳酸环丙沙星氯化钠、盐酸莫西沙星氯化钠注射液避光缓慢静脉滴注,对光不稳定,易发生光解反应,使抗菌活性下降。光促反应为放热反应,在溶液状态和有氧的条件下更易发生;光促反应不仅可产生降解物,也可以产物聚合 伊曲康唑注射液混合后的溶液,避免直接光照 盐酸氯丙嗪、异丙 嗪注射液 易氧化变色,静滴时须注意避光 维生素类注射液加入葡萄糖注射液中使用时需要避光。维生素B12遇光易分解,溶解后要尽快使用;亚叶酸钙注射液应避免光线直接照射及热接触,维生
素A、维生素B6和维生素C只需避光保存。 肾上腺素、异丙肾 上腺素、去甲肾上 腺素、多巴胺、吗 啡、酚磺乙胺等 易氧化变质,输注时宜避光 注射用硝普钠本品对光敏感,溶液稳定性差,光照下分解加速,硝普钠经光线照射后,生成激发态的硝普钠。然后分解为水合铁氰化钾和氧化氮。水合 铁氰化钾进一步分解,产生有毒的氢氰酸及普鲁士蓝等。因此该注射 液应临用前配制,避光滴注,并于12h内用完。如变为暗棕色,橙色 或蓝色,应弃去。(静滴时,输液器要用铝箔或不透光材料包裹使其 避光 硝苯地平注射剂对光极度敏感,易发生光解反应。 硝酸甘油注射液许多塑料输液器可吸附本药,故应采用玻璃输液瓶,且静脉给药必须避光 对氨基水杨酸钠注射剂由于其发生脱羧反应生成褐色的间氨基酚,再被继续氧化形成二苯醌型化合物所致,其氨基容易被羧基所取代而使溶液呈明显红棕色,临床如出现溶液颜色深于刚配制时的颜色则不能再行滴注 甲钴铵注射液见光易分解,静脉给药避光。注射液开封后立即使用 尼莫地平尼莫地平输液的活性成分有光敏感性,输液过程中应采用黑色,棕色或红色的玻璃注射器或输液管,或用不透光材料将输液泵及输液管包 裹,如在散射线日光或人工光源下,用药10小时内不必采取特殊的 保护措施