第四章 缩合反应练习题
一、举例说明或解释以下人名反应。
1. Mannich 反应
2. Strecker 反应
3. Michael 反应
4. Knoevenagel 反应
5. Perkin 反应
6. Stobbe 反应
7. Wttig 反应
8. Darzens 反应
9. Diels-Alder 反应 10. Aldol 缩合
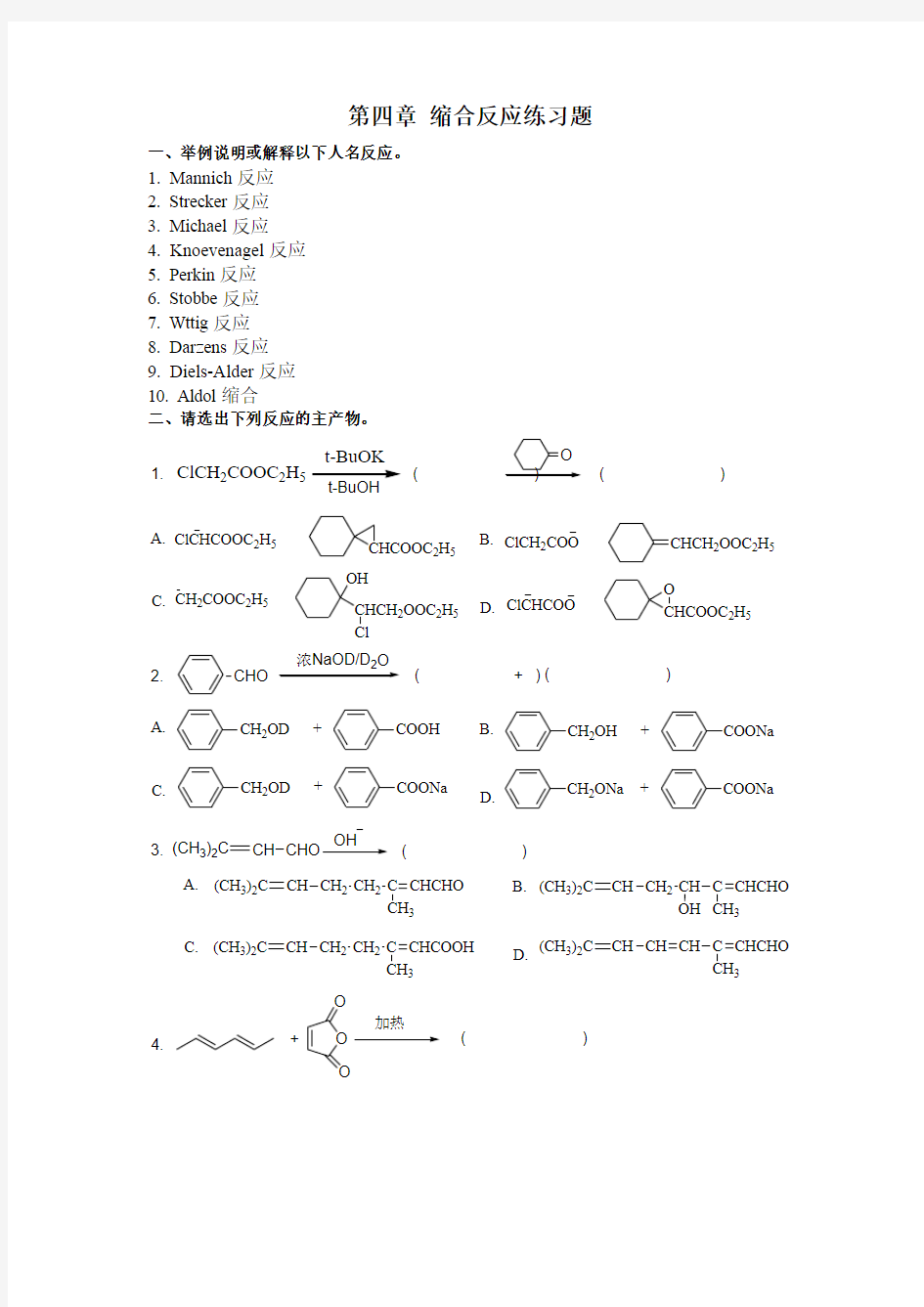
二、请选出下列反应的主产物。 ClCH 2COOC 2H 5
1.( )
( )
A. B.C. D.ClCHCOOC 2H 5
ClCH 2COO
CH 2COOC 2H 5
ClCHCOO
CHCOOC 2H 5CHCH 2OOC 2H 5CHCH 2OOC 2H 5O
CHCOOC 2H 5
OH
CHO 浓NaOD/D 2+
2.( )( )
A.
B.
C.
D.
CH 2OD
+COONa
CH 2OH +
COONa
CH 2OD +COOH CH 2ONa
+COONa
(CH 3)2C
CH OH
3.( )
A. B.C. D.
(CH 3)2C
CH CH 2CH 2C 3CHCHO
(CH 3)2C
CH CH 2CH C 3CHCHO
(CH 3)2C
CH CH 2CH 2C 3
CHCOOH
(CH 3)2C
CH CH CH C 3
CHCHO
+O O
加热
O
4.
( )
A.
B.
C.
D.
O O
O
O O
O
O O
O
O O O
O
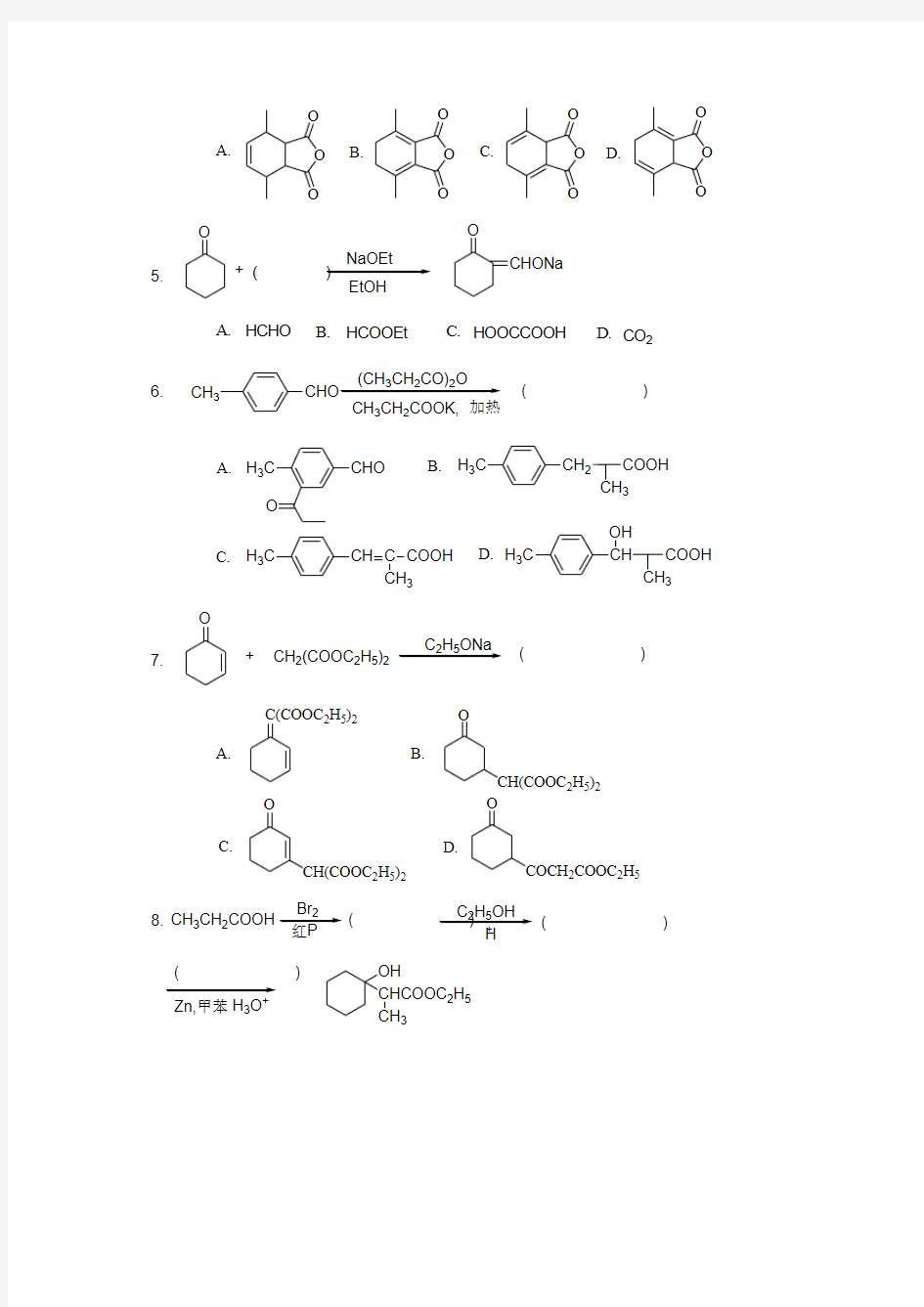
EtOH
O
CHONa
+(
)
5.
A. B. C. D. HCOOEt
HCHO
HOOCCOOH
CO 2
CH 3
322CH 3CH 2COOK,加热
6.
( )
A. B.C. D.CHO
H 3C
CH 2
CH 3COOH H 3C
CH C CH 3
COOH
H 3C
CH
CH 3
COOH H 3C
O
OH
O
+
CH 2(COOC 2H 5)2
C 2H 5ONa
7.
( )
A.
B.
C.
D.
C(COOC 2H 5)2
O CH(COOC 2H 5)2
O
CH(COOC 2H 5)2O COCH 2COOC 2H 5 8.CH 3CH 2COOH Br 2C 2H 5OH Zn,甲苯OH
CHCOOC 2H 5CH 3
( )( )
( )
H 3O
A.B.C.D.CH 3CH 2COBr
CH 3CHCOOH
BrCH 2CH 2COOH
CH 3CH 2CHO
CH 3CHCOOC 2H 5
Br CH 3CHCOOC 2H 5
2CH 3CH 3CHCOOH
2CH 3CH 3CH 2COOC 2H 5
O
O
O
O
9.
COCH 3
+ HCHO +
N H
HCl
( )
A
O H
2
C C H 2
N
.HCl
B
OH H
2
C CH 3.HCl N
C
C O H C C
H
N .HCl
C O H
2
C CH 3.HCl
D
10.
( )
( )
CHO + HCHO
OH 稀
A.
B.
C.
D.
CHO CHO CH 2OH CHO
CH 2OH CH 2OH
CH 22
O
CH 2OH COOH CH 2OH CH 2OH COOH COOH
CHO
CH 2OH
( )
( )
O
O
过量
2232
11.
A.
B.
C.
D.
CH 2
2CH 2
2CH 2
CH 2
2
( )
( )
( )
OH
H 2Ni
Na 2Cr 2O 7 H 2SO 4
OH 加热
12.
A.
B.
C.
D.
OH
OH
OH
OH
O O
COOH
O
O
O
O
O HO
O CH 3CHCH 2CH 2CH 2COOH
+加热
13.( )
CHCH 2CH 2CH 2COOH
H 2C A B CHCH 2CH 2COOH
H 3CHC C
O O
3
D
CH 3CHCH 2CH 2CH 2C OH
O O CCH 2CH 2CH 2CHCH 3
OH O
OH
314.
( )
( )
AlCl 3
A.
B.
C.
D.
O C O
CH 3OH O CH 3
OH
C O 3
O C O
CH 3
OH
C O 3
OH
O
CH 3
O C O 3
C O
CH 3
O C O
CH 3
O CHO + CH 3CHO 15.
( )
A.
B.
C.
D.
O
C H CHCHO O
OH
O
CH 3
O
OH
O
( )
( )
NH 3
16.
H COCl CH 3
H 2C
A.
B.
C. D.
H CONH 2CH 3
H 2C H CONH 2CH 3H 2C H CH 3H 2C
H CONH 2CH 3H 2C
NH 2
H NH 2CH 3H 2C
H CONHBr CH 3H 2C
H Br CH 3H 2C
H CH 2
H 2C CONH 2
NH O
KOH
N O (
)
17.
( )
A.
B.
C.
D.
NK O
O
O O O O
O OH OH NH O
O
CH 2Br
CH 2Br
CH 2OH
CH 2OH
18.
( )
( )
COOEt
C 2H 5ONa CH 3COOH/H 2O
稀NaOH-H 2O 3
A.
B.
C.
D.
O
OH
O COOEt O
O
O O
O
O
O
O
OH
OH
O OH
( )
O
CHO + Ac 2O
3219.
A.
B.
C.
D.
O
CH 2COOH
O
CH CHCOOK
O
HOOCH 2C
O
CHO
CH 2COOH
( )
20.
O
+ ClCH 2COOEt
t-BuOK t-BuOH
A.
B.
C.
D.
O COOEt
HO
COOEt
Cl
COOEt
COOEt
( )
( )
21.
O
N H
O
3H 2O
2
A.
B.
C.
D.
CH 3
N CH 3
N CH 3
N CH 3
N
CH 3
O CH 2CH 2CCH 3O CH 3
N
CH 2CH 23
O CH 3
O CH 2CH 23
O CH 3
N CH 2CH 23
O
CH 3
O CH 3
OH
CH 2CH 23O CH 3
O CH 2CH 2CCH 3O CH 3
O
( )
( )
( )
( )22.
O O
O LiAlH 4
EtONa
22
A.
B.
C.
D.
O O
O O O
O O O
O O O
O
CH 2OH CH 2OH CH 2OH CH 2OH CH 2OH CH 2OH
CH 2OH CH 2OH
COOEt COOEt
COOEt
COOEt COOEt
COOEt COOEt
Cl CH 2Cl CH 2OH
CH 2Cl CH 2Cl
CH 2Cl CH 2OH
CH 2Cl CH 2Cl
( )23.O
H 3O
PBr 3
PPh 3
( )
( )
( )
A.B.C.D.PhCH 2CH 2OH
PhCHCH 3
PhCH PhCHCH 2OH
CH 2
PhCH 2CH 2Br PhCHCH 2Br Br PhCHCH 3Ph 3P CHCH 2Ph
Ph 3P CHCH 2Ph
3CH 3CPh
3
Ph 3P CCH 2Ph
CH CHCH 2Ph
H C
H
Ph
C H H 2C H C H Ph C H C H CH 3C
H
Ph PhCHCH 2Br
24.
OH
+ HCHO +(CH 3)2NH
( )
A.
B.
C.
D.
CH 2N(CH 3)2
CH 2N(CH 3)2
CH 2N(CH 3)2
CH 2N(CH 3)2
(H 3C)2NH 2C
+
COOCH
3
( )
25.
A.
B.
C. D.
H 3C
H 3C
COOCH 3
3
H 3C H 3C
COOCH 3
CH 3
H 3C
H 3C
COOCH 3
3
H 3C
H 3C
COOCH 3
CH 3
26.
( )
CH 2CHCH(CH 3)2
OH
H +,加热
A.
B.C. D.
CH 2CH CH(CH 3)
CH CHCH(CH 3)2
CH 2CH 3CH 2CH 2
CH(CH 3)2
27.
( )
OH
CH 3
CH 3CH 2CCl, AlCl 3
O
A.
B.
C.
D.
OH 3
C
O CH 2CH 3
OH
CH 3
C CH 2CH 3
O 3
C O
CH 2CH 3
OH
H 2C CH 2CH 3
28.
( )
( )( )
( )
NH O
252223
NaOH 2+
A.
B.
C.
NK O
O O
O OK OK N O
O
OH NCH 2CH 2CH 2CH 3O
O NHCH 2CH 2CH 2CH 3O
O
OH
NHCH 2CH 2CH 2CH 3O
O NHCH 2CH 2CH 2CH 3COONa COONa
CH 3CH 2CH 2CH 2NH 2
COOH COOH
CH 3CH 2CH 2CH 2NH 2
COONa COONa
CH 3CH 2CH 22
O
D.
O O
O NHCH 2CH 2CH 2CH 3O
CH 3CH 2CH 2CH 2NH 2
COOH
ONa O COONa
29.
O
+CHCOCH 3
KOH
653
H 2C ( )
( )
2
A.
B.
C.
D.
O
O
O
OH
O
OH
CH
2
CH 2
O
30.
( )
C O
CH 3
+ ClCH 2COEt
O
OH +
( )
A.
B.
C.
D.
CH 3
O
COOC 2H 5
CH 3
O
COOC 2H 5
CH 3OH COOC 2H 5
CH 3COOC 2H 5
Cl
C O
CHCH 2OH
CH 3
CHCHO
CH 3
CHCOOH CH 3CH 3H
2
C COOH OH
常见有机反应类型总结 1.常见有机反应类型与有机物类型的关系 基本类型有机物类别 取代 反应 卤代反应饱和烃、苯和苯的同系物、卤代烃等 酯化反应醇、羧酸、糖类等 水解反应卤代烃、酯、低聚糖、多糖、蛋白质等 硝化反应苯和苯的同系物等 磺化反应苯和苯的同系物等 加成反应烯烃、炔烃、苯和苯的同系物、醛等 消去反应卤代烃、醇等 氧化 反应 燃烧绝大多数有机物 酸性KMnO4溶液烯烃、炔烃、苯的同系物等 直接(或催化)氧化酚、醇、醛、葡萄糖等 还原反应醛、葡萄糖等 聚合 反应 加聚反应烯烃、炔烃等 缩聚反应苯酚与甲醛、多元醇与多元羧酸等与浓硝酸的颜色反应蛋白质(含苯环的) 与FeCl3溶液的显色反应酚类物质 2.判断有机反应类型的常用方法 (1)根据官能团种类判断发生的反应类型。 (2)根据特定的反应条件判断反应类型。 (3)根据反应物和产物的结构不同判断反应类型。 1.化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
(1)指出下列反应的反应类型。 反应1:______________; 反应2:________________; 反应3:______________; 反应4:________________。 (2)写出D 与足量NaOH 溶液反应的化学方程式:________________________________ ________________________________________________________________________。 答案 (1)氧化反应 取代反应 取代反应(或酯化反应) 取代反应 (2)+3NaOH ――→ △ +CH 3COONa +CH 3OH +H 2O 2.请观察下图中化合物A ~H 的转化反应的关系(图中副产物均未写出),并填写空白: 已知:①――→400 ℃ R —CH==CH 2+CH 3COOH ; ②―――――→ 稀NaOH 溶液 。 (1)写出图中化合物C 、G 、H 的结构简式: C______________________,G_____________________________, H______________________。 (2)属于取代反应的有________(填数字代号)。 (3)属于消去反应的是____________。 (4)写出⑨的化学方程式并指明其反应类型:________________________________,________________________________________________________________________。 答案 (1)C 6H 5CH==CH 2 C 6H 5C ≡CH (2)①③⑥⑧ (3)②④⑦ (4) +2H 2――→催化剂 加成反应
1-3《化学反应热的计算》课时练 双基练习 1.在一定温度下,CO 和CH 4燃烧的热化学方程式分别为 2CO(g)+O 2(g)===2CO 2(g) ΔH =-566 kJ/mol CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-890 kJ/mol 1 molCO 和3 mol CH 4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( ) A .2 912 kJ B .2 953 kJ C .3 236 kJ D .3 867 kJ ? 解析:由热化学方程式可知,2 molCO 燃烧可放出566 kJ 热量,则1 mol CO 完全燃烧释放283 kJ 热量,同理3 mol CH 4释放3×890 kJ =2 670 kJ 热量,所以1 mol CO 和3 mol CH 4完全燃烧共释放热量为2 953 kJ 。 答案:B 2.已知A(g)+B(g)===C(g) ΔH 1,D(g)+B(g)===E(g) ΔH 2,且ΔH 1<ΔH 2,若A 和D 的混合气体1 mol 完全与B 反应,反应热为ΔH 3,则A 和D 的物质的量之比为( ) 解析:设1 mol 混合气体中含A x mol ,D y mol , 则有????? x +y =1ΔH 1x +ΔH 2y =ΔH 3,解得????? x =ΔH 2-ΔH 3ΔH 2-ΔH 1y =ΔH 3 -ΔH 1ΔH 2-ΔH 1 故x y =ΔH 2-ΔH 3ΔH 3-ΔH 1 。B 选项正确。
《 答案:B 3.已知25℃、101 kPa条件下: (1)4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2 kJ/mol (2)4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3 kJ/mol 由此得出的正确结论是() A.等质量的O2比O3能量低,由O2变O3为吸热反应 B.等质量的O2比O3能量低,由O2变O3为放热反应 C.O3比O2稳定,由O2变O3为吸热反应 ` D.O2比O3稳定,由O2变O3为放热反应 解析:(2)-(1)得:2O3(g)===3O2(g)ΔH=-kJ/mol,可知等质量的O2能量低。 答案:A 4.管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为: 2H2(g)+O2(g)===2H2O(l)ΔH=-kJ/mol 2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ/mol CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-kJ/mol 当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,理论上所获得的热值,前者大约是后者的多少倍() | A.B. C.D. 解析:由热化学方程式可得1 mol H2、CO燃烧放出的热量约为283 kJ~kJ;1 mol CH4燃烧放出的热量为kJ,两者之比约为,故答案为D。
《中和反应反应热的测定》实验报告 班别:姓名: 定义:在稀溶液中,强酸和强碱发生中和反应,生成1mol水时的反应热,叫中和热。 一、实验目的 测定强酸与强碱反应的反应热。(热效应) 二、实验用品 大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。 三、实验步骤 1.在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯 口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用 泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环 形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的, 如图所示。该实验也可在保温杯中进行。 2.用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计 测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。 3.用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。 4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次(防止造成热量损失)倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入表格中。 5.重复实验步骤2~4三次 6.根据实验数据计算中和热。 四、实验数据处理 1 3、计算反应热
五、实验分析 1、中和热与反应热的区别与联系? 答: 2、本实验中若把50 mL 0.50 mol/L的盐酸改为50 mL 0.50 mol/L醋酸,所测结果是否会有所变化?为什么? 答: 3、若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)? 答: 4、用相同浓度和体积的氨水代替NaOH50 mL 0.50mol/L NaOH 5、是什么原因使中和热测定结果往往偏低? 答: 6、离子方程式H++OH-=H2O代表了酸碱中和反应的实质,能否用此代表所有中和反应的离子方程式?答: 7、为什么中和热测定中要用稍过量的碱?能不能用过量的酸? 答: 8、为什么要用环形玻璃棒搅拌?若用铁丝取代环行玻璃棒会不会有影响? 答:
常见有机化学方程式归纳 物质类别性质反应方程式 一、烷烃 1、燃烧 CH4 + 2O2CO2 + 2H2O 2、取代反应 CH4 + Cl2CH3Cl + HCl CH3Cl + Cl2CH2Cl2 + HCl(或CH4 + 2Cl2CH2Cl2 + 2HCl) CH2Cl2 + Cl2CHCl3 + HCl(或CH4 + 3Cl2CHCl3 + 3HCl) CHCl3 + Cl2CCl4 + HCl(或CH4 + 4Cl2CCl4 + 4HCl) CH3CH3 + Br2CH3CH2Br + HBr 3、高温分解CH4 C + 2H2↑ 二、烯烃 1、燃烧 C2H4 + 3O22CO2 + 2H2O 2、加成反应
3、加聚反应 4、氧化反应 三、炔烃 1、燃烧 2C2H2 + 5O24CO2 + 2H2O 2、加成反应 四、芳香烃 1、卤代 2、硝化
3、加成 4、氧化 五、醇 1、与活泼金属反应2CH3CH2OH +2 Na2CH3CH2ONa + H2↑ 2、消去反应 3、脱水成醚 4、取代反应 5、氧化
6、酯化反应 六、醛1、氧化 2C2H4O + 5O24CO2 + 4H2O
2、还原 七、酮1、加氢还原 八、羧酸 1、酸性 2CH3COOH + 2Na = 2CH3COONa + H2↑ CH3COOH + NaOH = CHCOONa + H2O 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ CH3COOH + NaHCO3 = CH3COONa + H2O + CO2↑ 2、酯化反应参考醇的性质 九、酯1、水解 十一、卤代烃 1、水解反应 2、消去反应 十二、酚1、弱酸性
化学反应热效应练习题 1、下列说法不正确的是() A.化学反应可分为吸热反应和放热反应 B.化学反应的实质是旧键的断裂与新键的生成 C.化学反应中的能量变化都是以热能的形式表现出来 D.放热反应发生时不需加热 2.下列说法正确的是 A.化学反应中的能量变化,通常表现为热量的变化 B.反应物的总能量高于生成物的总能量时发生吸热反应 C.Ba(OH)2·8H2O与NH4Cl 的反应是放热反应 D.木炭在氧气中的燃烧是吸热反应 3.下列说法正确的是 A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应 B.需要加热才能进行的反应是吸热反应 C.反应放出热量的多少与反应物的质量和状态无关 D.对放热反应A+B→C+D ,A、B的能量总和大于C、D的能量总和 4.下列反应属于放热反应的是 A.氢气还原氧化铜 B.NH4Cl晶体和Ba(OH)2 ·8H2O混合搅拌 C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳 5.下列说法错误的是 A.化学键的断裂和形成是化学反应中能量变化的主要原因 B.放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小 C.化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热 D.凡经加热而发生的化学反应都是吸热反应 6.下列变化属于吸热反应的是: ①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰与水反应生成熟石灰 A.①④ B.②③ C.①④⑤ D.②④ 7.下列反应过程一定吸收能量的是 A.化合反应 B.加成反应 C.分子解离为原子 D.原子组成分子 8.下列过程需要吸热的是 A.O2→O+O B.H+Cl→HCl C.CaO+H2O=Ca(OH)2 D.浓硫酸稀释 9.下列关于能量转换的认识中不正确的是 A.电解水生成氢气和氧气时,电能转变成化学能 B.白炽灯工作时电能全部转化成光能 C.绿色植物光合作用过程中太阳能转变成化学能 D. 煤燃烧时化学能主要转变成热能 10.下列说法不正确的是
常见水解反应 一.简单水解反应 # 二.双水解 (一)不是彻底水解,比单一离子水解要强,用 表示,例: 1.(NH 4)2CO 3 水解离子方程式为:NH 4++CO 3 2- +H 2O HCO 3-+ 2.CH 3COONH 4水解离子方程式为:CH 3COO -+NH 4++H 2O CH 3COOH+ 3.NH 4HCO 3水解离子方程式为:NH 4++HCO 3 - +H 2O H 2CO 3+ (二)彻底水解, 用“=”,例: 1.泡沫灭火器原理:(药品为Al 2(SO 4)3和NaHCO 3) 水解化学方程式为:Al 2(SO 4)3+6NaHCO 3=2Al(OH)3↓+3Na 2SO 4+6CO 2↑ 水解离子方程式为:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑ 2.Al 3+与S 2-[如AlCl 3、Al 2(SO 4)3、Al (NO 3)3与Na 2S 、K 2S 溶液混合。] 水解物质 水解化学方程式 水解离子方程式 1.硫化钠水解 Na 2S+H 2O NaHS+NaOH S 2-+H 2O HS -+OH - 2.碳酸钠溶液呈碱性的原因 Na 2CO 3+H 2O NaHCO 3+NaOH … CO 32- +H 2O HCO 3-+OH - 溶液显酸性的原因 AlCl 3+3H 2O Al(OH)3+3HCl Al 3++ 3H 2O Al(OH)3+3H + 溶液中发生水解 NaHS+H 2O H 2S+NaOH HS -+H 2O H 2S+OH - NH 4Cl+H 2O +HCl NH 4++H 2O +H + ( CH 3COONa+H 2O CH 3COOH+NaOH CH 3COO -+H 2O CH 3COOH+OH - (SO 4)3 Fe 2(SO 4)3+6H 2O 2Fe(OH)3+3H 2SO 4 Fe 3++3H 2O Fe(OH)3+3H + NaF+H 2O HF+NaOH F -+H 2O HF+OH - · NaCN+H 2O HCN+NaOH CN -+H 2O HCN+OH - NaClO+H 2O HClO+NaOH ClO -+H 2O HClO+OH - CuSO 4+2H 2O Cu(OH)2+H 2SO 4 Cu 2++2H 2O Cu(OH)2+2H + * ZnCl 2+2H 2O Zn(OH)2+2HCl Zn 2++2H 2O Zn(OH)2+2H + NaHCO 3+H 2O H 2CO 3+NaOH HCO 3-+H 2O H 2CO 3+OH - Na 3PO 4+H 2O Na 2HPO 4+NaOH PO 43-+H 2O HPO 4-+OH - Na 2SO 3+H 2O NaHSO 3+NaOH ' SO 32-+H 2O HSO 3-+OH - HCOONa+H 2O HCOOH+NaOH HCOO -+H 2O HCOOH+OH - Na 2SiO 3+2H 2O H 2SiO 3+2NaOH SiO 32-+2H 2O H 2SiO 3+2OH - MgCl 2+2H 2O Mg(OH)2+2HCl Mg 2++2H 2O Mg(OH)2+2H +
化学反应与热效应练习题 一、选择题(每题只有1个正确答案) 1、今有如下三个热化学方程式:() H2(g)+1/2O2(g)=H2O(g);△H=a kJ/mol H2(g)+1/2O2(g)=H2O(l);△H=b kJ/mol 2H2(g)+O2(g)=2H2O(l);△H=c kJ/mol 关于它们的下列表述,正确的是 A. 它们都是吸热反应 B. a、b和c均为正值 C. 反应热的关系:a=b D. 反应热的关系:2b=c 2、已知:H2(g)+F2(g)2HF(g)+270kJ,下列说法正确的是( ) A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ 3、白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的 能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是()A.(6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1 4、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、 -1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( ) A.-44.2kJ·mol-1B.+44.2kJ·mlo-1 C.-330kJ·mol-1D.+330kJ·mlo-1 5、化学反应N2+3H2=2NH3的能量变化如题13图所示,该反应的热化学方程式 是( ) A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 B.N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1 C.1 2 N2(g)+ 3 2 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 D.1 2 N2(g)+ 3 2 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 6、下列关于热化学反应的描述中正确的是( )
中和反应的反应热测定 【教学目标】1、理解中和反应反应热测定的实验原理 2、掌握中和反应反应热测定的操作步骤、注意事项、数据处理及误差分析【教学重点】 1.中和热的测定原理和方法。 2.培养学生分析问题的能力。 【实验目的】 1.测定强酸、强碱反应的中和热,加深理解中和反应是放热反应。 2.培养学生设计实验的能力。 3.提高学生的思维能力和分析问题的能力。 4.培养学生严谨求实的科学作风。 【实验用品】 大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、碎纸条、硬纸板(中心有两个小孔)、环形玻璃搅拌棒。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液 【教学过程】 [引言]上节课我们刚刚认识了中和热,本节课我们就来亲自测一下强酸强碱反应的中和热。 [板书]中和反应的反应热测定 [设问]我们利用什么原理来测定酸、碱反应的中和热呢? [板书]实验原理 [问]中和热与反应热是否相同?它们之间有什么区别和联系? [学生讨论后回答] 本节课,我们取一定量的盐酸和氢氧化钠溶液发生中和反应,哪些数据可以帮助我们测出它们的反应热呢?请大家讨论回答。 [学生讨论后回答] [教师板书] Q=mcΔt ① Q:中和反应放出的热量。 m:反应混合液的质量。 c:反应混合液的比热容。 Δt:反应前后溶液温度的差值。 [问]我们如何得到上述数据呢? [生]m的质量为所用酸、碱的质量和,测出参加反应的酸、碱质量相加即可;c需要查阅,Δt可用温度计测出反应前后的温度相减得到。 [问]酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到? [生]量出它们的体积,再乘以它们的密度即可。 [师]如此说来,上述计算Q的式子可表示为 [板书]Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ② [讲解]本实验中,我们所用一元酸、一元碱的体积均为50 mL,它们的浓度分别为0.50 mol/L和0.55 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃) [板书]V酸=V碱=50 mL。
高中化学常见的水解反应 一.简单水解反应 水解物质水解化学方程式水解离子方程式 1.硫化钠水解 Na 2 S+H 2 O NaHS+NaOH S2-+H 2 O HS-+OH- 2.碳酸钠溶液呈碱性的原因 Na 2 CO 3 +H 2 O NaHCO 3 +NaOH CO 3 2-+H 2 O HCO 3 -+OH- 3.AlCl 3 溶液显酸性的原因 AlCl 3 +3H 2 O Al(OH) 3 +3HCl Al3++ 3H2O Al(OH) 3 +3H+ 4.NaHS溶液中发生水解 NaHS+H 2 O H 2 S+NaOH HS-+H 2 O H 2 S+OH- 5.NH 4Cl NH 4 Cl+H 2 O NH 3 .H 2 O+HCl NH 4 ++H 2 O NH 3 .H 2 O+H+ 6.CH 3COONa CH 3 COONa+H 2 O CH 3 COOH+NaOH CH 3 COO-+H2O CH 3 COOH+OH- 7.Fe 2(SO 4 ) 3 Fe 2 (SO 4 ) 3 +6H 2 O 2Fe(OH) 3 +3H 2 SO 4 Fe3++3H 2 O Fe(OH) 3 +3H+ 8.NaF NaF+H 2 O HF+NaOH F-+H 2 O HF+OH- 9.NaCN NaCN+H 2 O HCN+NaOH CN-+H 2 O HCN+OH- 10.NaClO NaClO+H 2 O HClO+NaOH ClO-+H 2 O HClO+OH- 11.CuSO 4 CuSO 4 +2H 2 O Cu(OH) 2 +H 2 SO 4 Cu2++2H 2 O Cu(OH) 2 +2H+ 12.ZnCl 2 ZnCl 2 +2H 2 O Zn(OH) 2 +2HCl Zn2++2H 2 O Zn(OH) 2 +2H+
2010高考化学试题分类汇编:化学反应中的能量变化 (2010山东卷)10下列与化学反应能量变化相关的叙述正确的是 A 生成物能量一定低于反应物总能量 B 放热反应的反应速率总是大于吸热反应的反应速率 C 英语盖斯定律,可计算某些难以直接侧脸房的反应焓变 D 同温同压下,22()()2()H g Cl g HCl g +=在光照和点燃条件的H ?不同 解析:生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A 错;反映速率与反应是吸热还是放热没有必然的联系,故B 错;C 是盖斯定律的重要应用,正确;根据H ?=生成物的焓-反应物的焓可知,焓变与反应条件无关,故D 错。 答案:C (2010重庆卷)12.已知()()()22H g Br l 2HBr g ;72kJ/mol.H +=?=- 蒸发1mol Br 2(l )需要吸收的能量为30kJ ,其它相关数据如下表: 则表中a 为 A .404 B .260 C .230 D .200 12. 答案D 【解析】本题考查盖斯定律的计算。由已知得:Br 2(l)=Br 2(g) H =+30KJ/mol ,则H 2(g) + Br 2(g) = 2HBr(g);H = -102KJ/mol 。436+a-2×369=-102;a=―200KJ ,D 项正确。 (2010天津卷)6.下列各表述与示意图一致的是 A .图①表示25℃时,用0.1 mol·L -1盐酸滴定20 mL 0.1 mol·L -1 NaOH 溶液,溶液的pH 随加入酸体积的变化 B .图②中曲线表示反应2S O 2(g) + O 2(g) 2S O 3(g);ΔH < 0 正、逆反应的平衡常数K 随温度的变化
r m r m 化学反应热效应测定 一、实验目的 1. 了解测定化学反应焓变的原理和方法,测定锌和硫酸铜反应的热效应; 2. 练习天平、容量瓶的使用等基本操作,熟悉准确浓度溶液的配制方法; 3. 掌握利用外推法校正温度改变值的作图方法。 二、实验原理 化学反应通常是在等压条件下进行的,此时的反应热叫做等压反应热,常以焓变 Δr Ηθ来表示,在热化学中规定,放热反应的焓变Δr Ηθ为负值,吸热反应的焓变 Δr Ηθ为正值。 例如,锌与硫酸铜溶液的反应,是一个自发 进行的反应,在 298.15K 下,每摩尔反应的 CuSO 4 与 Zn 放出 216.8kJ 热量,即 Zn + CuSO 4 = ZnSO 4 + Cu ? H θ = -216,8kJ / mol 放热反应焓变的测定方法很多,本实验是通 过如图 3-l 所示的量热器来测定的。测定焓变的 原理是根据能量守恒定律,即反应所放出的热量 促使量热器本身和反应体系温度升高,因此,由 图 3-l 反应热测定装置示意图 l —橡胶塞;2—温度计;3—真空隔热层;4—保温杯外壳;5—CuSO 4 溶液 溶液的比热和反应前后溶液的温度变化,可求得上述反应的焓变。 计算公式如下: ? r H m = -?T ? 1 ? n 1 1000 ? (cVd + c p ) 式中? H θ ——反应的焓变,kJ/mol ; ΔT ——反应前后溶液温度的变化,K ; c ——溶液的比热容,实验时测定; V ——反应时所用 CuSO 4 溶液的体积(mL ); d ——CuSO 4 溶液的密度,近似用水的密度 1.00g/mL 代替; n ——VmL 溶液中 CuSO 4 的物质的量; c p ——量热器等压热容,指量热器每升高一度所需的热量,J/K 。 θ
常见水解反应 一.简单水解反应 水解物质 水解化学方程式 水解离子方程式 1. 硫化钠水解 Na 2 S+H 2O NaHS+NaOH 2- +H 2O HS - - S +OH 2. 碳酸钠溶液呈碱性的原因 Na CO+HO NaHCO +NaOH 2- +H O HCO - - 3 CO 3 + OH 2 3 2 3 2 3.AlCl 3 溶液显酸性的原因 AlCl 3+3H 2O Al(OH) 3+3HCl Al 3++ 3H 2O Al(OH) 3 +3H + 4.NaHS 溶液中发生水解 NaHS+H 2O H 2 S+NaOH - H - HS+H 2O 2 S+OH 5.NH 4Cl NH 4Cl+H 2O NH 3 .H 2O+HCl + NH 3.H + NH 4 +H 2O 2O+H 3 3 2 CH 3 3 - 2 CH 3 - 6.CH COONa CHCOONa+H COOH+NaOH CHCOO+H O COOH+OH 2 4 3 2 4 3 2 3+ 2 Fe(OH) 3 + 7.Fe (SO ) Fe (SO ) +6H O Fe +3H O +3H 2Fe(OH) 3+3H 2SO 4 8.NaF NaF+H 2O HF+NaOH F - +H 2O HF+OH - 9.NaCN 2 HCN+NaOH - 2 HCN+OH - NaCN+HO CN+H O 10.NaClO 2 HClO+NaOH - 2 HClO+OH - NaClO+HO ClO +HO 11.CuSO 4 CuSO 4+2H 2O Cu(OH) 2+H 2SO 4 Cu 2++2H 2O Cu(OH) 2+2H + 12.ZnCl 2 ZnCl 2+2H 2O Zn(OH) 2+2HCl Zn 2++2H 2O Zn(OH) 2+2H + 13.NaHCO NaHCO+H O H 2CO+NaOH - H - HCO+HO 2 CO+OH 3 3 2 3 3 2 3 14.Na PO Na PO+HO Na HPO+NaOH 3- +HO HPO - - 2PO 4 +OH 3 4 3 4 2 4 4 2 15.Na SO Na SO+HO NaHSO +NaOH 2- HSO - - SO +HO 3 +OH 2 3 2 3 2 3 3 2 16.HCOONa HCOONa+H 2 HCOOH+NaOH - - HCOO+H 2O HCOOH+OH 17.Na 2SiO 3 Na 2 SiO 3+2H 2O SiO 3 2- +2H 2O H 2SiO 3+2NaOH - H 2SiO 3+2OH 18.MgCl 2 MgCl 2+2H 2O Mg(OH) 2+2HCl 2+ Mg(OH) + Mg +2H 2O 2 +2H 二.双水解 (一)不是彻底水解,比单一离子水解要强,用 表示 , 例: 1.( NH ) CO 水解离子方程式为: + 2- +H O HCO - +NH.H O NH +CO 3 4 2 3 4 3 2 3 2 2. CH 3COONH 4水解离子方程式为: - + CH 3COOH+NH 3. 2O CH 3COO+NH 4 +H 2O 3. NHHCO 水解离子方程式为: + - +HO H CO+NH.H O NH +HCO 4 3 4 3 2 2 3 3 2 ( 二) 彻底水解 , 用“ =”,例: 1.泡沫灭火器原理: (药品为 Al 2(SO 4) 3 和 NaHCO 3) 水解化学方程式为: Al 2(SO 4) 3+6NaHCO 3=2Al(OH) 3↓ +3Na 2SO 4+6CO 2↑ 水解离子方程式为: Al 3+ - 3 2 +3HCO=Al(OH) ↓ +3CO ↑ 2. Al 3+与 S 2- [ 如 AlCl 3、 Al 2(SO 4) 3、Al ( NO 3) 3 与 Na 2S 、 K 2S 溶液混合。 ] 水解离子方程式为: 2Al 3++3S 2- +6H 2O=2Al(OH)3↓ +3H 2S ↑ 3+ 2- [ 如 AlCl 、 Al (SO ) 、 Al ( NO ) 与 NaCO 、 K CO 溶液混合。 ] 3. Al 与 CO 3 3 3 2 4 3 3 2 3 2 3 水解离子方程式为: 3+ 2- 2 3 2 2Al +3CO +3H O=2Al(OH) ↓ +3CO ↑ 4. Al 3+与 AlO 2 - [ 如 AlCl 3、 Al 2(SO 4) 3、 Al ( NO 3) 3与 NaAlO 2、KAlO 2 溶液混合。 ] Al 3++3AlO 2 - +6H 2O=4Al(OH)3↓ 3+ - [ 3 2 4 3 3 3 与 NaClO 溶液混合。 ] 5.Fe 与 ClO 如 FeCl 、 Fe (SO ) 、 Fe ( NO ) Fe 3++3ClO - +3H 2O= Fe(OH)3↓ +3HClO 6.Fe 3+与 HCO 3 - [ 如 FeCl 3、 Fe 2 (SO 4) 3、 Fe ( NO 3) 3 与 NaHCO 3溶液混合。 ] 3+ - 3 2 Fe +3HCO =Fe(OH) ↓+3CO ↑
高考反应热的计算真题汇 编 Final revision on November 26, 2020
2017、2016年高考卷反应热的计算真题(word高清版含答案) 1.(2017全国新课标I卷28题) 28.(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 ________________、______________,制得等量H 2 所需能量较少的是 _____________。 2.(2017全国新课标II卷27题) 27.(1)正丁烷(C 4H 10 )脱氢制1-丁烯(C 4 H 8 )的热化学方程式如下: ①C 4H 10 (g)=C 4 H 8 (g)+H 2 (g)ΔH1 已知:②C 4H 10 (g)+1 2 O 2 (g)=C 4 H 8 (g)+H 2 O(g)ΔH2=?119kJ·mol1 ③H 2(g)+1 2 O 2 (g)=H 2 O(g)ΔH3=?242kJ·mol1 反应①的ΔH1为________kJ·mol1。 3.(2017全国新课标III卷7题) 7.化学与生活密切相关。下列说法错误的是 A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 B.绿色化学要求从源头上消除或减少生产活动对环境的污染C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放D.天然气和液化石油气是我国目前推广使用的清洁燃料 4.(2017全国新课标III卷28题) 28.(3)已知:As(s)+3 2 H 2 (g)+2O 2 (g)=H 3 AsO 4 (s)ΔH1 H 2(g)+ 1 2 O 2 (g)=H 2 O(l)ΔH2 2As(s)+5 2 O 2 (g)=As 2 O 5 (s)ΔH3 则反应As 2O 5 (s)+3H 2 O(l)=2H 3 AsO 4 (s)的ΔH=_________。 5.(2017天津卷7题)
高中化学:焰色反应实验技巧 (一). 钠离子: 钠的焰色反应本应不难做,但实际做起来最麻烦。因为钠的焰色为黄色,而酒精灯的火焰因灯头灯芯不干净、酒精不纯而使火焰大多呈黄色。即使是近乎无色(浅淡蓝色)的火焰,一根新的铁丝(或镍丝、铂丝)放在外焰上灼烧,开始时火焰也是黄色的,很难说明焰色是钠离子的还是原来酒精灯的焰色。要明显看到钠的黄色火焰,可用如下方法。 ⑴方法一(镊子-棉花-酒精法):用镊子取一小团棉花(脱脂棉,下同)吸少许酒精(95%乙醇,下同),把棉花上的酒精挤干,用该棉花沾一些氯化钠或无水碳酸钠粉末(研细),点燃。 ⑵方法二(铁丝法): ①取一条细铁丝,一端用砂纸擦净,再在酒精灯外焰上灼烧至无黄色火焰 ②用该端铁丝沾一下水,再沾一些氯化钠或无水碳酸钠粉末 ③点燃一盏新的酒精灯(灯头灯芯干净、酒精纯) ④把沾有钠盐粉末的铁丝放在外焰尖上灼烧,这时外焰尖上有一个小的黄色火焰,那就是钠焰。以上做法教师演示实验较易做到,但学生实验因大多数酒精灯都不干净而很难看到焰尖,可改为以下做法:沾有钠盐的铁丝放在外焰中任一有蓝色火焰的部位灼烧,黄色火焰覆盖蓝色火焰,就可认为黄色火焰就是钠焰。 (二). 钾离子: ⑴方法一(烧杯-酒精法): 取一小药匙无水碳酸钠粉末(充分研细)放在一倒置的小烧杯上,滴加5~6滴酒精,点燃,可看到明显的浅紫色火焰,如果隔一钴玻璃片观察,则更明显看到紫色火焰。 ⑵方法二(蒸发皿-?酒精法): 取一药匙无水碳酸钠粉末放在一个小发皿内,加入1毫升酒精,点燃,燃烧时用玻棒不断搅动,可看到紫色火焰,透过钴玻璃片观察效果更好,到酒精快烧
完时现象更明显。 ⑶方法三(铁丝-棉花-水法): 取少许碳酸钠粉末放在一小蒸发皿内,加一两滴水调成糊状;再取一条小铁丝,一端擦净,弯一个小圈,圈内夹一小团棉花,棉花沾一点水,又把水挤干,把棉花沾满上述糊状碳酸钠,放在酒精灯外焰上灼烧,透过钴玻璃片可看到明显的紫色火焰。 ⑷方法四(铁丝法): 同钠的方法二中的学生实验方法。该法效果不如方法一、二、三,但接近课本的做法。 观察钾的焰色时,室内光线不要太强,否则浅紫色的钾焰不明显。 (三). 锂离子: ⑴方法一(镊子-棉花-酒精法): 用镊子取一团棉花,吸饱酒精,又把酒精挤干,把棉花沾满Li2CO3粉末,点燃。? ⑵方法二(铁丝法):跟钠的方法二相同。 (四). 钙离子: ⑴方法一(镊子-棉花-酒精法):同钠的方法一。 ⑵方法二(烧杯-酒精法): 取一药匙研细的无水氯化钙粉末(要吸少量水,如果的确一点水也没有,则让其在空气吸一会儿潮)放在倒置的小烧杯上,滴加7~8滴酒精,点燃。 ⑶方法三(药匙法):用不锈钢药匙盛少许无水氯化钙(同上)放在酒精灯外焰上灼烧。 (五). 锶离子: 方法一、二:同碳酸锂的方法一、二。 (六). 钡离子:
实验 中和反应热的测定 【实验目的】 1、理解中和热的概念。 2、学习中和热的测定方法。 3、通过实验,进一步领会做定量实验的方法。 【知识点回顾】 中和热概念:酸与碱发生中和反应生成1molH 2O 时所释放的热量 【实验原理】 1、0.50mol ·L -1盐酸和0.55 mol ·L -1NaOH 溶液的密度都是1g ·cm -3,所以50mL 0.50mol ·L -1盐酸的质量m 1=50g ,50mL 0.55mol ·L -1 NaOH 溶液的质量m 2=50g 。 2、中和后生成的溶液的比热容c=4.18J ·(g ·℃)-1,由此可以计算出0.50mol ·L -1盐酸与 0.55mol ·L -1NaOH 溶液发生中和反应时放出的热量为 (m 1+m 2)·c ·(t 2-t 1)=0.418(t 2-t 1)kJ 又因50mL 0.50mol ·L -1盐酸中含有0.025molHCl ,0.025molHCl 与0.025molNaOH 发生中和 反应,生成0.025molH 2O ,放出的热量是0.418(t 2-t 1)kJ ,所以生成1 molH 2O 时放出的热 量即中和热 为 △H=-025.0) (418.012t t kJ ·mol -1 【实验用品】 大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡 沫塑料或硬纸板(中心有两个小孔),环形玻璃搅拌棒。 0.50mol ·L -1盐酸、0.55mol ·L -1 NaOH 溶液。 注:为了保证0.50mol ·L -1盐酸完全被NaOH 中和,采用0.55mol ·L -1NaOH 溶液,使碱稍微 过量。 【实验过程】 一、测定前的准备工作 1、 温度计的使用。 ⑴选择精密温度计(精确到0.1℃),并进行校对(本实验温度要求精确到0.1℃)。 ⑵使用温度计要轻拿轻放。温度计用后要及时 放回 。刚刚测量高温的 温度计不可立即用水冲洗,以免 。
常见有机反应的十大类型 李勇 1. 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代: s (2)硝化: s (3)磺化: (4)卤代烃水解: (5)酯水解:
(6)羟基( OH)取代: (7)分子间脱水: 2. 加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 (1)碳碳双键的加成: (2)碳碳三键的加成: (3)醛基的加成: (4)苯环的加成: 3. 加成聚合(加聚)反应 相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。
(1)丙烯加聚: (2)二烯烃加聚: 4. 缩合聚合(缩聚)反应 单体间相互反应而生成高分子化合物,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。 (1)制酚醛树脂: (2)缩聚制酯: (3)氨基酸缩聚: 5. 消去反应 有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。
6. 氧化还原反应 在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。 (1)氧化反应: (2)还原反应: 7. 酯化反应(亦是取代反应) 酸和醇起作用,生成酯和水的反应 s 8. 水解反应(亦是取代反应,其中卤代烃、酯的水解见取代反应部分)
化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等)。 麦芽糖葡萄糖 9. 脱水反应(又叫碳化) 有机物分子脱去相当于水的组成的反应。 10. 裂化反应 在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。
2017、2016年高考卷反应热的计算真题(word高清版含答案) 1.(2017全国新课标I卷28题) 28.(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 ________________、______________,制得等量H2所需能量较少的是 _____________。 2.(2017全国新课标II卷27题) 27.(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1 O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1已知:②C4H10(g)+1 2 O2(g)= H2O(g) ΔH3=242kJ·mol1 ③H2(g)+ 1 2 反应①的ΔH1为________kJ·mol1。 3.(2017全国新课标III卷7题) 7. 化学与生活密切相关。下列说法错误的是 A.是指粒径不大于μm的可吸入悬浮颗粒物 B.绿色化学要求从源头上消除或减少生产活动对环境的污染 C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 D.天然气和液化石油气是我国目前推广使用的清洁燃料 4.(2017全国新课标III卷28题) H2(g)+2O2(g)=H3AsO4(s) ΔH1 28.(3)已知:As(s)+3 2 O2(g)=H2O(l) ΔH2 H2(g)+1 2
2As(s)+5 O2(g) =As2O5(s) ΔH3 2 则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。 5.(2017天津卷7题) 7. (3)mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·x H2O的液态化合物,放热kJ,该反应的热化学方程式为___ _____ __。 6.(2017北京卷26题) 26.(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+ kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2= kJ·mol-1 ①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:________ _________。 ②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:____________ ___。 7.(2017江苏卷单科8题) 8.通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确 ...的是 ①C(s) + H 2O(g)CO(g) + H2 (g) ΔH1 = a kJ·mol-1 ②CO(g) + H 2O(g)CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1 ③CO 2 (g) + 3H2 (g)CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1 ④2CH 3OH(g)CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1