高二化学定时训练
班级______ 姓名________ 得分_______ 有机化学方程式练习1
(一).加成反应
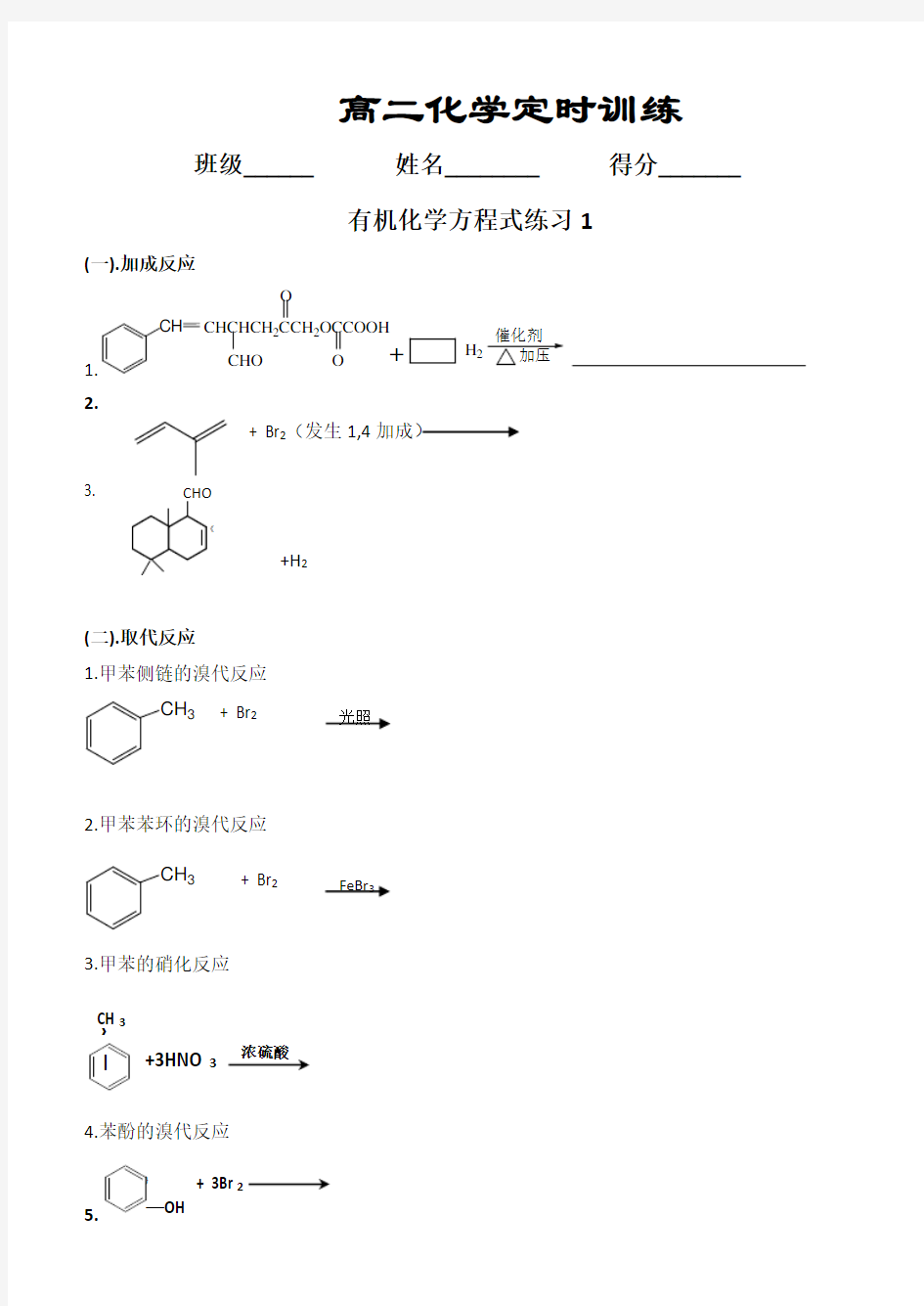
1.CH +CHCHCH 22OCCOOH
O
2.
+ Br 2
(发生1,4
3.
+H 2
(二).取代反应
1.甲苯侧链的溴代反应
+ Br 2
2.甲苯苯环的溴代反应
+ Br 2
3.甲苯的硝化反应
4.苯酚的溴代反应
5.
CH 3 》 | +3HNO 3 浓硫酸
} —OH + 3Br 2 CH 3CH 3
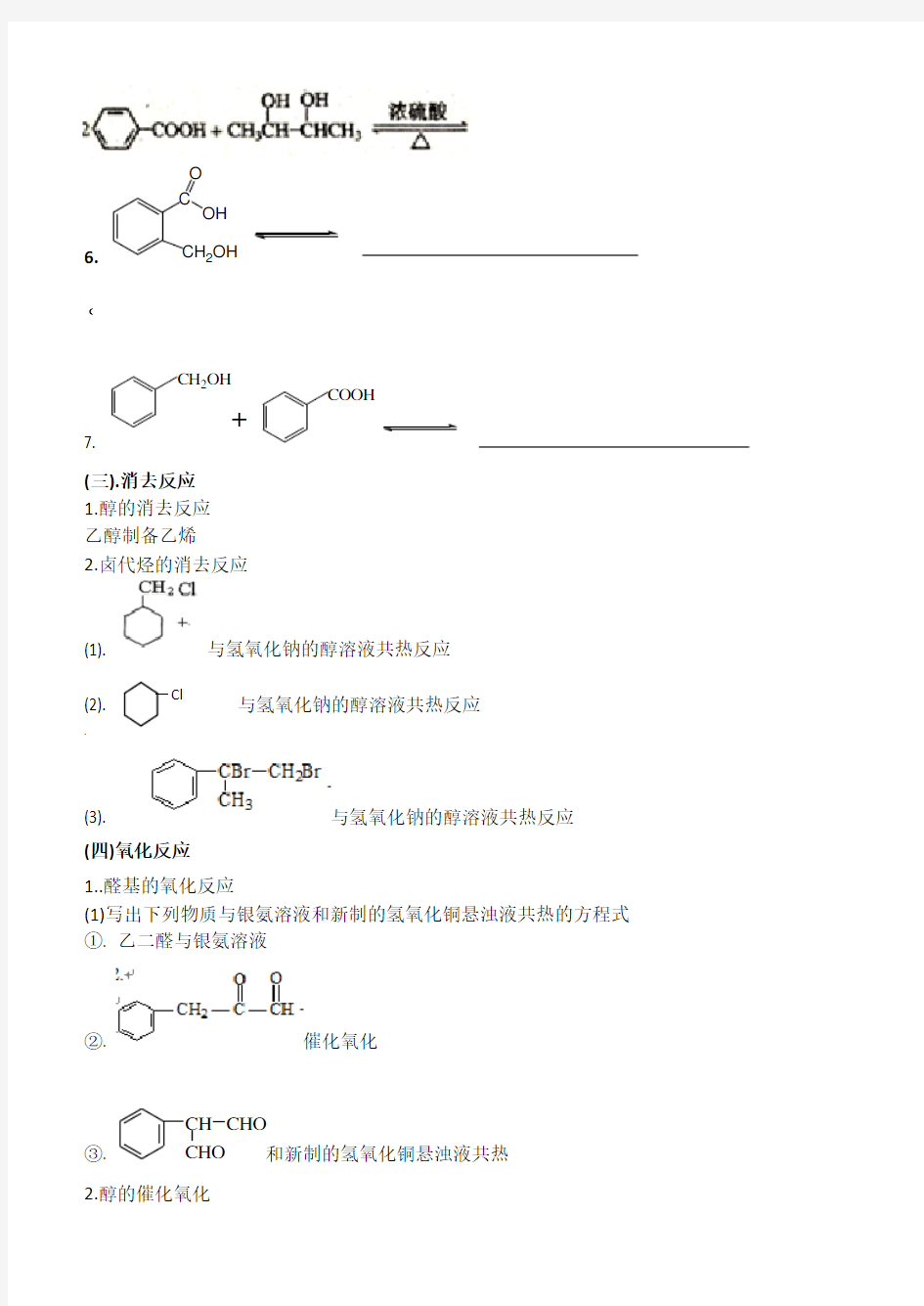
6.C
CH2OH
OH O
(
7.
COOH
+
CH2OH
(三).消去反应
1.醇的消去反应
乙醇制备乙烯
2.卤代烃的消去反应
(1). 与氢氧化钠的醇溶液共热反应
(2). 与氢氧化钠的醇溶液共热反应
.
(3). 与氢氧化钠的醇溶液共热反应
(四)氧化反应
1..醛基的氧化反应
(1)写出下列物质与银氨溶液和新制的氢氧化铜悬浊液共热的方程式
①. 乙二醛与银氨溶液
②. 催化氧化
③. CH
CHO
CHO
和新制的氢氧化铜悬浊液共热
2.醇的催化氧化
—Cl
)
(五)加聚反应
1. n
2.
(六)缩聚反应
)
1. 浓H 2SO 4 n HOCH 2CH 2OH +n HOOC-COOH
3.
4.苯酚和甲醛
(
跟踪练习
1. 2-甲基-2-丁烯被酸性KMnO 4溶液氧化的产物:
2. 2-溴丙烷的水解反应
消去反应
3. 环己醇发生下列反应:
(1)催化氧化反应:
催化剂
催化剂 H 3C CH OH 浓H 2SO4
(2)消去反应:
(3)与乙酸的酯化反应:
4. 对甲基苯酚发生下列反应
(1)与碳酸钠反应:
*
(2)与浓溴水反应:
(3)向对甲基苯酚钠溶液中通入CO2气体:5. 乙烯水化法制乙醇:
葡萄糖发酵法制乙醇:
乙炔水化法制乙醛:
乙烯氧化法制乙醛:
乙醛氧化法制乙酸:
(OH)-COOH发生下列反应
①与金属钠反应:
②与NaOH反应
'
③催化氧化反应:
④消去反应:
⑤单分子酯化成环:
⑥两分子酯化成链
⑦两分子酯化成环
⑧缩聚反应
3.苯甲酸甲酯在NaOH溶液中的水解
4.苯甲醛的银镜反应
|
高二化学定时训练
班级______ 姓名________ 得分_______
有机化学方程式练习2
1.写出下面物质分别与足量的钠、氢氧化钠、碳酸氢钠反应的化学方程式。
~
2.写出下列两物质分别与足量氢氧化钠反应的化学方程式。
(1)
(2)
】
高二化学定时训练
班级______ 姓名________ 得分_______
有机化学方程式练习3
1.比较: 乙醇催化氧化: __________________________________________________________
2-丙醇催化氧化: __________________________________________________________乙醛催化氧化: __________________________________________________________ 2.得到乙醇的五种方法:
____________________________________ ___________反应类型_____________
3.得到丙烯的三种方法:
1、甲烷的主要化学性质 (1)氧化反应 CH 4(g)+2O 2(g)??→?点燃 CO 2(g)+2H 2O(l) (2)取代反应 2、乙烯的主要化学性质 (1)氧化反应: C 2H 4+3O 2 ??→?点燃 2CO 2+2H 2O (2)加成反应 乙烯还可以和氢气、氯化氢、水等发生加成反应。 CH 2=CH 2 + H 2CH 3CH 3 CH 2=CH 2+HCl CH 3CH 2Cl (一氯乙烷) CH 2=CH 2+H 2O CH 3CH 2OH (乙醇) (3)聚合反应: 3、乙炔的主要化学性质 (1)乙炔的实验室制取 (2)加成反应 (氯乙烯) ( 聚氯乙烯) 4、苯的主要化学性质 (1) 氧化反应 2C 6H 6+15O 2 ??→?点燃 12CO 2+6H 2O (2) 取代反应
+ Br 2?? →?3FeBr + HBr 苯与硝酸(用HO-NO 2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度 大于水的油状液体——硝基苯。 + HO-NO 2 浓硫酸 △ + H 2O ( TNT 三硝基甲苯) (3) 加成反应 用镍做催化剂,苯与氢发生加成反应,生成环己烷。 + 3H 2 ??→?催化剂 5、苯酚的主要化学性质 (1)苯酚的弱酸性 (2)苯酚的取代反应(鉴别苯酚) (鉴别苯酚:滴加FeCl 3溶液,溶液呈紫色) 6、卤代烃的主要化学性质 (1)取代反应 (2)消去反应 7、乙醇的重要化学性质 (1)乙醇与金属钠的反应: 2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑ (2)乙醇的氧化反应 NO 2
化学式书写练习学生 Company number【1089WT-1898YT-1W8CB-9UUT-92108】
化学式练习(一)(书写)一、单质: 二、氧化物: 三、酸: 四、碱: 四、盐:
化学式练习(二)俗称 化学式练习(三)颜色、溶解性一、写出下表中溶液的颜色合溶液中溶质的化学式:
2月7日讲练化学式与化合价表示()。 个二氧化碳分子个碳原子和4个氧原子个碳原子和2个氧分子个碳原子和2个氧原子2.下列计算错误的是()。 (OH) 的相对分子质量:24 +(16 + 1)×2 = 58 2 中硫元素与氧元素的质量比:1:1
中氮元素的质量分数: 80 14 ×100% = % g 水(H 2O )中含氢元素的质量:18 g × 16 212 1+??= 2 g 3.比较5个SO 2分子和5个CO 2分子,含量一样的是( )。 A.氧分子 B.氧原子 C.氧元素 D.氧气 4.某物质化学式为R m (SO 4)n ,则R 的化合价为 ( ) B.m n 2+ C.n m 2+ (m-2n) 5.将下列符号的意义及符号中数字“2”的意义填入表中: 6、有关尿素[CO(NH2)2]的说法正确的是 ( ) A .尿素的相对分子质量为:12+16+14+1×2×2=46 B .尿素是一种有机氮肥 C .尿素中碳、氧、氮、氢四种元素的质量比为12:16:14:1 D .尿素中氮元素质量分数的计算式为(14/60)×l00% 7.黄曲霉素AFTB (化学式为C17H 12O 6)是污染粮食(大米、花生等)的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,继而转为肝癌。 (1)黄曲霉素AFTB 由几种元素组成 (2)黄曲霉素AFTB 分子中共有多少个原子
高二年化学有机化学方程式练习 完成下列反应的化学方程式(有机物写结构简式) 1、甲烷的氯代反应(只写二氯代反应) 取代反应 CH 4 Cl 2CH 2Cl 2 2、乙烯在硫酸作用下与水反应 加成反应 CH 2=CH 2 H-OH CH 3CH 2 OH 3、乙烯与溴水的反应 加成反应 CH=CH 2 Br 2CH 2 =CHBr 4、乙烯在一定条件下与溴化氢的反应 加成反应 CH=CH 2 CH 3CH 2 Br 6、乙炔在催化剂存在下与氯化氢反应生成氯乙烯 加成反应 CH 2 =CHCl 7、由丙烯制聚丙烯(7、8、9不要求写反应条件) 加聚反应 n CH 2 =CHCH 3 CH-----CH 2CH 3 8、由氯乙烯制聚氯乙烯 加聚反应 n CH 2 =CHCH 3 CH---CH 2Cl 9、由苯乙烯制聚苯乙烯 加聚反应 n CH 2=CHCH 3 CH--CH 2 10、苯的溴代 取代反应(溴代) 2 Fe Br 11、苯的氯代反应 取代反应(氯代) Cl 2 Fe Cl
12、苯的硝化取代反应(硝化) 3 NO 2 13、甲苯与较稀硝酸、较低温度下的硝化反应取代反应(硝化) HNO 3NO 2 CH 3 CH 3 HNO 3 CH 3 CH 3 NO 2 14、甲苯在较高温度、浓硝酸下的硝化反应取代反应(硝化) 3 NO 2 O 2 N NO 2 CH 3 CH 3 15、 2-溴丙烷在氢氧化钠水溶液中的反应 取代反应(水解) CH 3 CHBrCH 3 NaOH CH3CHOHCH3NaBr 16、 2-溴丙烷在氢氧化钠醇溶液中的反应 消去反应 CH 3 CHBrCH 3 NaOH CH 2 =CHCH 3 NaBr 17、1- 丙醇的催化氧化 氧化反应3 CH 2 CH 2 OH 2 CH 3 CHO 18、2-丙醇的催化氧化 氧化反应 2 CH 3 CH 3 CHOHCH 3 19 、1-丙醇氢溴酸的溴代反应 取代反应(溴代) CH 3 CH 2 CH 2 OH CH 3 CH 2 CH 2 Br
高中有机化学方程式总结 一、烃 1.甲烷 烷烃通式:C n H 2n -2 (1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯 乙烯的制取:CH 3CH 2OH H 2 烯烃通式:C n H 2n (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃 光 光 光 光 浓硫酸 170℃ 高温 催化剂 △ 图1 乙烯的制取
乙烯加聚,生成聚乙烯:n H 2 3.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH B r CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n CH n 4.苯 苯的同系物通式:C n H 2n-6 (1)氧化反应 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。 CH 2-CH 2 点燃 图2 乙炔的制取 催化剂 △ Br CH 2—CH Cl CH=CH 点燃
高二化学定时训练 班级______ ________ 得分_______ 有机化学方程式练习1 (一).加成反应 1.CH +CHCHCH 2CCH 2OCCOOH CHO O O 2. + Br 2 (发生1,4 3. +H 2 (二).取代反应 1.甲苯侧链的溴代反应 + Br 2 2.甲苯苯环的溴代反应 + Br 2 3.甲苯的硝化反应 4.苯酚的溴代反应 5. CH 3 | +3HNO 3 浓硫酸 —OH + 3Br 2 CH 3CH 3CHO
6. C CH 2OH OH O 7. COOH + CH 2OH (三).消去反应 1.醇的消去反应 乙醇制备乙烯 2.卤代烃的消去反应 (1). 与氢氧化钠的醇溶液共热反应 (2). 与氢氧化钠的醇溶液共热反应 (3). (四)氧化反应 1..醛基的氧化反应 (1)写出下列物质与银氨溶液和新制的氢氧化铜悬浊液共热的方程式 ①. 乙二醛与银氨溶液 ②. 催化氧化 ③. 和新制的氢氧化铜悬浊液共热 2.醇的催化氧化 (五)加聚反应 1. n 2. (六)缩聚反应 1.Cl
n HOCH 2CH 2OH +n 2.n 3. 4.苯酚和甲醛 跟踪练习 1. 2-甲基-2-丁烯被酸性KMnO 4溶液氧化的产物: 2. 2-溴丙烷的水解反应 消去反应 3. 环己醇发生下列反应: (1)催化氧化反应: (2)消去反应: (3)与乙酸的酯化反应: 4. 对甲基苯酚发生下列反应 (1)与碳酸钠反应: (2)与浓溴水反应: (3) 向对甲基苯酚钠溶液入CO 2气体: 5. 乙烯水化法制乙醇: 葡萄糖发酵法制乙醇: 乙炔水化法制乙醛: 乙烯氧化法制乙醛: 乙醛氧化法制乙酸: 6.CH 3-CH (OH )-COOH 发生下列反应 ①与金属钠反应: H 3C CH
天堂de 果冻专业贡献 光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ △ 催化剂 催化剂 催化剂 催化剂 催化剂 △ 催化剂 加热、加压 + 高中有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH 10. CH 2 = CH 23—CH 2 Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n 13. nCH 22-CH=CH-CH 2] n 14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O 24. + 3H 2O 26. 3CH ≡27. CH 3CH 228. CH 3CH 229. CH 3CH 22O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. 2O 35. 2O -+H 3O + 23 37 38. CH 339. 2CH 340. CH 34 +2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑ 44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O 46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O 47.CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+ 2OH 49. nOHCH 2CH 22H 2O 50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 2 52. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6 麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 56.C 17H 33COO-CH 2 C 17H 35COO-CH 2 C 17H 33COO-CH +3H 2 C 17H 35COO-CH C 17H 33COO-CH 2 C 17H 352 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH COOH+ CH-OH C 17H 35COO-CH 2 58. CH 2OH COOH CH 2OH COOH
化学式书写练习(学 生打印) https://www.doczj.com/doc/3e7860515.html,work Information Technology Company.2020YEAR
化学式练习(一)(书写) 二、氧化物: 三、酸: 四、碱: 四、盐:
化学式练习(二)俗称 化学式练习(三)颜色、溶解性
2月7日讲练 化学式与化合价 1.2CO 2表示( )。 A.2个二氧化碳分子 B.2个碳原子和4个氧原子 C.2个碳原子和2个氧分子 D.2个碳原子和2个氧原子 2.下列计算错误的是( )。 A.Mg(OH)2的相对分子质量:24 +(16 + 1)×2 = 58 B.SO 2中硫元素与氧元素的质量比:1:1 C.NH 4NO 3中氮元素的质量分数: 80 14 ×100% = 17.5% D.18 g 水(H 2O )中含氢元素的质量:18 g ×16 212 1+??= 2 g 3.比较5个SO 2分子和5个CO 2分子,含量一样的是( )。 A.氧分子 B.氧原子 C.氧元素 D.氧气 4.某物质化学式为R m (SO 4)n ,则R 的化合价为 ( ) A.2n-m B.m n 2+ C.n m 2+ D.-(m-2n) 5.将下列符号的意义及符号中数字“2”的意义填入表中:
6、有关尿素[CO(NH2)2]的说法正确的是 ( ) A .尿素的相对分子质量为:12+16+14+1×2×2=46 B .尿素是一种有机氮肥 C .尿素中碳、氧、氮、氢四种元素的质量比为12:16:14:1 D .尿素中氮元素质量分数的计算式为(14/60)×l00% 7.黄曲霉素AFTB (化学式为C17H 12O 6)是污染粮食(大米、花生等)的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,继而转为肝癌。 (1)黄曲霉素AFTB 由几种元素组成? (2)黄曲霉素AFTB 分子中共有多少个原子? (3)黄曲霉素AFTB 的相对分子质量是多少? (4)黄曲霉素AFTB 分子中氧元素的质量分数是多少? 化学式与化合价练习题 自主学习 1.关于“H 2”表示的意义,下列说法错误的是 ( ) A .表示氢气这种物质 B .表示2个氢气原子 C .表示1个氢气分子 D .表示每个氢分子是由2个氢原子构成的 2.下列符号能代表2个分子的是 ( ) A .MgCl 2 B .Re 2O 3 C .2O 2 D .2Al 3.下列计算或结果正确的是 ( ) A .Ca(OH)2的相对分子质量=40+16+1×2=58 B .SO 2中硫元素与氧元素的质量比是2:1 C .CO 2中氧元素的质量分数 44 12 ×100% D .54g 水中含有氢元素6g
5.2如何正确书写化学方程式 -、学习目标: 1. 领会化学方程式、反应物与生成物的含义。 2. 明确化学方程式中各种符号及化学意义。 3. 学会正确书写化学方程式和配平简单化学方程式。(重难点) 【课前预习】 1. 什么是质量守恒定律? 2. 用原子、分子的观点解释质量守恒的原因。 3. 用化学式完成下表中的化学反应(注明反应条件): 【情境导入】 、自主探究: 1. 书写化学方程式的原则:⑴必须以为基础;⑵遵 守。 2. 书写化学方程式的步骤(以磷在空气中燃烧生成五氧化二磷为例): ⑵; ⑶。 3. 注意: ⑴化学方程式配平的标志:。 ⑵化学反应在一定条件下才能发生,因此,需要在化学方程式中注明,如把点燃、加热(常用来表示),催化剂等写在。 ⑶如果生成物中有气体,在气体物质的化学式右边要注号;溶液中的反应如果生成物中有固体,在固体物质化学式右边要注号。 ■如果,气体生成物就不需注“f”号,同样,溶液中的反应如果 ,固体生成物也不需注。 1. 最小公倍数法:寻找化学反应方程式左右两边各出现一次的原子,且原子个数相差最多的元素为配平起点。 FeaQ+C----Fe+CO 2选择。原子为配平起点,由于3与2的最小公倍数为6,故Fe2。系数为2, _ . ,,一-、,"、,,-、一、一,,. ,一I一一^、~一、、,局温
而CO的系数为3,然后调节C与Fe2O3的系数分别为3和4,既原万程变为:2F&O+3C 4Fe+3CO 2。 2. 奇数配偶法:寻找反应式左右两边出现次数较多的原子,且原子的个数为一奇一偶的元素为 配平的起点。将奇数的原子用2、4、4、8….等偶数配成偶数,调节其他元素的原子的个数。 Fe2O3+C----Fe+CO 2选择O原子,因。原子的个数为一奇一偶,所以先将高?/e 2O3用偶数2配平,再依次推导出G Fe2O3、CO的系数,分别为3、4、3,即得2Fe2Q+3C =4Fe+3CO 2 。 3. 观察法:当反应方程式两边有的物质组成较为复杂时,考虑用观察法。即观察分析反应式左 右两边相关物质的组成,从中找出其变化规律来确定各自化学式前的系数;在推导其他原子的个数。 Fe2Q+C----Fe+CO 2反应中:C-----CO 2 , C夺取了Fe2。里两个。原子,那么一分" Fe2。里的3个O原子可以供给3/2个C-----3/2 个CQ,然后调节为整数系数为:2F&Q+3C =4Fe+3CO 。【课堂小结】通过本节课的学习,你收获了什么? 【小结】 1、书写化学方程式的步骤: ⑴写:根据事实,左边写反应物,右边写生成物,反应物或生成物不止一种时用“+”连接,反 应物和生成物之间用“一”连接。 ⑵配:在化学式前配上适当的化学计量数(并使之成最简整数比),使反应物和生成物中各元素的种类和原子个数都相等(遵守质量守恒定律),切不可改动化学式中的数字!一般用最小公倍数法或观察法。 ⑶标:即标明反应条件和生成物状态。气体用“f” ,液体中生成固体用“广,但当反应物和生成物中均有气体或固体时,不须注明!将“一”改成“==”。 2、配平化学方程式的常用方法:①最小公倍数法;②奇数配偶法;③观察法。 三、自我测评 【课堂练习】课本F99.1?5 1. 将“嫦娥一号”送上太空的火箭推力巨大,因为它所使用的燃料是液氢、助燃剂是液氧,则液氢 燃烧的化学方程式为;液氢作燃料除了单位质量燃烧的热能最大以外,还有一个与环保有关的优点是。 2. 写出下列反应的化学方程式:
溴水与高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物。 (1)能使溴水褪色或变色的物质及有关化学反应原理分别为: ①烯烃、炔烃、二烯烃等不饱与烃类及其不饱与烃的衍生物反应,使溴水褪色 CH2=CH2+Br2——→CH2Br-CH2Br CH≡CH+Br2——→CHBr=CHBr (或CH≡CH+2Br2——→CHBr2-CHBr2 CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br (或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2) ②与苯酚反应生成白色沉淀 图1 ③与醛类等有醛基的物质反应,使溴水褪色 CH3CHO+Br2+H2O=CH3COOH+2HBr ④因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。 (1)密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等); (2)密度小于1的溶剂(液态的饱与烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱与酯)。 ⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色。Br2+2NaOH=NaBr+NaBrO+H2O (或3Br2+6NaOH=5NaBr+NaBrO3+3H2O) Br2+Na2CO3=NaBr+NaBrO+CO2 ⑥与较强的无机还原剂(如H2S、SO2、KI与FeSO4等)发生反应, 使溴水褪色。 Br2+H2S=2HBr+S↓(浅黄色沉淀) Br2+SO2+2H2O=2HBr+H2SO4 3Br2+6FeSO4=2Fe2(SO4)3+2FeBr3 Br2+2KI=2KBr+I2(溶液变为棕色) ⑦其它:石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。 (2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为: ①与烯烃、炔烃、二烯烃等不饱与烃类及不饱与烃的衍生物反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。 ②与部分醇羟基、酚羟基(如苯酚)发生氧化还原反应,使高锰酸钾溶液褪色 ③与醛类等有醛基的有机物(如醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等)发生氧化还原反应,使高锰酸钾溶液褪色 ④与具有还原性的无机还原剂(如H2S、SO2、FeSO4、KI、HCl等)反应,使高锰酸钾溶液褪色。
高中化学方程式书写练习一 1.钠块在空气中变暗: 2.钠在空气中燃烧: 3.钠与熔融四氯化钛(TiCl4)反应: 4.钠与水反应:_______________________________________ 离子方程式:____________________________ 5.钠与硫酸反应: 离子方程式:______________ 6.钠与硫酸铜溶液: 7.氧化钠与水反应:___________________________________ 8.氧化钠与盐酸反应: 离子方程式:______________ 9.过氧化钠与盐酸反应: 离子方程式:______________ 10.过氧化钠与二氧化碳反应: 氧化剂:还原剂: 11.过氧化钠与水反应:_ 离子方程式:_______________________ 12.过氧化钠与二氧化硫反应: 13.电解熔融氯化钠: 14.NaOH溶液中通入少量CO2: 离子方程式:__________________ 15.NaOH溶液中通入过量CO2:
离子方程式:_____________________ 16.碳酸钠与氢氧化钙: 离子方程式:_____________________ 17.碳酸氢钠与盐酸: 离子方程式:_____________________ 18.碳酸氢钠溶液与醋酸溶液混合: 离子方程式:_____________________ 19.除去碳酸钠溶液中的碳酸氢钠: 离子方程式:_____________________ 20.除去碳酸钠固体中的碳酸氢钠: 21.除去碳酸氢钠溶液中混有的碳酸钠:离子方程式:_____________________ 22.用碳酸钠溶液吸收过量SO2: 离子方程式:_________________ 23.用碳酸钠溶液吸收少量SO2: 离子方程式:_____________________ 24.向碳酸钠溶液滴入少量稀盐酸: 离子方程式:_____________________ 25.向碳酸钠溶液滴入过量稀盐酸: 离子方程式:_____________________ 26.碳酸钙与醋酸反应: 离子方程式:_____________________
有机化学方程式书写练习1.甲烷 烷烃通式: (1)氧化反应 甲烷的燃烧: 甲烷能否使酸性高锰酸钾溶液及溴水褪色 (2)取代反应 一氯甲烷: 二氯甲烷: 三氯甲烷: 四氯化碳: 2.乙烯 烯烃通式: (1)氧化反应 乙烯的燃烧: 乙烯能否使酸性高锰酸钾溶液褪色 (2)加成反应 与溴水加成: 与氢气加成: 与氯化氢加成: 与水加成: (3)聚合反应: 3.乙炔 炔烃通式 (1)氧化反应 乙炔的燃烧: 乙炔能否使酸性高锰酸钾溶液褪色 (2)加成反应 与溴水加成:
与氯化氢加成: 与水加成: (3)聚合反应: 4.1,3-丁二烯 二烯烃通式 (1)氧化反应 1,3-丁二烯的燃烧: 1,3-丁二烯能否使酸性高锰酸钾溶液褪色 (2)加成反应 与溴水加成: (3)聚合反应: 5.苯: 苯的同系物通式: (1)氧化反应:苯的燃烧: 苯能否使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 (2)取代反应 ①苯与溴反应: ②硝化反应: 苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。(3)加成反应 苯与氢气加成: 6.卤代烃 (1)溴乙烷与NaOH水溶液共热: (2)溴乙烷与NaOH醇溶液共热: 7.乙醇 (1)与钠反应: (2)氧化反应 乙醇的催化氧化:
(4)取代反应: 分子内脱水成醚: 与丙酸酯化反应: 8.乙醛 (1)还原反应: (2)催化氧化: (3)与银氨溶液反应: (4)与新制氢氧化铜悬浊液: 9.乙酸 (1)乙酸的酸性 乙酸的电离: 乙酸与氢氧化钠: 乙酸与氧化钠: 乙酸与钠: 乙酸与碳酸钠: (2)与乙醇酯化反应: 10.乙酸乙酯 酸性条件下水解反应: 碱性条件下(NaOH)水解反应:练习: 1、CH2=CH—COOH 与钠: 与氢氧化钠: 与碳酸钠: 与乙醇: 与溴水: 与溴化氢: 加聚反应: 2、CH3CH=CH—CH2OH 与钠:
如何正确书写化学方程 式教案 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
《课题2如何正确书写化学方程式》教案 高村中学教师李娜 一、教学目标 1.知识与技能 (1)了解书写化学方程式应遵守的原则。 (2)能正确书写简单的化学方程式。 2.过程与方法 (1)采用讲练结合的方法,调动学生的学习主动性。 (2)采用归纳总结的方法,对配平化学方程式的方法加以总结。 3.情感态度与价值观 (1)培养学生思维的有序性和严密性。 (2)通过对化学方程式书写原则和配平方法的讨论,对学生进行尊重客观事实,遵从客观规律的辩证唯物主义观点的教育。 二、教学重点 正确书写化学方程式 三、教学难点 化学方程式的配平方法。 四、教学方法 复习提问→思考讨论→总结归纳→补充讲解→练习提高。 五、课时安排 1课时 六、教学过程 (一)导入新课: 【复习回顾】(幻灯片2) 1、所有的化学反应必须遵守定律?
为什么质量会守恒呢? 2、化学方程式是用来表示的式子。 (选择→入题)以下三个表达式哪个是木炭和氧气反应的化学方程式(出示幻灯片3)判断下列哪个是化学方程式 (1)碳+氧气二氧化碳 (2)C+O 2CO 2 (3)C+O 2CO 2 (出示幻灯片4) Fe+O2Fe3O4 H2+O2H2O 【引入】:这样的式子能不能称之为化学方程式呢?(不能) 【过渡】仅仅写出反应物、生成物以及反应条件并不能表示一个化学方程式,这仅仅完成了书写化学方程式的第一步。那么如何才能正确地书写化学方程式呢?本节课我们就来学习这方面的知识。 【板书】课题2如何正确书写化学方程式(幻灯片5) (二)授新: 【引入】:国有国法,家有家规,校有校纪校规。当然,书写化学方程式也要遵循一定的原则。化学方程式的书写应该遵守什么样的原则呢?首先我们探讨这个问题。 【归纳总结】请同学们阅读课本P99,找出化学方程式的书写原则。 (幻灯片5)[学生阅读并回答] 【过渡】我们知道,木炭在氧气中充分燃烧的化学方程式为:(幻灯片6) C+O 2=CO 2 [提问]这个方程式中,等号两边各原子的种类与数目相等吗?
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
化学方程式的书写练习 1、写出初中化学常见物质的化学式 单质:氮气氧气氢气氯气氦气氖气氩气 碳磷硫钠镁铝钾钙铁锌铜汞化合物水一氧化碳二氧化碳五氧化二磷二氧化硫三氧化硫 氧化镁氧化铜氧化亚铁三氧化二铁(铁红)四氧化三铁三氧化二铝二氧化锰 (常见氧化物) 氯化钾氯化钠氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝 KCl NaCl MgCl2 CaCl2 CuCl2 ZnCl2 BaCl2 AlCl3 氯化亚铁氯化铁氯化银(氯化物/盐酸盐) FeCl2 FeCl3 AgCl 硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸(常见的酸) H2SO4 HCl HNO3 H3PO4 H2S HBr H2CO3 [NextPage] 硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁 CuSO4 BaSO4 CaSO4 KSO4 MgSO4 FeSO4 Fe2 (SO4)3 硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银 Al2(SO4)3 NaHSO4 KHSO4 NaSO3 NaNO3 KNO3 AgNO3 硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁
MgNO3 Cu(NO3)2 Ca(NO3)2 NaNO3 Na2CO3 CaCO3 MgCO3 碳酸钾(常见的盐) K2CO3 氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝 NaOH Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 KOH Al(OH)3 氢氧化铁氢氧化亚铁(常见的碱) Fe(OH)3 Fe(OH)2 甲烷乙炔甲醇乙醇乙酸 (常见有机物) CH4 C2H2 CH3OH C2H5OH CH3COOH 碱式碳酸铜石膏熟石膏明 矾绿矾 Cu2(OH)2CO3 CaSO4?2H2O2CaSO4?H2O KAl(SO4)2?12H2O FeSO4?7H2O 蓝矾碳酸钠晶体(常见结晶水合物) CuSO4?5H2O Na2CO3?10H2O [NextPage] 尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾(常见化肥)CO(NH2)2 NH4NO3 (NH4)2SO4 NH4HCO3 KH2PO4 沉淀: 红褐色絮状沉淀--------Fe(OH)3
有机反应方程式书写竞赛 一.写出下列反应的方程式(注明反应条件,配平物质系数,有机物用其结构简式表示) (一).加成反应 1. 催化剂 加压 CH +CHCHCH 2CCH 2OCCOOH CHO O O H 2 2. + Br 2(发生1,4加成) 3. +H 2 (二).取代反应 1.甲苯侧链的溴代反应 + Br 2蒸气 2.甲苯苯环的溴代反应 + 液Br 2 3.甲苯的硝化反应 4.苯酚的溴代反应 5. 6. C CH 2OH OH O 7. COOH +CH 2OH CH 3 | +3HNO 3 浓硫酸 —OH + 3Br 2 光照 CH 3FeBr 3 CH 3 —CHO CHO
(三).消去反应 1.醇的消去反应 2.卤代烃的消去反应 (1). 与氢氧化钠的醇溶液共热反应 (2). 与氢氧化钠的醇溶液共热反应 (3).与氢氧化钠的醇溶液共热反应 (四)氧化反应 1醛基的氧化反应 (1)写出下列物质与银氨溶液和新制的氢氧化铜悬浊液共热的方程式 ①.CH CHO CHO ②. ③. 2.醇的催化氧化 (五)加聚反应 1.n (六)缩聚反应 1. 浓H2SO4 n HOCH2CH2OH+n HOOC-COOH 2.n 3. —Cl 催化剂 H3C CH浓H2SO
二.写出下列物质与相关物质反应的化学方程式 1. .足量氢氧化钠溶液共热反应 2. 3. 足量氢氧化钠溶液共热反应 足量氢氧化钠溶液共热反应 4. . 足量氢氧化钠溶液共热反应 5. 足量氢氧化钠溶液共热反应 6. 丁子香酚( )与溴水反应的方程式: 7. 8. 足量氢氧化钠的乙醇溶液共热反应 9. 足量氢氧化钠的乙醇溶液共热反应 -CH ―CH ―COOH Br Br —O —C —H HOOC — O +NaHCO 3 → ——OH HO — C H 2 CH 2CH OCH 3 OH 催化剂 HO C O CH 2CH OH C O O CH 22Br |OH
光照 光照 光照 光照 高温 催化剂 催化剂 △ 催化剂 △ 催化剂 浓硫酸 170℃ 高中有机化学方程式汇总 班级﹍﹍﹍﹍ 姓名﹍﹍﹍﹍ 一、甲烷(CH 4) 取代反应: 1. CH 4 + Cl 2 CH 3Cl (气)+ HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 分解反应: CH 4 C +2H 2 氧化反应: CH 4 + O 2 CO 2+ H 2Ol 二、乙烯(C 2H 4) 加成反应: 1. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 2. CH 2 = CH 2 + H 2O CH 3CH 2OH 3. CH 2 = CH 2 + HCl CH 3—CH 2Cl 4. CH 2 = CH 2 + H 2 CH 3—CH 3 聚合反应(加聚反应): nCH 2 = CH 2 [ CH 2—CH 2 ] n 聚乙烯 氧化反应: 1. C 2H 4 +3 O 2 2CO 2+ 2H 2Ol 2. 乙烯使酸性高锰酸钾溶液褪色。 乙烯的实验室制法: CH 3CH 2OH CH 2 = CH 2↑+ H 2O
催化剂 浓硫酸 △ 催化剂 △ 催化剂 △ 三、乙炔(C2H2) 加成反应: 1.CH≡CH + Br2CHBr = CHBr CHBr = CHBr+ Br2 CHBr2-CHBr2 2. CH≡CH + H2CH2 = CH2 CH2 = CH2+ H2 CH3 CH3 3. CH≡CH + HCl H2C = CHCl 氯乙烯 nCH2 = CH [ CH2-CH ] n Cl Cl 聚氯乙烯 氧化反应: 1. 2C2H2 +5O24CO2 + 2H2O 2. 乙炔使酸性高锰酸钾溶液褪色。 乙炔的实验室制法: CaC2 + 2H2O CH≡CH↑+ Ca(OH)2四、苯(C6H6) 取代反应: 1. + Br2Br + HBr 溴苯 2. + HO-NO2NO2 +H2O 硝基苯 加成反应: + 3H2环己烷 氧化反应: 2C6H6 + 15O212CO2 + 6H2O
黄山中学优生培养项目部 高二化学定时训练作业纸 班级______ 姓名________ 得分_______ 有机化学方程式练习1 (一).加成反应 1.CH +CHCHCH 2CCH 2OCCOOH O 2. + Br 2(发生 1,4 3. +H 2 4.甲醛和丙醛羟醛缩合 (二).取代反应 1.甲苯侧链的溴代反应 + Br 2 2.甲苯苯环的溴代反应 + Br 2 3.甲苯的硝化反应 4.苯酚的溴代反应 CH 3 | +3HNO 3 浓硫酸 CH 3CH 3CHO
5. 6. C CH 2OH OH O 7. COOH + CH 2OH (三).消去反应 1.醇的消去反应 乙醇制备乙烯 2.卤代烃的消去反应 (1). 与氢氧化钠的醇溶液共热反应 (2). 与氢氧化钠的醇溶液共热反应 (3). 与氢氧化钠的醇溶液共热反应 (四)氧化反应 1..醛基的氧化反应 (1)写出下列物质与银氨溶液和新制的氢氧化铜悬浊液共热的方程式 ①. 乙二醛与银氨溶液 ②. 催化氧化 —OH + 3Br 2 Cl
③. CH CHO CHO 和新制的氢氧化铜悬浊液共热 2.醇的催化氧化 乙二醇与氧化铜反应 (五)加聚反应 1. n 2. (六)缩聚反应 1. n HOCH 2CH 2OH +n 2.n 3. 4.苯酚和甲醛 跟踪练习 1. 2-甲基-2-丁烯被酸性KMnO 4溶液氧化的产物: 2. 2-溴丙烷的水解反应 消去反应 H 3C CH OH
3. 环己醇发生下列反应: (1)催化氧化反应: (2)消去反应: (3)与乙酸的酯化反应: 4. 对甲基苯酚发生下列反应 (1)与碳酸钠反应: (2)与浓溴水反应: (3)向对甲基苯酚钠溶液中通入CO2气体:5. 乙烯水化法制乙醇: 葡萄糖发酵法制乙醇: 乙炔水化法制乙醛: 乙烯氧化法制乙醛: 乙醛氧化法制乙酸: 6.CH3-CH(OH)-COOH发生下列反应 ①与金属钠反应: ②与NaOH反应 ③催化氧化反应: ④消去反应: ⑤单分子酯化成环: ⑥两分子酯化成链 ⑦两分子酯化成环 ⑧缩聚反应 3.苯甲酸甲酯在NaOH溶液中的水解 4.苯甲醛的银镜反应
课题2 如何正确书写化学方程式 课题2 如何正确书写化学方程式 教学目标: 1,通过具体化学反应分析、理解化学方程式的涵义 2了解书写化学方程式应遵守的原则。 3,能正确书写简单的化学方程式。 2,过程与方法 (1)采用讲练结合的方法,调动学生的学习主动性。 ) (2)采用归纳总结的方法,对配平化学方程式的方法加以总结 3,情感与价值观 (1)培养学生思维的有序性和严密性。 (2)通过对化学方程式书写原则和配平方法的讨论,对学生进行尊重客观事 实,遵从客观规律的辩证唯物主义观点的教育。 教学重点: (1)化学方程式的书写原则 (2)化学方程式的配平方法 教学难点: { 化学方程式的配平方法。 教学方法: 讲练结合 课 时:2课时 第一课 教学过程: 1、复习提问: 什么是化学方程式?一个化学方程式能提供给我们哪些信息? ; 例如 S +O 2 ====SO 2 由此化学方程式能提供给我们哪些信息? 2、情景导入: 化学反应的符号表达式是否就是化学方程式? P +O 2 ====P 2O 5 这个式子能不能称为化学方程式? 3、讲授新课: 一、化学方程式的书写原则(板书) ~ 点燃点燃 点燃
1. 以客观(实验)事实为依据 2. 遵循质量守恒定律
{ 二、化学方程式的书写步骤 写、配、注”三步进行 第二课时 【复习提问】 (1)书写化学方程式的原则? (2)配平化学方程式的步骤和方法? 【课题导入】 上一节我们讲了最小公倍数法配平化学方程式,除了此方法外还有很多种配平方法,今天我们就来继续学习其它配平方法。 ^ 【新课教学】 三、配平化学方程式的方法 1、最小公倍数法 2、奇数配偶法 (1).找出化学方程式两边出现次数较多的元素 (2).在该元素的原子的个数为奇数的化学式前配上一偶数 (3).由已推出的化学计量数推出其它化学式的计量数 例: FeS 2 + O 2 ---- Fe 2 O 3 + SO 2 | 该方程式出现次数较多的元素是O元素,首先在O元素的原子个数为奇数 的化学式Fe 2O 3 的前面配上偶数2,第二步在化学式FeS 2 的前面配上化学计 量数4,第三步在化学式SO 2的前面配上化学计量数8,最后在O 2 前配上化 学计量数11。 4FeS 2 + 11O 2 ====2Fe 2 O 3 + 8SO 2 3、观察法 (1)、找出化学方程式两边最复杂的化学式,将它的化学式的化学计量数暂定为“1” (2)由此化学式为准,来确定其它化学式的化学计量数 例: FeS 2 + O 2 ---- Fe 2 O 3 + SO 2 最复杂的化学式为“Fe 2O 3 ”,将它的化学计量数暂定为“1”,由此推出 化学式FeS 2的计量数为2,化学式SO 2 的计量数为4,O 2 的化学计量数为11/2, 最后在方程式两边同乘一个2。 4FeS 2 + 11O 2 ==== 2Fe2O 3 + 8SO 2 4、分析法 对于一些特殊的化学反应,可以通过对反应物和生成物的具体分析来进行配平。 如: Fe 2O 3 + CO ==== Fe + CO 2 由于一个CO分子只需要夺取一个氧原子就能变成一个CO 2分子,而Fe 2 O 3 分子里 有三个氧原子,所以需要3个CO分子去夺3个氧原子,因此在CO的化学式前配3, 然后在CO 2的化学式前配3,最后在Fe前配2,也就将化学方程式配平了。 高温