
全真模拟试题(二)
竞赛时间
3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离
场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填写。草稿纸在最后一页。不得持有任何其他纸张。
姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
允许使用非编程计算器以及直尺等文具。
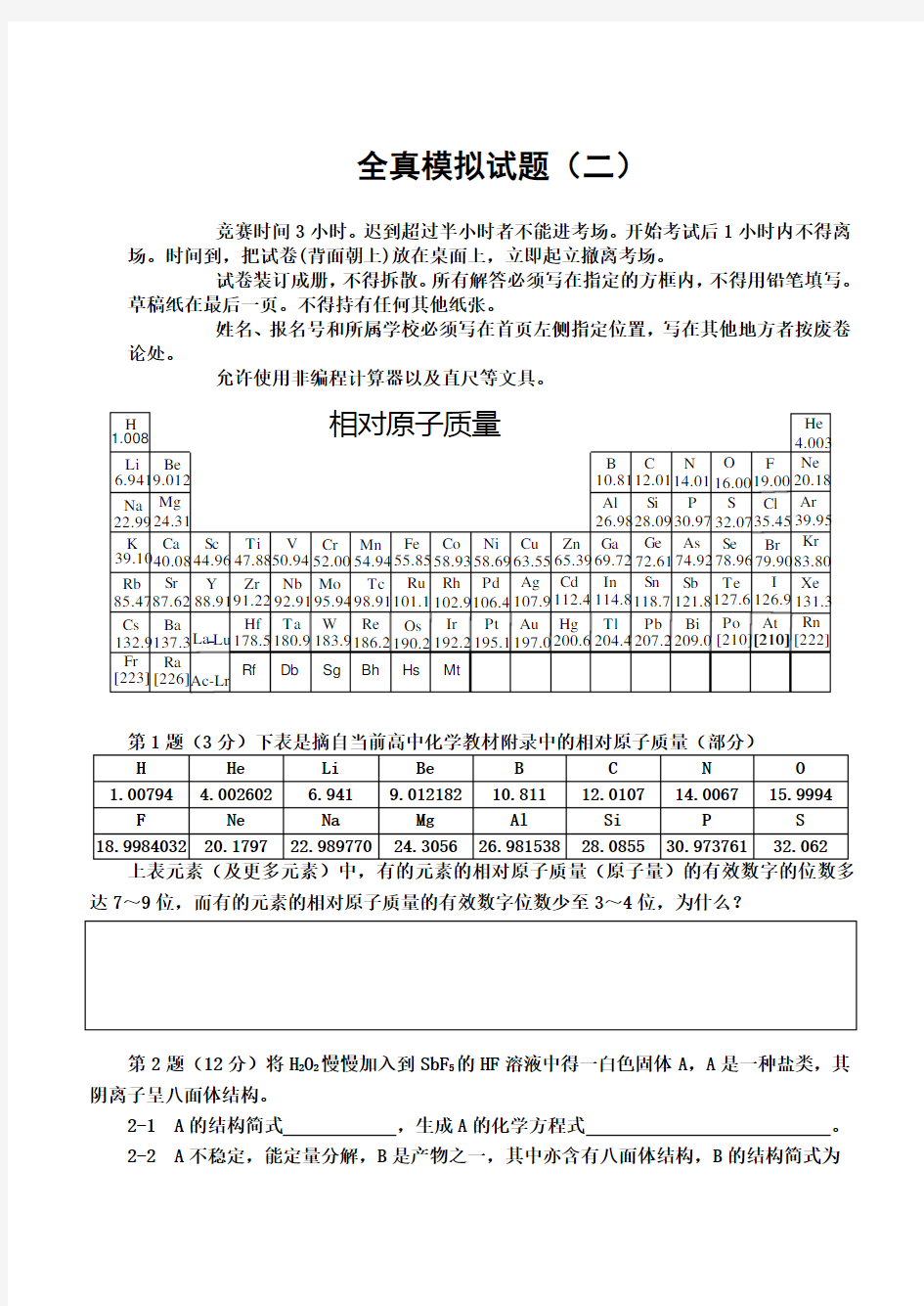
1.008
Zr Nb Mo Tc Ru Rh Pd Ag Cd
In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H
Li Be
B C N O F Na Mg
Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba
Ra
Y La Lu -6.9419.01222.9924.31
39.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]
[210]126.979.9035.454.003
20.18
39.9583.80
131.3
[222]He Ne Ar Kr
Xe Rn 相对原子质量
Rf
Db Sg Bh Hs Mt
H He Li Be B C N O
1.00794 4.002602 6.941 9.012182 10.811 1
2.0107 14.0067 15.9994
F Ne Na Mg Al Si P S 18.9984032 20.1797 22.989770 24.3056 26.981538 28.0855 30.973761 32.062
达7~9位,而有的元素的相对原子质量的有效数字位数少至3~4位,为什么? 第2题(12分)将H 2O 2慢慢加入到SbF 5的HF 溶液中得一白色固体A ,A 是一种盐类,其阴离子呈八面体结构。
2-1 A 的结构简式 ,生成A 的化学方程式 。 2-2 A 不稳定,能定量分解,B 是产物之一,其中亦含有八面体结构,B 的结构简式为
。
2-3 若将H 2S 气体通入SbF 5的HF 溶液中,则得晶体C ,C 中仍含有八面体结构,写出C 的结构简式 。生成C 的化学反应方程式是 。
2-4 将H 2O 2滴入液氨中得白色固体D ,D 是一种盐,含有正四面体结构,写出D 的结构式 和生成反应方程式 。
比较H 2O 2和H 2S 的性质异同 。
第3题(8分)有机物X 具有旋光活性,其分子由C 、H 、O 、N 4种元素组成,其中C 、H 、O 的原子个数比是3︰5︰2;工业上可以用A 和B 以物质的量1︰4通过取代反应制备X ;X 能与4倍其物质的量的NaOH 反应,并能与Ca 2+
等与大部分金属离子1︰1络合,所得螯合物结构中存在5个五原子环。
3-1 写出X 的化学式 和B 的结构简式 。 3-2
写出满足条件的全部X 的结构简式,分别命名和计算光学异构体的个数。
第4题(12分)据《中国制药》报道,化合物F 是用于制备抗“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:
F
4-1 请写出有机物字母代码的结构简式。
4-2 第③、④步反应的顺序能否填倒,说明理由。 4-3 写出D +E →F 的化学方程式,并用系统命名法命名F 。 4-4 第④步反应的反应类型是 。
4-5 E在一定条件下可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式。
第5题(6分)现在,我们来研究AgNO3溶液和(NH4)2S溶液之间的反应。
①将AgNO3溶液和(NH4)2S溶液混合,会发生反应。
②若在31℃时,将5mL 2mol/L AgNO3溶液和5mL接近饱和的(NH4)2S溶液分别放在2个青霉素瓶中,用一段60cm长充满饱和KNO3溶液的一次性医用输液管作盐桥,如图所示:
经观察,电解一段时间后,二个青霉素瓶中都有新物质生成。
5-1 插入AgNO3(aq)的碳棒上有,是因为有生成;插入(NH4)2S溶液的碳棒附近的液体显色,是因为有生成;上述电解的离子反应方程式为。
5-2 在盛AgNO3溶液和(NH4)2S溶液液面上分别用1cm厚的石蜡油封闭液面的原因是
第6题(20分)A物质是实验室一种无色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D只含两种元素,其中一种是Y。在交流放电的情况下,分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。E可在液氮条件下与HBr于77K生成含双键结构的物质G,冷却至室温可得G的环状三聚体H。
6-1 写出A、B、C、D、E、F、G、H的结构简式。
6-2 用X射线衍射法测得F的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g·cm-3。计算每个晶胞中F分子的数目。
6-3 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。除了碳原子团簇之外,其它元素的原子团簇是否也具有类似碳原子团簇的奇异的特性,这是个十分有趣的研究课题。F物质有很多同分异构体,在实验手段受到各种条件的限制时,理论研究是一种重要的补充。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种X具有2次对称轴,以及两个包含对称轴的对称面,一配位和三配位原子数目相等;另外一种Y是一种椅式结构原子团簇增加2个原子形成,也具有二次对称轴,对称面和对称轴垂直。请画出这两种结构的原子团簇。
6-4 五氟化砷AsF5(2.93g)和上述物质F(0.37g)用四氮化四硫S4N4(0.53g)在液态SO2溶剂中发生完全的反应,溶剂和挥发性产物被泵抽出后得黄色固体残留物L(3.08g),分析J知其含有:As 28.04%,F 42.70%,N 5.25%,经分析L是离子化合物,阴离子为正八面体结构,阳离子为两种元素组成,结构是直线形。固体L(0.48g)溶于液态二氧化硫,和叠氮化铯Cs+N3-(0.31g)完全反应,收集应释放出得氮气于66.5kPa、298K为67.1cm3。反应混合物过滤得难溶蓝黑色纤维状固体J(0.16g)。分析J知其含有2种元素,其中含N 30.3%。红外光谱、X射线粉末衍射结果表明抽出SO2后残留物是六氟砷(V)酸铯。
(1)L的实验式是什么?
(2)提出L的结构式;
(3)写出配平的生成L 的方程式;
(4)1mol L 发生转化时生成氮气的物质的量;
(5)J 的化学式;
(6)写出n mol L 生成J 的普遍离子方程式。
第7题(12分)已知298.2K 时,m C H ?(C 2H 5OH ,液)= -1366.8 kJ ·mol -1
,水和乙
醇的摩尔蒸发焓m vap H ?/( kJ ·mol -1
) 分别为44.01和42.6,C 2H 4(g), H 2O(g)和 CO 2(g)的
m f H ?/( kJ ·mol -1) 分别为52.26、-241.8及-393.5,求
7-1 同温度下,分子式为C n H 2n 的物质的m f H ?与m C H ?之间的关系式; 7-2 求298.2K 时C 2H 4(g) m C H ?
7-3 298.2K 时C 2H 5OH (气)的 m f H ?和m C H ? 7-4 298.2K 时C 2H 4(g) + H 2O(g) → C 2H 5OH(g)的m r H ?
第8题(7分)苯巴比妥是1903年就开始使用的安眠药,其合成路线表示如下。请在相应的方格中写出A —F 和苯巴比妥的结构:
Phenobarbital (C 12H 12N 2O 3)CH 3CH 2ONa
CO(NH 2)2
15H 20O 4)
CH 3CH 2Br KOC(CH 3)3 E (C 13H 16O 4)
CH CH ONa
CO(OCH 2CH 3)2
10H 12O 2)
32C (C 8H 7ClO)
SOCl 2
B (
C 8H 8O 2)
ii.CO 2, iii.H +
2A (C 7H 7
Br)CCl NBS CH 3
苯 巴 比 妥
F
E D
C B A
苯 巴 比 妥
第9题(14分)锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。
下图为锂电池工
作原理图,阴极材料由LiMO 2(M=Co, Ni, V, Mn )构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:
(-) C n / LiClO 4 / LiMO 2 (+)
9-1 写出锂电池充放电时的可逆电极反应。 9-2 根据上图所示的LiMO 2的尖晶石结构,写出氧的堆积方式,并指出Li 和M 占据何种空隙,画出以氧为顶点的一个晶胞。
9-3 锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
9-4 早期的阳极材料用的是锂金属, 试指出锂金属作阳极材料的不足, 并说明还可以用什么物质替代石墨作阳极材料?
第10题(6分)称取含有KBrO3、KBr及惰性物质试样1.000g,溶解定容于100mL容量瓶中。移取25.00mL试液,在H2SO4介质中以Na2SO3还原BrO3-至Br-,调至中性,用0.1010mol/LAgNO3滴定至终点,用去10.51mL,另取25.00mL试液,用硫酸酸化后,加热赶去Br2,再调至中性,滴定剩余的Br-,用去上述的AgNO3标准溶液3.25mL。计算试样中KBrO3、KBr 的质量分数。(已知KBrO3、KBr的摩尔质量分别为167.0g/mol,119.0g/mol)
参考答案:
1 有一些元素在自然界中分布较易准确测得(1分),有的只有一种稳定核素,所以相对原子质量有效数字多(1分);有的元素在自然界中的平均丰度难以准确测得,有效数字较少(1分)。
2-1 [H 3O 2]+[SbF 6]- (2分) ; H 2O 2+HF+SbF 5=[H 3O 2]+[SbF 6]- (1分) 2-2 [H 3O]+
[SbF 6]-
(2分)
2-3 [SH 3]+[SbF 6]- (2分) ; H 2S+HF+SbF 5=[SH 3]+[SbF 6]- (1分)
2-4 [NH 4]+[HOO]- (2分) ; H 2O 2+NH 3=[NH 4]+[HOO]-
(1分) H 2O 2既是酸又是碱,H 2S 是一种碱 (1分) 3-1 C 12H 20N 2O 8(2分) ClCH 2COOH (1分)
X 1: X 2:(2分)
3-2 命名:2,3-丁二胺四乙酸 1,2-丁二胺四乙酸(1分)
异构体 3种 2种(2分) 4-1 B :
CH 3NO 2
;C :
COOH
NO 2
;D :CH 2Cl ;F :
COOH
NH CH 2 (各1分)
4-2 不能,因为先生成CH 3NH 2
,再与KMnO 4氧化时—NH 2也会被氧化。
(2分) 4-3
CH 2Cl +
COOH
NH 2cat
COOH
NH CH 2
+HCl (2分)
F :N -苄基-邻-氨基苯甲酸(1分) 4-4 还原反应(1分)
4-5 n
COOH
NH 2
cat
C
NH O n
+nH 2O (2分)
5-1 银白色固体;银;黄;硫;2Ag ++S 2-=2Ag +S (各1分) 5-2 避免空气中氧气的干扰(1分)
6-1 A :CS 2 B :CO 2 C :SO 2 D :H 2S E :CS F :S 8
G : H :(各1分)
6-2 Z =16(3分)
6-3 X : Y :(写出1个即可)(各1.5分)
6-4 (1)AsF 6NS 2(1分) (2)[NS 2]+
[AsF 6]-
(1分)
(3)12AsF 5+S 8+2S 4N 4=8[NS 2]+
[AsF 6]-
+4AsF 3(1分) (4)1mol (1分) (5)SN (1分)
(6)n [NS 2]+
[AsF 6]-
+n Cs +
N 3-
=2(SN)n +n N 2+n Cs +
[AsF 6]-
(1分) 7-1 C n H 2n 生成反应与燃烧反应化学计量方程式的关系如下:
n C (石墨)+n H 2(g)+
2
3n O 2(g) ?→?)
3( n CO 2(g)+n H 2O(l)
(1) (2) C n H 2n +
2
3
n O 2(g) 反应(1)为C n H 2n 的生成反应,故 1H ?=m f H ?(C n H 2n )
反应(2)为C n H 2n 的燃烧反应,故 2H ?=m C H ?(C n H 2n ) 反应(3)为n CO 2(g) 和n H 2O(l)生成反应,故
3H ?= n m f H ? (CO 2,g) + n m f H ? (H 2O,l)