
第十五章含硫含磷有机化合物
[目的要求]:
1.掌握硫、磷原子的成键特征,了解含硫、含磷有机化合物的类型和命名。
2.掌握硫醇、硫酚、硫醚、亚砜和砜的制法、性质及有机硫试剂在有机合成上的应用。
3.掌握磺酸制法和性质,了解其衍生物的制法和性质。
4.掌握膦、季鏻盐的制法和魏悌希反应。
5.了解一些有机磷农药。
[教学内容]:
第一节硫、磷原子的成键特征
第二节含硫有机化合物
第三节有机硫试剂在有机合成上的应用
第四节磺酸及其衍生物
第五节含磷有机化合物
§15-1 S、P原子的成键特征
一、电子构型
1.核外电子排布
N
22S21S2 2S22 3P3;
O:1S22S2 2P4;S:1S2 2S2 2P63S2 3P4;
N7P15O8S16
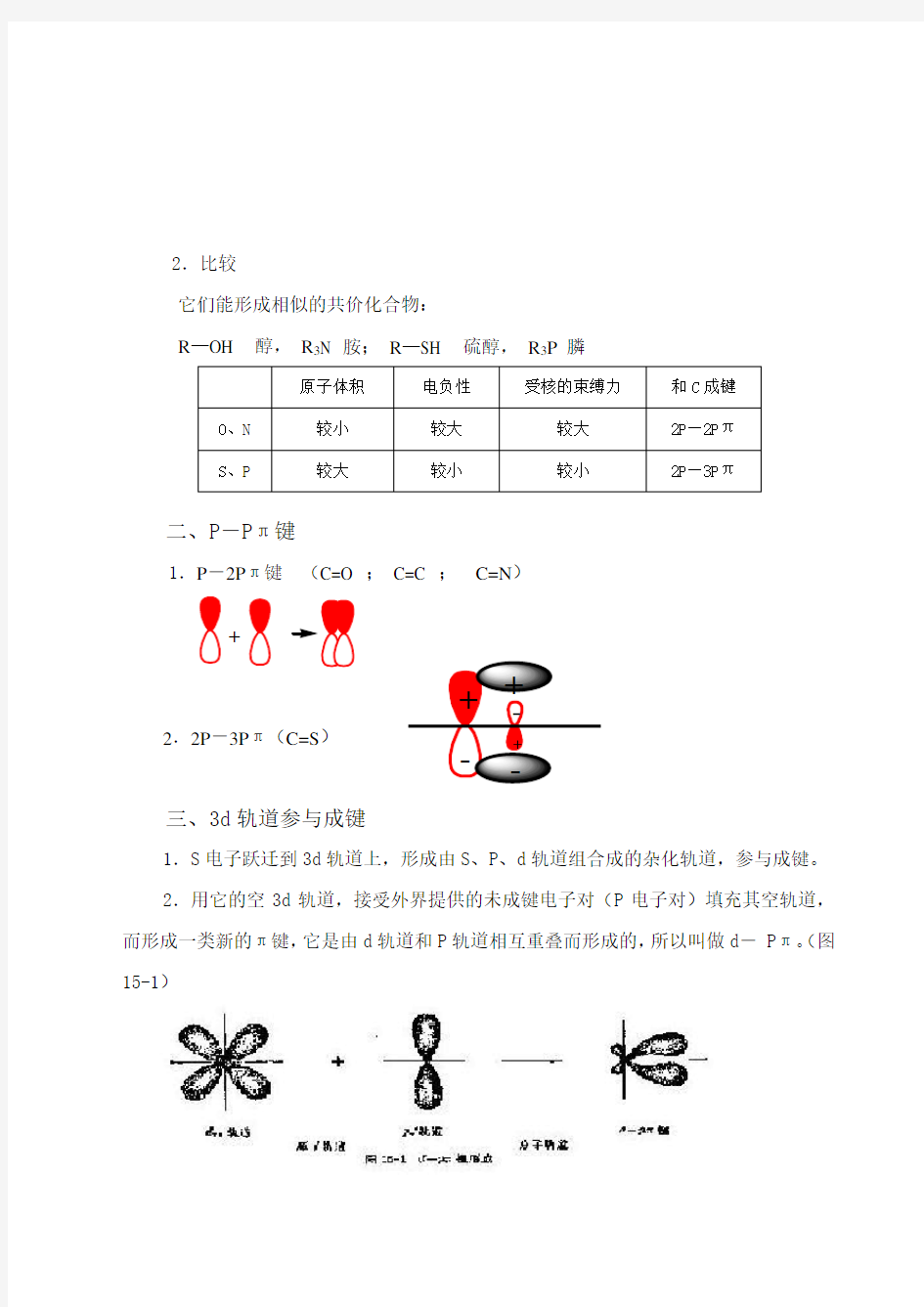
2.比较
它们能形成相似的共价化合物:
R —OH 醇, R 3N 胺; R —SH 硫醇, R 3P 膦
二、P -
P π键
1.P -2P π键 (C=O ; C=C ; C=N )
2.2P -3P π(C=S )
三、3d 轨道参与成键
1.S 电子跃迁到3d 轨道上,形成由S 、P 、d 轨道组合成的杂化轨道,参与成键。 2.用它的空3d 轨道,接受外界提供的未成键电子对(P 电子对)填充其空轨道,而形成一类新的π键,它是由d 轨道和P 轨道相互重叠而形成的,所以叫做d - P π。(图15-1)
原子体积 电负性 受核的束缚力
和C 成键 O 、N 较小 较大 较大 2P —2P π S 、P
较大
较小
较小
2P —3P π
+
++--+
-
四、与胺类似的含S 、P 有机物
§15-2 含硫有机物
一、低价含硫化合物——硫醇、硫酚和硫醚 1.结构和命名
S 原子可形成与氧相似的低价含化合物。—SH 官能团,叫做硫氢基或巯(音求)基。
2.制备 ⑴ 硫醇
硫脲 异硫脲盐
R-S H SH R-S -R
硫醚
硫酚
硫醇
+RX NaSH NaX
乙醇△
+RX S C NH 2
NH 2+△乙醇S C
NH 2
R H 2O
OH
-
H 2S
RCH 2CH 2SH
+RCH=CH 2ThO 2
R-OH
+H 2S
R-S H
+H 2O
400
℃
1
23
叔胺
1
23
R 4季铵盐氧化叔胺
1
2
R 3
1
23叔膦
1
23
R 4
季鏻盐
氧化叔膦
1
2
R 3
1
2硫醚
1
23铳盐
亚砜
1
2
⑵ 硫酚
⑶ 硫醚
3
.物理性质
⑴ 硫醇 分子量较低的硫醇有毒,并有难闻的嗅味。
水溶性比相应的醇低得多。
沸点比相应的醇低得多,与分子量相应的硫醚相近。
⑵ 硫酚 无色液体,气味难闻。
沸点比相应的酚低。
⑶ 硫醚 无色液体,气味刺鼻,沸点比相应的醚高。
SO 2C l
+6Zn 5H 2SO ZnCl 25ZnSO 44H 2O
++++N 2C l +Na
2S 2
S 2RX +Na 2S
+NaX
R-S H
-2CH 3
H 2C H 3
Br S -
+
DMF 120~130℃5~10小时
S
4.化学性质 ⑴ 酸性
硫醇、硫酚的酸性增强,可解释如下:
a. 可从S 、O 原子的价电子处于不同的能级来解释。3p-1s, 2p-1s 。
b. 也可从S 原子体积大,电荷密度小,拉质子能力差来解释。
c. 还可从键能说明:O-H ,462.8 KJ/mol ;S-H ,347.3 KJ/mo 。 ⑵氧化反应
a . 硫醇的缓和氧化
b . 硫醇的强氧化
C 2H 5SH NaOH
C 2H 5SNa H 2O
++2R-SH
R-S-S-R
[O]: I 2 ;H 2O 2 ;弱氧化剂
5Et-SH 6MnO 4-18H +
3H 6Mn +9H 2O
++++SH
SO 3H
浓HNO 3
RCH 2OH RCH 2SH
2-S-S-CH 22SO 3H
[O][O]
[O]
[O]
c.硫醚的氧化
⑶ 生成重金属盐
重金属盐进入体内,与某些酶的巯基结合使酶丧失生理活性,引起人畜中毒。医药上常把硫醇作为重金属毒剂。离子被螯合后由体内排出,不再与酶的巯基作用,同时二巯基丙醇还夺取已与酶结合汞离子,使酶恢复活性,起到解毒的作用。二巯基丙醇(巴尔BAL )是常用的解毒剂。
⑷ 亲核性
a. RS -有较强的亲核性。可用硫原子的电子结构来解释。由于硫的价电子离核较远,受核的束缚力小,其极化度较大;加上硫原子周围的空间大,空间阻碍小以及溶剂化程度减小等因素,导致RS -的给电子性增强,亲核性较强。
RS -有强的亲核性和相对弱的碱性。 b. 亲核取代(S N 2)
c . 亲核加成
O 2RSH HgO
2Hg ↓白H 2O
+
+2CH 2CHCH 2SH SH OH
Hg 2+
+CH 2CHCH 2OH
S
HOC H 22
S S
螯合物
R 2S RX
3SX
++
CH 3
S CH 3
H 2O 2
3CH 3
S 3
O H 2O 2
3CH 3S CH 3
O
O
N R S R +X
-CH 3CH 2SH +(CH 3)2CHCH 2Br
(CH 3)2CHCH 2SCH 2CH 3
95%
H 2O -
RC
O
+R`SH
RC
O SR`
硫代羧酸酯
二、亚砜和砜1.结构
⑴ 亚砜、砜中S=O 习惯表示,但要知道在硫氧键中包含着d-p π键。
硫醚被氧化成亚砜的过程,实质上就是形成硫-氧键的过程。目前一般认为由硫原子的一对未成键电子与氧原子相结合而形成σ配键,同时由氧原子提供的一对未成键电子进入硫原子的空的3d 轨道,而形成d-p π键,见上图。如继续氧化形成砜,其成键方式与亚砜相同。
二甲亚砜为锥形分子,而丙酮是平面构型。
⑵ d-p π键较弱,电子对大部分属于O 原子,这一点可以从亚砜分子具有较大的偶极矩得到证实。
⑶ 硫氧键的表示:>S +—O ->S =O ⑷
亚砜的对映异构体
CH 3
S CH 3
CH 3
S CH 3O
CH 3
S CH 3O
甲硫醚
二甲亚砜
二甲砜
C
O CH 3+C 2H 5S H 丙酮缩二乙硫醇
C H 3
2C
CH 33SC
2H 5SC 2H 5
H +ZnCl C O
`R
HS(CH 2)3H
1,3-二噻烷
R
`R
R S S
H 2O
HgCl 2
C O
`R
R 3d S O 2p
π键σ键
sp 3S O 2p
3
CH 3
3
3
CH 3
3
室温
2.性质与用途
⑴ 优良的非质子极性溶剂
二甲亚砜(DMSO )的介电常数(ε= 48)
二甲亚砜可与水任意混溶。它不仅可溶解大多数有机化合物,而且可溶解许多无机
盐,使无机试剂和有机物在均相中反应,因此在实验室中等到了广泛应用。二甲亚砜对亲核取代反应特别有效。由于它的介电常数大,而且氧原子上电子出现的几率密度高,所以能使阳离子(E +)强烈地溶剂化,但是它不能使负离子很好地溶剂化,因为它不能提供酸性氢与负离子形成氢键。
⑵ 温和的氧化剂
亚砜可被氧化为砜,又易被各种还原剂还原为硫醚。
二环已基碳酰二亚胺
§15-3 有机硫试剂在有机合成上的应用
E + Nu -
nMe 2+e 2 +S O
-
e
2e
2
++E + = Na + Nu - = OH - ; NH 2- ; CN -
等
S O ++R-S-S-R +H 2
O S
O HI ++I 2
+H 2O S
O
S
H 2O
LiAlH 4
RCH 2OH +CH 3S CH 3O
C 6H 11N=C=NC 6H 11+H 3PO
4
RCHO +CH 3S CH 3C 6H 116H 11
+O
有机硫化合物在有机合成上的应用日益受到人们的重视,本节主要讨论一瑞尼Ni 脱硫反应和含硫的碳负离子在有机合成上的应用。
一、瑞尼Ni 脱硫反应
1.反应:常用的还原剂是瑞尼Ni (被H 2饱和)。C-S 键在瑞尼Ni 作用下被氢解而生成相应的烃。又称瑞尼Ni 脱硫反应。
瑞尼Ni :是用氢氧化钠处理铝镍合金,溶去铝后,得到灰黑色的小颗粒多孔性的镍粉。
2.合成中的应用
⑴ 利用硫醚进行催化脱硫,可合成烃类。
⑵ 缩硫醛和缩硫酮的瑞尼Ni 脱硫提供了将羰基转变成亚甲基的另一种选择的方法。
R-S-R`RH R`H
++
CH 3
CH 2-S CH 2
CH 3CH 3
CH
3
C O
C S S
CH
2
O
COOE t
CH 3SH 3
COOE t
SCH 3
CH 3S
COOE t
75%
瑞尼Ni ,
61%
C O
2
CH 2
中性介质
碱性介质
二、含硫碳负离子在有机合成上的应用
在硫醚、亚砜、砜以及锍盐等含S 化合物中,由于硫原子具有空的3d 轨道,使相邻的碳负离子上的电荷反馈到d 轨道(这种反馈键与亚砜分子中的成键方式相似,因而起到使相邻碳负离子稳定化的作用。所以这类含硫化合物分子中的α-H 呈现出某种酸性(二甲亚砜pK a =33、二甲砜pK a =29),它们在强碱的作用下均能形成相应的碳负离子。
这类含S 碳负离子既是强碱又是强的亲核试剂。 1.烷基化反应和亲核加成反应
硫醚碳负离子可与伯RX 进行烷基化反应,与醛酮进行亲核加成反应。
S CH 3
O CH 3SCH 3S CH 3
O CH 3O S CH 3
CH 3
CH 3+
碱
SCH 2
-S CH 2
O
CH 3S CH 2
O
CH 3O --CH
2
CH 3
CH 3+
-n-C 4H 9Li C 6H 5SCH 3C 6H 5SCH 2-Li +
,CH 3(CH 2)9I C 6H 5S(CH 2)10CH 3
93%
C 5H 6CHO/HTF
H 3O
+
C 6H 5S-CH 2-CH-C 6H 5
OH
C H 2
O
C H 3-RX
+S N 2
C H 2-R
O H 3+X
-
S CH 2
O CH 3-+S C H 2-C-R
O
C H 3
C R`
O
R OH
R `
S CH 2
O
CH 3-OR`
O
R CH 2-S-CH O
R O
Al-Hg H 3O +
CH 3O R β-酮亚砜
甲基酮
2.反极性策略的应用
利用醛的直接烷基化反应合成相应的酮,在一般条件下是很难实现的,因为羰基碳呈正性,难以与R +
生反应。假如能设法将羰基碳的亲电性转变为亲核性,就有可能实现上述转化。醛与硫醇反应生成缩硫醛,提供了实现这种转化的基础。
缩硫醛(酮)分子中两个硫原子间的亚甲基在相邻的两个硫原子的影响下,酸性比硫醚强。例如,1,3-二噻烷的pK a =31.5。因此在丁基锂的作用下,它易转变为相应的负离子。
反极性:醛酮的羰基碳原来带部分正电荷,但是当醛酮转变为1,3-二噻烷负离子后,原来的羰基碳上由呈电正性转变为呈电负性,由亲电的碳(>C=O )转变为亲核的碳(1,3-二噻烷负离子),这种极性变换的方法称为“反极性”(umpolung )。
1,3-二噻烷负离子就可在原来的羰基碳上进行烷基化反应,配合缩醛水解,即可以用来合成结构复杂的醛、酮、羟基酮以及结构特殊的烃类等。
而今,“反极性”策略已成为有机合成的手段。例如:
S S +S
S H CH
3
Li
+
n-C 4H 9Li
H
O R 亲核的碳
SH
SH
+
R`X
S S R R`
H 2O
HgCl
2
C R
R`O
净的结果:RCHO RCOR`
S
S
H H n-C 4H 9Li ①CH 3(CH 2)4Br
S
S H n-C 4H 9Li ①CH 3(CH 2)4
Br
S
S O
酮烷烃
例一:
例二:
3.硫叶立德反应 (叶立德:正负电荷在相邻原子的内盐。)
锍盐分子中硫原子上带正电荷,有利于其共轭碱的稳定化,所以锍盐的酸性比硫醚强得多,甚至比缩硫醛还要强,其pKa 约为25左右,在丁基锂的作用下,锍盐易转变为相应的负离子。
又称为硫叶立德,即为内锍盐.它在0℃以上不稳定,但在低温下可与醛、酮加成,生成环氧化物,这是硫叶立德的特征反应(与魏悌希试剂磷叶立德比较)。
这一反应首先是由硫叶立德碳负离子进攻羰基碳,形成两性离子中间体,进而RO -作为亲核试剂,进行分子内SN 2反应,形成环氧乙烷环,与此同时,C-S 键断裂,并以(CH
3)2S 的形式离去。
S S H H n-C 4H 9Li ①ClCH )Br
S
S H
(CH 2)3Cl n-C 4H 9Li
S
S HgCl 2,CdCO 3
乙二醇,
H O ~50%
CH S
S
CH H
n-C 4H 9Li H O
C 6H 5CHO
②S
S 3-
①S
S CH 3HO
91%
H 2O HgCl 2CH H 3C
HO
90%
C
O α-羟基酮,CH 3CN
(CH 3)3S I
+
-+n-C 4H 9
Li
THF
(CH 3)2-S -CH 2
+
-
+n-C 4H 10+LiI
2+O CH 2-S(CH 3)2CH 3SCH 3(CH 3)2-S -CH 2+
-
§15-4 磺酸及其衍生物
一、磺酸
可看成硫酸分子中一个-OH 被烃基取代后的衍生物。
通式:RSO 3H
1.物理性质: 容于水,易潮解,强酸与无机酸相当。
常在合成洗涤剂、染料和药物中引入磺酸基。将磺酸基引入高分子化合物中,用来合成强酸型离子交换树脂。
2.制备
3.化学反应:
在有机合成上可以利用此反应来除去化合物中的磺酸基,或者先让占据环上的某些位置,待其他反应完成后,再经水解将磺酸基除去。
二、磺酸的衍生物
R-S-OH
RO-S-OH
O
O
O
O 硫酸氢酯
磺酸
HO-S-OH
O
O
硫酸
3H 3H
2Cl
ClCH 2CH 2C-SH
CH 3
CH 3
+H 2O HOAc
ClCH 2CH 2C-SO 3H
CH 3
CH 3+H 2O
92%
33+(CH 3)2CHCH 2CH 2Br NaHS O 3H 3O +
(CH 3)2CHCH 2CH 2S O 3H
96%
SO 3H
+NaCl
SO 3Na
+
HCl
SO 3H
++H 2O
H 2SO 4
H SO 150~160℃,加压
1.磺酰氯
苯磺酰氯为油状液体,凝固点14.4℃,沸点251.5℃,具有刺激性气味,不溶于水。它与醇、胺、水等亲核试剂反应时不象羧酸酰氯那样活泼。如:
磺酰氯对亲核试剂不大活泼的原因,可能是因为分子中硫原子易于从相邻的两个氧原子或碳原子那里获得电子(填充d 轨道),因而它接受外界电子(由亲核试剂提供)的倾向相对变弱。从空间效应上来说,磺酰氯中S 原子为sp 3杂化,具有四面体构型,而酰氯中羧基C 原子为sp 2杂化,为平面构型,前者的空间位阻较大,所以磺酰氯对亲核试剂的反应活性要比酰氯小得多。
苯磺酸很稳定,不易被还原。但磺酰氯相当容易被还原。
2.磺酸酯
磺酸酯大多为固体,实验室精制比较方便。而且磺酸根(RSO 2O -)又是一个很好的离去基团,易被各种类型的亲核试剂取代。例对甲苯磺酸根,(常用TsO -表示)是一个很
PCl 3
SO 3H 170℃
SO 2C
l
2
Cl
ClSO 2OH SO 2Cl
CH 3CONH
CH 3CONH
S O 2Cl +H 2O
COCl
S O 2Cl +
HCl
CH 3
亚磺酸
S O 2Cl
2Zn
CH 3
S -OH
Zn
24
3
S H
O EtOH
SO 2Cl
SO 2OE t
磺酸酯
CH 3SO 2Cl
ROH 吡啶
++C 5H 5N
CH 3SO 2OR +C 5H 5N
HCl
弱的碱(对甲苯磺酸是强酸),它的离去能力比-OH 强得多,它甚至可被卤离子,醇这样的弱亲核试剂所取代。因此实验室里常常先将醇转变为对甲苯磺酸酯,随后再与亲核试剂反应,合成各种取代产物。
由于对甲苯磺酸酯对亲核试剂取代反应活性大(比RBr 大),在合成中有一些特殊的用法。例制氟代烃,常规方法不能得到。
这类反应不发生分子重排。
3.磺酰胺 ⑴ 制备
⑵ 水解速度比羧酸酰胺慢得多。
⑶ 酸性
ROH 吡啶
3
S-O-R O
O
-3
O +CH 3
S-O O
O
-
(TsO )
-CH 3CH 223OH
TsCl
CH 3CH 223
OTs
F S 2
CH 3CH 22CH 3
F
CH 3-CH —CH-CH 3OH 碱
CH 3/HCl
浓CH 3-C-CH 2CH 3CH 3
Cl
(1,2-氢迁移)
CH 3-CH —CH-CH 3OTs
CH 3Cl S 2
CH 3—3
Cl
CH 3SO 2C l NH 3
SO 2N H 2
熔点 156℃
SO 2N H 2CH 3-C -N H
O
+H 2HCl (1:1)
30~40min
C H 3COOH +SO 2N H 2
H 2N
对氨基苯磺酰胺
(磺胺)
SO 2NR H
+OH -
H 2O SO 2NR
+
-
糖精是磺酰亚胺化合物,其学名叫邻磺酰苯甲酰亚胺,约比蔗糖甜500倍,难溶于水,商品为其钠盐。
4.磺胺药物
磺胺药物是一类对氨基苯磺酰胺的衍生物。它们具有抗菌性能,尤其是对链球菌和葡萄球菌类特别有效。自1932年发现了含有磺酰胺的偶氮染料“百浪多息”(Prontosil )对链球菌和葡萄球菌有很好抑制作用后,并且在1936年确证它的有效成分是在体内的代谢产物——对氨基苯磺酰胺,从而推动了对磺胺药物的研究和合成,迎来了化学疗法的新时代。在青霉素问世之前,磺胺类药物是最广泛使用的抗菌素。所有这些磺胺药都具有对氨基苯磺酰胺的基本骨架,它们的抗菌作用是由于对氨基苯磺酰胺干扰了细菌生长所必需的叶酸的合成所致。
因为细菌需要对氨基苯甲酸来合成叶酸,而对氨基苯磺酰胺在分子的大小、形状及某些性质上与对氨基苯甲酸十分相似,细菌将其误认为对氨基苯磺酰胺是对氨基苯甲酸而被细菌吸收,但它不是叶酸中的组成部分,所以叶酸的合成受阻,从而使细菌因缺乏叶酸而停止生长。
H 2N
COOH
H 2N SO 3NH
2
N
N N
HN
O H 2N
CH HN
C--NHCHCH 2CH 2COOH
O
COOH
对氨基苯甲酸叶酸
C O SO 2
N N a 2HCl
N H 2N
SO 2NH 2
H 2N N NH 2百浪多息
在体内
叶酸对于从也是一种必需的维生素,但它不是在体内合成的,而是由食物中摄取的,所以服用磺胺药物对人不会造成叶酸缺乏症。
虽后因抗生素的相继问世,磺胺药物的使用减少了,但对某些疾病仍有一定治疗价值。目前常用的磺胺药物有以下几种:磺胺对甲氧嘧啶(SMD )、磺胺二甲嘧啶(SM 2)、磺胺噻唑甲氧基哒嗪(SMP )、磺胺胍(SG )。
§15-5 含磷有机化合物
重要性:
◆ 在生物体中,某些磷酸衍生物作为核酸辅酶的组成部分,成为维持生命不可缺少的物质。
◆ 由于有机磷化合物具有强烈的生理活性,至今仍是重要的一类农药。 ◆ 有机磷化合物在工业上应用相当广泛。
一、分类
1.伯膦 RPH 2 ; 仲膦 R 2PH ; 叔膦 R 3P ; 季鏻盐 R 4P +X - 2.亚磷酸(三价磷)
3.膦酸及其衍生物(五价磷):磷酸中羟基被烃基取代的衍生物。
NH 3PH 3
胺膦
鏻盐
亚磷 酸烷基亚膦酸二烷基亚膦酸
亚膦酸酯HO P OH OH R P OH OH
R P R OH R
P
OR
OH 磷 酸
膦酸
次膦酸
R P HO
OH R P
R
OH
HO P HO
OH
O
O
RO
P RO RO
O OR P R O
R P
R
OR
O
4.膦烷(五价磷)
二、命名
1.膦 亚膦酸和膦酸的命名,在相应的类名前加上烃基的名称。
2.凡属含氧的酯基,都用前缀O-烷基表示:
O,O —二乙基磷酸酯 O,O —二乙基苯膦酸酯
O,O —二乙基硫代磷酸酯 O,O,O —三苯基磷酸酯
3.含P —X 或P —N 键的化合物可看作含氧酸的—OH 基被X ,NH 2取代后所形成的酰卤和酰胺。
苯膦酰氯 O,O —二乙基硫代磷酰氯
4.有机磷农药的命名十分长,习惯用商品名称。
(C 6H 5)3P
C 6H 5P
O
(OH )2
苯膦酸
三苯膦
P
O OH
P
O C 6H 5
E tO E tO
E tO E tO
C 6H 5P O
Cl
Cl
P
S Cl
E tO E tO
C 6H 5
P
C 6H 5C 6H 5C 6H 5
C 6H 5五苯膦
R P
R
CH 2
亚甲基三烃基膦
P O SH
P O C 6H 5O
E tO E tO
C 6H 5O C 6H 5O C 6H 5P
OE t
OE t
苯基亚膦酸乙酯
三、膦及季鏻盐
1.膦的制备
⑴ 格氏试剂——常制备叔膦
⑵
⑶ 将碘化鏻和碘烷在氧化锌存在下加热到150℃左右,则生成伯膦和仲膦
2.生成季鏻盐
PCl 33C 6H 5(C 6H 5)3P
3MgBrCl
乙醚++M gBr
+PCl Cl 2
+MgBrCl
-(OH)2
2
2RI PH 4I
ZnO
2·HI
ZnI 2150℃
+++H 2O
+2RPH 22RPH 2·HI ZnO +ZnI 2+H 2O
+RPH 2PI +R 2PH·HI 2R 2PH·HI
+ZnO
2PH ZnI 2+H 2O
+3CH 5MgBr
6H 5)3P
6H 5)3P + -CH 3]Br -
+PCl CH 3Br
(CH 3)3N CH 3Br
[(CH 3)4N]+ Br -+2
+
CH 3MgCl P
C H 3
32MgCl
干醚
P
C H 3
P
C H 3
H 2C H 3
膦具有较强的亲核性,易与卤代烃进行亲核取代反应,形成鏻盐。
烷基膦分子中,随着P 上的烃基增加,烃化反应活性增大。
胺的烃化反应顺序恰好相反: 原因是氮原子的体积较小,取代基的空间效应要比体积较大的磷原子突出。结构测定表明,三甲膦分子中C —P —C 键角为99℃,而三甲胺分子中的C —N —C 键角为108℃。磷原子上未成键电子对比较暴露,易于接近缺电子中心,而显示较强的给电子性。例如,三苯膦易与溴甲烷反应生成季鏻盐、溴化甲基三苯膦,而三苯胺则不发生类似的反应。
叔膦较强的给电子性,还突出地表现在与过渡金属的配位能力上,它要比胺强得多。叔膦与过渡金属所形成的络合物,例如,三苯膦铑氯络合物(又叫Wilkinson 催化剂)在有机催化反应中具有特别重要的意义。
3.Witting 反应(维狄希反应) ⑴ 磷叶立德—Witting 试剂
⑵ Witting 反应 Witting 试剂与醛、酮的反应称为维狄希反应
CH Br
P + -CH ]Br -
PhLi
Ph
+-
R 2PH RPH 2
R 3P >>R R 3P R`X
+
-
R 2
NH RNH
2R 3N <<(C 6H 5)3P +CH 3+
-
(C 6H 5)3P CH 3
-Br
3H 33
3H 33
Ph 2Ph 2P 2
含硫和含磷有机化合物第十五章 写出下列化合物的结构式:.1 (2 (1)硫酸二乙酯)甲磺酰氯)磷酸三苯酯)对硝基苯磺酸甲酯(4(3 -二氯代乙硫醚2 (6),2')对氨基苯磺酰胺(5 (7)二苯砜)环丁砜(8 9()苯基亚膦酸乙酯)苯基亚膦酰氯(10 答案: OO(1)(2)S ClCH S CHCHCHOOCH33322OOO(4)(3)OOPOCHSNO 323O(6)(5)O ClSCHCHCHClCH NHSNH222222OO(7)(8)SSOOO(10)(9)OOH PCl CHOCHP32H : .命名下列化物 2. 答案: )对甲苯环)对羧基苯磺酸(4)巯基乙醇(2)巯基乙酸(3 (1)氯化)碘化环已基二甲基锍(7已基二甲基锍(5)乙硫革甲醇(6)甲)苯基膦酸二乙酯(10N-甲基对甲苯磺酰胺(9四羟甲基磷(8)基乙基氯膦
:.用化学方法区别下列化合物3 答案:不发),HSH(乙硫醇(1)可以用氨水处理,能产生沉淀的为 C-AgNO523). 二甲硫醚SCH(生反应的是CH33为的泡产生气处用NaHCO水溶液理,能可(2)以CO23(甲基磺酸甲CHCHSOH(CHCHSO乙基硫醇),不产生气泡的为323333酯)。(甲CHSCHHSCH氨水处理,3 ()可以用能产生沉淀的为-AgNO3223 SCHCHHOCH硫基乙硫醇),不产生气泡的为(甲基硫基乙醇)。322. )可以用水处理,在室温下发生剧烈反应,产生热效应的为4(COClCH3(对甲苯甲酰氯),而几乎不发生明显反应,出ClSOHC32. 现水与油分层现象的为(对甲苯磺酰氯)4. 试写出下列反应的主要 产物: 答案:(1)+3HCl3+POCl CHOHCHOOP 3333O(2) r H n-CBP n-C-CO)HPHO)(n(+n-CH9423949494(3)CHS2HClCHC+HCHOHCSHHS(CH)CH 6565322SCN2(4)1:1SH+OHCHHSCH222O(5)Li n-CH(1)94CH)S(CH+LiBr
Compounds containing sulfur and phosphorus
含硫和含磷有机化合物的类型和命名; 含硫有机化合物的制法和性质; 有机硫试剂在合成上的应用; 膦、季钅 粦盐的制法和性质; 硫、磷叶立德在有机合成中的应用。 有机硫试剂在合成上的应用; Wittig试剂在合成上的应用。
§15-1 电子结构和成键特征
1 硫、磷的电子构型 O:1s22s22p4 N:1s22s22p3 相似:
ROH SH RSH
S:1s22s22p63s23p43d0 P:1s22s22p63s23p33d0
价电子层的结构相似,可形成结构相似的化合物
OH R O R' R R O C S C H(R') H(R') O R C OH S R C OH
R S R'
醇
酚
醚
醛酮
酸
RNH2
伯胺
R2NH
仲胺
R3N
叔胺
R4NX
季铵盐
RPH2
伯膦
R2PH
仲膦
R3P
叔膦
R4PX
季鏻盐
差异: P比N 、S比O ① 多一层电子,原子半径大 电负性较小 核对外层电子束缚力小 极化变形性(亲核性)大 2P 3P 轨道大小不匹配,侧面交叠小。
C C S P
不稳定 不存在
聚合
C S
S C
C S
② 除3s,3p轨道上的价电子可参与成键外, 能量相近的3d空轨道也可参与成键 P : sp3d杂化-5个单键(PCl5) S: sp3d2杂化-6个单键(SF6)
O R S R' R O S O R' R O S OH R O S O O (O H ) 2 (R O ) 3 P = O R P (O R ') 2 OH
→ 高氧化态化合物
O R P
第十五章 含硫、含磷有机化合物 教学目的: 了解一些常见的含磷有机化合物,熟悉硫醇、硫酚、硫醚,膦酸和膦酸酯类,磷酸酯和硫代磷酸酯类命名规则,掌握硫醇、硫酚、硫醚的物理和化学性质。 教学重点: 含硫和含磷有机化合物主要作为有机合成试剂使用。 教学难点: 如何理解含硫、含磷有机化合物的特性问题。 第一节含硫有机化合物 一、结构类型与命名 S 原子可形成与氧相似的低价含硫化合物。如:R-SH 硫醇 R-S-R 硫醚C 6H 5-SH 硫酚 —SH 官能团,叫做硫氢基或巯(音求)基。硫醇、硫酚、硫醚等含硫化合物的命名较简单,可在相应的含氧衍生物类名前加上“硫”字即可。例如: 甲硫醇 CH 3SH 2-丙硫醇 (CH 3)2CHSH 二甲硫醚 CH 3SCH 3 2,2‘-二氯二乙硫醚 ClCH 2CH 2SCH 2CH 2Cl 苯甲硫醚 C 6H 5SCH 3 如果-SH 作为取代基命名时,则与其他官能团的命名原则相同。例如: 巯基乙酸 HS-CH 2-COOH 2-氨基-3-巯基丙酸 HS-CH 2-CH(NH 2)-COOH 亚砜、砜、磺酸及其衍生物的命名,也只需在类名前加上相应的烃基名称就可以。例如: CH 3-S-CH 3O S O O S O O OH CH 3 S O O Cl CH 3 S O O H 2N NH 2二甲亚砜 二苯砜 甲磺酸 对甲苯磺酸 对甲苯磺酰氯 对氨基苯磺酰胺 S O O CH 3OH
二、硫醇、硫酚 1. 物理性质和制法 沸点低于相应的含氧化合物,因其极性:S 第十五章含硫含磷有机化合物 [目的要求]: 1.掌握硫、磷原子的成键特征,了解含硫、含磷有机化合物的类型和命名。 2.掌握硫醇、硫酚、硫醚、亚砜和砜的制法、性质及有机硫试剂在有机合成上的应用。 3.掌握磺酸制法和性质,了解其衍生物的制法和性质。 4.掌握膦、季鏻盐的制法和魏悌希反应。 5.了解一些有机磷农药。 [教学内容]: 第一节硫、磷原子的成键特征 第二节含硫有机化合物 第三节有机硫试剂在有机合成上的应用 第四节磺酸及其衍生物 第五节含磷有机化合物 §15-1 S、P原子的成键特征 一、电子构型 1.核外电子排布 N 22S21S2 2S22 3P3; O:1S22S2 2P4;S:1S2 2S2 2P63S2 3P4; N7P15O8S16 2.比较 它们能形成相似的共价化合物: R —OH 醇, R 3N 胺; R —SH 硫醇, R 3P 膦 二、P - P π键 1.P -2P π键 (C=O ; C=C ; C=N ) 2.2P -3P π(C=S ) 三、3d 轨道参与成键 1.S 电子跃迁到3d 轨道上,形成由S 、P 、d 轨道组合成的杂化轨道,参与成键。 2.用它的空3d 轨道,接受外界提供的未成键电子对(P 电子对)填充其空轨道,而形成一类新的π键,它是由d 轨道和P 轨道相互重叠而形成的,所以叫做d - P π。(图15-1) 原子体积 电负性 受核的束缚力 和C 成键 O 、N 较小 较大 较大 2P —2P π S 、P 较大 较小 较小 2P —3P π + ++--+ - 四、与胺类似的含S 、P 有机物 §15-2 含硫有机物 一、低价含硫化合物——硫醇、硫酚和硫醚 1.结构和命名 S 原子可形成与氧相似的低价含化合物。—SH 官能团,叫做硫氢基或巯(音求)基。 2.制备 ⑴ 硫醇 硫脲 异硫脲盐 R-S H SH R-S -R 硫醚 硫酚 硫醇 +RX NaSH NaX 乙醇△ +RX S C NH 2 NH 2+△乙醇S C NH 2 R H 2O OH - H 2S RCH 2CH 2SH +RCH=CH 2ThO 2 R-OH +H 2S R-S H +H 2O 400 ℃ 1 23 叔胺 1 23 R 4季铵盐氧化叔胺 1 2 R 3 1 23叔膦 1 23 R 4 季鏻盐 氧化叔膦 1 2 R 3 1 2硫醚 1 23铳盐 亚砜 1 2 第一节硫磷原子的成键特征 价电子层构型 O 2S22p4 S 3S23P43d0 N 2S22P3 p 3S23P33d0 1. 由于价电子层构型类似,所以硫、磷原子可以形成与氧、氢相类似的共价键化合物。 醇胺硫醇膦 2. 由于3P轨道比2P轨道比较扩散,它与碳原子的2P轨道的相互重叠不如2P 轨道之间那样有效,以硫、磷原子难以和碳原子形成稳定的P—Pπ键。 如硫醛和硫酮,除了少数芳香硫酮(二苯硫酮)之外,一般不稳定,易于二聚,三聚或多聚成为只含σ键的化合物 3. 硫,磷除了利用3S,3P电子成键外,还可以利用能量上相接近的空3d轨道参 与成键。 3d轨道参与成键有两种方式,一种是s电子跃迁到3d轨道上,形成由s. p. d电子组合而成的杂化轨道 磷原子 sp3d杂化形成五个共价单键 PCl 5 硫原子 sp3d2杂化形成六个共价单键 SF 6 另一种方式是利用它的空3d轨道,接受外界提供的未成键电子对形成 d—Pπ键,如:亚砜,砜,磷酸酯都是含有这种d-Pπ键。 4 硫,磷原子常取sp3杂化态,与胺类似具有四方体构型 叔胺叔膦硫醚 季铵盐季膦盐锍盐 氧化叔胺氧化叔膦亚砜 第二节含硫有机化合物的主要类型和命名 一结构类型 硫原子可以形成与氧相似的低价含硫化合物 硫醇硫酚硫醚 二硫化物亚砜砜 次磺酸亚磺酸磺酸[][] 硫醛硫酮硫代羧酸 硫脲异硫氰酸酯黄原酸酯 二命名 含硫化合物的命名,只需在相应的含氧衍生物类名前加上“硫”字即可。 如: 异丙硫醇 2.2-二氯二乙硫醚 -SH作取代基命名时,与其他官能团的命名原则相同。 巯基乙酸 亚砜、砜、磺酸及其衍生物的命名,也只需在类名前加上相应的烃基就可以了。 二甲亚砜对甲苯磺酸环丁砜 对甲苯磺酰氯对氨基苯磺酰胺 第三节有机硫化合物的性质及在有机合成上的应用 1 硫醇和硫酚 ① 制备 硫脲法 第十章含氮与含磷化合物 一、学习要求 1.掌握胺、酰胺及有机含磷化合物结构和命名。 2.掌握胺、酰胺化学性质。 3.熟悉酰胺化合物及有机磷化合物性能与生物活性。 4.了解生源胺及生物学意义。 5.了解有机磷农药的中毒机制和解毒机制。 二、本章要点 (一)胺可以看成氨分子中的氢被烷基或芳基取代的衍生物。 1.结构、分类和命名 (1)分类: 另外NH4+中的四个氢原子被烃基取代后的化合物有季铵盐和季铵碱两种。 (2)命名: 简单胺以胺作母体,烃基作取代基,称某胺;当氮上同时连有芳基和脂肪烃基时,以芳胺作母体,在脂肪烃基前加“N”字表示脂肪烃基连在氮原子上;比较复杂的胺采用氨基作取代基;季铵类化合物和胺的离子型化合物可作为NH4+的衍生物来命名,“负离子”化“正离子”,烷基依基团顺序写在“铵”字的前面。命名时“氨”用于表示取代基,“胺”表示氨的烃基衍生物,“铵”用于季铵类化合物和胺的离子型化合物,在使用时需特别注意。 (3)结构: 胺分子中的氮原子是不等性sp3杂化,其中三个sp3杂化轨道与烃基或氢相连,构成棱锥型,另外一个sp3杂化轨道上有一对未成键电子在棱锥形顶端,空间排布近似于碳的正四体结构。 23R1、R2、R3可以是烃基或氢 脂肪胺;芳香胺 伯胺;仲胺;叔胺 一元胺;二元胺;多元胺 因此氮原子上所连的三个原子或基团不同时,应存在对映异构现象和两个具有光学活性的对映异构体,但是对映体之间相互转化需要的能量很低,能很快相互转化而自动外消旋化。 苯胺分子中由于氮原子上的未成键电子对能与苯环的π电子形成共轭,因而其 占据的sp3杂化轨道虽还保留一部分s轨道的性质似呈棱锥形,但具有更多的P轨道性质,四面体结构比脂肪胺要扁平一些。 2.物理性质低分子胺具有特殊的不愉快的气味。氮原子有氢的胺能形成分子间氢键,因此相对分子质量相近的胺的沸点顺序是伯胺>仲胺>叔胺。由于胺分子中的氮氢间的氢键不如醇、羧酸间氧氢间氢键强。胺的沸点比相对分子质量相近的醇和羧酸低。低级脂肪胺一般能溶于水,但随着胺分子中烃基的增大溶解性迅速降低。 芳香胺是无色的高沸点的液体或低熔点的固体,具有特殊气味,一般难溶于水,毒性较大,使用时应注意防护。 3.化学性质胺分子的氮是sp3杂化,其中一个sp3杂化轨道上有一对未成键电子。 (1)碱性: 胺中的氮原子有一对未成键电子能结合质子,形成铵离子,因此具有碱性,结合质子能力越强碱性越强。其平衡关系如下: R+ H R N H 在水溶液中,胺的碱性强弱是由电子效应、溶剂化效应、空间效应综合作用的结果。其碱性强弱大致为:季铵碱>脂肪氨>氨>芳香胺 (2)亲核性:伯胺和仲胺中氮原子作为亲核中心可以与酰卤、酸酐等发生亲核取代反应而生成N-取代或N,N-二取代酰胺。叔胺氮原子上没有氢原子,因此不能发生酰化反应。人们常利用酰化反应修饰具氨基化合物为酰胺。 人们常利用苯磺酰氯来分离和鉴别伯、仲、叔胺,称Hinsberg反应。伯胺生成的苯磺酰胺氮原子上的氢显弱酸性,能溶于过量的碱变成盐而溶于水。仲胺生成不溶于水的苯磺酰胺,叔胺不能发生磺酰化反应。 (3)胺与HNO2的反应:胺能与亚硝酸反应,产物与胺的种类和反应条件有关。伯、仲、叔胺各有不同的反应的结果和现象;脂肪胺和芳香胺的反应也有所不同。因此可利用胺与HNO2的反应鉴别胺类化合物。 第十章 含氮和含磷有机化合物 Ⅰ 学习要求 1. 熟悉伯、仲、叔胺与伯、仲、叔醇和伯、仲、叔卤代烃的区别。 2. 掌握胺、酰胺、硝基化合物、重氮盐和偶氮化合物的命名。 3. 熟悉氨、脂肪胺及芳香胺的结构。掌握氨、胺和铵的区别以及磷和膦的区别。 4. 熟练掌握胺、酰胺、硝基化合物和重氮盐的化学性质及胺的分离提纯方法。 5. 掌握氨基的保护及在合成中的应用。 Ⅱ 内容提要 一. 胺的定义、分类和命名(略) 应当注意伯、仲、叔醇指的是羟基分别与伯、仲、叔碳原子相连的醇,而伯、仲、叔胺指的是氮原子与一个、两个、三个烃基相连的胺,与氮原子所连碳的种类无关。如(CH 3)3COH 是叔醇,而(CH 3)3CNH 2是伯胺。 二. 胺的性质 1. 碱性: 在水溶液中,胺的碱性强弱顺序为: 脂肪胺 > 氨 > 芳香胺。 脂肪胺在气相或非水溶液中的碱性与电子效应结果相一致:叔胺>仲胺>伯胺。脂肪胺在水溶液中的碱性受多种因素影响,一般情况下,仲胺表现出较强的碱性。就甲胺、二甲胺、三甲胺来说,其碱性强弱顺序为:二甲胺>甲胺>三甲胺。 芳香胺的碱性强弱顺序与电子效应、溶剂效应、位阻效应相一致。即苯胺>二苯胺>三苯胺。 2. 烷基化反应: 3. 酰基化反应: 酰胺是结晶固体,可通过测熔点确定原来的胺,叔胺无此反应,可用于定性鉴定伯胺和仲 胺,也可用于叔胺与伯胺和仲胺的分离。酰胺在酸碱催化下水解得到原来的胺,可用酰基化反应保护氨基。如: RNH 1) RX -R 2NH 1) RX -R 3N RX [R 4N]+X Ag 2O 2 [R 4N]+OH -R NH 2+R'C Cl O R NH C O R' R 2NH +R'C Cl O R 2N C O R'CH 3 NH 2CH 3COCl CH 3 NHCOCH 3[O] COOH NHCOCH 3H 2O - COOH NH 2 第十一章 含氮化合物 11.2 命名下列化合物或写出结构式 a. CH 3CH 2NO 2 b. NO H 3C c. NHC 2H 5 d. H 3C N 2+Br - e. Br NHCOCH 3 f. CH 3CH 2CH 2CN g. NHNH 2 O 2N h. H 2NCH 2(CH 2)4CH 2NH 2 i. NH O O j. (CH 3CH 2)2N--NO k. C 6H 5CH 2 N CH 3CH 3 C 12H 25+ Br - l.胆碱 m. 多巴胺 n. 乙酰胆碱 o. 肾上腺素 p. 异丁胺 q.胍 r. CH 3CH 2N(CH 3)2 答案: a. 硝基乙烷 b. p —亚硝基甲苯 c. N -乙基苯胺 d. 对甲苯重氮氢溴酸盐或溴化重氮对甲苯 e. 邻溴乙酰苯胺 f. 丁腈 g. 对硝基苯肼 h. 1,6-己二胺 i. 丁二酰亚胺 j. N-亚硝基二乙胺 k. 溴化十二烷基苄基二甲铵 [(CH 3)3N +CH 2CH 2OH]OH - m.HO CH 2CH 2NH 2 n. l.[(CH 3)3N + CH 2CH 2OCOCH 3]OH - o.HO HO CH(OH)CH 2NHCH 3 p. (CH 3)2CHCH 2NH 2 r. N,N--二甲基乙胺 q. H 22 NH 11.3 下列哪个化合物存在对映异构体? a.CH 3NHCH 2CH 2Cl b.(CH 3)2N +(CH 2CH 2Cl)2Cl - c. N CH 3 d. CH 2CHCH 3 2 答案: a, d 存在。但a 的对映异构体在通常条件下很容易相互转化。 11.4 下列体系中可能存在的氢键: a. 二甲胺的水溶液 b. 纯的二甲胺 答案: H H O H H N H 3C H 3C H N H 3C H 3C H N H H 3H 3H 3H 3 Ⅰ Ⅱ Ⅲ a 中有 Ⅲ Ⅱ Ⅰ Ⅰ 三种氢键 b. 中只有一种氢键 H H 11.5 如何解释下列事实? a. 苄胺(C 6H 5CH 2NH 2)的碱性与烷基胺基本相同,而与芳胺不同。 b. 下列化合物的pK a 为 O 2N NH 2 NH 2 H 3C NH 2 pK b =13.0 pK b =9.37 pK b =8.70 答案: 第十五章含硫、含磷有机化合物 教学目的: 了解一些常见的含磷有机化合物,熟悉硫醇、硫酚、硫醚,膦酸和膦酸酯类,磷酸酯和硫代磷酸酯类命名规则,掌握硫醇、硫酚、硫醚的物理和化学性质。教学重点: 含硫和含磷有机化合物主要作为有机合成试剂使用。 教学难点: 如何理解含硫、含磷有机化合物的特性问题。 第一节含硫有机化合物 一、结构类型与命名 S原子可形成与氧相似的低价含硫化合物。如:R-SH硫醇R-S-R硫醚C6H5-SH硫酚 —SH官能团,叫做硫氢基或巯(音求)基。硫醇、硫酚、硫醚等含硫化合物的命名较简单,可在相应的含氧衍生物类名前加上“硫”字即可。例如:甲硫醇CH3SH 2-丙硫醇(CH3)2CHSH 二甲硫醚CH3SCH3 2,2‘-二氯二乙硫醚ClCH2CH2SCH2CH2Cl 苯甲硫醚C6H5SCH3 如果-SH作为取代基命名时,则与其他官能团的命名原则相同。例如: 巯基乙酸HS-CH2-COOH 2-氨基-3-巯基丙酸HS-CH2-CH(NH2)-COOH 亚砜、砜、磺酸及其衍生物的命名,也只需在类名前加上相应的烃基名称就 可以。例如: CH 3-S-CH 3O S O O S O O OH CH 3 S O O Cl CH 3 S O O H 2N NH 2二甲亚砜 二苯砜 甲磺酸 对甲苯磺酸 对甲苯磺酰氯 对氨基苯磺酰胺 S O O CH 3OH 二、硫醇、硫酚 1. 物理性质和制法 沸点低于相应的含氧化合物,因其极性:S 第十五章 含硫和含磷有机化合物 1. 写出下列化合物的结构式: (1)硫酸二乙酯 (2)甲磺酰氯 (3)对硝基苯磺酸甲酯 (4)磷酸三苯酯 (5)对氨基苯磺酰胺 (6)2,2’-二氯代乙硫醚 (7)二苯砜 (8)环丁砜 (9)苯基亚膦酸乙酯 (10)苯基亚膦酰氯 答案: (1) S O O OCH 2CH 3 CH 3CH 2O (2) S O O Cl CH 3(3) S O 2N O O OCH 3 (4) O P O 3 (5) S H 2N O O NH 2 ClCH 2CH 2SCH 2CH 2Cl (6) (7) S O O (8) S O O (9) (10) P OH OCH 2CH 3 P O H Cl 2.命名下列化物: 答案: (1)巯基乙醇(2)巯基乙酸(3)对羧基苯磺酸(4)对甲苯环已基二甲基锍(5)乙硫革甲醇(6)碘化环已基二甲基锍(7)氯化四羟甲基磷(8)N-甲基对甲苯磺酰胺(9)苯基膦酸二乙酯(10)甲基乙基氯膦 3.用化学方法区别下列化合物: 答案: (1)可以用AgNO -氨水处理,能产生沉淀的为C2H5SH(乙硫醇),不发 3 生反应的是CH3SCH3(二甲硫醚). (2)可以用NaHCO3水溶液处理,能产生CO2气泡的为CH3CH2SO3H(乙基硫醇),不产生气泡的为CH3SO3CH3(甲基磺酸甲酯)。 (3)可以用AgNO -氨水处理,能产生沉淀的为HSCH2CH2SCH3(甲 3 硫基乙硫醇),不产生气泡的为HOCH2CH2SCH3(甲基硫基乙醇)。 (4)可以用水处理,在室温下发生剧烈反应,产生热效应的为 COCl H 3C (对甲苯甲酰氯),而几乎不发生明显反应,出 现水与油分层现象的为SO 2Cl H 3 C (对甲苯磺酰氯). 4. 试写出下列反应的主要产物: 答案: POCl 3+OH CH 33O CH 3 P 3 O +3HCl (1) (2) +(n -C 4H 9O)2P O C 4H 9-n n-C 4H 9B r (n -C 4H 9O)3P (3) C 5H 6CHO +HS(CH 2)3SH C 5H 6CH S S CH 2CN 2 CH 2 (4) H 2S +O HSCH 2CH 2OH (5) (CH 3)3SBr n -C H Li (CH 3)2S CH 2+ LiBr 322CH 3CH 2CH 2CH 2 O +CH 3SCH 3 5. 完成下列转化:第十五章 含硫含磷有机化合物
含硫和含磷有机化合物
第十章含氮与含磷化合物习题答案
第十章 含氮和含磷有机化合物
第十二章 含硫和含磷有机化合物课后习题答案
含硫含磷有机化合物
有机化学第十五章 含硫和含磷有机化合物