
临床常用生化检验项目参考区间
第6部分:血清总钙二无机磷二镁二铁
1 范围
W S /T404的本部分规定了中国成年人群血清总钙二
无机磷二镁二铁的参考区间及其应用三本部分适用于医疗卫生机构实验室血清总钙二无机磷二镁二铁检验结果的报告和解释,相关体外诊断产品生产厂商也可参照使用三2 规范性引用文件
下列文件对于本文件的应用是必不可少的三凡是注日期的引用文件,仅注日期的版本适用于本文件三凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件三
W S /T402 临床实验室检验项目参考区间的制定
3 术语和定义
W S /T402界定的术语和定义适用于本文件三4 参考区间建立
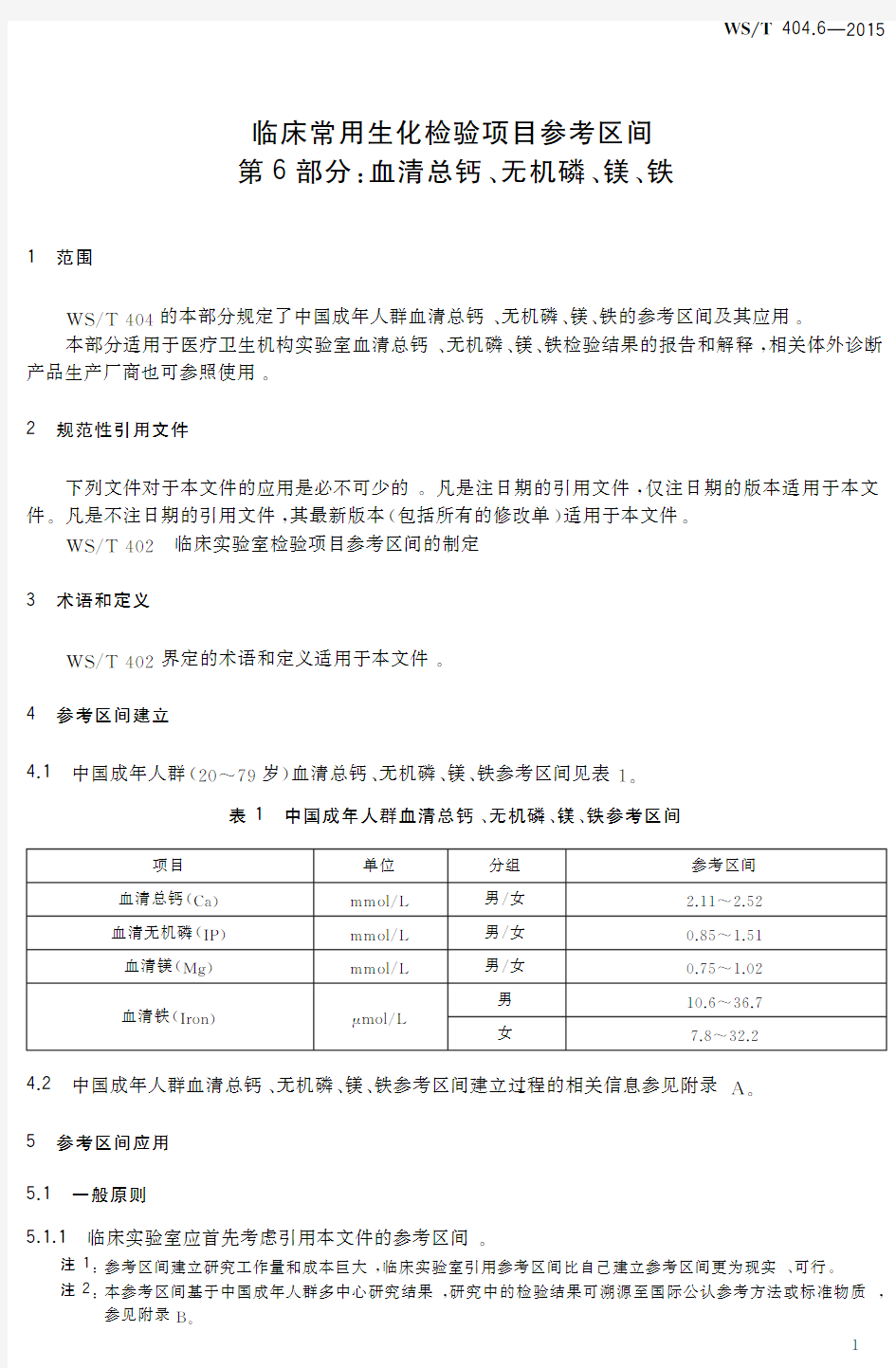
4.1 中国成年人群(20~79岁)
血清总钙二无机磷二镁二铁参考区间见表1三表1 中国成年人群血清总钙二无机磷二镁二铁参考区间
项目单位分组参考区间血清总钙(C a )mm o l /L 男/女2.11~2.52血清无机磷(I P )
mm o l /L 男/女0.85~1.51血清镁(M g
)mm o l /L 男/女0.75~1.02血清铁(I r o n
)μ
m o l /L 男10.6~36.7女
7.8~32.2
4.2 中国成年人群血清总钙二无机磷二镁二铁参考区间建立过程的相关信息参见附录A 三5 参考区间应用
5.1 一般原则
5.1.1 临床实验室应首先考虑引用本文件的参考区间三
注1:参考区间建立研究工作量和成本巨大,临床实验室引用参考区间比自己建立参考区间更为现实二可行三
注2:本参考区间基于中国成年人群多中心研究结果,研究中的检验结果可溯源至国际公认参考方法或标准物质,
参见附录B 三
1
W S /T 404.6 2015
W S/T404.6 2015
5.1.2使用本文件的参考区间前应进行必要的验证或评估三
注1:外部参考区间在实验室的适用性主要取决于实验室与参考区间建立时检验结果的可比性和人群的适用性三注2:检验结果只有存在恒定的系统偏倚(检验结果正确度)才影响参考区间的适用性,过大的实验室内变异是实验室分析质量问题,不是参考区间适用性问题三
注3:本文件的参考区间基于血清的检测结果建立,若临床实验室使用的标本类型为血浆,应进行适当的评估以决定是否采用本参考区间三
5.2参考区间评估二验证和使用
5.2.1按W S/T402的有关规定进行参考区间评估和验证三
5.2.2如实验室确认与参考区间建立时的检验结果可比且人群适用,则可直接引用本文件的参考区间,若不确定或基于实验室管理体系的要求需对引用的参考区间进行验证,可按下列步骤进行:
a)筛选合格参考个体不少于20名,筛选标准参见A.2.2;
b)按本实验室操作程序采集二处理二分析样品;
c)按适当方法检查并剔除离群值(若有,则另选参考个体补足);
注:离群值检验采用D i x o n方法:首先将检测结果按照大小排序并计算极差R,然后分别计算最大和最小值
与其相邻数值之差D;若D/R?1/3,则将最大值或最小值视为离群值予以剔除;将余下数据重复前述步
骤进行离群值检验,直至剔除所有离群值三
d)如选择20个合格的参考个体,将20个检验结果与参考区间比较,若超出参考区间的数据不超
过2个,则通过验证;若超过2个,则另选20名合格参考个体重新按照上述判断标准进行验
证三如参考个体多于20个,超出参考区间的数据不超过10%则通过验证;若超过10%的数据
超出参考区间,则另选至少20名合格参考个体,重新按照上述判断标准进行验证三验证结果
若符合要求,可直接使用参考区间,否则应查找原因三
5.3参考区间未通过验证时的处理程序
5.3.1对未通过验证的情况,应首先评价分析质量尤其是正确度,若证实是检测系统导致的分析质量问题,应改进或更换分析系统三分析质量评价可采用(但不限于)下列方式:
a)分析可互通有证标准物质或其他适宜参考物质;
b)参加适宜正确度验证计划或标准化计划;
c)与性能可靠的其他系统或方法进行比较三
5.3.2若证明是人群原因(如民族二高海拔地区二特殊生活习惯等因素)未通过验证,则应按W S/T402的要求建立或引用适宜参考区间三
2
W S/T404.6 2015
附录A
(资料性附录)
参考区间建立过程的相关信息
A.1参考区间建立的步骤
本文件参考区间按W S/T402的要求采用多中心的研究方式建立,主要包括以下步骤:
a)选择参考个体,组成参考样本组;
b)采集处理血液样品,获得血清样品;
c)检测血清样品,获得参考值;
d)统计处理参考值,建立参考区间三
A.2参考个体选择
A.2.1参考样本组的选择
设计总体参考人群为我国成年健康人群,参考样本组选自东北二华北二西北二华东二华南和西南6地区城乡居民,年龄范围为20~79岁,六地区最终入选的参考个体共计4397人,其中男性为1878人,女性为2519人三
A.2.2参考个体的选择
各中心分别在所在地区募集足够的可能参考个体,征得知情同意,进行参考个体的筛选,组成参考样本组三
通过问卷调查二体格检查二实验室检查筛选参考个体,满足以下要求:
a)问卷调查二体格检查:
1)自觉健康;
2)无下列疾病:急慢性感染(急性上呼吸道感染二肺炎二肺结核等)二消化系统疾病(肝硬化二肝
炎二脂肪性肝病二胆石病二胆囊炎二慢性腹泻二炎症性肠病等)二肾脏疾病(慢性肾脏病二急性
肾损伤等)二代谢和营养疾病(糖尿病二代谢综合征二血脂异常和脂蛋白异常血症二高尿酸血
症与痛风等)二风湿性疾病(类风湿性关节炎二系统性红斑狼疮等)二甲状腺疾病(甲状腺功
能亢进症二甲状腺功能减退症等)二血液系统疾病(贫血二白血病等)二动脉粥样硬化和血管
疾病二心脏病二肌病二恶性肿瘤二烧伤和肌肉损伤二肥胖或消瘦[B M I(体重指数)?28k g/m2
或<18.5k g/m2]二高血压[收缩压?140mmH g和(或)舒张压?90mmH g];
3)6个月内未进行手术,4个月内未献血二输血或大量失血,2周内未服用药物;
4)无营养不良二素食二酗酒(长期饮酒或2周内大量饮酒)二嗜烟(吸烟量>20支/d);
5)近期无剧烈运动或重体力劳动;
6)女性未处于妊娠或哺乳期三
b)通过实验室检查排除:
1)丙氨酸氨基转移酶>80U/L;
2)甘油三酯?2.26mm o l/L;
3)总胆固醇?6.22mm o l/L;
3
土壤交换性钙和镁的测定 乙酸铵交换——原子吸收分光光度法 1 方法提要 以乙酸铵为土壤交换剂,浸出液中的交换性钙、镁,可直接用原子吸收分光光度法测定。测定时所用的钙、镁标准溶液中要同时加入同量的乙酸铵溶液,以消除基本效应。此外,在土壤浸出液中,还要加入释放剂锶(Sr),以消除铝、磷和硅对钙测定的干扰。 2 应用范围 适用于酸性、中性土壤交换性钙镁的测定。 3 主要仪器和设备 3.1 天平(感量:0.01g) 3.2 原子吸收分光光度计(配置钙和镁空心阴极灯); 3.3 离心机; 3.4 离心管,100mL。 4 试剂和溶液 4.1乙酸铵溶液[c(CH3COONH4) = 1mol·L-1,pH7.0]:称取乙酸铵(CH3COONH4)77.08g 溶于约950mL水中,用(1:1)氨水和稀乙酸调节至pH7.0,加水稀释到1L; 4.2 氯化锶溶液[ρ(SrCl2?6H2O) = 30g·L-1]:称取氯化锶(SrCl2?6H2O)30g溶于水,定容至1L; 4.3 盐酸溶液(1:1):一份盐酸与等体积的水混合均匀; 4.4钙标准贮备液[ρ(Ca) = 1000μg·mL-1]:称取经110℃烘4h的碳酸钙(CaCO3,优级纯)2.4972g于250mL高型烧杯中,加少许水,盖上表面皿,小心从杯嘴处加入(1:1)盐酸溶液100mL 溶解,待反应完全后,用水洗净表面皿,小心煮沸赶去二氧化碳,将溶液无损移入1L容量瓶中,用水定容; 4.5钙标准溶液[ρ(Ca) =100μg·mL-1]:吸取10.00mL钙标准贮备溶液于100mL容量瓶中,定容; 4.6镁标准贮备液[ρ(Mg) =500μg·mL-1]:称取金属镁(光谱纯)0.5000g于250mL高型烧杯中,盖上表面皿,小心从杯嘴处加入(1:1)盐酸溶液100mL 溶解,用水洗净表面皿,将溶液无损移入1L容量瓶中,定容;
钙、磷、镁代谢与微量元素 一、钙、磷、镁代谢 钙、磷、镁的生理功能 钙盐和磷酸盐是人体含量最高的无机盐,约99%的钙和86%以上的磷存在于骨骼和牙齿中。 1.钙的生理功能 (1)血浆钙可降低毛细血管和细胞膜的通透性,降低神经、肌肉的兴奋性。 (2)血浆钙作为血浆凝血因子参与凝血过程。 (3)骨骼肌中的钙可引起肌肉收缩。 (4)重要的调节物质:①影响膜的通透性;②在细胞内作为第二信使,起着重要的代谢调节作用;③是许多酶的激活剂。 2.磷的生理功能 (1)血中磷酸盐是血液缓冲体系的重要组成成分。 (2)细胞内的磷酸盐参与许多酶促反应。 (3)构成核苷酸辅酶类的辅酶。 (4)细胞膜磷脂在构成生物膜结构、维持膜的功能和在代谢调控上均起重要作用。 3.镁的生理功能 镁一半以上沉积在骨中。 (1)Mg2+对神经、肌肉的兴奋性有镇静作用; (2)Mg2+是近300种酶的辅助因子。 与体内重要的生物高分子并且和ATP、DNA、tRNA、mRNA的生化反应有关系,参与氨基酸的活化等,在维持机体内环境相对稳定和维持机体的正常生命活动中起着重要的作用。 钙、磷、镁的代谢及调节 1.钙、磷、镁的代谢 (1)钙 1)吸收:十二指肠(活性D3调节下的主动吸收) 影响吸收的因素:①肠管的pH:偏酸时促进吸收; ②食物成分:食物中草酸和植酸可以和钙形成不溶性盐,影响吸收。 2)排泄:80%肠道排出,20%肾脏排出。 血钙低于2.4mmol/L时,尿中几无钙排出。 (2)磷:食物中磷以有机磷酸酯和磷脂为主,在肠管内磷酸酶的作用下被分解为无机磷被吸收。 由于磷的吸收不良引起的缺磷现象较少见。 磷主要由肾排泄,其排出量约占总排出量的70%。 (3)镁:吸收部位主要在回肠,是主动运转过程。 消化液中也有多量镁,长期丢失消化液(如消化道造瘘)是缺镁的主要原因。 排泄:主要是肾。 2.钙磷代谢的调节:甲状旁腺激素、降钙素、活性维生素D。 (1)甲状旁腺激素:维持血钙正常水平最重要调节因素。 总结果:升高血钙、降低血磷。(升钙降磷)
微量元素检测的临床意义 微量元素在人体中起着极其重要的作用,与人的生存和健康息息相关,它们的摄入过量或缺乏都会不同程度地引起人体生理的异常或发生疾病。通过对微量元素的测验,可以预知身体状况,是经济、科学的健康检测方法之一。钙、铁、锌、镁、铜、铅和镉七种元素在人体中尤其重要的微量元素,应该定期检验血中的这些微量元素。 以下几类人群应定期进行微量元素检测: 第一类人群是少年儿童。因快速生长发育,消耗较大,补充不足,饮食结构不合理,厌食、偏食、易生病等原因,易缺乏微量元素。 第二类人群是孕妇及哺乳期妇女。因胎儿快速生长发育,消耗量较大,孕妇由于妊娠反应也往往会导致摄入不足等原因,易缺乏微量元素。 第三类人群是免疫力低下者及中老年人。因免疫力低下、胃肠吸收功能下降,且易患慢性消耗性疾病等原因,易缺乏微量元素。 第四类人群是有害的微量元素铅、镉等摄入过多,造成中毒性损害。 微量元素的缺乏对儿童的生长发育影响尤为重要,微量元素检测对指导营养、预防疾病发生起着重要的作用。合理的营养是儿童身体素质和健康的重要因素。据文献报道反复呼吸道感染、佝偻病、身材矮小患儿出现多种微量元素失调,如果能把微量元素检测纳入常规体检,对那些缺乏微量元素的儿童也可以做到早发现、早预防、早治疗。 儿童如果出现厌食、挑食、生长发育迟缓、反复感冒、口腔溃疡、贫血、佝偻病、身材矮小等症状时,都可能与某种微量元素缺乏或失调有关。微量元素的不平衡,可以致机体的免疫功能的障碍,易致一些感染性疾病的发生,发生呼吸道感染、支气管炎、肺炎、肠炎等。 肃州区新城区社区卫生服务中心检验科应用国际公认的火焰原子吸收光谱法和石墨炉原子吸收光谱法,开展儿童微量元素检测,仅仅通过在孩子手指上取一滴血,就可以检测出孩子身体内的铜、铁、锌、钙、镁、铅、镉等微量元素的准确含量,帮助家长准确地掌握孩子的身体情况,及时地采取食补或药补,确保孩子健康成长。
茶叶中微量元素的鉴定与定量测定 姓名:丁坤 学号:5802114045 专业班级:环境工程142 学院:资源环境与化工学院
一、实验目的 1.了解并掌握鉴定茶叶中某些化学元素的方法。 2.学会选择合适的化学分析方法。 3.掌握配合滴定法测茶叶中钙、镁含量的方法和原理。 4.掌握分光光度法测茶叶中微量铁的方法。 5.提高综合运用知识的能力。 二、实验原理 茶叶属植物类,为有机体,主要由C,H,N和O等元素组成,其中含有Fe,Al,Ca,Mg 等微量金属元素。本实验的目的是要求从茶叶中定性鉴定Fe,Al,Ca,Mg等元素,并对Fe,Ca,Mg进行定量测定。 茶叶需先进行“干灰化”。“干灰化”即试样在空气中置于敞口的蒸发皿后坩埚中加热,把有机物经氧化分解而烧成灰烬。这一方法特别适用于生物和食品的预处理。灰化后,经酸溶解,即可逐级进行分析。 铁铝混合液中Fe3+离子对Al3+离子的鉴定有干扰。利用Al3+离子的两性,加入过量的碱,使Al3+转化为离子留在溶液中,Fe3+则生成沉淀,经分离去除后,消除了干扰。 钙镁混合液中,Ca2+离子和Mg2+的鉴定互不干扰,可直接鉴定,不必分离。 铁、铝、钙、镁各自的特征反应式如下: Fe3++nKSCN(饱和)→Fe(SCN)n3-n(血红色)+K+ Al3++铝试剂+OH-→红色絮状沉淀 Mg3++镁试剂+OH-→天蓝色沉淀 Ca2++C2O42-→CaC2O4(白色沉淀) 根据上述特征反应的实验现象,可分别鉴定出Fe,Al,Ca,Mg 4个元素。 钙、镁含量的测定,可采用配合滴定法。在pH=10的条件下,以铬黑T为指示剂,EDTA 为标准溶液。直接滴定可测得Ca,Mg总量。若欲测Ca,Mg各自的含量,可在pH>12.5时,使Mg2+离子生成氢氧化物沉淀,以钙指示剂、EDTA标准溶液滴定Ca2+离子,然后用差减法即得Mg2+离子的含量。 Fe3+, Al3+离子的存在会干扰Ca2+,Mg2+离子的测定,分析时,可用三乙醇胺掩蔽Fe3+与Al3+。 三、试剂与仪器 试剂:1%铬黑T,6mol·L-1HCl,2 mol·L-1HAc,6 mol·L-1NaOH,0.25 mol·L-1 ,0.01 mol·L-1(自配并标定)EDTA,饱和KSCN溶液,0.010mg·L-1Fe标准溶液,铝试剂,镁试
实验四十 茶叶中微量元素的鉴定与定量测定 一、 实验目的 1. 了解并掌握鉴定茶叶中某些化学元素的方法。 2. 学会选择合适的化学分析方法。 3. 掌握配合滴定法测茶叶中钙、镁含量的方法和原理。 4. 掌握分光光度法测茶叶中微量铁的方法。 5. 提高综合运用知识的能力。 二、 实验原理 茶叶属植物类,为有机体,主要由C ,H ,N 和O 等元素组成,其中含有Fe ,Al ,Ca ,Mg 等微量金属元素。本实验的目的是要求从茶叶中定性鉴定Fe ,Al ,Ca ,Mg 等元素,并对Fe ,Ca ,Mg 进行定量测定。 茶叶需先进行“干灰化”。“干灰化”即试样在空气中置于敞口的蒸发皿后坩埚中加热,把有机物经氧化分解而烧成灰烬。这一方法特别适用于生物和食品的预处理。灰化后,经酸溶解,即可逐级进行分析。 铁铝混合液中Fe3+离子对Al3+离子的鉴定有干扰。利用Al3+离子的两性,加入过量的碱,使Al3+转化为 离子留在溶液中,Fe3+则生成 沉淀,经分离去除后,消除了干扰。 钙镁混合液中,Ca2+离子和Mg2+的鉴定互不干扰,可直接鉴定,不必分离。 铁、铝、钙、镁各自的特征反应式如下: 33Fe K SC N ()Fe(SC N )()K n n n n +-+ +→+饱和血红色 3Al OH ++→-铝试剂+红色絮状沉淀 2M g O H ++→-镁试剂+天蓝色沉淀 HAc 222424Ca C O CaC O +-+????→介质(白色沉淀) 根据上述特征反应的实验现象,可分别鉴定出Fe ,Al ,Ca ,Mg 4个元素。 钙、镁含量的测定,可采用配合滴定法。在pH=10的条件下,以铬黑T 为指示剂,EDTA 为标准溶液。直接滴定可测得Ca ,Mg 总量。若欲测Ca ,Mg 各自的含量,可在pH>12.5时,使Mg2+离子生成氢氧化物沉淀,以钙指示剂、EDTA 标准溶液滴定Ca2+离子,然后用差减法即得Mg2+离子的含量。 Fe3+, Al3+离子的存在会干扰Ca2+,Mg2+离子的测定,分析时,可用三乙醇胺 掩蔽Fe3+与Al3+。 茶叶中铁含量较低,可用分光光度法测定。在pH=2~9的条件下,Fe2+与邻菲啰啉能生成稳定的橙红色的配合物,反应式如下: 该配合物的 ,摩尔吸收系数 。
制盐工业通用试验方法钙和镁离子的测定 1.适用范围 本方法适用于制盐工业中工业盐、食用盐(海盐、湖盐、矿盐、精制盐)、氯化钾、工业氯化镁试样中钙、镁离子含量的测定。 2.容量法 2.1.镁离子含量的测定 2.1.1.原理概要 样品溶液调至碱性(pH≈10),用EDTA标准溶液滴定,测定钙离子和镁离子的总量,然后从总量中减去钙离子量即为镁离子量。 2.1.2.主要试剂和仪器 2.1.2.1.试剂 氨-氯化铵缓冲溶液(pH≈10) 称取20g氯化铵,以无二氧化碳水溶解,加入100mL25%氨水,用水稀释至1L。 铬黑T:0.2%溶液 称取0.2g铬黑T和2g盐酸羟胺,溶于无水乙醇中,用无水乙醇稀释至100mL,贮于棕色瓶内; 三乙醇胺:10%溶液; 氧化锌:标准溶液 称取0.8139g于800±2℃灼烧恒重的氧化锌,置于150mL烧杯中,用少量水润湿,滴加盐酸(1∶2)至全部溶解,移入500mL容量瓶,加水稀释至刻度,摇匀; 乙二胺四乙酸二钠(EDTA):0.02mol/L标准溶液 配制:称取40g二水合乙二胺四乙酸二钠,溶于不含二氧化碳水中,稀释至5L,混匀,贮于棕色瓶中备用; 标定:吸取20.00mL氧化锌标准溶液,置于150mL烧杯中,加入5mL氨性缓冲溶液,4滴铬黑T指示剂,然后用0.02mol/L EDTA标准溶液滴定至溶液由酒红色变为亮蓝色为止。 计算:EDTA标准溶液对镁离子的滴定度按式(1)计算。 T EDTA/Mg2+= W×20/500 ×0.2987 (1) V 式中:T EDTA/Mg2+——EDTA标准溶液对镁离子的滴定度,g/mL; V——EDTA标准溶液的用量,mL; W——称取氧化锌的质量,g; 0.2987——氧化锌换算为镁离子的系数。 2.1.2.2.仪器 一般实验室仪器。 2.1. 3.过程简述 吸取一定量样品溶液〔见附录A(补充件)〕,置于150mL烧杯中,试验程序同2.1.2.1.标定,EDTA标准溶液用量为测定钙离子及镁离子的总用量。 2.1.4.结果计算 镁离子含量按式(2)计算。
2019第七章钙、磷、镁代谢与微量元素 一、A1 1、离子钙测定的临床已应用的方法是 A、火焰光度法 B、原子吸收分光光度法 C、邻甲酚酞络合酮法 D、离子选择电极法 E、EDTA络合滴定法 2、机体内钙主要存在于 A、骨和牙齿 B、血液 C、肌肉 D、毛发 E、神经 3、关于钙的叙述,不正确的是 A、血钙几乎全部存在于血浆中 B、离子钙可采用选择性电极进行测定 C、肠道pH值明显影响钙的吸收 D、甲状旁腺功能低下可使血清钙升高 E、骨骼肌中的钙可引起肌肉收缩 4、下列哪种疾病发生时,血钙浓度不降低 A、甲状旁腺机能减退 B、佝偻病 C、乳糜泻 D、慢性肾炎 E、维生素D过多症 5、低钙血症常见于 A、原发性甲状旁腺功能亢进 B、甲状腺功能亢进 C、恶性肿瘤骨转移 D、原发性肾上腺皮质功能减退症 E、维生素D活化受阻 6、影响血中游离钙浓度的主要因素是 A、体温 B、血液PH C、血浆球蛋白浓度 D、血磷浓度 E、血红蛋白浓度
7、生理活性钙是指 A、蛋白结合钙 B、枸橼酸钙 C、碳酸钙 D、总钙 E、离子钙 8、以下结构中含铁的物质不包括 A、胆红素 B、铁蛋白 C、血红蛋白 D、肌红蛋白 E、细胞色素C 9、实验室测定血清总钙的参考方法是 A、原子吸收分光光度法 B、火焰光度法 C、高效液相色谱法 D、分光光度法 E、离子选择电极法 10、关于镁代谢叙述错误的是 A、吸收部位主要在回肠 B、肾脏是体内镁的主要排泄器官 C、大量丢失消化液是造成缺镁的主要原因 D、肌肉是维持镁平衡的主要组织 E、溶血对血清镁测定影响不大 11、高钙血症临床常见的原因是 A、甲状腺功能亢进 B、甲状旁腺功能亢进 C、低清蛋白血症 D、维生素E中毒 E、甲状旁腺功能低下 12、促进新骨形成和钙化的物质是 A、甲状腺激素 B、甲状旁腺素 C、降钙素 D、1,25-(OH)2D3 E、25-(OH)D3 13、对体内钙、磷水平影响最大的激素是 A、雄激素 B、甲状旁腺激素 C、肾上腺素
钙磷镁与微量元素的临床生物化学 第一节概述 一、钙、磷代谢及调节 (一)含量与分布 钙是体内含量最多的无机盐,占体重的1.5%~2%,总量约700~1400g,其次是磷,占体重0.8%~1.2%,总量约400~800g。 99%以上的钙和86%以上的磷是以羟磷灰石形式沉积于骨、牙。 (二)吸收与排泄 吸收:在pH较低的小肠上段,钙的吸收率随年龄的增长而降低,每增加10岁减少5%~10%,婴儿吸收率可达50%以上,儿童40%,成人20%左右,故老人易发生骨质疏松症。 磷的吸收率约70%,低磷时可达90%。 排泄:主要通过肠道和肾脏。 钙:80%肠道 20%肾脏 磷:30%肠道 70%肾脏 (三)血钙与血磷 血液中钙几乎全部存在于血浆,正常血清钙 2.25~2.75mmol/(9~11mg/dl) 发挥生理作用的是离子钙,但临床实验室测定的大多数是总钙。 血磷是指血液中的无机磷酸盐(HPO42-、H2PO4-)正常人血清无机磷0.97~1.61mmol/L(3~5mg/dl),儿童稍高。
[Ca] ×[P] = 35~40 大于40骨盐沉积,有利于骨钙化。小于35骨盐溶解。 (四)钙、磷生理功能 钙:1.参与血液凝固。 2.参与肌肉收缩。 3.维持神经肌肉应激性。 H+HCO3 4.作为第二信使。 磷:1.作为核酸、磷脂、磷蛋白合成的原料。 2.参与高能磷酸化合物的合成。 3.构成核苷酸辅酶。 4.构成磷酸盐缓冲对。 (五)钙、磷代谢调节 1.维生素D3(VitD3) 促进肠道对钙、磷的吸收;促进肾小管对钙、磷的重吸收;协同PTH促进骨重建。 2.甲状旁腺素(PTH)甲状旁腺主细胞分泌的84肽。促进溶骨作用,促进间充质细胞转化成破骨细胞,抑制破骨细胞转化为成骨细胞;促进肾小管对钙的重吸收,抑制磷的重吸收。 3.降钙素(CT)甲状腺滤泡旁细胞分泌的32肽,与PTH拮抗。促进成骨作用,抑制间充质细胞转化为破骨细胞,促进破骨细胞转化为成骨细胞;抑制肾小管对钙、磷的重吸收。 二、镁代谢和生理功能
钙和镁离子去除对人体有哪些影响,常喝纯净水有碍健康吗? 台中地区最近爆发的河川污染事件,除了影响民众的饮水品质外,也严重危害到民众饮水的习惯。居民为了想尽办法要喝纯水,在饮水前无不煮了又煮,过滤再过滤,好将水中的杂质及有毒物质完全去除。就在这层层的净水过程中,除了将细菌、微生物及有毒物质全部去除外,同時也将水中有益健康的矿物质像钙离子与镁离子等一并去除了。 饮水中去除钙离子与镁离子究竟对人体有何影响呢?在瑞典地区最近就做了大规模的流行病学调查,结果发现若饮水中的钙离子与镁离子含量过低,甚至是低到零,会增加心血管疾病的发生率近四成,这项研究同時也在加拿大、南非及芬兰地区相继被证实。 水有「软水」和「硬水」之分,所谓「硬水」指的就是水中含有丰富钙离子及镁离子的水,我们可以从煮开的自来水中,发现在茶壶底部有一层水垢,这就是钙离子与镁离子的沉淀。 适量饮用富含钙离子与镁离子的水是有益健康的,镁离子有助人体中的活化,镁离子也有稳定神经肌肉传导的功能。因此当镁离子摄取不足导致体內镁离子的浓度过低時,就容易产生心律不整及血管异常收缩的现象。正常人每天从食物或饮水中须摄取镁离子至少三百五十毫克,才能保持身体健康。由于从食物中所摄取的镁离子易与食物中的纤维素结合,而不易被人体所吸收,所以要增加体內镁离子的吸收量,最有效的方法是从饮水中摄取。 常喝纯净水有碍健康吗? 上海某报曾以“常喝纯净水危害一代人健康”为题,大谈纯净水的各种危害,而另有几家颇有影响的报纸则刊登“纯净水不但无害,而且对健康有益,可以放心地喝”,引起一时纷争。中央电视台《生活》栏目进行了消费者调查,并走访了国家主管部门和权威专家,在她的专题报导中给了广大消费者一个公正、客观的说法。 据专家统计,喝一杯牛奶所含的钙质等于200杯矿泉水的含钙量,吃一块肉所含的铁量等于8200杯矿泉水的含铁量。营养专家指出,人体所需要的保种营养素,包括矿物质,微量元素,应该从食物中提取,或都是食物的一些补品。靠喝水来补充营养,无异于杯水车薪。专家说:实际上,饮水对水的要求就是水质纯净与否。 专家介绍,到90年代中期,在欧美、日本、东南亚等国,纯净水普及率已达到80%以上,中东地区则几乎是100%,在我国的香港地区,2/3的青少年喝的都是纯净水,而上述国家和地区,迄今末内因喝纯水而导致各种疾病的报导。为发规范我们的市场,国家技术监督局即将出台纯净水的国家标准。 全国食品工业标准化技术委员会秘书长郝煜说:“如里说喝净水器出来的纯净水本身对体有害,那么卫生部,国这技太监督局不会制定国家标准,不单是不能制定国这标准,还要制止生产、制止销售。
食品中微量元素的常规检验方法 食品中微量元素的常规检验方法 摘要:现如今人们对食品安全问题越来越重视,对社会报道的食品安全事件较为关注,尤其是对于食品中微量元素的污染问题,逐渐成为人类健康的核心影响因素之一,对食品安全有严重的威胁。因此,食品中微量元素的测定已成为当前食品安全检查中的核心工作内容。但我国与发达国家的食品安全测定与问题分析相比较而言还存在较大的差距。 关键词:食品安全微量元素检验测定 引言: 随着国民经济的快速发展,食品安全问题已经成为我国发展过程中需要面临的重要难题和挑战,对于政府的食品安全检测部门和生产企业都是一个巨大的考验。我国现有的食品中微量元素的检测方式已经不能满足现代社会发展的需要,迫切需要完善的检验方式,一门新兴的边缘化科学“生命科学中的微量元素”由此应运而生。本文就当前常规的食品微量元素的检验方法及其测定的重要性进行分析探讨。 一、原子荧光光谱法 每种元素的原子荧光强度都是特定的,根据此原理就可以检验出待测的元素含量。这种方法的特点是检测的灵敏度较高,实施过程中的干扰比较少,具有较宽的线性范围,并且能够将较多的元素放在一起同时检测分析。NaBH4与汞离子、SnCL2与汞离子都可以反应形成原子态的汞,在室温环境中能够被相互作用从而变成汞原子荧光,这种方式叫做冷原子荧光光谱法,也可以称作冷蒸汽法。因为AFS的测定方法对检验汞的敏感程度较高,所以在分析样品汞含量的时候通常较多的运用冷原子荧光与无焰、有焰HG-AFG这几种测定方式。如果想要检验大米当中的汞元素就可以使用原子荧光光谱法,它是通过微波加热的方式使样品在温度较高和压力较大的环境下消解样品。同时也可以利用此方法检验锗这一微量元素,它多存在于保健食品当中。可以研究酸介质和氢氧化物等因素对检验所产生的影响。把仪器最适
骨代谢标志物和钙磷镁在胫腓骨骨折愈合过程中的表达 发表时间:2019-03-11T15:29:52.850Z 来源:《医师在线》2018年9月17期作者:张峰巫娟张红梅[导读] 探讨骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶及无机盐等骨代谢标志物在胫腓骨骨折愈合过程中的表达水平。方法:选取2015年-2017年我院收治的胫腓骨骨折患者19例,入院第二天采空腹血,检测骨代谢标志物。然后分别在入院四天、一周、两周时采血检测。将数据进行统计分析。 骨代谢标志物和钙磷镁在胫腓骨骨折愈合过程中的表达 张峰巫娟张红梅 (四川省骨科医院;四川成都 610041) 【摘要】目的:探讨骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶及无机盐等骨代谢标志物在胫腓骨骨折愈合过程中的表达水平。方法:选取2015年-2017年我院收治的胫腓骨骨折患者19例,入院第二天采空腹血,检测骨代谢标志物。然后分别在入院四天、一周、两周时采血检测。将数据进行统计分析。结果:治疗后,所有患者的骨代谢标志物均升高,骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶均在第二周达到峰值,钙磷镁无显著变化(p>0.05)。结论:骨代谢标志物在胫腓骨骨折愈合过程中持续升高,在第二周达到峰值,变化显著(p <0.05),无机盐无显著变化(p>0.05),各种标志物浓度变化具有规律性,为以后进一步研究骨代谢标志物在创伤性骨折中的应用打基础。 【关键词】骨钙素;I型胶原交联C末端肽;骨碱性磷酸酶;钙磷镁;胫腓骨;骨折;愈合[ 中图分类号 ]R2 [ 文献标号 ]A [ 文章编号 ]2095-7165(2018)17-0358-01 骨折大多数由创伤引起,称为创伤性骨折,其它的可由骨骼疾病所致,包括骨髓炎、骨肿瘤所致骨骼破坏,受轻微外力即发生骨折,称为病理性骨折[1]。随着人们生活水平的提高和生产生活的需要,利用交通工具出行越来越多,随之而来的创伤性骨折的发生几率也随之增大。其中胫腓骨骨折的发生率较高。 以往骨代谢标志检测主要用于骨质疏松的诊断和疗效判断。本课题通过研究胫腓骨骨折愈合过程中,骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶及无机盐在患者血清中的表达水平,为以后进一步研究骨代谢标志物在创伤性骨折中的应用,以及在骨折风险评估和预后判断中的应用做基础,现报道如下。 1.资料与方法 1.1一般资料 选取2015年-2017年我院收治的胫腓骨骨折患者19例,所有患者均符合胫腓骨骨折的诊断标准[2];结合患者的病史、医学影像学手段以及临床表现等确诊;所有患者及家属均知情同意本研究,同时得到医院伦理委员会的批准。患者年龄为3-77岁,平均年龄为(35±10.5)岁。 1.2方法 所有患者入院第二天采空腹血,检测骨代谢标志物。然后分别在入院四天、一周、两周时采血检测,将数据进行统计分析。期间对所有患者采用胫腓骨骨折的常规治疗处理。 1.3观察指标 本研究的观测指标包括骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶及无机盐。 1.4统计学方法 检测数据用SPSS18.0分析,用((x±s)表示,采用t检验,P<0.05为有统计学意义。 2结果 2.1所有患者治疗后骨代谢标志物的比较分析 经过治疗后,所有患者的骨代谢标志物均升高,骨钙素、I型胶原交联C末端肽、骨碱性磷酸酶均在第二周达到峰值,具体见表1。 2.2所有患者治疗后无机盐的分析比较 所有患者治疗后无机盐的水平变化不显著(p>0.05),具体见表2. 3.讨论
主治医师 (临床医学检验学)-钙、磷、镁代谢与微量 元素 1、初步诊断 A.佝偻病 B.脚气病 C.缺铁症 D.缺锰症 E.缺锌症 2、治疗原则是 A.补锌 B.补锰 C.补钙及维生素D D.补铁 E.增加蛋白质饮食 3、表明该患者是 A.高钙血症 B.高钾血症 C.低钾血症 D.低钙血症
E.电解质正常 4、钙检测采用偶氮砷Ⅲ法,此方法检测的是 A.离子钙 B.结合钙 C.总钙 D.部分结合钙 E.以上都不是 5、该患者钙浓度1.68mmol/L的原因是 A.甲状旁腺功能亢进 B.血浆蛋白降低 C.维生素D中毒 D.脱水 E.肾功能不全 6、与克山病有关的是 A.碘 B.硒 C.铜 D.铁 E.汞
7、与水俣病有关的是 A.碘 B.硒 C.铜 D.铁 E.汞 8、与血红蛋白沉着有关的是 A.碘 B.硒 C.铜 D.铁 E.汞 9、与Wilson病有关的是 A.碘 B.硒 C.铜 D.铁 E.汞
10、与呆小症有关的是 A.碘 B.硒 C.铜 D.铁 E.汞 11、慢性肾衰时导致低钙血症的主要原因是 A.血磷升高 B.继发性甲状旁腺功能亢进 C.PTH分泌增加 D.血钙、磷乘积升高 E.肾组织不能生成1,25-(OH)D 12、PTH的作用是 A.成骨作用、升高血钙 B.促进钙磷重吸收 C.升高血钙、降低血磷 D.促进肠管对磷的重吸收 E.促进钙磷排泄 13、维生素D缺乏可见
A.血钙增高、血磷降低 B.血磷增高 C.血钙和血磷同时增高 D.血钙和血磷同时降低 E.血钙降低、血磷增高 14、人体内调节血钙和钙离子水平的主要器官是 A.肠、骨和肾 B.肝、骨和肾 C.肠、骨和肝 D.肠、肝和肾 E.胃、骨和肾 15、甲状旁腺素的主要功能在于升高血钙和降低血磷,其发挥作用的靶器官主要是 A.骨、肾上腺和小肠 B.骨、肾小管和小肠 C.骨、肝和小肠 D.肝、肾上腺和小肠 E.肝、肾上腺和骨 16、以下情况中一般不会引发低镁血症的是
第七章钙、磷、镁代谢与微量元素 本章考点 1.钙、磷、镁代谢 (1)钙、磷、镁的生理功能掌握 (2)钙、磷、镁代谢及其调节掌握 (3)钙、磷、镁测定的临床意义及方法评价熟练掌握 2.微量元素熟悉 (1)微量元素分布及生理功能 (2)锌、铜、硒、铬、钴、锰、氟、碘的生理作用与代谢 (3)微量元素与疾病的关系 钙盐和磷酸盐是人体含量最高的无机盐。 99%以上的钙和86%以上的磷以羟磷灰石的形式构成骨盐,和胶原纤维结合在一起使骨牙组织具有特殊的硬度和韧性。 一、钙、磷、镁代谢 (一)钙、磷、镁的代谢及调节 1.钙、磷、镁的代谢 (1)钙: 吸收部位:十二指肠,是在活性D3调节下的主动吸收。 影响吸收的因素: ①肠道的pH:偏酸时促进吸收。 ②食物成分:食物中草酸和植酸可以和钙形成不溶性盐,影响吸收。食物中钙、磷比例对钙吸收也有一定的影响。 Ca2+:P3+=2:1时,吸收最佳。 排泄: 钙主要由肠道排出,其次是肾脏排出。 肾小球滤过钙约10g/天,由尿中排出的仅约150mg/天,大部分被肾小管重吸收了。 尿钙排出量直接受血钙浓度影响,血钙低于2.4mmol/L时,尿中几乎无钙排出。 (2)磷: 食物中磷以有机磷酸酯和磷脂为主,在肠管内磷酸酶的作用下被分解为无机磷被吸收。 由于吸收不良引起的缺磷现象较少见。 磷主要由肾排泄,其排出量约占总排出量的70%,每天经肾小球滤过磷约5g,但85%~95%被肾小管回吸收。 (3)镁: 镁的日摄入量约250mg,其中2/3来自于谷物和蔬菜。 吸收:部位主要在回肠,是主动运转过程。 消化液中也有多量镁,长期丢失消化液(如消化道造瘘)是缺镁的主要原因。 排泄:主要是肾。 经肾小球滤过的镁大量被肾小管回吸收,仅2%~5%由尿排出,每日排出约100mg。 2.钙磷代谢的调节 调节钙磷代谢的因素有三个:甲状旁腺激素、降钙素和活性维生素D。 (1)甲状旁腺激素(PTH) 由甲状旁腺分泌,是维持血钙正常水平最重要的调节因素,有升高血钙、降低血磷和酸化血液等作用。
四川农业大学 第二届化学实验技能大赛 实验方案 作者:*** 2012年11月
鸡蛋壳中钙和镁含量的测定 1.前言 钙除了是骨骼发育的基本原料,直接影响身高外,还在体内具有其它重要的生理功能,这些功能对维护机体的健康,保证正常生长发育的顺利进行具有重要作用。镁是一种参与生物体正常生命活动及新陈代谢过程必不可少的元素,影响细胞的多种生物功能,还参与维持基因组的稳定性,并与机体氧化应激和肿瘤发生有关。 鸡蛋是一种深受人们喜爱的食品,然而,蛋壳大多作为废物被抛弃。而鸡蛋壳的主要成分为CaCO 3,其次为MgCO 3、蛋白质、色素以及少量Fe 和Al。近代科学实验证明,鸡蛋壳乃是非常有用的宝贵资源。实际上,我们若能运用化学知识将它变废为宝,既能减少环境污染,又能谋取利益。2.摘要 在生活中蛋壳大多作为废物被抛弃,但我们若能运用化学知识将它变废为宝,又能谋取利益,进而让我们意识到环境保护及充分利用资源的重要性。测定蛋壳中钙镁含量的方法包括:配位滴定法、酸碱滴定法、高锰酸钾滴定法、原子吸收法等,本实验采用配位滴定法中EDTA 直接滴定法进行测定,通过控制溶液的pH,在不同的pH 值下,钙镁离沉淀能力的大小,指示剂配合物的变色,及与EDTA 1:1结合生成不同的配合物,先测定出钙的百分含量,由消耗EDTA 标准溶液的体积关系进而计算出镁的百分含量。3.关键词:鸡蛋壳;钙和镁含量;配合滴定4.实验目的 (1)巩固掌握配合滴定分析的方法与原理,学习使用配合掩蔽剂排除干扰离子影响的方法。(2)训练对实物试样中某组分含量测定的一般步骤,提高思考水平和独立完成实验的能力。(3)通过对蛋壳钙和镁含量的测定,让我们意识到环境保护及充分利用资源的重要性。5.实验原理 鸡蛋壳的主要成分为CaCO 3,其次为MgCO 3、蛋白质、色素以及少量Fe 和Al。由于试样中含酸性不容物较少,可用HCl 溶液将其溶解制成试液,采用配位滴定法中直接滴定法测定钙、镁的含量。 试样经溶解后,Ca 2+ 、Mg 2+ 共存于溶液中。调节pH≈10,用EDTA 滴定Ca 2+ 、Mg 2+ 总量,此时Ca 2+ 、Mg 2+ 均与EDTA 形成1:1配合物。 Ca 2+ +H 2Y 2-?CaY 2-+2H + Mg 2+ +H 2Y 2-?MgY 2-+2H + 滴定时以铬黑T 作指示剂,在pH≈10的缓冲溶液中指示剂与Ca 2+、Mg 2+ 生成紫红色配合物,当用EDTA 滴定到化学计量点时,游离出指示剂后溶液显纯蓝色。 另取一份试剂,调节pH≈12,此时Mg 2+生成Mg(OH)2沉淀,故可以用EDTA单独滴定Ca 2+ ,且当用
食品理化检验质量控制与微量元素检验方法 食品理化检验应做好实验环境、实验设备、实验用具及清洗、实验用水和试剂等基础质量控制,标准溶液配制标定和物品称量等操作过程中质量控制,选择合适的分析方法、常规质量控制、滴定样品和绘制标准曲线等分析过程中质量控制和检验分析后质量控制。相关部门要认识到食品理化检验的重要性,按照正确检验流程和方法对样品进行检验,不断提高食品理化检验结果的精确度,最大程度降低食品安全隐患。 标签:食品检验;理化检验;质量控制;检验方法 食品理化检验和微量元素检验能够保障食品安全和使用者身心健康。检验人员要严格控制食品检验过程,按照标准要求设定实验环境、检验仪器和设备,进而选择正确的方法得出准确的检验结果。检验人员在检验过程中要具备食品安全意识,重视检验质量控制,确保检验结果的准确性。 1 食品理化检验的质量控制 1.1 基础质量控制 1.1.1 实验环境检验人员要根据食品理化检验的实际需要,合理布置实验室,避免不合理检验过程导致交叉感染,获得不准确检验结果。实验过程中要将不同的实验设备置于特定环境中,保持室内和周围环境整洁,并结合实验设定实验室内的温度、湿度等微小气候条件[1]。 1.1.2 实验设备检验人员要依据要求选择和准备实验仪器设备,保证仪器各项性能良好,设备误差在允许范围内。要定期检验实验设备,确保试验过程中涉及到设备正常运转,避免产生实验误差。应用原子吸收分光光度计等精密设备前,检验人员要经过专业培训,具有相关应用经验,避免不合理操作对实验设备或实验结果造成影响。要对大型实验仪器设备操作过程记录,定期检查、保养和维护实验设备。 1.1.3 实验用具及清洗要选用标准型号玻璃量杯和试管等实验用具。按照正确的清洗流程清洗实验用具,避免实验过程中污染和交叉感染的发生。 1.1.4 实验用水和试剂实验用水和试剂配比会直接影响实验结果。操作人员要结合实验要求选择实验用水和试剂,确保其纯度和合理配比。 1.2 操作过程中质量控制 1.2.1 标准溶液配制和标定检验人员称量试剂(误差控制在1%之内)后应根据称量结果配制标准溶液,之后按照正确的操作流程和方法标定浓度,进而计算浓度值。时间是标准溶液浓度影响因素。配制标准溶液后,要避免放置时间过
第十二章钙、磷、镁和微量元素检验 第一节概述 一、钙、磷代谢及调节 (一)含量与分布 钙是体内含量最多的无机盐,占体重的1.5%~2%,总量约700~1400g,其次是磷,占体重0.8%~1.2%,总量约400~800g。 99%以上的钙和86%以上的磷是以羟磷灰石形式沉积于骨、牙。 (二)吸收与排泄 吸收:在pH较低的小肠上段,钙的吸收率随年龄的增长而降低,每增加10岁减少5%~10%,婴儿吸收率可达50%以上,儿童40%,成人20%左右,故老人易发生骨质疏松症。 磷的吸收率约70%,低磷时可达90%。 排泄:主要通过肠道和肾脏。 钙:80% 肠道20% 肾脏 磷:30% 肠道70% 肾脏 (三)血钙与血磷 血液中钙几乎全部存在于血浆,正常血清钙2.25~2.75mmol/L(9~11mg/dl)。 血钙存在形式柠檬酸钙 碳酸氢钙 蛋白结合钙非扩散钙发挥生理作用的是离子钙,但临床实验室测定的大多数是总钙。 血磷是指血液中的无机磷酸盐(HPO42-、H2PO4-)正常人血清无机磷0.97~1.61mmol/L(3~5mg/dl),儿童稍高。 [Ca] ×[P] = 35~40 大于40骨盐沉积,有利于骨钙化。小于35骨盐溶解。 (四)钙、磷生理功能 钙:1.参与血液凝固。 2.参与肌肉收缩。
3.维持神经肌肉应激性。 4.作为第二信使。 磷:1.作为核酸、磷脂、磷蛋白合成的原料。 2.参与高能磷酸化合物的合成。 3.构成核苷酸辅酶。 4.构成磷酸盐缓冲对。 (五)钙、磷代谢调节 1.维生素D 3(VitD 3) D 3—————→25-OH D 3—————→1,25-(OH )2 D 3 促进肠道对钙、磷的吸收;促进肾小管对钙、磷的重吸收;协同PTH 促进骨重建。 2.甲状旁腺素(PTH ) 甲状旁腺主细胞分泌的84肽。促进溶骨作用,促进间充质细胞转化成破骨细胞,抑制破骨细胞转化为成骨细胞;促进肾小管对钙的重吸收,抑制磷的重吸收。 3.降钙素(CT ) 甲状腺滤泡旁细胞分泌的32肽,与PTH 拮抗。促进成骨作用,抑制间充质细胞转化为破骨细胞,促进破骨细胞转化为成骨细胞;抑制肾小管对钙、磷的重吸收。 PTH 间充质细胞————→破骨细胞————→成骨细胞 CT 二、镁代谢和生理功能 (一)镁代谢 1.镁的含量与分布 占体重的0.03%,正常成人镁的总量20~28g ,其中60%存在于骨骼,20%~30%存在于骨骼肌,其余10%存在于其它组织中。体液中细胞内液镁的含量占总量的39%,而细胞外液仅占1%。 2.血镁 血浆镁的浓度约0.67~1.23mmol/L ,存在形式主要有三种: 离子镁 55% 血镁 碳酸氢镁、柠檬酸镁、磷酸镁等 15% 蛋白结合镁 30% 发挥生理作用的是离子镁。 3.吸收与排泄 食物镁含量丰富,人体每天需要量300~350mg ,镁的吸收主要在小肠,吸收率只有30%~40%,吸收率与肠腔中镁的含量成反比。体内镁1-羟化酶 肾 肝 25-羟化㈠ ㈩ ㈩ ㈠
火焰原子吸收光谱法测定自来水中的铬 一、实验目的 1.学习原子吸收分光光度法的基本原理; 2.了解原子吸收分光光度法的基本构造及其作用; 3.掌握原子吸收光谱标准曲线法测定自来水中的铬的原理和方法。 二、实验原理 原子吸收光谱法是基于待测元素的原子蒸汽对待测元素空心阴极灯发射的特征波长光的吸收作用而建立起来的分析方法。吸光度与待测元素浓度的关系遵循朗伯-比尔定律,即A=lg(I0/I)=KLc。 原子吸收光谱仪的光路图: 光信号源—试样系统—波长选择—分析信号转换—分析信号处理输出 三、实验仪器及试剂 原子吸收光谱仪,空心阴极灯(铬空心阴极灯),无油空气压缩机,乙炔钢瓶,铬标准溶液、未知样—自来水中的铬 四、实验内容及数据处理 打开无油空气压缩机,再开乙炔钢瓶阀,然后打开减压阀,最后再将电脑工作站和原子吸收光谱仪连接起来,准备测定。 (一)标准曲线法测定自来水中的铬 1.设置原子吸收实验条件 吸收波长:理论上为357.9nm,但本次实验实际用的波长为422.15nm 灯电流:6mA 狭缝宽度:0.2nm 空气流量:8 L/min 乙炔流量:2.2 L/min 燃烧器高度:7mm 2.仪器稳定,用蒸馏水清洗雾化器吸液管并作空白溶液扣除背景,将雾化器吸液管依次插入0.05、 0.1、0.2、1.0、2.0、4.0、6.0μg/ml浓度标准系列溶液的容量瓶中,测定系列溶液的吸光度。然后, 用蒸馏水清洗雾化器吸液管,再测定自来水样品的吸光度。 3
A c /μg 由上可知,当y=0.8032时,x=19.7923,即测定自来水中钙的浓度为19.7923μg/ml。 (二)标准加入法测定自来水中的镁 1.设置的原子吸收实验条件 吸收波长:理论上为284.2nm,但本次实验实际用的波长为284.57nm 灯电流:6mA 狭缝宽度:0.2nm 空气流量:8 L/min 乙炔流量:1.8 L/min 燃烧器高度:7mm 2.仪器稳定,用蒸馏水清洗雾化器吸液管并作空白溶液扣除背景,将雾化器吸液管依次插入0.2、 0.3、0.4μg/ml浓度标准系列溶液的容量瓶中,测定系列溶液的吸光度。 3 A C/ μg/mL 当y=0时,x=-0.1157,因实验已将原待测浓度稀释了100倍,故测定自来水中镁的浓度为11.57μg/ml。
FHZDZTR0033 土壤 交换性钙和镁的测定 容量法 F-HZ-DZ-TR-0033 土壤—交换性钙和镁的测定—容量法 1 范围 本方法适用于酸性和中性土壤交换性钙和镁的测定。石灰性土壤是盐基饱和的土壤,目前无合适的测定方法。 2 原理 酸性和中性土壤中的交换性钙和镁,采用乙酸铵溶液交换,交换浸出液蒸干后,用盐酸溶解残渣,EDTA 容量法测定浸出液中的钙、镁量,即得土壤中交换性钙和镁的量。 3 试剂 3.1 缓冲溶液:称取67.5g 氯化铵,溶于无二氧化碳水中,加入新开瓶的氢氧化铵(ρ0.90g/mL )570 mL ,用无二氧化碳水稀释至1000mL ,贮于塑料瓶中,并防止吸入空气中的二氧化碳,缓冲溶液pH10。 3.2 酸性铬蓝K-萘酚绿B 混合指示剂:称取0.5g 酸性铬蓝K 和1.0g 萘酚绿B ,与100g 于105℃烘过的氯化钠相互研细磨匀,贮于棕色瓶中。 3.3 EDTA 标准溶液:0.0100mol/L ,称取已在80℃烘干2h 的乙二胺四乙酸二钠3.7225g (EDTA ,Na 2H 2C 10H 12O 2N 2·2H 2O ) ,精确至0.0001g ,溶于1000mL 水中。 3.4 氢氧化钠溶液:2mol/L ,称取8.0g 氢氧化钠,溶于100mL 无二氧化碳水中。 3.5 盐酸溶液,1+3。 3.6 氢氧化铵,1+1。 4 仪器 4.1 烧杯,200mL 。 5 操作步骤 5.1 吸取两份25.00mL 乙酸铵处理土样的浸出液(F-HZ-DZ-TR-0029乙酸交换法测定阳离子交换量5.1~5.2),分别置于200mL 烧杯中,低温蒸干。向蒸干的烧杯中加入3滴~5滴盐酸溶液(1+3)溶解残渣,并加入少量水擦洗烧杯内壁,再加水使溶液总体积控制在40mL 左右。 5.2 钙、镁合量的测定:取一份溶液,用氢氧化铵(1+1)中和至中性(pH 试剂检查),加入3.5mL 缓冲溶液,再加约0.1g 酸性铬蓝K-萘酚绿B 混合指示剂,用EDTA 标准溶液滴定至纯蓝色为终点。同时做空白试验。 5.3 钙量的测定:取另一份溶液,用氢氧化钠溶液(2mol/L )调节至pH12,加入0.1g 酸性铬蓝K-萘酚绿B 混合指示剂,用EDTA 标准溶液滴定至纯蓝色为终点。同时做空白试验。 注:如乙酸铵浸出液中有漂浮的枯枝落叶等粗有机质,应先过滤后进行测定。否则这些有机质中的钙、镁经蒸干后加 盐酸溶解时,也被溶解进入溶液中,影响交换性钙和镁的测定结果。 6 结果计算 土壤交换性钙按(1)式计算,交换性镁按(2)式计算: E (1/2Ca 2+)=100010 2)(42××××××?K m t C V V ……(1) E (1/2Mg 2+)=100010 2)]()[(4231××××××???K m t C V V V V ……(2) 式中: E (1/2Ca 2+)——交换性钙量,c mol/kg ; E (1/2Mg 2+)——交换性镁量,c mol/kg ;
水的总硬度,在每一个地方的变化都不一样。一般来说,海水比淡水硬,表面水比地下水软。不过就相似的水域来说,水的硬度和自然的地质有关。尤其是处于石灰岩的地质环境中的水域,它的总硬度常常比其他地区要高。引起硬度的离子除了钙和镁之外,象锶、锰、铁、铝等阳离子也是肇因之一,只不过它们的含量与钙、镁相较极少,因而常常忽略不计。 硬度常以CaCo3(分子量=100)的当量来表示,并以水质中含1ppmCaCo3为1度。计算硬度时,通常引起硬度的离子可用下列公式计算: 硬度(ppmCaCo3)=M2+(ppm)×100/M2+的当量(公式中的M2+代表任一的二价金属离子)例如,若水质中含有10ppm的镁离子(Mg2+),以及15ppm的钙离子(Ca2+),则它的总硬度值计算如下:总硬度=镁硬度+钙硬度镁硬度=10ppm×100/24.4=41.0ppm 钙硬度=15ppm×100/40.0=37.5ppm 总硬度=41.0ppm+37.5ppm=78.5ppm(计算公式中的24.4为镁的当量重,40.0为钙的当量重)■德国硬度表示法(gH)是以氧化钙的当量来表示溶于定量水质中所有可溶性钙和镁离子的方法。1度gH相当于每100ml水中含有磷化钙的当量为1毫克(10ppm)。1度gH也相当于CaCo3硬度17.8ppm。■kH硬度kH硬度是碳酸氢根(HCO3-)浓度的度标,因为碳酸氢根是水质中最主要的缓冲物质,它可以中和水质中任何增加或减少的游离CO2,以及亦能抑制氢离子的波动,以维持恒定的pH值,因此kH的控制被视为水质管理不可缺的手续。如果KH过低,表示水中天然的缓冲系统已经失去平衡,水质将趋酸性化,很容易受到中酸性物质的影响,使pH 值急遽降低。反之如果kH过高,水质将趋碱性化,很容易受到中碱性物质的影响,使pH 值急遽升高。这些现象势必对水族生物生长产生不良反应。kH硬度完全针对水质中的阴离子(HCO3-)含量的表示法,这种表示法是以100ml水中含有1毫克的HCO3-称为1度(相当于10ppm浓度),并标记为1度kH。它与CaCo3硬度完全针对水质中的阳离子(Mg2+、Ca2+)含量表示法完全不同。至于kH硬度要多少才适当?这个问题并没有一