
机密 第 1 页 2014-4-21-liuyu
实验 5 对甲基苯乙酮的制备
一、实验目的
1.学习傅—克酰基化制备芳香酮的方法和原理
2.掌握基本操作:
①带干燥管和吸收有害气体回流装置
②搅拌装置——电磁搅拌
③分液漏斗分离洗涤、萃取
④学习无水回流反应操作,进一步掌握蒸馏和气体吸收操作
二、实验原理
苯大大过量,既是反应物,又是溶剂;
本反应是放热反应,应注意乙酐的滴加速度,使反应平稳进行; 所用催化剂比其它反应所用催化剂都过量:
AlCl 3/Ac 2O=2.2
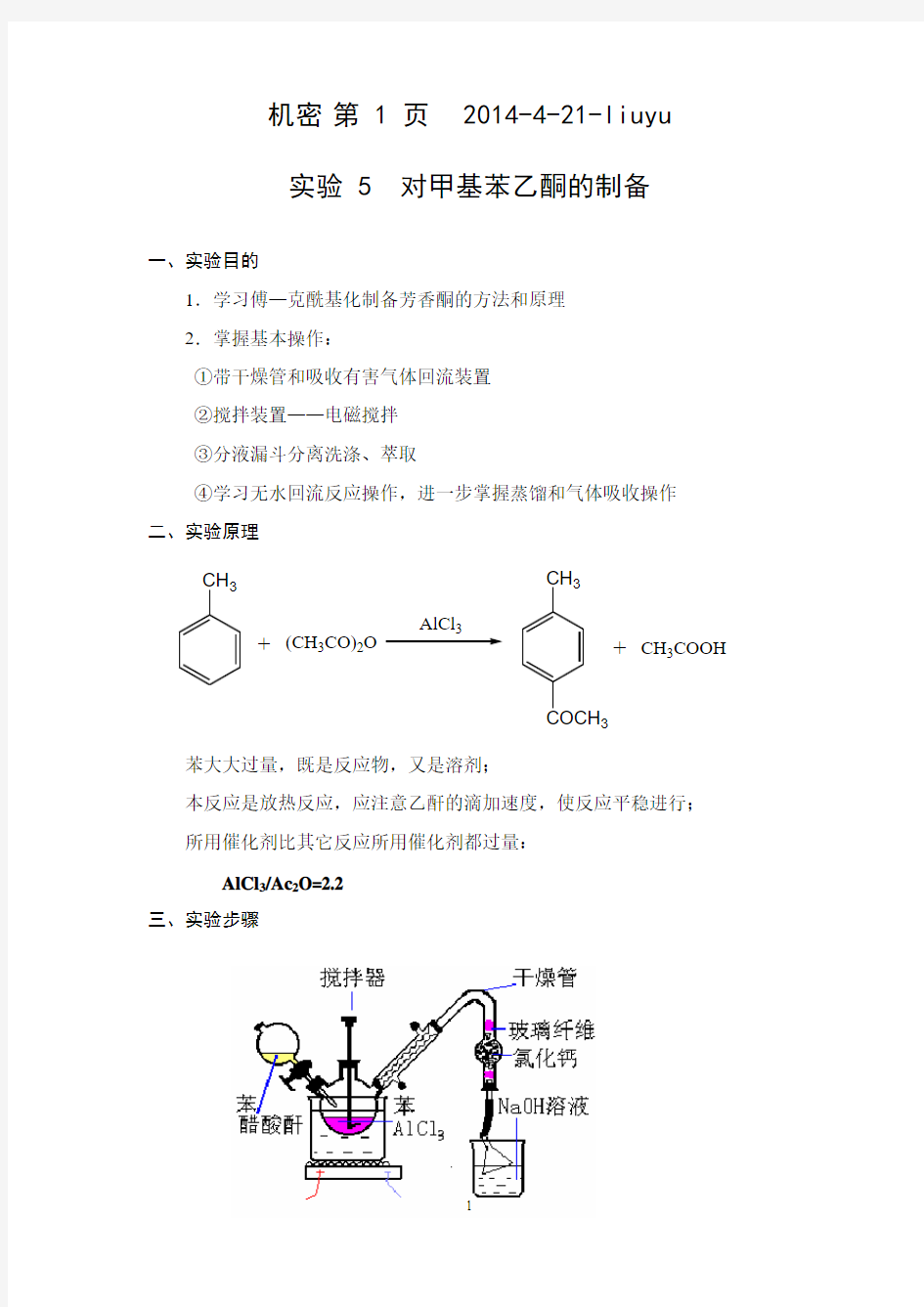
三、实验步骤
CH 3CH 3(CH 3CO)2O AlCl 33CH 3COOH
++
2、实验步骤
在分别装有恒压滴液漏斗,球形冷凝管的100 mL的三颈瓶中(冷凝管上端装一氯化钙干燥管,干燥管再与氯化氢气体吸收装置相连)。迅速称取10 g 经研细的无水三氯化铝加入三颈瓶中,再加入25mL 无水甲苯,在搅拌下自滴液漏斗慢慢滴加3mL 的新蒸乙酸酐和3 mL 无水甲苯的混合液(先加几滴,待反应发生后再继续滴加),控制滴加速度勿使反应过于激烈,以三颈瓶稍热为宜(60 ℃)。边滴加边搅拌,约10-15min 滴加完毕。加完后,在沸水浴上(90-95 ℃)回流15-20min,直至不再有氯化氢气体逸出为止。
将反应物冷至室温,在搅拌下将反应物倒入盛有15mL 浓盐酸和20g 碎冰的烧杯中进行分解(在通风橱中进行)。当固体完全溶解后,将混合物转入分液漏斗,分出有机层,水层每次用20 mL 甲苯萃取两次(10-1)。合并有机层和甲苯萃取液,依次用等体积(10 mL)的10%氢氧化钠溶液和(10 mL)水洗涤一次,用无水硫酸镁干燥。将干燥后的粗产物先在水浴上蒸去甲苯,当温度上升至140℃左右时,停止加热,减压蒸馏,收集〖?〗℃馏分,产量约?g。
有机层粗产物水层
次(4ml/次)
合并苯层水层
碱洗
水洗
水层有机层
(弃去)
无水硫酸镁干燥
澄清有机层
蒸馏回收溶剂苯
改用空气冷凝管蒸馏
收集195~202℃馏分
称量(无色透明油状液体)
四、实验注意事项:
①装置仪器和试剂应无水,否则反应失败;
②滴加乙酐时应控制速度,使反应平稳进行;
③注意反应终点和反应混合物处理时一定在通风橱内进行。
四、注意事项
1 反应装置要干燥,以免AlCl3吸水,无水三氯化铝的质量是本实验成败的关键,以白色粉末
打开盖冒大量的烟,无结块现象为好。若大部分变黄则表明已水解,不可用。
2 AlCl
3 要研碎,速度要快。
3 经老师检查后,方能开动搅拌装置。
4 加入稀HCl时,开始慢滴,后渐快;稀HCl(1:1,已配)用量约为140ml。
5 吸收装置:约20%氢氧化钠溶液,自配,200mL,特别注意防止倒吸。
6、滴加苯乙酮和乙酐混合物的时间以10min 为宜,滴的太快温度不易控制。
7、苯以分析纯为佳,最好用纳丝干燥24小时以上再用。
8、粗产物中的少量水,在蒸馏时与苯以共沸物形式蒸出,其共沸点为69.4℃,
这是液体化合物的干燥方法之一.
五、六、问题与讨论
1、水和潮气对本实验有何影响?在仪器装置和操作中应注意哪些事项?为什么要迅速称取
无水三氯铝?
2、反应完成后为什么要加入浓盐酸和冰水的混合物?
3、在烷基化和酰基化反应中,三氯化铝的用量有何不同?为什么?
4、下列试剂在无水三氯化铝存在下相互作用,应得到什么产物?
①过量苯+ClCH2CH2Cl;②氯苯和丙酸酐;
③甲苯和邻苯二甲酸酐;④溴苯和乙酸酐。
科研探索 知识创新 与。对羟基苯乙酮在医药、农药、 染料、液晶材料等领域具有重要的应用价值 。 不同生产方法的主要区别在第二步。 方法1:苯酚和乙酐加氯化锌在一定温度下反应,经柱层析可得到对位异构体40%,邻位异构体38%;此方法得率较高, 但反应时间较长,且生成的邻位取代物较多。 方法2:采用三氯化铝——氯化钠复盐作催化剂 合成了对羟 基苯乙酮,收率58.5%纯度98.68%。 综上,我们采用方法3,即以苯酚和乙酐为原料,先进行酯化反应,再通过三氯化铝催化Fries 重排得到产物对羟基苯乙酮,并对酯化反应是否添加催化剂与第二步重排的最佳反应条件进行探究。此方法催化剂易得,产率较高,纯度经精制后很高,是可行的合成方法。3实验 3.1乙酸苯酯的合成 将一定比例的苯酚和已酐混合后加入到50mL 圆底烧瓶中,加入3滴浓硫酸,加热回流一定时间,反应结束后,将反应液冷却至室温,用蒸馏水洗涤至PH 值为6~7,分去水层,保留有机层,用无水硫酸镁干燥后,常压蒸馏,收集190~194℃的馏分,测折光率分析产品。3.2对羟基苯乙酮的合成 在烘干的装有电动搅拌器、温度计、和上部带有干燥管的冷凝管的三口烧瓶中加入一定量的乙酸苯酯和溶剂A ,在剧烈 搅拌下分三次加入一定量的无水三氯化铝,加完后开始加热使反应温度保持在t ℃左右反应一定时间,停止加热。搅拌下加入一定量的水分解多余的无水三氯化铝。将反应液进行水蒸气蒸馏至澄清,将其转移到敞开容器中,冷却至室温后加入 一定量的一定浓度的稀盐酸,至PH 值为1~2。冰盐浴冷却到-2℃析出白色晶体,过滤得对羟基苯乙酮粗品,干燥称重。将粗品转移至小烧杯中加入一定量的水,水浴加热,分去油层后冰盐浴冷却,过滤得白色针状晶体,再次称重,测熔点和红外。 3.3实验结果与讨论 3.3.1反应时间对乙酸苯酯收率的影响 采用酐醇摩尔比1.2,改变反应时间,当回流时间为2h 时, 产率为46.04%,2.5h 时,产率为60.95%,3h 时,产率为67.7%。可见,随着反应时间相对减少,收率逐渐降低。其原因可能是反应时间过短,反应不完全,反应时间过长,逆反应进行程度较大。 3.3.2反应温度对对羟基苯乙酮收率的影响 采用乙酸苯酯、氯苯、催化剂无水三氯化铝摩尔比1:1.2:1.1,改变反应温度,结果表示,随温度升高,对羟基苯乙酮的收率先增加后减少,在70℃时收率最高,大致成抛物线型变化。在相对较低的温度下, 随着温度的升高,单位体积内反应物的活化分子数增多,从而增加了单位时间内单位体积内反应物 分子的有效碰撞的频率,导致反应速率增大
对甲苯乙酮的制备 作者:xxx 学号:xxx 摘要:以甲苯和乙酸酐为原料,无水氯化铝为催化剂,制备对甲基苯乙酮。在实验过程中,要求掌握实验室中利用Friedel Crafts酰基化制备对甲基苯乙酮的原理和方法。同时要求掌握带有气体吸收装置的加热回流等基本操作,学会控制无水的反应条件。 关键词:对甲苯乙酮、傅克酰基化反应、乙酸酐、尾气吸收 The preparation of toluene Acetophenone Author: xxx Number: xxx Abstract: Toluene and acetic anhydride is as raw materials,Anhydrous aluminium chloride is as catalyst to preparate for methyl acetophenone. In the experimental process, we require to master the principle and method of preparing methyl acetophenone using Friedel Crafts acyl laboratory. At the same time,we require to master with gas absorption heating reflux device and other basic operations,to learn to control the anhydrous reaction conditions. Keywords: absorption of toluene acetophenone, Friedel Crafts acylation reaction,acetic anhydride, tail gas 对甲基苯乙酮为无色略带黄色的透明液体,在稍低的温度下凝固,具有山楂子花的芳香及紫苜蓿、蜂蜜和香豆素的香味,且香气较苯乙酮较为柔和,极度稀释后有及草莓似的甜香味。对甲基苯乙酮的沸点为226度,熔点为28度,密度为1.0051,折射率为1.5335,闪点为92度,易溶于乙醇、乙醚、氯仿和丙二醇等,几乎不溶于水和甘油。对甲基苯乙酮有毒,应避免吸入对甲基苯乙酮的蒸气,避免与眼睛、皮肤接触,其存在于烤烟烟叶、白肋烟烟叶、香料烟烟叶、烟气中。天然存在于可可、黑醋栗、玫瑰木油、巴西檀木油、西藏柏木油、芳樟油,以及含羞草中。制备对甲基苯乙酮主要是采用乙酰化法,以甲苯和醋酸酐为原料,在无水三氧化铝催化剂存在下,进行乙酰化反应,然后冰解、中和、水洗、分离、蒸馏而得。也可以从巴西檀香木、玫瑰木等天然原料中经精馏提取而得。对甲基苯乙酮常用于调和花精油,也用于香皂及草莓等水果味香料的制造。对甲基苯乙酮也常用于烘烤食品、糖果、布丁,可用于日化香精和食用香精的配方中。 1.结果与讨论 1.1.实验装置的选取
苯乙酮的特性、用途与生产工艺 概述: 苯乙酮,又称乙酰苯,沸点(℃):,相对密度(水=1):(20℃) ,相对蒸气密度(空气=1):,是最简单的芳香酮,其中芳核(苯环)直接与羰基相连。以游离状态存在于一些植物的香精油中。纯品为无色晶体。市售商品多为浅黄色油状液体。有像山楂的香气。微溶于水、易溶于多种有机溶剂,能与蒸气一同挥发。 苯乙酮分子结构:甲基C原子以sp3杂化轨道成键,苯环和羰基C原子以sp2杂化轨道成键。苯乙酮能发生羰基的加成反应、α活泼氢的反应,还可发生苯环上的亲电取代反应,主要生成间位产物。 苯乙酮可在三氯化铝催化下由苯与乙酰氯、乙酸酐或乙酸反应制取。另外,由乙苯催化氧化为苯乙烯时,苯乙酮为副产物。 苯乙酮主要用作制药及其他有机合成的原料,也用于配制香料。用于制香皂和香烟,也可用做纤维素醚,纤维素酯和树脂等的溶剂以及塑料的增塑剂,有催眠性。现在苯乙酮大多以异丙苯氧化制苯酚和丙酮的副产品获得,它还可由苯用乙酰氯乙酰化制得。 苯乙酮的制备: 【仪器及药品】 药品:乙酸酐苯硫酸镁盐酸氯化铝氢氧化钠 仪器:圆底烧瓶冷凝管滴液漏斗蒸馏装置干燥管搅拌装置 【操作步骤】 向装有10ml恒压滴液漏斗、机械搅拌装置和回流冷凝管(上端通过一氯化钙干燥管与氯化氢气体吸收装置相连)的100ml三颈烧瓶中迅速加入13g()粉状无水三氯化铝和16ml(约14g,无水苯。在搅拌下将4ml(约,)乙酐自滴液漏斗慢慢滴加到三颈烧瓶中(先加几滴,待反应发生后在继续滴加),控制乙酐的滴加速度以使三颈烧瓶稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。将反应混合物冷到室温,在搅拌下倒入18ml浓盐酸和30g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层(哪一层),水层用苯萃取两次(每次8ml)。合并有机层,依次用15ml10%氢氧化钠、15ml水洗涤,再用无水硫酸镁干燥。先在水浴上蒸馏回收苯,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管(为什么)蒸馏收集195~202℃馏分,产量约为(产率85%)。纯苯乙酮为无色透明油状液体。 【注意事项】 1,滴加苯乙酮和乙酐混合物的时间以10min为宜,滴的太快温度不易控
实验七对羟基苯乙酮的合成 一、实验目的 1、掌握Fries重排重排反应的基本原理。 2、熟悉减压蒸馏和水蒸汽蒸馏基本操作。 二、实验原理 醇与酸作用生成酯的反应称作酯化反应。酚类化合物虽然也能起酯化反应, 但比醇困难。这是因为酚中存在的p-π共轭效应,降低了氧周围的电子云密度, 使其亲核性比醇弱。所以酚不能直接与酸成酯,而要与酸酐或酰氯作用才能成酯。 酚酯化在三氯化铝存在下加热,酰基可重排到羟基的邻位或对位,称Fries重排。 通常在低温下易于生成对位异构体。 三、实验材料与设备 1、实验设备与仪器 电动搅拌器、水蒸气发生器、长颈圆底烧瓶、量筒、梨形分液漏斗、蒸馏瓶、直 型冷凝器、球形冷凝器、空气冷凝器、三角烧瓶、尾接管、三口瓶、烧瓶、温度 计。 2、实验材料与试剂 苯酚、醋酐、四氯化碳、硝基苯、氢氧化钠、碳酸氢钠、无水三氯化铝、盐 酸、氢氧化钾、无水硫酸镁、三氯甲烷、无水氯化钙。 四、实验操作步骤 1.乙酰苯酚的制备 取500mL长颈锥形瓶(没有就用500mL三颈瓶替代),加入23.5g苯酚,再加入160ml (10%)NaOH溶液,后加入175g碎冰,最后加入32.5g(30mL)醋酐,猛烈振摇反应容器5min,反应液乳化,生成乙酰苯酚,将混合液倾入500 mL分液漏斗中,加入10 mL CCl 4振摇,静置,分层。水层再用10ml CCl 萃取、合并。酯层用5%~10% NaHCO3 40 mL 4
溶液洗涤至pH7到8,酯层(即CCl 4层)置于250mL三角锥瓶中。用适量无水CaCl 2 约 6克干燥,不时地振摇约1h,然后滤至100 mL蒸馏烧瓶中,旋蒸除去CCl 4 ,然后减压蒸馏收集常压下192~197℃的馏分,称重,计算收率。(油浴开始加热,阶段梯度加热(10+10+5+5+5…℃,当油浴锅指示温度为115℃,温度计指示温度为74℃时开始有馏出液溜出;馏出液呈无色透明。) 2.对羟基苯乙酮的制备(Fries重排反应) 在烘干的装有转子、温度计100mL的三口烧瓶中加入乙酸苯酚10g,硝基苯 25mL,剧烈搅拌下分数次缓慢加入无水三氯化铝16g,加完后开始油浴加热回流 升温至60℃反应2h,停止加热,慢慢倾入到150g冰水中,并迅速搅拌。滴加 6mol/L的盐酸(36%的浓盐酸:水=1:1)酸化至pH1~2,用500mL分液漏斗分出 硝基苯层,用5%~10%KOH溶液中和至微酸性或中性,然后进行水蒸气蒸馏, 至硝基苯蒸净为止(约1h),水层用CHCl 3 提取三次(20mL、15mL、10mL),合并 CHCl 3 提取液置于100mL干燥的三角烧瓶中,加适量的无水硫酸钠干燥,摇匀后 放置约20min,滤除硫酸钠,蒸馏除净CHCl 3 后得粗品。(棕黄色) 3.精制 将对羟基苯乙酮粗品和20 倍量的蒸馏水加入反应瓶中加热至沸腾。分去油 层后添加少量活性炭, 在沸腾状态下脱色 15 m in, 趁热过滤得无色透明液体, 室温下静置, 冷却, 结晶后过滤, 真空干燥得白色针状结晶对羟基苯乙酮。(文 献熔点,对羟基苯乙酮的熔点108~111℃) 五、实验注意事项和该思考的问题 1、(以下为一位同学针对其中一个现象的分析,同学可以思考以下,是否正确) 以硝基苯作溶剂乙酰苯酚在无水三氯化铝的催化作用下进行Fries重排,得 到对羟基苯乙酮;反应液倒入冰水中后,使反应液的温度降低,三氯化铝水解生 成氢氧化铝,溶于水相,对羟基苯乙酮形成其铝盐也溶于水相,这时,反应液分 成三层,上层为水层,中间为絮状的氢氧化铝,下层为硝基苯层,反应液呈酸性, pH为3左右,这是由于三氯化铝水解和对羟基苯乙酮酚羟基上的氢离子电离; 用盐酸酸化至pH1~2,这时,对羟基苯乙酮酚羟基上的铝离子离去而得到氢离子, 不溶于水相而溶于硝基苯;用KOH溶液调pH至中性或微酸性,通过水蒸气蒸馏 出去有机溶剂硝基苯,水层用三氯甲烷(对羟基苯乙酮易溶于三氯甲烷)萃取,
对硝基-α-氨基苯乙酮盐酸盐的车间生 产工艺规程 目录 1.产品概述............................... 错误!未指定书签。 1.1化学名称.......................... 错误!未指定书签。 1.2产品化学结构...................... 错误!未指定书签。 1.3质量标准及检验方法................ 错误!未指定书签。 1.4临床用途:有机合成中间体,是制造合霉素和氯霉素等医药的 原料 ................................. 错误!未指定书签。 1.5包装规格要求及贮藏................ 错误!未指定书签。 2.设计原理............................... 错误!未指定书签。 2.1工艺路线选择...................... 错误!未指定书签。 2.2设备选型和材质选用................ 错误!未指定书签。 2.3设计范围.......................... 错误!未指定书签。
3.反应过程............................... 错误!未指定书签。 3.1反应机理.......................... 错误!未指定书签。4.生产方法及工艺规程.................... 错误!未指定书签。 4.1生产.............................. 错误!未指定书签。 4.1.1设计采用原料................. 错误!未指定书签。 4.1.2生产工艺路线................. 错误!未指定书签。 4.2化学反应式........................ 错误!未指定书签。 5.生产工艺工程........................... 错误!未指定书签。 5.1原料配比.......................... 错误!未指定书签。 5.2主要工艺条件及详细操作过程........ 错误!未指定书签。 5.3工艺过程简图...................... 错误!未指定书签。 5.4异常现象的处理和有关注意事项...... 错误!未指定书签。 5.5重点工艺控制点.................... 错误!未指定书签。6中间体和成品的质量标准和检查方法........ 错误!未指定书签。 6.1生产中间体控制项目................ 错误!未指定书签。 6.2?成品出厂质量标准.................. 错误!未指定书签。 7.主要设备选择........................... 错误!未指定书签。 7.1设备选型及选材.................... 错误!未指定书签。 7.1.1反应器的选择................. 错误!未指定书签。 7.1.2塔设备的选择................. 错误!未指定书签。 7.1.3换热器的选择................. 错误!未指定书签。 8.生产分析............................... 错误!未指定书签。
邻羟基苯乙酮项目技术调查报告 有机0911 朱耀 43 第一章产品及原料介绍 1.1 邻羟基苯乙酮 中文名称:2-羟基苯乙酮;1-(2-羟苯基)-乙酮;邻羟基苯乙酮;邻乙酰基苯酚;英文名称:1-(2-hydroxyphenyl)-Ethanone;o-hydroxy-acetophenon;1-(2-hydroxyphenyl)ethanone;;2'-hydroxy-acetophenon CAS: 118-93-4 ,分子式: C8H8O2 ,分子质量:136.15 ,沸点: 213℃,熔点: 4-6℃,性质描述: 浅绿至黄色油状液体。沸点 213℃/95.6kPa(717mmHg),106℃/2.3kPa(17mmHg),相对密度 1.131,折光率 1.5584,闪点98。 用途: 心律平的中间体。 结构式: 1.2苯酚 相对分子量或原子量94.11,密度1.071,熔点(℃)40.3,沸点(℃)182 ,折射率1.5425(41),毒性LD50(mg/kg) 大鼠经口530。 性状:无色或白色晶体,有特殊气味。在空气中因为被氧化而显粉红色 溶解情况:溶于乙醇、乙醚、氯仿、甘油、二硫化碳等。易溶于有机溶
液,常温下微溶于水,当温度高于65℃时,能跟水以任意比例互溶。 用途:用于制染料合成树脂、塑料、合成纤维和农药、水杨酸等。作外科消毒,消毒能力大小的标准(石炭酸系数)。 制备或来源:由煤焦油经分馏,由苯磺酸经碱熔。由氯苯经水解,由异丙苯经氧化重排。 其他:加热至65℃以上时能溶于水(在室温下,在水中的溶解度是9.3g,当温度高于65℃时能与水混溶),有毒,具有腐蚀性如不慎滴落到皮肤上应马上用酒精(乙醇)清洗,在空气中易被氧化而变粉红色。在民间有土方用石炭酸来治皮肤顽疾,以毒攻毒,如用来治脚底起泡。 1.3乙酐 中文名称:乙酸酐,英文名称:Acetic Anhydride。别名:醋酸酐;醋酐;乙酐;Ac2O 无水醋酸; 分子式:C4H6O3;(CH3CO)2O。外观与性状:无色透明液体,有刺激性气味(类似乙酸),其蒸气为催泪毒气。分子量:102.09 。蒸汽压:1.33kPa/36℃ 闪点:49℃。熔点:-73.1℃。沸点:138.6℃ 溶解性:溶于苯、乙醇、乙醚,氯仿;渐溶于水(变成乙酸)。 密度:相对密度(水=1)1.08;相对密度(空气=1)3.52 。 折光率:n20D 1.450 。稳定性:稳定。 1.4氯苯 中文名称:氯苯、一氯代苯。英文名称:chlorobenzene、monochlorobenzene CAS: 108-90-7 。分子式: C6H5Cl 。分子量: 112.56 。熔点(℃): -45.2 沸点(℃): 132.2 。相对密度(水=1): 1.10 。相对蒸气密度(空气=1): 3.9 饱和蒸气压(kPa): 1.33(20℃) 。临界温度(℃): 359.2 。临界压力(MPa): 4.52 辛醇/水分配系数的对数值: 2.84 。闪点(℃): 28。引燃温度(℃): 590 爆炸上限%(V/V): 9.6。爆炸下限%(V/V): 1.3 。外观与性状:无色透明液体,具有不愉快的苦杏仁味。 溶解性:不溶于水,溶于乙醇、乙醚、氯仿、二硫化碳、苯等多数有机溶剂。主要用途:作为有机合成的重要原料。
目录 课程设计任务书1份(1页)课程设计说明书1份(39页)计算机绘图图纸1套(2张)
课程设计任务书
退热冰[1]即乙酰苯胺,学名N-苯(基)乙酰胺,白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体,由苯胺和冰醋酸通过酰化反应[2]制得。 关键词:退热冰;乙酰苯胺;生产;车间设计
摘要 (i) 1.设计说明 (1) 1.1 概述 (1) 1.2 设计依据 (1) 1.2.1 依据 (1) 1.2.2 主要技术资料 (1) 1.3 设计范围 (2) 1.4 设计原则 (2) 2.产品简介 (3) 3.化学原理及酰化工艺规程 (4) 3.1 化学反应原理 (4) 3.2 乙酰苯胺工艺酰化过程说明 (4) 3.2.1 酰化岗位操作法 (4) 3.2.2 制片岗位操作法 (6) 3.2.3 泵房岗位操作法 (7) 4.工艺流程示意图 (10) 5.物料衡算、能量衡算及设备的计算选型 (11) 5.1 物料衡算 (11) 5.1.1 概述 (11) 5.1.2 乙酰化过程的物料衡算 (12) 合计:9183.56 (14) 合计:9183.56 (14) 5.1.3 减压蒸馏岗的物料衡算 (14) 5.2 能量衡算 (16) 5.2.1 概述 (16) 5.2.2 热量衡算计算 (17) 5.2.3 比热的计算 (18) 5.2.4 酰化反应热量衡算 (19) 5.2.5 减压蒸馏热量衡算 (20) 5.3 设备计算和主要工艺设备选型 (21) 5.3.1 工艺设备选型原则 (21) 5.3.2 酰化反应罐 (22) 5.3.3 回收苯胺储罐 (22) 6.生产分析控制 (23) 6.1 概述 (23) 6.2 分析项目 (23) 6.2.1 原料质量标准及规格 (23) 6.2.2 中间体、半成品的质量标准和检验方法生产控制(分析) (24) 7.厂房和车间布置的设计方案 (26) 7.1 工艺布局的基本要求 (26) 7.2 洁净室(区)布置要求 (26) 7.2.1 一般规范 (26)
实验十二 苯亚甲基苯乙酮的制备 一、实验目的 1、掌握羟醛缩合反应原理和方法; 2、掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。 3、巩固产物重结晶的方法。 二、反应原理 NaOH -H 2O C 6H 5CHO + CH 3COC 6H 5 C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5 反应历程: OH +H 2C O H H 2C O +C H 2C O C O C O CH 2 O O +C CH 2 O O C CH 2 O OH +OH C 6H 5CH=CHCOC 6H 5 -H 2O
四、实验装置图 五、反应步骤 苯亚甲基苯乙酮是由苯甲醛与苯乙酮在10%氢氧化钠溶液催化下缩合而合成。为了使反应顺利进行和控制苯甲醛的滴加速度,通常在装有搅拌器、温度计和滴液漏斗的三颈瓶中进行。 在装有搅拌器、温度计和恒压漏斗的250ml三口烧瓶中,加入25mL10%氢氧化钠溶液、50mL 95%乙醇和12ml苯乙酮。保持反应温度在20~250C之间,搅拌下由恒压漏斗滴加10mL 苯甲醛,控制滴加速度(5-10min滴完)。滴加完毕后,继续保持此温度搅拌搅拌1~1.5h,即有固体析出。反应结束后将三口烧瓶置于冰水浴中冷却15~30min,使结晶完全。 抽滤收集产物,用水充分洗涤,至洗涤液对PH 试纸显中性,得苯亚甲基苯乙酮粗品。粗产物用95%乙醇重结晶(每克产物约需4~5mL溶剂),若溶液颜色较深可加少量活性炭脱色,得浅黄色片状结晶产物,熔点56~570C。 六、实验流程
七、注意要点 (1)稀碱最好新配(浓度要够)。 (2)控制好反应温度,温度过低产物发粘,过高副反应多。 (3)洗涤要充分,可转移至烧杯中进行。 (3)产物熔点较低,重结晶加热时易呈熔融状,故须加乙醇作溶剂使呈均相。 八、思考题 1.本实验中如何避免副反应的发生? 答:先将苯乙酮与碱混合,产生碳负离子,控制低温,防止苯乙酮的自身缩合;采取控温滴加与搅拌,有利于发生交叉羟醛缩合而防止苯甲醛的岐化。 3.本实验中,苯甲醛与苯乙酮加成后为什么不稳定并会立即失水? 答:生成的反式烯烃稳定,或者说亚甲基氢受羰基和羟基的影响比较活泼,易于消除。
第四章 酰化反应 答案 一、完成下列反应 1、 Cl Cl Cl O O +AlCl 3 西替利嗪中间体 金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。实用医药杂志。2005.22(12).1108-1109 2、 N H H N O Cl O Cl N H N O Cl O HCl 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 3、 N H H N O Cl O O N H N O Cl O 2 HCl Cl 3 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 4、 N H H N O NaH N H Na N O CH COCl N H N O O 青霉素。 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 5、 H H N O SO 2Cl N H N O O 2 HCl 半合成β-内酰胺类抗生素 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000
6、 O O 3 C O CH 2CH 2COOH 芬不芬 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,1340 7 N H S O O O N S COCH 3 乙酰丙嗪 8 NH 2COOH NHCOCH 3COOH 安眠酮 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,13 9 N N S H 2N SH O 3 O N N S HN SH 3 乙酰唑胺 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,14 10 NH 2 OH O O O NHCOCH 3 OH 嘧啶苯芥 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,15 11 NH 2 3NHCOCH 3 磺胺类药物 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,17 12
实验名称:苯亚甲基苯乙酮的制备 一、实验目的: 1 掌握羟醛缩合反应原理和方法; 2掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。巩固重结晶。 二、实验原理: 强碱性条件下发生的羟醛缩合反应。反应式如下: 反应历程: 苯亚甲基苯乙酮又称查耳酮(cha-lcone)。有顺(Z)-,反(E)-异构体。(E)-构型:淡黄色棱状晶体,熔点58℃,沸点345~348℃(分解),219℃(2.4kPa)。(Z)-构型:淡黄色晶体,熔点45~46℃。合成的混合体:熔点55~57℃,沸点208℃(3.3kPa),相对密度1.0712,1.6458。溶于乙醚、氯仿、二硫化碳和苯,微溶于乙醇,不溶于石油醚。吸收紫外光。有刺激性。能发生取代、加成、缩合、氧化、还原反应。由苯乙酮在碱性条件下与苯甲醛缩合而成。用作有机合成试剂和指示剂。 查耳酮广泛应用于医药和日用化学品等领域。查耳酮经典的合成方法是在乙醇水溶液中,强碱氢氧化钠或氢氧化钾催化苯甲醛和苯乙酮羟醛缩合后脱水而得到。近年来,在无溶剂条件下的固相有机反应由于具有反应效率高、操作简单和环境友好等优点而深受关注。1990年首次报道了在无溶剂条件下使用氢氧化钠催化取代苯甲醛和苯乙酮羟醛缩合,以比较高的收率得到相应的查耳酮。1997年有人采用球磨技术进一步改善了有机固相反应的效率,克服了反应底物不能充分接触的缺点。在无溶剂条件下利用氢氧化钠和碳酸钾混合碱作为催化剂,使用球磨技术促进取代苯甲醛和苯乙酮的固相羟醛缩合,反应时间明显缩短,收率可达到90%~98%。
苯亚甲基苯乙酮是由苯甲醛与苯乙酮在10%氢氧化钠溶液催化下缩合而合成。为了使反应顺利进行和控制苯甲醛的滴加速度,通常在装有搅拌器、温度计和滴液漏斗的三颈瓶中进行。反应时间由滴加苯甲醛算起至加入晶种继续搅拌待反应瓶中有结晶止,需1.5~2.0h,产率67~72%。 三、物理常数 试剂用量减半:苯乙酮3g,0.025mol;苯甲醛2.65g, 0.025mol ,理论产量:5.2g 四、反应步骤 在装有搅拌器、温度计和恒压漏斗的50 ml三口烧瓶中,加入12.5ml 10%氢氧化钠溶液、7.5 ml 95%乙醇和3 ml苯乙酮。搅拌下由滴液漏斗 滴加2.5 ml苯甲醛,控制滴加速度,保持反应温度在25~30。C之间, 必要时用冷水浴冷却。滴加完毕后,继续保持此温度搅拌0.5 h。然后 加入几粒苯亚甲基苯乙酮作为晶种,室温下继续搅拌1~1.5 h,即有固 体析出。反应结束后将三口烧瓶置于冰水浴中冷却15~30 min,使结晶 完全。 抽滤收集产物,用水充分洗涤,至洗涤液对石蕊试纸显中性。然后 用少量冷乙醇(3~4 ml)洗涤结晶,挤压抽干,得苯亚甲基苯乙酮粗品。 粗产物用95%乙醇重结晶(每克产物约需4~5ml溶剂),若溶液颜色较 深可加少量活性炭脱色,得浅黄色片状结晶4~5g,熔点56~57。C。 五、实验流程 六、注意要点 (1)苯甲醛须新蒸馏后使用。 (2)控制好反应温度,温度过低产物发粘,过高副反应多。 (3)苯亚甲基苯乙酮熔点较低,溶样回流时会呈熔融油状物,需加溶剂使之真正溶解。本品可引起某些人皮肤过敏,故操作时慎勿触及皮肤。 (4)反应温度以25~30℃为宜,偏高则副产物较多,过低则产物发粘,不易过滤和洗涤。 (5)一般室温搅拌1h后即有晶体析出,但如有苯亚甲基苯乙酮成品,可在开始室温搅
苯乙酮的制备 实验目的: 学习利用Friedel-Crafts酰基化反应制备芳香酮的原理和方法。 实验原理: Friedel-Crafts酰基化反应是制备芳香酮的最重要和最常用的方法之一,可用FeCl3,SnCl2, BF3,ZnCl2, AlCl3,等Lewis酸作催化剂,催化性能以无水AlCl3和无水AlBr3为最佳;分子内的Friedel-Crafts酰基化反应还可用多聚磷酸(PPA)作催化剂。酸酐是常用的酰化试剂,这是因为酰卤味难闻而酸酐原料易得,纯度高,操作方便,无明显的副反应或有害气体放出,反应平稳且产率高,生成的芳酮容易提纯。 酰基化反应常用过量的液体芳烃、二硫化碳、硝基苯、二氯甲烷等作为反应的溶剂。 Friedel-Crafts反应时一个放热反应,通常是将酰基化试剂配成溶液后慢慢滴加到盛有芳香族化合物溶液的反应瓶中,并需密切注意反应温度的变化。 由于芳香酮与三氯化铝和形成配合物,与烷基化反应相比,酰基化试剂的催化剂用量大得多。对烷基化反应,AlCl3/RX(摩尔比)=0.1,酰基化反应AlCl3/RCOCl=1.1,由于芳烃与酸酐反应产生的有机酸会与AlCl3反应,所以AlCl3/Ac2O=2.2。 实验步骤: 向装有10ml恒压滴液漏斗、机械搅拌装置[1]和回流冷凝管(上端通过一个氯化钙干燥管与氯化氢气体吸收装置相连)的100ml三颈烧瓶中迅速加入13g(0.097mol)分装无水三氯化铝和16ml(约14g,0.18mol)无水苯[2]。在搅拌下将4ml(约4.3g,0.04mol)乙酐[3]自滴液漏斗慢慢滴加到三颈烧瓶中(先加几滴,待反应发生后再继续滴加),控制乙酐的滴加速度以使三颈烧瓶稍热为宜。加完后(约需10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。 将反应混合物冷到室温,在搅拌下倒入18ml浓盐酸和35g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层(哪一层?),水层用苯萃取2次(每次8ml)。合并有机层,依次用15ml10%氢氧化钠、15ml水洗涤,在用无水硫酸镁干燥。 先在水浴上蒸馏回收苯,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管(为什么?)蒸馏收集195~202℃馏分,产量约为4.1g(产率85%)。 纯苯乙酮为无色透明油状液体,bp为202℃,mp为20.5℃,n D201.5372. 注释: [1] 本实验也可用电磁搅拌器或人工振荡代替机械搅拌,此时可改用二颈烧瓶。若采用人工振荡,回流时间应增长以提高产率。 [2] 本实验所用的仪器和试剂均需充分干燥。无水AlCl3质量的好坏对实验的影响很大,研细、称量、投料都要迅速;可用带塞锥形瓶称量AlCl3,投料时将纸卷成筒状插入瓶颈。从普通苯中除去噻吩的方法为:用等体积的15%H2SO4洗涤数次,直至酸层为无色或淡黄色。再分别用水、10%Na2CO3溶液、水洗涤,用无水氯化钙干燥过夜,过滤,蒸馏。 [3]乙酐在用前应重新蒸馏,收集137~140℃馏分备用。 课后思考题(在实验报告中回答): 1 反应完成后为什么加入浓盐酸和冰水混合物来分解产物? 2 下列试剂在无水三氯化铝存在下相互作用,应得什么产物? (1)过量苯+ClCH2CH2Cl (2)苯和马来酐
竭诚为您提供优质文档/双击可除对甲苯乙酮的制备实验报告 篇一:12-对甲基苯乙酮的制备 苏州大学化学化工学院课程教案 [实验名称]对甲基苯乙酮的制备 [教学目标]掌握实验室制备对甲基苯乙酮的原理(Friedel-crafts酰基化反应)和方法; 了解无水条件下的搅拌、滴加及带有尾气吸收装置,减压蒸馏的操作技术。 [教学重点]无水条件下的搅拌、滴加及带有尾气吸收装置,减压蒸馏的操作技术。 [教学难点]无水条件下的搅拌、滴加技术和减压蒸馏的操作技术。 [教学方法]讨论法,演示法,讲述法 [教学过程] [引言]【实验内容】对甲基苯乙酮的制备 【实验目的】掌握实验室制备对甲基苯乙酮的原理(Friedel-crafts酰基化反应)和
方法;了解无水条件下的搅拌、滴加及带有尾气吸收装置,减压蒸 馏的操作技术。 [讲述]【实验原理】Friedel-crafts酰基化反应是制备芳基酮类化合物的重要方法,反应 中常用三氯化铝为催化剂。 ch3h3c3+ch3cooh+(ch3co)2o [讲述]【实验步骤】 对甲基苯乙酮的制备: 在100mL干燥的三颈烧瓶上安装温度计、恒压滴液漏斗,上口装有无水氯化钙干燥管的球形冷凝管,干燥管与氯化氢尾气吸收装置相连。 快速称取13.0g(0.098mol)无水三氯化铝,研碎后放入三颈瓶中,立即加入20mL无水甲苯,在搅拌下慢慢滴加3.7mL(0.039mol)醋酐与5mL无水甲苯的混合液,约需20min 滴完。然后在90~95℃下水浴加热至没有氯化氢气体逸出,约需30min。撤去气体吸收装置,待反应液冷却后,在搅拌下倒入30mL浓盐酸和30g碎冰的烧杯中(通风橱中进行)。将混合物转入分液漏斗中,分出有机层,水层用苯萃取2次(每次5mL)。合并有机层,依次用水、5%氢氧化钠、水各15mL洗涤,再用无水硫酸镁干燥。 先在水浴上蒸馏回收甲苯,稍冷后改为减压蒸馏装置,
苯亚甲基苯乙酮的制备 一、实验目的 1 掌握羟醛缩合反应原理和方法; 2掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。巩固重结晶。 二、反应式 NaOH -H 2O C 6H 5CHO + CH 3COC 6H 5 C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5 反应历程: OH +H 2C O H C H 2C O +H 2C O C O C O H C CH 2 O O +CH CH 2 O O C CH 2 O OH +OH C 6H 5CH=CHCOC 6H 5 苯亚甲基苯乙酮又称查耳酮(cha-lcone)。有顺(Z)-,反(E)-异构体。(E)-构型:淡黄色棱状晶体,熔点58℃,沸点345~348℃(分解),219℃(2.4kPa)。(Z)-构型:淡黄色晶体,熔点45~46℃。合成的混合体:熔点55~57℃,沸点208℃(3.3kPa),相对密度1.0712,1.6458。溶于乙醚、氯仿、二硫化碳和苯,微溶于乙醇,不溶于石油醚。吸收紫外光。有刺激性。能发生取代、加成、缩合、氧化、还原反应。由苯乙酮在碱性条件下与苯甲醛缩合而成。用作有机合成试剂和指示剂。 查耳酮广泛应用于医药和日用化学品等领域。查耳酮经典的合成方法是在乙醇水溶液中,强碱氢氧化钠或氢氧化钾催化苯甲醛和苯乙酮羟醛缩合后脱水而得到。近年来,在无溶剂条件下的固相有机反应由于具有反应效率高、操作简单和环境友好等优点而深受关注。1990年首次报道了在无溶剂条件下使用氢氧化钠催化取代苯甲醛和苯乙酮羟醛缩合,以比较高的收率得到相应的查耳酮。1997年有人采用球磨技术进一步改善了有机固相反应的效率,克服了反应底物不能充分接触的缺点。在无溶剂条件下利用氢氧化钠和碳酸钾混合碱作为催化剂,使用球磨技术促进取代苯甲醛和苯乙酮的固相羟醛缩合,反应时间明显缩短,收率可达到90%~98%。 -H 2O
α-苯乙醇合成苯乙酮 氧化醇类化合物为相应的羰基化合物, 在有机化学研究及工业应用中占有非常重要的地位.近年来关于醇的氧化反应研究, 尤其是在催化剂方面, 得到了很快的发展. 一钼钨催化体系 钼钨催化剂在醇的氧化反应中有很广泛的应用, 2009 年Hida 等[44]用Na2WO4-H2O2 催化氧化体系, 以N,N-二甲基乙酰胺为溶剂, 用Na2HPO4?12H2O 调节溶液pH 值, 中性条件下, 催化过氧化氢氧化仲醇、伯醇为羰基化合物(Eq. 10). 中性的反应特点使此方法可应用于对酸敏感的醇的氧化. 虽然此方法具有催化剂和氧化剂均便宜、易得的优点, 但对于伯醇的氧化效果比较差. 例如2-乙基-1-己醇的氧化产物的产率仅为50%. 二钴催化体系 Iwahama 等[54]以无机钴盐Co(OAc)和配合物Co(acac)3为催化剂, N-羟基邻苯二甲酰亚胺(近几年来被认为是在温和条件下氧化各种有机物质的有价值的催化剂)存在下, 分子氧为氧源, 可以在室温下氧化各种醇(Eq. 17). 但不足之处是, 在有些反应中, 需要加入苯甲酸及其衍生物如MCBA, PMBA 作为共氧化剂. 产物中不可避免地会有酸或过酸的存在, 这给产物的分离带来麻烦.
钴的席夫碱配合物已被证实可以有效地催化分子氧进行氧化反应, 而且席夫碱双氧-钴配合物作为催化剂、醛作为牺牲试剂已经引导了几种重要方法的发展, 如烯烃环氧化、硫醚氧化为亚砜等[55]. Sharma 等[56]合成了四种席夫碱钴配合物8~11 (Scheme 7), 并有效地催化分子氧氧化仲醇. 羟基的α位有羰基的底物更容易发生反应, 而且所需的时间短一些. 其中配合物8 的催化活性最好. 金属酞菁稳定、易得, 是一类可供选择的仿生氧化催化剂, 已经用来氧化很多有机物. 金属酞菁在普通有机溶剂中不溶, 容易从反应体系中分离出来循
对羟基苯乙酮的合成 鲍继明,戴淑昌 (安徽省淮南市生产力促进中心,安徽淮南 232001) 摘要:以苯酚和乙酐为原料,经过酯化反应和Fr ies 重排反应合成了对羟基苯乙酮,收率58.5%,纯度98.68%。 关 键 词:对羟基苯乙酮;苯酚;乙酐;酯化反应;F r ies 重排反应;合成中图分类号:O 622.4,O625.4 文献标识码:A 文章编号:1005-1511(2002)03-281-02 Synthesis of 4-Hydroxy -acetophenone BAO Ji-ming , DAI Shu-chang (A n Hui Huainan P ro ductiv ity Center ,Huainan 232001,China) Abstract :4-Hy drox y -acetophenone w as synthesized fr om phenol and acetic anhydride by es-terification and Fr ies rearrangement reactio ns w ith the yield of 58.5%(content 98.68%of 4-hy drox y -acetophenone). Keywords :4-hydrox y-acetophenone;phenol;acetic anhydride;esterification;Fries rear-r angemeng reactio n ;sy nthesis . 对羟基苯乙酮是重要的精细有机化学品之一。它作为有机合成的中间体,可用于香料的生产,它 还是一种利胆的药品,适用于胆囊炎和急、慢性黄胆型肝炎的辅助治疗。 本文以苯酚和乙酐为原料进行酯化反应生成乙酸苯酯,再在无水三氯化铝作用下进行Fries 重排反应[1] ,通过控制反应温度,使酰基移位到对位生成对羟基苯乙酮[2] 。 HO +O O O HO O O AlCl 3 HO O 反应在无溶剂存在时进行,合成的对羟基苯乙酮经中国药科大学检验,确认其含量达97.04%~98.68%。 1 实验1.1 试剂 苯酚、乙酐、NaOH,无水硫酸钠为市售分析纯试剂;无水三氯化铝、活性炭为工业品。1.2 合成 1.2.1 酯化反应 在烘干的装有回流冷凝器的单口烧瓶中依次加入苯酚400g (4.25mol),乙酐480g (4.70mo l),小心混合,缓慢加热至沸腾,回流3h 后冷却至室温。分出有机相,蒸馏水洗至近中性,无水硫酸钠干 燥后常压蒸馏收集190℃~196℃馏分得无色透明液体乙酸苯酯。 1.2.2 Fr ies 重排反应 在烘干的装有电动搅拌器、温度计和加料漏斗的三口烧瓶中加入乙酸苯酯100g (0.73mo l),剧烈搅拌下分数次缓慢加入无水三氯化铝120g (0.90mol ),加完后开始升温至反应温度反应3h ,停止 — 281— 合成化学 Chinese Journal of Sy nthetic Chemistr y 收稿日期:2002-02-04;修订日期:2002-03-12 作者简介:鲍继明(1947-),男,汉族,高级工程师,主要从事技术开发和科技信息研究。
对甲基苯乙酮的制备 一、实验目的 1.学习利用Friedel-Crafts 酰化反应制备芳香酮的原理和方法; 2.复习带尾气吸收装置的回流装置的安装和使用; 3.复习分液漏斗的使用规程及注意事项; 4.复习固体干燥液体的方法和原理; 5.学习减压蒸馏的原理,方法及仪器装置的安装和使用 二、实验原理 先问学生在苯环上引入烷基和羰基的方法?总结(1)先在苯环上引入卤素,再利用格氏试剂等的操作,达到目的。(2)利用Friedel-Crafts 反应,包括烷基化和酰基化。该方法操作步骤较多,且格氏试剂反应的效果易受影响的影响因素较多,因此今天选择Friedel-Crafts 反应,向学生解释Friedel-Crafts 反应的原理,解释Lewis 酸的作用机理(常用的如AlCl 3,ZnCl 2,FeCl 3等),以AlCl 3为例: HX ArR RX ArH AlCl +??→?+3 HCl RCOAr ArH RCOCl AlCl +??→?+3(R 包括Ar) HCl RCOAr ArH O RCO AlCl +??→?+32)( 然后联系到今天要合成的对甲基苯乙酮,通常可用无水AlCl 3催化,酰氯反应剧烈,且受空气中的水分影响较大;酸酐反应温和,易控制,乙酸基本达不到反应效果或者说反应极慢,因此本实验选择乙酸酐作为原料。 主反应: COOH CH COAr CH ArH O CO CH AlCl 33233)(+??→?+ 副反应:主要是生成邻硝基苯乙酮,它与主产物之比一般不超过1:20。 向学生详细解释反应机理,并说明无水三氯化铝易与空气中的水反应,使反应受到影响,因此整套反应仪器装置必须是干燥的。 反应完毕,用盐酸冰水混合物是为了使产物从络合物中析出,并将催化剂三氯化铝以离子形式转移到水相中。 减压蒸馏原理下一节讲。 三、实验装置 仪器选择: 反应装置:三颈瓶,蒸馏头,冷凝管,温度计套管,100℃温度计,恒压漏斗,干燥管(这些仪器都必须是干燥的,事先必须烘干),玻璃漏斗 洗涤装置:分液漏斗 干燥装置:带塞子的干燥的锥形瓶1个 减压蒸馏装置:100ml 圆底烧瓶(根据量多少),克氏蒸馏头,毛细管,冷凝管,三叉燕尾管,3个50ml 圆底烧瓶(一个大组准备一套,且必须事先烘干) 反应装置注意十字夹,万用夹的夹法,冷凝管的进出水,安装装置的先后顺序,尾气吸收漏斗的位置,整套装置的安装美观与否。 洗涤装置:分液漏斗;涂凡士林,检漏,铁圈选择,静置时小孔凹槽位置,放液顺序,回收装置。 减压蒸馏装置:十字夹、万用夹的夹法,毛细管插入的深度,冷凝管的位置和进出水口,温度计的安装,燕尾管的安装,凡士林的涂抹位置,接收瓶的固定,真空泵与燕尾管的连接,安全瓶的用法,整套装置的美观,装置气密性的检查,加热、抽压、停止、拆装置的顺序,气压计的使用,收集馏分温度范围的计算。