
III.实验动物心肌肥厚模型
A、压力超负荷/主动脉缩窄
压力超负荷引起的心脏肥厚常用的手术方法是主动脉缩窄(i.e.缩窄升主动脉)。
小鼠行主动脉缩窄(TAC)可以引起心脏机械性的压力超负荷,最终导致心肌肥厚、心衰(20,84)。TAC通常诱导方法采用在近胸骨端行小切口, 缩窄主动脉的这样的开胸手术。TAC模型虽然不能完全模拟人类的心室重构,但该模型可以用于肥厚发病过程中多种基因学的研究。主动脉缩窄模型能很好的模拟血流动力学超负荷引起左心室肥厚的发生发展。该动物模型在主动脉缩窄造成心肌肥厚几个月后会导致心衰。
B、容量超负荷
在静脉回流适当的情况下,心脏不能排出足够的血液满足全身组织代谢的需要就会引起CHF(充血性心力衰竭)。心内檐沟血或回心血量增加导致瓣膜闭锁不全就会引起心室容量超负荷。在慢性动脉和/或二尖瓣瓣膜回流疾病中的容量超负荷,我们会观察到“舒张期压力-容积曲线”整体右移,说明心脏僵硬度增加,即发生LVH (可见于主动脉瓣狭窄、高血压、肥厚性心肌病)(36)。通常情况下,容量超负荷CHF模型制备方法是腹主动脉-下腔静脉分流术。即于肾动脉上方分离出下腔静脉和腹主动脉,用血管夹在近肾动脉端夹闭主动脉阻断血流;用0.6-mm的针头由主动脉远端刺入,继续进针刺入下腔静脉,使动静脉联合。退针后,缝合血管壁伤口。4-5周后,就能复制出心肌肥厚模型,并具有左心室收缩力增强、舒张末期压力增加的特点(257)。
C、冠状动脉结扎
冠状动脉结扎常用于复制心衰动物模型。冠脉左前降枝(LAD)结扎后会阻断心脏的供养和营养输送,这种情况类似于人类心脏病发作时伴随的症状。血氧和营养供输阻断后,心肌细胞死亡,心脏整体功能受影响,最终导致心功能紊乱。由于这种动物模型非常接近临床心衰疾病的发生发展,研究证明该模型是心衰发病机制研究的重要手段(13)。
D、转基因型心脏肥大模型
几十年以来,一些心脏肥大和心力衰竭的转基因小鼠模型被学者们用于心肌肥厚和心衰这些致命疾病的可能的分子机制研究。受条件限制,在此不能针对于所有模型作一全面的综述,但在此文中,我们介绍一种转基因小鼠模型,该模型能成功模拟心肌肥厚的发生发展以及最终演变为心衰的过程。表1列举的是截止目前,研究学者们发现的较成熟的心肌肥厚/心衰模型。
表1:小鼠心衰模型
转基因小鼠模型代谢转变模型ECM紊乱转基因模型
肌侵蛋白,TNFα,G i,Gαq,PKCβ,PKA,β1AR,
磷酸化蛋白, 肌集钙蛋白, 钙调磷酸酶, L-型Ca2+ 通道
线粒体功能紊乱
氧化应激
脂肪酸氧化(FAO) 通路的受损
基质金属蛋白酶2/MMP2
基质金属蛋白酶9/MMP9
组织金属蛋白酶抑制剂
1/TIMP1
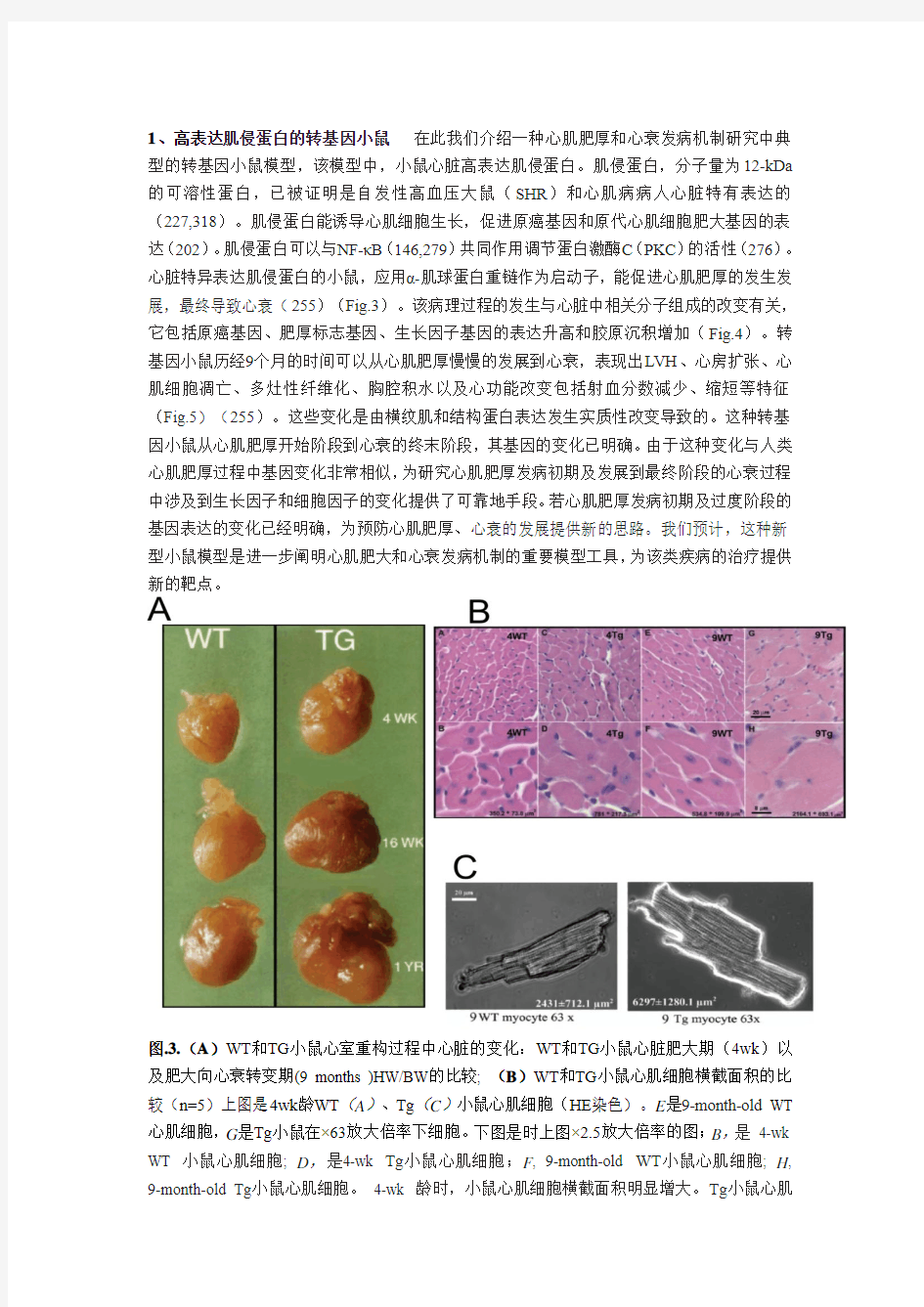
1、高表达肌侵蛋白的转基因小鼠在此我们介绍一种心肌肥厚和心衰发病机制研究中典型的转基因小鼠模型,该模型中,小鼠心脏高表达肌侵蛋白。肌侵蛋白,分子量为12-kDa 的可溶性蛋白,已被证明是自发性高血压大鼠(SHR)和心肌病病人心脏特有表达的(227,318)。肌侵蛋白能诱导心肌细胞生长,促进原癌基因和原代心肌细胞肥大基因的表达(202)。肌侵蛋白可以与NF-κB(146,279)共同作用调节蛋白激酶C(PKC)的活性(276)。心脏特异表达肌侵蛋白的小鼠,应用α-肌球蛋白重链作为启动子,能促进心肌肥厚的发生发展,最终导致心衰(255)(Fig.3)。该病理过程的发生与心脏中相关分子组成的改变有关,它包括原癌基因、肥厚标志基因、生长因子基因的表达升高和胶原沉积增加(Fig.4)。转基因小鼠历经9个月的时间可以从心肌肥厚慢慢的发展到心衰,表现出LVH、心房扩张、心肌细胞凋亡、多灶性纤维化、胸腔积水以及心功能改变包括射血分数减少、缩短等特征(Fig.5)(255)。这些变化是由横纹肌和结构蛋白表达发生实质性改变导致的。这种转基因小鼠从心肌肥厚开始阶段到心衰的终末阶段,其基因的变化已明确。由于这种变化与人类心肌肥厚过程中基因变化非常相似,为研究心肌肥厚发病初期及发展到最终阶段的心衰过程中涉及到生长因子和细胞因子的变化提供了可靠地手段。若心肌肥厚发病初期及过度阶段的基因表达的变化已经明确,为预防心肌肥厚、心衰的发展提供新的思路。我们预计,这种新型小鼠模型是进一步阐明心肌肥大和心衰发病机制的重要模型工具,为该类疾病的治疗提供新的靶点。
图.3.(A)WT和TG小鼠心室重构过程中心脏的变化:WT和TG小鼠心脏肥大期(4wk)以及肥大向心衰转变期(9 months )HW/BW的比较; (B)WT和TG小鼠心肌细胞横截面积的比较(n=5)上图是4wk龄WT(A)、Tg(C)小鼠心肌细胞(HE染色)。E是9-month-old WT 心肌细胞,G是Tg小鼠在×63放大倍率下细胞。下图是时上图×2.5放大倍率的图;B,是4-wk WT 小鼠心肌细胞; D,是4-wk Tg小鼠心肌细胞;F, 9-month-old WT小鼠心肌细胞; H, 9-month-old Tg小鼠心肌细胞。4-wk 龄时,小鼠心肌细胞横截面积明显增大。Tg小鼠心肌
细胞横截面积明显增大(2,431 ± 712 至6,297 ± 280μm2;p < 0.001)。(C) 9-month-old WT 小鼠分离出的心肌细胞(左图) (×63) 以及9-month-old Tg小鼠分离出的心肌细胞且肌侵蛋白高表达(右图) (×63). (图来自参考文献255.)
图.4. (A) 24 wks 时,与WT小鼠比较,Tg小鼠(Gn1-Gn4)ANF and β-MHC 表达上调。4重转基因小鼠心肌发生肥厚后,ANF 和β-MHC 表达上调。(B) 与WT小鼠比较,幼龄及老龄Tg小鼠中原癌基因表达上调。(图来自参考文献255.)
图. 5. 36-wk龄WT和Tg小鼠的M-型超声心动图. (图来自参考文献255.)
2、能量代谢紊乱的心脏衰竭CHF发病过程中会伴有横纹肌动蛋白功能、细胞外基质、钙离子和能量代谢等一系列细胞内物质的变化。基础和临床实验研究表明,肥厚性心脏和衰竭的心脏特点是线粒体功能紊乱、磷酸化物质含量增加以及脂肪酸氧化途径(FAO)异常。当前述能量物质代谢发生变化,心肌就需要消耗更多的能量物质-三磷酸腺苷(ATP)。然而,“能量代谢紊乱”在心衰发生机制中扮演着怎样的角色需要进一步的研究。本文从线粒体功能紊乱和脂肪酸代谢途径异常两个方面综述心衰的发生发展。
3、线粒体功能紊乱与心衰线粒体被视为细胞中的“能量站”。线粒体位于心脏肌原纤维之间,约占心肌细胞总体积的50%,具有线粒体DNA(mtDNA)、核糖体、转运RNAs、以及线粒体基因表达所需要的几种酶。基础和临床试验研究证明,当心衰发生时心肌细胞线粒体呼吸功能明显受损(140,271)。在心室重构发生过程中线粒体是重要的受损靶点,它
会释放多种神经调节因子。“线粒体孔”的开/关与心肌细胞凋亡密切相关(130)。现从下面几点,进一步解释线粒体功能紊乱与心衰的关系:
a.氧化应激:氧化应激的特点是在呼吸链中产生过量氧自由基(ROS)。线粒体中氧化磷酸化酶做功能产生氧自由基,如超氧化物自由基、H2O2、羟自由基(150)。氧自由基产生的另一种途径是脂质过氧化。研究已显示慢性缺血性心脏中过量氧自由基的产生加重mtDNA的损伤程度,最终从基因水平上引起氧化磷酸化(56)。mtDNA是不与组蛋白结合,裸露存在于线粒体中的,与核DNA比较,mtDNA更容易受到破坏,而且mtDNA缺乏自我修复能力(49,241,242)。呼吸链产生ATP时,mtDNA不断的暴露在自由基环境中,使其具有高达10-12倍的突变率(167)。在线粒体中,ROS主要影响线粒体酶的活性。在心肌中,氧自由基能改变Na+/Ca2+交换、Na+--K+ATP酶、Ca2+ ATP酶的活性。缺乏锰超氧化物歧化酶(一种清除酶)的突变小鼠体内,呼吸链中复合物Ⅱ明显减少并迅速发展为扩张性心肌病。
b.获得性突变研究已证明线粒体呼吸链中引起的许多缺陷均可导致遗传性充血性心力衰竭和心肌病(177,323)。也有报道家族性心肌病患者中,线粒体中转运蛋白肉碱缺乏(322)。虽然突变蛋白在遗传性心肌病的作用还不是很明确(177),但有一点可以肯定的是mtDNA和线粒体是可以母性遗传的。在母系遗传中,我们还观察到特定线粒体基因突变可以诱导呼吸链多种缺陷,导致CHF的发生(347)。因此,线粒体基因大片段缺失,必会导致心脏传导缺陷和心肌病,如卡尔森-赛尔斯综合征(40)。线粒体基因片段的缺失会影响电子传递系统,人们认为线粒体基因片段的缺失发生机率在胚胎早期自发突变体细胞中较大,它在心脏疾病发展中发挥着重要作用(298)。
c.线粒体功能紊乱的心衰小鼠模型大量的转基因小鼠已经被开发用于研究线粒体与心脏功能之间的关系。这些模型的方法不是使线粒体代谢紊乱(功能丧失)就是激活线粒体分子氧化途径(功能增强)。在线粒体代谢模型中研究最成熟的腺嘌呤核苷酸转运体(ANT)。ANT,是一分子量为32-kDa的能量转移蛋白,编码3个不同的核基因(ANT-1、2、3),并以特定的组织形式结合在一起,在线粒体内膜上能完成ATP/ADP转运。ANT是调节ATP在线粒体基质中的产生和消耗的关键分子。Graham等(102,203)发现ANT-/-的小鼠表现为线粒体功能异常、心肌表型肥厚。另外一个模拟毁坏mtDNA复制的基因敲除模型是Tfam(线粒体转录因子A)。Tfam是由核编码的mtDNA复制转录因子。利用cre-lox系统,Larson’s课题组(155,165,324)研究出特异性缺失Tfam基因的小鼠。Tfam基因敲除的小鼠通常在新生儿期就死亡了,即使生存下来,在2月龄的时候也伴有心肌病。这些小鼠的特点是心脏肥大、心室扩张、心室传导缺陷,如房室传导阻滞。另外,小鼠的过氧化物酶体增殖物激活受体γ(PPARγ)基因几乎无表达,心肌脂肪分解降低、有一定程度的心肌病表型(158,328)。据此推测,是不是脂肪酸不同形式的中间代谢产物积累导致心脏疾病的发生。
相反,心脏中PPARα特异性高表达转基因小鼠,线粒体FAO途径相关基因表达上调,葡萄糖转运和糖酵解途径相关基因表达下调(88)。这种转基因小鼠也有心脏肥厚、短轴缩短率较小、心室壁变薄、心室腔扩大等特点。另外,小鼠心脏超表达过氧化物酶体增殖物激活受体协同刺激因子-1α(PGC-1α)诱导的扩张型心肌病模型,心脏超微结构异常,包括纤维化、肌原纤维破坏、大型线粒体增多(160)。考虑到线粒体功能紊乱在这些转基因小鼠模型中的重要性,推测单独激活PPARα或PGC-1α或两者都被激活对于心脏肥厚和心脏功能紊乱具
有重要的作用。
d.脂肪酸氧化(FAO)途径受损FAO是心脏和骨骼肌线粒体中ATP产生的主要路径。长链脂肪酸的跨膜转运是通过脂肪酸转运体实现的,如脂肪酸转运蛋白(FATP)、CD36/FAT。进入胞内后,脂肪酸活化为酰基辅酶A(CoA,CoA在CoA合成酶作用下生成)。β氧化的第一步是乙酰CoA的氧化:这一反应在乙酰CoA脱氢酶催化下完成。乙酰CoA脱氢酶家族包括:极长链乙酰CoA脱氢酶(VLCAD)、长链乙酰CoA脱氢酶(LCAD)、乙酰CoA脱氢酶、短链乙酰CoA脱氢酶(SCAD)四个家族成员。研究发现VLCAD基因突变的儿童和青少年患有心肌病(183)。VLCAD缺乏的小鼠体内VLCAD基因性的缺乏会导致心脏出现微多孔状脂质聚集、线粒体增生、室性心动过速、退行性纤维化、胶原沉积、心肌细胞空泡状的特点(86)。这个新型有趣的模型系统,为我们的研究提供一个新的切入点即在病理生理情况下,细胞内脂肪酸的代谢平衡与心肌细胞功能是有关联的。
另外一个因FAO受损导致心肌病比较受关注的小鼠模型,其制备方法是利用cre-lox P位点特异性重组系统,特异性除去心肌细胞PPARδ(46)。这种小鼠具有心功能紊乱、心肌中脂肪沉积加重、心脏肥大和CHF、存活率下降特点。心肌PPARδ的慢性缺失会引起脂毒性心肌病。因此,PPARδ是心肌FAO重要的因子,对于维持能量平衡和正常的心功能也具有重要的作用。
4.心肌肥厚和心衰中细胞外基质的作用细胞外基质(ECM)是网状结构的胶原,维持着心肌细胞的完整性。ECM将心肌细胞和肌纤维以同轴度的方式连接在一起,形成一定的框架从而支撑着心肌细胞,能提高心脏对各种刺激的顺应性,同时又加重心室重构的发展。心肌的ECM成分主要是Ⅰ型胶原(Col I)和Ⅲ型胶原(Col Ⅲ),它们的作用是连接心肌细胞,维持心脏结构和功能的完整性。若改变Col I /Col Ⅲ的比例会妨碍心脏的收缩和舒张功能。在扩张型心肌病和CHF的高血压患者中,也发现了Col I 、Col Ⅲ增多或者二者比例增大的现象(174,223)。胶原纤维丢失会诱导心室扩张、心肌细胞位移、收缩功能障碍。因此,在心室重构和心衰的病理生理过程中,基质蛋白的合成与降解平衡的调节是至关重要的。在正常心脏中,胶原的转换依赖于基质金属蛋白酶(MMP)及其内源性抑制剂[基质金属蛋白酶组织抑制物(TIMPs)](168)。MMPs和TIMPs之间的平衡维持着基质正常水平。增强MMP的活性会促进ECM的降解,从而导致心室扩张和CHF。MMPs是一类Zn-依赖的蛋白水解酶家族,一种能降解ECM的蛋白。目前,已发现、克隆出很多种不同形式的MMPs,并且都具有广泛的特异性底物(58)。根据它们的结构和作用的底物不同,MMP可分为4类:(a) 胶原酶,包括MMP-1,-8,-13,和-18;(b) 明胶酶,包括MMP-2 和-9;(c)基质溶解素,包括MMP-3,-10,和-11;(d) 膜型MMP (MT-MMP),包括MMP-14 至MMP-17 、MMP-24 和-25。MMPs表达在心脏间质,心肌梗死时,其表达水平上调(38)。在此综述中,本文将从下面三个方面进行综述:目前已经知道的心衰疾病中MMP/TIMP系统、调控该系统的新机制以及该蛋白水解途径怎样向临床试验和应用的转换。
已经证实人类心脏中表达的几种MMP在发生CHF时,他们含量会发生变化。许多研究已经证实人、鼠、猪的心脏发生重构时,心脏中MMP-1、-2、-3和-9表达上调,表明MMP 在不同疾病阶段扮演着重要的角色(53,58,300,311)。更重要的是,在临床性和实验性扩张型心肌病病患的心脏中MMP活性增强(287,309,310)。MMPs [如胶原酶-3(MMP-13)、
膜型MMPs (MT-MMP)]在正常心脏中是低表达的,而在CHF心脏中表达大幅度升高(281)。然而,在终末期的CHF没观察到同样的MMPs表达增加,暗示在心衰的心脏中有“特定组合”的MMPs存在(281)。在CHF动物模型中,已经验证了心肌中MMP的表达在LV重构过程中的变化。一个典型的超表达MMP-1的转基因小鼠模型,很好的解释了心脏ECM降解,此情况与人类CHF相似(144)。与心肌梗死(MI)WT小鼠相比,MMP-2的基因敲除小鼠其存活率升高、LV破裂率降低、左心室腔扩张被抑制、短轴缩短频率得到改善,提示这可能是心肌梗死(MI)一种新的有效的治疗方针(118)。MMP-9缺失的MI小鼠,同样心室扩张被抑制、胶原沉积减少,提示MMP-9可以作为MI治疗候选的选择性抑制剂(76)。相反,MI小鼠TIMP-1的缺失,加重LV重构(59)。前面列举的研究都是与MMP基因敲除或转基因或应用MMP抑制剂有关,这些都肯定了MMP蛋白酶在心室重构中的作用,为MMP作为CHF的治疗靶点提供充分依据。药理学中也应用MMP抑制剂介入治疗MI动物,发现MMP
抑制剂能改善心室重构,对CHF具有保护作用(226,245)。更值得一提的是MMP-1, -3, -9, 和-12多样性的激活与心血管疾病密切相关,包括冠状动脉疾病和腹主动脉瘤,暗示MI患者MMP基因转录的多样性同样会导致不同的LV重构以及会有不同的梗塞治疗方案(341,348)。因此基因小鼠和MMP抑制剂的使用,揭示了这些蛋白酶在心血管疾病中的作用。更多关于MMP的多样性与心血管疾病因果关系研究是非常有必要的。
表2:药理学抑制剂对血压及心脏肥厚的影响
模型药物HW/BW BP 参考文献
SHR / 3.44 ± 0.15 196 ± 28 Sen S (268) SHR 卡托普利 2.64 ± 0.08 119 ± 23 Sen S (268) SHR 双氢氯噻嗪 3.30 ± 0.05 171 ± 60 Sen S (268) SHR 阿替洛尔 3.00 ± 0.11 151 ± 50 Sen S (268) SHR 氯沙坦 2.86 ± 0.04 146 ± 30 Alvarez BV (4) SHR 硝苯地平 3.06 ± 0.05 140 ± 20 Alvarez BV (4)
结果以平均值±SEM表示。SHR,自发性高血压大鼠;卡托普利,ACE抑制剂;双氢氯噻嗪,利尿剂;阿替洛尔,β受体阻断剂;氯沙坦,AngⅡ受体阻断剂;硝苯地平,钙离子通道阻滞剂;HW/BW,心脏重量与体重之比;BP,血压。
、糖尿病的概念及分类 糖尿病已成为全人类继恶性肿瘤和心脑血管病之后的严重威胁人类健康的第三大非传染 性疾病。目前我国己成为世界第一糖尿病大国。 糖尿病是一类由遗传、环境、免疫等因素引起的、具有明显异质性的慢性高血糖症及其并 发症所组成的综合征,并非单一病因所引起的单一疾病(多原因引起的综合症)。糖尿病分 为:i型糖尿病、n型糖尿病和其它特异性糖尿病。I型糖尿病即胰岛B细胞大量破坏,常导 致胰岛素绝对性缺乏,以往称为胰岛素依赖型糖尿病、青年发病型糖尿病,“三多一少”症状明显。本型病因及发病是由于胰岛B细胞受到细胞介导性自身免疫性破坏。n型糖尿病由于胰 岛素抵抗并胰岛素分泌不足所致,以高血糖高血脂为显著特点。以往称为非胰岛素依赖型糖尿病、成年发病型糖尿病,常伴有明显的遗传因素,但遗传机制尚未阐明。其它特异性糖尿病 包括,B细胞功能的基因缺陷、胰岛素作用的基因缺陷、胰腺外分泌疾病、内分泌疾病、药物或化敏学制剂所致的糖尿病、感染、非常见型免疫介导性糖尿病以及有时并发糖尿病的其它遗传综合症。 (糖尿病是无法根治的,现在随着人们生活水平的提高,饮食习惯,生活方式的改变糖尿病的发病率节节攀升,成为威胁人类健康的一大难题。人们曾经一度把糖尿病称为富贵病这也是有一定道理的。为了提高人们的生活质量,近几年对糖尿病的研究日益加深) 二、糖尿病模型的建立 近年来,随着国内外对糖尿病治疗药物研究的深入开展,建立比较理想的糖尿病动物模型 显得尤为重要。目前常用的动物模型有实验性动物模型和自发性动物模型。自发性模型应用价 值较高,但因价格昂贵,饲养、繁殖条件要求严格,而不能得到广泛应用。实验性模型则应用比较广泛,实验性糖尿病动物模型的建立,是用各种方法损伤动物胰脏或胰岛B细胞导致胰岛 素的缺乏,或用化学药物对抗胰岛素作用,导致动物出现高血糖形成糖尿病。实验性糖尿病动 物模型的建立主要有6种方法:胰腺切除法致糖尿病、免疫性糖尿病、激素性糖尿病、下丘脑损伤性糖尿病、化学性糖尿病、病毒性糖尿病。由于化学性糖尿病动物模型诱发简便、来源广,应用较广泛。目前多采用注射化学诱导剂(链脲佐菌素或四氧嘧啶)的方法,引起短时间 内胰岛B细胞大量损害而诱发糖尿病动物模型的建立。 1糖尿病模型小鼠
二十种常见实验动物模型 一、缺铁性贫血动物模型 缺铁性贫血(iron deficiency anemia,IDA)是体内用来合成血红蛋白(HGB)的贮存铁缺乏,HGB合成减少而导致的小细胞低色素性贫血,主要发生于以下情况:(1)铁需求增加而摄入不足,见于饮食中缺铁的婴幼儿、青少年、孕妇和哺乳期妇女。(2)铁吸收不良,见于胃酸缺乏、小肠粘膜病变、肠道功能紊乱、胃空肠吻合术后以及服用抗酸和H2受体及抗剂等药物等情况。(3)铁丢失过多,见于反复多次小量失血,如钩虫病、月经量过多等。 IDA是一种多发性疾病,据报道,在多数发展中国家,约2/3的儿童和育龄妇女缺铁,其中1/3患IDA,因此,研究IDA的预防和治疗具有重要的意义。在这些研究中,缺铁性贫血的动物模型(Animal model of IDA),又是实施研究的基础工具。常见的IDA动物模型的构建技术如下: 实验动物:一般选用SD大鼠,4周龄,雌雄不拘,体重65g左右,HGB≥130g/L。 建模方法:低铁饲料加多次少量放血法。低铁饲料一般参照AOAC 配方配制,采用EDTA浸泡处理以去除饲料中的铁,饲料中的含铁量是诱导SD大鼠形成缺铁性贫血模型的关键,现有研究表明,饲喂含铁量<15.63mg/Kg的饲料35天,SD大鼠出现典型IDA表现,而饲喂
含铁40.30mg/Kg的饲料SD大鼠出现缺铁,但并不表现贫血症状。建模时一般采用去离子水作为动物饮水,以排除饮水中铁离子的影响。少量多次放血主要用于模拟反复多次小量失血导致的铁丢失,还可以加速贫血的形成。放血一般在低铁饲料饲喂2周后进行,常用尾静脉放血法,1~1.5ml/次,2次/周。 模型指标:(1)HGB≤100g/L;(2)血象:红细胞体积较正常红细胞偏小,大小不一,中心淡染区扩大,MCV减小、MCHC降低;(3)血清铁(SI)降低,常小于10μmol/L,血清总铁结合力(TIBC)增高,常大于60μmol/L。 需要指出的是,以上模型不能用于铁吸收不良相关IDA的防治研究。根据具体的研究需要,也可以适当调整建模方法。 二、白血病动物模型 用免疫耐受性强的人类胎儿骨片植入重症联合免疫缺陷病(SCID)小鼠皮下,出于人类造血细胞与造血微环境均植入小鼠,建立具有人类造血功能的SCID小鼠模型称为SCID-hu小鼠。再将髓系白血病患者的骨髓细胞植入SCID-hu小鼠皮下的人类胎儿骨片内,植入的髓系白血病细胞选择性生长在SCID-hu小鼠体内的人类造血微环境中,即为人类髓系白血病的小鼠模型。SCID小鼠是由于其scid所致。T、B淋巴细胞功能联合缺陷,这种小鼠能接受人类器官移植物。 造模方法:
组织研磨管的使用方法 1.作用:只适用于蛋白提取、RNA提取、基因组DNA提取时的组 织裂解,不做他用; 2.组织研磨管:容量为1.5ml, 里面已经提前放置了研磨珠(有时也 不放置),研磨液(Trizol或RIPA裂解液,有时也不放置)一般在取回后才加入,如果已经加入了研磨液,请离心后才拧开管盖,以免研磨液溢出,对皮肤造成伤害,所以操作时,要小心注意! 3.组织:把收取的组织分切,用生理盐水或PBS缓冲液把分切的组 织上的血液漂洗干净,然后用医用纱布或滤纸把组织表面的水分吸干,然后放入研磨管(组织体积大小为1颗绿豆至2颗黄豆,根据实际情况决定)中,然后把放入的组织尽量剪碎; 4.存放:上述过程应尽量在最短的时间内操作完毕,立即用液氮冻 结,然后置于液氮或-80℃保存; 5.操作事项:操作时间尽可能短,做好一个,立马放置一个;
实验方法总结(3):动物模型部分 1、研究肿瘤细胞增殖 (2) 2、研究肿瘤细胞转移 (3) 2.1. 体外(浸润模型) (3) 2.2. 体内(转移模型) (3) 3、研究肿瘤细胞耐药 (5) 3.1. 耐药细胞株的建立 (5) 3.2. 裸鼠移植瘤耐药模型的建立 (6) 从肿瘤起源分,肿瘤动物模型的分类如下: 从研究目的来分,可以从增殖、转移、耐药三个角度来分析: 1、研究肿瘤细胞增殖 细胞准备:GeneA敲减慢病毒感染细胞扩增至需要的细胞量。分为:空白对照组、阴性对照组、实验组。 取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。每只接种2×106个细胞,注射体积为100 μL。此后,每隔5天测量注射部位肿瘤的体积。30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。 2、研究肿瘤细胞转移 肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。 2.1. 体外(浸润模型) 例:浸润型脑胶质瘤动物模型的建立 方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。取2 μL胶质瘤干细胞以1×104 cells /只小鼠的剂量,经微量注射器缓慢注射入鼠脑纹状体内(深度是2.5 ~3 mm) 。在确定的时间点处死一部分动物进行荧光( 立体荧光显微镜下) 病理证实和比较,同时检查脑胶质瘤干细胞的体内生长特征以及干细胞标志物等。 2.2. 体内(转移模型)
心肌梗死(MI)小鼠模型具体方法及步骤原型物种人 来源结扎左冠状动脉前降支(LAD)法致心梗 模式动物品系SPF级Balb/c小鼠,雄性,周龄为6w~8w,体重为 23g~27g。 实验分组实验分三组:模型组(10只),对照组(10只),空白组(10只)。 实验周期0h、3h、6h、12h、24h、72h 建模方法1. 3%戊巴比妥钠80mg/kg腹腔注射麻醉,用小鼠剃毛器剃除小鼠胸部及腋下毛发(充分暴露手术区),用碘酒和75%乙醇手术区消毒。 2.气管插管:麻醉后,夹趾检测无反应即可进行MI手术。打开外置光源、显微镜开关,打开呼吸机,设置好各参数(呼吸频率110bpm),将气管插管沿声门插入气管,取下小鼠接上呼吸机,观察小鼠呼吸状况,胸廓起伏与呼吸机频率一致表示插管成功,即可进行MI手术。 3.小鼠采用右侧卧位,用眼科剪在左前肢腋下,用显微剪于三、四肋间打开胸腔充分暴露心脏,显微直镊轻轻夹起少量心包并于左心耳下撕开少许心包,充分暴露左冠状动脉前降支(LAD)或所在区域。 4. 结扎冠状动脉:于显微镜下找到LAD走向或可能所在位置,持针器持取7-0带针缝合线,于左心耳下缘2mm处进针,缝线穿过LAD,以完全阻断LAD 血流。 5. 关胸:结扎完成后,6-0缝线完全缝合胸腔开口(保证无缝隙、无错位)关闭胸腔,由内向外逐层缝合各层肌肉和皮肤。
6.术后管理:术后密切关注小鼠状态,有无呼吸异常等。待小鼠自然苏醒后将小鼠从呼吸机上取下并取下气管插管,正常饲养。 模型评价 1.心脏功能评价由Laplace定理可知:S=Pr/2h,P为心室内压,r为心腔内径,h为心壁厚度。在心脏压力负荷过重的情况下,为适应心脏做功增加,室壁厚度增加,左室室壁应力增加,提高心脏收缩功能起到早期代偿的机制;但持续的压力超负荷,可促进心肌肥厚,导致心肌细胞的坏死及凋亡,心脏的收缩和/或舒张功能受到损害,最终发展为慢性心力衰竭甚或心源性猝死。可通过超声或血流动力学检测来评价心功能。M超图像,测量左室舒张末期及收缩末期内径(LVIDd、LVIDs),同时系统将会自动计算出相应的射血分数(EF%)及左室短轴缩短率(FS%)。 2. TTC染色测量梗死面积 迅速取下心脏,清洁并挤压心脏蘸干血渍,4°C生理盐水冲洗干净后蘸干,于-20°C冰箱冷冻15min至心脏变硬,取出并用刀片自心尖向心底沿房室沟方向切成1mm厚切片,共切5片,迅速将切片置于5ml 37°C 1% PH为7.4的TTC磷酸缓冲液中,水浴15min,TTC染色后梗死区为白色,梗死边缘区为砖红色,正常区为红色。 3 病理学评价 取出心脏,剔除血管、脂肪等杂质,心脏放纱布上蘸干残留的血渍和溶液并称重后放入4%多聚甲醛溶液中保存,24h后行脱水、包埋、石蜡切片,各个标本选择固定位置(乳头肌水平)切片,做HE染色。HE 染色结果可见,对照组心肌排列整齐、细胞质丰富均匀、间质正常;模型组部分心肌细胞核丢失、
实验方法总结:动物模型部分 1、研究肿瘤细胞增殖 (1) 2、研究肿瘤细胞转移 (2) 2.1. 体外(浸润模型) (2) 2.2. 体内(转移模型) (2) 3、研究肿瘤细胞耐药 (4) 3.1. 耐药细胞株的建立 (4) 3.2. 裸鼠移植瘤耐药模型的建立 (5) 从肿瘤起源分,肿瘤动物模型的分类如下: 从研究目的来分,可以从增殖、转移、耐药三个角度来分析: 1、研究肿瘤细胞增殖 细胞准备:GeneA敲减慢病毒感染细胞扩增至需要的细胞量。分为:空白对照组、阴性对照组、实验组。 取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。每只接种2×106个细胞,注射体积为100 μL。此后,每隔5天测量注射部位肿瘤的体积。30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。 2、研究肿瘤细胞转移 肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。 2.1. 体外(浸润模型) 例:浸润型脑胶质瘤动物模型的建立 方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。取2 μL胶质瘤干细胞以1×104 cells /只小鼠的剂量,经微量注射器缓慢注射入鼠脑纹状体内(深度是2.5 ~3 mm) 。在确定的时间点处死一部分动物进行荧光( 立体荧光显微镜下) 病理证实和比较,同时检查脑胶质瘤干细胞的体内生长特征以及干细胞标志物等。 2.2. 体内(转移模型)
STZ诱导的小鼠糖尿病模型 糖尿病(diabetes mellitus,DM)是胰岛素抵抗和胰岛素缺乏导致的以高血糖为主要特征表现的代谢紊乱综合征,易发生心、脑、肾等并发症。糖尿病状态下血浆游离脂肪酸异常增高,心肌耗能增加,葡萄糖代谢下降,脂肪酸代谢增加,心脏内过量的脂肪酸摄取和氧化导致心肌内脂肪代谢产物的积聚引起心脏脂质毒性,并在此基袖上出现氧化应激,导致细胞调亡、内皮功能紊乱、炎症反应增加,同时出现心肌的损伤,心肌的结构和功能均发生改变,最后导致糖尿病患者的死亡。 1.实验动物 SPF级Balb/C小鼠,雄性,周龄为4w~6w,体重为20g~22g。 2.实验分组: 实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。 3.模型周期 24W 4.主要试剂及配制方法 柠檬酸、柠檬酸三钠、链脲佐霉素(Streptozocin,STZ) 1.柠檬酸钠缓冲液配制:将 2.10g柠檬酸加入双蒸水100ml配成柠檬酸母液,称为A液;将2.94g柠檬酸三钠加入双蒸水100ml配成柠檬酸钠母液,称为B液;将A、B液按1:1.32比例混合,pH计测定pH值,调定溶液pH=4.0,即是所需配制STZ的0.1mol/L柠檬酸钠缓冲液。 2.STZ溶液的配制:将STZ溶于0.1mol/L柠檬酸钠缓冲液中,新鲜配制成10mg/mL浓度的STZ溶液,并用0.22μm滤菌器过滤除菌。注意避光配制,现用现配。 5.建模方法 1.术前12h禁食 2.模型组小鼠按照120mg/kg剂量的STZ进行腹腔注射,对照组给予给予相同剂量的柠檬酸钠缓冲液。 3.STZ注射3d后,测空腹血糖,选择血糖高于16.7mmol/L纳入正式实验。
常用实验动物 1、小鼠 喜欢群居,怕热,高温容易中暑 雌雄性小鼠交配后10~12小时,在雌性小鼠阴道口会形成白色的阴道栓 主要解剖学特性 消化系统:食管内壁有角质化鳞状上皮,利于灌胃;有胆囊;胰腺分散,色淡红,似脂肪组织。 生殖系统:雌性小鼠为双子宫型,呈“Y”形,卵巢不予腹腔相通,无宫外孕。 骨髓为红骨髓,无黄骨髓,终身造血。 皮肤无汗腺。 小鼠常用品种、品系 1. 近交系小鼠 C3H:1975年从美国引进,野生色毛; ? C57BL/6:1975年从日本引进,黑色毛; ? BALB/c:Bagg1913年获得小鼠白化株,经近亲繁殖20代以上育成,毛色为白色; ? DBA:分为DBA/1和DBA/2两个品系,1977年由美国实验动物中心引进,毛色均为浅灰色。 2、封闭群小鼠 ①KM小鼠:我国使用量最大的远交种小鼠,白色,抗病、适应力强,繁殖、成活率高。 ②ICR:1973年由日本国立肿瘤研究所引入我国,白色,其显著特点是繁殖
力强。 ③LACA :1973年由英国实验动物中心引入我国,白色。其实是小鼠改名而成。 ④NIH :由美国国立卫生研究院培育,白色,繁殖力强,幼仔成活率高,雄性好斗 3、突变系 1、裸鼠:第11对染色体上的裸基因(nu)导致无毛裸体、无胸腺 2、SCID小鼠:第16对染色体上的Scid隐性基因突变基因导致T、B淋巴细胞联合免疫缺陷.外观与普通小鼠差别不大,被毛白色,体重发育正常 3、快速老化模型小鼠:4~6月龄以前与普通小鼠的生长一样,4~6月龄以后迅速出现老化症状。如心、肺、脑、皮肤等器官老化,出现骨质疏松和老化淀粉样变。侏儒症:比正常小鼠体型小,缺少生长素和促甲状腺素,用于内分泌研究。小鼠在医学、生物学的应用 1、重组近交系小鼠将双亲品系的基因自由组合和重组产生一系列的子系,是遗传分析的重要依据,用作基因定位及其连锁关系的研究 2、提供自然的动物模型 2、大鼠染色体数2n=42 喜独居,喜啃咬,性情较凶猛、抗病力强,对新环境适应力强,但对环境刺激、炎症反应敏感。强烈噪音可引起食仔或抽搐;湿度低于40%易发生环尾巴症。行为表现多样,情绪反应敏感,易接受通过正负强化进行的多种感觉指令的训练雌性2.5月龄达到性成熟,具有产后发情、产后妊娠的特点。寿命2.5~3年。解剖学特征
常用疾病动物模型 上海丰核可以为广大客户提供各种疾病动物模型定制服务,同时提供相关疾病模型的药物敏感性实验分析服务。 客户只需要提供疾病模型的用途及建模方法的选择,我们会根据客户的具体要求量身定做各种动物模型服务。
小鼠或裸 鼠 加贴近实际(八)心血管疾病模型 1. 动脉粥样硬化(高脂高胆固醇+维生素D喂养)兔高脂、高胆固醇饲喂兔造模,成 膜后血脂变化显著,为伴高血脂 症的动脉粥样硬化 4月血管组织病 理切片染色 2. 主动脉粥样硬化(高脂高胆固醇+主动脉球囊损伤)兔此模型用大球囊损伤加高脂饲 养方法成功建立兔主动脉粥样 硬化狭窄的动物模型,为相关基 础研究提供可靠模型。 2月动物实验模型病理切片展示 一、CCl4诱导的肝脏纤维化 简介:肝纤维化是肝细胞坏死或损伤后常见的反应,是诸多慢性肝脏疾病发展至肝硬化过程中的一个中间环节。肝纤维化的形成与坏死或炎症细胞释放的多种细胞因子或脂质过氧化产物密切相关。CCl4为一种选择性肝毒性药物,其进入机体后在肝内活化成自由基,如三氯甲基自由基,后者可直接损伤质膜,启动脂质过氧化作用,破坏肝细胞的模型结构等,造成肝细胞变性坏死和肝纤维化的形成。通过CCl4复制肝纤维化动物模型通常以小鼠或大鼠为对象,染毒途径主要为灌胃、腹腔注射或皮下注射。 动物模型图. 经过3个月的CCl4注射造模,小鼠的肝脏在中央静脉区形成了比较明显的肝纤维化,中央静脉之间形成了纤维桥接。(Masson染色) 二、CXCL14诱导的急性肝损伤动物模型
简述:CCl4是最经典的药物性肝损伤造模毒素之一,其在肝内主要被微粒体细胞色素P450氧化酶代谢,产生三氯甲烷自由基和三氯甲基过氧自由基,从而破坏细胞膜结构和功能的完整性,引起肝细胞膜的通透性增加,可溶性酶的大量渗出,最终导致肝细胞死亡,并引发肝脏衰竭。根据CCl4代谢和肝毒性机制可复制不同的肝损伤模型,其中给药剂量和给药方法是其技术关键。对于复制急性肝衰竭动物模型,往往采用大剂量一次性灌胃或腹腔注射给药。 图. (A) CCl4注射后0.5 d的HE染色表明CXCL14过表达增加了肝脏组织的嗜酸性变性面积(在照片中用虚线标记)(p < 0.05)。 (B) 1.5天组织样本的HE染色表明CXCL14过表达造成了比对照组更大面积的细胞坏死(p < 0.05)。 (C)同时还造成了中央静脉周围肝细胞中明显的脂肪滴积累。图中P和C分别表示动物模型的门静脉和中央静脉。KU指凯氏活性单位。 细胞凋亡检测结果 TUNEL标记没有显示CXCL14免疫中和小鼠和对照小鼠在凋亡细胞数量上的差异。C0, C1和C2分别是对照组0 d,1 d,和2 d样本,T1
[文章编号] 100723949(2005)1320120113203 ?文献综述? 心肌梗死动物模型研究的最新进展 孙慧君1, 范江霖2 (1.大连医科大学药理学教研室,辽宁省大连市116027;2.日本筑波大学基础医学系心血管病研究室,日本筑波市30528575) [关键词] 病理学与病理生理学; 心肌梗死动物模型; 综述; 冠状动脉粥样硬化; 不稳定斑块; 家族性高 脂血症[摘 要] 心肌梗死是发达国家的主要致死因素之一,在我国随着生活习惯的改变及胆固醇摄取量的增加而增加。但对心肌梗死的研究及治疗因为没有合适的动物模型一直受到很大的限制。心肌梗死动物模型的研制及开发不但可以研究心肌梗死的发病机制以预防心肌梗死的发生,也将为制定新的治疗方案用于治疗心肌梗死提供理论依据。本文将回顾这一方面的国际进展情况,特别是将我们最近研制成功的自发型心肌梗死家兔模型作一重点介绍。此种家兔血中胆固醇水平明显升高,心电图发现心肌梗死的典型征象。病理组织学分析表明,此种家兔心肌梗死病变为陈旧性心肌梗死病变伴急性梗死病变,与人类心肌梗死相似。导致心肌梗死病变部位的冠状动脉呈严重的粥样硬化,狭窄程度达90%以上,且有些斑块为不稳定性斑块。这些结果表明此种家兔可以作为人类心肌梗死的一种合适动物模型。[中图分类号] R363[文献标识码] A [收稿日期] 2003207218 [修回日期] 2004212216[作者简介] 孙慧君,医学博士,副教授,主要研究方向为心血管药理学,现工作于大连医科大学药理学教研室,E 2mail 为sunhuijun @https://www.doczj.com/doc/369578536.html, 。范江霖,医学博士,教授,博士研究生导师,主要研究方向为心血管病理学,现工作于日本筑波大学基础医学系,E 2mail 为j 2lfan @md.tsukuba.ac.jp. 心肌梗死是发达国家的主要致死因素之一,在我国也随着生活习惯的改变及胆固醇摄取量的增加而不断增加。研究心肌梗死发生的机制,不但可以预防心肌梗死的发生,也将为制定新的治疗方案用于治疗心肌梗死提供理论依据。但心肌梗死的研究及治疗由于没有合适的动物模型一直受到很大限制。因此就迫切地需要研制出一种与人类心肌梗死非常相似的动物模型。至目前为止,已有许多动物模型被报道,本文将回顾这一方面的研究进展情况,特别是将我们最近研制成功的自发型心肌梗死家兔模型作一重点介绍。 1 已报道的心肌梗死动物模型 已经报道的心肌梗死动物模型可以根据动物种类及制造方法不同分为以下几种:首先是小鼠心肌梗死模型。小鼠体型较小,容易造成转基因或基因敲除,目前已有报道载脂蛋白E 基因敲除小鼠在同时敲除内皮素1受体,或NO 分解酶及清道夫受体时会出现类似心肌梗死病变123。此种小鼠的特点是具有严重的高脂血症及动脉粥样硬化。但小鼠的脂代谢类型与人类不同,另外,小鼠体形较小,使得一些外科手术及治疗措施的研究无法进行及运用,也是这种模型的缺点。其次是用大鼠、家兔、羊、犬及猪等中大型动物建立的心肌梗死动物模型。其主要方法是人工阻塞左冠状动脉,使动物造成急性或慢性心肌缺血及梗死;包括冠状动脉结扎或夹闭术4211及冠状动脉阻塞术12215。此种模型实验周期短,可以观察梗死后再灌注对心肌细胞的损伤。但此种动物模 型手术操作过程复杂,创伤大,心肌周围组织的切开也影响心肌梗死后的重建。另外,此种动物模型并无血脂升高及冠状动脉粥样硬化病变,因此,与人类由冠状动脉粥样硬化引起的心肌梗死差别较大,临床相关性较小。猪、羊及犬体形较大,饲养条件苛刻也是用这些大动物研制心肌梗死模型的缺点。用结扎羊无名动脉及其对角分支方法建立起来的心肌梗死模型,与上述结扎冠状动脉方法建立起来的模型具有相同的特点16。也有报道用血管造影术在家兔旋动脉处放置导致血栓形成的环的方法,以建立起胸腔闭合型心肌梗死动物模型17,避免了手术创伤及心肌周围组织切开对梗死后重建的影响。也有人用剖开犬的左冠状动脉放置血管夹的方法,通过产生人工狭窄建立心肌梗死模型,此种模型的优点是可以精确控制狭窄的程度18。用化学药物诱导方法建立大鼠心肌梗死模型的方法也曾有报道,与冠状动脉阻塞方法类似19。Nakamura 20曾报道过用猪(G ottingen male miniature swine )建立的心肌梗死模型与人类由冠状动脉痉 挛引起的变异型心肌梗死极其相似,方法是对病灶部位进行内皮细胞剥脱,中度高脂血症及X 线辐射。此种模型心肌梗死的发生机制主要是由痉挛部位中膜平滑肌细胞在组胺及5羟色胺作用下产生的过度收缩引起的,内膜依赖性的舒张障碍作用较小。综上所述,虽然有很多上述心肌梗死模型报道,但据我们所知,至目前为止,与人类心肌梗死模型极其相似的自发性心肌梗死模型特别是由冠状动脉粥样硬化引起的心肌梗死模型还未曾建立起来,本文将重点介绍由我们实验室新近研制成功的自发性心肌梗死家兔模型。 2 自发性心肌梗死动物模型的创建 日本神户大学Watanabe 等21人在1980年首次报道了遗传性高脂血症(Watanabe 2heritable hyperlipidemic rabbit , WHHL )家兔。此种家兔具有先天性LDL 受体缺损的特点 3 11CN 4321262/R 中国动脉硬化杂志2005年第13卷第1期
论著 文章编号:1007-8738(2011)01-0044-03 LPS 诱导的内毒素血症小鼠及重症联合免疫缺陷小鼠模型炎症反应的比较 罗 冲,杨锡强*,李 欣,刘 玮,王莉佳 (重庆医科大学附属儿童医院儿童发育疾病研究省部共建教育部重点实验室,重庆400014) 收稿日期:2010-07-14; 接受日期:2010-09-13基金项目:国家自然科学基金资助项目(30772915)作者简介:罗 冲(1981-),女,四川成都人,在读博士 T e:l 023 ********;E m ai:l l uochong @yahoo .c n *Correspond i ng au t hor ,E m ai:l x i qyang @163.co m Co mparation of i nfl a mm ation bet w een w il d m ice and severe co m bi ned i m m u nodeficiency m ice w ith endotoxe m ia i n duced by li popo l ysacchari de LUO Chong,Y ANG X i qiang *,L I X i n , LIU W ei , WANG L i ji a ng M i n i stry o f Educati on K ey L aboratory of Chil d D ev elopment and D i so rders ,Ch ildren s H o spita,l Chongq i ng M ed ica l U niversity ,Chongqi ng 400014,China [Abstract] A I M:To compa re t he in flamma tion be t w een w ild BALB /c m ice and m ice w ith seve re comb ined m i muno de ficiency (SC I D )w ith endo toxem ia i n duced by lipopo lysacchar i d e (LPS ).METHODS :Endo t oxem ia m ode ls o f w ild and SC I D m ice we re estab lished by in jecti n g LPS intra pe ritonea lly .S eru m was taken be fore and 3h ,6h ,12h a f t e r in jecting LPS,live r and lung were t aken 12h a fter in j e c ting LPS.A lan i n e transa rn inase (A LT ),a spa rtate am in o transf e rase (AST)and b lood u rea n itrogen (BUN)l e ve ls we re mea sured by automa tic b iochem ica l ana lyz e r .L ive r and lung in flamma tion in jury we re observed by H .E s t a i n ing .TNF ,I FN ,IL 6and MCP 1leve ls in se rum we re detect ed by Cyt ome tr ic Bead A rray (CBA ).RESULTS :(1)A ll o fSC I D m ice (8/8)we re dead a t 12-24h a ft e r in jecting LPS ,and on ly one BALB /c mouse (1/8)was dead .(2)A LT and AST leve ls o f SC I D m ice 12h a fter in j e cting LPS we re h iger than those of BALB /c m ice (P <0.05),bu t the re was no d iff e rence o f BUN l e ve ls be t w een them.(3)The b li n d live r and lung pa tho logy score s o f SC I D m ice we re h ighe r than those o f BALB /c m ice (P <0.05).(4)TNF ,I FN ,IL 6and MCP 1l e ve ls in seru m a t 3h ,6h ,12h a f t e r in j e c ting LPS increased significan tly ,and t he cy t okine leve ls o f SC I D m ice w ere h igher t han t hose o f BA LB /c m ice (P <0.05).CONCLUSI ON :SC I D m ice don t on ly exce s sive ly secre te infla mma t o ry cytokines a fter in j e c ting LPS,but a lso lead t o m ore seve re endo toxem ia and infla mma tion in jury o f o rgans ,wh ich a re the m i portan t cause o f mouse dea t h .The above resu lt s a lso show t ha t the ad j u st men t de fi c i e ncy o f adap tive m i m uno response ,abnor m a l augmen t a ti o n o f innate m i munore sponse may be an m i portan t cause o f seve re S I RS of endange ring life .[K ey word s] li p opo lysacchar i d e ;seve re comb ined m i m uno de ficiency ;in flamma ti o n reaction ;mouse [摘要] 目的:比较脂多糖(LPS)诱导的内毒素血症BALB /c 小鼠及重症联合免疫缺陷(SCID )小鼠炎症反应的差异。方法:建立LPS 诱导的BALB /c 小鼠和SC I D 小鼠内毒素血症模型,观察小鼠的存活率。分别于诱导前、诱导后3h 、6h 、12h ,取小鼠的血清及诱导后12h 小鼠的肝脏、肺脏,用全自动生化分析仪检测两种小鼠血清谷丙转氨酶(A LT )、谷草转氨酶(A ST )、尿素氮(BUN )水平;HE 染色评价肝脏、肺脏的炎症病理改变;用流式细胞术微球阵列法检测两种小鼠血清TNF 、IFN 、I L 6及M CP 1的水平。结果:(1)LPS 诱导内毒素血症后,SC I D 小鼠于12~24h 均死亡(8/8),BA LB /c 小鼠仅1只死亡(1/8)。(2)LPS 诱导后12h ,BALB /c 小鼠及SCID 小鼠血清ALT 、AST 、BUN 的水平均明显升高(P <0.05),SC I D 小鼠前两项均高于B A LB /c 小鼠(P <0.05),但B UN 两种小鼠无显著差异。(3)肺脏,肝脏炎症盲法的病理评分,SC I D 小鼠均高于BALB /c 小鼠(P <0.05)。(4)SC I D 小鼠和BALB /c 小鼠LPS 诱导后3h 、6h 、12h ,血清TN F ,I FN 的水平,诱导后12h ,IL 6,M CP 1的水平均显著升高(P <0.05),SC I D 小鼠明显高于BALB /c 小鼠(P <0.05)。结论:LPS 刺激SC I D 小鼠后,可分泌过量的炎性细胞因子,导致更严重的内毒素血症和脏器损伤,是造成小鼠死亡的重要原因。结果提示,缺乏适应性免疫应答细胞调控的情况下,异常增强的固有免疫应答,可能是危及机体生命的重症全身炎症反应综合征发生的重要原因。 [关键词]脂多糖;重症联合免疫缺陷;炎症反应;小鼠[中图分类号]R392.1 [文献标识码]A 脓毒症、重症急性呼吸窘迫综合征(severe acute resp iratory syndro m e ,SARS)及感染相关的嗜血细胞综合征(infection associated he m ophagocy tic syndro m e ,I A H S)均为机体全身炎症反应的表现[1-2] 。失控的 炎症反应可导致机体多器官功能障碍引起死亡,给临床治疗带来极大困难,是以上疾病预后不良的重要原因。目前认为,I A H S 是由于感染引起的T 细胞及单核巨噬细胞过度活化所致,但对于脓毒症、SARS 的免疫病理以及固有免疫应答与适应性免疫应
一. 背景: 本次动物实验相关疾病介绍、国内外相关治疗及研究的现状及结果(含临床、基础)、相关引文摘要等。 二、实验所用器械简介: 三、实验目的 1、使用猪或其他适宜动物为实验模型, 按照临床要求对产品进行模拟 使用,对* *器械的* *性能、* *效应进行测试。 2、通过动物实验取得数据和经验, 以便为产品的临床使用撰写详尽的使 用指南。 3、确定* * 器械置入猪后的最长可回收天数, 以便为临床使用的最长 可回收时间提供参考。 4、研究* *器械置入* *天后的可回收性, 以回答以往实验中未能解决 的* * 器械在置入* * 天后是否可取出的问题。 四、实验模型和材料 1、实验模型 (1).动物模型:猪,体重:25?35KG (2).体外模型:拟采用透明塑料软管作成的20mm 25mm两 种直径的下腔静脉模型。 2、材料: (1)* *器械采用XX公司研发生产的器械。 (2)其他手术配套器械采用临床通用器械。 3.过程要求:
本实验开始前必须取得动物道德委员会的许可(注:国外 有此要求,国内仅少数几家大医院有动物伦理委员会) 五.实验设计 动物数量及分组方法:实验动物共22头,在置入器械后分为A和B两组.A组动物采用介入方法取出滤器,B组动物采用外科方法经腹切开方法取出滤器.下腔静 脉滤器置入后饲养观察时间为7、10、12、14、16、20、30、60和90天,具体分组方法见下表。 分组(头) 时间(天)- A B 7 1 1 10 1 1 12 3 1 14 3 1 16 1 1 20 3 1 30 0 2 60 0 1 90 0 1 六、实验方法: 1、随机选取实验动物以1:1的比例进行* *实验,并记录* * 总结出的操作要求。7?20天实验用以观察器械置入后的可回收期,30、60、90天实验用以观察器械置入后的长期通畅情况。 2、所有动物器械取出前应造影复查,并与器械置入时的资料进行对比,判断器
III.实验动物心肌肥厚模型 A、压力超负荷/主动脉缩窄 压力超负荷引起的心脏肥厚常用的手术方法是主动脉缩窄(i.e.缩窄升主动脉)。 小鼠行主动脉缩窄(TAC)可以引起心脏机械性的压力超负荷,最终导致心肌肥厚、心衰(20,84)。TAC通常诱导方法采用在近胸骨端行小切口, 缩窄主动脉的这样的开胸手术。TAC模型虽然不能完全模拟人类的心室重构,但该模型可以用于肥厚发病过程中多种基因学的研究。主动脉缩窄模型能很好的模拟血流动力学超负荷引起左心室肥厚的发生发展。该动物模型在主动脉缩窄造成心肌肥厚几个月后会导致心衰。 B、容量超负荷 在静脉回流适当的情况下,心脏不能排出足够的血液满足全身组织代谢的需要就会引起CHF(充血性心力衰竭)。心内檐沟血或回心血量增加导致瓣膜闭锁不全就会引起心室容量超负荷。在慢性动脉和/或二尖瓣瓣膜回流疾病中的容量超负荷,我们会观察到“舒张期压力-容积曲线”整体右移,说明心脏僵硬度增加,即发生LVH (可见于主动脉瓣狭窄、高血压、肥厚性心肌病)(36)。通常情况下,容量超负荷CHF模型制备方法是腹主动脉-下腔静脉分流术。即于肾动脉上方分离出下腔静脉和腹主动脉,用血管夹在近肾动脉端夹闭主动脉阻断血流;用0.6-mm的针头由主动脉远端刺入,继续进针刺入下腔静脉,使动静脉联合。退针后,缝合血管壁伤口。4-5周后,就能复制出心肌肥厚模型,并具有左心室收缩力增强、舒张末期压力增加的特点(257)。 C、冠状动脉结扎 冠状动脉结扎常用于复制心衰动物模型。冠脉左前降枝(LAD)结扎后会阻断心脏的供养和营养输送,这种情况类似于人类心脏病发作时伴随的症状。血氧和营养供输阻断后,心肌细胞死亡,心脏整体功能受影响,最终导致心功能紊乱。由于这种动物模型非常接近临床心衰疾病的发生发展,研究证明该模型是心衰发病机制研究的重要手段(13)。 D、转基因型心脏肥大模型 几十年以来,一些心脏肥大和心力衰竭的转基因小鼠模型被学者们用于心肌肥厚和心衰这些致命疾病的可能的分子机制研究。受条件限制,在此不能针对于所有模型作一全面的综述,但在此文中,我们介绍一种转基因小鼠模型,该模型能成功模拟心肌肥厚的发生发展以及最终演变为心衰的过程。表1列举的是截止目前,研究学者们发现的较成熟的心肌肥厚/心衰模型。 表1:小鼠心衰模型 转基因小鼠模型代谢转变模型ECM紊乱转基因模型 肌侵蛋白,TNFα,G i,Gαq,PKCβ,PKA,β1AR, 磷酸化蛋白, 肌集钙蛋白, 钙调磷酸酶, L-型Ca2+ 通道 线粒体功能紊乱 氧化应激 脂肪酸氧化(FAO) 通路的受损 基质金属蛋白酶2/MMP2 基质金属蛋白酶9/MMP9 组织金属蛋白酶抑制剂 1/TIMP1
病理生理学实习指导 一、缺氧模型的实验性复制 ㈠目的与原理 通过给动物低氧环境,影响Hb的带氧能力及使组织不能利用氧等方法,复制不同类型缺氧模型,经呼吸、机能状态、皮肤粘膜颜色等指标,显示了其不同症状与特征,同时对复制模型的方法及原理又有大概的了解,有利于深入和研究各缺氧症的发生、发展和转归的规律。 ㈡实验对象 小白鼠。 ㈢器材与药品 缺氧瓶(装有管道瓶塞的250ml广口瓶),酒精灯,一氧化碳发生器,1ml注射器,5ml 和2ml刻度吸管,粗天平(附砝码),剪刀,普通镊。 钠石灰(氢氧化钠、氧化钙),甲酸,浓硫酸,0.125%氰化钾溶液,1%亚硝酸钠溶液,10%硫代硫酸钠溶液。 ㈣步骤与观察 表8-3-1观察指标 呼吸机能状态皮肤粘膜颜色类型(频率、幅度)(活动度) –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– 低张性缺氧 一氧化碳中毒 氰化钾中毒 ⒈低氧性缺氧 ⑴将小白鼠至于250ml广口瓶(内装钠石灰吸收二氧化碳)中观察上述指标。 ⑵将瓶塞紧,同时记录时间,每5min重复观察上述指标一次(如有变化则随时记录)直到动物死亡为止。 ⒉一氧化碳中毒性缺氧 ⑴如图8-3-1装好一氧化碳发生装置。 ⑵将小白鼠一只放入瓶中,观察上述指标。 ⑶取甲酸3ml放入试管内,加入浓硫酸2ml,塞紧。如气泡产生较少,可用酒精灯加热,加速一氧化碳的产生(但不可过热以至液体连续沸腾,因一氧化碳产生过快,动物迅速死亡,血液颜色改变不明显)。 ⑷在整个过程中,注意观察上述指标。 (注):一氧化碳产生原理: H2SO4 HCOOH CO↑+H2O △ ⒊氰化钾中毒性缺氧 ⑴称小白鼠体重,观察上述指标,预先准备1%亚硝酸钠及10%硫代硫酸钠各10ml·Kg-1,以备急救用。
疼痛实验动物模型 科研探索2007-04-25 23:11:36 阅读147 评论0 字号:大中小订阅 疼痛是机制非常复杂的神经活动。疼痛研究已经成为当前神经科学研究的重要课题之一。由于疼痛机制的复杂性,使得在患者身上研究与疼痛有关的神经机制成为不可能的事。因而,我们的研究需要相应的动物模型。本章介绍了在现代神经科学研究中常用的疼痛动物模型。在概要介绍了疼痛研究的意义及其现状之后,重点介绍了在生理痛研究和急性、慢性病理痛研究中所应用的动物模型。生理痛的模型即常用的动物伤害性感受阈测定法;急性病理痛的模型则主要是各种急性炎症模型模型;慢性病理痛的模型则包 括慢性炎症模型和慢性神经损伤模型。 前言 疼痛(pain)是人们一生中经常遇到的不愉快的感觉。它提供躯体受到威胁的警报信号,是生命不可缺少的一种特殊保护功能。另一方面,它又是各种疾病最常见的症状,也是当今困扰人类健康最严重的问题之一。近年来,仅在美国就有三至四千万人患有慢性痛。据估计,美国每年用于治疗慢性痛的费用约为400~600亿美元;澳大利亚每年用于治疗疼痛的费用占全部医疗费用的40%。随着医学的进步和人类生活水平的提高,烈性传染病逐渐得到控制,疼痛在人的身心痛苦和医疗费用消耗上的相对地位将越来越重要。 由于难以在人体对疼痛进行深入的机制研究,有必要建立疼痛的动物模型。但疼痛是是包括性质、强度和程度各不相同的多种感觉的复合,并往往与自主神经系统、运动反应、心理和情绪反应交织在一起,它既不是简单地与躯体某一部分的变化有关,也不是由神经系统某个单一的传导束、神经核和神经递质进行传递的,所以很难将某种客观指标与疼痛直接联系起来。因而,我们只能根据模型动物对伤害性刺激的 保护反应和保护性行为来推测它们的疼痛程度。 伤害性感受(nociception)和痛觉是两个有密切关系但又不相同的概念。前者是指中枢神经系统对由于伤害性感受器的激活而引起的传入信息的加工和反应,以提供组织损伤的信息;痛觉则是指上升到感觉水 平的疼痛感觉。两者之间有时并没有严格的相关性。 生理痛模型与常用的痛阈测定法 概述 为了能够对痛觉现象及其机制作深入细致的观察,特别是在中枢神经系统的形态学、细胞生物学和分子生物学水平研究痛觉机制,必须建立动物的痛觉模型。又由于痛觉是意识水平的感觉,我们无法确定动物是否具有痛觉,只能观察其对伤害性刺激的行为反应。因而在下文的描述中有时用伤害性感受阈 (nociceptive threshold)取代痛阈(pain threshold)。 正常情况下,疼痛是机体对外界伤害性刺激的感受,它是一种报警系统,提示实存的或潜在的组织损伤的可能性。如果这种伤害性刺激是可以回避的,那么痛觉就是一种具有完全的积极意义的感觉形式,称为生理痛。这种意义上的疼痛模型实际上就是对伤害性感受阈的测量。它是通过观察动物对伤害性温度 和机械刺激的逃避反应实现的。 如果动物遇到无法逃避的伤害性刺激,就会引起它的情绪反应,发出嘶叫声。这是需要高级神经中枢配合的反应,并且不受局部运动功能的影响。因而,在伤害性刺激下引起的嘶叫反应也可以作为伤害性 感受阈的测量指标。 热辐射-逃避法 这是最常见的伤害性感受阈测量方式。最常用的有热辐射-甩尾法、热辐射-甩头法和热辐射-抬足法。